-
Medical journals
- Career
Extraadrenálny paraganglióm
Authors: Zuzana Teliarová 1; Jana Kollerová 1; Peter Jackuliak 1; Ján Breza 2; Juraj Payer 1
Authors‘ workplace: V. interná klinika LF UK a UN Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, PhD., FRCP 1; Urologická klinika LF UK a UN Bratislava, Slovenská republika, prednosta prof. MUDr. Ján Breza, DrSc. 2
Published in: Vnitř Lék 2014; 60(5-6): 514-519
Category: Case Report
Overview
Príznaky feochromocytómu a paragangliómu môžu byť rôzne, nádor môže napodobňovať veľké množstvo ochorení, čo často vedie k chybnej diagnóze. Súčasné pokroky v laboratórnej diagnostike (stanovenie voľných plazmatických metanefrínov), lokalizácii nádorov (použitie pozitrónovej emisnej tomografie), chirurgických technikách a zlepšenom porozumení patofyziológie a genetiky (úloha podjednotky B enzýmu sukcinátdehydrogenázy) vedú k skoršiemu stanoveniu diagnózy, zmenám v stratégii a možností liečby. Autori popisujú prípad výskytu retroperitoneálneho paragangliómu u 59-ročného pacienta, ktorý sa interdisciplinárnou spoluprácou pri diagnostike a liečbe podarilo úspešne zvládnuť.
Kľúčové slová:
diagnostika – feochromocytóm – paragangliónÚvod
Feochromocytómy sú pomerne vzácne nádory, produkujúce katecholamíny, najčastejšie sa vyskytujúce vo veku medzi 40–50 rokov s miernou prevahou u žien. Typicky, asi v 85 % prípadov, pochádzajú z chromafinného tkaniva drene nadobličky a v približne 15 % prípadov z extraadrenálneho chromafinného tkaniva. Nádory vychádzajúce z extraadrenálneho tkaniva sa nazývajú paragangliómy. Paragangliómy rozdeľujeme do 2 skupín – na tie, ktoré pochádzajú z tkaniva odvodeného z parasympatika (väčšinou pozdĺž hlavových nervov, blúdivého nervu, chemodektóm, nádor karotického telieska) a na tie, ktoré vychádzajú z tkaniva odvodeného zo sympatika (často označované ako extraadrenálne feochromocytómy). Extraadrenálne feochromocytómy pochádzajú hlavne z chromafinného tkaniva priliehajúceho k sympatikovým brušným gangliám (75 %) [1]. Brušné extraadrenálne feochromocytómy najčastejšie vychádzajú zo zhluku chromafinného tkaniva okolo odstupu dolnej mezenterickej tepny (Zuckerkandlov orgán) alebo bifurkácie aorty [2].
Asi 36–60 % paragangliómov je funkčných, produkujúcich norepinefrín a normetanefrín. Podľa miesta lokalizácie môžu paragangliómy spôsobovať deštrukciu priľahlých stavcov, spôsobiť kompresiu miechy s poškodením nervov, invadovať stenu močového mechúra, spôsobiť obštrukciu ureterov a metastázovať do regionálnych lymfatických uzlín. Veľké perinefrické tumory môžu spôsobovať stenózu renálnej artérie. Niektoré nádory majú nízku alebo prerušovanú sekrečnú činnosť, iné produkujú hlavne alebo výlučne dopamín, zatiaľ čo ďalšie len veľmi zriedka syntetizujú a uvoľňujú katecholamíny (nonsekrečné alebo nefunkčné nádory). Tieto nádory sa môžu prejaviť len mierne alebo dokonca chýbajú príznaky nadbytku katecholamínov. Nízka sekrečná aktivita môže odrážať malú veľkosť nádoru alebo rozdiely v sekrečných fenotypoch spojených s biochemickým a genetickým pozadím nádorov. Nádory v dôsledku mutácie sukcinátdehydrogenázovej podjednotky B sú často subklinické, zle diferencované, obsahujú nízke množstvo katecholamínov a sú obvykle v čase stanovenia diagnózy malígne.
Popis prípadu
Autori v kazuistike prezentujú prípad 59-ročného pacienta s retroperitoneálnym paragangliómom. Dôvodom prijatia na V. internú kliniku LF UK a UN Bratislava bola hypertenzná urgencia pri neliečenej artériovej hypertenzii s epistaxou, celková slabosť, nechutenstvo, váhový úbytok (10 kg za 4 týždne), ako aj návaly potenia, hyperglykémia pri známom zle kompenzovanom diabetes mellitus 2. typu (DM2T). Pri prijatí na kliniku v objektívnom náleze dominoval astenický habitus, hypotrofické svalstvo, bledá, spotená koža, hypertenzné hodnoty krvného tlaku (180/100 mm Hg), tachykardia 100/min. V laboratórnom obraze bola opakovane hyperglykémia, mierna pozitivita zápalových markerov, vysvetlená prebiehajúcim infektom močových ciest. Pacientovi bola upravená antihypertenzívna a antidiabetická terapia. V rámci diagnostického procesu pacient absolvoval CT vyšetrenie abdomenu, ktorým mu bol verifikovaný solídny tumorózny útvar retroperitoneálne, paraaortálne vľavo veľkosti 8,5 × 4,5 × 5,5 cm s naliehaním na aortu a a. renalis s nekrotickým rozpadom (obr. 1). Za účelom laparotómie a exstirpácie tumoru bol pacient preložený na IV. chirurgickú kliniku LF UK a UN Bratislava. Avšak vzhľadom na naliehanie tumoru na aortu a a. renalis a výraznú krvácavosť peroperačne bola odobratá len časť masy a od radikálnej resekcie pre vysoké riziko chirurgovia ustúpili. Vzhľadom na peroperačný nález hypervaskularizovaného tumoru a jeho lokalizáciu, ako aj ťažko kontrolovanú hypertenziu predoperačne sa doplnili biochemické odbery na diagnostiku možného feochromocytómu. Vo výsledkoch dominovali vysoké hodnoty plazmatických a močových metanefrínov (tab. 1). V laboratórnom obraze bola taktiež hyperglykémia a retencia dusíkatých látok. Pre nedostatočne kontrolovanú arteriovú hypertenziu (zhoršenie oproti predoperačnému obdobiu), dekompenzovaný diabetes mellitus s hyperglykémiami, bol pacient opätovne preložený na našu kliniku za účelom vytitrovania liečby. Počas hospitalizácie bol pacient nastavený na kombináciu 6 antihypertenzív (vrátane alfablokátora a betablokátora) a na liečbu intenzifikovaným inzulínovým režimom. Po stabilizácii stavu pacient absolvoval scintigrafické vyšetrenie nadobličiek pomocou 123I-MIBG, kde sa popisoval paraganglióm paraaortálne vľavo s prítomným vychytávaním rádiofarmaka aj v oboch nadobličkách a v jednej lymfatickej uzline v mediastine pod karinou (s nemožnosťou vylúčiť metastázy). Preto bolo doplnené PET vyšetrenie, podľa ktorého bolo ložisko s náznakom centrálnej nekrózy v retroperitoneu paraaortálne vľavo, s len nízkou metabolizáciou 18-FDG, bez ďalších patologických zmien v súvislosti so základným ochorením v PET/CT obraze (obr. 2). V súvislosti s nutnosťou vylúčenia MEN 2A syndrómu sme pacientovi vyšetrili parametre štítnej žľazy a doplnili aj USG štítnej žľazy, kde bolo prítomné cystické ložisko veľkosti 7,6 × 11,5 mm. Punkčná aspiračná biopsia z uzla preukázala adenomatózny uzol s cystickými zmenami. Genetickým vyšetrením bola vylúčená mutácia RET-protoonkogénu. Vzhľadom na klinický stav sme pacienta konzultovali na Urologickej klinike LF UK za účelom chirurgickej intervencie. Predoperačne sa však klinický stav komplikoval rozvojom hnačiek, hydrominerálnym rozvratom, renálnym zlyhávaním pri septickom stave v rámci vývoja ileózneho stavu na podklade pseudomembranóznej enterokolitídy. Pacient bol preliečovaný ATB terapiou (vankomycín, metronidazol), kompletne parenterálne vyživovaný. Napriek tomu pre výrazné oslabenie imunitného systému došlo k rozvoju DIC (diseminovanej intravaskulárnej koagulácie), progresii multiorgánového zlyhávania, imobilizačnému syndrómu. Rozvinuli sa dekubity na oboch koxách a na pätách s nekrózou, taktiež flekčné kontraktúry dolných končatín. Po úspešnom zvládnutí akútneho stavu bola snaha aj o lokálne ošetrenie dekubitov v trochanterickej oblasti a preto pacient podstúpil ich operačné ošetrenie na Klinike popálenín a rekonštrukčnej chirurgie LF UK a UN Bratislava. Následne v marci roku 2010 bola na Urologickej klinike vykonaná exstirpácia paragangliómu. Histologické vyšetrenie preukázalo, že sa jednalo o extraadrenálny paraganglióm retroperitoneálne (s angioinváziou, perineurálnym šírením a extenziou do tuku). Pooperačný priebeh bol bez komplikácií. Laboratórne došlo k poklesu plazmatických voľných metanefrínov, močových metanefrínov a katecholamínov (tab. 1). Na posúdenie reziduálneho nálezu sme doplnili PET vyšetrenie, ktoré ukázalo patologické heterogénne tkanivo so zvýšenou metabolickou aktivitou v retroperitoneu, v mieste po exstirpácii pôvodného tumoru. Pre pomerne vysokú hodnotu SUVmax bol stav záverovaný ako v.s. obraz dediferenciácie primárneho tumoru (resp. recidívy v tejto lokalite). Pacient bol bez jednoznačných prejavov aktivity základného ochorenia v PET-CT obraze s 18-FDG. S laboratórnymi výsledkami ako aj kontrolným PET vyšetrením sme konzultovali prof. Karla Pacáka z National Institute of Health (NIH) Bethesda, Maryland, USA, za účelom vylúčenia možnej recidívy ochorenia. Pacient cestou hospitalizácie v NIH absolvoval kompletné biochemické (tab. 2) a zobrazovacie vyšetrenia. Scintigrafia pomocou 123I-MIBG preukázala normálnu distribúciu MIBG aktivity v slinných žľazách, pľúcach, pečeni, GIT a močovom mechúri, bez evidencie neuroendokrinného tumoru. FDG/PET len mierne vychytávalo rádiofarmakum v operačnom lôžku v ľavej periaortickej oblasti. Zároveň bolo v NIH doplnené aj genetické vyšetrenie na familiárny paraganglióm (mutácia sukcinátdehydrogenázovej podjednotky B, D), ktorá ale nebola potvrdená. Komplexnými vyšetreniami bola recidíva ochorenia nateraz vylúčená. Pacient od operácie pribral 15 kg, hodnoty krvného tlaku sa darí udržiavať na dvojkombinácii antihypertenzívnej liečby (kalciový blokátor a centrálne pôsobiace antihypertenzívum). Hodnoty glykémii sú stabilizované na diabetickej diéte, čo je v súlade s poznatkami z klinickej praxe ako aj literatúry, že po odstránení feochromocytómu sa upraví aj kompenzácia DM [3]. Postupne aj naďalej pacient rehabilituje a je sledovaný na našej endokrinologickej ambulancii.
Image 1. CT vyšetrenie abdomenu pri diagnostike 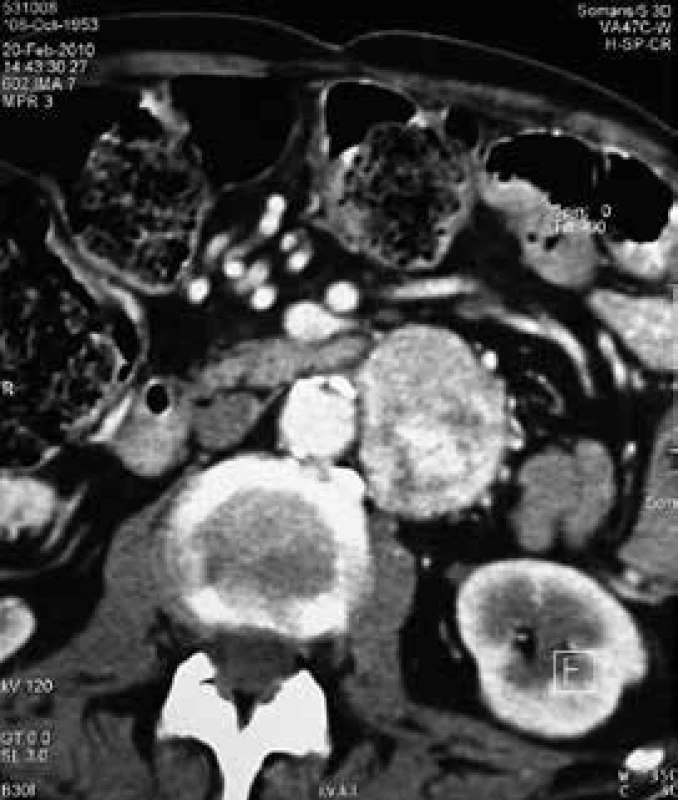
Solídny TU útvar retroperitoneálne paraaortálne vľavo veľkosti 8,5 × 4,5 × 5,5 cm s naliehaním na aortu a a. renalis s nekrotickým rozpadom. Table 1. Laboratórne hodnoty na začiatku prípadu a po resekcii tumoru 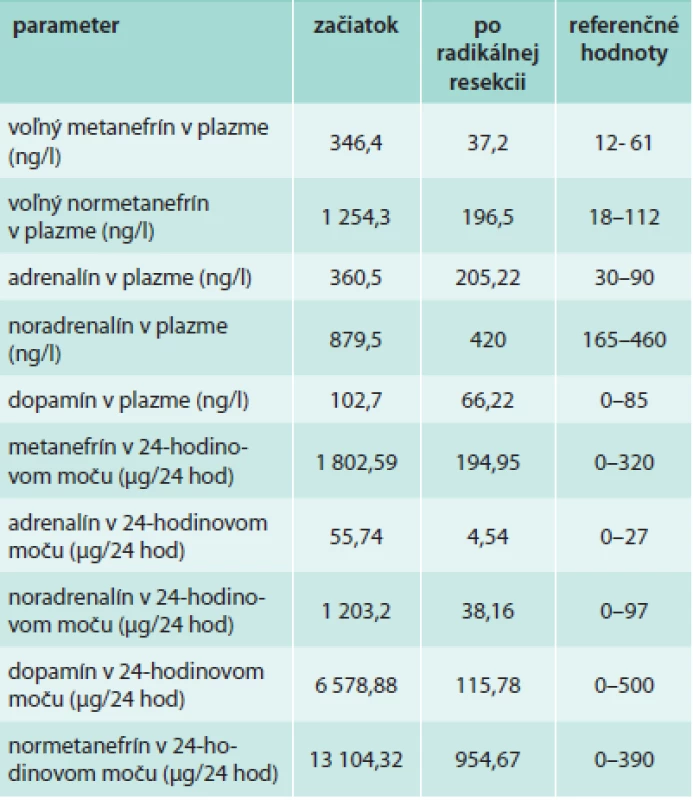
Image 2. Predoperačné PET vyšetrenie 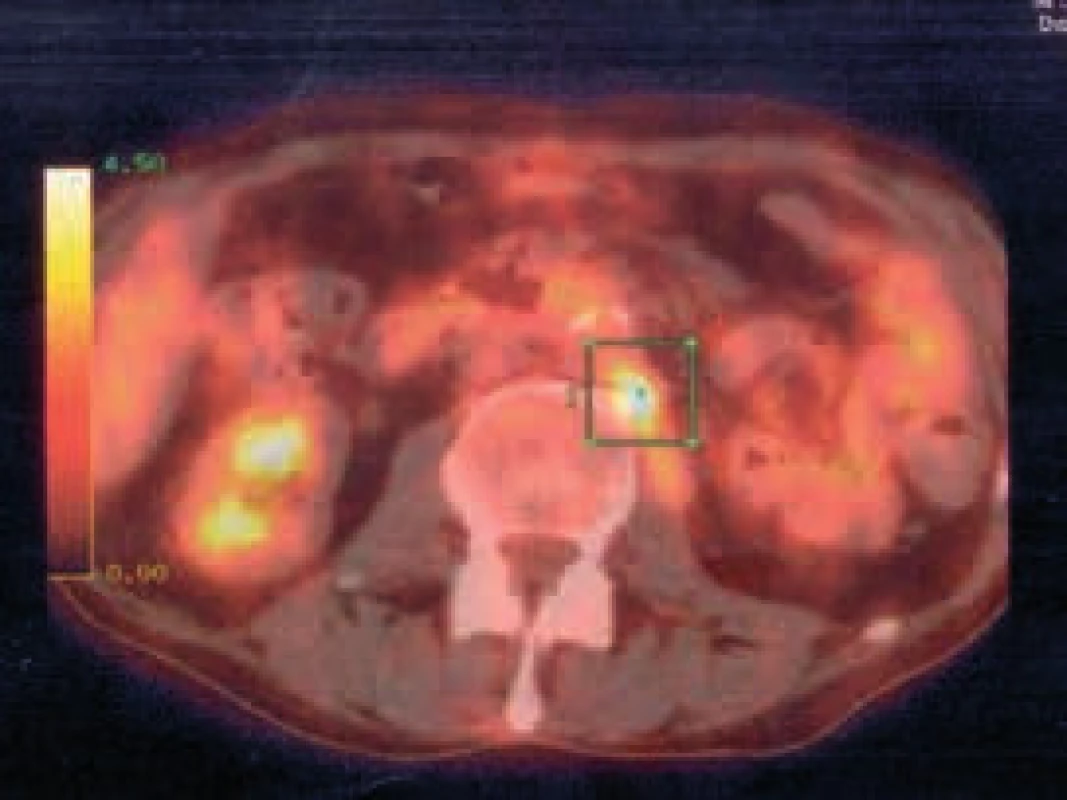
Ložisko s náznakom centrálnej nekrózy v retroperitoneu paraaortálne vľavo, s len nízkou metabolizáciou 18-FDG, bez ďalších patologických zmien v súvislosti so základným ochorením v PET/CT obraze. Table 2. Laboratórne vyšetrenia v Bethesda, USA 
Diskusia
Feochromocytóm býva nazývaný ako „veľký herec“, vzhľadom k tomu, že je popisovaných veľa neobvyklých prejavov tohto ochorenia, ktoré si vyžadujú rýchlu intervenciu.
Prítomnosť feochromocytómu/paragangliómu je charakterizovaná klinickými príznakmi (tab. 3), ktoré sú následkom hemodynamického a metabolického pôsobenia cirkulujúcich katecholamínov, alebo menej často následkom pôsobenia iných amínov alebo súčasne produkovaných neuropeptidov [4]. Avšak závažnosť klinických symptómov nekoreluje vždy s koncentráciou plazmatických katecholamínov [5]. Katecholamíny sa zvyčajne vylučujú prerušovane alebo nepretržite, vrátane noradrenalínu a adrenalínu, zriedkavo je vylučovaný dopamín. Hoci bolesť hlavy, palpitácie a potenie sú nešpecifické symptómy, ich prítomnosť u pacientov s hypertenziou by mala vzbudiť bezprostredné podozrenie na feochromocytóm/paraganglióm, pretože táto triáda patrí medzi najčastejšie uvádzané symptómy.
Table 3. Klinické príznaky a prejavy typické pre pacientov s feochromocytómom 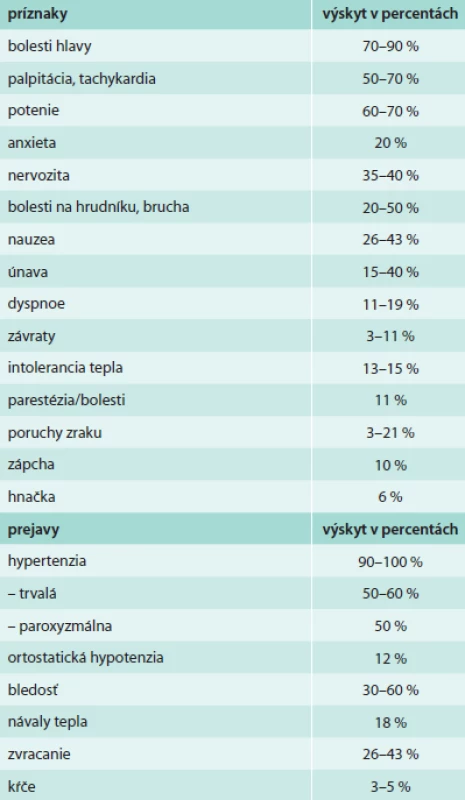
Biochemický dôkaz nadmernej produkcie katecholamínov je základným krokom diagnostiky ochorenia. Feochromocytómy/paragangliómy často produkujú katecholamíny epizodicky. Medzi epizódami môžu byť často koncentrácie katecholamínov v plazme a v moči v norme, pretože feochromocytómy neprodukujú dostatočné množstvo katecholamínov, aby došlo k pozitivite diagnostického testu alebo ku vzniku typických príznakov nádoru [6].
Meranie plazmatických koncentrácií metanefrínov predstavuje v súčasnosti základ laboratórnej diagnostiky. Najdôležitejšou výhodou merania metanefrínov v porovnaní s katecholamínmi je fakt, že O-metylované metabolity sú produkované feochromocytómom kontinuálne a nezávisle na uvoľňovaní katecholamínov. Katecholamíny sa väčšinou merajú vo voľnej forme, zatiaľ čo metanefríny je možné stanovovať buď ako voľné, alebo po dekonjugácii, ktorá uvoľní konjugované metabolity.
K lokalizácii feochromocytómu by sme mali pristúpiť vtedy, ak je nádor laboratórne potvrdený. Zobrazovacie vyšetrenie magnetickou rezonanciou s alebo bez gadolínia (kontrastnej látky) je veľmi spoľahlivou metódou pre vyhľadávanie extraadrenálnych nádorov. Môže zobraziť viac ako 95 % nádorov. Z funkčných zobrazovacích vyšetrení využívame scintigrafiu s 123I-MIBG (metajódbenzylguanidín) pri podozrení na disemináciu a neobvyklú lokalizáciu, alebo PET (pozitrónovú emisnú tomografiu) s použitím 18-fluorodeoxyglukózy pri rýchlo progredujúcom tumore.
Hoci je k lokalizácii nádoru v nadobličke väčšinou zvolená správna zobrazovacia technika, v prípade extraadrenálnej lokalizácie sú veľké pochybnosti, aký má byť zvolený diagnostický postup. Až 24 % pacientov so zdanlivo sporadickým feochromocytómom sú nosiči zárodočnej mutácie, z ktorých niektoré môžu mať vplyv na predispozíciu pre extraadrenálny alebo mnohopočetný feochromocytóm [7]. Malígny feochromocytóm sa môže vyskytovať v 36 % a viac prípadov v závislosti na type nádoru. Približne 10 % pacientov s feochromocytómom môže mať v dobe diagnózy nádoru prítomný metastatický rozsev. Voľbu funkčného vyšetrenia môže ovplyvniť aj fakt, že okolo 50 % nadobličkových feochromocytómov produkuje skoro výlučne noradrenalín, ktorý je tiež príznakom extraadrenálnych feochromocytómov. Keďže produkcia adrenalínu (najlepšie zistená ako zvýšenie metanefrínu) ukazuje adrenálnu lokalizáciu, izolovaná nadprodukcia noradrenalínu (najlepšie dokazateľná zvýšením normetanefrínu bez zvýšenia metanefrínu) môže znamenať adrenálnu, alebo extraadrenálnu lokalizáciu.
Do diferenciálnej diagnózy patria stavy, ktoré môžu vzbudzovať podozrenie na jeho prítomnosť (tab. 4). Najčastejšie môže imitovať noradrenergnú hypertenziu, ktorá je charakterizovaná tachykardiou, potením, anxietou, a zvýšeným srdcovým výdajom. Títo pacienti mávajú často zvýšené hodnoty plazmatických a močových katecholamínov. Najlepšie je možné noradrenergnú hypertenziu odlíšiť od feochromocytómu pomocou klonidinového supresného testu, ktorý môže odlíšiť zvýšenie katecholamínov pri zväčšenej aktivite centrálneho sympatického systému od zvýšenia navodeného nádorom.
Table 4. Diferenciálna diagnóza feochromocytómu 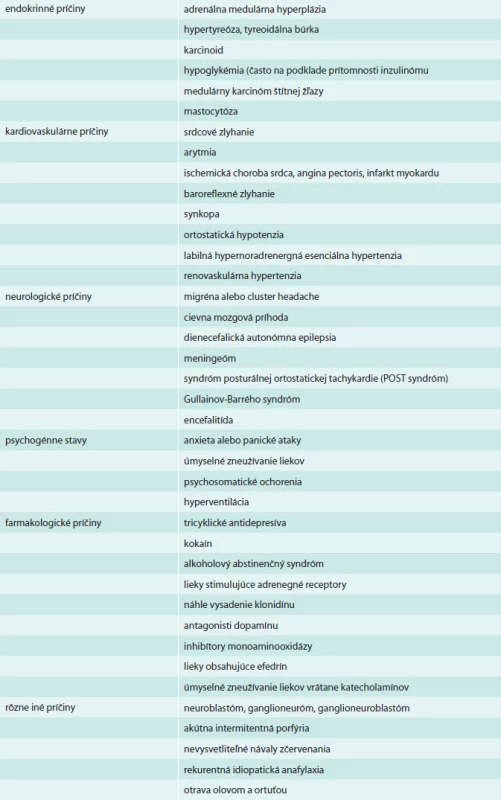
V dnešnej dobe je nutné brať do úvahy stavy navodené liekmi či inými látkami, ktoré môžu napodobňovať feochromocytóm, predovšetkým amfetamíny alebo kokaín. Amfetamíny vedú k stimulácii centrálneho nervového systému a k uvoľňovaniu katecholamínov so všetkými ich periférnymi manifestáciami. Kokaín spôsobuje uvoľňovanie katecholamínov a tiež blokuje spätné vychytávanie, takže účinok katecholamínov je zvýšený a predĺžený.
Podľa dnešných prác môže byť až 24 % feochromocytómov dedičných [8]. Dedičné feochromocytómy sú spojené s mnohopočetnou endokrinnou neopláziou typ 2 (MEN 2A alebo MEN 2B), von Recklinghausenovou neurofibromatózou typ 1 (NF 1), syndrómom von Hippel-Lindau (VHL) a familiárnou paragangliomatózou vďaka zárodočným mutáciám génov kódujúcich podjednotky B, C a D enzýmu sukcinátdehydrogenázy [9–11].
Záver
Feochromocytómy sú vzácne, ale zradné nádory drene nadobličiek, ktoré produkujú katecholamíny spôsobujúce vysoký krvný tlak, palpitácie, arytmie, hyperglykémie, hypertriacylglycerolémiu a iné. Ich príznaky môžu byť rôzne a pokiaľ nie sú tieto nádory rozpoznané alebo správne liečené, končia takmer vždy fatálne. Diagnostika feochromocytómu nie je však honbou za vzácnym ochorením, ale za poznaním príčiny hypertenzie, ktorá môže chorého usmrtiť, ak nie je včas odhalená. Ak je správne klasifikovaná, dáva potom nádej na plné vyliečenie, na ktoré sme chceli poukázať aj našou kazuistikou.
Týmto chceme vyjadriť úprimne poďakovanie za spoluprácu a pomoc prof. MUDr. Karlovi Pacákovi, DrSc., z National Institute of Health, Bethesda, USA.
MUDr. Peter Jackuliak
peter.jackuliak@gmail.com
V. interná klinika LF UK a UN, Bratislava
www.fmed.uniba.sk
Doručeno do redakce: 16. 2. 2013
Přijato po recenzi: 19. 2. 2014
Sources
1. Elder E, Elder G, Larsson C. Pheochromocytoma and functional paraganglioma syndrome: no longer the 10% tumor. J Surg Oncol 2005; 89(3): 193–201.
2. Pacák K. Feochromocytóm. Galén: Praha 2008. ISBN 978–80–7262–519–2.
3. Daub KF. Pheochromocytoma: challenges in diagnosis and nursing care. Nurs Clin North Am 2007; 42(1): 101–111.
4. Pacák K, Lazúrová I et al. Endokrinní nádory nadledvin v současné klinické praxi. Galén: Praha 2011; 1 : 131–133. ISBN 978–80–7262–819–3.
5. Lenders JW, Eisenhofer G, Mannelli M et al. Pheochromocytoma. Lancet 2005; 366 (9486): 665–675.
6. Amar L, Servais A, Gimenez-Roqueplo AP et al. Year of diagnosis, features at presentation, and risk of recurrence in patients with pheochromocytoma or secreting paraganglioma. J Clin Endocrinol Metab 2005; 90(4): 2110–2116.
7. Neumann HP, Bausch B, McWhinney SR et al. Germ-line mutations in nonsyndromic pheochromocatoma. N Engl J Med 2002; 346(19): 1459–1466.
8. Mantero F, Terzolo M, Arnaldi G et al. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab 2000; 85(2): 637–644.
9. Manger WM, Gifford RW. Pheochromocytoma. J Clin Hypertens (Greenwich) 2002; 4(1): 62–72.
10. Pacak K, Linehan WM, Eisenhofer G et al. Recent advances in genetics, diagnosis, localization and treatment of pheochromocytoma. Ann Intern Med 2001; 134(4): 315–329.
11. Pacak K, Ilias I, Adams KT et al. Biochemical diagnosis, localization and management of pheochromocytoma: focus on multiple endocrine neoplasia type 2 in relation to other hereditary syndromes and sporadic forms of the tumour. J Intern Med 2005; 257(1): 60–68.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 5-6-
All articles in this issue
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

