Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
Authors:
L. Procházková; P. Němec; M. Souček
Authors‘ workplace:
Revmatologická ambulance II. interní kliniky Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MU Dr. Miroslav Souček, CSc.
Published in:
Vnitř Lék 2013; 59(5): 383-390
Category:
Review
Overview
Spondyloartritidy (SpA) jsou heterogenním souborem chronických zánětlivých onemocnění se společnými klinickými rysy a genetickým podkladem. Primárně postihují osový skelet, zejména sakroiliakální skloubení, dalšími lokalizacemi postižení jsou periferní klouby a – pro skupinu spondyloartritid typické – enteze. Na základě predominantního postižení osového či periferního skeletu je lze podle aktuálních klasifikačních kritérií členit na axiální SpA a periferní SpA. Mnoho pacientů má kromě axiálních a periferních kloubních projevů i mimokloubní manifestace, které tak mohou být významným diagnostickým vodítkem a taktéž prvním projevem onemocnění. Nejčastějšími z nich jsou přední uveitida, zánětlivá střevní onemocnění a psoriáza. Taktéž silná vazba spondyloartritid na pozitivitu HLA B27 antigenu či rodinný výskyt onemocnění je významnou informací napomáhající v diagnostice. Nedílnou součástí problematiky spondyloartritid jsou komorbidity, z nichž k nejčastějším a nejvýznamnějším patří kardiovaskulární onemocnění nebo osteoporóza a její důsledky v podobě fraktur.
Klíčová slova:
spondyloartritidy – ASAS kritéria – sakroiliitida – MRI – mimokloubní manifestace – entezitida
Úvod
Zatímco v rychlosti stanovení diagnózy revmatoidní artritidy byl v poslední dekádě učiněn významný pokrok, u skupiny onemocnění označovaných jako axiální spondyloartritidy není situace zdaleka tak optimistická. Označení axiální spondyloartritida (aSpA) je aktuálně preferovaný název pro podskupinu onemocnění ze skupiny spondyloartritid, která je charakterizována přítomností chronické bolesti zad vzniklé před 45. rokem věku. Patří mezi ně jak plně vyjádřená forma choroby a nejznámější nosologická jednotka z nich – ankylozující spondylitida (AS), tak nově i stavy bez radiograficky prokazatelné sakroiliitidy. Toto novější označení a rozdělení skupiny spondyloartritid vyplývá z nových klasifikačních kritérií vytvořených v roce 2009 skupinou ASAS (Assessment of SpondyloArthritis international Society) a odráží rozšiřující se diagnostické a terapeutické možnosti těchto onemocnění.
Prodlení mezi vznikem prvních symptomů a stanovením diagnózy u ankylozující spondylitidy je podle různých autorů až 9 let [1,2]. Důvodů, proč dochází k takovémuto zpoždění, je hned několik. V minulých letech (od roku 1984) byla pro klasifikaci AS používána zejména modifikovaná newyorská kritéria [3]. Podle těchto kritérií byla AS přítomna u pacientů za podmínky přítomnosti radiografického kritéria a alespoň jednoho kritéria klinického (obr. 1). Klinická kritéria přitom zahrnovala pouze zánětlivou bolest zad, limitaci spinální mobility a omezení expanze hrudníku (měřeno jako dechové exkurze). Právě limitace hybnosti v oblasti páteře a omezení expanzí hrudníku jsou většinou dosti pozdním příznakem již pokročilého onemocnění a nejsou projevem odrážejícím zánětlivou aktivitu, spíše jeho důsledkem. Ke splnění radiografického kritéria musela být přítomna minimálně oboustranná sakroiliitida 2. stupně, nebo 3.– 4. stupně jednostranně. Opět tedy požadavek průkazu strukturálních změn, které jsou i vzhledem k relativně pomalé progresi radiografického poškození přítomny se zpožděním. Ne nepodstatným problémem je také to, že ačkoliv je sakroliitida hlavním znakem AS, má interpretace RTG nálezů sakroiliitidy zejména 2. a nižších stupňů omezenou senzitivitu i specificitu [4]. Dalším a neméně důležitým důvodem opožděného stanovení diagnózy je relativní rozmanitost příznaků spondyloartritid, včetně důležitých a ve starších kritériích zcela opomíjených mimokloubních projevů onemocnění, která mohou být velmi dobrým diagnostickým vodítkem.

ASAS kritéria
Spondyloartritidy (SpA) jsou skupinou zánětlivých chronických onemocnění, pro které je charakteristické postižení osového skeletu a společný genetický podklad v podobě pozitivity HLA B27 antigenu. Jsou pro ně typické specifické radiografické projevy v pokročilejších stadiích onemocnění, stejně jako změny prokazatelné jinými zobrazovacími metodami již v časných stadiích choroby. SpA jsou skutečně heterogenní skupinou onemocnění, zahrnující ankylozující spondylitidu (AS), psoriatickou artritidu, reaktivní artritidu, artritidy doprovázející zánětlivá střevní onemocnění a nediferencovanou artritidu. Klinické projevy onemocnění jsou různorodé a zahrnují zejména bolest zad, artritidu – nejčastěji oligoartritidu predominantně postihující dolní končetiny, entezitidy, daktylitidy a četné mimokloubní projevy, jako je uveitida, psoriáza či zánětlivé střevní onemocnění typu Crohnovy nemoci nebo ulcerózní kolitidy. Typické je prolínání těchto projevů mezi jednotlivými klinickými jednotkami.
Dalším možným pohledem je dělení celé skupiny onemocnění podle převažujících příznaků (obr. 2) tak, jak je tomu dle ASAS klasifikačních kritérií (obr. 3). Skupina SpA je zde rozdělena na 2 větve (obr. 4): skupinu axiálních spodylartritid, kde je přítomno klinické postižení ve smyslu chronické bolesti zad se vznikem před 45. rokem věku a skupinu periferních spondyloartritid, kde tento klinický projev není přítomen [5]. Oproti původním kritériím je tím umožněna identifikace a klasifikace pacientů jak s projevy osovými, tak s periferními manifestacemi.

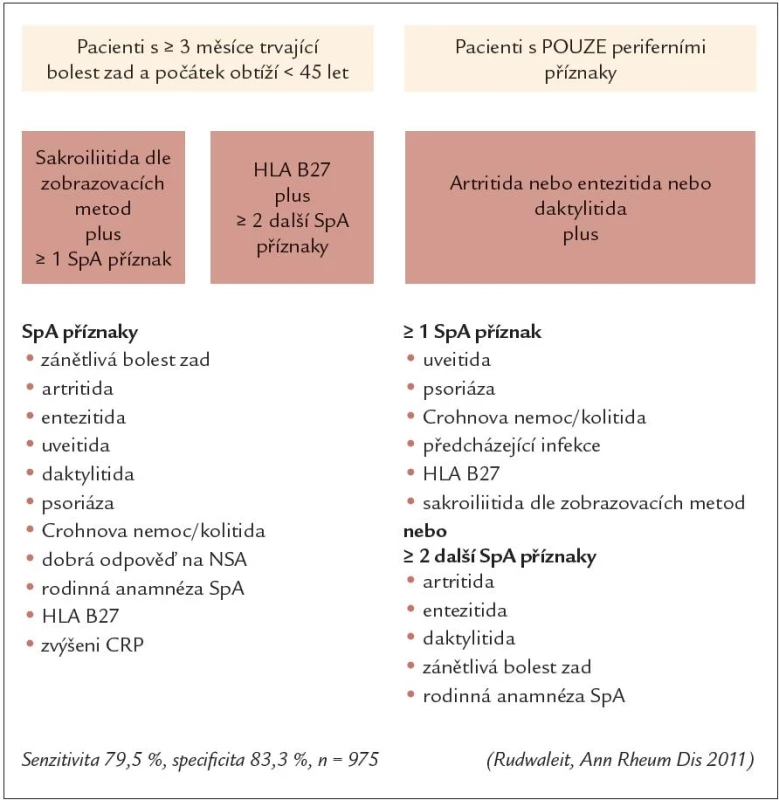
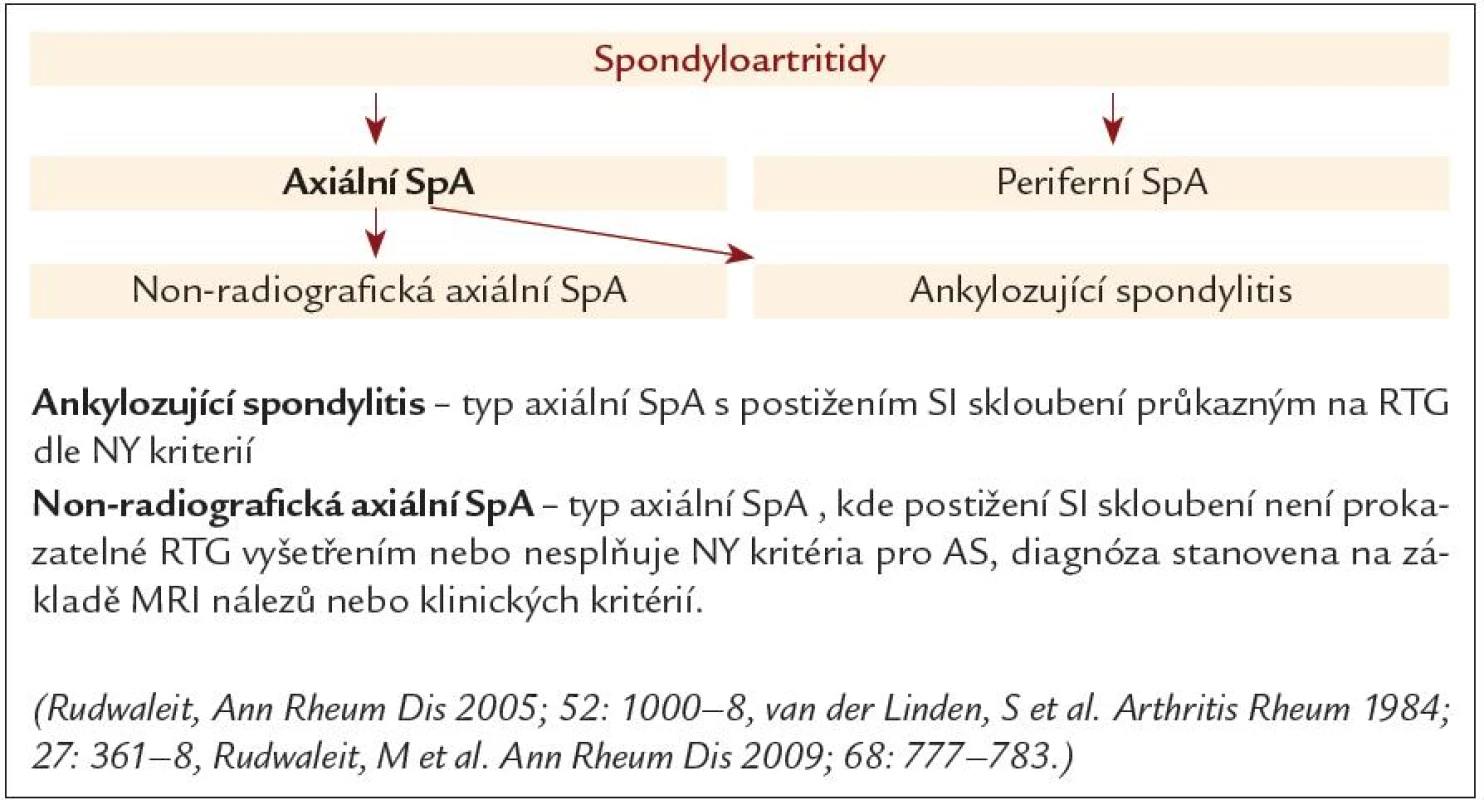
Podskupinu axiálních spondyloartritid je dále možno rozdělit na skupinu tzv. radiografické SpA – onemocnění s již prokazatelnou sakroiliitidou podle RTG (tedy vlastní AS) a skupinu tzv. neradiografické SpA (non‑radiographic SpA – nxSpA) (obr. 4). U této subpopulace pacientů není sakroiliitida prokazatelná rentgenologicky. Je zde buď možno prokázat aktivní sakroiliitidu vyšetřením SI skloubení magnetickou rezonancí, nebo je nález na SI skloubeních zcela negativní a diagnóza je stanovena na základě přítomnosti HLA B27 antigenu a dalších klinických projevů onemocnění. A právě zde nabývají na významu i mimokloubní projevy těchto onemocnění.
Průkaz sakroiliitidy podle zobrazovacích metod
Podle nové koncepce spondyloartritid je akceptován průkaz sakroiliitidy rentgenologicky nebo magnetickou rezonancí. Ostatní dříve užívaná vyšetření (CT, scintigrafie) nejsou z níže uvedených důvodů pro diagnostiku postižení SI skloubení přijatelná.
RTG
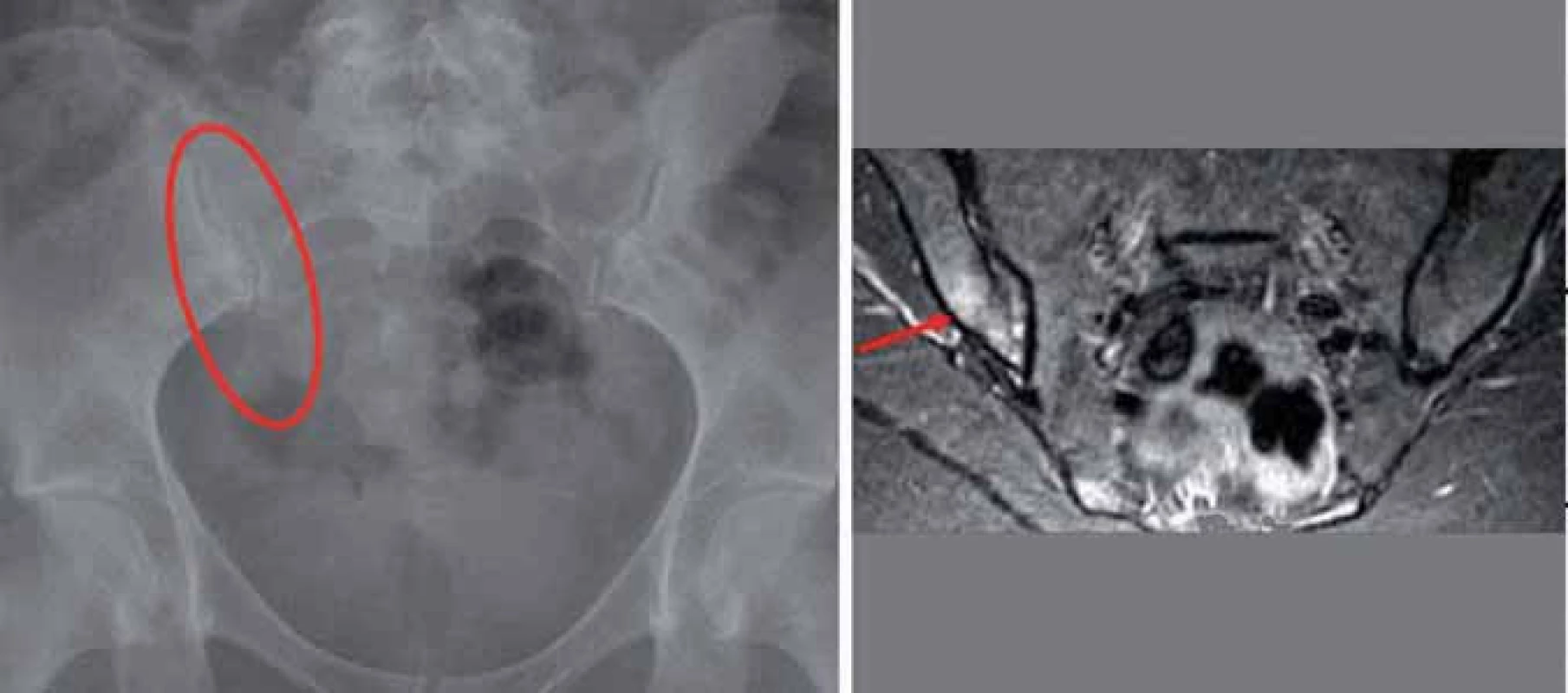
RTG SI skloubení je základním zobrazovacím vyšetřením, nicméně je známo, že zejména při posuzování počínajících změn je často zatíženo chybou hodnotitele. Hodnocení RTG snímků SI skloubení není jednoduché – je to dáno jednak multiplanární anatomií SI skloubení a také častou přítomností artefaktů, ztěžujících hodnocení. Zejména je třeba se zaměřit na hodnocení distálních částí SI skloubení, neboť právě zde se většinou vyskytují první strukturální zánětlivé léze. Nepřítomnost strukturálních lézí však nevylučuje diagnózu spondyloartritidy (obr. 5). V jedné z publikovaných prací [6] bylo sledováno 50 pacientů se zánětlivou bolestí zad, kteří neměli pozitivní nález na RTG SI skloubení. S odstupem 3,3 roku již 21 z těchto 50 pacientů splňovalo modifikovaná NY kritéria – byla tedy u nich již prokazatelná RTG sakroiliitida. Právě suspektní nálezy (sakroiliitida 1. stupně – tzv. low grade sacroiliitis) mají vysokou prediktivní hodnotu pro vývoj definitivní sakroiliitidy podle RTG. Je tedy nezbytné u těchto suspektních nálezů provádět opakovaná vyšetření a doplnit v případě klinického podezření MRI vyšetření. Pravděpodobnost průkazu strukturálních změn na SI skloubeních narůstá v průběhu času. Nicméně i po 10 letech trvání nemoci pouze asi 1/ 2 pacientů, u nichž byla diagnóza stanovena na základě klinických nálezů, prokáže radiografickou sakroiliitidu.
MRI
MRI vyšetření detekuje aktivní zánětlivé léze v podobě edému kostní dřeně či osteitidy v oblasti SI skloubení nebo páteře. K hodnocení SI skloubení a páteře se užívají 2 různé sekvence: sekvence s potlačením tukové tkáně – tzv. tekutina‑ senzitivní (např. STIR), a sekvence se senzitivitou pro tukovou tkáň (např. T1w) [12]. Nebyla prokázána výhoda použití sekvence s aplikací kontrastní látky oproti STIR v běžné klinické praxi [13]. ASAS skupina přesně definovala sakroiliitidu dle MRI: za průkaz aktivní zánětlivé léze SI skloubení je považován edém kostní dřeně (v sekvenci STIR) nebo osteitida (v sekvenci T1 po aplikaci kontrastní látky gadolinia) lokalizované v subchondrální nebo periartikulární kostní dřeni ve 2 lokalizacích na 1 snímku nebo v 1 lokalizaci na 2 a více snímcích (obr. 6). Přítomnost strukturálních lézí, jako jsou tuková depozice, sklerotizace, eroze či ankylóza v nepřítomnosti aktivní zánětlivé léze není dostačující pro diagnózu sakroiliitidy dle MRI [14].
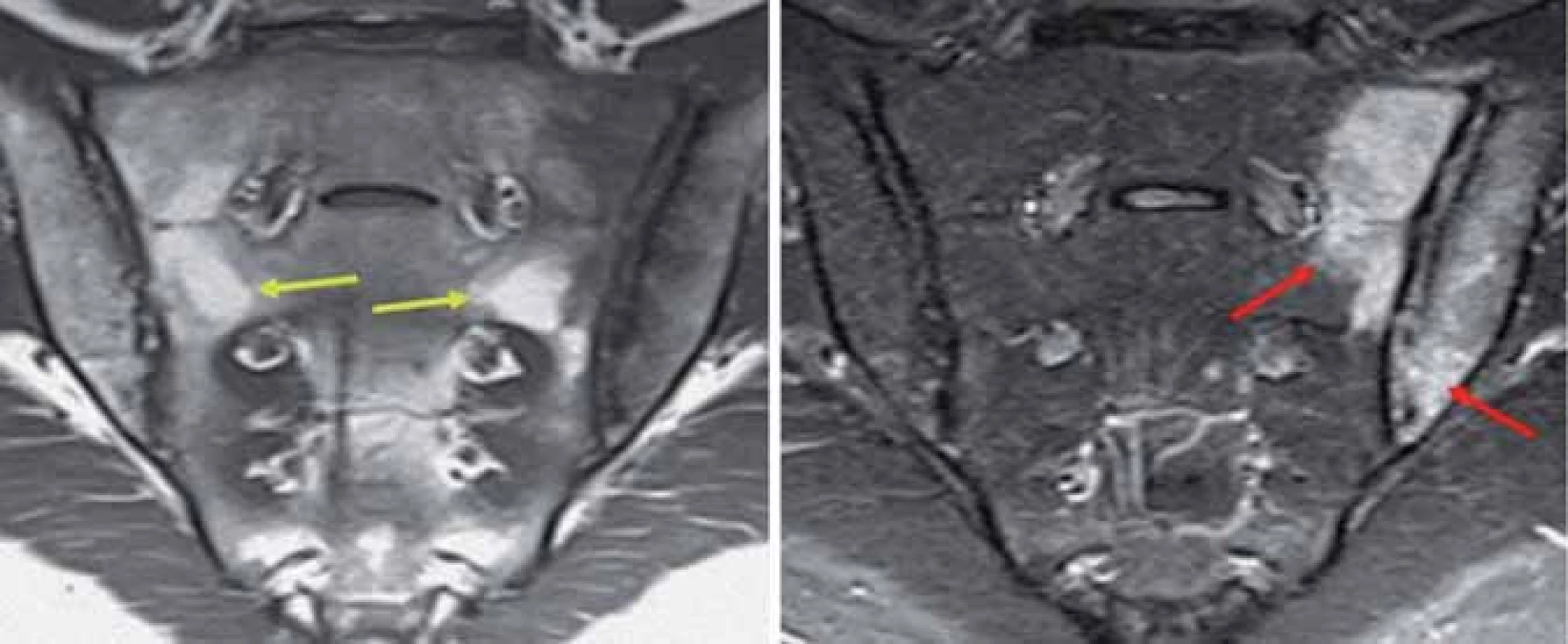
MRI páteře se v použitých sekvencích a nálezech neliší od zobrazení SI skloubení, užívá se sagitální zobrazení páteře. Důležité je zobrazení laterálních řezů, protože nález zánětlivé léze (edému kostní dřeně) v této oblasti je vysoce specifický pro SpA [15].
MRI je tedy velkým přínosem v diagnostice SpA. Průkaz edému kostní dřeně v přesně definovaných lokalizacích a počtu je obrazem aktivní sakroiliitidy a má stejnou hodnotu pro klasifikaci onemocnění jako původně požadovaná sakroilitida podle RTG. Slouží pro potvrzení diagnózy založené na klinických vyšetřeních v případě normálního nebo suspektního nálezu podle RTG (časná stadia). Nutno ovšem podotknout, že ani normální MRI SI skloubení nevylučuje pre‑radiografické stadium SpA. V případě podezření na časnou SpA (na základě klinických nálezů) a negativního MR SI skloubení je doporučeno pravidelné kontrolní vyšetření každých 6– 12 měsíců.
CT, scintigrafie, UZ
Ve světle výše uvedených „nedostatků“ RTG průkazu strukturálních změn byly v minulosti využívány další zobrazovací metodiky. CT vyšetření SI skloubení nenabízí oproti RTG žádné výhody – i zde se jedná pouze o průkaz strukturálních změn, bez možnosti zobrazení aktivních zánětlivých lézí. CT scan má lepší senzitivitu než RTG pánve, ale stejně nízkou specificitu [7– 10]. Navíc je toto vyšetření zatíženo nezanedbatelnou radiační zátěží. Podle doporučení ASAS není tedy CT vhodnou metodikou k průkazu sakroiliitidy. Jednou z mála indikací může být průkaz transspinální fraktury u pacientů s AS, která je většinou v prostém RTG obraze neprůkazná. Stejně jako CT vyšetření ani scintigrafie skeletu nenabízí žádné výhody oproti RTG vyšetření. Limitacemi jsou jednak opět vyšší radiační zátěž, dále pak nemožnost přesného anatomického určení léze. Nelze diferencovat mezi strukturálními a aktivními zánětlivými lézemi, výsledky vyšetření bývají velmi často falešně pozitivní. Scintigrafii lze použít k průkazu vícečetných entezitid u pacientů s periferním postižením, tedy např. k diferenciální diagnostice polyentezitid jako součásti SpA oproti fibromyalgii [11]. Ultrasonografii je pak možno použít jednak k průkazu periferního postižení (artritidy, entezitidy), což je jeho hlavní indikace v diagnostice SpA, a jednak k vyšetření SI skloubení. Právě průkaz sakroiliitidy pomocí UZ je však poměrně sporný. Toto vyšetření je možné, nicméně je nezbytné, aby bylo prováděno velmi zkušeným monografistou, a není prováděno rutinně. UZ lze zachytit jak strukturální léze, tak subklinické zánětlivé změny.
Jednotlivé příznaky SpA
Zánětlivá bolest zad (IBP)
Zánětlivá bolest zad (IBP) je přítomna téměř u 90 % pacientů s axiální SpA [20]. IBP byla v minulosti opakovaně předmětem pokusů o přesnou a jednoznačnou definici. V současnosti jsou k dispozici různá kritéria ke stanovení diagnózy tzv. zánětlivé bolesti zad. Skupinou ASAS byla vytvořena klasifikační kritéria zahrnující tyto příznaky:
- vznik bolestí před 40. rokem věku,
- plíživý začátek obtíží,
- zmírnění bolestí cvičením,
- bez zmírnění bolestí v klidu,
- bolest přítomná v noci, mírnící se po povstání z lůžka.
Zánětlivá bolest zad je klasifikována v přítomnosti alespoň 4 z těchto 5 kritérií. Podle recentních modifikací doporučení je dostačující i přítomnost 3 z 5 příznaků. Navrhovaná kritéria pro IBP jsou také součástí návrhu na screeningový algoritmus u pacientů s bolestí zad (obr. 7). Základním rozdílem oproti původním newyorským kritériím je tedy chápání zánětlivé bolesti zad jako důležitého příznaku, nikoliv však podmínky pro diagnózu SpA [21].
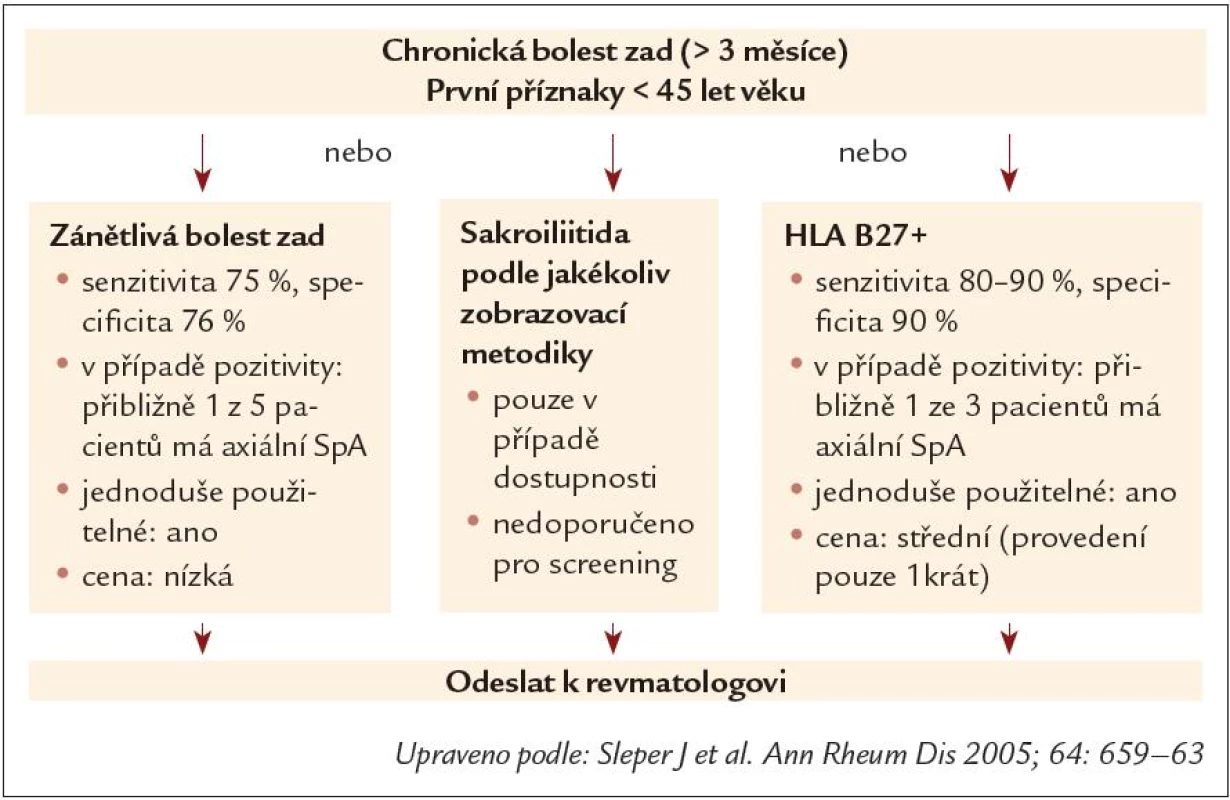
Artritidy
Periferní artritidy u SpA byly charakterizovány nejčastěji jako oligoartritidy či monoartritidy, vyskytující se asymetricky a predominantě na dolních končetinách, ale postižen může být kterýkoliv periferní kloub. Data ukazující percentuální zastoupení artritid u pacientů se SpA nejsou zcela konzistentní. Jedním z důvodů je rozdílné složení hodnocených souborů, kde největší rozdíl činí zařazení či vyřazení pacientů s psoriatickou artritidou, u nichž je právě postižení periferních kloubů velmi časté. Rozdílně je také hodnoceno relativně časté postižení kyčelních kloubů – některými autory je přiřazováno k osovému skeletu, jiní jej řadí mezi periferní artritidy. Právě postižení proximálních kloubů jako kyčlí či ramenou je ve skupině spondyloartritid časté a významně ovlivňuje kvalitu života pacientů.
Entezitidy
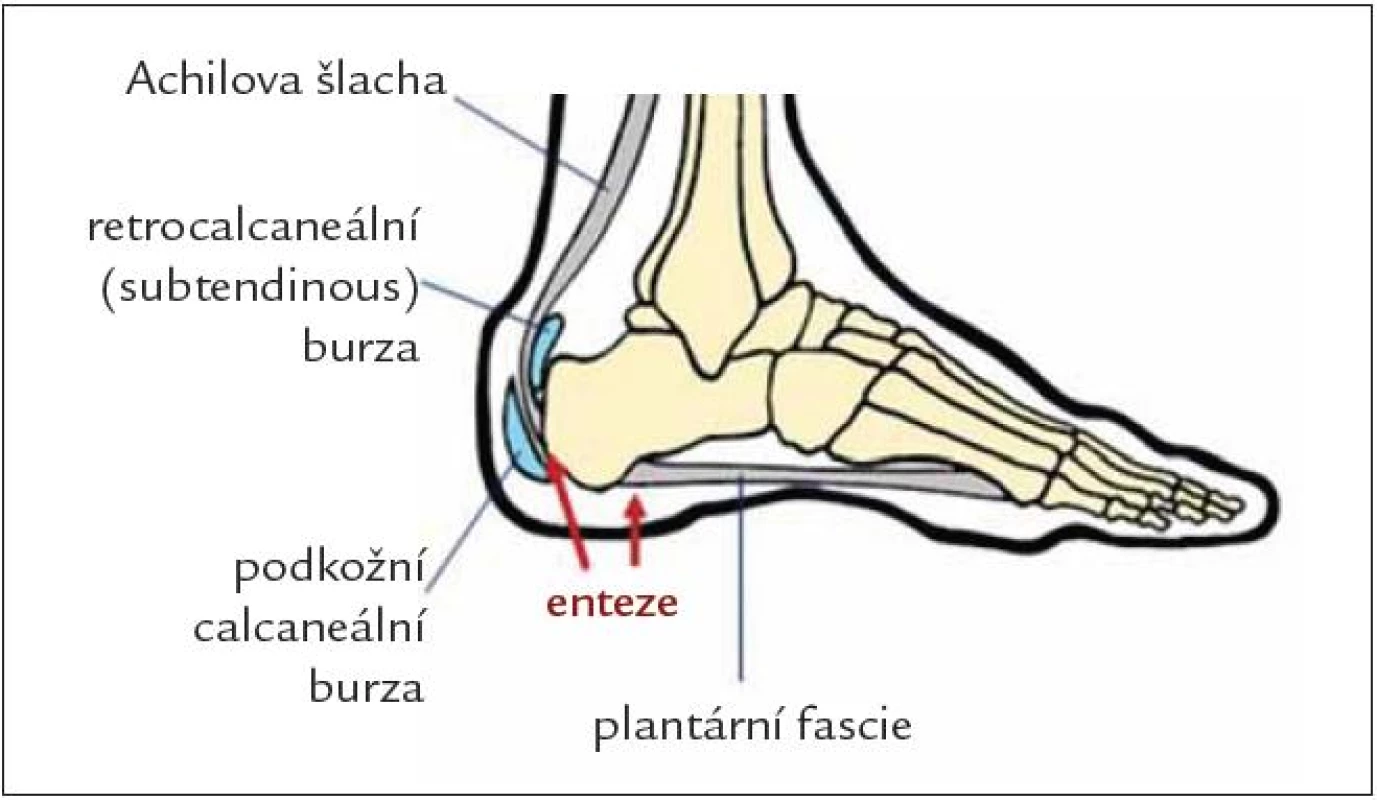
V době stanovení diagnózy již přibližně 40 % pacientů s axiální spondylitidou prodělalo enterizidu [22]. V podstatě může být postižena kterákoliv enteze, postižení v oblasti dolních končetin je však častější než entezitidy na horních končetinách [23]. Nejčastější a pro SpA vcelku typická je pak entezitida v oblasti patní kosti – ať už entezitida v oblasti úponu Achillovy šlachy na zadní část kalkanea (ta je zodpovědná za bolest v oblasti zadní části patní kosti), nebo entezitida v oblasti úponu plantární fascie na dolní část kallanea, zodpovědná za bolesti v oblasti plosky nohy (obr. 8). Klinický nález v oblasti patní kosti bývá většinou chudý, vodítkem je bolestivost v oblasti úponu. V případě výrazného prosáknutí se většinou jedná nikoliv o entezitidu, ale o častou burzitidu. V rámci snahy o vyloučení jiných nálezů než entezitid při diagnostice SpA, zejména z obavy o možné diferenciálně diagnostické problémy při diferenciaci mezi polyentezopatiemi a fibromyalgií, byla právě entezitida v oblasti patní kosti jako jediná zařazena mezi klasifikační kritéria. Nicméně v rámci klinických hodnocení jsou běžně užívány i širší entezitické indexy, hodnotící nejčastěji i oblast pánve a na horních končetinách epikondyly v oblasti loktů. Entezopatie bývá někdy přirovnávána k ledovci, kdy postižení vlastní šlachy činí jen malou část a většina patologického nálezu je na kostní straně. Není tedy překvapením, že jednou z diagnostických metod užívaných k průkazu zejména polyentezitid je scintigrafie. Taktéž při průkazu magnetickou rezonancí je zřetelné postižení v oblasti kosti. Ultrazvukové vyšetření prokazuje zánětlivé léze v místě ukotvení šlachy na kost.
Uveitida
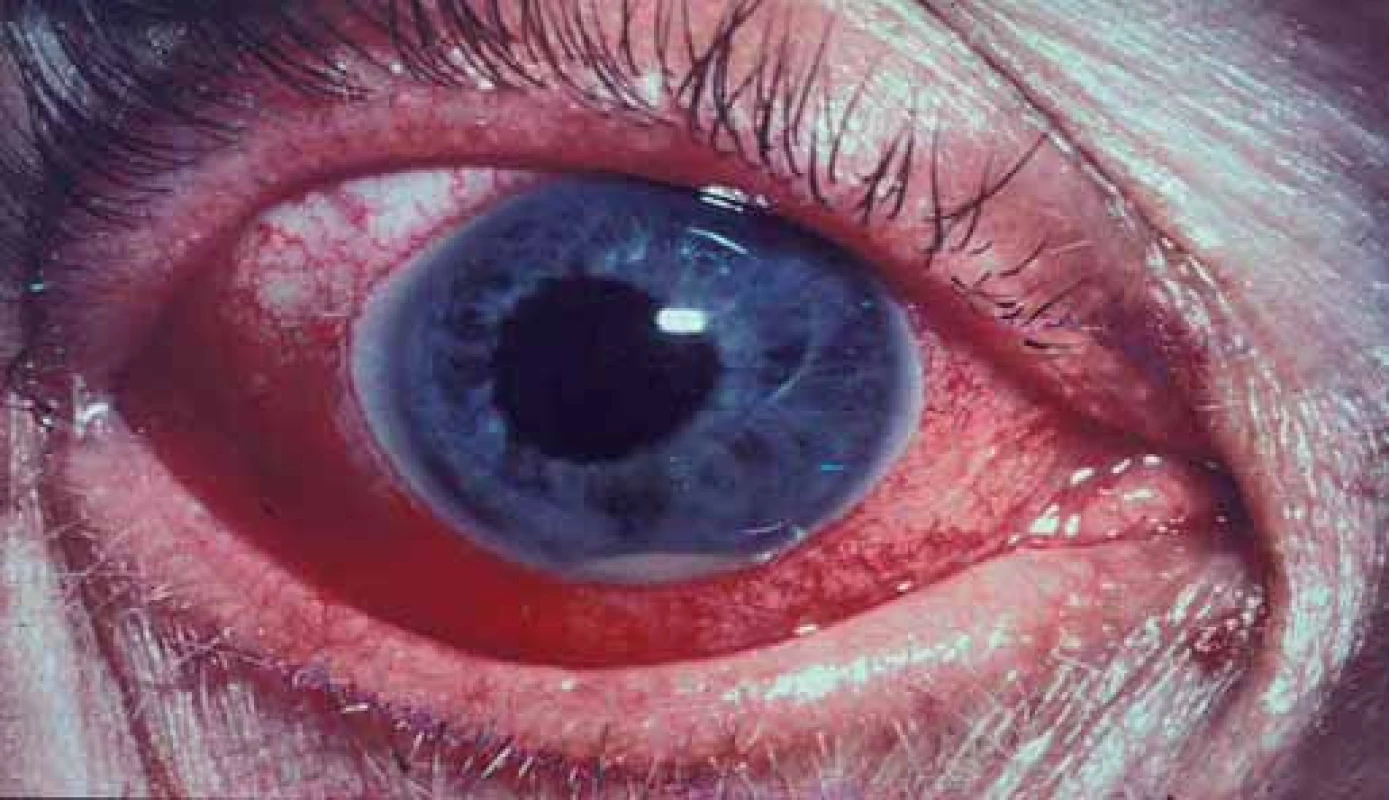
Akutní přední uveitida jako nejčastější typ očního mimokloubního postižení při SpA je velmi častá, v době stanovení diagnózy SpA ji nalezneme v anamnéze až u 12 % pacientů a někdy v průběhu onemocnění ji prodělá až 1/ 2 všech pacientů se spondyloartritidou [22]. Zadní uveitida je vzácnější. Charakteristickými znaky jsou zarudnutí a epizodická bolest postiženého oka, většinou probíhající unilaterálně, zřídka synchronizovaná s aktivitou SpA (obr. 9). Akutní uveitida může odeznít sama, častá je rekurence na protilehlém oku. Ataky jsou provázeny fotofobií a zvýšeným slzením. Prognóza je ve většině případů dobrá, u některých pacientů však může dojít i k nevratnému poškození vizu. HLA B27 pozitivní pacienti mají všeobecně horší průběh uveitid než případy idiopatické uveitidy u HLA B27 negativních.
Daktylitida
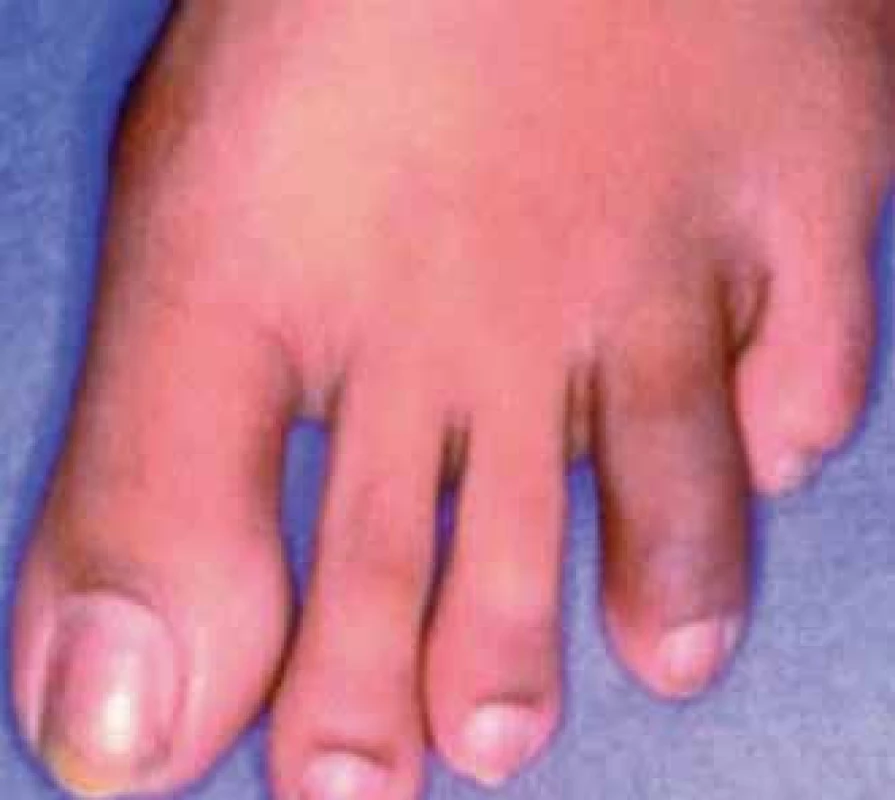
Daktylitida je také relativně typickým nálezem u spondyloartritid. V době stanovení diagnózy SpA již prodělalo daktylitidu asi 7 % pacientů [22]. Postižen může být kterýkoliv z prstů rukou či nohou včetně palců. Asi nejvýstižnějším označením pro daktylitidu je onen známý termín „párkovitý“ prst (obr. 10). Jedná se o bolestivé prosáknutí prstů v oblasti šlach flexorů se zvětšením objemu prstu jako celku, v případě akutní epizody často provázené zarudnutím. Většinou v tomto případě nelze rozlišit mezi synovitidou a tenosynovitidou [24].
Psoriáza
Kolem 8 % pacientů se SpA má již v době diagnózy psoriázu [22]. I když je častější předcházení psoriázy axiálním symptomům, nelze možnou přítomnost kožních projevů opomíjet ani u stavů bez zjevných kožních lézí. Součástí vyšetření zaměřeného na průkaz psoriázy je klinické vyšetření cílené na typické lokalizace psoriatických plaků, jako jsou extenzorové strany končetin, i na místa pro psoriázu specifická, jako jsou kštice, pupík, retroaurikulární prostory a kožní ohyby. Důležitá je také inspekce nehtů, jejichž postižení (typické léze nehtů: onycholýza, pitting a hyperkeratóza) se vyskytuje až u 50 % pacientů s psoriázou. Neméně důležitá je i otázka rodinného výskytu psoriázy.
Kromě psoriázy jsou možnými doprovodnými kožními manifestacemi např. erythema nodosum, provázející stavy asociované s Crohnovou chorobou, či pyoderma gangrenosum u pacientů s ulcerózní kolitidou.
IBD
IBD (inflammatory bowel disease – zánětlivá střevní onemocnění) jsou jedním z možných mimokloubních projevů SpA (obr. 11). Crohnova nemoc či ulcerózní kolitida jsou prokazatelné u 4 % pacientů se SpA již v době stanovení diagnózy spondyloartritidy [22]. Nelze samozřejmě rutinně u pacientů se SpA provádět kolonoskopické vyšetření k průkazu či vyloučení IBD. Nicméně v případě pozitivní odpovědi na některou z následujících otázek je vhodné podrobnější vyšetření: chronické bolesti břicha?, průjmy?, spontánní váhový úbytek?, krev či hlen ve stolici?, anémie?, rodinná anamnéza IBD? [25]. V laboratorních nálezech pátráme po známkách zánětu a malabsorpce, v klinickém vyšetření po fistulích, abscesech či aftózních ulceracích v dutině ústní. Prevalence klinicky manifestního IBD u pacientů se SpA je do 10 %, předpokládá se, že ve 25– 50 % probíhá IBD subklinicky.
Dobrá odpověď na NSA
Jedním z příznaků zahrnutých do ASAS klasifikačních kritérií je dobrá odpověď na terapii nesteroidními antirevmatiky (NSA). V intervalu 24– 48 hod po užití plné terapeutické dávky NSA by mělo dojít k vymizení či výraznému zmírnění bolesti zad. Nesteroidní antirevmatika jsou efektivní terapií ovlivňující hlavní příznaky onemocnění a v případě nepřítomnosti kontraindikací by měly být lékem volby u většiny pacientů se SpA. Nová data ukazují i jistou možnost ovlivnění radiografické progrese v případě dlouhodobého užívání NSA v pravidelném režimu oproti užití on demand, nicméně tato data nejsou platná pro celou skupinu SpA, protektivní efekt NSA se týkal zejména pacientů s vysokým vstupním CRP [39,40]. Na druhé straně je třeba mít na paměti možné nežádoucí účinky dlouhodobého užívání NSA.
Rodinná anamnéza SpA
Již dlouhou dobu je znám rodinný výskyt spondyloartritid. Riziko výskytu kupř. AS u sourozenců je > 50násobné oproti 6násobku u revmatoidní artritidy. V mnoha studiích na dvojčatech byl prokázán shodný výskyt onemocnění až u 75 % případů [19]. Stejně tak je známa jistá „dědičnost“ konkrétních klinických manifestací onemocnění. Takováto významná dědičnost bývá většinou průkazná u monogenně dědičných chorob, ale evidence z rodinných a dvojčecích studií u SpA ukazuje na vliv několika různých genů. I z hlediska výše uvedeného je tedy zřejmé, že správně odebraná rodinná anamnéza je velmi důležitým faktorem, a potvrzením důležitosti této informace je i zařazení rodinné anamnézy SpA mezi jednotlivá klasifikační kritéria (akceptován je výskyt ankylozující spondylitidy, psoriázy, akutní uveitidy, reaktivní artritidy či IBD u příbuzných 1. nebo 2. řádu).
HLA B27
Spondyloartritidy jsou skupinou onemocnění s významným genetickým podkladem. HLA B27 je jednou z mnoha alel na HLA B lokusu, který náleží k 1. třídě hlavního histokompatibilního komplexu (MHC). Jeho významná asociace s ankylozující spondylitidou byla poprvé publikována již v roce 1973. Mezi kavkazskou populací je výskyt tohoto antigenu asi 8 %, zatímco u pacientů se spondyloartritidou je to mezi 70– 90 % [17]. Tato čísla ukazují na jednu z nejsilnějších asociací mezi HLA alelou a určitou nemocí. Nutno podotknout, že vazba se týká jen určitých subtypů HLA B27 antigenu, které se mezi sebou liší jen několika málo aminokyselinami. Stejně tak není pozitivita HLA B27 antigenu vyjádřena stejnou měrou u různých klinických manifestací této skupiny onemocnění. Zatímco u pacientů s prokázanou ankylózující spondylitidou je HLA B27 antigen přítomen v 90– 95 %, u pacientů s reaktivními artritidami je to mezi 70 a 80 %, u pacientů s psoriatickou artritidou ve 24 %, a u pacientů s IBD jen kolem 7 % případů [18]. Vlastní patofyziologická role HLA B27 antigenu není dosud jasná – existuje několik hypotéz počínaje teorií o antigen‑ prezentující roli HLA B27 a nebo možností aktivace NK buněk prostřednictvím homodimerů těžkých řetězců.
Zvýšení CRP
Rutinní krevní testy mají v diagnostice SpA limitovanou hodnotu. Význam zvýšených hodnot sedimentace erytrocytů (FW) a C‑ reaktivního proteinu (CRP) je zde nižší než kupř. u RA, pozitivní nález pouze u 50– 60 % pacientů, často nekoreluje s aktivitou onemocnění [20]. Zvýšené CRP tak lze akceptovat jako jedno z klasifikačních kritérií a známku onemocnění u pacientů s axiálními symptomy pouze po vyloučení jiných příčin tohoto nálezu, jako např. infekce, nádorového onemocnění apod. Popisované zvýšení sérové alkalické fosfatázy (ALP) je bez korelace s aktivitou onemocnění či trváním choroby.
Komorbidity
V poslední době je u revmatických onemocnění významná pozornost věnována i diagnostice doprovodných onemocnění a management terapie se stává nedílnou součástí komplexní léčby revmatických chorob. Mezi nejvýznamnější komorbidity provázející SpA patří např. osteoporóza a v neposlední řadě, stejně jako je tomu u RA, i četné kardiovaskulární komorbidity.
Osteoporóza
U pacientů s AS existuje vyšší riziko vertebrálních fraktur, udáváno je až 6násobné zvýšení rizika pro vertebrální fraktury ve srovnání s běžnou populací [26,27]. Pravděpodobně je to důsledkem nižší kostní hustoty a zvýšené rigidity v oblasti páteře. Markery kostní resorpce, jako je pyridinolin, ale i RANKL, byly podle výsledků studií u pacientů s AS zvýšeny. Naopak BMD bylo u těchto pacientů sníženo [28,29]. Recentní data ukazují snížení BMD i u pacientů v časné fázi spondyloartritidy [30,31]. Osteoporóza u pacientů se SpA souvisí s aktivitou onemocnění [32], čehož důkazem je i fakt, že u pacientů léčených anti‑TNF preparáty většinou dochází k zástavě poklesu BMD. Vyšetření kostní denzity by tedy mělo být součástí komplexní péče o pacienty se SpA.
Kardiovaskulární onemocnění
Zvýšené riziko kardiovaskulárních onemocnění u pacientů se SpA je připisováno na vrub chronického zánětlivého procesu v kombinaci s dysregulací lipidového spektra či jinými běžnými rizikovými faktory, jako jsou obezita, nízká fyzická aktivita, hypertenze, kouření [33– 35]. K vyššímu kardiovaskulárnímu riziku může přispívat i farmakoterapie SpA, zejména dlouhodobé užívání nesteroidních antirevmatik či kortikoterapie [36]. V minulosti byla v různých studiích opakovaně prokázána vyšší prevalence hypertenze, ICHS, cerebrovaskulárních onemocnění či diabetu u pacientů se SpA ve srovnání se zdravou populací [34,37,38]. Samostatnou kapitolou jsou méně známé a méně časté vlastní manifestace SpA v oblasti kardiovaskulárního systému. Patří mezi ně aortální regurgitace jako jedna z nejčastěji rozpoznaných kardiálních manifestací s jizevnatými změnami v oblasti kořene aorty a aortálních chlopní. V důsledku zánětlivých změn v oblasti septa může dojít k různým převodním poruchám od benigních až po závažné AV blokády, toto poškození kardiovaskulárního systému je častější u pacientů s pozitivitou HLA B27 antigenu. I v případě kardiovaskulárních komorbidit a mimokloubních manifestací SpA v oblasti kardiovaskulárního systému je tedy na místě zvážit komplexní screening těchto poškození a důrazně prosazovat preventivní a v případě potřeby i terapeutická opatření, vedoucí k omezení rizika zvýšené kardiovaskulární morbidity a mortality.
Závěr
Časné rozpoznání různých fenotypů SpA je důležitým cílem nejen z důvodu současných terapeutických možností, jakými je např. biologická léčba. Stejně jako je tomu u jiných revmatických onemocnění, i u SpA je počáteční fáze onemocnění ideálním „místem a dobou“ zásahu i s vědomím jistých limitací, jakými jsou např. zatím ne zcela dostatečná data o možném ovlivnění radiologické progrese anti‑TNF preparáty.
Koncept axiální SpA zahrnuje všechny stupně onemocnění počínaje stadii bez radiograficky prokazatelného postižení až po finální stavy kompletní ankylózy páteře. Díky rozpoznání významu periferních a mimokloubních projevů a důležitosti genetického podkladu onemocnění, jež jsou nově součástmi klasifikačních kritérií, je možno zkrátit ono zpoždění od vzniku prvních symptomů do stanovení diagnózy a zachytit časněji celé spektrum této skupiny onemocnění. Užití nových zobrazovacích metodik pak napomáhá rozpoznání iniciálních stavů vzniku strukturálních změn na počátku onemocnění.
MU Dr. Leona Procházková
www.fnusa.cz
e‑mail: leona.prochazkova@fnusa.cz
Doručeno do redakce: 5. 2. 2013
Přijato po recenzi: 19. 3. 2013
Sources
1. Feldtkeller E, Erlendsson J. Definition of disease duration in ankylosing spondylitis. Rheumatol Int 2008; 28: 693– 696.
2. Mau W, Zeidler H, Mau R et al. Clinical features and prognosis of patients with possible ankylosing spondylitis. Results of a 10‑year followup. J Rheumatol 1988; 15: 1109– 1114.
3. van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum 1984; 27: 361– 368.
4. van Tubergen A, Heuft‑ Dorenbosch L, Schulpen G et al. Radiographic assessment of sacroiliitis by radiologists and rheumatologists: does training improve quality? Ann Rheum Dis 2003; 62: 519– 525.
5. Rudwaleit M, van der Heijde D, Landewe R et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68: 777– 783.
6. Huerta‑ Sil G, Casasola‑ Vargas JC, Londono JD et al. Low grade radiographic sacroiliitis as prognostic factor in patients with undifferentiated spondyloarthritis fulfilling diagnostic criteria for ankylosing spondylitis throughout follow up. Ann Rheum Dis 2006; 65: 642– 646.
7. Jurik AG, Hansen J, Puhakka KB. Effective radiation dose from semicoronal CT of the sacroiliac joints in comparison with axial CT and conventional radiography. Eur Radiol 2002; 12: 2820– 2825.
8. Fazel R, Krumholz HM, Wang Y et al. Exposure to Low‑ Dose Ionizing Radiation from Medical Imaging Procedures. N Engl J Med 2009; 361: 849– 857.
9. Berrington de Gonzalez A, Mahesh M, Kim KP et al. Projected cancer risks from computed tomographic scans performed in the United States in 2007. Arch Intern Med 2009; 169: 2071– 2077.
10. Smith‑ Bindman R, Lipson J, Marcus R et al. Radiation Associated With Common Computed Tomography Examinations and the Associated Lifetime Attributable Risk of Cancer. Arch Intern Med 2009; 169: 2078– 2086.
11. Song IH, Carrasco‑ Fernández J, Rudwaleit M et al. The diagnostic value of scintigraphy in assessing sacroiliitis in ankylosing spondylitis: a systematic literature research. Ann Rheum Dis 2008; 67: 1535– 1540.
12. Baraliakos X, Hermann KG, Landewe R et al. Assessment of acute spinal inflammation in patients with ankylosing spondylitis by magnetic resonance imaging (MRI): a comparison between contrast enhanced T1 and short‑ tau inversion recovery (STIR) sequences. Ann Rheum Dis 2005; 64: 1141– 1144.
13. Madsen KB, Egund N, Jurik AG. Grading of inflammatory disease activity in the sacroiliac joints with magnetic resonance imaging: comparison between short‑ tau inversion recovery and gadolinium contrast‑ enhanced sequences. J Rheumatol 2010; 37: 393– 400.
14. Sieper J, Rudwaleit M, Baraliakos X et al. The Assessment of SpondyloArthritis international Society (ASAS) handbook: a guide to asses spondyloarthritis. Ann Rheum Dis 2009; 68: (Suppl. II): ii1– ii 44.
15. Maksymowych WP, Crowther SM, Dhillon SS et al. Systematic assessment of inflammation by magnetic resonance imaging in the posterior elements of the spine in ankylosing spondylitis. Arthritis Care Res 2010; 62: 4– 10.
16. Braun J, Listing J, Sieper J. Reply. Arthritis Rheum 2005; 52: 4049– 4050.
17. Reveille J. Clinical features of ankylosing spondylitis. In: Rheumatology. 4th edition, Mosby, Elservier 2007, 1109– 1114.
18. Brown MA, Kennedy LG, MacGregor AJ et al. Susceptibility to AS in twins. Arthritis Rheum 1997; 40: 1823– 1828.
19. Rudwaleit M, van der Heijde D, Khan MA et al. How to diagnose axial spondyloarthritis early. Ann Rheum Dis 2004; 63: 535– 543.
20. Sieper J, van der Heide D, Landewe R et al. New criteria for inflammatory back pain in patients with chronic back pain: a real patient exercise by experts from the Assessment of SpondyloArthritis Society (ASAS). Ann Rheum Dis 2009; 68: 784– 788.
21. van den Berg R, de Hooge M, Rudwaleit M et al. ASAS modification of the Berlin algorithm for diagnosing axial spondyloarthritis: results from the SPondyloArthritis Caught Early (SPACE)- cohort and from the Assessment of SpondyloArthritis international Society (ASAS)- cohort. Ann Rheum Dis doi:10.1136/ annrheumdis‑ 2012– 201884.
22. Rudwaleit M, van der Heijde D, Landewe R et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68: 777– 783.
23. D’Agostino MA, Palazzi C, Olivieri I. Entheseal involvement. Clinical and Experimental Rheumatology 2009; 27: (4, supplement 55): S50– S55.
24. Oliveri H et al. Editorial: Dactylitis or “Sausage‑ Shaped” Digit. J Rheumatol 2007; 34: 1217– 1220.
25. Nikolaus S, Schreiber S. Diagnostics of inflammatory bowel disease. Gastroenterology 2007; 133: 1670– 1689.
26. Cooper C, Carbone I, Michet CJ et al. Fracture risk in patients with AS: a population based study. J Rheumatol 1994; 10: 1887– 1882.
27. Vosse D, Landewé R, Heijde D et al. AS and the risk of fracture: results from a large primary care based nested case‑ control study. Ann Rheum Dis 2009; 68: 1839– 1842.
28. Franck H, Meurer T, Hofbauer LC et al. Evaluation of BMD, hormones, biochemical markers of bone metabolism, and OPG serum levels in patients with AS. Rheumatol 2004; 31: 2236– 2241.
29. Arends SA, Spoorenberg A, Bruyn GA et al. The relationship between BMD, vitamin D levels and bone markers in AS patients. Osteoporos Int 2011; 22: 1431– 1439.
30. Weijden MA, Denderen JC, Lems WF et al. Low BMD is related to male gender and decreased functional capacity in early AS. Clin Rheumatol 2011; 30: 497– 503.
31. van der Weijden MA, van der Horst‑ Bruinsma IE, van Denderen JC et al. High frequency of vertebral fractures in early spondylarthropathies. Osteoporos Int 2012; 23: 1683– 1690.
32. Allali F, Breban M, Porcher R et al. Increase in BMD of patients with AS treated with anti‑TNF. Ann Rheum Dis 2003; 62: 347– 349.
33. Bijlsma J EULAR compendium on rheumatic diseases. London: BMJ Publishing Group; 2009.
34. Peters MJ, Visman I, Nielen MM et al. Ankylosing spondylitis: a risk factor for myocardial infarction? Ann Rheum Dis 2010; 69: 579– 581.
35. McCarey D, Sturrock RD. Comparison of cardiovascular risk in ankylosing spondylitis and rheumatoid arthritis. Clin Exp Rheumatol 2009; 27: (Suppl.): S124– S126.
36. Farkouh ME, Kirshner H, Harrington RA et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), cardiovascular outcomes: randomised controlled trial. Lancet 2004; 364: 675– 684.
37. Han C, Robinson jr. DW, Hackett MV et al. Cardiovascular disease and risk factors in patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis. J Rheumatol 2006; 33: 2167– 2172.
38. Kang JH, Chen YH, Lin HC. Comorbidity profiles among patients with ankylosing spondylitis: a nationwide population‑based study. Ann Rheum Dis 2010; 69: 1165– 1168.
39. Poddubnyy D, Rudwaleit M, Haibel H et al. Effect of non‑steroidal anti‑inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: results from the German spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71: 1616– 1622.
40. Kroon F, Landewe R, Dougados M et al. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012; 71: 1623– 1629.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 5
Most read in this issue
- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Choroby způsobené lepkem
