-
Medical journals
- Career
Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
Authors: Z. Beneš 1; J. Abrahámová 2; M. Matějčková 3; Z. Antoš 1; G. Puškárová 1; P. Kohout 1; M. Rozmahel 1; A. Hep 4; Jiří Dolina 4; F. Koukolík 3
Authors‘ workplace: II. interní klinika Thomayerovy nemocnice Praha, přednosta doc. MUDr. Zdeněk Beneš, CSc. 1; Onkologická klinika 1. lékařské fakulty UK a Thomayerovy nemocnice Praha, přednostka prof. MUDr. Jitka Abrahámová, DrSc. 2; Oddělení patologie a molekulární medicíny Thomayerovy nemocnice Praha, přednosta prim. MUDr. František Koukolík, DrSc. 3; Gastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc. 4
Published in: Vnitř Lék 2012; 58(7 a 8): 186-189
Category: 60th Birthday prof. MUDr. Miroslav Souček, CSc.
Overview
Kolorektální karcinom (KRK) je velmi častým maligním nádorem v ČR. V posledních letech došlo v jeho detekci a léčbě k značným pokrokům. Byly vyvinuty nové léky, které působí proti EGRF doméně exprimované na povrchu nádorové buňky. Nejdůležitějším zástupcem této biologické léčby jsou cetuximab a panitumumab. Nicméně u této léčby je známá skutečnost, že je jejich účinnost velmi snížena při zjištění mutovaného KRAS v nádorové tkáni. Většinou se vyšetření na KRAS provádí v maligní tkáni v resekátu. Nicméně jsou situace, kdy biologická léčba může či by měla předcházet chirurgickému zákroku (nemocný odmítne operaci, chirurgický zákrok nelze provést pro komorbiditu, plánuje se léčba cetuximabem u jaterních metastáz KRK). U těchto nemocných je vhodné provést vyšetření na KRAS již v bioptickém vzorku získaném při kolonoskopii. Cílem práce bylo zjistit a prokázat, že vyšetření na KRAS či jeho mutace lze v biopsii provést. Vyšetřili jsme 74 nemocných, kteří se podrobili koloskopii s biopsií. U 26 nemocných, tj. u 35 %, byla prokázána v biopsii mutace KRAS. Proto lze říci, že lze vyšetřovat KRAS při endoskopické biopsii, což pomůže zrychlit a zkvalitnit biologickou léčbu u nemocných s metastatickým KRK.
Klíčová slova:
koloskopie – kolorektální nádory – KRAS geny – mutaceÚvod
Kolorektální karcinom (KRK) je jedním z nejčastějších maligních onemocnění v ČR. Je co do incidence druhým nejčastějším nádorem u mužů po bronchogenním karcinomu a u žen po karcinomu prsu. Z evropského a celosvětového pohledu se KRK v ČR vyznačuje nadprůměrným výskytem i úmrtností. V roce 2006 bylo nově hlášeno 7 801 nálezů KRK, poněkud více u mužů (4 573 případů) než u žen (3 228 případů). Odhaduje se, že v roce 2012 se vyskytne 8 709 nových případů. Snahy o zvládnutí tohoto nepříznivého jevu, který se stává celospolečenským problémem, se ubírají jak cestou zlepšení diagnostiky (celoplošný screening), tak cestou efektivnější léčby. Dalším nepříznivým faktem je to, že kolem 60 % nemocných se diagnostikuje v pokročilém stadiu. Zatímco ještě před deseti lety jsme měli v systémové léčbě k dispozici pouze fluorouracil, nyní je náš léčebný arzenál mnohem bohatší jak na poli chemoterapie (oxilaplatina, irinotekan, kapecetabin), tak zejména v oblasti biologické cílené léčby inhibitory receptoru EGFR1. Receptor epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) je klinicky prověřeným cílem u metastatického KRK (MKRK). Jde o transmembránovou tyrozinkinázu, která náleží do rodiny humánních receptorů růstového faktoru označovaných jako HER1 (EGFR1), HER 2, HER 3, HER 4. Skládají se z transmembránového lipofilního segmentu a intracelulární domény s tyrozinkinázovou aktivitou. Pro všechny receptory (kromě HER 2) byly rozpoznány ligandy, které zahajují přenos signálu. Na extracelulární doménu EGFR se váží různé ligandy jako EGF, TGF β (transformující růstový faktor β), amphireguli, β-celulin a epiregulin. Receptor EGFR je zvýšeně exprimován u KRK, a to ve 35–40 % (obr. 1) [1–4] .
Image 1. Endoskopický obraz kolorektálního karcinomu. 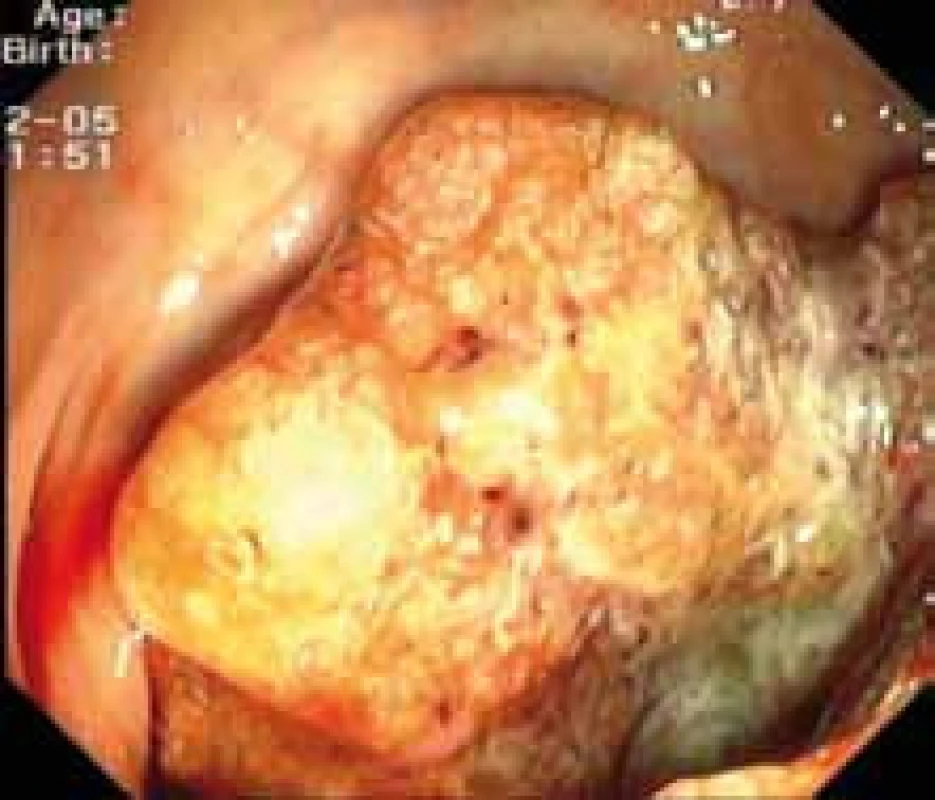
V současné době jsou v léčbě používány protilátky proti extracelulární doméně EGFR (cetuximab, panitumumab). S podivem však nebyla zjištěna přímá souvislost mezi expresí EGFR na povrchu nádorové buňky a procentem terapeuticko-klinických odpovědí. Z řady posledních studií vyplývá, že mutace v genu KRAS je prediktorem nedostatečné odpovědi na anti-EGRF protilátky – cetuximab a panitumumab [5].
KRAS gen kóduje protein, který je součástí signální dráhy regulující buněčný růst a proliferaci. Jeho mutace jsou dávány do souvislosti právě s nádorovou transformací buňky. Protinádorová účinnost anti-EGRF protilátek je dílem inhibice těchto RAS/RAF//MAPK a P13K signálních drah. Inhibice receptoru však zablokuje celou signální dráhu pouze v případě, že se některý člen této kaskády nevymkne kontrole v důsledku mutace nebo amplifikace svého genu. Důsledkem takové mutace je v případě onkogenu KRAS vznik proteinu, který je konstitutivně aktivní bez ohledu na signály (aktivační, či inaktivační), které přicházejí z membránových receptorů. Tyto poznatky vedou k zpřesnění indikací pro léčbu MKRK uvedenými léčebnými přípravky a na základě další klinické validace k vyhledávání dalších prediktorů léčby. Léčba monoklonálními protilátkami (anti-EGFRmAb, cetuximab, panitumumab) má své důležité místo v léčbě pokročilého MKRK exprimujícího nemutovaný „wild type KRAS“. V současné době je již potvrzeno, že dobrá odezva na léčbu inhibitory EGRF je i u pacientů, kteří exprimují normální množství EGFR. Nemutovaná varianta genu KRAS je ale nutným a důležitým předpokladem úspěšnosti léčby. Aktivační mutace v kodonech 12 a 13 jsou příčinou selhání inhibice signální kaskády EGFR u 94 % těchto pacientů [6]. Detekce mutací genu KRAS je tedy nezbytná před rozhodnutím o eventuální biologické cílené léčbě.
Vlastní diagnostika KRAS se nejčastěji provádí v nádorové tkáni z resekátu MKRK. Nicméně jsou situace, kdy je důležité znát mutační status genu KRAS co nejdříve, aby byl optimalizován léčebný postup u nemocného s MKRK. Cílem této práce je zjistit, zda je možno standardně vyšetřit mutaci KRAS z tkáně odebrané při bioptickém vyšetření koloskopovaných pacientů.
Metody
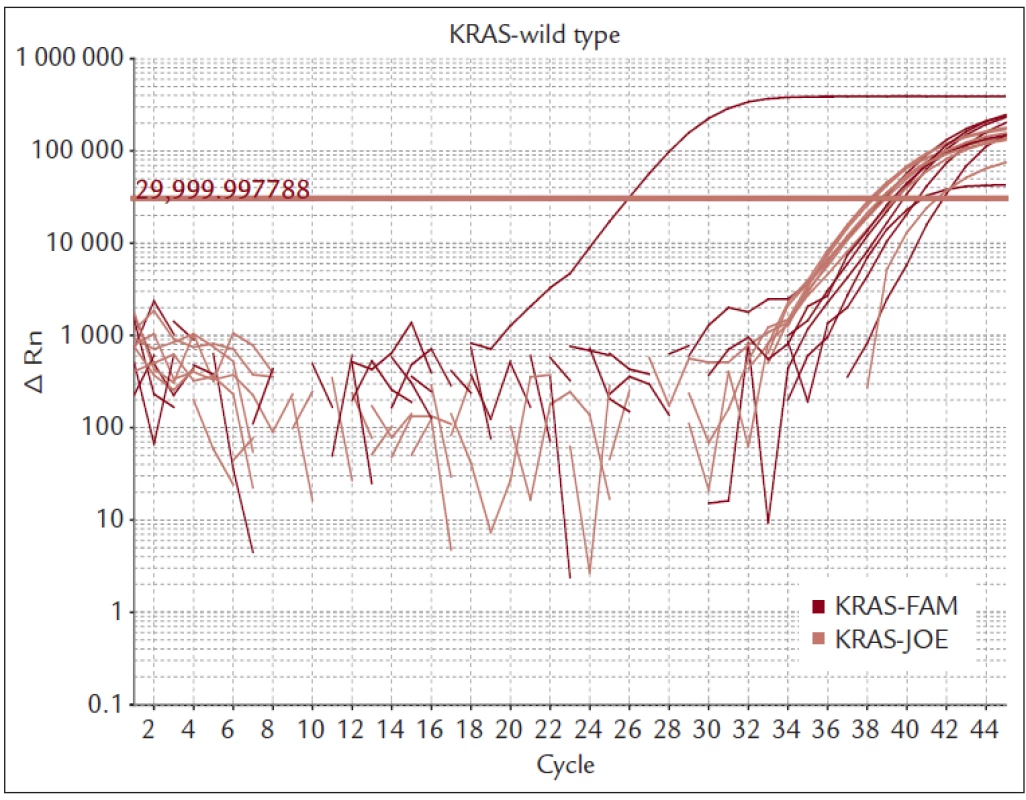
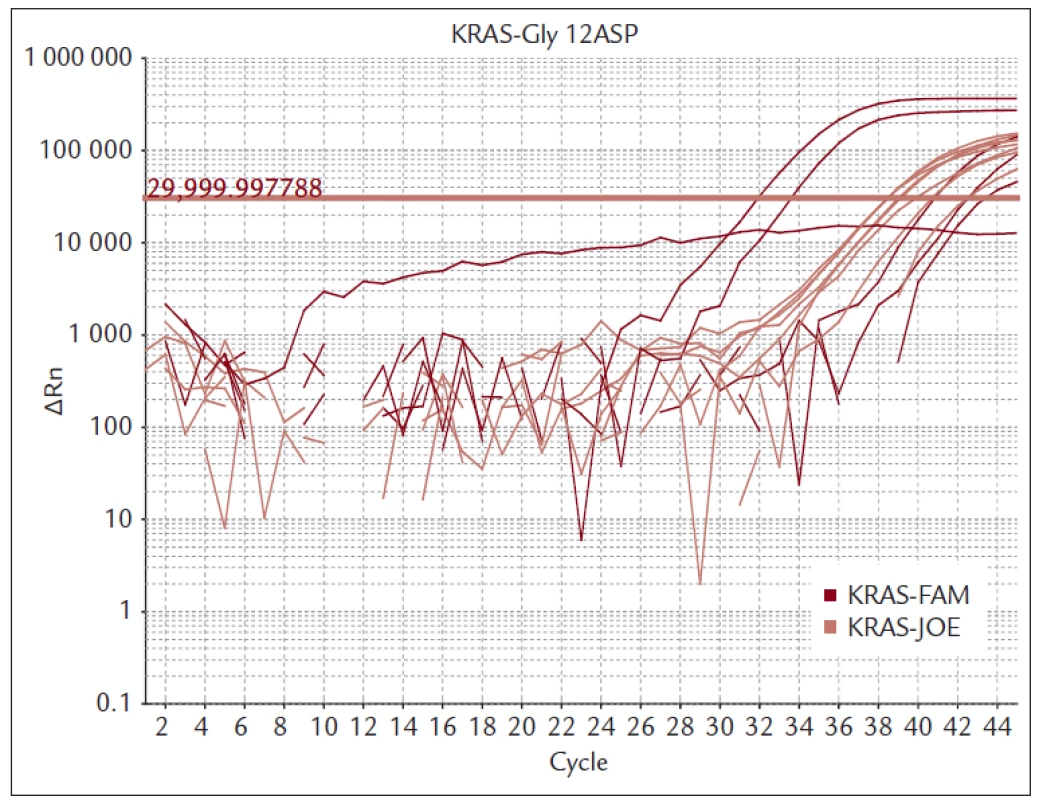
Nemocné s MKRK jsme vyšetřovali kolonoskopem CFQ-180 firmy Olympus (Tokyo, Japan). Provedli jsme vždy 8–10 biopsií přímo z nádorové tkáně. Bioptické vzorky byly ihned fixovány 10% formaldehydem a urychleně byly transportovány do morfologické laboratoře tak, aby nedošlo k poškození DNA dlouhou fixací. Tkáň byla zpracována do parafinového bločku a standardním postupem a histologicky vyšetřena. Pokud histolog potvrdil, že se jedná o karcinom, byl bioptický preparát vyšetřen s cílem určení mutačního stavu onkogenu KRAS. Materiál byl odebrán z oblasti označené histologem jako nádorová tkáň. Izolace DNA byla provedena kitem QiaAmp (Qiagen). Mutace genu KRAS jsme vyšetřili kitem TheraScreen (DXS Diagnostics Innovations, Manchester, UK), který je certifikován pro IVD. Kit využívá k detekci mutací PCR v reálném čase. Vysoké selektivity je dosaženo použitím kombinace technologie ARMS a sond typu Skorpion. Touto metodou je možné detekovat mutovanou DNA, která je zastoupena pouze v 1 % celkové DNA z nádorové tkáně. Souprava detekuje sedm mutací v kodonech 12 a 13 onkogenu KRAS (obr. 2 a 3).
Výsledky
V období od 1. prosince 2010 do 30. května 2011 jsme provedli kolonoskopii u 74 pacientů (u 45 mužů a 29 žen průměrného věku 65 let), u kterých byl zjištěn metastazovaný KRK. Biopticky byl adenokarcinom potvrzen ve všech případech.
Prováděli jsme vždy 8–10 biopsií z nádorové masy. U těchto nemocných jsme provedli vyšetření mutací genu KRAS. U 26 nemocných byla zjištěna mutace KRAS (u 17 mužů a 9 žen). Z toho byla v 23 případech detekována mutace KRAS v kodonu 12 a u 3 v kodonu 13 (tab. 1).
Table 1. Charakteristika mutací KRAS. 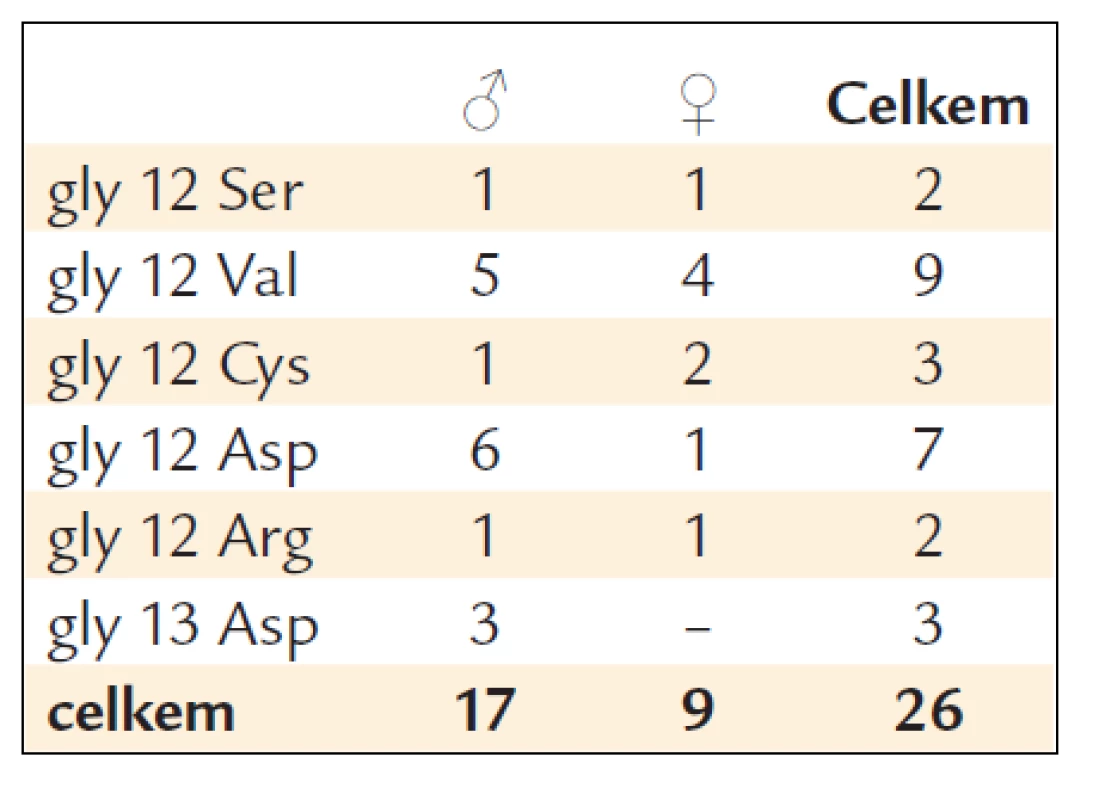
Diskuze
Přesná predikce odpovědi na cílenou léčbu je nezbytná pro indikaci léčby anti-EGFR protilátkami. Na jedné straně jde o látky velmi účinné, na druhé straně však jde o léčbu finančně náročnou, která s sebou nese i nezanedbatelné vedlejší účinky. Vyšetření KRAS u všech nemocných s pokročilým a MKRK před zamýšlenou léčbou anti-EGFR protilátkami je vyšetřením obligatorním [7]. Neodpovídavost na léčbu uvedenými léky u nemocných s MKRK s prokázanou přítomností mutovaného KRAS byla prokázána v řadě multicentrických mezinárodních studií [8,9].
Toto tvrzení podporuje např. práce Lierveho et al [12]. Ti léčili metastatický KRK cetuximabem a 11 z jejich 30 nemocných (37 %) v jejich studii pozitivně odpovědělo na léčbu s mediánem trvání 33,9 měsíce. KRAS mutace nebyla zjištěna u žádného pacienta, který dobře zareagoval na léčbu. Avšak u 13 z 19 (68 %) nereagujících pacientů na terapii byla mutace KRAS potvrzena. Také přežití u nemocných s divokým typem KRAS ve srovnání s KRAS mutací byla lepší u divokého KRAS (16,3 vs 6,9 měsíce). Mutace KRAS se vyskytuje v 30–40 % pří-padech MKRK [11,12]. Je spojena s vyšším stupněm tumoru, má horší prognózu a zhoršuje přežití. V naší práci jsme pozorovali přítomnost KRAS mutace u 26 nemocných ze 74, což představuje 35 %. I když se v současné době využívá k izolaci nádorové DNA resekátu po chirurgickém zákroku, pokusili jsme se detekovat mutaci KRAS v bioptickém materiálu získaném při koloskopickém vyšetření. Je to výhodné pro rychlost a zkvalitnění diagnostiky. Kromě toho ne všichni nemocní souhlasí s operací či jsou vzhledem k přidruženým nemocem schopni operace. V některých případech může dokonce léčba anti-EGRF předcházet chirurgickému zákroku. U našich 74 bioptovaných nemocných se nám podařilo zachytit mutovaný KRAS u 26 nemocných, z toho bylo 23 mutací v kodonu 12 a 3 u kodonu 13. Chceme však zdůraznit, že jsme kladli velký důraz na rychlost transportu bioptického materiálu do laboratoře, aby fixace bioptického vzorku byla co možná nejkratší tak, aby nedošlo k poškození DNA. Zásadní také je, aby výběr oblasti nádorové tkáně ve vzorku, ze kterého je izolována DNA k dalšímu vyšetření, provedl patolog.
Takto získaná DNA je cenným zdrojem informace o nádoru i z hlediska dalšího zkvalitňování výběru pacientů pro léčbu monoklonálními protilátkami.
Dnes je již prokázáno, že odpověď na anti-EGFR protilátky není závislá na případné zvýšené expresi EGFR. Z léčby mohou mít prospěch i pacienti s normální úrovní EGFR a nemutovaným typem KRAS. Vyšetření imunhistochemicky detekované overexprese EGFR nebo metodou FISH prokázaná amplifikace EGFR je proto pro odhad úspěšnosti léčby zcela nevyhovující predikční marker.
Na druhé straně pacienti, kteří nemají v kodonech 12 a 13 genu KRAS mutaci, mohou mít mutaci v jiném místě genu (např. KRAS kodon 61 a 146) nebo v dalších genech EGFR kaskády, např. v genu BRAF [6].
Výběr vhodných pacientů k léčbě anti-EGFRmoAb by mohl být v budoucnu při využití současných poznatků přesnější. DNA získaná z nádorové tkáně takové analýzy umožňuje.
V současné době se používají k léčbě MKRK cetuximab a panitumumab. Uvedené léky jsou schváleny pro léčbu pokročilého a MKRK v první řadě (cetuximab) a u refrakterního předléčeného pokročilého KRK při nesnášenlivosti cetuximabu s irinotekanem – panitumumab [13–16]. K tomu je známo, že léčba cetuximabem vede k zmenšení velikosti a počtu metastáz v játrech. Až po jejich regresi by měl pak následovat chirurgický zákrok, který je pro tuto skutečnost efektivnější [17]. Zjišťováním mutace KRAS v bioptickém materiálu nám tedy již od samého počátku diagnostiky pomůže rozdělit nemocné na ty, jejichž nádor exprimuje mutovaný KRAS, a na ty, u kterých je prokázán „wild typ KRAS“. To znamená, že můžeme velmi dobře odhadnout benefit léčby pro nemocné a zároveň plánovat i finanční výdaje.
Závěr
V současné praxi se vyšetření mutací KRAS provádí prakticky jenom v resekátu po chirurgickém zákroku. Nicméně klinické uvažování nás často vede k tomu, abychom mutační status onkogenu KRAS vzali v úvahu již v období bezprostředně po stanovení diagnózy MKRK. Jedná se zejména o nemocné, kteří se z různých důvodů nemohou podrobit chirurgickému zákroku či mají metastázy v játrech a plánuje se u nich léčba cetuximabem.
U nich by měla biologická léčba předcházet léčbě chirurgické. V těchto případech je vhodné provést vyšetření na mutaci KRAS v bioptickém materiálu již při endoskopickém vyšetření. V naší práci jsme se přesvědčili, že takto lze úspěšně z biopsie při koloskopii provést detekci mutací KRAS. Tato skutečnost může přispět k urychlení a efektivně vedené biologické léčbě ještě před radikálním zákrokem.
doc. MUDr. Zdeněk Beneš, CSc.
www.ftn.cz
e-mail: zdenek.benes@ftn.cz
Doručeno do redakce: 28. 5. 2012
Sources
1. Artale S, Sartore-Bianchi A, Veronese SM et al. Mutations of KRAS and BRAF in primary and matched metastatic sites of colorectal cancer. J Clin Oncol 2008; 26 : 4217–4219.
2. Di Fiore F, Blanchard F, Charbonnier F et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy. Br J Cancer 2007; 96 : 1166–1169.
3. Khambata-Ford S, Garrett CR, Meropol NJ et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J Clin Oncol 2007; 25 : 3230–3237.
4. Zauber P, Sabbath-Solitare M, Marotta SP et al. Molecular changes in the Ki-ras and APC genes in primary colorectal carcinoma and synchronous metastases compared with the findings in accompanying adenomas. Mol Pathol 2003; 56 : 137–140.
5. Oliveira C, Velho S, Moutinho C et al. KRAS and BRAF oncogenic mutations in MSS colorectal carcinoma progression. Oncogene 2007; 26 : 158–163.
6. van Krieken JH, Jung A, Kirchner T et al. KRAS mutation testing for predicting response to anti-EGFR therapy for colorectal carcinoma: proposal for an European quality assurance program. Virchows Arch 2008; 453 : 417–431.
7. Tórtola S, Steinert R, Hantschick M et al. Discordance between K-ras mutations in bone marrow micrometastases and the primary tumor in colorectal cancer. J Clin Oncol 2001; 19 : 2837–2843.
8. Al-Mulla F, Going JJ, Sowden ET et al. Heterogeneity of mutant versus wild-type Ki-ras in primary and metastatic colorectal carcinomas, and association of codon-12 valine with early mortality. J Pathol 1998; 185 : 130–138.
9. Baisse B, Bouzourene H, Saraga EP et al. Intratumor genetic heterogeneity in advanced human colorectal adenocarcinoma. Int J Cancer 2001; 93 : 346–352.
10. Daum O, Šíma R, Němcová J et al. Current possibilities to predict response to targeted therapy of colorectal cancer. Čes Slov Gastroent Hepatol 2009; 63 : 25–28.
11. Garcia J, Riely GJ, Nafa K et al. KRAS mutational testing in the selection of patients for EGFR-targeted therapies. Semin Diagn Pathol 2008; 25 : 288–294.
12. Lièvre A, Bachet JB, Le Corre D et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66 : 3992–3995.
13. Bokemeyer C, Bondarenko I, Makhson A et al. Cetuximab plus 5-FU/FA/oxaliplatin (FOLFOX-4) versus FOLFOX-4 in the first-line treatment of metastatic colorectal cancer (mCRC): OPUS, a randomized phase II study. J Clin Oncol 2007; ASCO Annual Meeting Proceedings Part I., 25: No. 18S (June 20 Supplement) 2007 : 4035.
14. Bokemeyer C, Bondarenko I, Hartmann JT et al. KRAS status and efficacy of first-line treatment of patients with metastatic colorectal cancer (mCRC) with FOLFOX with or without cetuximab: the OPUS experience [abstract]. J Clin Oncol 2008; 26 (Suppl 15S): 4000.
15. Freeman DJ. Safety and Efficacy of Panitumumab in the Treatment of Metastatic Colorectal Cancer. Clin Med Ther 2009; 1 : 633–645.
16. Bernstein WO, Lang H, Kohne C et al. Resectability and agreement between surgeons: Review of CT and MR scan of the CELIM study: Multicenter randomized trial of cetuximab/FOLFOX versus cetuximab/FOLFIRI in unresectable liver metastases. J Clin Oncol 27 : 15 s, 2009 ASCO Annual Meeting (suppl; abstr. 4091).
17. Loupakis F, Ruzzo A, Cremolini C et al. KRAS codon 61, 146 and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12 and 13 wild-type metastatic colorectal cancer. Br J Cancer 2009; 101 : 715–721.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 7 a 8-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career