-
Medical journals
- Career
Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
Authors: R. Hájek 1–3; M. Almaši 1,3; L. Říhová 1,3; J. Smejkalová 1,3; L. Pour 2; L. Zahradová 1,2; Z. Adam 2
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 1; Interní hematoonkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 2; Babákova myelomová skupina při Ústavu patologické fyziologie LF MU Brno, přednostka prof. MUDr. Anna Vašků, CSc. 3
Published in: Vnitř Lék 2012; 58(7 a 8): 135-140
Category: 60th Birthday prof. MUDr. Miroslav Penka, CSc.
Overview
Vývoj ve výzkumu, diagnostice a léčbě mnohočetného myelomu za posledních 10 let je mimořádný. Jedním ze základních předpokladů výzkumné činnosti je vstupní zpracování a třídění biologického materiálu a vytvoření biobanky s archivací kritického množství vzorků pro výzkum. Práce popisuje vývoj a činnosti výzkumné laboratoře experimentální hematologie zajišťující nezbytné nároky kladené pokrokem ve výzkumu mnohočetného myelomu a dalších monoklonální gamapatií na vstupní zpracování a třídění materiálu a jeho archivaci pro potřeby výzkumu i diagnostiky.
Klíčová slova:
mnohočetný myelom – monoklonální gamapatie – biobanka – flowcytometrieÚvod
Mnohočetný myelom (MM) je krevní nádorové onemocnění, u kterého se v posledních letech výrazně zlepšuje dlouhodobé přežití. Zlepšení léčebných výsledků souvisí se zavedením autologní transplantace krvetvorných buněk do léčebné strategie u mladších nemocných v 90. letech minulého století, ale také se zavedením nových účinných léků, bortezomibu, thalidomidu a lenalidomidu, do běžné klinické praxe v poslední dekádě [1]. Řada nových léků je testována v klinických studiích fáze I–III. Stávající léčebné strategie mohou vést až k vyléčení. Toto tvrzení objevující se vůbec poprvé v roce 2009 [2] se považuje za zásadní zvrat v názoru na toto krevní nádorové onemocnění. Doposud byl MM považován za nevyléčitelné onemocnění a hovořili jsme maximálně o možnosti navodit chronické onemocnění. Vyléčitelnost je podmíněna dosažením hluboké a trvalé kompletní remise onemocnění. To je v reálné praxi nejpravděpodobnější a možné asi u 10 % nemocných ze skupiny vhodných nemocných k provedení autologní transplantace s prognosticky příznivým MM, kteří jsou léčeni intenzivní kombinovanou léčbou z dostupných nejúčinnějších postupů sestavených do komplexního bloku vstupní indukční léčby následované udržovací léčbou [3,4]. Kompletní remisi trvající déle než 3 roky lze označit za první milník k vyléčitelnosti [3]. Je potřeba zdůraznit, že ve stávajícím světle poznatků a dlouhodobých zkušeností s intenzivními režimy se otevřeně mluví o možnosti vyléčení nemocných s MM poprvé až na konci roku 2011 [5].
Kontinuální zlepšování našich léčebných výsledků přináší neustálé nároky na dostupnost moderních diagnostických a výzkumných metod. Zcela zásadně stoupla role flowcytometrického hodnocení patřící nyní mezi základní metody pro diagnostiku, vyhodnocení hloubky léčebné odpovědi a sledování zbytkového nádorového onemocnění [6]. Upřesňuje se význam pozitronové emisní tomografie v kombinaci s výpočetní tomografií (PET/CT). Zdokonaluje se možnost využití nejmodernějších celogenomových metod pro stanovení prognózy a individualizaci léčby [7]. Pro splnění výzkumných úkolů a rychlé aplikace do klinické praxe je potřeba vstupně zpracovat tisíce vzorků biologického materiálu, které musí být průběžně archivovány v biobance a dostupné pro různé typy analýz dle potřeby výzkumných týmů. Je optimální, pokud existuje klinický datový registr nemocných s MM a možnost propojení vědeckých a klinických dat.
Moderní laboratorní zázemí je dnes zcela nezbytnou součástí vyspělých pracovišť. Vytvoření takových podmínek na pracovišti zpravidla trvá nejméně 10 let. V souhrnném článku uvádíme 14leté zkušenosti s budováním takového laboratorního zázemí pro potřeby výzkumu MM na Oddělení klinické hematologie FN Brno vedeného prof. Penkou.
Historie Laboratoře experimentální hematologie a buněčné terapie – vědecké zázemí pro výzkum v oblasti mnohočetného myelomu
V roce 1998 byly na Oddělení klinické hematologie FN Brno vytvořeny prostorové i personální podmínky pro vznik Laboratoře experimentální hematologie a buněčné imunoterapie (LEHABI). Chod výzkumné laboratoře byl od zahájení provozu z větší části financován ze získaných grantů, projektů a výzkumných záměrů. Od roku 1999 se laboratoř zabývá vstupním zpracováním a archivací biologického materiálu pro výzkumné projekty v oblasti hematologie, zvláště pak oblasti monoklonálních gamapatií. Postupně byla založena Myelomová banka vzorků – biobanka, která dnes představuje jednu z největších v Evropě.
V roce 2006 došlo k rozšíření myelomového výzkumného programu do nově otevřených prostor Univerzitního kampusu Brno, kde probíhá další vědecká analýza pomocí moderních molekulárně biologických metod. Jsou používány metody I-FISH (Interphase Fluorescence in situ Hybridization), aCGH (array Comparative Genomic Hybridization), real--time PCR, GEP (Gene Expression Profiling). Činnost laboratoře je úzce spjata s výzkumnou činností Babákovy myelomové skupiny při Ústavu patologické fyziologie LF MU a s Laboratoří molekulární cytogenetiky Přírodovědecké fakulty MU. Propojením uvedených týmů došlo ke vzniku plně integrovaného moderního vědecko-výzkumného pracoviště, které vytvořilo optimální podmínky v definovaných oblastech preklinického a klinicky aplikovaného výzkumu s rychlým využitím dosažených poznatků v klinické praxi.
Grantová činnost je nejzásadnějším zdrojem financování výzkumných aktivit LEHABI. Plnění projektů je vždy v součinnosti s LF MU a Přírodovědeckou fakultou MU, resp. s Babákovou myelomovou skupinou při Ústavu patologické fyziologie LF MU a s Laboratoří molekulární cytogenetiky Přírodovědecké fakulty MU. Za klíčový lze považovat rok 2006, kdy byla výzkumnému týmu mimo jiné přidělena dotace z MŠMT – výzkumné centrum. Vývoj získaných projektů a finanční podpory je přehledně znázorněn v grafu 1. Přehled řešených grantů od roku 1997 je v tab. 1.
Graph 1. Vývoj získaných projektů a finanční podpory. 
Table 1. Přehled řešených projektů (grantů) od roku 1997 v rámci výzkumné součinnosti LEHABI a Babákovy myelomové skupiny při Ústavu patologické fyziologie LF MU. 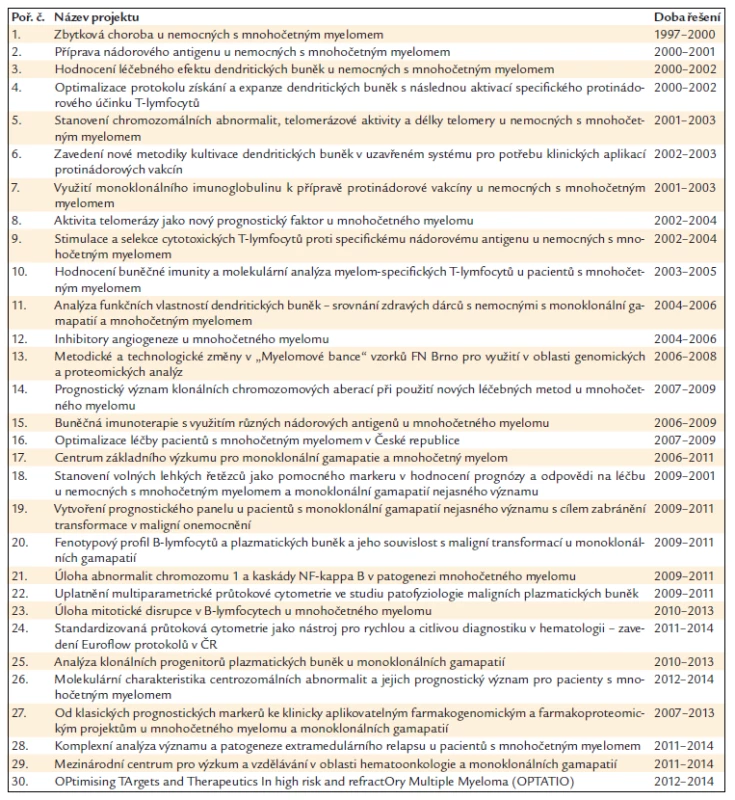
Biobanka mnohočetného myelomu a monoklonálních gamapatií
Už více než deset let probíhá v rámci LEHABI archivace biologického materiálu v biobance. Tato archivace je považována za vstupní kritickou část výzkumné činnosti hrající klíčovou roli při testování výzkumných hypotéz. Obecným problémem při řešení řady výzkumných otázek je dostupnost kritického množství vzorků pro výzkumné projekty umožňující robustní statistickou analýzu. Biobanky jsou dobře organizované zdroje zahrnující biologické vzorky a související informace dostupné pro vědecký výzkum [8]. Každý vzorek od osoby s raritním onemocněním má vysokou hodnotu, protože může být klíčem k zodpovězení významné výzkumné otázky [9]. Laboratorní analýzy monoklonálních gamapatií nejasného významu (MGUS) a MM jsou založeny na separaci plazmatických buněk (PB) z kostní dřeně nemocných. Patologické populace plazmatických buněk jsou heterogenní a mohou obsahovat různě zralé formy B-lymfocytů [10]. Základem dobře fungující biobanky je kvalitní vstupní zpracování klinických vzorků (periferní krev a kostní dřeň) pacientů s monoklonální gamapatií a dalších raritních hematologických nádorových onemocnění jako Castlemanova choroba, Erdheim-Chesterův syndrom, histiocytózy, hemangiomatózy, Waldenströmova makroglobulinemie, IgA pemfigus a amyloidózy.
Zpracování vzorků
Specifickým problémem u monoklonálních gamapatií je zpravidla nedostatek nádorové frakce buněk, což je dáno umístněním nádorových buněk v kostní dřeni v kombinaci s nízkou infiltrací. Existuje několik možností separací, náš výzkumný tým se trvale snaží tuto problematiku řešit [11–16]. Rovněž již byl zveřejněn souhrnný přehled zásad separačních metod a popsán náš optimalizovaný algoritmus postupů následujících po vstupním zpracování vzorků [17]. Kostní dřeň (10–40 ml) je odebrána do heparinu a ihned smíchána s transportním médiem v poměru 1 : 1 obsahujícím IMDM médium (Iscove’s Modified Dulbeccoś Medium, Sigma-Aldrich), které obsahuje 100 U/ml heparinu a 100 U/ml DNázy (Roche Diagnostics). Před vlastní separací plazmatických buněk se provádí izolace mononukleárních buněk denzitní gradientovou centrifugací na Ficoll-Plaque Plus (StemCele Technologies). Procento CD138+ plazmatických buněk (CD 138-PE, Exbio) je hodnoceno na přístroji FACSCanto II (BD Biosciences); dále je provedena separace plazmatických buněk podle standardních protokolů metodou magneticky aktivované separace buněk (MACS) pomocí přístroje AutoMACS Pro (Miltenyi Biotec) a/nebo fluorescenčně aktivované separace buněk (FACS) na přístroji FACSAria (BD Biosciences). Vzorky s ≥ 5 % plazmatických buněk jsou separovány metodou MACS, vzorky s < 5 % plazmatických buněk jsou tříděny metodou FACS. Pro separace se používá magneticky značená protilátka CD138 MACS MicroBeads (Miltenyi Biotec) namířená proti povrchovému antigenu CD138 známému jako syndecan-1 nebo fluorescenčně značené protilátky CD138-PE, CD19-PC7, CD56-FITC, CD38-APC a CD45-PerCP (Exbio, Beckman Coulter).
Na LEHABI probíhá vstupní zpracování klinických vzorků, jejich distribuce mezi jednotlivé vědecké týmy a archivace v biobance. Jedná se především o vzorky z FN Brno, v rámci výzkumných projektů jsou do laboratoře transportovány vzorky z dalších center v ČR. Do projektu myelomové biobanky jsou zapojena i zahraniční centra (Bratislava, Vratislav, Krakov, Lublin). Podíl spolupracujících center je znázorněn v grafu 2.
Graph 2. Podíl spolupracujících center na archivaci vzorků od pacientů s MM. 
Archivace vzorků
Biologické vzorky od nemocných jsou značeny specifickým kódem a ty, které nejsou ihned zpracovány k vědeckým účelům, jsou archivovány kryogenním skladováním v biobance. Vzorky CD138+ (tzv. pozitivní frakce) jsou zamraženy jako suchý pelet a uloženy v Dewarových nádobách v atmosféře tekutého dusíku (–190 °C). Vzorky plazmy a séra jsou uloženy při teplotě –80 °C. Vzorky vstupní buněčné frakce – mononukleární buňky kostní dřeně (MNKD) s nízkou buněčností a infiltrací PB a CD138– negativní frakce jsou archivovány s použitím kryoprotektivního média albuminu s 10% DMSO (dimetylsulfoxid). Úspěch molekulárně biologických metod je založen především na kvalitě nukleových kyselin purifikovaných z klinického materiálu. Využití dlouhodobě zamrazených vzorků pro tyto metody automaticky předpokládá dobrou molekulární stabilitu DNA. Při teplotě –80 °C se archivuje genomová DNA z plné periferní krve, izolovaná na MagNA Pure DNA izolátoru (Roche). Koncentrace a kvalita DNA je měřena spektrofotometricky na Nanodropu ND-1000 (NanoDrop Technologies Inc, Wilmington, NC, USA). Tento materiál je vhodný zejména pro porozumění dědičných změn v oblasti nukleových kyselin, např. analýzy jednonukleotidových polymorfizmů – SNPs [18,19].
V současné době je v biobance celkem archivováno 3 290 alikvotů vzorků plazmy kostní dřeně; 1 165 alikvotů separovaných buněk pozitivní frakce CD138+, z toho 20 % transportních vzorků (227/1 165); 3 371 alikvotů negativní frakce CD138–, z toho 8 % transportních vzorků (282/3 371) a 15 947 alikvotů, z toho 15 % transportních vzorků (2 400/15 947) plazmy/séra periferní krve nemocných s MM a MGUS (graf. 3).
Graph 3. Současný stav archivovaného biologického materiálu v biobance. 
Myelomová biobanka patří dnes mezi velké biobanky v Evropě. Její udržování stojí do 1 milionu Kč ročně. Díky dosažení kritického množství výzkumných vzorků je myelomová biobanka začleněna do řady mezinárodních projektů v rámci spolupráce s celoevropskou European Myeloma Network (EMN) a světovou International Myeloma Working Group (IMWG). V minulosti se tým LEHABI účastnil spolupráce s International Myeloma Foundation (IMF) na projektu Bank on a Cure (BOAC), což je první myelom-specifická banka DNA vzorků. Vznik velkých konzorcií s kvalitně vedeným biobankovnictvím je příležitostí ke sledování vztahů mezi genotypem a fenotypem pacienta na větším souboru jedinců. V současné době rozvíjíme, vedle řady bilaterálních výzkumných projektů, mezinárodní spolupráci v projektu MAGIC (MyelomA Genetics International Consortium) [20] a OPTATIO (OPtimizing TArgets and Therapeutic In high-risk and refractOry Multiple Myeloma) spolu s Rakouskem, Německem, Maďarskem a Itálií.
Flowcytometrie a její využití u mnohočetného myelomu
Základy vzniku Laboratoře průtokové cytometrie na Oddělení klinické hematologie byly položeny již v roce 2003, kdy byl Českou myelomovou skupinou zakoupen průtokový cytometr FC500 Cytomics (Beckman Coulter) a umístěn na laboratoř LEHABI. Jeho pořízení bylo podmíněno potřebou rutinních i výzkumných analýz u pacientů s MM. Vlastní flowcytometrická laboratoř, v rámci úseku LEHABI, vznikla až v roce 2004. Nyní, v roce 2012, jsou pro analýzy k dispozici dva průtokové cytometry. Vedle FC500 Cytomics s možností detekce pěti fluorescencí a 3laserový přístroj BD FACSCanto II s možností detekce osmi fluorescencí, díky čemuž je možno provádět tzv. polychromatickou flowcytometrii. Laboratoř disponuje také analyzačními softwary, a to SW Infinicyt (Cytognos) a SW Kaluza (Beckman Coulter), díky nimž mohou být získaná data analyzována rychleji a efektivněji.
Prováděné flowcytometrické analýzy
Podstatou analýz prováděných v laboratoři byla od počátku charakterizace leukocytů a dalších buněčných populací na základě jejich povrchové či intracelulární antigenní výbavy. Tzv. imunofenotypizaci lze provádět v rámci různých druhů biologického materiálu (periferní krev, kostní dřeň, mozkomíšní mok, výpotek, bronchoalveolární laváž, homogenizovaná solidní tkáň aj.). Simultánní detekce 4 a více znaků prostřednictvím monoklonálních protilátek značených fluorochromy vede k odlišení jednotlivých buněčných populací, přičemž může být současně odhalena též patologická populace, ať už benigního či maligního charakteru [21,22].
Laboratoř od svých počátků řešila zejména vzorky pacientů s MM. V rámci probíhajících grantů a výzkumných záměrů, které byly cíleny zejména na imunoterapii, byly analyzovány jednak dendritické buňky, ale také byli monitorováni pacienti, kterým byla aplikována vakcína na bázi dendritických buněk [23–26]. V rámci výzkumu byl úspěšně zaveden neradioaktivní test cytotoxicity či byly indukovány a analyzovány nádorově specifické T-lymfocyty [27,28]. Současně probíhaly rutinní analýzy periferních krví a kostních dření s cílem fenotypizace plazmatických buněk [29]. V současnosti je stále hlavní náplní laboratoře zejména analýza monoklonálních gamapatií na rutinní i výzkumné úrovni. Imunofenotypizace se uplatňuje jak v diferenciální diagnostice monoklonálních gamapatií, což obnáší i rozlišení mezi MGUS a MM, tak v monitorování stavu onemocnění či léčebné odpovědi (včetně stanovení tzv. minimální reziduální nemoci – MRN) [30,31]. Flowcytometrická laboratoř slouží rovněž jako centrální laboratoř v oblasti Visegrádu pro stanovení MRN u MM v rámci projektů a klinických studií European Myeloma Network (EMN). Dlouhodobá zkušenost s analýzou monoklonálních gamapatií posunula laboratoř na čelní místo v ČR, co se týče počtu vyšetřených osob či využívaných analytických postupů [10]. Pořízení výkonnějšího průtokového cytometru BD FACSCanto II s možností polychromatických analýz laboratoř posunulo na světovou úroveň [6]. Laboratoř spolupracuje s EMN, kde je mj. řešena standardizace a optimalizace flowcytometrických analýz u osob s monoklonální gamapatií [32]. Výsledkem spolupráce je zavedení standardních postupů Euroflow skupiny, které zaručují jednotné výstupy z analyzátorů, a tedy možnost sdílení dat pro účely studií apod. Laboratoř se, pod hlavičkou České myelomové skupiny, snaží o zavedení standardních procedur v analýze monoklonálních gamapatií také v ČR. Platforma Euroflow je přitom využitelná pro analýzu jakékoli hematoonkologické malignity a v laboratoři je dále používána ve screeningu lymfocytů k odhalení možné klonální populace (obr. 1). Znalost fenotypu B lymfoproliferací je výhodou, neboť v laboratoři již byl několikrát zachycen souběh MM s B-CLL. Je vhodné zmínit, že laboratoř provádí řadu dalších analýz pro potřebu hematologie a imunologie. Laboratoř má zaveden systém vnitřní kontroly pro základní analyzované parametry, účastní se také Systému externích kontrol kvality (SEKK) a v současné době se připravuje na akreditaci dle ČSN EN ISO 15189.
Image 1. Analýza lymfocytů pomocí Euroflow přístupu. Znázorněná tzv. Lymphoid Screen Tube (LST) obsahuje 11 MoAb umožňujících jednoduše prověřit zastoupení subpopulací lymfocytů, včetně ověření klonality B-lymfocytů. Na obrázku vzorek B-CLL s patologickými CD5<sup>+</sup>CD19<sup>+</sup>sκ<sup>–</sup>sλ<sup>–</sup> B-lymfocyty a normálním zastoupením T, NK i NK-T-lymfocytů. 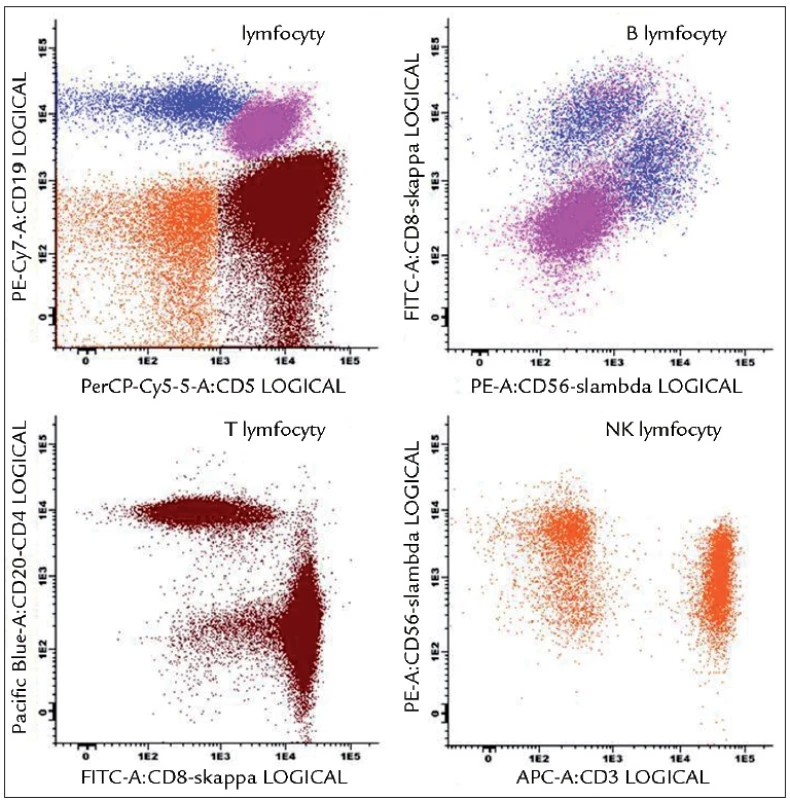
Závěr
Klinický pokrok u MM musí být podporován výzkumným pokrokem a kvalitním laboratorním zázemím. Vstupní zpracování materiálu a jeho archivace v biobance je dnes samozřejmostí ve všech vyspělých centrech, stejně jako významný podíl práce na klinicky aplikovaném výzkumu a klinických studiích. Díky pochopení vedení Oddělení klinické hematologie, zvláště pak prof. Penky, vznikly ve FN Brno na LEHABI unikátní podmínky v případě diagnózy MM a dalších monoklonálních gamapatií. I díky tomu patří dnes vědecko-výzkumný program mnohočetného myelomu v Brně k těm významným v rámci Evropské unie.
prof. MUDr. Roman Hájek, CSc.
www.fnbrno.cz
e-mail: r.hajek@fnbrno.cz
Doručeno do redakce: 28. 5. 2012
Sources
1. Kumar SK, Rajkumar SV, Dispenzieri A et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111 : 2516–2520.
2. Barlogie B, Shaughnessy JD Jr, Anaissie E et al. Modeling for cure with total therapy (TT) trials for newly diagnosed multiple myeloma (MM): let the math speak. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 744.
3. Hoering A, Crowley J, Shaughnessy JD Jr et al. Complete remission in multiple myeloma examined as time-dependent variable in terms of both onset and duration in total therapy protocols. Blood 2009; 114 : 1299–1305.
4. Van Rhee F, Szymonifka J, Anaissie E et al. Total Therapy 3 for multiple myeloma: prognostic implications of cumulative dosing and premature discontinuation of VTD maintenance components, bortezomib, thalidomide, and dexamethasone, relevant to all phases of therapy. Blood 2010; 116 : 1220–1227.
5. San-Miguel JF, Mateos MV. Can multiple myeloma become a curable disease? Haematologica 2011; 96 : 1246–1248.
6. Kovářová L, Varmužová T, Zarbochová P et al. Průtoková cytometrie u monoklonálních gamapatií. Klin Onkol 2011; 24 (Suppl): 24–29.
7. Ševčíková S, Němec P, Pour L et al. Genomika ve výzkumu mnohočetného myelomu. Klin Onkol 2011; 24 (Suppl): 34–38.
8. Yuille M, van Ommen GJ, Bréchot C et al. Biobanking for Europe. Brief Bioinform 2008; 9 : 14–24.
9. Lochmüller H, Schneiderat P. Biobanking in rare disorders. Adv Exp Med Biol 2010; 686 : 105–113.
10. Kovarova L, Buresova I, Buchler T et al. Phenotype of plasma cells in multiple myeloma and monoclonal gammopathy of undetermined significance. Neoplasma 2009; 56 : 526–532.
11. Fišerová A, Hájek R, Doubek M et al. Imunomagnetická separace myelomových buněk. Klin Onkol 2001; 14 : 46–50.
12. Čumová J, Burešová I, Kovářová L et al. Selekce plazmatických buněk. Klin Onkol 2008; 21 (Suppl 1): 190–194.
13. Cumova J, Kovarova L, Potacova A et al. Optimization of immunomagnetic selection of myeloma cells from bone marrow using magnetic activated cell sorting. Int J Hematol 2010; 92 : 314–319.
14. Burešová I, Čumová J, Kovářová L et al. Srovnání selekce plazmatických buněk metodami MACS a FACS. Klin Onkol 2008; 21 (Suppl 1): 195–197.
15. Buresova I, Cumova J, Kovarova L et al. Bone marrow plasma cell separation – validation of separation algorithm. Clin Chem Lab Med 2012; 50: DOI 10.1515/cclm-2011-0837.
16. Burešová I, Kyjovská D, Kovářová L. Algoritmus separace plazmatických buněk ze vzorků kostní dřeně. Klin Onkol 2011; 24 : 35–40.
17. Almasi M, Sevcikova S, Svachova H et al. Polymorphisms contribution to the determination of significant risk of specific toxicities in multiple myeloma. Klin Onkol 2011; 24 (Suppl): S39–S42.
18. Almasi M, Sevcikova S, Slaby O et al. Association study of selected genetic polymorphisms and occurrence of venous thromboembolism in patients with multiple myeloma who were treated with thalidomide. Clin Lymphoma Myeloma Leuk 2011; 11 : 414–420.
19. Potacova A, Stossova J, Buresova I et al. Sample processing and methodological pitfalls in multiple myeloma research. Klin Oncol 2011; 24 (Suppl): 18–24.
20. Morgan G, Johnsen HE, Goldschmidt H et al. MyelomA Genetics International Consortium. Leuk Lymphoma 2012; 53 : 796–800.
21. Brown M, Wittwer C. Flow cytometry: principles and clinical applications in hematology. Clin Chem 2000; 46 : 1221–1229.
22. Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111 : 3941–3967.
23. Buchler T, Kovarova L, Musilova R et al. Generation of dendritic cells using cell culture bag – description of a method and review of literature. Hematology 2004; 9 : 199–205.
24. Kovarova L, Buchler T, Pour L et al. Dendritic cell counts and their subsets during treatment of multiple myeloma. Neoplasma 2007; 54 : 297–303.
25. Ocadlikova D, Zahradova L, Kovarova L et al. The preparation of anticancer vaccine for patients with multiple myeloma on the base of monoclonal immunoglobulin loaded dendritic cells. Klin Onkol 2009; 22 : 67–72.
26. Zahradova L, Mollova K, Ocadlikova D et al. Efficacy and safety of Id-protein-loaded dendritic cell vaccine in patients with multiple myeloma – Phase II study results. Neoplasma 2012; 59 : 440–449.
27. Ocadlikova D, Kryukov F, Mollova K et al. Generation of myeloma-specific T cells using dendritic cells loaded with MUC1 - and hTERT-drived nonapeptides or myeloma cell apoptotic bodies. Neoplasma 2010; 57 : 455–464.
28. Zahradová L, Očadlíková D, Kovářová L et al. Hodnocení protinádorového efektu antigen-specifických T-lymfocytů s využitím neradioaktivního testu cytotoxicity. Transfuze Hematol Dnes 2006; 12 : 244–248.
29. Kovářová L, Hájek R. Flowcytometrická analýza plazmatických buněk u mnohočetného myelomu. Klin Onkol 2008; 21 (Suppl): 249–252.
30. Paiva B, Almeida J, Pérez-Andrés M et al. Utility of flow cytometry immunophenotyping in multiple myeloma and other clonal plasma cell-related disorders. Cytometry B Clin Cytom 2010; 78 : 239–252.
31. Kovářová L, Hájek R. Prognostický význam imunofenotypizace u nemocných s monoklonální gamapatií nejasného významu a mnohocetným myelomem. Klin Biochem Metab 2011; 19 : 96–100.
32. Rawstron AC, Orfao A, Beksac M et al. European Myeloma Network. Report of the European Myeloma Network on multiparametric flow cytometry in multiple myeloma and related disorders. Haematologica 2008; 93 : 431–438.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 7 a 8-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

