-
Medical journals
- Career
Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
Authors: P. Polák 1; R. Svoboda 1; P. Kubáčková 2; Y. Brychtová 3; A. Panovská 3; E. Nohýnková 4,5; P. Husa 1; M. Freibergerová 1; R. Pařízková 1; M. Šnelerová 1; M. Pýchová 1; J. Kamelander 6
Authors‘ workplace: Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Petr Husa, CSc. 1; Oddělení klinické mikrobiologie FN Brno, pracoviště Bohunice, přednostka prim. MUDr. Alena Ševčíková 2; Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 3; Klinika infekčních, parazitárních a tropických nemocí 1. lékařské fakulty UK a Nemocnice Na Bulovce Praha, přednosta prof. MUDr. Michal Holub, Ph. D. 4; Národní referenční laboratoř pro diagnostiku tropických parazitárních infekcí Praha, vedoucí RNDr. Eva Nohýnková, Ph. D. 5; Oddělení klinické hematologie FN Brno, přednosta prof. MUDr. Miroslav Penka, CSc. 6
Published in: Vnitř Lék 2012; 58(10): 761-764
Category: Case Reports
Overview
Autoři předkládají kazuistiku pacienta s febriliemi, pancytopenií, hepatosplenomegalií a váhovým úbytkem, u kterého byla složitě stanovena diagnóza viscerální leishmaniózy. Standardní léčba viscerální leishmaniózy amfotericinem B po dobu 20 dnů vedla za několik týdnů k relapsu onemocnění. Definitivního vyléčení onemocnění bylo dosaženo až v České republice neregistrovaným cytostatikem miltefosinem (Impavido©). Cílem práce je upozornit na tuto importovanou protozoární infekci a na její základní klinické i laboratorní charakteristiky.
Klíčová slova:
viscerální leishmanióza – pancytopenie – hepatosplenomegalie – amfotericin B – miltefosinKazuistika
39letý pacient byl poprvé hospitalizován na Klinice infekčních chorob LF MU a FN Brno, pracoviště Bohunice, koncem dubna roku 2009 pro remitující horečky s maximem 40 °C. Současně pacient udával suchý kašel a bolesti na hrudníku. Horečky se poprvé vyskytly již v únoru roku 2009, kdy byl ambulantně empiricky sukcesivně léčen orálně aplikovanými makrolidy, cefalosporiny II. generace a doxycyklinem, vždy pouze s přechodným efektem. V posledních 3 měsících došlo rovněž k významnému váhovému úbytku 12 kg (15 % původní tělesné hmotnosti). V osobní anamnéze byl zjištěn pouze údaj o prodělané komoci mozku v roce 2004, jinak se pacient s ničím dlouhodobě neléčil, neužíval žádné léky, byl nekuřák a alkohol pil jen výjimečně, udával alergii na preparáty penicilinové řady. Pobyt v cizině a kontakt se zvířaty negoval.
Při přijetí byl pacient astenický (hmotnost 67 kg, výška 172 cm, BMI 22,64 kg/m2), febrilní 38,1 °C, s klidovou sinusovou tachykardií 115/min, TK 115/80 mm Hg, mírně dyspnoický//tachypnoický s dechovou frekvencí 18/min, palpačně byla zjištěna nefixovaná bilaterální axilární lymfadenopatie. Laboratorně byla nápadná leukocytopenie (3,09 × 109/l) s absolutní eozinopenií v diferenciálním rozpočtu, mírná trombocytopenie (147 × 109/l), normální počet erytrocytů. V biochemii byla přítomna mírná nekonjugovaná hyperbilirubinemie s mírně zvýšenou aktivitou aminotransferáz (ALT 0,8 µkat/l, AST 1,1 µkat/l). Hladina C-reaktivního proteinu byla 34 mg/l. Hormony štítné žlázy, myokardiální enzymy a D-dimery byly v referenčním rozmezí. Zvláště nápadná byla vysoká hladina cirkulujících imunokomplexů (243 arbitrárních jednotek). Nádorové markery (CEA, AFP, CA 19–9) byly v normě. RTG snímek hrudníku a paranazálních dutin neprokázal zánětlivé změny. Sérologický nález svědčil pro prodělanou nákazu virem Epsteina-Barrové (EBV) v minulosti, protilátky proti cytomegaloviru nebyly prokázány. Na ultrazvukovém vyšetření břišní dutiny byla zjištěna splenomegalie (16 × 5 cm) s vícečetnými hypoechogenními ložisky o maximálním průměru 13 mm a mírná hepatomegalie. Kultivační vyšetření moči a výtěru z krku neprokázalo patogenní mikroorganizmy. Hemokultivace byly rovněž opakovaně bez růstu mikroorganizmů. Pacient byl zajištěn doxycyklinem a k vyloučení případné hematologické malignity či systémového autoimunitního onemocnění byl dále přeložen na Interní hematologickou a onkologickou kliniku LF MU a FN Brno, pracoviště Bohunice.
Z dalších laboratorních abnormalit byla přítomna zvýšená hladina laktátdehydrogenázy (7,91 µkat/l), v elektroforéze bílkovin snížená α2 frakce (7,3 %, norma 8,3–15 %), zmnožené β2-globuliny (8,3 %, norma 2,5–7,2 %), bez průkazu monoklonální gamapatie. Dále byla extrémně vysoká hladina protilátek ve třídě IgE (310 U/ml), zvýšená hladina C3 složky komplementu (2,02 g/l) při normální hladině C4 složky (0,34 g/l) a extrémní hyperferitinemie (nad 2 000 µg/l) při normální hladině železa v séru (19 µmol/l). Cytoflowmetrie periferní krve neprokázala hemoblastózu, histologické vyšetření kostní dřeně neprokázalo lymfoproliferaci, kostní dřeň byla zvýšeně buněčná s utlumenou granulopoézou a mírně zmnoženou megakaryopoézou, tedy jen nediagnostické reaktivní změny všech 3 krevních řad. Při vyšetření autoprotilátek byla zjištěna pozitivita lupus-antikoagulans a protilátek proti β-II-glykoproteinu a hraniční pozitivita protilátek proti trombocytům a leukocytům. Testy hemolýzy byly negativní. Přímý i nepřímý antiglobulinový test byly negativní. K těmto laboratorním nálezům však nebyl adekvátní klinický korelát. Pacient nesplňoval kritéria Feltyho syndromu ani antifosfolipidového syndromu, a proto se revmatologická příčina stavu jevila jako méně pravděpodobná. Pro dyspepsii podstoupil pacient gastroskopické vyšetření, kde byla prokázána aftózní bulbitida (histologicky zjištěny pouze reaktivní změny).
Pro celkově dobrý stav byly ambulantně doplňovány infekční fokusy: odontogenní fokus neprokázán, echokardiografický nález bez jakékoli patologie. Pro relaps febrilií (opět až ke 40 °C) a suchý kašel byl pacient rehospitalizován na Interní hematologické a onkologické klinice v polovině června roku 2009. Laboratorně došlo k rozvoji výrazné hyperproteinemie (celková bílkovina v séru 98 g/l), dále byla přítomna mikrocytární anémie (Hb 90 g/l, MCV 77 fl, MCH 28) s lehkou retikulocytózou (177 × 109/l), lehká trombocytopenie 127 × 109/l a leukopenie 2,77 × 109/l s absolutním počtem eozinofilů 0,02 × 109 /l a neutrofilů 0,71 × 109/l. Hemokultivace byly opět nediagnostické. Intenzivně byly vylučovány ostatní možné infekce (mykotické antigeny v séru neprokázány, Widalova reakce negativní, sérologie virových hepatitid A, B, C negativní, sérologie HIV-1, 2 a lues negativní, sérologie hantavirů a Entamoeba histolytica byly negativní). Kožní reakce Mantoux-II byla negativní, genom Mycobacterium tuberculosis metodou polymerázové řetězové reakce (polymerase chain reaction – PCR) ve sputu neprokázán. Pro trvající suchý kašel bylo provedeno HRCT vyšetření plic bez diagnostického nálezu. V opakovaném vyšetření kostní dřeně v myelogramu byla zjištěna pouze vysoce iritovaná erytropoéza, bez průkazu malignity. Vyšetření tlusté kapky z periferní krve neprokázalo protozoární infekci (pomýšleno na plazmodia). Nicméně mikrobiolog zaregistroval údaj o splenomegalii a doporučil mikroskopické vyšetření kostní dřeně, kde byly následně diagnostikovány amastigotní formy leishmanií (potvrzeno v NRL pro diagnostiku tropických parazitárních infekcí). Sérologie leishmaniózy byla rovněž vysoce pozitivní (25. 6. 2009: protilátky proti Leishmania donovani metodou nepřímé hemaglutinace v titru 1 : 2 048).
Po téměř 5 měsících febrilií doprovázených signifikantním úbytkem na váze byla tedy stanovena diagnóza viscerální leishmaniózy. Na cílený dotaz teprve v této době pacient uvádí pobyt v přímořské oblasti v Chorvatsku v roce 2008. V polovině července roku 2009 byl pacient přeložen na Kliniku infekčních chorob LF MU a FN Brno, pracoviště Bohunice a tam byla zahájena cílená terapie amfotericinem B (0,9 mg/kg tělesné hmotnosti a den) po celkovou dobu 20 dnů. Po této léčbě byl sonografický obraz hepatosplenomegalie s vícečetnými hypoechogenními ložisky ve slezině bez vývoje, normalizoval se počet leukocytů, pozvolna se upravovala i červená krevní řada a počet trombocytů k normě. V diferenciálním krevním rozpočtu trvala mírná neutropenie a eozinopenie. Klinicky odezněly febrilie, pacient začal opět zvolna přibývat na váze. Během dalších ambulantních kontrol byla náhle začátkem října roku 2009 nově zjištěna progrese anémie se známkami hemolýzy, opětovná retikulocytóza a středně těžká leukocytopenie. V novém vzorku kostní dřeně však leishmanie prokázány nebyly. Doporučenou trepanobiopsii pacient s ohledem na špatně tolerovanou předchozí terapii amfotericinem B odmítnul. Koncem listopadu roku 2009 byl pacient rehospitalizován na Klinice infekčních chorob LF MU a FN Brno, pracoviště Bohunice, pro novou ataku febrilií (až 39 °C) a suchý kašel jako suspektní relaps viscerální leishmaniózy. V kostní dřeni byly opět zjištěny amastigotní formy leishmanií. Vzhledem k relapsu viscerální leishmaniózy po léčbě amfotericinem B byl pro další léčbu objednán v České republice neregistrovaný preparát s cytostatickým účinkem miltefosin (Impavido©) a pacient jej užíval v dávce 100 mg/den po dobu dalších 28 dnů (doba 14 dnů do doručení preparátu byla překlenuta amfotericinem B v dávce 0,9 mg/kg tělesné hmotnosti a den) – tato léčba byla doprovázena intenzivními bolestmi hlavy a celého těla, nevolností a intermitentní dušností. Přesto došlo k pozvolnému zlepšení celkového stavu, tělesná teplota se pohybovala již jen v pásmu subfebrilií, sonograficky byla prokázána regrese hepatosplenomegalie, rychlost sedimentace erytrocytů a hodnoty krevního obrazu se upravily k normě. V kontrolních vyšetřeních kostní dřeně byly opakovaně popsány jen reaktivní změny hematopoézy, s dysplastickými rysy, ale nebyla naplněna kritéria myelodysplastického syndromu. Postupně došlo k vymizení protilátek proti β-II-glykoproteinu i lupus-antikoagulans. Vývoj laboratorních parametrů v čase je zachycen v tab. 1. Během dalšího, ročního sledování již nebyly klinické ani laboratorní známky relapsu viscerální leishmaniózy a dispenzarizace pacienta byla ukončena.
Table 1. Vývoj laboratorních parametrů v čase. 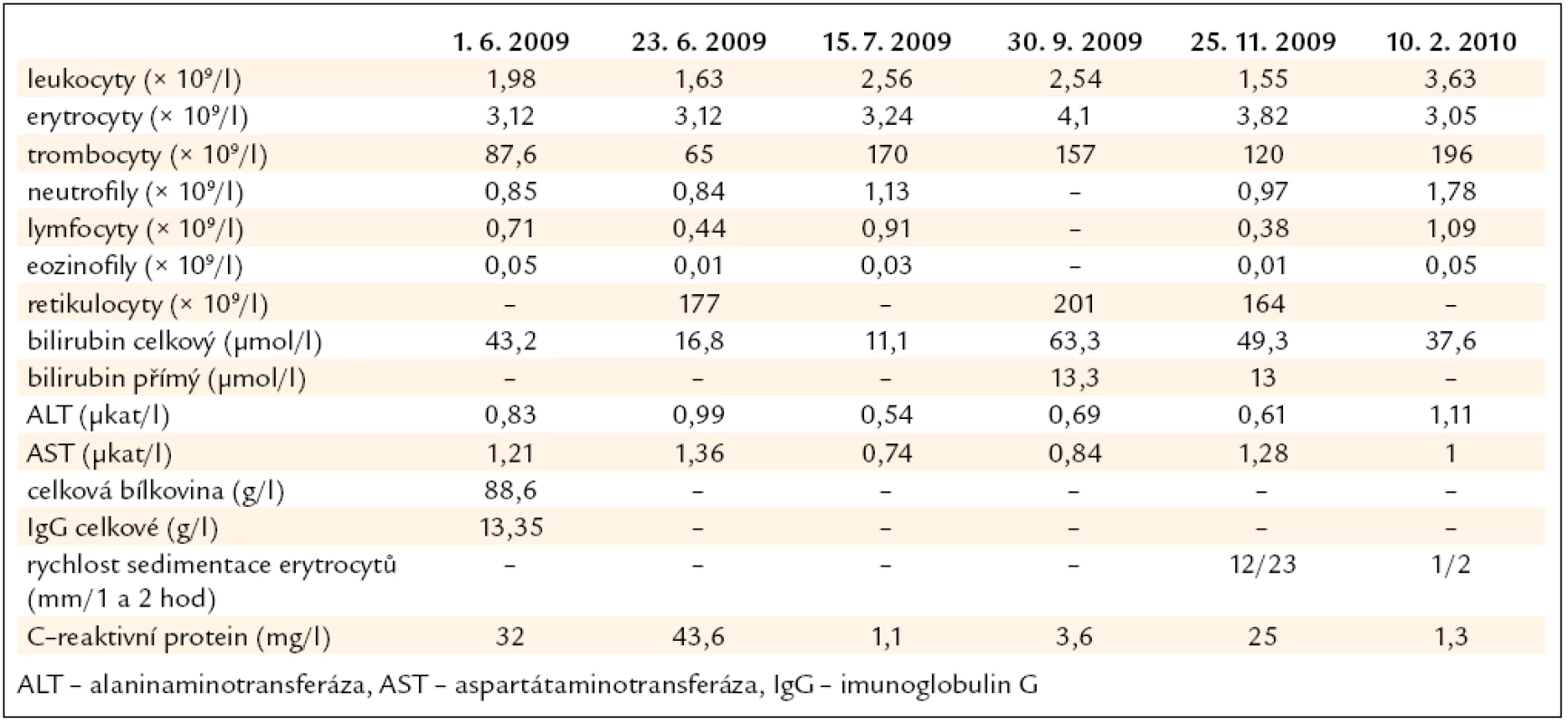
Diskuze
Viscerální leishmanióza (VL) je život ohrožující infekce způsobená protozoárními parazity z rodu Leishmania. Zatímco indickou VL (kala-azar) vyvolává Leishmania donovani, v Evropě, kde se nakazil náš pacient, je původcem onemocnění druh Leishmania infantum, který se vyskytuje endemicky ve všech zemích podél Středozemního moře. Nákaza je přenášena flebotomy, drobným krevsajícím hmyzem, který během sání krve vpraví parazity do kůže. Středomořská VL patří mezi zoonózy – rezervoárem jsou především psovité šelmy. Inkubační doba onemocnění se pohybuje v týdnech až měsících. Od roku 1990 bylo do ČR importováno celkem 16 případů VL (průměrně 1 diagnostikovaný případ za rok) – ve všech případech došlo k nákaze v letních měsících během pobytu v jižní Evropě (údaje NRL) [1–5]. Pozitivitu protilátek proti Leishmania donovani v séru popsaného pacienta lze vysvětlit zkříženou sérologickou reaktivitou mezi antigeny jednotlivých druhů, která je běžná.
Po několik desítek let byly lékem volby VL vyvolané Leishmania infantum soli pětimocného antimonu. Během posledních 10 let jsou ale stále častěji nahrazovány amfotericinem B, zejména jeho lipidovými formami (v dávkách 3–5 mg/kg/den), případně miltefosinem, jediným lékem proti VL určeným pro perorální podávání [6]. Všeobecný odklon od používání antimonových preparátů souvisí s nárůstem rezistentních případů VL působené Leishmania donovani ve 2 hyperendemických ohniscích kala-azar: indickém státu Bihár a v Nepálu. Rozvoj rezistence středomořské VL (Leishmania infantum) vůči pětimocnému antimonu dosud prokázán nebyl. K léčbě středomořské VL lze použít jak amfotericin B deoxycholát, tak všechny 3 lipidové formy amfotericinu B: Ambisome (liposomální amfotericin B), Abelcet (lipidový komplex amfotericinu B) i Amphocil (koloidní disperze amfotericinu B). V prezentovaném případě byly dávky amfotericinu B redukovány s ohledem na klinicky výrazné nežádoucí účinky; lipidová forma amfotericinu B nebyla dostupná. Vzhledem k selhání terapie amfotericinem B byl v terapii relapsu onemocnění úspěšně použit miltefosin. Účinnou vakcínu se dosud vyvinout nepodařilo [7]. Základní prevencí tedy zůstává ochrana před poštípáním flebotomy. Tranzientní imunologické abnormality jsou u postižených jedinců běžné a zpravidla se po léčbě upravují k normě. Ačkoliv naprostá většina případů importované VL včetně námi popisovaného se týkala imunokompetentních osob, je nutné upozornit, že zvláště ohroženou skupinou jsou pacienti užívající imunosupresivní léčbu (metotrexát) a pacienti s vrozeným či získaným deficitem buněčné imunity [8–10].
Závěr
Z uvedené kazuistiky vyplývá, jak může být někdy obtížné správně stanovit diagnózu importované infekce – a to i když průběh onemocnění odpovídá klasickým příznakům [11]. Proto je v každodenní praxi nezbytné nezapomínat na rozšířenou epidemiologickou anamnézu a případně časně indikovat cílená laboratorní vyšetření. Úzká spolupráce klinika a mikrobiologa zde bývá naprosto zásadní. Významnou limitací v České republice zůstává omezená dostupnost některých léčiv. Necílená empirická sekvenční terapie širokospektrými antibiotiky pacienta ohrožuje několika způsoby: jednak dochází k absolutnímu zkreslení klinického stavu, laboratorních a mikrobiologických výsledků, jednak je indukován rozvoj mikrobiální rezistence k antibiotikům a navíc hrozí postantibiotická kolitida. Proto je před započetím jakékoli antibiotické léčby nutné dbát na provedení základního laboratorního screeningu a základních odběrů biologického materiálu.
MUDr. Pavel Polák
www.fnbrno.cz
e-mail: pavel.polak@fnbrno.cz
Doručeno do redakce: 8. 3. 2012
Přijato po recenzi: 2. 5. 2012
Sources
1. Moore EM, Lockwood DN. Leishmaniasis. Clin Med 2011; 11 : 492–497.
2. Marty P, Pomares C, Michel G et al. Mediterranean visceral leishmaniasis. Bull Acad Natl Med 2011; 195 : 181–188.
3. Lahlou H, Filali AB, Alami M et al. Visceral leishmaniasis in 26 HIV-negative adults. BMC Res Notes 2011; 4 : 389.
4. Srividya G, Kulshrestha A, Singh R et al. Diagnosis of visceral leishmaniasis: developments over the last decade. Parasitol Res 2012; 110 : 1065–1078.
5. Korolová E. Leishmanióza jako profesionální tropické onemocnění. Pracov Lék 2010; 62 : 20–24.
6. Lobovská A, Nohýnková E. Nové léky proti parazitárním infekcím. Čas Lék Čes 2003; 142 : 177–181.
7. Evans KJ, Kedzierski L. Development of Vaccines against Visceral Leishmaniasis. J Trop Med 2012; 2012 : 892817.
8. Pitini V, Cascio A, Arrigo C et al. Visceral leishmaniasis after alemtuzumab in a patient with chronic lymphocytic leukaemia. Br J Haematol 2012; 156 : 1.
9. Yanamandra U, Jairam A, Shankar S et al. Visceral leishmaniasis mimicking as second line anti retroviral therapy failure. Intern Med 2011; 50 : 2855–2858.
10. Jawhar NM. Visceral Leishmaniasis with an Unusual Presentation in an HIV Positive Patient. Sultan Qaboos Univ Med J 2011; 11 : 269–272.
11. Varma N, Naseem S. Hematologic changes in visceral leishmaniasis/kala azar. Indian J Hematol Blood Transfus 2010; 26 : 78–82.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 10-
All articles in this issue
- Akutní infarkt myokardu u mladých – stala se někde chyba? – editorial
- Méně invazivní kardiochirurgické přístupy pro léčbu ischemické choroby srdeční – editorial
- Viscerální leishmanióza – editorial
- Festina lente! – editorial
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Existuje vzťah medzi zápalovými markermi, oxidačným stresom a pooperačnou fibriláciou predsiení?
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Hypoglykemie – fenomén, nad kterým moderní diabetologie pomalu vítězí
- AII antagonisté (candesartan a irbesartan) v léčbě kardiovaskulárních onemocnění
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
- Vysoké podezření na ICHS získané anamnézou nesmí vyvrátit negativita některých objektivních vyšetřovacích metod – zkušenost ambulantního internisty
- Dabigatran-etexilát v klinické praxi pro prevenci tromboembolických příhod u nemocných s fibrilací síní
- Efekt ivabradinu na tepovou frekvenci, vývoj funkce levé komory a koncentraci NT-proBNP u pacientů se systolickým chronickým srdečním selháním – příklady z praxe
- Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

