-
Medical journals
- Career
Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
Authors: M. Doubková; I. Binková; J. Skřičková
Authors‘ workplace: Klinika nemocí plicních a tuberkulózy Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednostka prof. MUDr. Jana Skřičková, CSc.
Published in: Vnitř Lék 2012; 58(10): 735-742
Category: Original Contributions
Overview
Sarkoidóza je systémové granulomatózní onemocnění neznámé etiologie, které může postihovat jakýkoli orgán. Patří do skupiny nemocí řazených mezi intersticiální plicní procesy. Naše práce je retrospektivní analýzou 169 nemocných (100 žen a 69 mužů), u kterých byla sarkoidóza diagnostikována na Klinice nemocí plicních a tuberkulózy FN Brno v letech 2005–2010. Cílem práce bylo zjistit prognostické faktory nemoci a její průběh na tomto souboru pacientů. Medián věku při stanovení diagnózy byl 48 let (20–79), poměr ženy : muži 1,5 : 1, poměr nekuřáci : kuřáci (bývalí kuřáci) byl 2,2 : 1. Rodinný výskyt byl pozorován u 4 nemocných (2,4 %). V době diagnózy mělo stadium 0 6 nemocných (3,5 %), stadium I 58 nemocných (34 %), stadium II 84 nemocných (49,5 %), stadium III 18 nemocných (11 %) a stadium IV 3 nemocní (2 %). Diagnóza sarkoidózy byla podpořena histologickým nálezem u 111 nemocných. U 76 nemocných (45 %) jsme našli mimoplicní postižení. U 10 pacientů jsme pozorovali koincidenci s autoimunitními onemocněními a u 6 nemocných přítomnost tromboembolické nemoci. U 1 pacienta byla diagnostikována sarkoidóza spolu s atypickou formou cystické fibrózy. Spontánní regrese bez nutnosti zahájení léčby byla pozorována u 65 (38,5 %) pacientů: u 37 (64 %) ve stadiu I, u 26 (31 %) ve stadiu II a u 2 (11 %) nemocných ve stadiu III. U 3 nemocných s plicním postižením jsme nezahajovali terapii vzhledem ke komorbiditám a věku. U 101 nemocných (60 %) bylo nutné zahájit léčbu kortikoidy. Nežádoucí vedlejší účinky kortikoidní léčby byly pozorovány u 28 (26 %) nemocných. U pacientů se spontánní regresí nemoci jsme ve sledovaném období nezaznamenali recidivu sarkoidózy. Ze 101 nemocných léčených kortikoidy či kombinací imunosupresivní léčby byla u 11 (11 %) zjištěna recidiva sarkoidózy. Medián návratu nemoci po skončení léčby byl 6 měsíců (2–34). Jako příznivé statisticky významné prognostické faktory ovlivňující spontánní regresi se ukázaly věk pod 40 let, RTG stadium I a II, vyšší imunoregulační index v bronchoalveolární tekutině a plicní postižení včetně Löfgrenova syndromu. Při léčbě sarkoidózy kortikoidy nebo kombinací imunosupresiv jsme zaznamenali vyšší pravděpodobnost vyléčení při terapii trvající méně než 2 roky. Ze souboru pacientů zemřeli za dobu sledování jen 2 (1,2 %; oba v souvislosti se sarkoidózou).
Klíčová slova:
sarkoidóza – diagnostika – terapie – prognózaÚvod
Sarkoidóza je systémové granulomatózní onemocnění neznámé etiologie s plicními a mimoplicními projevy. Toto onemocnění patří mezi záhady medicíny nejen kvůli nedostatečně poznané etiologii, ale i kvůli pestrosti klinických příznaků. Historie poznávání nemoci spadá do 19. století [1].
Deskriptivní definice nemoci zní: sarkoidóza je systémové onemocnění neznámé příčiny. Obvykle postihuje dospělé pacienty mladého a středního věku a často se projevuje jako oboustranná hilová lymfadenopatie, plicní infiltrace či oční a kožní léze. Mohou být také postiženy játra, slezina, další lymfatické uzliny, slinné žlázy, srdce, nervový systém, svaly, kosti a jiné orgány. Diagnózu sarkoidózy je možno stanovit, když klinické a radiologické nálezy podpoří průkaz nekaseifikujícího granulomu. Granulomy jiných známých příčin a lokální sarkoidní reakce musí být vyloučeny [2,3].
Diagnóza sarkoidózy může být pravděpodobná při nepřítomnosti histologického ověření, pokud klinika, nálezy radiologické, laboratorní a nálezy při vyšetření bronchoalveolární tekutiny korelují s diagnózou sarkoidózy [4].
Morfologická definice nemoci zní: nemoc je charakterizována granulomy z epiteloidních buněk v různých orgánech a tkáních, které vznikají akumulací T-lymfocytů a transformovaných makrofágů. V granulomech nedochází ke kaseifikaci, ačkoliv fibrinoidní nekróza může být v jejich centru přítomna. Granulomy vedou k úplné rezoluci nebo k hyalinní fibróze [2].
Materiál a metody
Provedli jsme retrospektivní analýzu pacientů, jimž byla na našem pracovišti diagnostikována sarkoidóza v letech 2005–2010. Tato studie měla za cíl provést charakteristiku souboru pacientů našeho regionu se sarkoidózou a porovnat naše údaje s údaji publikovanými ve světové a české lékařské literatuře.
Diagnóza sarkoidózy byla stanovena standardními postupy (klinický nález, laboratorní vyšetření, plicní funkční vyšetření, zobrazovací metody, bronchoskopie s vyšetřením bronchoalveolární tekutiny, histologický průkaz granulomu). Pro stanovení diagnózy jsme vyžadovali korelaci histologického nálezu, klinického nálezu, zobrazovacích a laboratorních vyšetření [2,4]. V případě chybění histologického průkazu granulomu byla diagnóza stanovena na základě shody klinického nálezu s výsledky zobrazovacích a laboratorních vyšetření a vyšetření bronchoalveolární tekutiny (BAT) získané bronchoalveolární laváží, observací a vyloučením jiných granulomatózních procesů.
Ve studii jsme analyzovali přirozený vývoj nemoci, příčiny úmrtí, riziko relapsů nemoci u pacientů se spontánní regresí a u nemocných léčených kortikoidy. Pozorovali jsme i výskyt koincidence jiných onemocnění včetně autoimunitních.
Statistické zpracování výsledků bylo provedeno Wilcoxonovým testem. Výsledky byly označeny jako významné při hladině p < 0,05.
Výsledky
Ve sledovaných letech byla na našem pracovišti stanovena diagnóza sarkoidózy u 169 pacientů, 100 žen a 69 mužů. Medián věku při stanovení diagnózy byl 48 let (20–79). Rodinný výskyt jsme pozorovali u 4 pacientů (2,4 %). Hodnocením klinických nálezů našich pacientů jsme zjistili, že v době stanovení diagnózy byla u 63 (37 %) našich pacientů přítomna dušnost při námaze, u 2 (1 %) nemocných dušnost v klidu, u 63 (37 %) pacientů suchý kašel, u 21 (12 %) pacientů atypické stenokardie, u 18 (11 %) teploty, u 23 (14 %) bolesti kloubů, u 6 (3,5 %) zvýšené pocení, u 10 (6 %) únava, u 6 (3,5 %) hubnutí a u 2 (1 %) bolesti svalů. Löfgrenův syndrom byl pozorován u 22 pacientů. Ze 169 pacientů bylo 116 nekuřáků, zbylí byli kuřáci, bývalí kuřáci nebo jejich kuřácká anamnéza nebyla známa. Histologický průkaz granulomu charakteru sarkoidózy byl potvrzen u 111 pacientů: videoasistovanou torakoskopií u 39, u 23 metodou transbronchiální plicní biopsie, mediastinoskopií u 12, endobronchiální biopsií u 4 a minitorakotomií u 2 nemocných. U 14 nemocných byla diagnóza potvrzena histologicky z kůže, u 8 z periferní krční uzliny, u 2 z tonzily a po jednom z jater, kostní tkáně, rtu, podčelistní slinné žlázy, příušní žlázy, uzliny jaterního hilu a omenta. U zbylých nemocných byla diagnóza stanovena na základě korelace klinického obrazu, nálezu zobrazovacích metod (skiagram hrudníku nebo výpočetní tomografie s vysokou rozlišovací schopností – HRCT), bronchoskopie s bronchoalveolární laváží a vyšetřením bronchoalveolární tekutiny (BAT), laboratorních vyšetření s vyloučením jiných granulomatózních onemocnění (tab. 1, 2).
Table 1. Charakteristika souboru (n = 169). 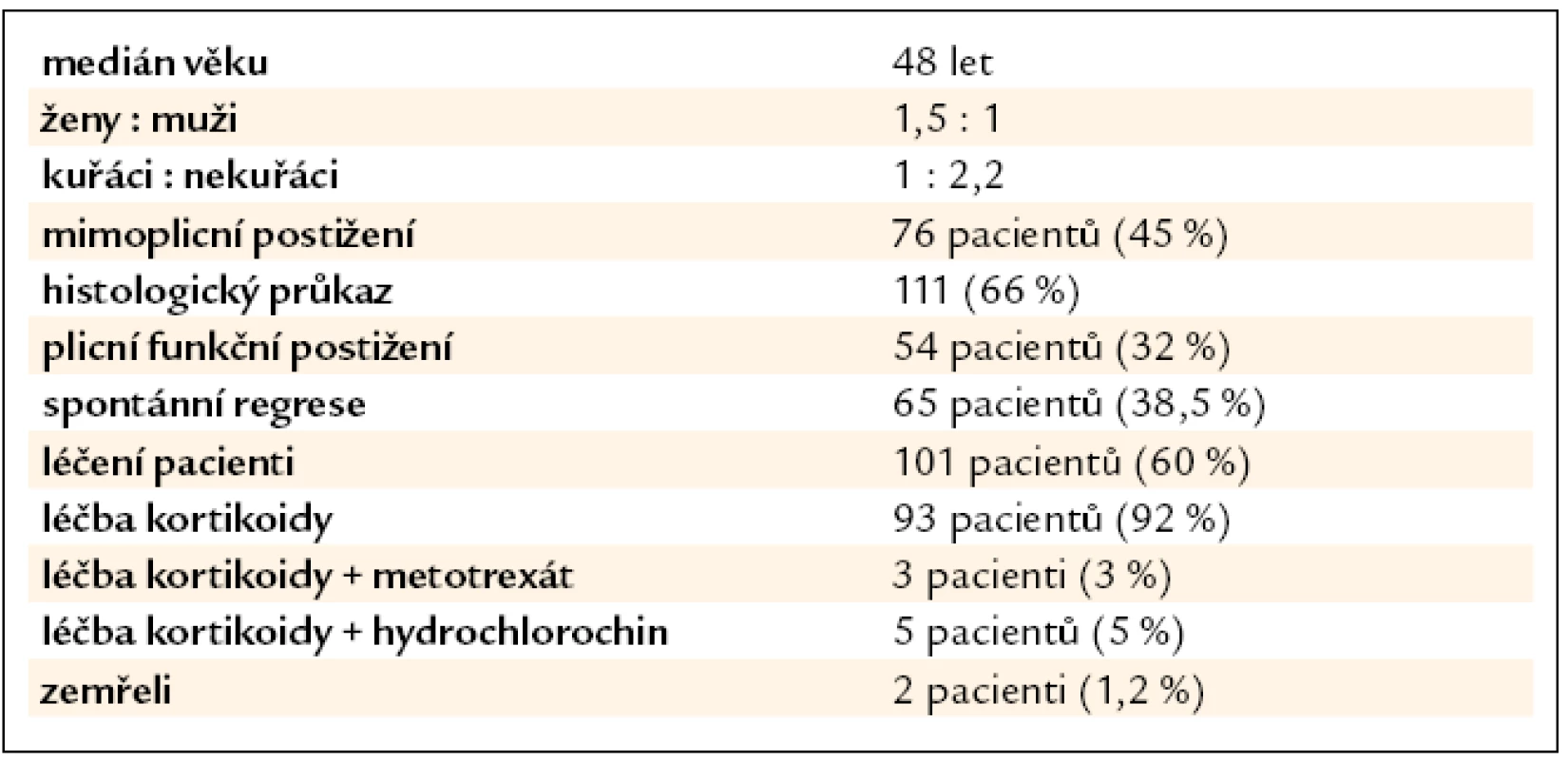
Table 2. Orgánové postižení v době diagnózy sarkoidózy (n = 169). 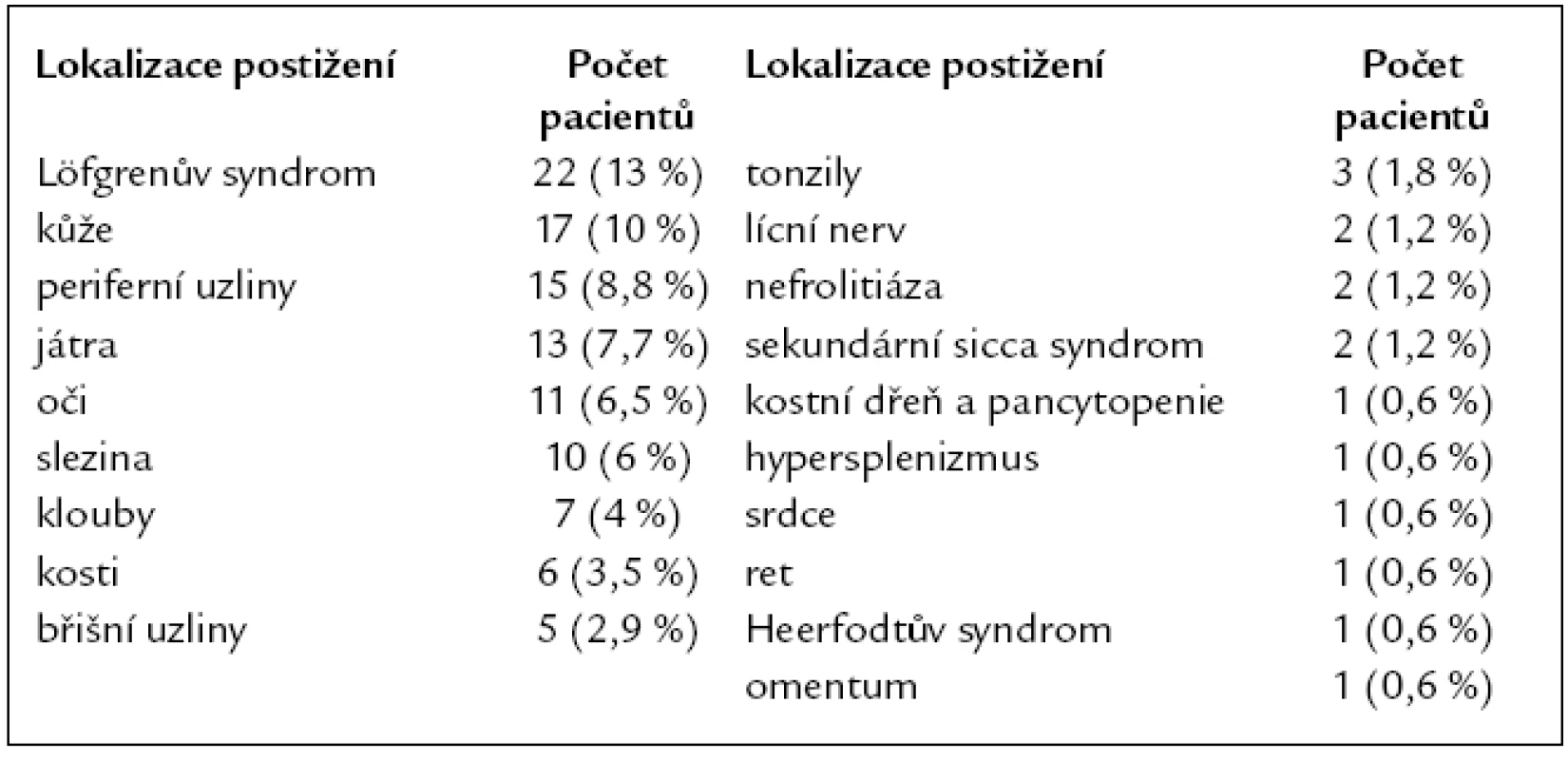
Postižení plic a mediastina se vyskytovalo u všech 169 pacientů. Podle nálezu na zadopředním skiagramu hrudníku bylo v době diagnózy přítomno stadium 0 u 6 (3,5 %) nemocných, stadium I u 58 (34 %), stadium II u 84 (49,5 %), stadium III u 18 (11 %), stadium IV u 3 (2 %) (tab. 3). CT a HRCT hrudníku bylo provedeno u všech 169 nemocných. Löfgrenův syndrom byl přítomen u 22 (13 %) nemocných. Mimoplicní postižení sarkoidózou bylo zjištěno u 76 (45 %) pacientů, jednalo se o jedno či o kombinaci více postižení. Z toho postižení jater bylo přítomno u 8 (4,7 %) nemocných, postižení jater a sleziny u 5 (3 %) a postižení sleziny u 5 (3 %) nemocných. Postižení očí bylo u 11 (6,5 %) nemocných, postižení kůže u 17 (10 %), postižení srdce u 1 (0,6 %) pacienta. Ultrazvukové vyšetření srdce bylo provedeno u 96 pacientů, nepřímé známky plicní hypertenze byly zjištěny v 5 případech (5 %). Postižení kostní dřeně s pancytopenií bylo u jednoho (0,6 %) nemocného, projevy hypersplenizmu při postižení sleziny rovněž u jednoho nemocného (0,6 %). Postižení kostí bylo u 6 (3,5 %) pacientů, postižení kloubů u 7 (4 %), postižení rtu u 1 (0,6 %) a tonzily u 3 (1,8 %) pacientů. Heerfodtův syndrom (febris uveoparotidea) byl pozorován u 1 (0,6 %) pacienta. Postižení lícního nervu u 2 (1,2 %), nefrolitiáza u 2 (1,2 %), sekundární sicca syndrom rovněž u 2 (1,2 %) pacientů. Postižení periferních uzlin bylo u 15 (8,8 %) nemocných, postižení břišních uzlin u 5 (2,9 %) a postižení omenta u 1 (0,6 %) nemocného (tab. 2).
Table 3. Procento spontánní regrese bez nutnosti nasazení léčby v závislosti na stadiu nemoci dle skiagramu hrudníku (n = 169). 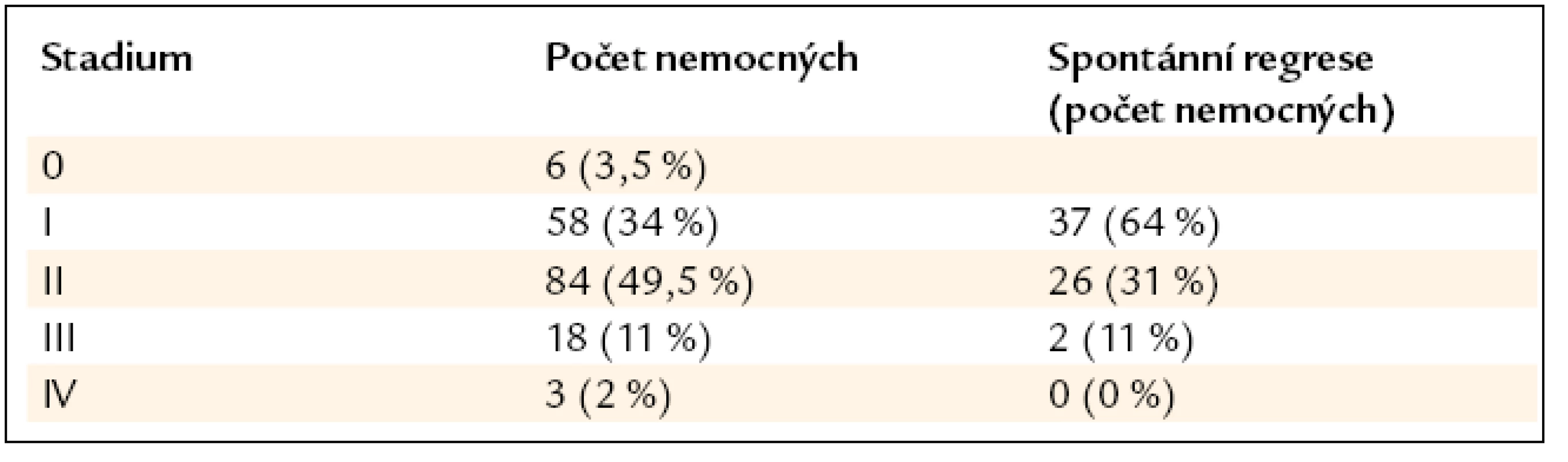
Přítomnost autoimunitní tyreoiditidy byla u 4 (2,4 %) nemocných, revmatické polymyalgie u 1 (0,6 %), Sjögrenova syndromu u 1 (0,6 %), séronegativní spondylartritidy u 1 (0,6 %), ulcerózní kolitidy u 1 (0,6 %) a revmatoidní artritidy rovněž u 1 (0,6 %) pacienta. Tromboembolická nemoc byla zjištěna u 6 (3,5 %) nemocných, z toho plicní embolie byla u 2 (1,2 %) a flebotrombóza dolních končetin u 4 (2,4 %). U 1 (0,6 %) pacienta byla zjištěna koincidence histologicky potvrzené sarkoidózy a atypické formy cystické fibrózy (tab. 4).
Table 4. Koincidence autoimunitních a jiných onemocnění a sarkoidózy u našich nemocných (n = 169). 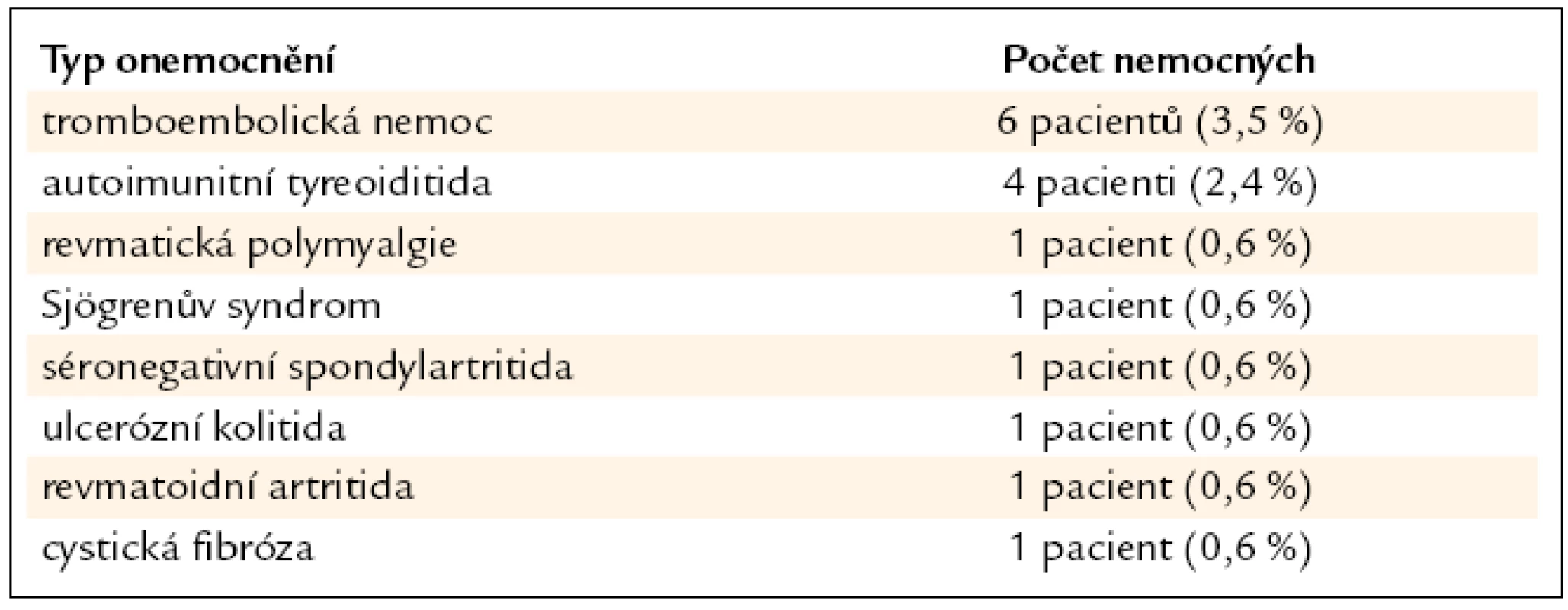
Z laboratorních hodnot jsme si všímali především hodnoty angiotenzin konvertujícího enzymu (ACE) v séru (norma 12–68 mmol/l). Zvýšená hladina ACE byla přítomna u 62 pacientů (37 %). U 24 nemocných nebylo ACE v době zjištění diagnózy zaznamenáno. Medián naměřené hodnoty byl 62,1 mmol/l (1–233,6). U pacientů histologicky verifikovaných byl medián ACE v séru 70,25 mmol/l (17–191,2). Po zahájení léčby nebo při spontánní regresi došlo k poklesu hodnot ACE, medián u nemocných s regresí sarkoidózy byl 40,8 mmol/l (6,8–82).
U 75 (44 %) pacientů byly zvýšeny jaterní testy (zejména GGT v 63 případech). U 29 (17 %) pacientů byl popsán nález hepatomegalie s mírně nehomogenní strukturou jater. Hyperkalcemie byla u 16 (9,5 %) nemocných. Odpady vápníku v moči byly vyšetřovány jen u 67 nemocných, hyperkalciurie byla přítomna u 30 (44,8 %) z nich. U 20 (34 %) pacientů (z 58 vyšetřených) jsme nacházeli zvýšené hodnoty autoprotilátek při nepřítomnosti autoimunitního onemocnění. Tuberkulinový kožní test Mantoux II byl proveden u 65 nemocných pacientů, u všech s negativním výsledkem.
Plicní funkční vyšetření neprokázalo při stanovení diagnózy ventilační poruchu u 115 pacientů (68 %). Restriktivní ventilační porucha byla přítomna u 16 (9 %) nemocných, obstrukční u 30 (18 %) a kombinovaná porucha u 8 (5 %). Bez poruchy difuze bylo 115 (68 %) pacientů. Mírná porucha difuzní plicní kapacity byla zjištěna při stanovení diagnózy u 33 (20 %) nemocných, středně těžká porucha difuze byla prokázána u 14 (8 %) a těžká porucha difuze u 1 (1 %). Vyšetřením krevních plynů (arterializovaná krev z ušního lalůčku) v klidu v době diagnózy jsme u 149 (88 %) pacientů neprokázali respirační nedostatečnost, u 11 (7 %) byla přítomna parciální respirační nedostatečnost mírného stupně, u 4 (2 %) středně těžkého stupně.
Bronchoskopie byla provedena u 140 (83 %) nemocných. Ve zbylých případech nebyla bronchoskopie indikována vzhledem k již stanovené diagnóze sarkoidózy jinou metodou, nebo z důvodu odmítnutí pacienta. BAT byla hodnocena u 138 pacientů. Cytologické vyšetření BAT bylo hodnoceno na 600 buněk. Makroskopický bronchoskopický nález byl u 76 (54 %) nemocných normální, u 41 (29 %) ukázal fragilní sliznici s bohatou cévní kresbou, u 16 (12 %) difuzní zánětlivé změny, u 4 (3 %) ukázal sliznici s endobronchiálním nálezem granulací a u 3 (2 %) známky extramurálního tlaku ze zvětšených uzlin v mezihrudí. Cytologickým vyšetřením bronchoalveolární tekutiny jsme nalezli u 31 (22 %) nemocných normální obraz, u 78 (56,5 %) lymfocytární alveolitidu, u 9 (6,5 %) převahu neutrofilních granulocytů, u 19 (14 %) převahu neutrofilních granulocytů a lymfocytů a u 1 (1 %) pacienta zvýšený počet lymfocytů, neutrofilních i eozinofilních granulocytů. Imunoregulační index (IRI, poměr subpopulací T-lymfocytů CD4+ a CD8+) v BALT byl proveden u 118 pacientů. Medián IRI byl 7,33 (0,815–50,368). U 61 pacientů s histologicky potvrzenou sarkoidózou byl medián IRI 5,971 (0,917–50,368). U nemocných se spontánní regresí byl medián IRI 9,733 (1,247–50,368). U nemocných se závažnějším postižením a nutností léčby byl medián IRI 5,407 (0,815–20,304). U 8 z 9 nemocných s neutrofilní alveolitidou jsme pozorovali plicní i mimoplicní postižení s nutností léčby a chronickým průběhem (tab. 5).
Table 5. Analyzované prognostické faktory ve vztahu k pravděpodobnosti spontánní regrese či vyléčení nemoci. 
Transbronchiální plicní biopsie byla provedena u 58 pacientů ze 140, kteří podstoupili bronchoskopii (41 %). U 23 (39,6 %) pacientů z nich byl metodou TBB potvrzen nález granulomatózního zánětu typu sarkoidózy. U nemocných bylo odebráno průměrně 1,7 vzorku tkáně (medián 1 vzorek). TBB přispěla k diagnóze sarkoidózy u 3 nemocných v I. stadiu, u 18 ve II. stadiu a u 2 ve III. stadiu. Endobronchiální biopsie podpořila diagnózu sarkoidózy u 2 pacientů. Mediastinoskopie umožnila stanovit diagnózu sarkoidózy u 12 (7 %), videotorakoskopie u 39 (23 %) pacientů a u 2 nemocných byla provedena minitorakotomie (1 %).
Spontánní regrese byla pozorována u 65 (38,5 %) pacientů. Z 69 mužů se vyskytla spontánní regrese u 25. Mezi 100 ženami byla pozorována spontánní regrese u 40. Statisticky významně vyšší pravděpodobnost spontánní regrese nebyla zjištěna u žádného z obou pohlaví. Léčení pacienti měli medián věku 49 let (20–76). U pacientů se spontánní regresí byl medián věku 44 let (26–76). Spontánní vyléčení bylo více pozorováno u pacientů mladších 40 let. Spontánní regresi mělo 37 (64 %) nemocných ve stadiu I, 26 (31 %) ve stadiu II a 2 (11 %) ve stadiu III (tab. 5). Ve stadiu IV nedošlo u žádného pacienta ke spontánní regresi. Z 93 nemocných s pouze plicním postižením (zahrnuti byli i nemocní s Löfgrenovým syndromem) byla pozorována regrese u 58. Ze 76 pacientů s plicním a mimoplicním postižením byla pozorována spontánní regrese u 7 (tab. 5). Většina našich nemocných byla léčena monoterapií prednizonem nebo metylprednizolonem ve standardní dávce 40 mg prednizonu nebo jeho ekvivalentu, perorálně denně s postupným snižováním na udržovací dávku. U nemocných s přetrvávající hyperkalcemií a hyperkalciurií jsme indikovali antimalarikum hydroxychlorochin (Plaquenil). U nemocných dlouhodobě užívajících vysoké dávky kortikoidů s relapsy nemoci při snížení dávky jsme léčbu doplňovali o metotrexát v dávce 10 mg 1krát týdně. Celkem bylo léčeno 101 nemocných (60 %). Z toho 93 pacientů monoterapií kortikoidy (92 %) a 8 (8 %) kombinací kortikoidů s dalším imunosupresivem. Jmenovitě antimalarikem to bylo 5 nemocných a metotrexátem 3 nemocní. Remise nemoci byla pozorována u 48 ze 101 léčených pacientů (48 %) (tab. 1). Žádný z našeho souboru nemocných nebyl indikován k domácí dlouhodobé oxygenoterapii (DDOT). Plicní transplantace v tomto období nebyla zvažována u žádného nemocného. 49 nemocných (29 %) bylo sledováno pro chronický průběh sarkoidózy s nutností udržovací léčby kortikoidy po dobu delší než 2 roky.
Nežádoucí vedlejší účinky kortikoidů byly přítomny u 28 (26 %) nemocných. Pozorovali jsme osteoporózu (8; 7 %), osteopenii (3; 3 %), steroidní diabetes (10; 9 %), poruchu glukózové tolerance (1; 1 %), depresi (1; 1 %), alopecii (2; 2 %), dekompenzaci hypertenzní nemoci (5; 5 %), oční komplikace (katarakta, glaukom) (3; 3 %), gastrointestinální obtíže (1; 1 %) a zlomeninu bederního obratle (1; 1 %).
U pacientů se spontánní regresí jsme ve sledovaném období recidivu sarkoidózy nezaznamenali. Naopak ze 101 nemocných léčených kortikoidy či kombinací imunosupresivní léčby byla u 11 (11 %) recidiva sarkoidózy zjištěna. Medián doby do návratu nemoci po skončení léčby sarkoidózy byl 6 měsíců (2–34).
Jako příznivé prognostické faktory ovlivňující spontánní regresi se ukázaly věk pod 40 let, RTG stadium I a II, vyšší IRI v BAT a plicní postižení včetně Löfgrenova syndromu. Při léčbě sarkoidózy kortikoidy nebo v kombinaci s jinými imunosupresivy jsme zaznamenali vyšší pravděpodobnost vyléčení při potřebě terapie po dobu kratší než 2 roky (tab. 5).
Za dobu sledování zemřeli 2 (1,2 %) pacienti. Příčinou smrti u prvního pacienta se závažným plicním postižením stadia IV a mimoplicním postižením byla terminální oboustranná pneumonie. U druhého pacienta s plicní sarkoidózou stadia II byl příčinou úmrtí infarkt myokardu způsobený kardiálním postižením při sarkoidóze.
Diskuze
Sarkoidóza je onemocnění neznámé etiologie [2,3]. Jde o granulomatózní systémový zánětlivý proces s celosvětovým výskytem postihující jedince všech etnik a věkových skupin. Příčina vzniku sarkoidózy není stále objasněna. Předpokládá se působení neznámé noxy u geneticky predisponovaného jedince. Po působení noxy vzniká oligoklonální buněčná odpověď s akumulací CD4+ Th1 lymfocytů a aktivovaných makrofágů produkujících různé cytokiny v místě postižení [4]. Současné poznatky poukazují i na význam Th17 lymfocytů a T regulačních lymfocytů [5]. Z hlediska genetické predispozice se uvažuje o roli HLA systému (hlavní histokompatibilní systém) a polymorfizmů cytokinů. Zvažován je i infekční původ nemoci.
Epidemiologická data jsou velmi nepřesná, protože sarkoidóza může probíhat až u 1/3 pacientů zcela asymptomaticky nebo může dojít ke spontánní regresi [6,7]. V České republice dosahuje incidence 3,1 případů na 100 000 obyvatel a rok, prevalence všech forem je 63,1/100 000 [8,9]. Onemocnění postihuje převážně ženy a poměr muži : ženy je 1 : 2,35 [6,7]. Byla pozorována i rodinná vazba výskytu sarkoidózy [10]. Letalita je nízká a udává se mezi 1–4 % [6,7]. Uvedené údaje korespondují s našimi výsledky.
Ve studii ACCESS (A Case Control Etiologic Study of Sarcoidosis) z roku 2001 byl věk téměř 2/3 nemocných při stanovení diagnózy sarkoidózy 35–45 let; 1/3 nemocných byla ve věku nad 50 let [7,11,12]. U našich nemocných byl medián věku při zjištění diagnózy vyšší – 48 let. Většina pacientů se sarkoidózou jsou nekuřáci, což se potvrdilo i v naší analýze. Vztah kouření a sarkoidózy popisuje už práce z roku 1988 [13]. Žádná práce zatím nepotvrdila skutečnost, že sarkoidóza má méně závažný průběh u kuřáků.
V lékařské literatuře jsou popisovány koincidence sarkoidózy s jinými onemocněními včetně autoimunitních, jako jsou kolagenózy, lymfoproliferativní onemocnění, dna, psoriáza, Crohnova nemoc, tromboembolické nemoci a nádory. V našem souboru jsme zaznamenali i koincidenci atypické formy cystické fibrózy a sarkoidózy. Patogenetická souvislost mezi těmito nemocemi nebyla nicméně dosud objasněna [14–16].
Klinické projevy sarkoidózy jsou velmi pestré [11,12], což ukazují i naše data (tab. 2). Ve studii MORSA (multicentrická moravská studie epidemiologických trendů sarkoidózy v letech 1991–2000) Kolek et al zjistili mimoplicní postižení u 39 % pacientů [9]. Procentuální zastoupení postižení jednotlivých orgánů má ale poměrně široký rozptyl v závislosti na studii, která se touto otázkou zabývala. Vzhledem k tomu, že ve více než v 90 % je postižen respirační systém, symptomy zahrnují kašel, dušnost a bolest na hrudi. Löfgrenův syndrom jako akutní forma sarkoidózy, který byl přítomen v našem souboru u 13 % pacientů, zahrnuje teploty, nodózní erytém, oboustranné zvětšení hilových uzlin, polyartralgie (zejména talokrurálních kloubů) a negativní tuberkulinový kožní test [17]. Z dalších projevů může sarkoidóza postihnout až u 30 % nemocných periferní lymfatické uzliny [6,7], slezinu (10–50 %) [6,7], srdce (asi u 5–30 %) [6,7], játra (zvýšení jaterních testů až u 35 % pacientů; u 50–70 % pacientů při bioptickém vyšetření jater jsou nalézány granulomy) [6,7], kůži (20–25 % pacientů) [6,7], oči (10–80 % pacientů) [6,7], nervovou soustavu (10 %) [6,7], pohybové ústrojí s bolestmi kloubů (25–40 %) [6,7], postižení skeletu (3 %) a gastrointestinálního traktu (do 1 %) [6,7]. Hematologické změny jsou pozorovány u 30 % nemocných [6,7]. Heerfodtův syndrom (teploty, zvětšení příušní žlázy, obrny tváře a přední uveitida) je pozorován asi u 6 % [6,7]. Plicní hypertenze (PH) je uváděna u 1–28 % nemocných se sarkoidózou [6,7]. Výskyt PH bývá zaznamenán i u pacientů bez plicní fibrózy.
Z diagnostických zobrazovacích metod je zlatým standardem skiagram hrudníku. I v dnešní době výpočetní tomografie se sarkoidóza plic dělí na 5 stadií dle skiagramu hrudníku (tzv. Scadding scale) [18]. V našem souboru nemocných převažovala stadia I a II (tab. 4). V literatuře se uvádí, že stadium 0 je přítomno u 5–15 % nemocných, stadium I u 75–80 %, stadium II u 30–40 %, stadium III u 15 % a stadium IV u necelých 5 % pacientů [6,19,20]. Ve studii MORSA Kolek et al zaznamenali analýzou 1 001 nemocných se sarkoidózou stadium I u 54,3 %, stadium II u 32 % a stadium III u 8,2 % a stadium IV v 1, 9 % nemocných [9]. Plicním funkčním vyšetřením lze odhalit pestrou škálu nálezů, s čímž korespondují nálezy naše. Nejcitlivější metodou pro posouzení plicního funkčního postižení u sarkoidózy je vyšetření difuzní kapacity plic (DLco) [3].
V séru pacientů se sarkoidózou jsou zjišťovány vyšší hodnoty ACE, solubilního receptoru pro interleukin 2 (sIL-2R) a neopterinu. Zvýšené hladiny ACE bývají zaznamenávány u 40–90 % pacientů [19]. Na naší klinice jsme ve sledovaných letech vyšetřovali pouze ACE. Podle mnohých autorů je ale stanovení hladin ACE v diagnostice sarkoidózy diskutabilní vzhledem k tomu, že hladiny tohoto enzymu jsou ovlivněny věkem, genovým polymorfizmem a jinými nemocemi (další granulomatózní choroby, hypertyreodizmus, Hodgkinův lymfom) a především léky (kortikoidy, inhibitory ACE) [7,19]. ACE se více využívá při dynamickém sledování k hodnocení aktivity onemocnění a efektu terapie nežli při diagnostice nemoci [19,20].
Z dalších laboratorních ukazatelů je u nemocných se sarkoidózou zjišťována hyperkalcemie a hyperkalciurie. Hyperkalcemie je popisována u 2–5 % pacientů [19]. Hyperkalciurie je častější než hyperkalcemie a nachází se v některých souborech až ve 40 % případů. Proto je důležité vyšetřovat nejen hladiny vápníku v séru, ale i v moči [6]. V séru nemocných se sarkoidózou můžeme nacházet různé autoprotilátky, zejména antinukleární protilátky a revmatoidní faktor. Tuto pozitivitu si můžeme vysvětlovat jako důsledek nespecifického zvýšení aktivity humorální složky imunity.
Jaterní postižení bývá při pitvě nalézáno až u 70 % nemocných se sarkoidózou [6]. Nejčastěji se klinicky neprojevuje a je zjistitelné jen elevací jaterních enzymů. Zvýšené jaterní enzymy se u všech našich nemocných normalizovaly buď spontánně zároveň se spontánní regresí plicního postižení, nebo po léčbě kortikoidy indikované pro jiné než jaterní postižení sarkoidózou.
Tuberkulinový kožní test bývá u sarkoidózy zpravidla negativní, což koresponduje i s našimi výsledky. Kožní areaktivitu testu lze vysvětlit redistribucí T pomocných lymfocytů, které se akumulují v místě granulomatózního procesu. V krevním obraze nemocných bývá lymfopenie s převahou CD8+ lymfocytů, respektive s deplecí CD4+ lymfocytů, což souvisí se změnami v reakcích buněčné imunity (nejde o klinický imunodeficit) [8].
Bronchoskopický nález může být negativní, případně pozorujeme žlutavé uzlíčky, které představují nakupení granulomů, nebo nacházíme zarudnutí a ztluštění sliznice s vinutými dilatovanými cévkami. Během bronchoskopie se provádí bronchoalveolární laváž s vyšetřením BAT. BAT lze vyšetřit cytologicky a flowcytometricky. Ve stadiu aktivní nemoci se v BAT nemocných na rozdíl od zdravých osob zjišťuje zvýšený celkový počet buněk, a to zejména lymfocytů (normální nález lymfocytů je do 15 %) s posunem IRI nad 3,5 (vzestup pomocných CD4+ T-lymfocytů). Dosahuje-li index CD4/CD8 hodnoty nad 3,5, je diagnóza sarkoidózy pravděpodobná, při hodnotě nad 10 (při splnění dalších klinických nálezů) pak téměř jistá [3,6,8,15]. Vyšší hodnoty lymfocytů (20–80 %, průměrná hodnota 40 %) bývají pozorovány u neléčených pacientů, v době aktivity procesu [6]. U pacientů dobře léčených, nebo ve stadiu ireverzibilní plicní fibrózy, mohou být nálezy v BAT normální či mohou převažovat vyšší hodnoty neutrofilů a/nebo mastocytů [21–24]. Dalšími bronchoskopickými metodami využívanými k diagnostice sarkoidózy patří endobronchiální biopsie, transbronchiální biopsie (TBB) nebo odběr vzorku pod kontrolou endobronchiálního ultrazvuku (EBUS) [22]. Úspěšnost TBB záleží na stadiu sarkoidózy a množství odebraných reprezentativních vzorků. U našich pacientů byla výtěžnost TBB 38 %. Na našem výsledku se podílel odběr malého počtu vzorků při TBB (průměrně 1,7 vzorku) v době zavádění této metody do naší praxe a obav z rizika pneumotoraxu a krvácení [3]. Optimální by bylo a je doporučováno odebírat 4–6 vzorků, u stadia I až 10 vzorků [3]. Výtěžnost TBB u stadia I je 55 %, zatímco u stadií II a III 70 % [3].
Terapie byla u našich nemocných indikována u postižení vitálně důležitých orgánů (srdce, mozek, oční formy nereagující na lokální léčbu), při hyperkalciurii a hyperkalcemii, plicním postižení stadia II a III s poruchou plicních funkcí a výrazné symptomatologii. Lékem první volby ve shodě s našimi postupy jsou systémové kortikosteroidy, samostatně a v kombinaci s dalšími imunosupresivy nebo biologická léčba [3,23–25].
Prognóza sarkoidózy je většinou příznivá. U 50–70 % pacientů se sarkoidózou dochází během 12–24 měsíců ke spontánní remisi choroby. V našem souboru to bylo u 65 (38, 5 %) nemocných; spontánní regrese byla zaznamenána nejčastěji u stadia I a II (tab. 4 a 5). V práci Kolka et al byl zaznamenán spontánní ústup nemoci v 19,6 % a ústup nemoci po léčbě v 58 % případů [9]. U zbývajících pacientů bývá tendence k chronicitě, tj. proces zůstává stacionární (chronická inaktivní forma) nebo progreduje (chronická aktivní forma) a vyžaduje terapii [6,7]. Spontánní remise (SR) u postižení respiračního traktu sarkoidózou je závislá na stadiu nemoci dle skiagramu hrudníku. Vzhledem k variabilitě přirozeného průběhu nemoci nelze pravděpodobnost spontánní remise určit přesně [26]. Löfgrenův syndrom jako akutní projev sarkoidózy mívá excelentní prognózu s více než 80 % SR [2,26]. U stadia I se pravděpodobnost SR pohybuje mezi 55 a 90 %, u stadia II se SR mezi 35 a 70 %, u stadia III mezi 10 a 20 % a u stadia IV je následná SR nepravděpodobná, protože jde o nevratné stadium plicní fibrózy [26–28]. U 20–30 % pacientů přechází nemoc do chronického stadia se symptomatickým průběhem nebo nutností léčby po dobu delší než 2 roky [6]. U 30–50 % nemocných dochází k vyléčení po nasazení kortikoterapie. Krátkodobý pozitivní efekt nízké dávky kortikoidní léčby je popisován v četných studiích u nemocných symptomatických s příznaky kašle, bolestí kloubů nebo teplotami [6,29]. Nicméně dlouhodobý benefit kortikoidní léčby je obtížně hodnotitelný vzhledem k variabilitě přirozeného průběhu nemoci s tendencí ke spontánní remisi, riziku návratu nemoci po skončení kortikoterapie a závažným nežádoucím vedlejším účinkům dlouhodobé léčby kortikoidy [6]. Riziko relapsů nemoci (16–70 %) je vyšší u léčených nemocných při snižování dávky kortikoidů nebo do 2 let po ukončení terapie [6,29]. Ve studii MORSA byla pozorována recidiva onemocnění sarkoidózou u 10 % nemocných [9]. V naší analýze to bylo 11 % léčených.
Vyšetření BAT u sarkoidózy nemá jednoznačný prognostický význam [30,31]. Dle některých prací se jeví, že lepší prognózu mají nemocní s vyšším IRI a malým počtem eozinofilů a neutrofilů [21,22]. Vyšší hodnota IRI u našich pacientů byla spojena s lepší prognózou a tendencí ke spontánní regresi, což souvisí se zastoupením Löfgrenova syndromu ve skupině s vyšším IRI. U pacientů s nálezem neutrofilní alveolitidy jsme zaznamenali závažnější postižení s nutností nasazení léčby a jejím dlouhodobějším podáváním.
Letalita onemocnění se odhaduje na 1–4 % [6]. Tyto údaje jsou v korelaci s našimi výsledky. Příčinou smrti bývá respirační selhání při pokročilé plicní fibróze, hemoptýza s krvácením do plicního parenchymu nebo selhání srdce při postižení srdce sarkoidózou.
Závěr
V naší retrospektivní studii jsme popsali soubor pacientů našeho regionu se sarkoidózou. Výsledky naší práce ukazují pestrost a variabilitu průběhu tohoto onemocnění. Jako příznivé prognostické faktory ovlivňující spontánní regresi se ukázaly věk pod 40 let, RTG stadium I a II, vyšší IRI v bronchoalveolární tekutině, plicní postižení včetně Löfgrenova syndromu. Pokud je u nemocných léčba nutná jen po dobu kratší než 2 roky, je naděje na vyléčení signifikantně vyšší než u nemocných s nutností léčby po dobu delší než 2 roky.
MUDr. Martina Doubková
www.fnbrno.cz
e-mail: doubkovamartina@seznam.cz
Doručeno do redakce: 12. 4. 2012
Přijato po recenzi: 7. 8. 2012
Sources
1. Hutchinson J. Anomolous disease of skin the fingers: case of livid papillary psoriasis. Illustration of Clinical Surgery. London: J & A Churchill 1878.
2. Hunninghake GW, Costabel U, Ando M et al. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasc Diffuse Lung Dis 1999; 16 : 149–173.
3. Bradley B, Branley HN, Egan JJ et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax 2008; 63 (Suppl 5): v1–v58.
4. Petrek M, Kolek V, Szotkowska J et al. CC and C chemokine expression in pulmonary sarcoidosis. Eur Respir J 2002; 20 : 1206–1212.
5. Parisinos CA. Sarcoidosis is a TH1/TH17 multisystem disorder: wider implications. Thorax 2011; 66 : 1011–1012.
6. Baughman RP. Sarcoidosis. USA: Inform a Healthcare 2010.
7. Baughman RP, Teirstein AS, Judson MA et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164 : 1885–1889.
8. Kolek V et al. Sarkoidóza. Známé a neznámé. Praha: Avicenum 1998.
9. Kolek V, Hutyrová B, Lošťáková V. MORSA – multicentrická moravská studie epidemiologických trendů sarkoidózy 1991–2000. Stud Pneumol Phthiseol 2005; 65 : 17–20.
10. Rybicki BA, Iannuzzi MC, Frederick MM et al. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS). Am J Respir Crit Care Med 2001; 164 : 2085–2091.
11. Judson MA, Baughmann RP, Tierstein AS et al. Defining organ involvement in sarcoidosis: the ACCESS proposed instrument. ACCESS research group. A case control etiologic study of sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 1999; 16 : 75–86.
12. Newman LS, Rose CS, Bresnitz EA et al. A case control etiologic study of sarcoidosis: environmental and occupational risk factors. Am J Respir Crit Care Med 2004; 170 : 1324–1330.
13. Valeyre D, Soler P, Clerici C. Smoking and pulmonary sarcoidosis: effect of cigarette smoking on prevalence, clinical manifestations, alveolitis, and evolution of the disease. Thorax 1988, 43 : 516–524.
14. Doubková M, Binková I, Skřičková J. Je sarkoidóza spojena s vyšším výskytem nádorových onemocnění? Studia Pneumol Phtiseol 2011; 71 : 129–134.
15. Doubková M, Binková I, Skřičková J. Skrytá cystická fibróza u nemocného se sarkoidózou. Vnitř Lék 2012; 58 : 329–334.
16. Sharma OP. Sarcoidosis and other autoimmune disorders. Curr Opin Pulm Med 2002; 8 : 452–456.
17. James DG. In memoriam Sven Löfgren (1910––1978). Sarcoidosis 1988; 5 : 77–78.
18. Scadding J. Prognostic of intrathoracic sarcoidosis in England: a review of 136 cases after five years’ observation. Br Med J 1961; 2 : 1165–1172.
19. Costabel U, Ohshimo S, Guzman J. Diagnosis of sarcoidosis. Curr Opin Pulm Med 2008; 14 : 455–461.
20. Drajna M, Hutyrová B, Stejskal D et al. Použitie solubilného receptoru interleukínu 2 a sérového enzymu konvertujúceho angiotenzin v diagnostike a pri hodnotení vývoja sarkoidózy. Stud Pneumol Phthizeol 2009; 69 : 183–189.
21. Bjermer L, Rosenhall L, Angström T et al. Predictive value of bronchoalveolar lavage cell analysis in sarcoidosis. Thorax 1988; 43 : 284–288.
22. Costabel U, Bonella F, Ohshimo S et al. Diagnostic modalities in sarcoidosis: BAL, EBUS, and PET. Semin Respir Crit Care Med 2010; 31 : 404–448.
23. Lošťáková V, Kolek V, Vašáková M. Sarkoidóza – doporučený postup diagnostiky, terapie a sledování vývoje onemocnění. Sekce intersticiálních plicních procesů České pneumologické a ftizeologické společnosti. Dostupné na: www.pneumologie.cz.
24. Wells AU. Infliximab in extrapulmonary sarcoidosis: tantalising but inconclusive. Eur Respir J 2008; 31 : 1148–1149.
25. Sharma OP. Pulmonary sarcoidosis and corticosteroids. Am Rev Respir Dis 1993; 147 : 1598–1600.
26. Neville E, Walker AN, James DG. Prognostic factors predicting the outcome of sarcoidosis: an analysis of 818 patients. Q J Med 1983; 52 : 525–533.
27. Pietinalho A, Tukiainen P, Haahtela T et al. Oral prednisolone followed by inhaled budesonide in newly diagnosed pulmonary sarcoidosis: a double-bling, placebo-controlled multicenter study. Finnish Pulmonary Sarcoidosis Study Group. Chest 1999; 116 : 424–431.
28. Johns CJ, Michele TM. The clinical management of sarcoidosis. A 50-year experience at the Johns Hopkins Hospital. Medicine (Baltimore) 1999; 78 : 65–111.
29. Costabel U, Bross KJ, Guzman J et al. Predictive value of bronchoalveolar T-cell subsets for the course of pulmonary sarcoidosis. Ann N Y Acad Sci 1986; 465 : 418–426.
30. Lin YH, Haslam PL, Turner-Warwick M. Chronic pulmonary sarcoidosis: relationship between lung lavage cell counts, chest radiograph, and results of standard lung function test. Thorax 1985; 40 : 501–507.
31. Ziegenhagen MW, Rothe ME, Schlaak M et al. Bronchoalveolar and serological parameters reflecting the severity of sarcoidosis. Eur Respir J 2003; 21 : 407–413.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 10-
All articles in this issue
- Akutní infarkt myokardu u mladých – stala se někde chyba? – editorial
- Méně invazivní kardiochirurgické přístupy pro léčbu ischemické choroby srdeční – editorial
- Viscerální leishmanióza – editorial
- Festina lente! – editorial
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Existuje vzťah medzi zápalovými markermi, oxidačným stresom a pooperačnou fibriláciou predsiení?
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Hypoglykemie – fenomén, nad kterým moderní diabetologie pomalu vítězí
- AII antagonisté (candesartan a irbesartan) v léčbě kardiovaskulárních onemocnění
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
- Vysoké podezření na ICHS získané anamnézou nesmí vyvrátit negativita některých objektivních vyšetřovacích metod – zkušenost ambulantního internisty
- Dabigatran-etexilát v klinické praxi pro prevenci tromboembolických příhod u nemocných s fibrilací síní
- Efekt ivabradinu na tepovou frekvenci, vývoj funkce levé komory a koncentraci NT-proBNP u pacientů se systolickým chronickým srdečním selháním – příklady z praxe
- Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fyziologická úloha vitaminu C ve vztahu ke složkám imunitního systému
- Diagnostika, prognostické faktory a léčba sarkoidózy – retrospektivní analýza
- Akutní infarkt myokardu u mladých nemocných – závažné nedostatky v systému akutní a následné péče
- Febrilní pancytopenie a hepatosplenomegalie jako hlavní symptomy viscerální leishmaniózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

