-
Medical journals
- Career
Diabetes, dyslipidemie a onemocnění ledvin
Authors: R. Češka 1; V. Tesař 2
Authors‘ workplace: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 1; Nefrologická klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Vladimír Tesař, DrSc. 2
Published in: Vnitř Lék 2008; 54(5): 511-517
Category:
Předneseno na 9. celostátním diabetologickém sympoziu „Diabetes a urogenitální systém“ ve dnech 1.-2. června 2007 v Novém Adalbertinu v Hradci Králové.
Overview
Dyslipidemie (DLP) představuje nejvýznamnější rizikový faktor kardiovaskulárních onemocnění (KVO). Stejně tak diabetes mellitus (DM) je považován za tak silný ukazatel rizika KVO, že je v různých systémech odhadu globálního kardiovaskulárního (KV) rizika kladen na roveň sekundární prevence KVO. A konečně nejnověji zmiňovaným rizikem manifestace KVO se stává i onemocnění ledvin. Podle některých doporučení jsou nemocní s onemocněním ledvin stejně rizikoví jako pacienti s manifestní ICHS (nebo jinou manifestací aterosklerózy) a pacienti s DM. Toto sdělení si neklade nároky na řešení složitého vztahu DLP, DM a nefropatií. Chce jen upozornit na to, že se jedná o problematiku živou, významnou, která se postupně dostává do centra pozornosti. V první části je diskutována především diabetická DLP a možnosti jejího ovlivnění. V další části pak otázka DLP u onemocnění ledvin, její rizikovosti, možnosti ovlivnění a posléze i výsledky prvních intervenčních studií. Ty se zabývaly jednak vlivem léčby hypolipidemiky na KV riziko nemocných, jednak podílem hypolipidemik na zlepšení či udržení renálních funkcí, nebo jaký je jejich vliv na markery renálního postižení.
Klíčová slova:
dyslipidemie - renální insuficience - nefropatie - albuminurie - statiny - fibráty - ezetimib - hypolipidemikaLipidy jako rizikový faktor kardiovaskulárních onemocnění - jak je to u DM a metabolického syndromu?
Význam dyslipidemie (DLP) a hyperlipoproteinemie (HLP) spočívá především v tom, že jsou významnými rizikovými faktory (RF) kardiovaskulárních onemocnění (KVO). O dominantním DLP postavení mezi rizikovými faktory svědčí výsledek INTERHEART study [1].
Tato studie zasadila velkou ránu stálým „hledačům“ nových, zajímavých rizikových faktorů. Přes 90 % KV příhod je totiž možno predikovat na základě těch klasických, všem známých rizikových faktorů: DLP, hypertenze, DM a kouření cigaret. Přitom právě DLP hrála zcela dominantní úlohu. I když byla v INTERHEART studii HLP reprezentována poměrem ApoB/ApoAI (který bychom mohli pro srozumitelnost přeložit jako poměr LDL/HDL), je stále považován za základní lipidový rizikový faktor LDL-cholesterol. Ten však sám o sobě nebývá u DM a metabolického syndromu významněji zvýšen. Jak je to tedy s rizikovostí diabetické DLP?
Diabetická DLP jako rizikový faktor KVO
Diabetickou DLP můžeme charakterizovat jako DLP s hypertriglyceridemií, nízkým HDL-cholesterolem, zvýšenou koncentrací apolipoproteinu B (v budoucnu bude třeba se zaměřit na měření hladiny apolipoproteinu B), výskytem malých denzních LDL-částic (tab.1).
Table 1. Diabetická dyslipidemie. 
Dyslipidemie při metabolickém syndromu a diabetu může být potencována tím, že pacient má genetickou vlohu, familiární kombinovanou hyperlipidemii, nebo familiární hypertiglyceridemii (FCH, FHTG). Pokud se někdy hovoří o preventivním účinku pití malého množství alkoholu pro rozvoj kardiovaskulárních onemocnění, rozhodně to neplatí pro nemocné s diabetickou DLP s hypertriglyceridemií. Význam pro potencování DLP má hypotyreóza a zajímavé je, že v diabetické populaci je těžší u žen než u mužů.
LDL-částice nejsou jednotnou populací. Máme malé denzní, vysoce aterogenní, a lehké LDL-částice [Dense LDL III, denzity 1,04-1,06 kg/l (26 nm), Intermediate LDL II, denzity 1,03-1,04 kg/l (26,6 nm), Light LDL I, denzity 1,02-1,03 kg/l (17 nm)].
Výskyt malých denzních částic může někdy komplikovat odhad rizika u nemocných s DM. Ti mohou být ve vysokém riziku KVO navzdory „normální“ celkové hladině LDL (schéma 1). Obecně je akceptován fakt, že diabetická DLP, respektive riziko DM je z hlediska KVO extremně vysoké [2-4].
Schéma 1. „Normální“ hladiny LDL-C u DM mohou být zavádějící... Malé denzní částice LDL-C vykazují vyšší aterogenicitu. 
Apolipoprotein B, majoritní apolipoprotein částic LDL, je zastoupen stejně v malé denzní částici i ve velké. Máme-li hodně malých denzních částic, při stejné koncentraci LDL-cholesterolu celkově, máme zvýšené riziko. Jediným rozdílem bude apolipoprotein B (graf.1). Právě proto bude užitečné, podaří-li se rozšířit paletu vyšetřovacích metod o dostupné a nikterak nákladné vyšetření apo B i v širší klinické praxi.
Graph 1. Riziko výskytu ICHS v závislosti na koncentraci apo B a největším průměru částic LDL. 
Ischemickou chorobu srdeční nacházíme u osob, které mají malé denzní částice a zvýšené koncentrace apolipoproteinu B.
Zastoupení malých denzních LDL-částic nezávisí na celkové hladině LDL-cholesterolu, naproti tomu je velice závislá na hladině triglyceridů - malé denzní částice se vyskytují právě u nemocných s hypertriglyceridemií, výrazně se zvyšuje od koncentrace triglyceridů od 1,5-1,7 mmol/l [5].
Terapie DLP u diabetika
Léčba diabetické dyslipidemie je jak nefarmakologická - dieta, pohyb a opatření proti kouření, tak farmakologická. U nefarmakologické léčby je podstatný pokles tělesné hmotnosti. Není důležité mířit na cílové hodnoty nereálné pro naše pacienty, ale je třeba vědět, že snížení váhy o 10 % vede ke 30% snížení abdominálního viscerálního tuku, což povede k výraznému snížení kardiovaskulárního rizika. Velkou roli bude hrát i normalizace lipidů.
Z farmakologických přípravků používáme nejčastěji statiny a fibráty. U statinů se opíráme o subanalýzy některých studií (tab. 2). Ať již šlo o Heart Protection Study, ASCOT, 4S či další studie s atorvastatinem, simvastatinem i pravastatinem, vidíme, že diabetici mají z léčby minimálně stejný prospěch jako nediabetici.
Table 2. Účinnost vybraných statinů u diabetiků. 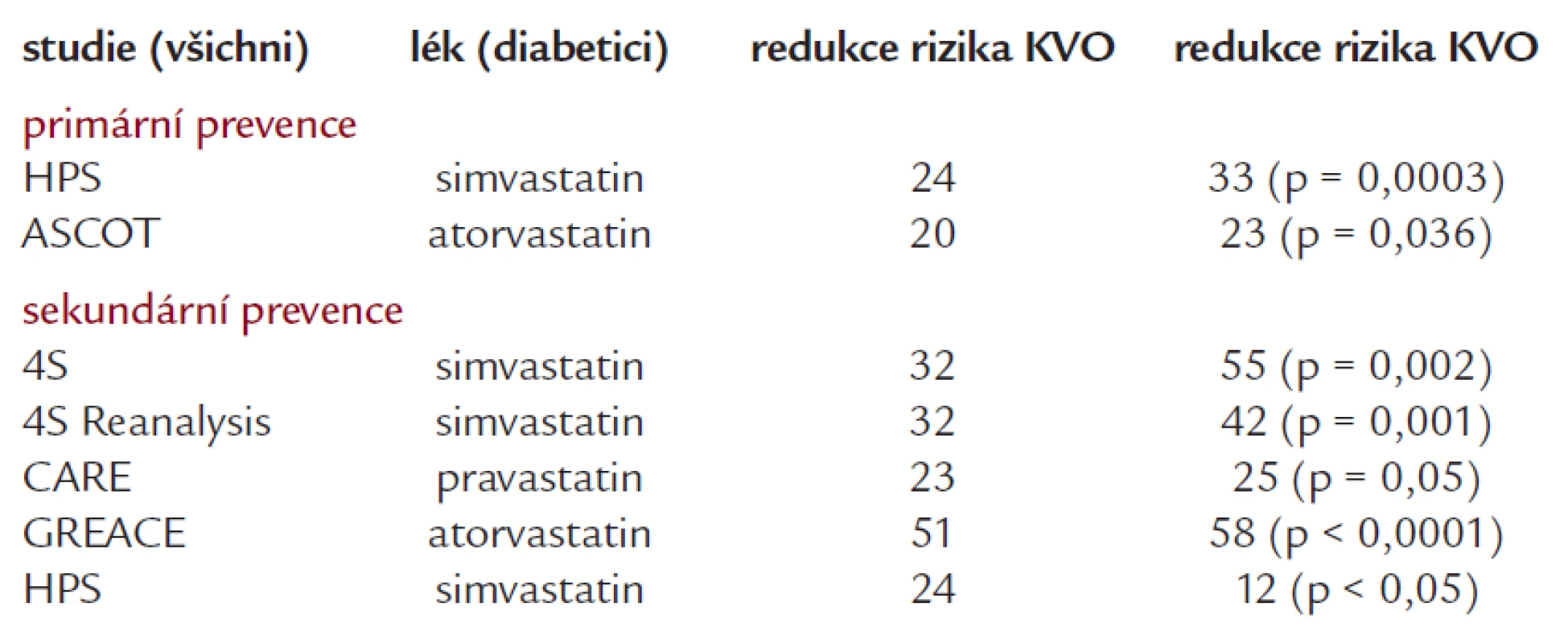
První studií u diabetiků byla studie CARDS. U 3 000 nemocných (2 838) (graf. 2) bylo podáváno 10 mg atorvastatinu. Nemocní neměli dramaticky zvýšené hodnoty lipidů, celkový cholesterol 5,35 mmol/l, LDL-cholesterol 3 mmol/l, HDL-cholesterol 1,4 mmol/l. Cílové hodnoty LDL-cholesterolu pod 2,5 dosáhlo 75 % pacientů a dokonce 25 % pacientů mělo LDL-cholesterol pod hodnotou 2 mmol/l.
Graph 2. Vliv atorvastatinu na primární „end point“: závažné KV příhody včetně cévní mozkové příhody studie CARDS. 
Ve studii CARDS bylo prokázáno, že atorvastatin v dávce 10 mg redukoval závažné kardiovaskulární příhody o 37 %, cévní mozkové příhody o 48 % a celkovou mortalitu o 27 %. Jde jistě o pádný důvod pro léčbu diabetiků statinem.
Jak je to s účinky fibrátů? Fibráty ovlivňují aktivitu PPAR receptorů. Zvyšují koncentraci apolipoproteinu AI, tím zvyšují koncentraci HDL-cholesterolu. Snižují apolipoprotein CIII, tím snižují koncentraci triglyceridů a zvětšují velikost LDL-částic. Zvyšují aktivitu lipoproteinové lipázy, což vede ke snížení koncentrace triglyceridů a zvýšení koncentrace HDL-cholesterolu. Zvýšená aktivita lipoproteinové lipázy zlepšuje postprandiální lipemii.
Fenofibrát byl u diabetiků poprvé studován v menší studii DAIS. Jde o angiograficky dokumentovanou studii.
Studie DAIS, angiograficky dokumentovaná, ukázala u 418 nemocných následující výsledky. Z hlediska kardiovaskulárních příhod došlo k 23% redukci (úmrtí, infarkt myokardu, PTCA, chirurgické revaskularizace). Nicméně šlo o malou studii.
Ve studii FIELD (The Fenofibrate Intervention and Event Lowering in Diabetes) se investigátoři zaměřili na účinky přidání fenofibrátu k zavedené léčbě diabetiků, u kterých však nebyla indikována v době zařazení do studie hypolipidemická terapie. Do studie bylo zařazeno téměř 10 000 nemocných, rozdělených do 2 větví: fenofibrátové (200 mg denně) a placebové [6]. Během studie bylo možno přidat nemocným další, nestudiovou hypolipidemickou léčbu, včetně statinů, které pak užívala více než 1/3 nemocných v placebové větvi (2krát více než ve větvi fenofibrátové). Primární cílový parametr (úmrtí na ICHS a nefatální infarkt myokardu) se snížil statisticky nevýznamně o 11 %, všechny kardiovaskulární příhody poklesly o 11 %, statisticky významně (p < 0,035). Tento pokles všech kardiovaskulárních příhod byl v souvislosti především s významným snížením revaskularizací o 21 % (p < 0,003).
Fibráty nejsou statiny a nemají tak významný kardioprotektivní potenciál. Fibráty mohou k zavedené léčbě statiny přinést další aditivní účinek, pro kombinační léčbu statinem a fibrátem tedy důvody jsou. Především by tato kombinace byla užitečná asi u pacientů s kombinací nízkého HDL-cholesterolu a vysoké hladiny triglyceridů. Ve studii FIELD nebyla zaznamenána jediná myopatie.
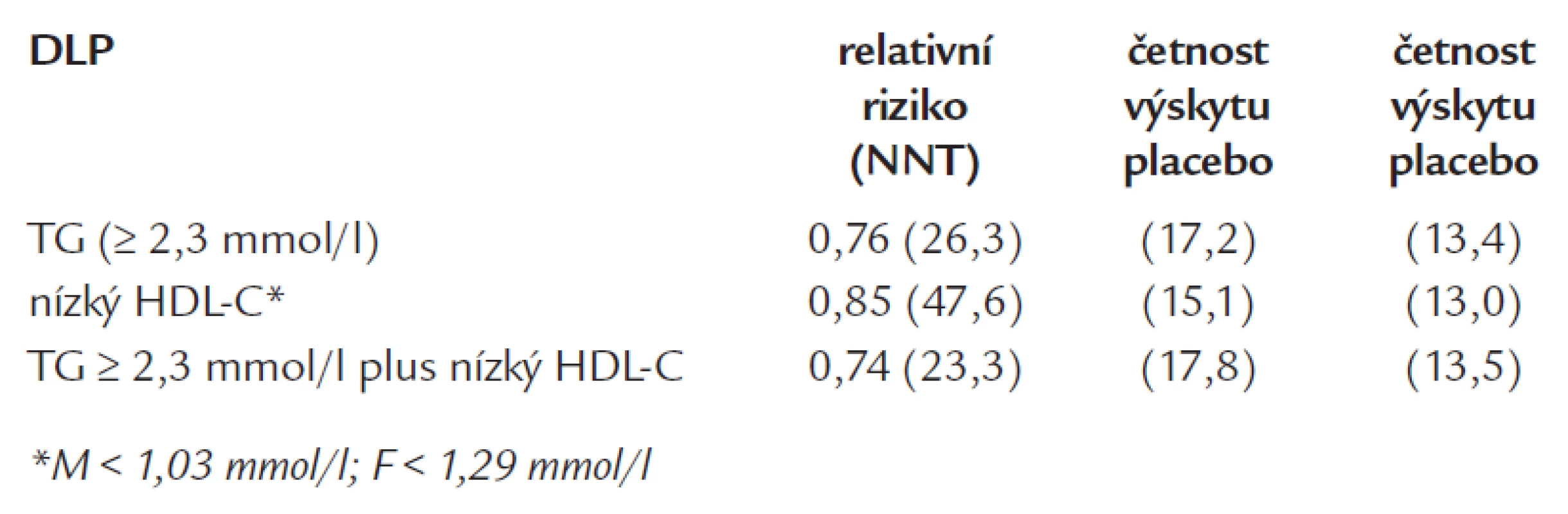
Studie FIELD byla mnohými kritizována především pro zařazení ne zcela vhodné skupiny nemocných. Teprve pozdější analýzy prokázaly, že skutečný profit měli ve studii skutečně ti, u kterých to bylo lze očekávat, tedy pacienti s nízkým HDL-cholesterolem, zvýšenými triglyceridy a vůbec typickou diabetickou DLP (tab. 3).
Statistické významnosti dosáhla redukce mikrovaskulárních komplikací diabetu, poklesl počet laserových ošetření retinopatií [7] a v aktivně léčené skupině byl i významně nižší výskyt mikroalbuminurie (graf. 3). A na tomto místě bychom se vlastně mohli zastavit a od problematiky diabetické DLP přejít k onemocnění ledvin, která ostatně velmi často s DM a potažmo i s DLP (a negativní KV prognózou) souvisí.
Graph 3. FIELD: Důkazy pro ovlivnění mikrovaskulárních komplikací DM. Účinky nezávislé na stupni glykemické kontroly (HbA1c), současně podávané léčbě nebo snížení krevního tlaku! 
DLP a onemocnění ledvin
Onemocnění ledvin je významným rizikovým faktorem KVO, předčasné manifestace ICHS a dalších aterosklerotických onemocnění. Předčasná manifestace ICHS je vedoucí příčinou úmrtí u pacientů po transplantaci ledvin. Rovněž dialyzovaní nemocní mají dramaticky vyšší mortalitu na KVO ve srovnání s běžnou populací (graf. 4).
Graph 4. Roční kardiovaskulární mortalita (%) u dialyzovaných pacientů a v běžné populaci. 
Dokonce již mírná až střední renální insuficience je spojena se zvýšením kardiovaskulární morbidity a mortality (graf. 5).
Graph 5. Již mírná až střední renální insuficience je spojena se zvýšenou kardiovaskulární morbiditou a mortalitou. Studie HOPE. Citováno podle [17]. ![Již mírná až střední renální insuficience je spojena se zvýšenou kardiovaskulární morbiditou a mortalitou.
Studie HOPE. Citováno podle [17].](https://pl-master.mdcdn.cz/media/image/c45ae20c0b232af4d8f86abd8b99d541.jpg?version=1537796505)
Co se podílí na zvýšeném kardiovaskulárním riziku nemocných s nefrologickým onemocněním? Jistě je to příčin více. Z hlavních jmenujme arteriální hypertenzi, dyslipidemii, možná i hyperhomocytseinemii, fibrinogen, akcelerovaný zánět, malnutrici, hyperfosfatemii, oxidační stres a další. DLP u nefropatií má podobný charakter jako DLP u DM, s vysokou koncentrací apo B a zvýšeným zastoupením „malých denzních LDL“.
Z hlediska ovlivnění DLP - zlepšení prognózy a kardiovaskulárního rizika nemáme zdaleka tolik pozitivních důkazů jako u obecné populace nebo u diabetiků. U nemocných po transplantaci ledviny byla provedena studie ALERT. V této studii vedla léčba fluvastatinem ke snížení kardiálního úmrtí a infarktu myokardu o 35 % za snížení LDL-cholesterolu o 32 % (graf. 6).
Graph 6. Kumulativní incidence srdeční smrti ve studii ALERT. Citováno podle [18]. ![Kumulativní incidence srdeční smrti ve studii ALERT. Citováno podle [18].](https://pl-master.mdcdn.cz/media/image/b03969c7812f93bd63ebd8daea7f93d4.jpg?version=1537795964)
Ve studii „4D“ bylo 1 200 diabetiků 2. typu ve věku 18-80 let, léčených hemodialýzou (HD) < 2 roky, s LDL-cholesterolem 2,1-4,9 mmol/l a triglyceridy < 11,4 mmol/l randomizováno k léčbě atorvastatinem (20 mg) nebo placebem se střední dobou sledování asi 2,5 roku [9].
Primární parametr byla kardiovaskulární smrt, sekundární parametry byly celková mortalita, nefatální kardiovaskulární příhody, cerebrobaskulární příhody a střední procentuální změna lipidů proti vstupní hodnotě. Závěry můžeme shrnout následovně:
Průměrný věk pacientů byl 65,7 let, BMI 27, HbA1c 6,8 %, albumin 38 g/l, Hb 109 g/l, TK 145/76 mm Hg, 17 % pacientů bylo po IM, 30 % mělo ICHS, 35 % srdeční selhání NYHA II-III, CMP prodělalo 18 %, ICHDK mělo 44 %, 50 % pacientů užívalo ACEI a 50 % pacientů užívalo antiagregancia.
U pacientů léčených atorvastatinem klesl celkový cholesterol z 5,63 na 3,9 mmol/l, LDL-cholesterol z 3,18 na 1,89 mmol/l, triglyceridy klesly z 3,17 na 2,91 mmol/l, u pacientů léčených placebem se srovnatelné vstupní parametry během sledování nezměnily.
Primární parametr - kardiovaskulární smrt se během 5,5 roku snížil nevýznamně o 8 %, všechny kardiální příhody klesly významně o 18 %, cerebrovaskulární příhody stouply nevýznamně o 33 %.
Léčba byla bezpečná, významný vzestup CK byl zaznamenán jen u několika nemocných, rabdomyolýza nebyla zaznamenána vůbec.
Na přesvědčivější výsledky si (snad) počkáme do zveřejnění dalších studií - studie AURORA (rosuvastatin) a studie SHARP (kombinace ezetimib + simvastatin).
Přece jen nějaké pozitivní výsledky přinesly výsledky studií, které sledovaly možnost ovlivnění renální funkce hypolipidemickou léčbou statiny i fibráty. Tonelli sledoval vliv léčby pravastatinem na renální funkce u pacientů se střední chronickou renální insuficiencí a kardiovaskulárním onemocněním. 4 159 pacientů po IM, se sérovým cholesterolem < 6,3 mmol/l randomizovaných k léčbě pravastatinem nebo placebem (studie CARE) bylo rozděleno podle kalkulované glomerulární filtrace.
U celé skupiny pacientů s GF < 60 ml/min nebyl zjištěn významný vliv pravastinu na progresi chronické renální insuficience.
U pacientů s GF < 50 ml/min ale byla rychlost progrese chronické renální insuficience u pacientů léčených pravastatinem významně nižší než u pacientů léčených placebem.
V další studii pak byl na menším počtu nemocných ověřován vliv atorvastatinu. 56 proteinurických pacientů s CHRI bylo randomizováno k roční léčbě atorvastatinem nebo placebem. Všichni pacienti byli současně léčeni ACEI nebo AIIA.
Proteinurie klesla a GF zůstala stabilní u pacientů léčených atorvastatinem, u pacientů léčených placebem se proteinurie nezměnila a došlo k poklesu GF.
Atorvastatin snížil rychlost progrese CHRI u pacientů léčených ACEI nebo AIIA.
Obdobná data získal pro fibráty (gemfibrozil), subanalýzou studie VA-HIT opět Tonelli. 2 531 pacientů s ischemickou chorobou srdeční, HDL-cholesterol < 1,0 mmol/l a LDL-cholesterol < 3,6 mmol/l bylo randomizováno k léčbě gemfibrozilem nebo placebem (studie VA-HIT). 1 046 pacientů mělo clearance kreatininu < 75 ml/min (30-75 ml/min). Gemfibrozil snížil (u celé sledované populace) incidenci primárního sledovaného parametru (fatálního nebo nefatálního infarktu myokardu) o 27 %. U pacientů s CHRI snížil gemfibrozil riziko fatálního a nefatálního infarktu myokardu a cévní mozkové příhody o 26 %, neovlivnil ale celkovou mortalitu a potřebu koronárních revaskularizací. Výskyt nežádoucích účinků byl stejný u pacientů léčených gemfibrozilem i placebem, u pacientů léčených gemfibrozilem ale došlo častěji k trvalému vzestupu sérového kreatininu (5,9 vs 2,8 %). Analýza byla provedena u podskupiny 399 pacientů, kteří měli vstupní kalkulovanou glomerulární filtraci 30-59 ml/min a u kterých byly dostupné v průběhu 5letého sledování opakované hodnoty sérového kreatininu. Rychlost ztráty glomerulární filtrace se mezi pacienty léčenými gemfibrozilem a placebem nelišila, a to ani v podskupinách nemocných definovaných dle hladin sérových lipidů, vstupní renální funkce, přítomnosti diabetu či metabolického syndromu, a to i po vyloučení 5 pacientů se vzestupem CK, u kterých mohl být akutní vzestup sérového kreatininu důsledkem rabdomyolýzy. Ve výskytu trvalého zvýšení sérového kreatininu se pacienti léčení gemfibrozilem a placebem nelišili.
Pro fenofibrát jsou podobná data dostupná ze subanalýzy studie DAIS. Mikroalbuminurie byla měřena v ročních intervalech u 314 pacientů s diabetem 2. typu, kteří byli randomizováni k léčbě fenofibrátem nebo placebem. 214 pacientů mělo vstupně normoalbuminurii, 97 pacientů bylo mikroalbuminurických. V průběhu sledování (střední doba 38 měsíců) došlo k progresi albuminurie u 18 % pacientů léčených placebem, ale jen u 8 % pacientů léčených fenofibrátem. Na tomto efektu se podílelo zejména nižší riziko progrese normoalbuminurie do mikroalbuminurie (20/113 vs 3/101, p < 0,001).
Význam hypolipidemické léčby je u nemocných s renálním onemocněním v současné době ověřován v řadě studií. U diabetiků již víme, že prognózu lze hypolipidemickou léčbou významně zlepšit.
Pokusme se na závěr shrnout léčbu diabetické DLP (schéma 2):
Schéma 2. Farmakologická léčba DLP při DM. 
Hlavním cílem je LDL-cholesterol. Budeme jej ovlivňovat především statiny nebo kombinací statiny + ezetimib. Dalším cílem je zvýšit HDL-cholesterol, užijeme především niacin (v kombinaci s laropiprantem k blokaci nežádoucích účinků), ev. fibrát. Dále je třeba snížit triglyceridy. Optimální kompenzací glykemie, stále platí také indikace fibrátů, dále niacin a ω-3 mastné kyseliny. Podstatný je fakt, že budoucnost patří kombinační léčbě (schéma 3).
Schéma 3. Farmakologická léčba diabetické DLP– kombinace. 
U diabetické dyslipidemie budeme kombinovat ke snížení LDL-cholesterolu statin s ezetimibem, statin s pryskyřicí ev. statin s niacinem. Ke zvýšení HDL-cholesterolu se bude podávat nejčastěji fibrát nebo niacin a ve většině případů jej budeme kombinovat se statinem. Ke snížení triglyceridů budeme kombinovat antidiabetika, hypolipidemika; fibrát, statin, niacin i ω-3 mastné kyseliny.
U nemocných s renální insuficiencí je třeba redukovat dávky některých hypolipidemik. Základní informace nám poskytne tab. 4.
Table 4. Hypolipidemika – dávkování při snížené renální funkci. 
Práce byla podpořena grantem NB 7392-3 IGA MZ ČR.
prof. MUDr. Richard Češka, CSc.
www.vfn.cz
e-mail: rcesk@lf1.cuni.cz
Doručeno do redakce: 14. 4. 2008
Sources
1. Yusuf S et al. INTERHEART. Lancet 2004; 364 : 937–952.
2. A Joint Editorial Statement by the ADA, NHLBI, AHA et al. Diabetes mellitus: A major risk factor for cardiovascular disease. Circulation 1999; 100 : 1132–1133.
3. Haffner SM. Coronary heart disease in patients with diabetes. N Engl J Med 2000; 342 : 1040–1042.
4. Executive summary of the third report of the NCEP expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult treatment panel III). JAMA 2001; 285 : 2486–2497.
5. Češka R et al. Cholesterol a ateroskleróza, léčba dyslipidémií. Praha: Triton 2005.
6. The FIELD Study Investigators. Lancet [Early Online Publication]. November 14, 2005.
7. Keech AC, Mitchell P, Summanen PA et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007; 370 : 1687–1697.
8. Holdaas H et al. The ALERT study. Lancet 2003; 361 : 2024–2031.
9. Wanner Z et al. Die Deutsche Diabetes Dialyse Studie (4D). Kidney Int 2003, 14 : 1605–1613.
10. O’Keefe JH et al. Improving the adverse cardiovascular prognosis of type 2 diabetes. Mayo Clin Proc 1999; 74 : 171–180.
11. Austin MA, Edwards KL. Small, dense low density lipoproteins, the insulin resistance syndrome and noninsulin–dependent diabetes. Curr Opin Lipidol 1996; 7 : 167–171.
12. Austin MA et al. Low-density lipoprotein subclass patterns and risk of myocardial infarction. JAMA 1988; 260 : 1917–1921.
13. Sniderman AD et al. Hypertriglyceridemic hyperapoB in type 2 diabetes. Diabetes Care 2002; 25 : 579–582.
14. Lamarche et al. Small, dense lowdensity lipoprotein particles as a predictor of the risk of ischemic heart disease in men. Prospective results from the Québec Cardiovascular Study. Circulation 1997; 95 : 69–75.
15. Colhoun HM, Betteridge DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004; 364 : 685–696.
16. Keech A. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005; 366 : 1849–1861.
17. Mann et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001, 134 : 629–636.
18. Holdaas et al. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo - controlled trial. Lancet 2003; 361 : 2024–2031.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 5-
All articles in this issue
- Hemokoagulace a renální insuficience, hemokoagulace a diabetes mellitus 2. typu
- Urologické výkony u diabetika
- Nádory ledvin, močového měchýře a prostaty u obezity a diabetu
- Bariatrická chirurgie a ledviny
- Systém renin-aldosteron v tuku a v dalších orgánech a tkáních
- Diabetes, dyslipidemie a onemocnění ledvin
- Specifické problémy u dialyzovaných diabetiků v ambulantní praxi
- Specifické aspekty peritoneální dialýzy u diabetiků
- Edukace diabetiků v renálním selhání a po transplantaci
- Metformin a ledviny
- Využití orgánově specifických substrátů u onemocnění ledvin diabetika
- Výživa diabetika s onemocněním ledvin
- Imunita na sliznicích se zřetelem na sliznici urogenitálního traktu a diabetes
- Viscerální diabetická neuropatie urogenitálního traktu
- Erektilní dysfunkce, její vztah k diabetu a její řešení v roce 2007
- Epidemiologie diabetické nefropatie
- Vyšetření ledvin u diabetika
- Diabetes mellitus, hypertenze a ledviny
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metformin a ledviny
- Hemokoagulace a renální insuficience, hemokoagulace a diabetes mellitus 2. typu
- Specifické problémy u dialyzovaných diabetiků v ambulantní praxi
- Vyšetření ledvin u diabetika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career