-
Medical journals
- Career
Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
Authors: J. Widimský Jr 1; T. Zelinka 1; O. Petrák 1; B. Štrauch 1; L. Šafařík 2; M. Kasalický 3; A. Vranková 1; R. Holaj 1
Authors‘ workplace: Centrum pro hypertenzi III. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 1; Urologická klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Jan Dvořáček, DrSc. 2; I. chirurgická klinika 1. lékařské fakulty UK a VFN Praha, přednosta doc. MUDr. Jan Šváb, CSc. 3
Published in: Vnitř Lék 2007; 53(4): 428-433
Category: Reviews
Overview
Feochromocytom je relativně vzácná příčina arteriální hypertenze. Neléčený feochromocytom může však vést až k fatální hypertenzní krizi v průběhu anestezie či jiných forem stresu. Je proto důležitá náležitá diagnostika tohoto onemocnění. Již 24hodinové monitorování krevního tlaku (TK) může přispět k diagnostice feochromocytomu s ohledem na často se vyskytující zvýšenou variabilitu TK a absenci nočního poklesu TK. Dosud byly identifikovány mutace 5 genů, zodpovědných za vznik familiárních forem feochromocytomu: mutace genu von Hippel-Lindau (VHL), vedoucí ke vzniku VHL-syndromu, mutace RET-protoonkogenu u mnohočetné endokrinní adenomatózy 2. typu, mutace typu 1 genu pro neurofibromatózu, který je asociován s von Recklinghausenovým onemocněním a konečně mutace genů kódujících B - a D-subjednotky mitochondriální sukcinát-dehydrogenázy (SDHB, SDHD), které se vyskytují u familiární paragangliomatózy a feochromocytomu. Genetická analýza by se proto měla provádět u všech potvrzených případů feochromocytomu, zejména u mladších osob do 50 let věku. Biochemická diagnostika se opírá zejména o stanovení plazmatických volných metanefrinů nebo močových frakcionovaných metanefrinů, které mají obvykle vyšší diagnostickou výtěžnost ve srovnání s plazmatickými, popřípadě močovými katecholaminy. V diagnostice extraadrenálních či mnohočetných forem se kromě CT/MRI uplatňuje zobrazení pomocí radiofarmaka 123I-metaiodobenzylguanidinu (MIBG) nebo pomocí 18F-fluorodopaminu PET (dostupné jen v USA). Farmakologická léčba pomocí blokátorů alfa-, popřípadě i beta-receptorů s následnou laparoskopickou exstirpací tumoru bývá u benigních forem feochromocytomu obvykle úspěšná. Bohužel u maligních forem nejsou stále k dispozici přesvědčivě účinné léčebné přístupy.
Klíčová slova:
feochromocytom - krevní tlak - genetická analýza - diagnostika - léčbaÚvod
Feochromocytom je považován za vzácnou formu arteriální hypertenze. Nálezy z velkých autoptických studií v Austrálii a na Novém Zélandě svědčí pro velmi nízký výskyt tohoto tumoru [1]. Odhady prevalence feochromocytomu u hypertenzní populace se pohybují mezi 0,01 % až 0,1 %. Ve specializovaných centrech jsou pochopitelně tato čísla vyšší [2].
Ačkoliv je feochromocytom relativně vzácným onemocněním, je jeho správná diagnostika a léčba mimořádně důležitá. Nerozpoznané a neléčené případy feochromocytomu mohou vést v průběhu anestezie či jiné formy stresu až k fatální hypertenzní krizi [3]. Důležitá je i skutečnost, že přibližně 10 % všech feochromocytomů je nacházeno zcela náhodně (incidentalomy) a asi 5 % všech incidentalomů jsou ve skutečnosti feochromocytom [4].
Změny krevního tlaku
Trvalá (fixovaná) hypertenze bývá častější než paroxyzmální. Nemocní s fixovanou hypertenzí mívají však navíc epizody výrazně zvýšeného krevního tlaku, které mohou být vyvolány různými podněty (fyzická námaha, anestezie, kouření, močení, defekace nebo tlakové podněty na abdominální oblast).
V klinické praxi je vžitá představa, že nemocní s feochromocytomem mívají často sklon k hypertenzi, rezistentní na farmakologickou léčbu. Epizody zvýšené produkce/uvolňování katecholaminů sice mohou někdy vést ke krátkodobým vzestupům krevního tlaku (TK) s TK až přes 250/150 mm Hg, avšak průměrný 24hodinový TK bývá obvykle nižší ve srovnání s jinými formami endokrinní hypertenze typu primárního hyperaldosteronizmu nebo Cushingova syndromu anebo ve srovnání s esenciální hypertenzí [5]. U většiny feochromocytomů je rezistence na farmakologickou léčbu vzácná.
Cirkadiánní rytmus TK je u feochromocytomu vymizelý díky absenci nočního poklesu TK, či dokonce v některých případech díky zvýšenému TK v nočních hodinách oproti denní době [5]. Tato 24hodinová charakteristika TK pomocí 24hodinového ambulantního monitorování krevního tlaku (AMTK) může být považována za nepřímý diagnostický marker feochromocytomu, neboť podobné změny 24hodinového profilu TK nejsou pozorovány u dalších forem endokrinní hypertenze [5]. Normotenze se u feochromocytomu může vyskytovat u asymptomatických nemocných [6], absence zvýšeného TK bývá vysvětlována desenzitizací adrenergních receptorů díky dlouhodobě zvýšeným hladinám katecholaminů v cirkulaci. Je zajímavé, že normotenzní případy feochromocytomu mají rovněž vymizelý pokles TK v nočních hodinách [6].
Katecholaminy jsou u hypertoniků spolu s některými dalšími faktory zodpovědné jak za krátkodobé, tak i dlouhodobé zvýšení krevního tlaku. Stanovení variability TK může být u hypertenzních pacientů užitečné v odhadu kardiovaskulárního rizika, protože se ukazuje, že zvýšená variabilita TK je samostatným rizikovým faktorem kardiovaskulární mortality a morbidity [7]. Nadprodukce katecholaminů je u pacientů s feochromocytomem často spojena s vyšší dlouhodobou variabilitou TK ve srovnání s esenciální hypertenzí. Tato skutečnost je nejmarkantnější u osob s invertovaným cirkadiánním rytmem TK [8]. Úspěšné odstranění nádoru vede k normalizaci zvýšené variability TK [8].
Vyšetření pomocí AMTK může tak být u feochromocytomu diagnosticky přínosné s ohledem na popsané změny 24hodinového rytmu TK a zvýšenou variabilitu TK.
Familiární syndromy
Dříve se odhadovalo, že familiární formy feochromocytomu se vyskytují relativně zřídka, maximálně do 10 % všech případů. Nedávná studie provedená převážně ve střední Evropě na velkém vzorku zdánlivě sporadických forem feochromocytomu nalezla však relativně vysokou prevalenci (24 %) mutací jednoho ze 4 genů známých pro výskyt familiárních forem feochromocytomu [9]. Celkově do dnešního dne jsou popsány mutace 5 genů, které mají přímý vztah ke vzniku familiárních feochromocytomu (tab. 1): von Hippel-Lindau genu (VHL), vedoucí ke vzniku von Hippel-Lindau syndromu, RET-protoonkogenu vedoucí ke vzniku mnohočetné endokrinní neoplazie/adenomatózy typu 2 (MEN 2), genu pro neurofibromatózu typu 1 (NF1), asociovaného s von Recklinghausenovou chorobou a mutace genů kódujících B - a D-subjednotky mitochondriální sukcinát-dehydrogenázy (SDHB, SDHD), zodpovědných za vznik familiárních paragangliomů a feochromocytomu [10,11]. Feochromocytomy nemusí být u těchto familiárních syndromů vždy přítomné a nebývají obvykle ani první klinickou manifestací těchto onemocnění (tab. 1) [10].
Zdá se tak užitečné, aby se genetické analýzy prováděly u všech nemocných s potvrzeným feochromocytomem, zejména u mladších osob pod 50 let věku [10]. Všechny pozitivní případy by pak měly být celoživotně sledovány.
Syndrom von Hippelův-Lindauův
Tento syndrom se rozděluje do tří základních typů (typ 1, 2 a 3). Klinické projevy bývají velmi rozmanité. Feochromocytom bývá přítomen jen u VHL syndromu typu 2, který se dále rozděluje na formu 2A, prezentující se hemangioblastomy CNS, feochromocytomy, endolymfatickými tumory a epididymálními cystadenomy. VHL syndrom typu 2B kromě feochromocytomu zahrnuje cysty ledvin, karcinom ledvin, hemangioblastomy CNS, cysty a tumory pankreatu, endolymfatické tumory a epididymální cystadenomy. Třetí typ (2C) syndromu VHL se projevuje pouze přítomností feochromocytomu [10].
Mnohočetná endokrinní neoplazie typu 2 (MEN 2)
Tento syndrom (mutace genu RET) se obvykle rozděluje na 2 hlavní formy. Forma/typ A kromě feochromocytomu zahrnuje také medulární karcinom štítné žlázy, hyperparatyreózu, nebo jen familiární medulární karcinom štítné žlázy (FMTC). Typ B se projevuje přítomností medulárního karcinomu tyreoidey, feochromocytomu, mnohočetnými neuromy a marfanoidními rysy [10].
Syndromy projevující se přítomností paragangliomů
Klasifikace těchto syndromů v literatuře bývá značně heterogenní. Tyto syndromy mají velmi různorodé klinické rysy projevující se přítomností tumorů hlavy a krku (tumory glomus caroticum, vagové a jugulární paragangliomy a paragangliomy středního ucha, feochromocytom) nebo přítomností abdominálních či torakálních paragangliomů. Paragangliomy hlavy a krku mají často popisovanou mutaci genu SDHD a bývají obvykle benigní. Naopak přítomnost mutace genu SDHB bývá spojena s velmi vysokým rizikem maligních forem (80 %!) [11].
Syndrom neurofibromatózy typu 1
Tento syndrom se projevuje mnohočetnými kožními a slizničními změnami, kožními ložisky typu „cafe au lait“ a potenciálně i přítomností feochromocytomu. Feochromocytomy jsou však u tohoto syndromu velmi vzácné (< 5 %), diagnostický screening není nezbytně nutný.
Biochemická diagnostika
V posledních 10 letech došlo k významnému technickému pokroku. Eisenhofer et al [12] popsali vyšší diagnostickou senzitivitu a specificitu stanovení plazmatických metanefrinů, která může být vysvětlena rozdílnou afinitou katecholaminů ke katechol-O-metyltransferáze (COMT) membrány adrenálních chromafinních buněk. Tato afinita je mnohem vyšší oproti COMT v jiných tkáních. Všechny tumory metabolizují katecholaminy na volné metanefriny, avšak ne všechny tumory vedou k hypersekreci katecholaminů [4,12]. Zatímco hladiny katecholaminů v plazmě jsou zvýšeny po minimálních podnětech, jako je úzkost a stres, koncentrace metanefrinů jsou těmi vlivy méně ovlivněny.
Multicentrická kohortová studie provedená ve čtyřech centrech u 214 pacientů s potvrzeným feochromocytomem vedla k závěru, že stanovení volných metanefrinů v plazmě je nejvhodnějším testem v diagnostice feochromocytomu [13]. Nedávný přehledný článek stejných autorů doporučoval měření plazmatických volných metanefrinů anebo močových frakcionovaných metanefrinů (oddělené stanovení normetanefrinu a metanefrinu v moči) jako test s nejvyšší diagnostickou citlivostí [10]. Tab. 2 uvádí srovnání senzitivity a specificity různých biochemických testů používaných v diagnostice feochromocytomu dle Lenderse [13].
Navzdory velmi vysoké senzitivitě plazmatických/močových metanefrinů je určitým problémem jejich relativně nižší specificita, a proto pozitivní výsledky neznamenají vždy potvrzení diagnózy feochromocytomu [4,10]. Některé látky navíc mohou interferovat s biochemickými testy feoochromocytomu a vést tak k falešné pozitivitě výsledků. Nejčastěji se jedná o interferující medikaci typu fenoxybenzaminu, paracetamolu nebo tricyklická antidepresiva [14]. Falešně pozitivní výsledky mohou rovněž být vyvolány dietními vlivy a nedodržením odpovídajících podmínek odběrů krve krve/moče, což může být problémem zejména v ambulantních podmínkách.
Někteří další autoři [15] doporučují pro diagnostiku feochromocytomu provádět více testů s ohledem na komplexní metabolizmus katecholaminů. Kombinace stanovení plazmatického norepinefrinu (NE) a epinefrinu (E) se součtem koncentrací obou těchto látek nad 2,000 pg/ml a současně měření močových metanefrinů - metanefrin (MNM) + normetanefrin (NM) - s výslednou hladinou nad 1,8 mg/24 hod mělo diagnostickou přesnost 98 % u sporadických i familiárních feochromocytomů [15]. Pochopitelně, provádění kombinace více diagnostických testů je pracnější a ekonomicky nákladnější.
Pracovníci Mayo kliniky doporučují volit diagnostický postup v závislosti na pravděpodobnosti přítomnosti feochromocytomu [16]. Za účelem minimalizace počtu falešně pozitivních případů doporučují provádět stanovení metanefrinů a katecholaminů ve 24hodinovém sběru moči. V případě důvodného podezření na feochromocytom (charakteristické příznaky, rodinná anamnéza feochromocytomu, familiární syndromy, zvětšení nadledviny) doporučují použít testy s vyšší senzitivitou typu frakcionovaných volných plazmatických metanefrinů [16].
Stanovení kyseliny vanilmandlové (VMA) je v klinické praxi stále velmi rozšířeno. Měření VMA je však zatíženo nižší senzitivitou, protože asi 80 % VMA vzniká z metabolitů NE ze sympatických nervových vláken. Proto zvýšení exkrece VMA močí nemusí znamenat přítomnost feochromocytomu [4].
Ačkoliv panuje určitá nejasnost, který laboratorní test je pro diagnostiku feochromocytomu nejlepší [4], zdá se, že stanovení plazmatických volných metanefrinů nebo močových frakcionovaných metanefrinů bude nejvhodnější volbou [10,13].
Farmakologické testy
Klonidinový test je nejpoužívanějším farmakologickým přístupem odlišujícím zvýšené uvolňování katecholaminů díky zvýšené aktivitě sympatiku od nadprodukce a hypersekrece katecholaminů tkání feochromocytomu [17]. V případě pozitivity tohoto testu je jeho prediktivní hodnota pro diagnostiku feochromocytomu 97 %. Negativní prediktivní hodnota je však relativně nízká (75 %). Výzkumný tým z Bethesdy doporučuje proto provádět klonidinový supresní test a namísto plazmatického NE měřit koncentrace plazmatického normetanefrinu [18]. Tato modifikace vedla ke zlepšení pozitivní a negativní prediktivní hodnoty klonidinového tesu na 100 % a 96 % [18]. Tento test se tak zdá být nejpřesnější metodou laboratorní diagnostiky feochromocytomu a měl by být používán ve sporných a nejasných případech.
Stimulační testy s použitím histaminu nebo glukagonu jsou náročné a potenciálně rizikové. Díky dostupnosti dalších laboratorních testů je jejich diagnostický přínos problematický [4].
Morfologická diagnostika
Abdominální počítačová tomografie (CT) se stále často používá k lokalizaci tumoru. Zdá se, že aplikace iohexolu pro zlepšení kontrastu nevede k ovlivnění koncentrací plazmatických katecholaminů [19]. Na obr. 1 je znázorněna diagnostika paragangliomu pomocí CT v oblasti pravého glomus caroticum. Magnetická rezonance (T2-weighted MRI) s podáním gadolinia má srovnatelnou diagnostickou přesnost s CT vyšetřením [4,10], avšak MRI je preferována v diagnostice extraadrenálních feochromocytomů, u těhotných osob, dětí, alergií na kontrastní látku anebo v případě renální insuficience. V případě realizace CT či MRI není nutná současná blokáda adrenergních receptorů.
Image 1. Feochromocytom/paragangliom oblasti pravého glomus caroticum (značeno šipkou) zobrazený pomocí CT. 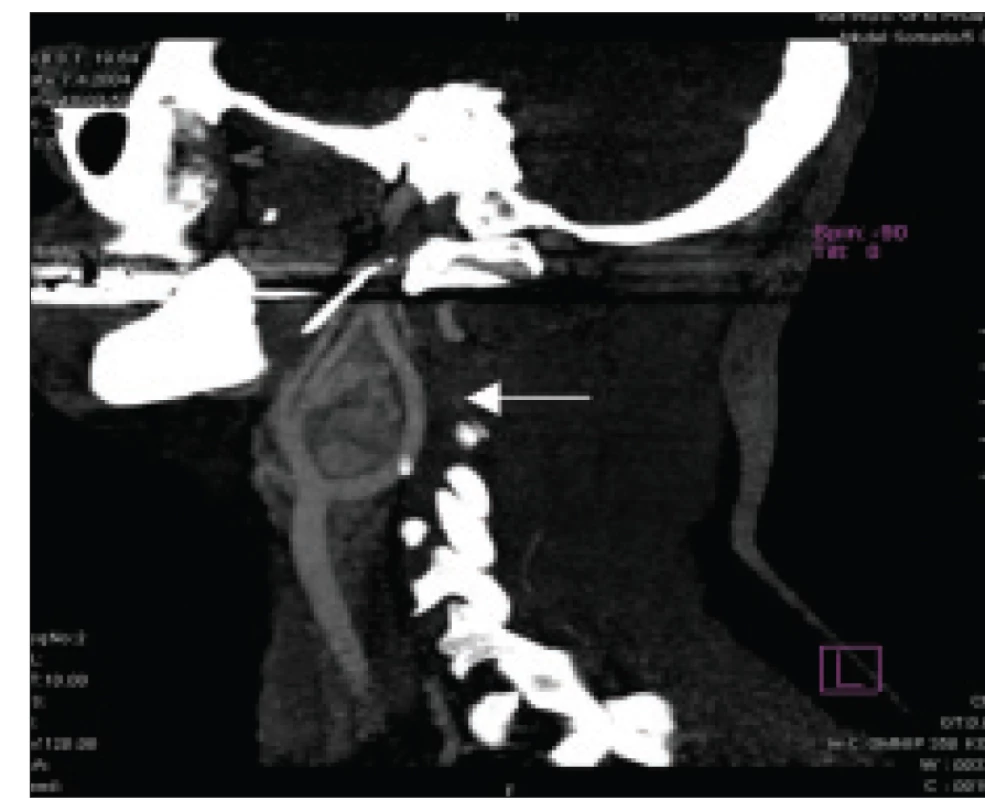
U nemocných s podezřením na extraadrenální lokalizaci feochromocytomu, u větších tumorů nad 5 cm anebo v případě podezření na vícečetné či metastatické feochromocytomy je indikováno vyšetření pomocí i.v. aplikace radiofarmaka 123I-metaiodobenzylguanidin (MIBG) spíše než 131I-MIBG, které má horší technickou kvalitu [10]. Některé látky (labetalol, tricyklická antidepresiva, kalciové blokátory) mohou interferovat s vychytáváním nebo retencí 123I-MIBG. V případě negativity 123I-MIBG vyšetření se doporučuje provést oktreotidový scan značený 111In anebo PET značený 18F-fluorodeoxyglukózou. Oba dva tyto posledně uváděné testy mají však nižší specificitu pro feochromocytom a nejsou proto doporučovány pro základní vyšetření. PET vyšetření pomocí 18F-fluorodopaminu má oproti MIBG scintigrafii (zejména v případě metastatických feochromocytomů) vyšší diagnostickou výtěžnost [19]. 18F-fluorodopamin (a podobné látky jako je 18F-fluorodopa či 11C-hydroxyefedrin) není však široce dostupný pro klinické využití.
Léčba
Benigní formy
Předoperační farmakologická léčba je nezbytná pro snížení rizika a komplikací operačního odstranění tumoru, protože emergentní resekce feochromocytomu má vysokou letalitu [10]. Farmakologická léčba se opírá o podávání selektivních blokátorů alfa1-receptorů (doxazosin, terazosin nebo prazosin). Prazosin má nevýhodu krátkého trvání biologického účinku. Fenoxybenzamin je neselektivní, nekompetitivní blokátor alfa-receptorů, avšak v současnosti není v ČR dostupný. Nejsou k dispozici žádné randomizované klinické studie, srovnávající fenoxybenzamin s prazosinem nebo doxazosinem.
Labetalol je kombinovaný beta - a alfa-blokátor, avšak u feochromocytomu je méně vhodný k předoperační farmakologické přípravě díky převažující blokádě beta-receptorů.
Betablokátory se podávají ke kontrole tachykardie a arytmií nejméně 24 hod po podání alfa-blokátorů. Podání betablokátorů v monoterapii může vést u feochromocytomu k presorické reakci až plicnímu edému díky neoponované alfa-receptory zprostředkované vazokonstrikci [4].
Blokátory kalciových kanálů (BKK) se mohou rovněž použít k inhibici katecholaminy zprostředkovaného uvolnění intracelulárního kalcia buď samotné (zejména u normotenzních forem feochromocytomu) anebo v kombinaci s alfa-blokátory [4,10]. Podání samotných BKK sice nevede k ortostatické hypotenzi, avšak je méně výhodné, protože nezabraňuje vzestupům TK u feochromocytomu [10].
Předoperační léčba pomocí alfa - (a potenciálně i beta-) blokátorů by měla být zahájena nejméně týden, lépe 10 - 14 dní před plánovaným chirurgickým řešením.
Zdá se, že typ použitého anestetika má pro kontrolu TK v průběhu operace až druhořadý význam [21]. Pro kontrolu hypertenzních špiček v průběhu operačního výkonu se používá izosorbiddinitrát, sodium nitroprussid anebo krátkodobě působící BKK. Pro kontrolu tachyarytmií je výhodný krátkodobě působící betablokátor esmolol.
Riziko pooperační hypotenze může být sníženo zvýšeným přísunem soli a tekutin. V pooperačním průběhu se může vyskytovat i hypoglykemie způsobená náhlou hyperinzulinemií.
Chirurgická léčba
V současné době se díky technickým pokrokům a přesné morfologické lokalizaci tumoru široce používá laparoskopické odstranění tumoru [22]. Laparoskopický přístup vede ve srovnání s konvenční operací k nižší pooperační morbiditě, k časnější rehabilitaci se zkrácením doby hospitalizace a ušetřením ekonomických nákladů [22,23]. V případě bilaterálních feochromocytomů se doporučuje provádět „nadledvinovou kůru šetřící“ (adrenal-cortex sparing) laparoskopickou operaci k prevenci nutnosti celoživotního podávání glukokortikoidů.
Prognóza nemocných po operaci je velmi dobrá, avšak u části nemocných může přetrvávat hypertenze, obvykle však již méně závažná ve srovnání s předoperačním obdobím [24]. Po operaci feochromocytomu se doporučuje provádět dlouhodobé sledování v pravidelných intervalech, neboť recidivy feochromocytomu se nacházejí u 17 % případů. Tyto recidivy jsou častější u extraadrenálních nebo familiárních forem.
Maligní formy
Feochromocytom je považován za maligní v případě přítomnosti metastáz chromafinní tkáně v jiných (neobvyklých) lokalizacích. Vyšší riziko malignity je u velkých nádorů, extraadrenálních či familiárních forem. Klinický průběh maligních forem bývá variabilní s 5letým přežíváním u 50 % osob.
Bohužel zatím neexistuje jednoznačně úspěšný způsob léčby maligních feochromocytomů. Nejvíce se osvědčuje chirurgické odstranění nádorové tkáně včetně metastáz. Konzervativní léčba pomocí alfablokátorů vede ke kontrole krevního tlaku a symptomů. Bylo popsáno zmenšení tumorózní tkáně po podání metyrozinu, inhibitoru syntézy katecholaminů. Léčba pomocí 131I-MIBG anebo chemoterapie pomocí cyklofosfamidu, vinkristinu a dakarbazinu zhoršuje kvalitu života a vede ke kompletní remisi jen u menšiny nemocných [10]. Podle některých pramenů mohou vysoké dávky 131I-MIBG prodloužit přežívání [25], bohužel nám však chybí kontrolní studie díky nízkému výskytu maligních forem feochromocytomu. Kostní metastázy mohou podle některých názorů příznivě reagovat na iradiaci nebo radiofrekventní ablaci [4,10].
Tato práce byla podpořena vědeckým záměrem MSM číslo 0021620817, 21620808 a 21620807.
prof. MUDr. Jiří Widimský, CSc., jr.
www.vfn.cz
e-mail: jwidi@lf1.cuni.cz
Doručeno do redakce: 27. 3. 2007
Sources
1. McNeil AR, Blok BH, Koelmeyer TD et al. Phaeochromocytoma discovered during coronial autopsies in Sydney, Melbourne and Auckland. Aust NZ J Med 2000; 30 : 648-652.
2. Strauch B, Zelinka T, Hampf M et al. Prevalence of primary hyperaldosteronism in moderate to severe hypertension in the Central Europe region. J Hum Hypertension 2003; 17 : 349-352.
3. Manger WM, Eisenhofer G. Pheochromocytoma: diagnosis and management update. Curr Hypertens Rep 2004; 6 : 477-484.
4. Kaplan NM. Clinical hypertension. Philadelphia: Lippincott, Williams&Wilkins 2006 : 1-518.
5. Zelinka T, Štrauch B, Pecen L et al. Diurnal blood pressure variation in pheochromocytoma, primary aldosteronism and Cushing’s syndrome. J Human Hypertension 2004; 18 : 107-111.
6. Zelinka T, Widimský J jr, Weisserová J. Diminished circadian blood pressure rhytm in patients with asymptomatic normotensive pheochromocytoma. Physiol Res 2001; 50 : 631-634.
7. Kikuya M, Hozawa T, Ohkubo T et al. Prognostic significance of blood pressure and heart rate variabilities. The Ohasama study. Hypertension 2000; 36 : 901-906.
8. Zelinka T, Štrauch B, Petrák O et al. Increased blood pressure variability in pheochromocytoma compared to essential hypertension patients. J Hypertens 2005; 23 : 2033-2039.
9. Neumann HP, Bausch B, Mc-Whinney SR et al. for the Freiburg-Warshaw-Columbus Pheochromocytoma Study Group. Germ-line mutations in nonsyndromic pheochromocytoma. N Engl J Med 2002; 346 : 1459-1466.
10. Lenders JWM, Eisenhofer G, Mannelli M et al. Pheochromocytoma. Lancet 2005; 366 : 665-675.
11. Amar L, Bertherat J, Baudin E et al. Genetic testing in pheochromocytoma or functional paraganglioma. J Clin Oncol 2005; 23 : 8812-8818.
11. Eisenhofer G, Bornstein SR, Brouwers FM et al. Malignant pheochromocytoma. Current status and initiatives for future progress. Endocr Rel Cancer 2004; 11 : 423-436.
12. Eisenhofer G, Keiser H, Friberg P et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors. J Clin Endocrinol Metab 1998; 83 : 2175-2185.
13. Lenders JW, Pacak K, Walther MM et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002; 287 : 1427-1434.
14. Goldstein DS, Eisenhofer G, Flynn JA et al. Diagnosis and localisation of pheochromocytoma. Hypertension 2004; 43 : 907-910.
15. Bravo EL, Tagle R Pheochromocytoma: state of the art and future prospects. Endocr Rev 2003; 24 : 539-553.
16. Kudva YC, Sawka AM, Young WF jr et al. The laboratory diagnosis of adrenal pheochromocytoma: the Mayo Clinic experience. J Clin Endocrinol Metab 2003; 88 : 4533-4539.
17. Bravo EL, Tarazi RC, Fouad FM et al. Clonidine-suppression test: a useful aid in the diagnosis of pheochromocytoma. N Engl J Med 1981; 305 : 623-626.
18. Eisenhofer G, Goldstein DS, Walther MM et al. Biochemical diagnosis of pheochromocytoma: how to distinquish true-from false positive results. J Clin Endocrinol Metab 2003; 88 : 2656-2666.
19. Mukherjee JJ, Peppercorn PD, Reznek RH et al. Pheochromocytoma: effect of nonionic contrast medium in CT on circulating catecholamine levels. Radiology 1997; 202 : 227-231.
19. Pacak K, Eisenhofer G, Carrasquillo JA et al. 6-(18F)fluorodopamine positron emission tomographic (PET) scanning for diagnostic localisation of pheochromocytoma. Hypertension 2001; 38 : 6-8.
20. Ilias I, Pacak K Current approaches and recommended algorithm for the diagnostic localisation of pheochromocytoma. J Clin Endocrinol Metab 2004; 89 : 479-491.
21. Prys-Roberts C Pheochromocytoma - recent progress in its management. Br J Anaesth 2000; 85 : 44-57.
22. Janetschek G, Finkenstdt G, Gasser R et al. Laparoscopic surgery for pheochromocytoma: adrenalectomy, partial resection, excision of paragangliomas. J Urol 1998; 160 : 330-334.
23. Sprung J, O’Hara JF jr, Gill IS et al. Anesthetic aspects of laparoscopic and open adrenalectomy for pheochromocytoma. Urology 2000; 55 : 339-343.
24. Plouin PF, Chatellier G, Fofol I et al. Tumour recurrence and hypertension persistance after successful pheochromocytoma operation. Hypertension 1997; 29 : 1133-1139.
25. Rose B, Matthay KK, Price D et al. High-dose 131I-MIBG therapy for 12 patients with malignant pheochromocytoma. Cancer 2003; 98 : 239-248.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 4-
All articles in this issue
- Prevalencia abdominálnej obezity na Slovensku. Štúdia IDEA Slovakia
- Dlouhodobé zkušenosti s infuzní léčbou treprostinilem u nemocných s plicní arteriální hypertenzí v České republice
- Vliv léčby fenofibrátem na rizikový profil nemocných s metabolickým syndromem a smíšenou dyslipidemií léčených ambulantně
- Molekulární genetika infarktu myokardu
- Lipoprotein (a)
- Chronická pankreatitida - etiologická klasifikace a diagnostická kritéria
- Adiponektin a ateroskleróza
- Představuje inhibitor reninu aliskiren nové výhledové možnosti v léčbě kardiovaskulárních onemocnění?
- Genetika dyslipidemií včera, dnes a zítra
- Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
- Tyreopatie, dyslipidemie a kardiovaskulární rizika
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- CRP - marker proinflamačního stavu a kardiovaskulárního rizika
- Sekundární dyslipidemie a jejich léčba
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
- Pravidelná aerobní pohybová aktivita zlepšuje lipidový profil u osob s vyšší než normální tělesnou hmotností
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Intravenózní léčba akutního srdečního selhání
- Duální inhibice cholesterolu prostřednictvím přípravku ezetimib/simavastatin (Inegy®) - nejsnadnější cesta k dosažení cílových hodnot LDL-cholesterolu?
- Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lipoprotein (a)
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



