-
Medical journals
- Career
Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
Authors: L. Smolej 1; C. Andrýs 2; J. Krejsek 2; D. Belada 1; P. Žák 1; O. Široký 1; J. Malý 1
Authors‘ workplace: Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 2
Published in: Vnitř Lék 2007; 53(11): 1171-1176
Category: Original Contributions
Overview
Chronická lymfocytární leukemie (CLL) je charakteristická výraznou různorodostí prognózy s celkovým přežitím v řádu několika měsíců až desítek let. V současné době není možné přesně určit budoucí klinický průběh u jednotlivého pacienta. Angiogeneze se ukazuje v posledních letech jako potenciální prognostický faktor u řady hematologických malignit včetně CLL. Cílem naší studie bylo změřit klíčové angiogenní faktory bFGF a VEGF (basic fibroblast growth factor, vascular endothelial growth factor) metodou ELISA v plazmě periferní krve u 73 nemocných s neléčenou chronickou lymfocytární leukemií (43 mužů, 30 žen, medián věku 65 let, rozmezí 31-88 let) a 80 zdravých dobrovolníků. Zjistili jsme signifikantně zvýšenou koncentraci u nemocných s CLL v porovnání s kontrolní skupinou (p < 0,0001 pro oba cytokiny). Nebyly nalezeny významné rozdíly v angiogenních faktorech mezi podskupinami s nízkým vs středním vs vysokým rizikem dle Raie či závislost angiogenních faktorů na pohlaví. U skupiny 12 pacientů došlo po intenzivní léčbě založené na fludarabinu k významnému poklesu u obou těchto faktorů (bFGF: p = 0,0005; VEGF: p = 0,0068), které již nebyly signifikantně odlišné od kontrolní skupiny (bFGF: p = 0,524; VEGF: p = 0,728). Naše data prokázala zvýšení zásadních angiogenních aktivátorů bFGF a VEGF u chronické lymfocytární leukemie. Intenzivní léčba kombinující fludarabin a cyklofosfamid ± rituximab by mohla mít také antiangiogenní účinky. Další studie s delší dobou sledování jsou nutné k vyhodnocení vlivu angiogenních ukazatelů na dobu do progrese či celkové přežití.
Klíčová slova:
chronická lymfocytární leukemie - angiogeneze - bFGF - VEGF - prognóza - léčba - fludarabinÚvod
Angiogeneze, tedy novotvorba cév z již existující vaskulatury, je zásadním procesem při rozvoji malignit [1-4]. Zatímco význam angiogeneze u solidních nádorů je znám již od počátku 70. let 20. století [1], teprve v 90. letech 20. století dochází k výzkumu neovaskularizace u maligních onemocnění krvetvorby. Zvýšená angiogeneze byla zjištěna u akutních a chronických leukemií, maligních lymfomů, mnohočetného myelomu, myeloproliferací i myelodysplazií [3-9]. Některé studie u maligních onemocnění krvetvorby prokázaly souvislost mezi zvýšenou angiogenezí a nepříznivým klinickým průběhem [7-9]. Chronická lymfocytární leukemie (CLL] je nejčastějším leukemickým onemocněním dospělých v západní populace. Toto lymfoproliferativní onemocnění je typické neobyčejnou různorodostí prognózy (s celkovým přežitím od několika měsíců až po desítky let), která neumožňuje dopředu odhadnout klinický průběh u individuálního pacienta [10]. S cílem zpřesnění prognózy CLL jsou hledány nové prognostické parametry, jako v posledních letech např. genetické aberace detekované fluorescenční in situ hybridizací (FISH) či mutační stav genů kódujících variabilní část těžkého řetězce imunoglobulinu (IgVH) [11]. V posledních letech bylo publikováno, že lymfocyty CLL mají schopnost vyrábět angiogenní aktivátory i inhibitory [12] a že ukazatele angiogeneze by mohly mít u CLL prognostický význam [13-16]. Pouze jediná studie zkoumala vývoj koncentrací angiogenních cytokinů při léčbě CLL [17]. Za nejdůležitější aktivátory angiogeneze jsou pokládány cévní endotelový růstový faktor (vascular endothelial growth factor - VEGF) a bazický fibroblastový růstový faktor (basic fibroblast growth factor - bFGF) [3-4,18-20]. Cílem naší práce bylo 1. stanovení těchto angiogenních faktorů v periferní krvi u nemocných s CLL, 2. zhodnocení jejich vztahu ke klinickému stadiu a 3. porovnat jejich hodnoty v závislosti na intenzivní léčbě na bázi fludarabinu.
Nemocní a metody
Do studie bylo zařazeno 73 nemocných s neléčenou chronickou lymfocytární leukemií diagnostikovanou podle klasických kriterií National Cancer Institute - Sponsored Working Group [21]. Jednalo se o 43 mužů a 30 žen, medián věku 65 let, rozmezí 31-88 let. Nízké (Rai 0)/střední (Rai I - II)/vysoké (Rai III - IV) riziko dle modifikovaného Raiova stagingu [22] bylo přítomno u 37/31/5 nemocných. Kontrolní skupinu tvořilo 80 zdravých dobrovolníků. Jako antikoagulans ethylendiamintetraoctová kyselina (EDTA) byla použita. Všechny vzorky plazmy byly po centrifugaci zamraženy při teplotě -70 ºC až do měření. bFGF i VEGF byly stanoveny pomocí komerčně dostupného ELISA kitu (Human VEGF/bFGF Quantikine ELISA kit, R & D Systems, MN, USA). Měření bylo provedeno podle standardní metodiky doporučené výrobcem. Studie byla provedena dle zásad Helsinské deklarace, schválena etickou komisí a nemocní podepsali informovaný souhlas. Statistická analýza byla provedena pomocí softwaru Analyse-it (Analyse-it Software Ltd, Velká Británie). Všechna data byla testována na normalitu Shapirovým-Wilkovým testem. Pokud bylo rozdělení dat normální, byl k testování rozdílů koncentrací vůči kontrolní skupině užit parametrický t-test. Pokud neměla data normální rozdělení, byl použit neparametrický Mannův-Whitneyův U test. K testování změny angiogenních faktorů po léčbě byl proveden Wilcoxonův test. Korelace byla stanovena pomocí Spearmanova korelačního koeficientu. Všechny výsledky p hodnot jsou pro dvoustranné testy. P hodnoty nižší než 0,05 byly považovány za statisticky signifikantní.
Výsledky
Deskriptivní statistika i výsledky testování rozdílů v koncentracích bFGF a VEGF mezi jednotlivými skupinami a kontrolami jsou uvedeny v tab. 1. Koncentrace obou cytokinů u nemocných s CLL byly signifikantně vyšší oproti kontrolní skupině (bFGF: průměr ± standardní odchylka 177,1 ± 167,3 pg/ml, 95% IS - interval spolehlivosti - průměru 140,9-213,5 pg/ml vs 11,1 ± 11,3 pg/ml, 95% IS 8,6-13,6 pg/ml, p < 0,0001; VEGF: 144,2 ± 141,6 pg/ml, 95 % IS 113,4-174,9 pg/ml vs 64,2 ± 59,6 pg/ml, 95% IS 51,0-77,5 pg/ml, p < 0,0001), obr. 1. Počet leukocytů v době odběru nekoreloval s koncentracemi angiogenních faktorů (bFGF: r = 0,1; VEGF: r = 0,17), z čehož vyplývá, že hodnoty angiogenních cytokinů nejsou prostým ukazatelem nádorové masy (tab. 2). Z hlediska prognostických faktorů nebyly nalezeny rozdíly v koncentracích bFGF či VEGF u nemocných s nízkým vs středním vs vysokým rizikem dle Raie (což také hovoří proti lineární souvislosti intenzity angiogeneze a nádorové nálože) či u mužů vs u žen (obr. 2 a 3). U 12 nemocných, kteří podstoupili intenzivní léčbu obsahující fludarabin (režim FCR - fludarabin + cyklofosfamid + rituximab, n = 9; protokol FC - fludarabin + cyklofosfamid, n = 3) došlo po léčbě k signifikantnímu poklesu koncentrace bFGF (p = 0,0005) i VEGF (p = 0,0068), aniž by pokles angiogenních cytokinů po léčbě koreloval s počtem leukocytů (obr. 4, tab. 2). Hodnoty bFGF i VEGF u CLL pacientů po léčbě byly již bez statisticky významného rozdílu vůči zdravým kontrolám (p = 0,524, resp. 0,728).
Graf 1. Statisticky významné zvýšení bFGF (a) i VEGF (b) u skupiny nemocných s CLL vs kontrol. 
Koncentrace jsou uvedeny v pg/ml. Graf 2. Plazmatické koncentrace bFGF (a) a VEGF (b) se neliší mezi muži a ženami. 
Koncentrace jsou uvedeny v pg/ml. Graf 3. Hodnoty bFGF (a) ani VEGF (b) nejsou závislé na klinickém stadiu dle Raie. 
Koncentrace jsou uvedeny v pg/ml. Graf 4. Statisticky významný pokles koncentrací bFGF (a) i VEGF (b) po intenzivní léčbě založené na fludarabinu. 
Koncentrace jsou uvedeny v pg/ml. Table 1. Angiogenní aktivátory bFGF a VEGF jsou signifikantně zvýšeny u CLL a významně klesají po léčbě založené na fludarabinu. 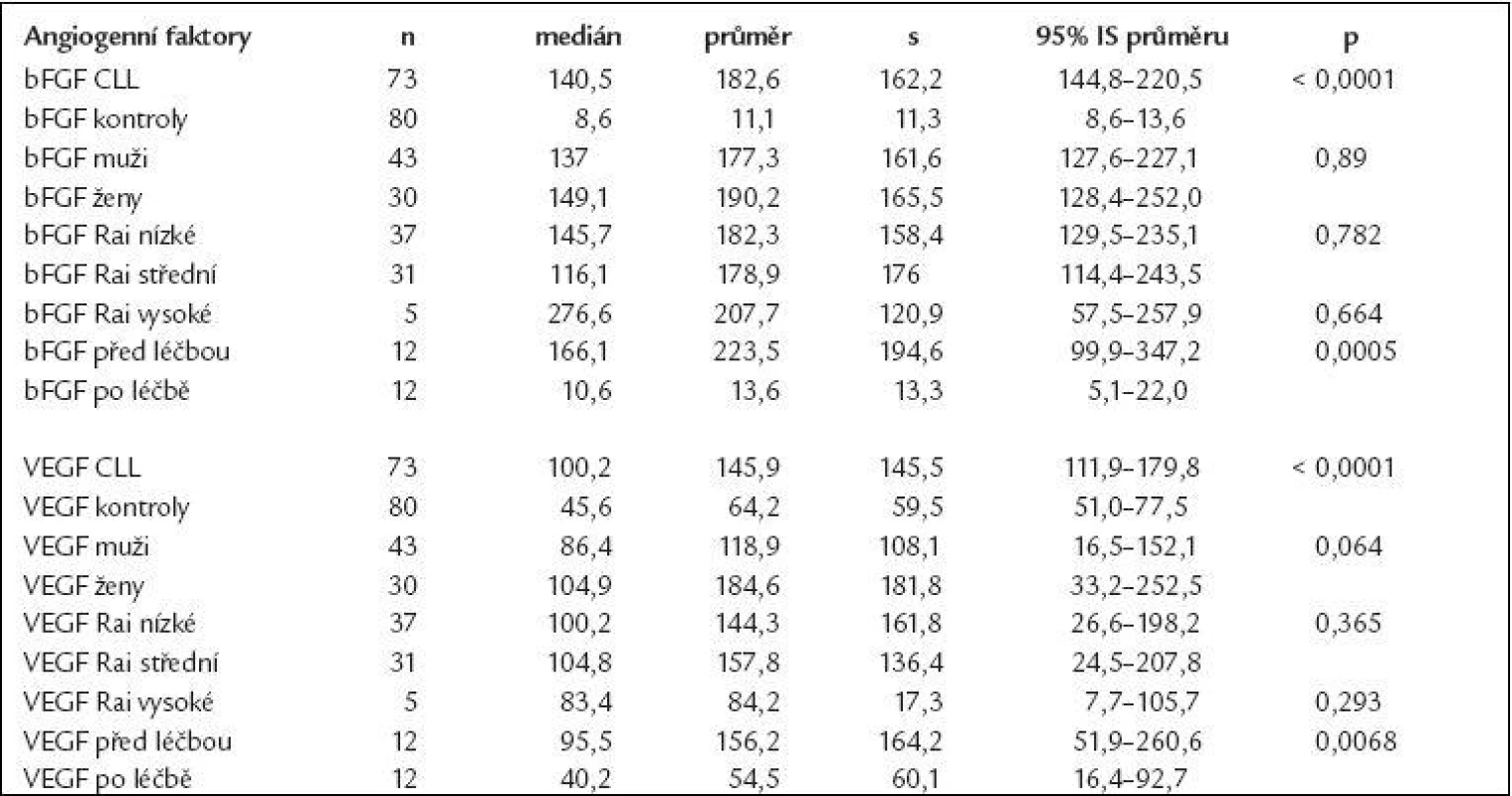
Hodnoty bFGF i VEGF jsou uvedeny v pg/ml. CLL – chronická lymfocytární leukemie, s – standardní odchylka, IC – interval spolehlivosti. Table 2. Koncentrace angiogenních faktorů ani jejich pokles po léčbě nekorelují s hodnotou leukocytů. 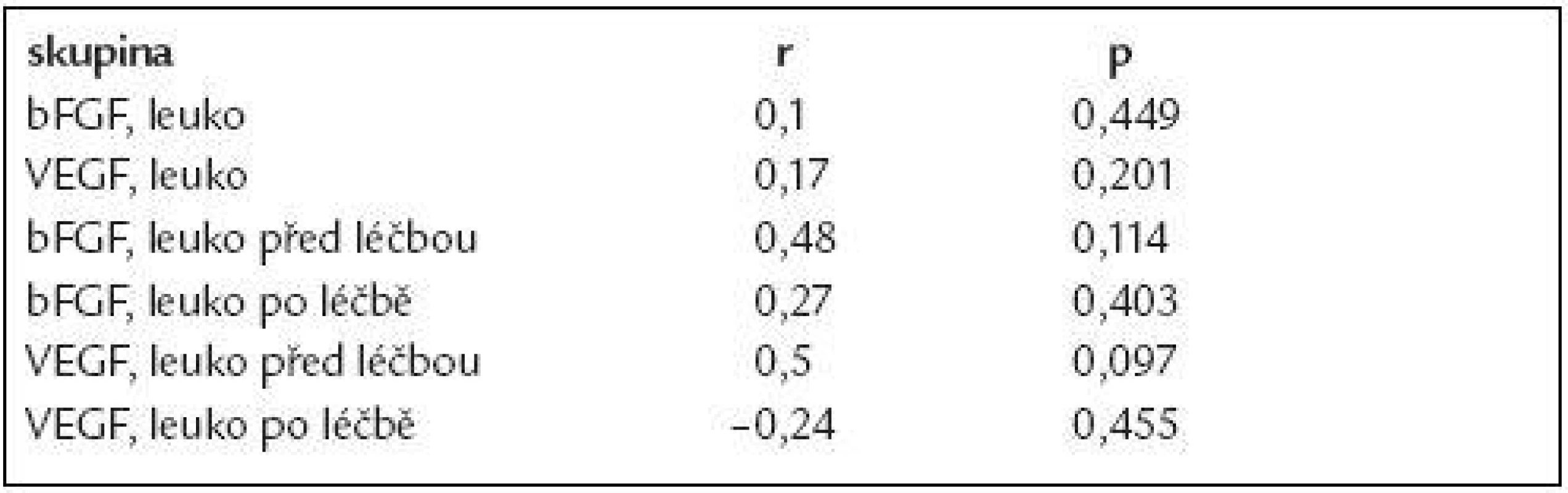
Leuko – leukocyty, r – Spearmanův korelační koeficient Diskuse
V posledních letech přibývá důkazů o významu angiogeneze u hematologických malignit. Zvýšené koncentrace angiogenních aktivátorů v periferní krvi byly zjištěny u prakticky všech maligních krevních onemocnění [3-9]. První zmínka o angiogenních ukazatelích u chronické lymfocytární leukemie pochází z roku 1995, kdy Duensing et al prokázali zvýšení bFGF v séru u pilotního souboru 18 pacientů s CLL [23]. V pozdějších letech bylo publikováno několik prací zkoumajících cirkulující bFGF i VEGF [5,13,24-29], některé však vykazovaly metodické nedostatky v podobě naprosté absence či nedostatečného rozsahu kontrolní skupiny [5,23,25,29], ev. zařazení i nemocných, kteří před hodnocením angiogeneze již podstoupili cytoredukční léčbu [5,23,25,29]. V naší práci jsou proto zařazeni výhradně nemocní s neléčenou CLL a kontrolní skupina 80 zdravých dobrovolníků (největší ze všech publikovaných prací na dané téma) prakticky vylučuje chybu malých čísel. V naší práci jsme v souladu s literaturou zjistili statisticky významné zvýšení klíčových aktivátorů angiogeneze bFGF a VEGF v periferní krvi ve srovnání s kontrolní skupinou. Co se týče prognostického významu ukazatelů angiogeneze, ve 3 studiích byly nalezeny vyšší koncentrace bFGF u pokročilých vs časných stadií [13,26,28]. Molica et al navíc zjistili souvislost mezi vyšší koncentrací VEGF a časnější progresí nemocných z časných stadií [13]. Bairey et al publikovali korelaci mezi sérovým bFGF a antiapoptotickým proteinem bcl-2 [25]. V našem souboru jsme neshledali signifikantních rozdílů v bFGF či VEGF mezi nemocnými různých klinických stadií. Jednou z možných příčin je odlišné spektrum pacientů (pouze 5 nemocných v pokročilém stadiu) a také použití odlišného materiálu pro hodnocení angiogenních faktorů (plazma vs sérum). Z technického hlediska je zajímavé, že naprostá většina studií hodnotila angiogenní aktivátory v krevním séru periferní krve [14,24-27], pouze ve2 pracích byla použita krevní plazma [5,29]. Otázka, zda je vhodnější měřit ukazatele angiogeneze v séru či plazmě, je kontroverzní a dosud nedořešená, nicméně řada prací dokazuje, že zejména v případě VEGF je kvantifikace v séru zatížena chybou způsobenou uvolněním tohoto faktoru z trombocytů při tvorbě krevní sraženiny, z čehož vyplývají vyšší hodnoty v séru ve srovnání s plazmou a pozitivní korelace s počtem trombocytů [30-33]. Z tohoto důvodu považujeme za přesnější stanovení angiogenních faktorů v plazmě.
Naše pilotní data prokázala významné snížení bFGF i VEGF po chemo(imuno)terapii na bázi fludarabinu, na základě čehož vyslovujeme hypotézu, že tato léčba by mohla mít také antiangiogenní účinky. Tuto domněnku nepřímo podporují publikace dokazující antiangiogenní efekt u některých klasických cytostatik [34,35]. V jediné předchozí studii hodnotící vliv léčby na angiogenní faktory u CLL zjistila Gora-Tybor et al signifikantní pokles bFGF a TGF-β (transformujícího růstového faktoru β) u 18 nemocných léčených monoterapií kladribinem [17]. Dosud neexistuje práce hodnotící angiogenní faktory v závislosti na kombinované léčbě obsahující fludarabin, stejně tak nebyla dosud publikována studie hodnotící vývoj koncentrací VEGF po léčbě CLL. V tomto jsou naše výsledky prioritní. Nedostatkem naší studie je absence srovnání angiogenních faktorů s moderními prognostickými faktory (mutační stav IgVH, genetické aberace vyšetřované pomocí FISH). Souvislost mutačního stavu IgVH a angiogenních aktivátoru jsme již publikovali jako pilotní studii u 46 nemocných [36]. V nynější rozšířené kohortě však nebylo možné z finančních důvodů tato vyšetření provést u starých či polymorbidních nemocných vzhledem k tomu, že velmi drahé stanovení mutačního stavu IgVH či genetických aberací u nich neovlivní volbu terapie.
Závěr
Závěrem shrnujeme, že v naší studii jsme prokázali signifikantní zvýšení zásadních angiogenních cytokinů bFGF a VEGF u skupiny nemocných s dosud neléčenou CLL. Nebyla prokázána souvislost koncentrací těchto faktorů s klinickým stadiem dle Raie, či pohlavím. Agresivní léčba složená z fludarabinu, cyklofosfamidu ± rituximabu vedla k významnému snížení koncentrací těchto angiogenních aktivátorů na hodnoty srovnatelné s kontrolní skupinou. Tyto výsledky by tedy mohly ukazovat na antiangiogenní působení této terapie. Delší doba sledování je nutná k posouzení eventuální spojitosti mezi angiogenními ukazateli parametry jako doba do progrese či celkové přežití; rozsáhlejší kohorta nemocných pak k potvrzení pilotních dat týkajících se poklesu angiogenních faktorů po léčbě. Další výzkum angiogeneze u CLL je cenný nejen z prognostického, ale také léčebného hlediska, neboť v současné době jsou již k dispozici nadějná data z klinických studií využívajících antiangiogenní léky, jako je thalidomid či lenalidomid [37,38].
Tato práce byla podpořena grantem NR/8373 - 3 IGA MZ ČR.
MUDr. Lukáš Smolej
www.fnhk.cz
e-mail: smolej@seznam.cz
Doručeno do redakce: 18. 5. 2007
Přijato po recenzi: 17. 7. 2007
Sources
1. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med 1971; 285 : 1182-1186.
2. Folkman J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med 1995; 333 : 1757-1763
3. Pour L, Hájek R, Büchler T et al. Angiogeneze a antiangiogenní léčba u nádorů. Vnitř Lék 2004; 50(12): 930-938.
4. Smolej L, Benešová P. Význam angiogeneze u maligních nádorů. Acta Medica (Hradec Králové) Suppl 2005; 48 : 69-72.
5. Aguayo A, Kantarjian H, Manshouri T et al. Angiogenesis in acute and chronic leukemias and myelodysplastic syndromes. Blood 2000; 96 : 2240-2245.
6. Moehler TM, Ho AD, Goldschmidt H et al. Angiogenesis in hematologic malignancies. Crit Rev Oncol Hematol 2003; 45 : 227-244.
7. Rajkumar SV, Witzig TE. A review of angiogenesis and antiangiogenic therapy with thalidomide in multiple myeloma. Cancer Treat Rev 2000; 26 : 351-362.
8. Salven P, Teerenhovi L, Joensuu H. A high pretreatment serum vascular endothelial growth factor concentration is associated with poor outcome in non-Hodgkin’s lymphoma. Blood 1997; 90 : 3167.
9. Perez-Atayde AR, Sallan SE, Tedrow U et al. Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia. Am J Pathol 1997; 150 : 815-821.
10. Shanafelt TD, Geyer SM, Kay NE. Prognosis at diagnosis: integrating molecular biologic insights into clinical practice for patients with CLL. Blood 2004; 103 : 1202-1210.
11. Papajík T, Jarošová M, Pikalová Z et al. Chronická B-lymfocytární leukemie. Část II: Diagnostická kritéria a význam stanovení individuální prognózy nemocného. Trans Hemat dnes 2006; 12 : 132-139.
12. Kay NE, Bone ND, Tschumper RC et al. B-CLL cells are capable of synthesis and secretion of both pro - and anti-angiogenic molecules. Leukemia 2002; 16 : 911-919.
13. Molica S, Vitelli G, Levato D et al. Clinicoprognostic implications of increased serum levels of vascular endothelial growth factor and basic fibroblastic growth factor in early B-cell chronic lymphocytic leukaemia. Br J Cancer 2002; 86 : 31-35.
14. Menzel T, Rahman Z, Calleja E et al. Elevated intracellular level of basic fibroblast growth factor correlates with stage of chronic lymphocytic leukemia and is associated with resistance to fludarabine. Blood 1996; 87 : 1056-1063.
15. Konig A, Menzel T, Lynen S et al. Basic fibroblast growth factor (bFGF) upregulates the expression of bcl-2 in B-cell chronic lymphocytic leukemia cell lines resulting in delaying apoptosis. Leukemia 1997; 11 : 258-265.
16. Ferrajoli A, Manshouri T, Estrov Z et al. High levels of vascular endothelial growth factor receptor-2 correlate with shortened survival in chronic lymphocytic leukemia. Clin Cancer Res 2001; 7 : 795-799.
17. Gora-Tybor J, Blonski JZ, Robak T. Cladribine decreases the level of angiogenic factors in patients with chronic lymphocytic leukemia. Neoplasma 2002; 49 : 145-148.
18. Auguste P, Javerzat S, Bikfalvi A. Regulation of vascular development by fibroblast growth factors. Cell Tissue Res 200; 314 : 157-166.
19. Šimíčková M, Dubská L, Kocáková I et al. Angiogeneze a antiangiogenní terapie se zaměřením na cirkulující vaskulární endotelový růstový faktor (VEGF). Klin Onkol 2006; 19 : 212-216.
20. Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Nat Rev Drug Discov 2004; 3 : 391-400.
21. Cheson BD, Bennett JM, Grever M et al. National Cancer Institute–sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990-4997.
22. Rai KR. A critical analysis of staging in CLL. In: Gale RP, Rai KR (eds). Chronic Lymphocytic Leukemia. Recent Progress and Future Direction. New York (NY): AR Liss 1987 : 253.
23. Duensing S, Atzpodien J. Increased intracellular and plasma levels of basic fibroblast growth factor in B-cell chronic lymphocytic leukemia. Blood 1995; 85 : 1978-1980.
24. Molica S, Vitelli G, Levato D et al. Increased serum levels of vascular endothelial growth factor predict risk of progression in early B-cell chronic lymphocytic leukaemia. Br J Haematol 1999; 107 : 605-610.
25. Bairey O, Zimra Y, Shaklai M et al. Bcl-2 expression correlates positively with serum basic fibroblast growth factor (bFGF) and negatively with cellular vascular endothelial growth factor (VEGF) in patients with chronic lymphocytic leukaemia. Br J Haematol 2001; 113 : 400-406.
26. Gora-Tybor J, Blonski JZ, Robak T. Circulating proangiogenic cytokines and angiogenesis inhibitor endostatin in untreated patients with chronic lymphocytic leukemia. Mediators Inflamm 2003; 12 : 167-171.
27. Gora-Tybor J, Blonski JZ, Robak T. Circulating vascular endothelial growth factor (VEGF) and its soluble receptors in patients with chronic lymphocytic leukemia. Eur Cytokine Netw 2005; 16 : 41-46.
28. Wolowiec D, Dybko J, Wrobel T et al. Circulating sCD138 and some angiogenesis-involved cytokines help to anticipate the disease progression of early-stage B-cell chronic lymphocytic leukemia. Mediators Inflamm 2006; 3 : 1-6.
29. Krejci P, Dvorakova D, Krahulcova E. FGF-2 abnormalities in B cell chronic lymphocytic and chronic myeloid leukemia. Leukemia 2001; 15 : 228-237.
30. Werther K, Christensen IJ, Nielsen HJ. Determination of vascular endothelial growth factor (VEGF) in circulating blood: significance of VEGF in various leucocytes and platelets. Scand J Clin Lab Invest 2002; 62 : 343-350.
31. Webb NJ, Bottomley MJ, Watson CJ et al. Vascular endothelial growth factor (VEGF) is released from platelets during blood clotting: implications for measurement of circulating VEGF levels in clinical disease. Clin Sci (Lond) 1998; 94 : 395-404.
32. George ML, Eccles SA, Tutton MG et al. Correlation of plasma and serum vascular endothelial growth factor levels with platelet count in colorectal cancer: clinical evidence of platelet scavenging? Clin Cancer Res 2000; 6 : 3147-3152.
33. Banks RE, Forbes MA, Kinsey SE et al. Release of the angiogenic cytokine vascular endothelial growth factor (VEGF) from platelets: significance for VEGF measurements and cancer biology. Br J Cancer 1998; 77 : 956-964.
34. Vacca A, Iurlaro M, Ribatti D et al. Antiangiogenesis is produced by nontoxic doses of vinblastine. Blood 1999; 94 : 4143-4155.
35. Kerbel KS, Viloria-Petit A, Klement G et al. “Accidental” anti-angiogenic drugs: anti-oncogene directed signal transduction inhibitors and conventional chemotherapeutic agents as examples. Eur J Cancer 2000; 36 : 1248-1257.
36. Smolej L, Andrys C, Pekova S et al. Plasma levels of basic fibroblast growth factor and vascular endothelial growth factor and their association with IgVH mutation status in patients with B-cell chronic lymphocytic leukemia. Haematologica 2006; 91 : 1432-1433.
37. Chanan-Khan A, Miller KC, Takeshita K et al. Results of a phase 1 clinical trial of thalidomide in combination with fludarabine as initial therapy for patients with treatment-requiring chronic lymphocytic leukemia (CLL). Blood 2005; 106 : 3348-3352.
38. Chanan-Khan A. Targeting the microenvironment: a new treatment paradigm for chronic lymphocytic leukaemia. Haematologica Reports 2006; 2 : 22-27.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 11-
All articles in this issue
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Dlouhodobé výsledky srdeční resynchronizační léčby u pacientů s těžkým srdečním selháním
- Využití stanovení glykogenfosforylázy BB v diagnostice algické formy akutních koronárních syndromů
- Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
- Variabilita plazmatických hladin big endotelinu a NT-proBNP u nemocných se srdečním selháním v chronickém hemodialyzačním programu
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
- Vliv obezity na genovou expresi adiponektinu a jeho receptorů v subkutánní tukové tkáni
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Význam endoskopické cytoskopie u vyšetření trávicího traktu
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně a Společnosti infekčního lékařství České lékařské společnosti J.E. Purkyně
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

