-
Medical journals
- Career
Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
Authors: P. Němec 1,2; M. Goldbergová 2; T. Swobodnik 2; D. Polášková 2; M. Souček 1; A. Vašků 2
Authors‘ workplace: Revmatologická ambulance II. interní kliniky Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc. 1; Ústav patologické fyziologie Lékařská fakulty MU, Brno, přednostka prof. MUDr. Anna Vašků, CSc. 2
Published in: Vnitř Lék 2006; 52(4): 348-354
Category: Original Contributions
Overview
Úvod:
Matrix metaloproteinázy (MMP), které náleží do rodiny zinkdependentních endopetidáz, se účastní remodelace extracelulární matrix v řadě fyziologických a patologických dějů, včetně revmatoidní artritidy (RA). Revmatoidní artritida je chronické autoimunitní, zánětlivé, multisystémové onemocnění charakterizované mimo jiné degradací hyalinní kloubní chrupavky a vystupňovanou angiogenezou. Tyto procesy mohou být ovlivňovány MMP. Na druhou stranu mohou MMP potlačovat zánět degradací biologicky aktivních molekul, jako jsou cytokiny, chemokiny či receptory růstových faktorů. V séru a synoviální tekutině pacientů s RA jsou prokazovány zvýšené hladiny MMP-2 (gelatináza A). Polymorfizmus genu pro MMP-2 může ovlivňovat vnímavost ke vzniku a/nebo závažnost průběhu RA.Metoda:
Cílem studie bylo prokázat možný vztah mezi polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T) a RA. Do studie bylo zařazeno celkem 101 pacientů s RA, kteří splnili revidovaná diagnostická kritéria ACR, 1987 pro RA, s délkou trvání choroby minimálně 2 roky, a 101 zdravých dobrovolníků obdobné distribuce věku a pohlaví.Výsledky:
Nebyl zjištěn rozdíl v genotypových distribucích ani frekvencích alel polymorfizmů -1575A/G, -1306C/T a -735 C/T mezi pacienty s RA a kontrolní skupinou. Statisticky významný rozdíl byl pozorován mezi pacienty s RA a kontrolní skupinou v alelických frekvencích polymorfizmu -790 T/G MMP-2 (T alela -0,70 vs 0,66, Pa = 0,013). Rovněž byla pozorována tendence k nárůstu genotypu GG u pacientů s RA (Pg = 0,053). Statisticky významný rozdíl v alelických frekvencích byl rovněž pozorován mezi muži s RA a muži v kontrolní skupině (T alela -0,80 vs 0,61, Pa = 0,025). Navíc haplotyp GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T byl častější u pacientů s RA (Pcorr = 0,016; OR = 0,09; konfidenční interval 0,00-0,65), zatímco haplotyp GCTC byl více zastoupen u kontrolní skupiny (Pcorr = 0,017; OR = 1,8; konfidenční interval 1,17-2,70).Závěr:
Výsledky poukazují na možnou asociaci polymorfizmu v promotorové oblasti genu pro MMP-2 s vnímavostí ke vzniku RA.Klíčová slova:
revmatoidní artritida - gen - polymorfizmus - MMP-2Úvod
Revmatoidní artritida (RA) je chronické systémové zánětlivé autoimunitní onemocnění. Vyskytuje se celosvětově s prevalencí 0,5-2 % s jistými regionálními rozdíly. Nižší prevalence RA je v oblasti subsaharské Afriky a jihovýchodní Asie. Naopak vysoký výskyt RA byl zaznamenán u příslušníků indiánských kmenů Pima (5 %) a Chipewa (7 %) [1]. V České republice se prevalence pohybuje kolem 1 %. Incidence RA je udávána mezi 1-2/10 000 u mužů a 2-4/10 000 u žen [2]. RA postihuje všechny věkové skupiny s maximálním výskytem u premenopauzálních žen. U svých nositelů vede revmatoidní artritida dříve nebo později k disabilitě [2].
Iniciálními symptomy onemocnění jsou kloubní bolest a otok, provázený kloubní ztuhlostí a ve většině případů i celkovou reakcí organizmu. Místem patologického zánětlivého děje je synoviální výstelka v kloubech, burzách a šlachách [3]. Chronický zánět vede k tvorbě granulační zánětlivé tkáně (pannus) tvořené řadou imunokompetentních buněk (monocyty, dendritickými buňkami, synoviálními fibroblasty - FLS, T-lymfocyty, mastocyty a B-lymfocyty). Chronická synovitida způsobuje destrukci hyalinní chrupavky, eroze subchondrální kosti a v konečné fázi deformity postižených kloubů. Destrukce hyalinní chrupavky je mediována proteinázami, schopnými degradovat komponenty extracelulární matrix (ECM) chrupavky tvořenou zejména kolagenem typu II a makromolekulárními proteoglykanovými komplexy agrekanu. V patogenezi RA se uplatňují jednak matrixové metaloproteinázy (MMP) a dále, jak se ukazuje v poslední době, skupina tzv. disintegrin metaloproteináz (ADAM) [4]. Tyto skupiny proteináz jsou produkovány především synoviálními výstelkovými buňkami, stromálními buňkami v subintimální zóně synoviální membrány, neutrofily, synoviálními fibroblasty, chondrocyty a makrofágy [5-13]. V synoviální tekutině pacientů s RA jsou prokazovány signifikantně vyšší hladiny některých MMP (MMP-1, MMP-2, MMP-3, MMP-8, MMP-9, MMP-13) ve srovnání s pacienty s osteoartrózou (OA) [9,14-20]. Jiných mechanizmem degradace hyalinní chrupavky je apoptóza chondrocytů mediovaná oxidem dusnatým (NO) [4].
MMP patřící do rodiny zinkdependentních endopeptidáz se účastní remodelace ECM během řady fyziologických i patologických dějů včetně RA [21]. Jak bylo popsáno výše, MMP se mohou v patogenezi RA účastnit procesu degradace hyalinní chrupavky a zasahují i do procesu vystupňované angiogeneze. Na druhou stranu mohou MMP potlačovat zánět degradací biologicky aktivních molekul, jako jsou cytokiny, chemokiny či receptory růstových faktorů [22-26]. V séru a synoviální tekutině pacientů s RA jsou prokazovány mimo jiné zvýšené hladiny MMP-2 (gelatináza A) [20]. Předpokládá se, že hlavní rolí MMP-2 u RA může být zejména degradace zánětlivých faktorů a/nebo aktivace faktorů protizánětlivých [22].
RA je, co se týče věku vzniku prvních obtíží, spektra klinických projevů a stupně progrese onemocnění, značně heterogenní. Za klinickou heterogenitu může na jedné straně odpovídat genetická predispozice a na druhé straně i faktory zevního prostředí (viry, bakterie, stres, toxiny). Genetickou predispozici potvrzují poznatky získané ze studií dvojčat, kde se konkordance u monozygotních dvojčat pohybuje mezi 10-15 % a u dizygotních dvojčat 3,6 % [27]. Z výsledků celonárodní finské studie dvojčat vyplývá, že se dá očekávat až 65% podíl genetické determinace na vznik a vývoj RA bez vlivu faktorů, jako je pohlaví, věk, věk při vzniku choroby nebo aktivita RA [28].
Významný podíl genetické determinace RA připadá na geny hlavního histokompatibilního komplexu (u člověka HLA) [29]. Velikost příspěvku HLA genů k celkové genetické predispozici je odhadována na 30-50 % [30,31]. Bylo zjištěno, že genetická predispozice k RA je vázána na ty alely, které nesou stejný sekvenční motiv 5 aminokyselin (QKRAA/QRRAA) na pozicích 70-74 ve třetí hypervariabilní oblasti DRB1 (řetezec β) molekuly [32]. Tento úsek je označován jako tzv. sdílený epitop (shared epitope, SE). SE kódují následující alely (HLA-DRB1*0401, 0404, 0405, 0408, 0409, 0410 (HLA-DR4), HLA-DRB1*0101, 0102 (HLA-DR1), HLA-DRB1*1001 (HLA-DR 10) a HLA-DRB1*1402 (HLA-DR6) [33]. Alely kódující zmíněný motiv se vyskytují u více než 70 % pacientů s RA [34]. Pacienti s RA nesoucí SE mohou mít vyšší aktivitu a závažnější průběh choroby [35].
Předpokládá se však, že mimo HLA lokus existuje řada kandidátních genů majících vztah k RA [36]. Yamada et al analyzovali genom 48 pacientů s RA v rozsahu přibližně 104 Kb. Detekovali celkem 163 polymorfizmů 41 kandidátních genů asociovaných s RA. U 142 těchto polymorfizmů se jednalo o jednonukleotidové záměny (SNP), které se řadí k nejčastější formě variability genetické informace. Předpokládá se existence jedné SNP na zhruba 200-300 bází [37].
Jedním ze studovaných kandidátních genů byl i gen pro MMP-2. Gen pro MMP-2 je lokalizován na 16. chromozomu, v místě 16q13 - q21. Jeho délka je 17 kb, obsahuje 13 exonů (110 až 901 bp) a 12 intronů (175 až 4350 bp). Doposud bylo identifikováno 6 polymorfizmů v promotorové oblasti genu pro MMP-2, 1 v 5´ nepřekládané oblasti, 6 v kódující oblasti, 1 v sekvenci intronu a 10 v 3´ nepřekládané oblasti. V naší laboratoři byl identifikován polymorfizmus -735 C/T. Polymorfizmy genu pro MMP-2 by mohly ovlivňovat vnímavost ke vzniku a/nebo závažnost průběhu RA. Cílem naší studie bylo prokázat možný vztah mezi sledovanými polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T) a RA.
Metoda
Pacienti
Do studie bylo zařazeno celkem 101 pacientů s revmatoidní artritidou (RA), kteří byli vyšetření v průběhu roku 2004 v revmatologické ambulanci II. interní kliniky LF MU a FN u sv. Anny v Brně. Všichni pacienti splnili revidovaná kritéria American College of Rheumatology pro revmatoidní artritidu. Soubor zahrnoval 80 žen a 21 mužů věkového rozpětí 25-80 roků. Medián věku byl 54 roků. Minimální délka trvání choroby byla 2 roky. Kontrolní soubor zahrnoval 101 zdravých dobrovolníků obdobné distribuce věku (věkové rozpětí 23-86 roků, medián věku byl 51 roků) bez klinických a laboratorních známek revmatoidní artritidy. Studie byla schválena Etickou komisí FN u sv. Anny v Brně a LF MU v Brně. Zařazení jedince do projektu bylo podmíněno podpisem informovaného souhlasu a studie probíhala v souladu s Helsinskou deklarací schválenou na zasedání WMA v Edinburgu.
Detekce polymorfizmů MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T)
Pacientům i kontrolám byla odebrána periferní krev a z ní izolována DNA z leukocytů pomocí metody s využitím proteinázy K. Izolace DNA spočívala v lýze buněk v roztoku, který obsahuje 10 mM Tris - HCl (pH = 8,5), 0,1% SDS, 0,1 mg/ml proteinázy K. Proteináza K byla odtraněna extrakcí fenolem a po etanolové precipitaci a vysušení byl vzorek DNA rozpuštěn v TE pufru. Polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G a -735 C/T) byly detekovány pomocí PCR (polymerase chain reaction) a restrikční analýzy (RFLP - restriction fragment length polymorphism). Polymorfizmus -1575 G/A byl detekován pomocí PCR s produktem o velikosti 269 bp. Po restrikční analýze enzymem NmuCI (MBI Fermentas, USA) při 37 °C přes noc, nanesení na 2% agarózu (Serva) s ethydium bromidem a prosvícení v UV světle pak byly rozlišeny tři genotypy: GG (113 a 156 bp), GA (113,156 a 269 bp) a AA (269 bp). Polymorfizmus -1306 C/T byl detekován pomocí PCR s produktem o velikosti 193 bp. Po restrikční analýze enzymem FspBI (MBI Fermentas, USA) při 37 °C přes noc byly rozlišeny tři genotypy: CC (188 bp), CT (188, 162 a 26 bp) a TT (162, 26 bp). Polymorfizmus -790 T/G byl detekován pomocí PCR s produktem o velikosti 118 bp. Po restrikční analýze enzymem PvuI (MBI Fermentas, USA) přes noc, nanesením na 3% agarózu Metaphor byly rozlišeny tři genoty: TT (118 bp), GT (118,19 a 99 bp) a GG (19 a 99bp). Čtvrtý polymorfizmus -735 C/T byl detekován pomocí PCR s produktem o velikosti 300 bp. Po restrikční analýze enzymem HinfI (MBI Fermentas, USA) přes noc a gelové elektroforéze mohly být odečteny 3 genotypy: CC (300 bp), CT (300,254 a 46 bp) a TT (254 a 46 bp).
Statistická analýza
Genotypové distribuce byly kalkulovány χ2 testem. Statistická významnost rozdílů v alelických frekvencích mezi skupinami byla testována Fisherovým přesným testem. Shoda zastoupení jednotlivých variant polymorfizmu s Hardy-Weinbergerovou rovnováhou byla vypočtena χ2 testem. Haplotypové frekvence byly kalkulovány po rekonstrukci haplotypů z populačních dat dle Stephense et al (2001) a Stephense a Donella (2003). Statistická významnost byla testována Fisherovým přesným testem a síla testu (chyba druhého řádu) byla počítána pomocí programu EpiInfo6. Za signifikantní byla považována hladina 5 %.
Výsledky
Nebyl zjištěn rozdíl v genotypových distribucích ani frekvencích alel polymorfizmů -1575A/G, -1306C/T a -735 C/T mezi pacienty s RA a kontrolní skupinou (tab. 1).
Table 1. Genotypové distribuce a alelické frekvence polymorfizmů v promotorové oblasti genu pro MMP-2: pacienti s RA vs kontrolní skupina. 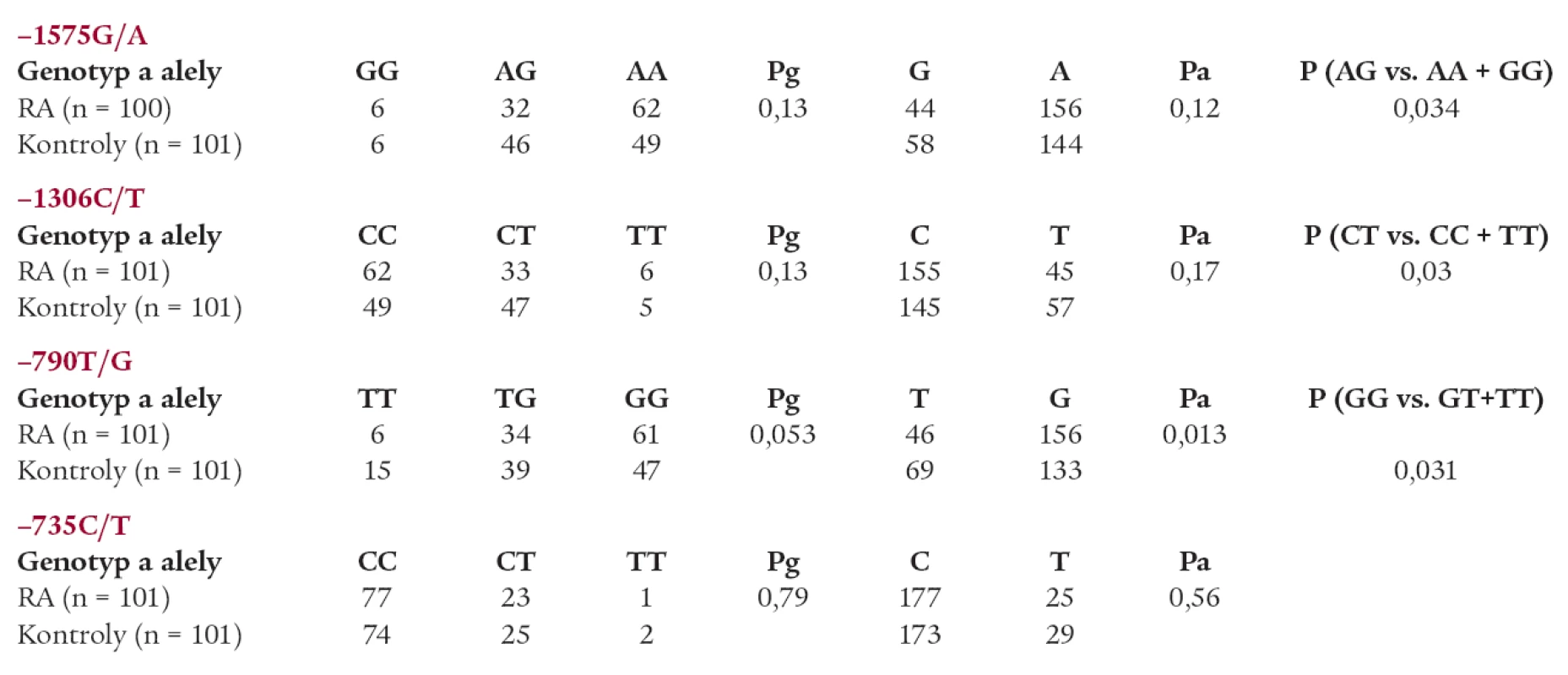
Statisticky významný rozdíl byl pozorován mezi pacienty s RA a kontrolní skupinou v alelických frekvencích polymorfizmu -790 T/G MMP-2 (T alela -0,70 vs 0,66, Pa = 0,013) (graf 1). Rovněž byl pozorován trend k nárůstu výskytu genotypu GG u pacientů s RA (Pg = 0,053) (graf 2). Statisticky významný rozdíl v alelických frekvencích byl rovněž pozorován mezi muži s RA a muži v kontrolní skupině (T alela -0,80 vs 0,61, Pa = 0,025).
Graph 1. –790 T/G MMP-2 alelické frekvence. 
Graph 2. –790 T/G MMP-2 genotypová distribuce. 
Navíc haplotyp GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T byl častěji zastoupen u pacientů s RA (P corr = 0,016;OR = 0,09; konfidenční interval 0,00-0,65), zatímco haplotyp GCTC byl více zastoupen u kontrolní skupiny (Pcorr = 0,017; OR = 1,8; konfidenční interval 1,17-2,70) (graf 3).
Graph 3. Haplotypové frekvence polymorfizmů –1575 G/A, –1306 C/T, –790 T/G, –735 C/T genu pro MMP-2. 
Diskuse
Rodina MMP zahrnuje minimálně 18 členů, kteří jsou rozděleni do 5 podskupin: (a) kolagenázy, zahrnující kolagenázu 1 (MMP-1), kolagenázu 2 (MMP-8) a kolagenázu 3 (MMP-13); (b) gelatinázy, gelatinázu A (MMP-2) a gelatinázu B (MMP-9); (c) stromelysiny, zahrnující stromelysin 1 (MMP-3), stromelysin 2 (MMP-10), stromelysin 3 (MMP-11); (d) membranový typ MMP (MT-MMP), zahrnující MT1-MMP (MMP-14), MT2-MMP (MMP-15), MT3-MMP (MMP-16), MT4-MMP (MMP-17) a MT5-MMP (MMP-24); (e) ostatní MMP, jako jsou matrilysin (MMP-7), stromelysin 3 (MMP-11), metaloelastáza (MMP-12), MMP-19, enamelysin (MMP-20) a MMP-23 [20,38-45]. Enzymatická aktivita těchto MMP je kontrolována specifickými tkáňovými inhibitory metaloproteináz (TIMP) (TIMP-1, TIMP-2, TIMP-3 a TIMP-4) [46,47,48]. Rovnováha mezi MMP a TIMP přítomnými v synoviální tkáni a synoviální tekutině může ovlivňovat míru degradace ECM. MMP-1 a MMP-3 jsou produkovány zejména synoviálními výstelkovými buňkami u pacientů s RA, zatím co MMP-2 je produkována stromálními buňkami subintimální zóny synoviální výstelky [5-7]. MMP-8 a MMP-9 jsou produkovány neutrofily a MMP-9 je navíc produkována makrofágy a rovněž synoviálními buňkami [8,9]. U pacientů s RA byla rovněž prokázána exprese těchto MMP chondrocyty a fibroblasty [10-13]. Různými skupinami jsou prokazovány signifikantně vyšší hladiny některých MMP (MMP-1, MMP-2, MMP-3, MMP-8, MMP-9, MMP-13) a TIMP-1 v synoviální tekutině pacientů s RA ve srovnání s nálezy u pacientů s OA nebo s traumatickým postižením kolenního kloubu [9,14-19].
MMP-2 patří spolu s MMP-9 do podskupiny gelatináz schopných štěpení základních komponent ECM hyalinní chrupavky (kolagenu typu I a agrekanu). V synoviální tekutině pacientů s RA jsou prokazovány zvýšené hladiny MMP-2 a MMP-9 [9,20,49]. Práce Itoha et al poukazuje na poněkud kontroverzní roli gelatináz v patogenezi RA [22]. Autoři sledovali vývoj protilátkami indukované artritidy (AbIA) jednoho ze zvířecích modelů RA, u MMP-2 knockout (KO) myší a MMP-9 KO myší. Překvapivým zjištěním bylo, že MMP-2 KO myši vyvinuly těžší histologický i klinický obraz artritidy než myši normální a naopak MMP-9 KO myši vyvinuly mírnější formu artritidy než myši normální. Zmírnění příznaků artritidy u MMP-2 KO myší bylo dosaženo injekcí normálních fibroblastů, schopných produkovat MMP-2 in vitro. Autoři tedy prokázali fakt, že zhoršení průběhu AbIA u MMP-2 KO myší souvisí s deficitem MMP-2. V poslední době je prokazována řada nových cílových substrátů pro MMP-2, jako jsou cytokiny (interleukin 1 β), chemokiny (monocyte chemoattractant-3) nebo receptor 1 růstového faktoru fibroblastů [23-25]. Protichůdné role MMP-2 a MMP-9 mohou být dány rozdílným spektrem substrátů [24,25].
Výsledky naší studie poukazují na možnou asociaci polymorfizmu v promotorové oblasti genu pro MMP-2 s vnímavostí ke vzniku RA. Pokud je nám známo, jedná se o první práci prokazující asociaci polymorfizmu -790 T/G MMP-2 s rizikem vývoje RA. Náš nález je navíc podpořen častějším zastoupením „rizikového“ haplotypu GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T genu pro MMP-2 u pacientů s RA a naopak častějším zastoupením haplotypu GCTC u zdravých kontrol.
Některé práce se již zabývaly asociací polymorfizmů genů jiných MMP a RA. V práci Dörra et al nebyla prokázána asociace mezi vnímavostí ke vzniku RA a polymorfizmem 1G/2G (delece/inzerce guaninu na pozici -1607) v promotorové oblasti genu pro MMP-1 a polymorfizmem 5A/6A (delece/inzerce adeninu na pozici -1171) v promotorové oblasti genu pro MMP-3 [50]. Stupeň radiografické progrese RA koreloval signifikantně s haplotypem 1G-5A. Haplotyp 1G-5A měl „protektivní“ efekt na radiografickou progresi RA. Homozygoti 2G/2G genu pro MMP-1 vykazovali během sledovaného období výraznější radiografickou progresi RA ve srovnání s homozygoty 1G/1G. Jiná práce tuto asociaci neprokázala [51]. Studie zabývající se asociací polymorfizmu MMP-3 přinesly rovněž kontroverzní výsledky [52]. Autoři neprokázali asociaci polymorfizmu 5A/6A s vnímavostí ke vzniku RA, ale naopak prokázali, že genotyp 6A/6A MMP-3 je asociovaný s výraznější RTG-progresí choroby v úvodu i na konci 4letého sledovacího období. Pacienti homozygoti 6A/6A pro MMP-3 a pro DRB1 SE měli výraznější RTG-progresi choroby.
Získané výsledky naší práce bude nutné ověřit na větším souboru pacientů s RA. Plánujeme studovat možnou asociaci mezi promotorovými polymorfizmy MMP-2 a závažností průběhu RA. Otázkou rovněž zůstává, zda polymorfizmus v promotorové oblasti genu pro MMP-2 ovlivňuje míru exprese DNA.
Studie byla podpořena grantovým projektem NR7812-3/2004, IGA Ministerstva zdravotnictví České republiky.
MUDr. Petr Němec
www.fnusa.cz
e-mail: petr.nemec@fnusa.cz
Doručeno do redakce: 23. 12. 2005
Přijato po recenzi: 31. 1. 2006
Sources
1. Harney SM, Newton JL, Worsworth BP. Molecular genetics of rheumatoid arthritis. Curr Opin Pharmacol 2003; 3 : 280-285.
2. Lawrence RC, Helmick GG, Arnett FC et al. Estimates of the prevalence of arthritis and selected musculosceletal disorders in the United States. Arthritis Rheum 1998; 41 : 778-799.
3. Goldring SR. Pathogenesis of bone and cartilage destruction in rheumatoid arthritis. Rheumatology (Oxford) 2003; 42(Suppl 2): ii11-ii16.
4. Yamada H, Yoshihara Y. Mechanism of cartilage destruction in rheumatoid arthritis. Clin Calcium 2003; 13 : 702-708.
5. Hembry RM, Bagga MR, Reynolds JJ et al. Immunolocalization studies on six matrix metalloproteinases and their inhibitors, TIMP-1 and TIMP-2, in synovia from patients with osteo - and rheumatoid arthritis. Ann Rheum Dis 1995; 54 : 25-32.
6. Okada Y, Takeuchi N, Tomita K et al. Immunolocalization of matrix metalloproteinase 3 (stromelysin) in rheumatoid synovioblasts (B cell): correlation with rheumatoid arthritis. Ann Rheum Dis 1989; 48 : 645-653.
7. Okada Y, Gonoji Y, Nakanishi I et al. Immunohistochemical demonstration of collagenase and tissue inhibitor of metalloproteinases (TIMP) in synovial lining cells of rheumatoid synovium. Virch Arch B Cell Pathol 1990; 59 : 305-312.
8. Grillet B, Dequeker J, Paemen L et al. Gelatinase B in synovitis: immunolocalization with a monoclonal antibody. Br J Rheumatol 1997; 36 : 744-747.
9. Ahrens D, Koch AE, Pope RM et al. Expression of matrix metalloproteinase 9 (96-kd gelatinase B) in human rheumatoid arthritis. Arthritis Rheum 1996; 39 : 1576-1587.
10. Stephenson ML, Goldring MB, Birkhead JR et al. Stimulation of procollagenase synthesis parallels increases in cellular procollagenase mRNA in human articular chondrocytes exposed to recombinant interleukin-1β. Biochem Biophys Res Commun 1987; 144 : 583-590.
11. Okada Y, Shinmei M, Tanaka O et al. Localization of matrix metalloproteinase 3 (stromelysin) in osteoarthritic cartilage and synovium. Lab Invest 1992; 66 : 680-690.
12. Cole AA, Chubinskaya S, Schumacher B et al. Chondrocyte matrix metalloproteinase-8. Human articular chondrocytes express neutrophil collagenase. J Biol Chem 1996; 271 : 11023-11026.
13. Mohtai M, Smith RL, Schurman DJ et al. Expression of 92-kDa type IV collagenase/gelatinase (gelatinase B) in osteoarthritic cartilage and its induction in normal human articular cartilage by interleukin 1. J Clin Invest 1993; 92 : 179-185.
14. Walakovits LA, Moore VL, Bhardwaj N et al. Detection of stromelysin and collagenase in synovial fluid from patients with rheumatoid arthritis and posttraumatic knee injury. Arthritis Rheum 1992; 35 : 35-42.
15. Clark IM, Powell LK, Ramsey S et al. The measurement of collagenase, tissue inhibitor of metalloproteinases (TIMP), and collagenase-TIMP complex in synovial fluids from patients with osteoarthritis and rheumatoid arthritis. Arthritis Rheum 1993; 36 : 372-379.
16. Yoshihara Y, Obata K, Fujimoto N et al. Increased levels of stromelysin-1 and tissue inhibitor of metalloproteinases-1 in serum from patients with rheumatoid arthritis. Arthritis Rheum 1995; 38 : 969-975.
17. Shinmei M, Kobayashi T, Yoshihara Y et al. Significance of the levels of carboxy terminal type II procollagen peptide, chondroitin sulfate isomers, tissue inhibitor of metalloproteinases, and metalloproteinases in osteoarthritis joint fluid. J Rheumatol 1995; 22(Suppl 43): 78-81.
18. Matsuki H, Fujimoto N, Iwata K et al. A one-step sandwich enzyme immunoassay for human matrix metalloproteinase 8 (neutrophil collagenase) using monoclonal antibodies. Clin Chim Acta 1996; 244 : 129-143.
19. Sopata I, Wize J, Filipowicz-Sosnowska A et al. Neutrophil gelatinase levels in plasma and synovial fluid of patients with rheumatic diseases. Rheumatol Int 1995; 15 : 9-14.
20. Yoshihara Y, Nakamura H, Obata K et al. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in synovial fluids from patients with rheumatoid arthritis or osteoarthritis. Ann Rheum Dis 2000; 59 : 455-461.
21. Nagase H, Woessner JF. Matrix Metalloproteinases. J Biol. Chem 1999; 274 : 21491-21494.
22. Itoh T, Matsuda H, Tanioka M et al. The role of matrix metalloproteinase-2 and matrix metalloproteinase-9 in antibody-induced arthritis. J Immunol 2002; 169 : 2643-2647.
23. Ito A, Mukaiyama A, Itoh Y et al. Degradation of interleukin 1 beta by matrix metalloproteinases. J Biol Chem 1996; 271 : 14657-14660.
24. McQuibban GA, Gong JH, Tam EM et al. Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant-3. Science 2000; 289 : 1202-1206.
25. Levi E, Fridman R, Miao HQ et al. Matrix metalloproteinase 2 releases active soluble ectodomain of fibroblast growth factor receptor 1. Proc Acad Sci USA 1996; 93 : 7069-7074.
26. Cawley LJ, Matrisian LM. Matrix metalloproteinases: they´re not just for matrix anymore! Curr Opin Cell Biol 2001; 13 : 534-540.
27. Aho K, Koskenvuo M, Tuominen J et al. Occurrence of rheumatoid arthritis in a nationwide series of twin. J Rheumatol 1986; 13 : 899-902.
28. MacGregor AJ, Snieder H, Rigby AS et al. Characterizing the quantitative genetic contribution to rheumatoid arthritis using data from twins. Arthritis Rheum 2000; 43 : 30-37.
29. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 389-466.
30. Gregersen PK. Genetics of rheumatoid arthritis: confronting complexity. Arthritis Res 1999; 1 : 37-44.
31. Seldin MF, Amos CI, Ward R et al. The genetics revolution and the assault on rheumatoid arthritis. Arthritis Rheum 1999; 42 : 1071-1079.
32. Singal DP, Li J, Lei K. Genetics of rheumatoid arthritis (RA): two separate regions in the major histocompatibility complex contribute to susceptibility to RA. Immunol Letters 1999; 69 : 301-306.
33. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 398-466.
34. Rowley MJ, Stockman A, Brand CA et al. The effect of HLA-DRB1 disease susceptibility markers on the expression of RA. Scand J Rheumatol 1997; 26 : 448-455.
35. Vencovský J, Pešáková V, Kafková J et al. Přínos některých laboratorních vyšetření k diagnostice a hodnocení revmatoidní artritidy. Čes Revmatol 1999; 7 : 155-165.
36. Yamada R, Tanaka T, Ohnishi Y et al. Identification of 142 single nucleotide polymorphisms in 41 candidate genes for rheumatoid arthritis in the Japanese population. Hum Genet 2000; 106 : 293-297.
37. Halushka MK, Fan JB, Bentley K et al. Patterns of single nucleotide polymorphisms in candidate genes of blood-presure homeostasis. Nat Genet 1999; 22 : 239-247.
38. Sato H, Takino T, Okada Y et al. A matrix metalloproteinase expressed on the surface of invasive tumor cells. Nature 1994; 370 : 61-65.
39. Takino T, Sato H, Shinagawa A et al. Identification of the second membrane-type matrix metalloproteinase (MT-MMP-2) gene from a human placenta cDNA library. MT-MMPs form a unique membrane-type subclass in the MMP family. J Biol Chem 1995; 270 : 23013-23020.
40. Will H, Hinzmann B. cDNA sequence and mRNA tissue distribution of novel human matrix metalloproteinase with a potential transmembrane segment. Eur J Biochem 1995; 231 : 602-608.
41. Puente XS, Pendás AM, Liano E et al. Molecular cloning of novel membrane-type matrix metalloproteinase from a human breast carcinoma. Cancer Res 1996; 56 : 944-949.
42. Pei D. Identification and characterization of the fifth membrane-type matrix metalloproteinase MT5-MMP. J Biol Chem 1999; 274 : 8925-8932.
43. Pendas AM, Knäuper V, Puente XS et al. Identification and characterization of a novel human matrix metalloproteinase with unique structural characteristics, chromosomal location, and tissue distribution. J Biol Chem 1997; 272 : 4281-4286.
44. Bartlett JD, Simmer JP, Xue J et al. Molecular cloning and mRNA tissue distribution of a novel matrix metalloproteinase isolated from porcine enamel organ. Gene 1996; 183 : 123-128.
45. Velasco G, Pendas AM, Fueyo A et al. Cloning and characterization of human MMP-23, a new matrix metalloproteinase predominantly expressed in reproductive tissues and lacking conserved domains in other family members. J Biol Chem 1999; 274 : 4570-4576.
46. Uría JA, Ferrando AA, Velasco G et al. Structure and expression in breast tumors of human TIMP-3, a new member of the metalloproteinase inhibitor family. Cancer Res 1994; 54 : 2091-2094.
47. Greene J, Wang M, Liu YE et al. Molecular cloning and characterization of human tissue inhibitor of metalloproteinase 4. J Biol Chem 1996; 271 : 30375-30380.
48. Nagase H, Okada Y. Proteinases and matrix degradation. In: Kelly WN, Harris ED Jr, Ruddy S et al (eds). The text book of rheumatology. 5th ed. Philadelphia: WB Saunders 1996; 323-341.
49. Jovanovic DV, Martel-Pelletier J, Di Battista JA et al. Stimulation of 92-kd gelatinase (matrix metalloproteinase 9) production by interleukin-17 in human monocyte/macrophages: a possible role in rheumatoid arthritis. Arthritis Rheum 2000; 43 : 1134-1144.
50. Dörr S, Lechtenböhmer N, Rau R et al. Association of a specific haplotype across the genes MMP1 nd MMP-3 with radiographic joint destruction in rheumatoid arthritis. Arthritis Res Ther 2004; 6: R199-R207.
51. Constantin A, Lauwers-Cances V, Navaux F et al. Collagenase-1 (MMP-1) and HLA-DRB1 gene polymorphisms in rheumatoid arthritis: a prospective longitudinal study. J Rheumatol 2002; 29 : 15-20.
52. Constantin A, Lauwers-Cances V, Navaux F et al. Stromelysin 1 (matrix metalloproteinase 3) and HLA-DRB1 gene polymorphisms: association with severity and progression of rheumatoid arthritis in a prospective study. Arthritis Rheum 2002; 46 : 1754-1762.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 4-
All articles in this issue
- Jsou chronická onemocnění ledvin a poruchy ledvinné funkce na standardním lůžku interních oborů dostatečně diagnostikovány?
- Nefarmakologická léčba hypertrofické obstrukční kardiomyopatie - srovnání výsledků léčby metodami perkutánní transluminální septální myokardiální ablace a 2dutinové kardiostimulace
- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Pozdní kardiotoxicita u nemocných léčených pro maligní lymfomy chemoterapií s doxorubicinem
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
- Histiocytóza z Langerhansových buněk u osob dospělého věku - zkušenosti jednoho pracoviště a přehled léčebných možností
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
- Problémy s interpretací nízkých hladin tyreoidálních hormonů podmíněné změnami v transportních proteinech
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

