-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
Polymorphism of gene promotor region for MMP-2 in rheumatoid arthritis
Introduction:
Matrix metalloproteinase (MMP) belonging to family of zinc-dependent endopeptidases participates in remodelling of extracellular matrix in many physiological and pathological processes including rheumatoid arthritis (RA). Rheumatoid arthritis is a chronic autoimmune inflammatory multi-systemic disease characterized, among others, by degradation of hyaline articular cartilage and escalated angiogenesis. As a matter of fact, these processes may by influenced by MMP. On the other hand, MMP can suppress inflammation by degrading biologically active molecules like cytokines, chemokines or growth factor receptors. Increased levels of MMP-2 (gelatinase A) are observed in serum and synovial fluid of patients with RA. Gene polymorphism for MMP-2 can affect susceptibility to development and/or severity of RA.Method:
The aim of the study was to prove possible association of polymorphisms in gene promotor region for MMP-2 (–1575 G/A, –1306 C/T, –790 T/G, –735 C/T) with RA. We worked with 101 patients with RA who met reviewed diagnostic criteria of ACR (1987) for RA, and suffer from RA for at least 2 years. Control group consisted of 101 healthy volunteers of similar age and gender distribution.Results:
RA patients and control group did not differ in genotype distributions or frequencies of alleles of polymorphisms –1575A/G, –1306C/T and –735 C/T. Significant difference was observed between RA patients and control group in allelic frequencies of polymorphism –790 T/G MMP-2 (T allele –0.70 vs. 0.66, Pa = 0.013). Also, a tendency of GG genotype growth was noted in RA patients (Pg = 0.053). Significant difference in allelic frequencies was also observed between men with RA and men from control group (T allele –0.80 vs. 0.61, Pa = 0.025). Haplotype of GCGC polymorphisms –1575 G/A, –1306 C/T, –790 T/G, –735 C/T was more frequent in RA patients (Pcorr = 0.016; OR = 0.09; confidence interval 0.00–0.65), whereas GCTC haplotype was noted more frequently in control group (Pcorr = 0.017; OR = 1.8; confidence interval 1.17–2.70).Conclusion:
The results indicate the association between polymorphisms in gene promotor region for MMP-2 and susceptibility to development of RA.Key words:
Rheumatoid arthritis – gene – polymorphism – MMP-2
Autoři: P. Němec 1,2; M. Goldbergová 2; T. Swobodnik 2; D. Polášková 2; M. Souček 1; A. Vašků 2
Působiště autorů: Revmatologická ambulance II. interní kliniky Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc. 1; Ústav patologické fyziologie Lékařská fakulty MU, Brno, přednostka prof. MUDr. Anna Vašků, CSc. 2
Vyšlo v časopise: Vnitř Lék 2006; 52(4): 348-354
Kategorie: Původní práce
Souhrn
Úvod:
Matrix metaloproteinázy (MMP), které náleží do rodiny zinkdependentních endopetidáz, se účastní remodelace extracelulární matrix v řadě fyziologických a patologických dějů, včetně revmatoidní artritidy (RA). Revmatoidní artritida je chronické autoimunitní, zánětlivé, multisystémové onemocnění charakterizované mimo jiné degradací hyalinní kloubní chrupavky a vystupňovanou angiogenezou. Tyto procesy mohou být ovlivňovány MMP. Na druhou stranu mohou MMP potlačovat zánět degradací biologicky aktivních molekul, jako jsou cytokiny, chemokiny či receptory růstových faktorů. V séru a synoviální tekutině pacientů s RA jsou prokazovány zvýšené hladiny MMP-2 (gelatináza A). Polymorfizmus genu pro MMP-2 může ovlivňovat vnímavost ke vzniku a/nebo závažnost průběhu RA.Metoda:
Cílem studie bylo prokázat možný vztah mezi polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T) a RA. Do studie bylo zařazeno celkem 101 pacientů s RA, kteří splnili revidovaná diagnostická kritéria ACR, 1987 pro RA, s délkou trvání choroby minimálně 2 roky, a 101 zdravých dobrovolníků obdobné distribuce věku a pohlaví.Výsledky:
Nebyl zjištěn rozdíl v genotypových distribucích ani frekvencích alel polymorfizmů -1575A/G, -1306C/T a -735 C/T mezi pacienty s RA a kontrolní skupinou. Statisticky významný rozdíl byl pozorován mezi pacienty s RA a kontrolní skupinou v alelických frekvencích polymorfizmu -790 T/G MMP-2 (T alela -0,70 vs 0,66, Pa = 0,013). Rovněž byla pozorována tendence k nárůstu genotypu GG u pacientů s RA (Pg = 0,053). Statisticky významný rozdíl v alelických frekvencích byl rovněž pozorován mezi muži s RA a muži v kontrolní skupině (T alela -0,80 vs 0,61, Pa = 0,025). Navíc haplotyp GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T byl častější u pacientů s RA (Pcorr = 0,016; OR = 0,09; konfidenční interval 0,00-0,65), zatímco haplotyp GCTC byl více zastoupen u kontrolní skupiny (Pcorr = 0,017; OR = 1,8; konfidenční interval 1,17-2,70).Závěr:
Výsledky poukazují na možnou asociaci polymorfizmu v promotorové oblasti genu pro MMP-2 s vnímavostí ke vzniku RA.Klíčová slova:
revmatoidní artritida - gen - polymorfizmus - MMP-2Úvod
Revmatoidní artritida (RA) je chronické systémové zánětlivé autoimunitní onemocnění. Vyskytuje se celosvětově s prevalencí 0,5-2 % s jistými regionálními rozdíly. Nižší prevalence RA je v oblasti subsaharské Afriky a jihovýchodní Asie. Naopak vysoký výskyt RA byl zaznamenán u příslušníků indiánských kmenů Pima (5 %) a Chipewa (7 %) [1]. V České republice se prevalence pohybuje kolem 1 %. Incidence RA je udávána mezi 1-2/10 000 u mužů a 2-4/10 000 u žen [2]. RA postihuje všechny věkové skupiny s maximálním výskytem u premenopauzálních žen. U svých nositelů vede revmatoidní artritida dříve nebo později k disabilitě [2].
Iniciálními symptomy onemocnění jsou kloubní bolest a otok, provázený kloubní ztuhlostí a ve většině případů i celkovou reakcí organizmu. Místem patologického zánětlivého děje je synoviální výstelka v kloubech, burzách a šlachách [3]. Chronický zánět vede k tvorbě granulační zánětlivé tkáně (pannus) tvořené řadou imunokompetentních buněk (monocyty, dendritickými buňkami, synoviálními fibroblasty - FLS, T-lymfocyty, mastocyty a B-lymfocyty). Chronická synovitida způsobuje destrukci hyalinní chrupavky, eroze subchondrální kosti a v konečné fázi deformity postižených kloubů. Destrukce hyalinní chrupavky je mediována proteinázami, schopnými degradovat komponenty extracelulární matrix (ECM) chrupavky tvořenou zejména kolagenem typu II a makromolekulárními proteoglykanovými komplexy agrekanu. V patogenezi RA se uplatňují jednak matrixové metaloproteinázy (MMP) a dále, jak se ukazuje v poslední době, skupina tzv. disintegrin metaloproteináz (ADAM) [4]. Tyto skupiny proteináz jsou produkovány především synoviálními výstelkovými buňkami, stromálními buňkami v subintimální zóně synoviální membrány, neutrofily, synoviálními fibroblasty, chondrocyty a makrofágy [5-13]. V synoviální tekutině pacientů s RA jsou prokazovány signifikantně vyšší hladiny některých MMP (MMP-1, MMP-2, MMP-3, MMP-8, MMP-9, MMP-13) ve srovnání s pacienty s osteoartrózou (OA) [9,14-20]. Jiných mechanizmem degradace hyalinní chrupavky je apoptóza chondrocytů mediovaná oxidem dusnatým (NO) [4].
MMP patřící do rodiny zinkdependentních endopeptidáz se účastní remodelace ECM během řady fyziologických i patologických dějů včetně RA [21]. Jak bylo popsáno výše, MMP se mohou v patogenezi RA účastnit procesu degradace hyalinní chrupavky a zasahují i do procesu vystupňované angiogeneze. Na druhou stranu mohou MMP potlačovat zánět degradací biologicky aktivních molekul, jako jsou cytokiny, chemokiny či receptory růstových faktorů [22-26]. V séru a synoviální tekutině pacientů s RA jsou prokazovány mimo jiné zvýšené hladiny MMP-2 (gelatináza A) [20]. Předpokládá se, že hlavní rolí MMP-2 u RA může být zejména degradace zánětlivých faktorů a/nebo aktivace faktorů protizánětlivých [22].
RA je, co se týče věku vzniku prvních obtíží, spektra klinických projevů a stupně progrese onemocnění, značně heterogenní. Za klinickou heterogenitu může na jedné straně odpovídat genetická predispozice a na druhé straně i faktory zevního prostředí (viry, bakterie, stres, toxiny). Genetickou predispozici potvrzují poznatky získané ze studií dvojčat, kde se konkordance u monozygotních dvojčat pohybuje mezi 10-15 % a u dizygotních dvojčat 3,6 % [27]. Z výsledků celonárodní finské studie dvojčat vyplývá, že se dá očekávat až 65% podíl genetické determinace na vznik a vývoj RA bez vlivu faktorů, jako je pohlaví, věk, věk při vzniku choroby nebo aktivita RA [28].
Významný podíl genetické determinace RA připadá na geny hlavního histokompatibilního komplexu (u člověka HLA) [29]. Velikost příspěvku HLA genů k celkové genetické predispozici je odhadována na 30-50 % [30,31]. Bylo zjištěno, že genetická predispozice k RA je vázána na ty alely, které nesou stejný sekvenční motiv 5 aminokyselin (QKRAA/QRRAA) na pozicích 70-74 ve třetí hypervariabilní oblasti DRB1 (řetezec β) molekuly [32]. Tento úsek je označován jako tzv. sdílený epitop (shared epitope, SE). SE kódují následující alely (HLA-DRB1*0401, 0404, 0405, 0408, 0409, 0410 (HLA-DR4), HLA-DRB1*0101, 0102 (HLA-DR1), HLA-DRB1*1001 (HLA-DR 10) a HLA-DRB1*1402 (HLA-DR6) [33]. Alely kódující zmíněný motiv se vyskytují u více než 70 % pacientů s RA [34]. Pacienti s RA nesoucí SE mohou mít vyšší aktivitu a závažnější průběh choroby [35].
Předpokládá se však, že mimo HLA lokus existuje řada kandidátních genů majících vztah k RA [36]. Yamada et al analyzovali genom 48 pacientů s RA v rozsahu přibližně 104 Kb. Detekovali celkem 163 polymorfizmů 41 kandidátních genů asociovaných s RA. U 142 těchto polymorfizmů se jednalo o jednonukleotidové záměny (SNP), které se řadí k nejčastější formě variability genetické informace. Předpokládá se existence jedné SNP na zhruba 200-300 bází [37].
Jedním ze studovaných kandidátních genů byl i gen pro MMP-2. Gen pro MMP-2 je lokalizován na 16. chromozomu, v místě 16q13 - q21. Jeho délka je 17 kb, obsahuje 13 exonů (110 až 901 bp) a 12 intronů (175 až 4350 bp). Doposud bylo identifikováno 6 polymorfizmů v promotorové oblasti genu pro MMP-2, 1 v 5´ nepřekládané oblasti, 6 v kódující oblasti, 1 v sekvenci intronu a 10 v 3´ nepřekládané oblasti. V naší laboratoři byl identifikován polymorfizmus -735 C/T. Polymorfizmy genu pro MMP-2 by mohly ovlivňovat vnímavost ke vzniku a/nebo závažnost průběhu RA. Cílem naší studie bylo prokázat možný vztah mezi sledovanými polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T) a RA.
Metoda
Pacienti
Do studie bylo zařazeno celkem 101 pacientů s revmatoidní artritidou (RA), kteří byli vyšetření v průběhu roku 2004 v revmatologické ambulanci II. interní kliniky LF MU a FN u sv. Anny v Brně. Všichni pacienti splnili revidovaná kritéria American College of Rheumatology pro revmatoidní artritidu. Soubor zahrnoval 80 žen a 21 mužů věkového rozpětí 25-80 roků. Medián věku byl 54 roků. Minimální délka trvání choroby byla 2 roky. Kontrolní soubor zahrnoval 101 zdravých dobrovolníků obdobné distribuce věku (věkové rozpětí 23-86 roků, medián věku byl 51 roků) bez klinických a laboratorních známek revmatoidní artritidy. Studie byla schválena Etickou komisí FN u sv. Anny v Brně a LF MU v Brně. Zařazení jedince do projektu bylo podmíněno podpisem informovaného souhlasu a studie probíhala v souladu s Helsinskou deklarací schválenou na zasedání WMA v Edinburgu.
Detekce polymorfizmů MMP-2 (-1575 G/A, -1306 C/T, -790 T/G, -735 C/T)
Pacientům i kontrolám byla odebrána periferní krev a z ní izolována DNA z leukocytů pomocí metody s využitím proteinázy K. Izolace DNA spočívala v lýze buněk v roztoku, který obsahuje 10 mM Tris - HCl (pH = 8,5), 0,1% SDS, 0,1 mg/ml proteinázy K. Proteináza K byla odtraněna extrakcí fenolem a po etanolové precipitaci a vysušení byl vzorek DNA rozpuštěn v TE pufru. Polymorfizmy v promotorové oblasti genu pro MMP-2 (-1575 G/A, -1306 C/T, -790 T/G a -735 C/T) byly detekovány pomocí PCR (polymerase chain reaction) a restrikční analýzy (RFLP - restriction fragment length polymorphism). Polymorfizmus -1575 G/A byl detekován pomocí PCR s produktem o velikosti 269 bp. Po restrikční analýze enzymem NmuCI (MBI Fermentas, USA) při 37 °C přes noc, nanesení na 2% agarózu (Serva) s ethydium bromidem a prosvícení v UV světle pak byly rozlišeny tři genotypy: GG (113 a 156 bp), GA (113,156 a 269 bp) a AA (269 bp). Polymorfizmus -1306 C/T byl detekován pomocí PCR s produktem o velikosti 193 bp. Po restrikční analýze enzymem FspBI (MBI Fermentas, USA) při 37 °C přes noc byly rozlišeny tři genotypy: CC (188 bp), CT (188, 162 a 26 bp) a TT (162, 26 bp). Polymorfizmus -790 T/G byl detekován pomocí PCR s produktem o velikosti 118 bp. Po restrikční analýze enzymem PvuI (MBI Fermentas, USA) přes noc, nanesením na 3% agarózu Metaphor byly rozlišeny tři genoty: TT (118 bp), GT (118,19 a 99 bp) a GG (19 a 99bp). Čtvrtý polymorfizmus -735 C/T byl detekován pomocí PCR s produktem o velikosti 300 bp. Po restrikční analýze enzymem HinfI (MBI Fermentas, USA) přes noc a gelové elektroforéze mohly být odečteny 3 genotypy: CC (300 bp), CT (300,254 a 46 bp) a TT (254 a 46 bp).
Statistická analýza
Genotypové distribuce byly kalkulovány χ2 testem. Statistická významnost rozdílů v alelických frekvencích mezi skupinami byla testována Fisherovým přesným testem. Shoda zastoupení jednotlivých variant polymorfizmu s Hardy-Weinbergerovou rovnováhou byla vypočtena χ2 testem. Haplotypové frekvence byly kalkulovány po rekonstrukci haplotypů z populačních dat dle Stephense et al (2001) a Stephense a Donella (2003). Statistická významnost byla testována Fisherovým přesným testem a síla testu (chyba druhého řádu) byla počítána pomocí programu EpiInfo6. Za signifikantní byla považována hladina 5 %.
Výsledky
Nebyl zjištěn rozdíl v genotypových distribucích ani frekvencích alel polymorfizmů -1575A/G, -1306C/T a -735 C/T mezi pacienty s RA a kontrolní skupinou (tab. 1).
Tab. 1. Genotypové distribuce a alelické frekvence polymorfizmů v promotorové oblasti genu pro MMP-2: pacienti s RA vs kontrolní skupina. 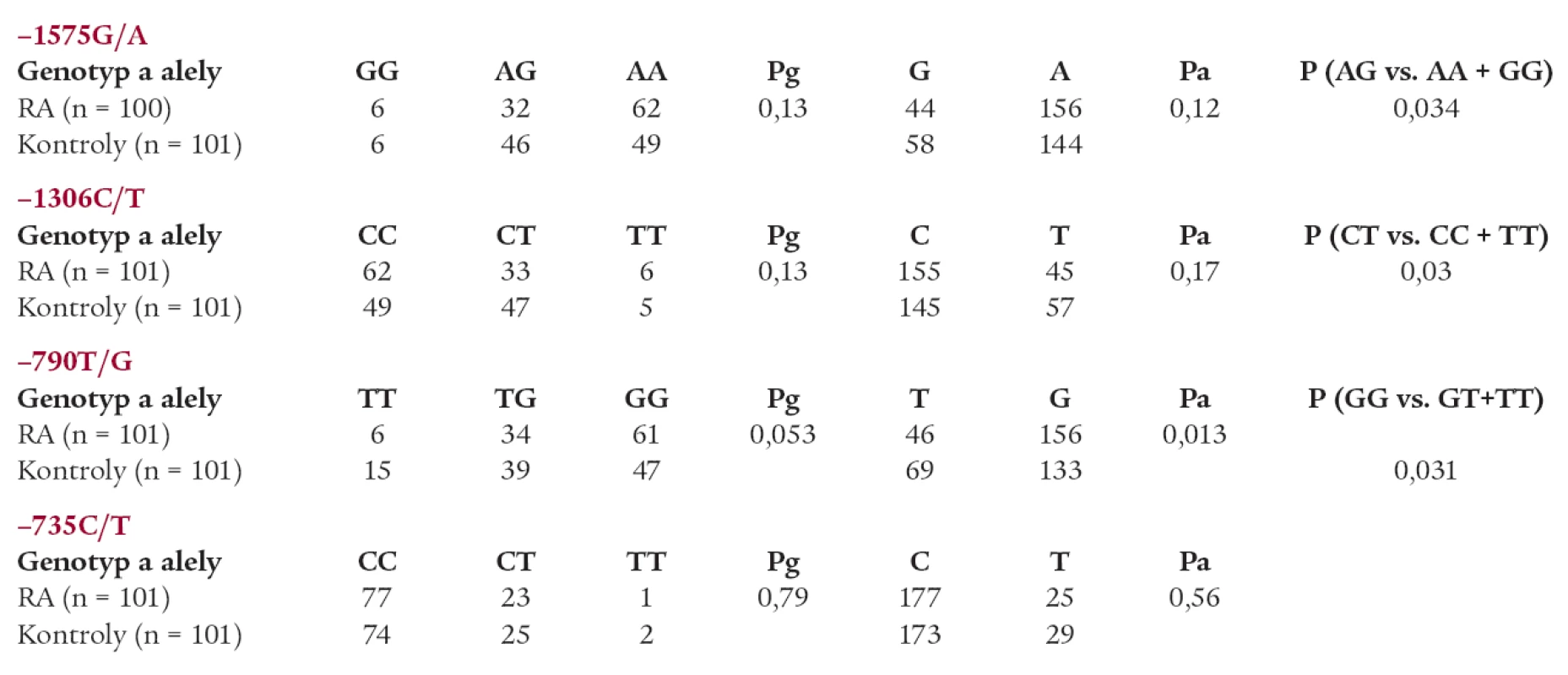
Statisticky významný rozdíl byl pozorován mezi pacienty s RA a kontrolní skupinou v alelických frekvencích polymorfizmu -790 T/G MMP-2 (T alela -0,70 vs 0,66, Pa = 0,013) (graf 1). Rovněž byl pozorován trend k nárůstu výskytu genotypu GG u pacientů s RA (Pg = 0,053) (graf 2). Statisticky významný rozdíl v alelických frekvencích byl rovněž pozorován mezi muži s RA a muži v kontrolní skupině (T alela -0,80 vs 0,61, Pa = 0,025).
Graf 1. –790 T/G MMP-2 alelické frekvence. 
Graf 2. –790 T/G MMP-2 genotypová distribuce. 
Navíc haplotyp GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T byl častěji zastoupen u pacientů s RA (P corr = 0,016;OR = 0,09; konfidenční interval 0,00-0,65), zatímco haplotyp GCTC byl více zastoupen u kontrolní skupiny (Pcorr = 0,017; OR = 1,8; konfidenční interval 1,17-2,70) (graf 3).
Graf 3. Haplotypové frekvence polymorfizmů –1575 G/A, –1306 C/T, –790 T/G, –735 C/T genu pro MMP-2. 
Diskuse
Rodina MMP zahrnuje minimálně 18 členů, kteří jsou rozděleni do 5 podskupin: (a) kolagenázy, zahrnující kolagenázu 1 (MMP-1), kolagenázu 2 (MMP-8) a kolagenázu 3 (MMP-13); (b) gelatinázy, gelatinázu A (MMP-2) a gelatinázu B (MMP-9); (c) stromelysiny, zahrnující stromelysin 1 (MMP-3), stromelysin 2 (MMP-10), stromelysin 3 (MMP-11); (d) membranový typ MMP (MT-MMP), zahrnující MT1-MMP (MMP-14), MT2-MMP (MMP-15), MT3-MMP (MMP-16), MT4-MMP (MMP-17) a MT5-MMP (MMP-24); (e) ostatní MMP, jako jsou matrilysin (MMP-7), stromelysin 3 (MMP-11), metaloelastáza (MMP-12), MMP-19, enamelysin (MMP-20) a MMP-23 [20,38-45]. Enzymatická aktivita těchto MMP je kontrolována specifickými tkáňovými inhibitory metaloproteináz (TIMP) (TIMP-1, TIMP-2, TIMP-3 a TIMP-4) [46,47,48]. Rovnováha mezi MMP a TIMP přítomnými v synoviální tkáni a synoviální tekutině může ovlivňovat míru degradace ECM. MMP-1 a MMP-3 jsou produkovány zejména synoviálními výstelkovými buňkami u pacientů s RA, zatím co MMP-2 je produkována stromálními buňkami subintimální zóny synoviální výstelky [5-7]. MMP-8 a MMP-9 jsou produkovány neutrofily a MMP-9 je navíc produkována makrofágy a rovněž synoviálními buňkami [8,9]. U pacientů s RA byla rovněž prokázána exprese těchto MMP chondrocyty a fibroblasty [10-13]. Různými skupinami jsou prokazovány signifikantně vyšší hladiny některých MMP (MMP-1, MMP-2, MMP-3, MMP-8, MMP-9, MMP-13) a TIMP-1 v synoviální tekutině pacientů s RA ve srovnání s nálezy u pacientů s OA nebo s traumatickým postižením kolenního kloubu [9,14-19].
MMP-2 patří spolu s MMP-9 do podskupiny gelatináz schopných štěpení základních komponent ECM hyalinní chrupavky (kolagenu typu I a agrekanu). V synoviální tekutině pacientů s RA jsou prokazovány zvýšené hladiny MMP-2 a MMP-9 [9,20,49]. Práce Itoha et al poukazuje na poněkud kontroverzní roli gelatináz v patogenezi RA [22]. Autoři sledovali vývoj protilátkami indukované artritidy (AbIA) jednoho ze zvířecích modelů RA, u MMP-2 knockout (KO) myší a MMP-9 KO myší. Překvapivým zjištěním bylo, že MMP-2 KO myši vyvinuly těžší histologický i klinický obraz artritidy než myši normální a naopak MMP-9 KO myši vyvinuly mírnější formu artritidy než myši normální. Zmírnění příznaků artritidy u MMP-2 KO myší bylo dosaženo injekcí normálních fibroblastů, schopných produkovat MMP-2 in vitro. Autoři tedy prokázali fakt, že zhoršení průběhu AbIA u MMP-2 KO myší souvisí s deficitem MMP-2. V poslední době je prokazována řada nových cílových substrátů pro MMP-2, jako jsou cytokiny (interleukin 1 β), chemokiny (monocyte chemoattractant-3) nebo receptor 1 růstového faktoru fibroblastů [23-25]. Protichůdné role MMP-2 a MMP-9 mohou být dány rozdílným spektrem substrátů [24,25].
Výsledky naší studie poukazují na možnou asociaci polymorfizmu v promotorové oblasti genu pro MMP-2 s vnímavostí ke vzniku RA. Pokud je nám známo, jedná se o první práci prokazující asociaci polymorfizmu -790 T/G MMP-2 s rizikem vývoje RA. Náš nález je navíc podpořen častějším zastoupením „rizikového“ haplotypu GCGC polymorfizmů -1575 G/A, -1306 C/T, -790 T/G, -735 C/T genu pro MMP-2 u pacientů s RA a naopak častějším zastoupením haplotypu GCTC u zdravých kontrol.
Některé práce se již zabývaly asociací polymorfizmů genů jiných MMP a RA. V práci Dörra et al nebyla prokázána asociace mezi vnímavostí ke vzniku RA a polymorfizmem 1G/2G (delece/inzerce guaninu na pozici -1607) v promotorové oblasti genu pro MMP-1 a polymorfizmem 5A/6A (delece/inzerce adeninu na pozici -1171) v promotorové oblasti genu pro MMP-3 [50]. Stupeň radiografické progrese RA koreloval signifikantně s haplotypem 1G-5A. Haplotyp 1G-5A měl „protektivní“ efekt na radiografickou progresi RA. Homozygoti 2G/2G genu pro MMP-1 vykazovali během sledovaného období výraznější radiografickou progresi RA ve srovnání s homozygoty 1G/1G. Jiná práce tuto asociaci neprokázala [51]. Studie zabývající se asociací polymorfizmu MMP-3 přinesly rovněž kontroverzní výsledky [52]. Autoři neprokázali asociaci polymorfizmu 5A/6A s vnímavostí ke vzniku RA, ale naopak prokázali, že genotyp 6A/6A MMP-3 je asociovaný s výraznější RTG-progresí choroby v úvodu i na konci 4letého sledovacího období. Pacienti homozygoti 6A/6A pro MMP-3 a pro DRB1 SE měli výraznější RTG-progresi choroby.
Získané výsledky naší práce bude nutné ověřit na větším souboru pacientů s RA. Plánujeme studovat možnou asociaci mezi promotorovými polymorfizmy MMP-2 a závažností průběhu RA. Otázkou rovněž zůstává, zda polymorfizmus v promotorové oblasti genu pro MMP-2 ovlivňuje míru exprese DNA.
Studie byla podpořena grantovým projektem NR7812-3/2004, IGA Ministerstva zdravotnictví České republiky.
MUDr. Petr Němec
www.fnusa.cz
e-mail: petr.nemec@fnusa.cz
Doručeno do redakce: 23. 12. 2005
Přijato po recenzi: 31. 1. 2006
Zdroje
1. Harney SM, Newton JL, Worsworth BP. Molecular genetics of rheumatoid arthritis. Curr Opin Pharmacol 2003; 3 : 280-285.
2. Lawrence RC, Helmick GG, Arnett FC et al. Estimates of the prevalence of arthritis and selected musculosceletal disorders in the United States. Arthritis Rheum 1998; 41 : 778-799.
3. Goldring SR. Pathogenesis of bone and cartilage destruction in rheumatoid arthritis. Rheumatology (Oxford) 2003; 42(Suppl 2): ii11-ii16.
4. Yamada H, Yoshihara Y. Mechanism of cartilage destruction in rheumatoid arthritis. Clin Calcium 2003; 13 : 702-708.
5. Hembry RM, Bagga MR, Reynolds JJ et al. Immunolocalization studies on six matrix metalloproteinases and their inhibitors, TIMP-1 and TIMP-2, in synovia from patients with osteo - and rheumatoid arthritis. Ann Rheum Dis 1995; 54 : 25-32.
6. Okada Y, Takeuchi N, Tomita K et al. Immunolocalization of matrix metalloproteinase 3 (stromelysin) in rheumatoid synovioblasts (B cell): correlation with rheumatoid arthritis. Ann Rheum Dis 1989; 48 : 645-653.
7. Okada Y, Gonoji Y, Nakanishi I et al. Immunohistochemical demonstration of collagenase and tissue inhibitor of metalloproteinases (TIMP) in synovial lining cells of rheumatoid synovium. Virch Arch B Cell Pathol 1990; 59 : 305-312.
8. Grillet B, Dequeker J, Paemen L et al. Gelatinase B in synovitis: immunolocalization with a monoclonal antibody. Br J Rheumatol 1997; 36 : 744-747.
9. Ahrens D, Koch AE, Pope RM et al. Expression of matrix metalloproteinase 9 (96-kd gelatinase B) in human rheumatoid arthritis. Arthritis Rheum 1996; 39 : 1576-1587.
10. Stephenson ML, Goldring MB, Birkhead JR et al. Stimulation of procollagenase synthesis parallels increases in cellular procollagenase mRNA in human articular chondrocytes exposed to recombinant interleukin-1β. Biochem Biophys Res Commun 1987; 144 : 583-590.
11. Okada Y, Shinmei M, Tanaka O et al. Localization of matrix metalloproteinase 3 (stromelysin) in osteoarthritic cartilage and synovium. Lab Invest 1992; 66 : 680-690.
12. Cole AA, Chubinskaya S, Schumacher B et al. Chondrocyte matrix metalloproteinase-8. Human articular chondrocytes express neutrophil collagenase. J Biol Chem 1996; 271 : 11023-11026.
13. Mohtai M, Smith RL, Schurman DJ et al. Expression of 92-kDa type IV collagenase/gelatinase (gelatinase B) in osteoarthritic cartilage and its induction in normal human articular cartilage by interleukin 1. J Clin Invest 1993; 92 : 179-185.
14. Walakovits LA, Moore VL, Bhardwaj N et al. Detection of stromelysin and collagenase in synovial fluid from patients with rheumatoid arthritis and posttraumatic knee injury. Arthritis Rheum 1992; 35 : 35-42.
15. Clark IM, Powell LK, Ramsey S et al. The measurement of collagenase, tissue inhibitor of metalloproteinases (TIMP), and collagenase-TIMP complex in synovial fluids from patients with osteoarthritis and rheumatoid arthritis. Arthritis Rheum 1993; 36 : 372-379.
16. Yoshihara Y, Obata K, Fujimoto N et al. Increased levels of stromelysin-1 and tissue inhibitor of metalloproteinases-1 in serum from patients with rheumatoid arthritis. Arthritis Rheum 1995; 38 : 969-975.
17. Shinmei M, Kobayashi T, Yoshihara Y et al. Significance of the levels of carboxy terminal type II procollagen peptide, chondroitin sulfate isomers, tissue inhibitor of metalloproteinases, and metalloproteinases in osteoarthritis joint fluid. J Rheumatol 1995; 22(Suppl 43): 78-81.
18. Matsuki H, Fujimoto N, Iwata K et al. A one-step sandwich enzyme immunoassay for human matrix metalloproteinase 8 (neutrophil collagenase) using monoclonal antibodies. Clin Chim Acta 1996; 244 : 129-143.
19. Sopata I, Wize J, Filipowicz-Sosnowska A et al. Neutrophil gelatinase levels in plasma and synovial fluid of patients with rheumatic diseases. Rheumatol Int 1995; 15 : 9-14.
20. Yoshihara Y, Nakamura H, Obata K et al. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in synovial fluids from patients with rheumatoid arthritis or osteoarthritis. Ann Rheum Dis 2000; 59 : 455-461.
21. Nagase H, Woessner JF. Matrix Metalloproteinases. J Biol. Chem 1999; 274 : 21491-21494.
22. Itoh T, Matsuda H, Tanioka M et al. The role of matrix metalloproteinase-2 and matrix metalloproteinase-9 in antibody-induced arthritis. J Immunol 2002; 169 : 2643-2647.
23. Ito A, Mukaiyama A, Itoh Y et al. Degradation of interleukin 1 beta by matrix metalloproteinases. J Biol Chem 1996; 271 : 14657-14660.
24. McQuibban GA, Gong JH, Tam EM et al. Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant-3. Science 2000; 289 : 1202-1206.
25. Levi E, Fridman R, Miao HQ et al. Matrix metalloproteinase 2 releases active soluble ectodomain of fibroblast growth factor receptor 1. Proc Acad Sci USA 1996; 93 : 7069-7074.
26. Cawley LJ, Matrisian LM. Matrix metalloproteinases: they´re not just for matrix anymore! Curr Opin Cell Biol 2001; 13 : 534-540.
27. Aho K, Koskenvuo M, Tuominen J et al. Occurrence of rheumatoid arthritis in a nationwide series of twin. J Rheumatol 1986; 13 : 899-902.
28. MacGregor AJ, Snieder H, Rigby AS et al. Characterizing the quantitative genetic contribution to rheumatoid arthritis using data from twins. Arthritis Rheum 2000; 43 : 30-37.
29. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 389-466.
30. Gregersen PK. Genetics of rheumatoid arthritis: confronting complexity. Arthritis Res 1999; 1 : 37-44.
31. Seldin MF, Amos CI, Ward R et al. The genetics revolution and the assault on rheumatoid arthritis. Arthritis Rheum 1999; 42 : 1071-1079.
32. Singal DP, Li J, Lei K. Genetics of rheumatoid arthritis (RA): two separate regions in the major histocompatibility complex contribute to susceptibility to RA. Immunol Letters 1999; 69 : 301-306.
33. Winchester R. The molecular basis of susceptibility to rheumatoid arthritis. Adv Immunol 1994; 56 : 398-466.
34. Rowley MJ, Stockman A, Brand CA et al. The effect of HLA-DRB1 disease susceptibility markers on the expression of RA. Scand J Rheumatol 1997; 26 : 448-455.
35. Vencovský J, Pešáková V, Kafková J et al. Přínos některých laboratorních vyšetření k diagnostice a hodnocení revmatoidní artritidy. Čes Revmatol 1999; 7 : 155-165.
36. Yamada R, Tanaka T, Ohnishi Y et al. Identification of 142 single nucleotide polymorphisms in 41 candidate genes for rheumatoid arthritis in the Japanese population. Hum Genet 2000; 106 : 293-297.
37. Halushka MK, Fan JB, Bentley K et al. Patterns of single nucleotide polymorphisms in candidate genes of blood-presure homeostasis. Nat Genet 1999; 22 : 239-247.
38. Sato H, Takino T, Okada Y et al. A matrix metalloproteinase expressed on the surface of invasive tumor cells. Nature 1994; 370 : 61-65.
39. Takino T, Sato H, Shinagawa A et al. Identification of the second membrane-type matrix metalloproteinase (MT-MMP-2) gene from a human placenta cDNA library. MT-MMPs form a unique membrane-type subclass in the MMP family. J Biol Chem 1995; 270 : 23013-23020.
40. Will H, Hinzmann B. cDNA sequence and mRNA tissue distribution of novel human matrix metalloproteinase with a potential transmembrane segment. Eur J Biochem 1995; 231 : 602-608.
41. Puente XS, Pendás AM, Liano E et al. Molecular cloning of novel membrane-type matrix metalloproteinase from a human breast carcinoma. Cancer Res 1996; 56 : 944-949.
42. Pei D. Identification and characterization of the fifth membrane-type matrix metalloproteinase MT5-MMP. J Biol Chem 1999; 274 : 8925-8932.
43. Pendas AM, Knäuper V, Puente XS et al. Identification and characterization of a novel human matrix metalloproteinase with unique structural characteristics, chromosomal location, and tissue distribution. J Biol Chem 1997; 272 : 4281-4286.
44. Bartlett JD, Simmer JP, Xue J et al. Molecular cloning and mRNA tissue distribution of a novel matrix metalloproteinase isolated from porcine enamel organ. Gene 1996; 183 : 123-128.
45. Velasco G, Pendas AM, Fueyo A et al. Cloning and characterization of human MMP-23, a new matrix metalloproteinase predominantly expressed in reproductive tissues and lacking conserved domains in other family members. J Biol Chem 1999; 274 : 4570-4576.
46. Uría JA, Ferrando AA, Velasco G et al. Structure and expression in breast tumors of human TIMP-3, a new member of the metalloproteinase inhibitor family. Cancer Res 1994; 54 : 2091-2094.
47. Greene J, Wang M, Liu YE et al. Molecular cloning and characterization of human tissue inhibitor of metalloproteinase 4. J Biol Chem 1996; 271 : 30375-30380.
48. Nagase H, Okada Y. Proteinases and matrix degradation. In: Kelly WN, Harris ED Jr, Ruddy S et al (eds). The text book of rheumatology. 5th ed. Philadelphia: WB Saunders 1996; 323-341.
49. Jovanovic DV, Martel-Pelletier J, Di Battista JA et al. Stimulation of 92-kd gelatinase (matrix metalloproteinase 9) production by interleukin-17 in human monocyte/macrophages: a possible role in rheumatoid arthritis. Arthritis Rheum 2000; 43 : 1134-1144.
50. Dörr S, Lechtenböhmer N, Rau R et al. Association of a specific haplotype across the genes MMP1 nd MMP-3 with radiographic joint destruction in rheumatoid arthritis. Arthritis Res Ther 2004; 6: R199-R207.
51. Constantin A, Lauwers-Cances V, Navaux F et al. Collagenase-1 (MMP-1) and HLA-DRB1 gene polymorphisms in rheumatoid arthritis: a prospective longitudinal study. J Rheumatol 2002; 29 : 15-20.
52. Constantin A, Lauwers-Cances V, Navaux F et al. Stromelysin 1 (matrix metalloproteinase 3) and HLA-DRB1 gene polymorphisms: association with severity and progression of rheumatoid arthritis in a prospective study. Arthritis Rheum 2002; 46 : 1754-1762.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Význam včasné diagnózy chronických onemocnění ledvin - editorial
- Hypertrofická kardiomyopatie - názory na současné léčebné postupy - editorial
- Postavení torakoskopie v diagnostice onemocnění plic a pleury v současnosti - editorial
- Je kardiotoxicita chemoterapie problémem onkologa nebo také kardiologa? - editorial
- Jsou chronická onemocnění ledvin a poruchy ledvinné funkce na standardním lůžku interních oborů dostatečně diagnostikovány?
- Nefarmakologická léčba hypertrofické obstrukční kardiomyopatie - srovnání výsledků léčby metodami perkutánní transluminální septální myokardiální ablace a 2dutinové kardiostimulace
- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Pozdní kardiotoxicita u nemocných léčených pro maligní lymfomy chemoterapií s doxorubicinem
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
- Histiocytóza z Langerhansových buněk u osob dospělého věku - zkušenosti jednoho pracoviště a přehled léčebných možností
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
- Problémy s interpretací nízkých hladin tyreoidálních hormonů podmíněné změnami v transportních proteinech
- Prim. MUDr. Jiří Bakala 60letý
- Padesátiny primáře MUDr. Jaroslava Točíka
- Profesor MUDr. Miroslav Vykydal, DrSc., jubilující
- Zemřel prof. MUDr. Karel Opatrný, jr., DrSc.
- P. Kohout et al. Dieta. Celiakie a bezlepková dieta. Praha: Maxdorf 2006. 166 stran. ISBN 80-7345-070-4.
- Topinková E. Geriatrie pro praxi. Praha: Galén 2005. 270 stran. ISBN 80-7262-365-6.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Topinková E. Geriatrie pro praxi. Praha: Galén 2005. 270 stran. ISBN 80-7262-365-6.
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



