-
Medical journals
- Career
Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
: P. Pužman 1; M. Teřl 1; P. Mukenšnabl 2
: Klinika tuberkulózy a respiračních nemocí Lékařské fakulty UK a FN, Plzeň, přednosta prof. MUDr. Miloš Pešek, CSc. 1; Ústav patologické anatomie Lékařské fakulty UK a FN, Plzeň, přednosta prof. MUDr. Michal Michal 2
: Vnitř Lék 2006; 52(4): 321-327
: Original Contributions
Videotorakoskopie (VTS) provádíme na Klinice tuberkulózy a respiračních nemocí LF UK a FN Plzeň od roku 2001. Do září roku 2005 zde bylo provedeno 75 výkonů, všechny v lokální anestezii za analgosedace a při spontánní ventilaci pacienta. Cílem této práce je dokladovat, že videotorakoskopie v lokální anestezii je velmi dobře tolerovaná, rychlá a přesná miniinvazivní vyšetřovací metoda pleurálních patologických stavů, která má vysokou diagnostickou úspěšnost a minimální komplikace. Během výkonu lze vedle odběru bioptických vzorků z parietální i viscerální pleury provést i řadu terapeutických úkonů - evakuaci výpotku, mechanické rozrušení adhezí při empyému s jeho následnou drenáží nebo pleurodézu talkem u maligních výpotků. Za základní indikaci k tomuto výkonu považujeme diferenciální diagnostiku pohrudničního výpotku nejasné etiologie, spočívající nejčastěji v potvrzení či vyloučení maligních výpotků. Diferenciální diagnostika s pomocí VTS mezi zánětlivým a maligním výpotkem byla v našem souboru úspěšná v 96 %. Výkon byl všemi pacienty dobře tolerován a u žádného z nich se nevyskytly závažnější komplikace nebo následky.
Klíčová slova:
videotorakoskopie - lokální anestezie - pleurální patologie - pohrudniční výpotek - maligní výpotek - diferenciální diagnózaÚvod
Torakoskopie byla poprvé provedena v roce 1910 švédským lékařem Jacobaeusem [1]. Dlouhý čas byla používána pneumology zejména k rozrušování pleurálních adhezí při zakládání léčebných pneumotoraxů u pacientů s tuberkulózou. Další rozvoj nastal až v druhé polovině 20. století. V té době dochází k rozšíření zájmu chirurgů o minimálně invazivní chirurgii a rozvíjí se i řada dalších videem asistovaných endoskopických výkonů.
Klasická chirurgická videem asistovaná torakoskopie (VATS) je prováděna v celkové anestezii za selektivní intubace pravé či levé plíce. Umožňuje rozsáhlejší operační zákroky v plicním parenchymu, pleurální dutině či mediastinu. Při komplikacích je chirurg schopen provést konverzi na torakotomii a dokončit operaci klasickou otevřenou cestou. Tento výkon vyžaduje zázemí dobře vybavených operačních sálů, erudovaného chirurga i anesteziologa.
Současně s rozvojem chirurgické torakoskopie se začala vyvíjet i jednodušší torakoskopie nejčastěji prováděná v lokální anestezii - v angličtině nazývaná medical thoracoscopy.
Tuto metodu začali používat pneumologové k diagnostice a morfologickému ověření zejména pleurálních, ale i některých plicních procesů. Jedná se o relativně jednoduchý endoskopický výkon, který nepotřebuje zázemí velkého operačního sálu a není nutná ani přítomnost anesteziologa. Postačuje standardní vybavení klasického endoskopického sálu a jeho personál.
Výhodou je, že výkon je možné provádět v lokální anestezii při vědomí a za spontánní ventilace pacienta. Využívá se toho, že v pohrudniční dutině je senzitivně inervována pouze hrudní stěna s parietální pleurou. Plíce ani viscerální pleura nejsou téměř vůbec senzitivně inervovány a při výkonu „nebolí“. Používána je analgosedace a lokální anestezie hrudní stěny v místě zavedení trokaru do pohrudniční dutiny. Vzhledem k nepodávání celkové anestezie je výkon velmi dobře tolerován i u velmi rizikových pacientů, má lepší dostupnost a v neposlední řadě je i nákladově výhodnější než klasická chirurgická VATS.
Výkon ve většině případů umožňuje rychle stanovit správnou diagnózu (diagnostická úspěšnost 90-99 %), včetně morfologického ověření maligního postižení pohrudniční dutiny a včas zahájit odpovídající léčbu [2-8]. Odpadne tím velké množství zdlouhavých a často nepřesných vyšetřovacích metod.
V některých případech pohrudničního výpotku (empyém, maligní, rychle se doplňující výpotky) je VTS i léčebným výkonem. U empyému s vytvářejícími se septy je možné mechanicky rozrušit adheze a eventuelně lokálně podat fibrinolytika (streptokinázu) [9]. U maligních, rychle se doplňujících výpotků je možné aplikovat do pohrudniční dutiny talek a indukovat tak obliteraci pohrudniční dutiny (pleurodéza) - úspěšnost pleurodézy talkem činí 80-100 % [10,11]. Obliterace pohrudniční dutiny je paliativním zásahem, který zamezuje vysilování pacienta další tvorbou výpotku.
Popis metody
Na našem pracovišti samostatně provádí videotorakoskopie (VTS) pouze první autor sdělení, vždy s jednou asistencí, která nemusí být k výkonu plně erudována, může se jednat i o mladšího sekundárního lékaře. Asistují 2 sálové sestry - jedna je k dispozici operatérovi k zajištění výkonu, druhá aplikuje pacientovi léky a je zodpovědná za monitoraci životních funkcí pacienta. Další personál není nutný.
Podmínkou provedení VTS je podepsaný informovaný souhlas pacienta. Všichni pacienti jsou během výkonu dle stavu kardiovaskulárního aparátu hydratováni krystaloidy a je jim podáván kyslík, obvykle 3-5 l/min nosními hroty. Samozřejmá je monitorace EKG, měření krevního tlaku a saturace O2. Během výkonu je pacient v poloze vleže na boku.
Jako instrumentarium používáme trokar, optiku a kamerový systém firmy Wolf (Richard Wolf GmbH, Knittlingen, Germany) (obr. 4). Trokar je obvykle zaváděn ve 4.-6. mezižebří v přední, střední či zadní axilární čáře, nejlépe po předchozí ultrasonografické kontrole lokalizace výpotku a uložení bránice. Vzhledem k lokální anestezii preferujeme pouze jeden operační přístup do pohrudniční dutiny - tím je však i výkon, na rozdíl od chirurgické torakoskopie, limitován.
Po odsátí výpotku (pokud je aktuálně přítomen) a vpuštění vzduchu do pohrudniční dutiny dojde k zkolabování plicního křídla. Tento arteficiální pneumotorax bývá pacientem během spontánní ventilace velmi dobře tolerován. (To proto, že výkon se nejčastěji provádí při přítomnosti výpotku v pohrudniční dutině, kdy během zákroku vlastně dojde k nahrazení výpotku vzduchem a k minimálním změnám poměrů uvnitř hrudníku. Ale i při založení pneumotoraxu bez přítomnosti pohrudničního výpotku jsou změny krevních plynů, krevního tlaku a srdeční frekvence nevýznamné.) V krevních plynech dochází k mírnému poklesu paO2, který je dobře korigovatelný současnou oxygenoterapií. Významnější desaturace jsou popisovány s četností maximálně 2 % [12]. V jedné ze studií, která se touto problematikou zabývala, byla variabilita změn saturace O2 (měřeno pulzní oxymetrií) před, během a po torakoskopii 93,5 ± 5 %, 91,0 ± 4 % a 94,0 ± 3 % [13]. K významnějším změnám paCO2 nedochází [13].
Vytvořeným přístupem přes hrudní stěnu je do pohrudniční dutiny zaváděna optika, jejíž obraz snímá kamerový systém na monitor. Pracovním kanálem je možné pod optickou kontrolou provádět evakuaci výpotku, zavádět kleště či jehly k provádění biopsií, případně rozprašovací nástavec k provedení pleurodézy talkem.
Na probíhající onemocnění je možné usuzovat již dle makroskopického vzhledu pohrudniční dutiny. Bioptické vzorky lze odebírat z viscerální či parietální pleury nebo bránice, jehlou provádět cílené biopsie lokalizovaných subpleurálních plicních ložisek. Po odsátí výpotku je možné provést pleurodézu rozprášením talku v pohrudniční dutině. VTS je ukončena zavedením drénu stejným kanálem, kterým byl zaveden trokar. Pacient je po VTS připojen na podtlakovou drenáž, na které dochází k rozvinutí plicního parenchymu a kterou lze eventuelně odsávat novotvořený pohrudniční výpotek. Pokud nebyla prováděna biopsie z plic či viscerální pleury, bývá drenáž v průměru po 1-2 dnech zrušena. Při excizi z viscerální pleury, po biopsii plíce či při pleurodéze talkem je doba drenáže delší, v průměru 3-6 dnů.
Možné komplikace jsou při správné indikaci minimální. Jedná se o operační zákrok, proto stejně jako u jiné operace může dojít k poranění všech struktur v místě prováděného výkonu nebo ke krvácení v místě rány či do pohrudniční dutiny. Během VTS se může objevit hypotenze nebo hypertenzní reakce, tachyarytmie nebo naopak bradykardie (nejčastěji při iritaci nervus vagus). Při dobře vedené analgosedaci obvykle dochází ke klinicky nevýznamnému poklesu krevního tlaku a mírnému zvýšení tepové frekvence [12]. Po VTS může dojít k rozvoji podkožního emfyzému pronikáním vzduchu z pohrudniční dutiny kolem drénu do podkoží. Všechny tyto komplikace jsou při správné technice výkonu výjimečné, a pokud se vyskytnou, nebývají závažné [2,12,14-17]. Např. Viskum a Eng popisují pouze jednu letální komplikaci z 8000 VTS [12], Boutin udává mortalitu v souvislosti s VTS 0,09 % ze 4 300 výkonů [2]. V další literatuře jsou závažné komplikace, jako velké krvácení nebo těžká dušnost, popisovány v méně než 3 % případů, letální komplikace v méně než 0,01 % [11,18,19].
Základní indikace torakoskopie v lokální anestezii
Pohrudniční výpotek nejasné etiologie je nejčastější indikací. Dle literatury představuje asi 90 % výkonů [3,18]. Zásadní je zde odlišení maligních výpotků od výpotků jiné etiologie. Torakoskopická biopsie umožňuje morfologické ověření či vyloučení maligního postižení pleury, histologické ověření možné tuberkulózy či jiných zánětlivých změn. Diagnostická úspěšnost při určení etiologie pohrudničního výpotku je popisována v 90-98 %. Maligní výpotek je ověřen v 95 %, ověření tuberkulózního výpotku při použití kombinace kultivace a histologie v 98 % [2-5]. Oproti tomu diagnostická výtěžnost tzv. uzavřené „slepé“ biopsie pleury dosahuje u malignit a tuberkulózy pouze asi 60 % [20].
Empyém - asi do 2 týdnů po vzniku je možné torakoskopické rozrušení čerstvých křehkých pleurálních adhezí, což vede k lepšímu výsledku drenáže pohrudniční dutiny. Torakoskopie umožní i diferenciální diagnostiku základní příčiny empyému [2,6].
Cílená biopsie periferního plicního tumoru nebo tumoru pleury k histologickému, ev. i imunohistochemickému či genetickému vyšetření [3,6,21].
Pleurodéza talkem - symptomatická léčba zejména maligních výpotků [2,3,5,14,17,19,22-27].
Další složitější diagnostické a terapeutické indikace, jako např. hemotorax, spontánní pneumotorax, plicní biopsie u intersticiálních plicních procesů, biopsie z mediastina, hrudní sympatikolýza, fenestrace perikardu, jsou již v našich podmínkách doménou chirurgů. Na velkých zahraničních pracovištích, kde je torakoskopie rutinním, téměř denním výkonem, jsou někdy i tyto výkony prováděny pneumology [2,15,28].
Za absolutní kontraindikaci výkonu považujeme manifestní respirační insuficienci přetrvávající i po evakuaci výpotku, závažné poruchy hemokoagulace, předchozí torakotomii s obliterací pohrudniční dutiny, nespolupráci pacienta a dále preterminální, léčebně neovlivnitelné fáze generalizovaného maligního onemocnění.
Soubor pacientů a výsledky
Videotorakoskopie (VTS) na plicní klinice v Plzni provádíme od roku 2001. Do září roku 2005 zde bylo provedeno 75 výkonů u 75 pacientů, všechny v analgosedaci, lokální anestezii a za spontánní ventilace pacienta. Ze 75 pacientů bylo 19 žen a 56 mužů, průměrný věk byl 62,6 let. Nejmladšímu pacientovi bylo 27 let, nejstaršímu 83 let. Diagnostickou indikací VTS byl pohrudniční výpotek nejasné etiologie.
V 41 případech byl histologicky ověřen maligní pohrudniční výpotek (54,7 % ze všech VTS), paramaligní výpotek byl prokázán v 8 případech (10,7 %). Parainfekční výpotek byl diagnostikován v 22 případech (29,3 %), z toho empyém byl řešen v 6 případech (27,3 % z parainfekčních výpotků, 8 % ze všech VTS), tuberkulóza s pohrudničním výpotkem ve 3 případech (13,6 % z parainfekčních výpotků, 4 % ze všech VTS). Kardiální etiologie výpotku byla ověřena u 1 pacienta (1,3 %), přičemž u dalších 2 pacientů s diagnostikovaným parainfekčním výpotkem se mohla na tvorbě výpotku spolupodílet. Výsledky ukazuje tab., resp. grafy 1 a 2.
Tab. Torakoskopicky stanovené diagnózy. 
Celkový počet pacientů: n = 75. 2. Maligní výpotky – poměrné zastoupení. 
Ve skupině maligního postižení pleury byl nejčastější histologickou diagnózou metastatický rozsev adenokarcinomu - celkem 28 případů (68,3 % ze všech maligních pleuritid). Origo adenokarcinomu bylo nejčastěji: plíce 12krát, ovarium 3krát (obr. 2 a 2a), tlusté střevo 2krát (obr. 3), prs 2krát, endometrium 1krát, pankreas 1krát. V 7 případech (25 % adenokarcinomů) se origo tumoru nepodařilo jednoznačně prokázat.
2. Metastáza karcinomu ovaria na bránici. 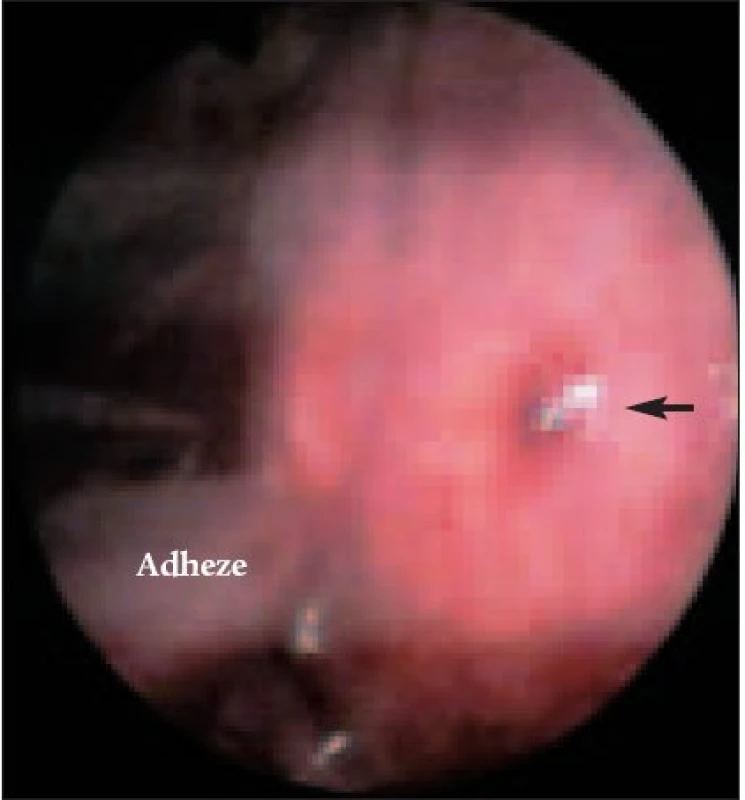
Obr. 2a. Metastáza karcinomu ovaria na bránici. 
3. Metastázy adenokarcinomu colon na parietální pleuře. 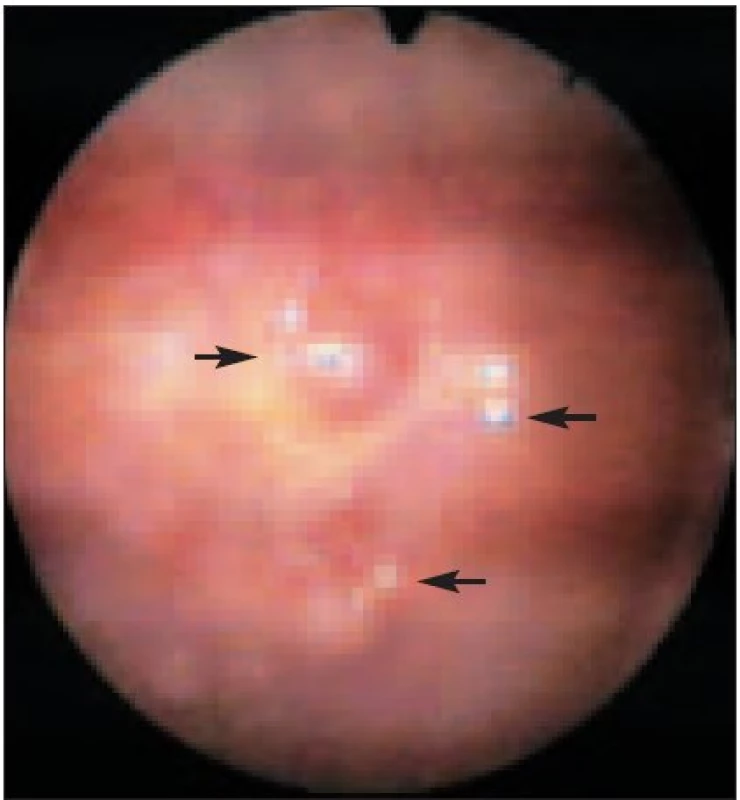
Z ostatních metastatických nádorů byl ve 3 případech histologicky ověřen mezoteliom, ve 4 případech epidermoidní karcinom plic, v 1 případě malobuněčný karcinom plic, 1krát velkobuněčný karcinom plic, 1krát osteoblastom, 1krát světlobuněčný konvenční tumor ledviny, 1krát non-hodgkinský B lymfom, 1krát chronická lymfocytární leukemie B.
U 2 pacientů byla pleurální dutina obliterována rozsáhlými adhezemi (obr. 1) a bez větší traumatizace nebylo možné při VTS přehlédnout pohrudniční dutinu a provádět cílené odběry tkáně na histologické vyšetření. Diagnóza malignity byla potvrzena s časovým odstupem cytologicky punkcí výpotku z místa torakoskopicky nepřístupného.
4. Adheze v pohrudniční dutině při nespecifickém zánětu. 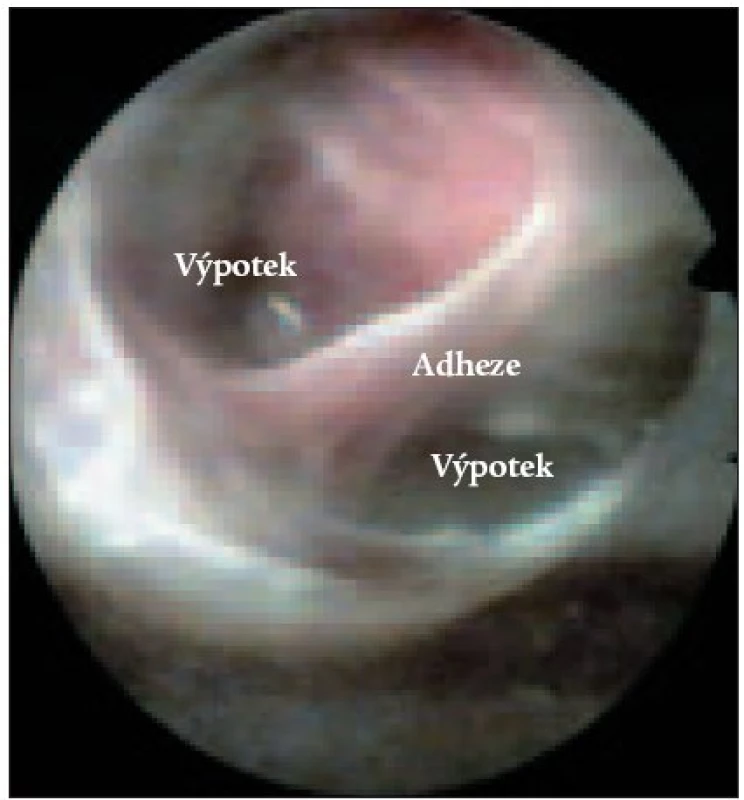
V 1 případě byl výpotek hodnocen jako pozánětlivý a po VTS již nedošlo k recidivě. Pacient neměl žádné symptomy malignity, byl pokročilého věku (81 let) a nedostavil se na další kontroly. Až po 2 letech byl u něho diagnostikován adenokarcinom levé plíce.
I v případě, že počítáme tyto 3 sporné případy jako diagnostické selhání VTS, činí naše diagnostická úspěšnost v diferenciální diagnostice mezi maligními a nemaligními výpotky 96 %.
Jako paramaligní výpotek bylo označeno 8 případů (10,7 %). Jednalo se o pacienty s již ověřenou malignitou s různým origo a s recidivujícím pohrudničním výpotkem. VTS ale neprokázala maligní rozsev na pleuru a nebyla zachycena jiná příčina, která by pohrudniční výpotek vysvětlovala. Podrobněji viz diskuze.
Ve skupině kardiálních výpotků byl pouze 1 pacient, u dalších 2 vzhledem ke kardiálnímu onemocnění bylo možné připustit i kardiální složku u původně pozánětlivého pohrudničního výpotku.
Ve skupině parainfekčních výpotků se nám nedařilo histologické ověření u žádného ze 3 pacientů s pohrudničním výpotkem při tuberkulóze plic. Ověření tuberkulózy přinesla až další vyšetření. Jedenkrát byla tuberkulóza histologicky ověřena z následné klínovité excize z infiltrace plicního parenchymu a 2krát byla po 6 týdnech zjištěna kultivační pozitivita výpotku.
Až na případ výše zmiňovaného 81letého pacienta žádný z výpotků, označených za zánětlivý, nebyl při pozdější dispenzarizaci diagnostikován jako maligní.
Komplikace
U žádného z provedených 75 výkonů jsme nezaznamenali závažnější komplikaci, která by nás nutila přerušit výkon. Žádná komplikace nebyla zdrojem možného trvalého poškození pacienta. Výkon naopak dobře snášeli i ti pacienti, kteří byli z interního či anesteziologického hlediska kontraindikováni k výkonu v celkové anestezii.
Změny krevního tlaku a pulzové frekvence. Tachykardie a hypertenzní reakce byla pozorována pouze u 2 pacientů s nedostatečnou analgosedací a s preexistující hypertenzí a špatně volenou premedikací. Tyto komplikace byly během výkonu snadno farmakologicky ovlivnitelné.
Závažné hyposaturace jsme během výkonu při standardně podávané oxygenoterapii nezaznamenali.
Výraznější krvácení z rány jsme řešili u jednoho pacienta (1,3 %). Jednalo se o etylika, s empyémem, v minulosti po autonehodě (sražení kamionem) spojené s mnohočetnými frakturami žeber, postiženého hemitoraxem, kde byly změněné anatomické poměry vztahu žeber a cév. Krvácení bylo po kompresi zastaveno a výkon jsme provedli jiným přístupem.
Podkožní emfyzém. Výraznější podkožní emfyzém se po výkonu rozvinul v 9 případech z prvních 28 výkonů (32 %), nikdy ale nebyl rozsáhlý a vždy byl léčen konzervativně, bez negativního dopadu na celkový stav pacienta. Po změně techniky výkonu (viz diskuse) byl pozorován rozvoj pouze malého podkožního emfyzému v 7 případech z dalších 47 výkonů (14,9 %).
U jednoho pacienta s adenokarcinomem plic jsme zaznamenali pozdní komplikaci - implantační metastázu v místě drénu, která však neměla však vliv na prognózu nemoci.
Během našich výkonů nedošlo k závažnému krvácení do pohrudniční dutiny či k poranění nitrohrudních orgánů. Nezaznamenali jsme infekci rány či pohrudniční dutiny po výkonu. Žádnou další komplikaci jsme nepozorovali.
Diskuse
Pleurální výpotek je častým problémem interní medicínské praxe. Jako projev, respektive komplikace nemoci se objevuje u asi 10 % nemocných s interními chorobami [9,20].
Důsledným rozborem klinických okolností vzniku výpotku a jeho vyšetřením (specifická váha, biochemie, cytologie) se daří u většiny nemocných vyčlenit nejčastější skupinu (asi 40 %) výpotků kardiálních - transsudátů. Zbývající část výpotků představují exsudáty, jejichž nejčastějšími příčinami bývají malignity (20 %) a infekce (25 %), včetně tuberkulózy.
Zlatým standardem při určení etiologie výpotku stále zůstává hrudní punkce s následnou analýzou získané tekutiny.
V praxi bývají nejproblematičtější případy:
- charakter výpotku se pohybuje na hranici diagnostických kritérií exsudátu a transsudátu,
- (častěji) u exsudátů, jejichž vyšetření neprokazuje maligní buňky nebo tuberkulózní bacily, přitom ale pouhá nespecificky zánětlivá etiologie je klinicky sporná. Výše popsané situace se vyskytují až u 1/5 výpotků.
Pokud jsou výsledky neurčité, bývala doporučována tzv. uzavřená „slepá“ biopsie parietální pleury pomocí nejčastěji Abramsovy jehly. Její výtěžnost u malignit a tuberkulózy dosahuje 60 %. Teprve při negativitě výsledku uzavřené biopsie byla doporučována chirurgická torakoskopie, zvyšující specificitu i senzitivitu u všech typů výpotků nad 90 %.
Zavedením techniky torakoskopie v lokální anestezii, jejíž zátěž je pro pacienta jen mírně větší než uzavřená biopsie, avšak její výtěžnost je srovnatelná s chirurgickou torakoskopií, se zavedený algoritmus v centrech, která mají možnost provádět tento výkon, mění.
Histologický průkaz maligní tkáně v bioptickém vzorku pleury je jednoznačným průkazem jejího maligního postižení. Na úspěšnosti morfologického ověření maligního postižení pleury se velkou měrou podílí i kvalita histologické laboratoře a erudice hodnotícího patologa. Přesto i s použitím imunohistochemických metod nebylo možno vždy jednoznačně odlišit maligní mezoteliom od metastazujícího adenokarcinomu. Při stanovení diagnózy mezoteliomu jsme proto zohledňovali i klinický průběh nemoci.
Kardiální výpotky bývá obvykle možné diagnostikovat podrobným kardiologickým vyšetřením a analýzou výpotku [9], indikace k VTS při tomto postižení bývají velmi výjimečné.
V 8 případech byl výpotek označen jako paramaligní, tzn. že v pohrudniční dutině nebyly makroskopické známky malignity a tumor nebyl zachycen ani v odebraných vzorcích z pleury. Malignita plic či jiných orgánů byla ověřena jinými vyšetřovacími metodami nebo byla již před provedením výkonu známa. V 1 případě se jednalo o indukovaný výpotek při hepatocelulárním karcinomu jater, 1krát při rozsáhlém karcinomu pankreatu. Jedenkrát byl vyšetřován oboustranný výpotek při karcinomu kardie s rozsáhlou mediastinální lymfadenopatií. Třikrát jsme řešili výpotek u pokročilého světlobuněčného karcinomu ledvin s metastázami do plic a mediastina, ale bez známek maligního postižení pleury. V jednom případě se jednalo o výpotek u pacienta s atelektázou plíce při epidermoidním karcinomu v hlavním bronchu, cílem VTS bylo provedení pleurodézy.
Pokud bychom byli pesimisté, mohli bychom označit tyto případy jako diagnostické selhání VTS. Tím bychom ovšem zpochybnili existenci diagnózy paramaligního výpotku. Paramaligní výpotky neobsahují nádorové buňky proto, že tumor vede k tvorbě výpotku jiným mechanizmem než nádorovou infiltrací pleury (blokáda lymfatické či žilní drenáže, důsledek podtlaku vyvolaný vznikem atelektázy aj).
Sporný je případ uváděného 81letého polymorbidního pacienta, u kterého nebylo při VTS prokázáno maligní postižení pleury, a výpotek byl hodnocen jako zánětlivý. Byl septován četnými adhezemi a k jeho plné evakuaci došlo až po jejich rozrušení při VTS a následné opakované intrapleurální aplikaci streptokinázy. Výpotek již poté nerecidivoval. Pacient se k dalším plánovaným kontrolám nedostavil. Až po 24 měsících od VTS, v 83 letech, byl u něj diagnostikován adenokarcinom postižené plíce s prorůstáním do hrudní stěny. Je sporné, zda se u tohoto pacienta již jednalo o projev malignity nebo zda se tumor vyvinul později.
Kromě tohoto případu nebyl žádný výpotek, označený po VTS jako zánětlivý, ani při pozdější dispenzarizaci pacienta diagnostikován jako maligní.
Nedařilo se nám histologické ověření tuberkulózního výpotku (3 případy). Tento výpotek byl ve všech případech hodnocen jako (nespecificky) zánětlivý. V jednom případě k diagnóze dopomohlo kultivační vyšetření výpotku odebraného při VTS, v dalším případě byl kultivačně (v 6. týdnu) pozitivní výpotek odebíraný několik dnů před VTS. Poslední pacient byl po VTS pro zjištěnou intraparenchymatózní infiltraci indikován ke klínovité resekci středního laloku. V této biopsii byla histologicky prokázána kazeózní nekróza, přitom kultivace byla negativní.
K histologickému průkazu tuberkulózy v časnějším stadiu je nutný velký vzorek tkáně, který nelze vzhledem k bolestivosti parietální pleury při lokální anestezii odebrat. Často ale ani při velkých vzorcích, odebraných při chirurgické videem asistované torakoskopii, nemusí být diagnóza histologicky jednoznačná.
Nezaznamenali jsme žádnou závažnější komplikaci. Vyšší frekvence výskytu podkožního emfyzému při prvých 28 výkonech byla způsobena tělesnou aktivitou provázenou zvýšením tlaku v hrudníku během překladu na lůžko po výkonu a zejména podrážděním receptorů vyvolávajících kašel při rychlém rozvíjení plíce při podtlakové drenáži. Po změně techniky výkonu - pomalém odsávání a rozvíjení plíce ještě na sále za trvající analgosedace, se četnost této komplikace snížila na polovinu.
Pacienti v 9. deceniu či s těžkou dysfunkcí levé komory srdeční byli k výkonu indikováni pouze výjimečně, vždy až po důkladném zvážení všech rizik oproti přínosu (3 pacienti ve věku 81 let, 1 pacient 83 let, 2 pacienti s těžkou dysfunkcí levé komory srdeční). Indikováni byli vždy pro recidivující pohrudniční výpotek nejasné etiologie (exsudát) s nutností opakovaných zatěžujících a vysilujících evakuačních hrudních punkcí. V první řadě zde šlo o vyloučení TBC pleuritidy, která by i u takovýchto pacientů byla potenciálně léčitelná. Navíc zde vždy byl předpoklad, že i při možném průkazu karcinomatózní pleuritidy je pacient únosný k provedení paliativní pleurodézy talkem. VTS u všech těchto pacientů (včetně úspěšné pleurodézy talkem ve 3 případech pacientů v 9. deceniu) proběhla bez komplikací.
Naše výsledky, vedle uvedené spolehlivosti v potvrzení či vyloučení maligní etiologie výpotků, dokladují, že výkon je velmi dobře tolerován, a to i u vysoce rizikových pacientů, kontraindikovaných k výkonu v celkové anestezii.
Závěr
Naše výsledky prokazují, že videotorakoskopie v lokální anestezii je velmi dobře tolerovaná, rychlá a přesná miniinvazivní vyšetřovací metoda pohrudničních výpotků nejasné etiologie. V rukou erudovaného internisty - pneumologa a při dobré spolupráci s patologem má vysokou diagnostickou úspěšnost a minimální komplikace.
MUDr. Petr Pužman
www.fnplzen.cz
e-mail: puzman@fnplzen.cz
Doručeno do redakce: 15. 11. 2005
Přijato po recenzi:9. 1. 2006
Sources
1. Jacobaeus HC. Über die Möglichkeit, die Zystoskopie bei Untersuchung seröser Höhlen anzuwenden. Münch Med Wschr 1910; 40 : 2090-2092.
2. Boutin C, Viallat JR, Aelony Y. Practical thoracoscopy. Heidelberg: Springer Verlag 1991.
3. Loddenkemper R. Thoracoscopy: state of the art. Eur Respir J 1998; 11 : 213-221.
4. Colt HG. Thoracoscopy: window to the pleural space. Chest 1999; 116 : 1409-1416.
5. Mathur P, Boutin C, Loddenkemper R. Medical thoracoscopy: technique and indications in pulmonary medicine. J Bronchol 1994; 1 : 1153-1156.
6. Karmy-Jones R, Sorenson V, Horst HM et al. Rigid thoracoscopic debridement and continuous pleural irrigation in the management of empyema. Chest 1997; 111 : 272-274.
7. Engel G. Diagnostický postup při pleurálním výpotku. Vnitř Lék 2000; 46 : 126-129.
8. Klein J, Kral V, Neoral C et al. Thorakoskopická diagnostika mediastinálního lymfomu. Vnitř Lék 1997; 43 : 787-789.
9. Teřl M, Pešek M, Tauchman A. Pleurální výpotek v interní praxi. Vnitř Lék 2005; 51 : 430-437.
10. Gibson GJ, Geddes DM, Costabel U. Respiratory Medicine. Edinburgh: Elsevier Science (WB Saunders) 2003; 1918-1919.
11. Canto A, Rivas J, Moya J et al. Pleural effusion of malignant etiology. Thoracoscopic use of talc as an effective method of pleurodesis. Medica Clin 1985; 84 : 806-808.
12. Viskum K, Enk B. Complications of thoracoscopy. Poumon Coeur 1981; 37 : 25-28.
13. Newhouse M. Pulmonary gas exchange during thoracoscopy. Chest 1989; 96 : 246-249.
14. Mathur P, Martin WJ. Clinical utility of thoracoscopy. Chest 1992; 102 : 2-4.
15. Brandt HK, Loddenkemper R, Mai J. Atlas of diagnostic thoracoscopy. Stuttgart: Georg Thieme Verlag 1985.
16. Cassina PC, Hauser M, Hillejan L. Video-assisted thoracoscopy in the treatment of pleural empyema. J Thorac Cardiovasc Surg 1999; 117 : 2234-2238.
17. Colt HG. Thoracoscopy: New Frontiers. Pulmonary Perspectives 1992; 4 : 1-4.
18. Frank W, Herziger D. Medical Thoracoscopy in Germany: a current national status report. Pneumologie 1999; 53: S10.
19. Colt HG. Thoracoscopy: a prospective study of safety and outcome. Chest 1995; 108 : 324-329.
20. Albert RK, Spiro SG, Jett JR. Comprehensive Respiratory Medicine. Barcelona: Mosby 1999, 21. sekce.
21. Harris RJ, Kavuru MS, Mehta AC et al. The impact of thoracoscopy on the management of pleural disease. Chest 1996; 107 : 846-852.
22. Loddenkemper R, Kaiser D. Thoracoscopy. Stuttgart: Thieme 2001.
23. Boutin C, Loddenkemper R, Astoul P. Diagnostic and therapeutic thoracoscopy: techniques and indications in pulmonary medicine. Tuber Lung Dis 1993; 74 : 225-239.
24. Weissberg D, Ben Zeev I. Talc pleurodesis. Experience with 360 patients. J Thorac Cardivasc Surg 1993; 106 : 689-695.
25. Aelony Y, King R, Boutin C. Thoracoscopic talc poudrage pleurodesis for chronic recurrent pleural effusions. Ann Intern Med 1991; 115 : 778-782.
26. Kennedy L, Sahn SA. Talc pleurodesis for the treatment of pneumothorax and pleural effusion. Chest 1994; 106 : 1215-1222.
27. Hartman DL, Gaether DM, Kesler KA et al. Comparison of insufflated talc under thoracoscopic guidance with standart tetracycline and bleomycin pleurodesis for control of malignant pleural effusion. J Thorac Cardiovasc Surg 1993; 105 : 743-748.
28. Colt HG, Russack V, Shangs TG et al. Comparison of wedge to forceps videothoracoscopic lung biopsy. Gross and histologic findings. Chest 1995; 107 : 546-550.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 4-
All articles in this issue
- Chronic nephropathies and disorders of renal function - is it sufficiently diagnosed in patients hospitalised on department of internal medicine and cardiology?
- Non-pharmacologic therapy of hypertrophic obstructive cardiomyopathy – results of therapy based on percutaneous transluminal septal myocardial ablation compared with results of dual-chamber cardiac pacing
- Medical videothoracoscopy in diagnosis and therapy of pleural effusions
- Late cardiotoxicity in patients with malignant lymphoma treated with doxorubicin chemotherapy
- Primary prevention of ischemic heart disease in middle-aged men living in Prague: Results of twenty-year research
- Polymorphism of gene promotor region for MMP-2 in rheumatoid arthritis
- Histiocytosis from Langerhans cell in adults – experience of one department and review of treatment alternatives
- Ubiquitins, proteasomes, sumoylation and application today and in future for cancer and other diseases therapy I. Ubiquitin-proteasome system and the transcription factor NF-κB
- The Prophylaxis against Venous Thromboembolic Complications in Internal Medicine - the Gap between Theory and Practice
- Problems with interpretation of low levels of thyroidal hormones conditioned by changes in transport proteins
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Medical videothoracoscopy in diagnosis and therapy of pleural effusions
- Primary prevention of ischemic heart disease in middle-aged men living in Prague: Results of twenty-year research
- Ubiquitins, proteasomes, sumoylation and application today and in future for cancer and other diseases therapy I. Ubiquitin-proteasome system and the transcription factor NF-κB
- The Prophylaxis against Venous Thromboembolic Complications in Internal Medicine - the Gap between Theory and Practice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



