-
Medical journals
- Career
Molekulární patofyziologie pozdních komplikací diabetes mellitus – genetická predispozice k rozvoji diabetických komplikací
Authors: K. Kaňková
Authors‘ workplace: Ústav patologické fyziologie Lékařské fakulty MU, Brno, přednostka prof. MUDr. Anna Vašků, CSc.
Published in: Vnitř Lék 2005; 51(4): 438-449
Category: Reviews
Overview
Příspěvek je věnován problematice genetické determinace náchylnosti k rozvoji pozdních diabetických komplikací, možnostem jejího studia a potenciální klinické využitelnosti poznatků pro posouzení individuálního rizika. Pro existenci genetických rizikových faktorů diabetických komplikací hovoří údaje o prevalenci a incidenci komplikací ve vztahu k délce a kompenzaci diabetu, opakovaný průkaz familiární agregace a výsledky segregačních analýz. Uvedené doklady se týkají v naprosté většině diabetické nefropatie a makrovaskulární choroby. Patogeneticky se zde zřejmě uplatňuje funkční variabilita v relevantních metabolických a hemodynamických parametrech jako důsledek genetické variability. Genetická komponenta náchylnosti k diabetickým komplikacím má z genetického hlediska charakter tzv. komplexního onemocnění. Práce shrnuje podrobněji nejvýznamnější výsledky vazebných a asociačních studií genetiky diabetické nefropatie a kardiovaskulárních onemocnění komplikujících diabetes.
Klíčová slova:
diabetes mellitus – diabetické komplikace – diabetická nefropatie – asociace – polymorfizmus – komplexní onemocněníÚvod
V první části příspěvku věnované pozdním komplikacím diabetu jsme shrnuli současné poznatky o patofyziologii proximálních změn iniciovaných hyperglykemií [1]. V této volně navazující druhé části se chceme zaměřit na problematiku genetické determinace náchylnosti k rozvoji pozdních komplikací, možnosti jejího studia a na potenciální klinickou využitelnost poznatků pro posouzení individuálního rizika.
Diabetici mají oproti nediabetické populaci podstatně zvýšeno riziko ischemické choroby srdce, mozku a dolních končetin (souhrnně označovaných jako makrovaskulární komplikace), nefropatie, retinopatie, neuropatie (mikrovaskulární komplikace), katarakty, glaukomu, a periodontopatie. V případě renálních a kardiovaskulárních komplikací se seriózně předpokládá existence genetických rizikových faktorů (nezávislých na diabetu), které u konkrétního diabetika modulují efekt primárního onemocnění na jednotlivé orgánové systémy.
Proč předpokládáme existenci genetické dispozice k rozvoji komplikací
Dědičnost určitého onemocnění (nebo náchylnost k němu) může být prokázána například jeho nenáhodným výskytem v rodinách (fenomén nazývaný familiární agregace), studiem jednovaječných dvojčat, pomocí segregační analýzy a celou řadou dalších postupů. Pro existenci genetických rizikových faktorů diabetických komplikací hovoří (i) údaje o prevalenci a incidenci komplikací ve vztahu k délce a kompenzaci diabetu, (ii) opakovaný průkaz familiární agregace a (iii) výsledky segregačních analýz. Uvedené doklady se týkají v naprosté většině diabetické nefropatie a makrovaskulární choroby.
Obecně je přijímán názor, že hlavními rizikovými faktory rozvoje pozdních diabetických komplikací je trvání choroby, míra hyperglykemie a genetická složka. Empiricky dobře známým faktem je, že doba nástupu, rychlost progrese a celková míra postižení diabetickými komplikacemi, ačkoliv jsou obecně v úzkém vztahu s délkou trvání choroby a mírou kompenzace, vykazují zřetelnou interindividuální variabilitu. Podíl genetické predispozice na celkové variabilitě je ovšem obtížné posoudit. Existují diabetici, u kterých se i přes velmi dobrou kompenzaci rozvinou poměrně brzy závažné komplikace, naopak jsou tací, u nichž diabetes probíhá dlouho bez komplikací i při mnohem horší metabolické kompenzaci [2]. Jsou dokonce doloženy i sporadické případy cévního postižení retiny a ledvin totožného s tím, které vidíme u diabetiků („diabetes-like“) u normoglykemických osob [3]; opakované testy u nich i po letech neprokázaly poruchu glukózové tolerance. Můžeme se domnívat, že zde jde o extrémní případy genetické predispozice. Naopak komplikace výhradně v důsledku chronické metabolické dekompenzace bez predisponující genetické složky (tj. fenokopie) existují jistě rovněž a jsou asi poměrně běžné.
Genetická variabilita jako determinanta náchylnosti k pozdním komplikacím
V první části našeho příspěvku jsme ukázali, že patofyziologie diabetických komplikací je mnohostupňová. Změny primárně indukované hyperglykemií jsou amplifikovány dalšími modulujícími faktory, což nakonec vede k rozvoji klinicky manifestních diabetických orgánových komplikací. Patogeneticky se zde uplatňuje oxidační stres, neenzymatická glykace, zánět, remodelace extracelulární hmoty a další mechanizmy [1]. Anti-/prooxidační, deglykační a pro-/protizánětlivá kapacita v širokém slova smyslu vykazují populační variabilitu podobně jako jiné kontinuální proměnné (tj. kvantitativní znaky) jako důsledek populační genetické variability [4]. Většina genů kódujících proteiny (tj. enzymy, receptory a transkripční faktory) zapojené v těchto procesech vykazuje tzv. genetický polymorfizmus. Polymorfizmus v genetickém slova smyslu značí situaci, v níž pro určitý gen existuje v populaci vícero alel (nejčastěji dvě – bialelický polymorfizmus) a alelická frekvence nejméně četné varianty je ≥ 1 %. Substituce vzácnější než 1 % jsou označovány jako mutace (situace typická pro tzv. mendelisticky děděné choroby). Substituce se mohou nacházet v kódujících (exony) a/nebo nekódujících oblastech (introny, promotory, 3’UTR – pozn. redakce: vysvětlení zkratek viz seznam za textem) a vést ke kvalitativním, či kvantitativním rozdílům. Poněvadž tyto rozdíly jsou zpravidla malé a každá jednotlivá varianta nepůsobí patologicky sama o sobě, jsou populační frekvence těchto alel poměrně vysoké. Za konstantních podmínek reprezentuje populační modus funkční optimum; většina populace leží v optimálním rozsahu s extrémy na obou koncích. Osoby, které se nachází několika svými hodnotami pro relevantní parametry v nevýhodné oblasti distribuce, jsou náchylné k rozvoji daného patologického fenotypu (polygenní způsob dědičnosti). To neznamená, že se u nich nutně rozvine klinicky významné onemocnění za fyziologických podmínek, ovšem za situace, kdy se nároky kladené na daný systém změní, latentní insuficience se může stát zjevnou (obr. 1).
Image 1. Hypotetická populační distribuce relevantních metabolických a hemodynamických parametrů jako důsledek genetické variability. 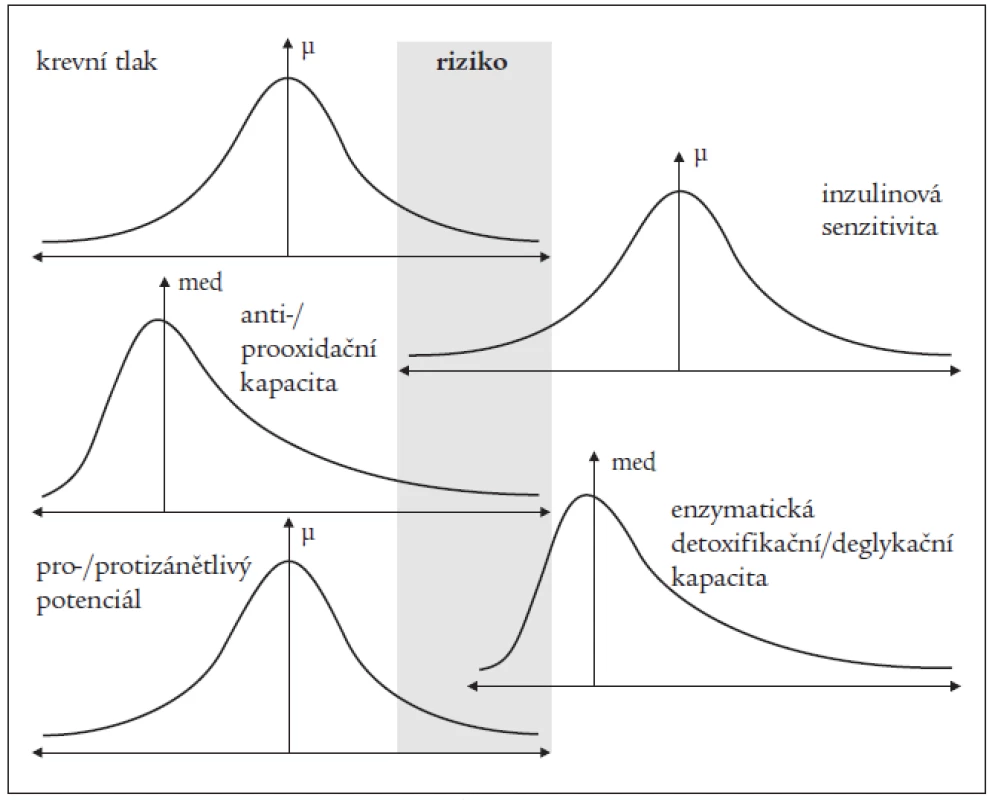
Různě velká proporce jedinců v každé distribuci je latentně náchylná k rozvoji patologického fenotypu, pokud dojde k přetížení daného systému. Osoby s mnohočetnou funkční insuficiencí, resp. hyperaktivitou uvedených systémů (šedá oblast) jsou náchylné k rozvoji komplikací. V případě diabetu (zejména typu 2 – DM2T) a jeho komplikací lze těžko uvažovat o tom, že se populace nachází ve stabilních podmínkách. Lidský genom nemůže pohotově reflektovat rychle probíhající environmentální a behaviorální změny a diabetes je evidentně důsledkem dysadaptace genomu na tyto změny. Otázkou je, zda se v lidské populaci vůbec ještě uplatňuje přirozená selekce; především vzhledem k manifestaci nejběžnějších nemocí v postreprodukčním věku. Ancestrální genotypy tedy již nereprezentují populační optimum. Dříve favorizované varianty jsou stále velmi četné, ale již zčásti patogenní.
Diabetické komplikace jako komplexní onemocnění
Výše popsaná situace přesně zapadá do uvažované koncepce individuálně modifikované náchylnosti k pozdním diabetickým komplikacím, nezávislé na diabetu jako takovém. Genetická komponenta náchylnosti má z genetického hlediska charakter tzv. komplexního onemocnění, pro které beze zbytku platí kritéria pregnantně formulovaná Landerem a Schorkem [5]. Termínem komplexní onemocnění se označuje patologický fenotyp, který nevykazuje klasickou mendelistickou dominantní či recesivní dědičnost jako důsledek změn v jediném lokusu. Označení „komplexní onemocnění“ zdůrazňuje existenci „komplexu“ etiologických činitelů (tj. geny a prostředí). Pro komplexní onemocnění jsou charakteristické: a) neúplná penetrance, b) existence fenokopií, c) genetická heterogenita – lokusová a alelická, d) polygenní dědičnost, e) vysoká frekvence potencionálně patogenních alel a f) spolupůsobení dalších mechanizmů přenosu (např. mitochondriální dědičnost, imprinting aj). V praxi to znamená, že u určité části diabetiků, přestože zdědí nevýhodný genotyp (ve smyslu souboru alel více genů), se příslušný typ komplikací nerozvine (= neúplná penetrance); naopak může být přítomen u pacientů, kteří nejsou nosiči zmíněného genotypu (= fenokopie). Predisponující genotyp zvyšuje pravděpodobnost rozvoje komplikací, ale nedeterminuje jednoznačně jejich přítomnost. Klinický obraz není specifický, ale může se rozvinout v důsledku záměn v genech ležících na různých lokusech (= lokusová heterogenita), v jednotlivých genech může být přitom vícero mutací či polymorfizmů (= alelická heterogenita). Pravděpodobnost rozvoje komplikací se zvyšuje pouze při simultánním výskytu určitého souboru alel (= polygenní dědičnost), z nichž každá jednotlivá není sama o sobě výrazně patogenní (= proto jejich vysoká frekvence v populaci).
V souvislosti s pojmem komplexní onemocnění je nutno zmínit problém samotné definice příslušného patologického fenotypu. Pozdní diabetické komplikace můžeme stejně dobře definovat jako stavy diskrétní (přítomnost diabetické nefropatie ano/ne, přítomnost diabetické retinopatie ano/ne, přítomnost ischemické choroby srdeční ano/ne) či stavy kontinuální, tedy jako kvantitativní znaky [vylučování albuminu do moči (albumin excretion rate, AER), glomerulární filtrační rychlost (glomerular filtration rate, GFR), míru neoproliferace na sítnici, míru ztluštění intimy a medie (intima/media thickness, IMT) a další]. Oba přístupy mají svá opodstatnění, je ovšem nutno si uvědomit, že diskrétní definice je jakýmsi prahovým přístupem značně zjednodušujícím fenotypovou variabilitu a z pohledu experimentálního jde proti smyslu předpokládaného polygenního založení těchto onemocnění.
Další důležitou okolností je rychlost nástupu komplikací vzhledem k začátku diabetu, věk pacienta a rodinná anamnéza [6]. Podíl genetické dispozice u mladého diabetika, u kterého se do 10 let po nástupu diabetu rozvinulo terminální selhání ledvin s nutností pravidelné dialýzy a který má navíc podobně postiženého sourozence, jistě nebude stejný jako u diabetika v pokročilém věku, který má po 15 letech trvání diabetu perzistentní mikroalbuminurii a lehký pokles renálních funkcí. Pojetí komplikací jako kvantitativního znaku umožňuje studovat izolovaně příspěvek konkrétních genů a homogenizovat soubor z hlediska fenotypu – například vydělit nejzávažnější, rychle progredující, na terapii rezistentní typy. Homogennější fenotyp dává větší šance využít dostupných metod a v konečném čase nalézt genetický základ [7].
Jako u všech komplexních nemocí, spoluúčast epigenetických faktorů (kouření, dietní návyky, farmakoterapie, pohybová aktivita a další) hraje důležitou roli a bohužel, z pohledu studia genetiky komplikací, dále komplikuje už tak složitou situaci.
Možnosti genetického studia diabetických komplikací
Pro genetické mapování komplexních znaků existuje celá řada metod, z nichž každá má určité výhody i nevýhody, teprve syntéza jejich výsledků může vést k identifikaci lokusů zodpovědných za dědičnost studovaných komplexních znaků. V případě genetického mapování diabetických komplikací lze z metodologického hlediska využít v zásadě dvojího přístupu – vazebných nebo asociačních studií; z hlediska rozsahu mohou oba typy sledovat buď jeden nebo více kandidátních genů („candidate gene approach“), anebo pracovat v rozsahu celého genomu bez předchozí kandidátní hypotézy („genome-wide“) [5]. Principiálně se vazebný a asociační přístup zásadně liší, zjednodušeně řečeno první sleduje přenos genetického a fenotypového znaku v postižených rodinách, zatímco druhý srovnává výskyt genetického znaku mezi fenotypicky odlišnými nepříbuznými osobami. Vazebné („linkage“) studie lze dále dělit na parametrické a neparametrické („allele sharing methods“), asociační studie mohou být retrospektivní, prospektivní nebo ve formě tzv. testu nerovnováhy přenosu (transmission disequilibrium test, TDT). V neposlední řadě diabetologie intenzivně využívá výsledků studia na modelových organizmech; seznam dostupných spontánně či indukovaně diabetických pokusných zvířat jak pro diabetes typu 1, tak typu 2 (DM1T, resp. DM2T) čítá desítky modelů. Geneticky inbrední či nejrůzněji modifikovaná zvířata (zejména hlodavci) umožňují selektivně studovat jednotlivé procesy způsobem, který není u člověka ani teoreticky myslitelný. Konkrétní specifikace využívaných geneticko-epidemiologických metod a jejich výhody a nevýhody při studiu diabetických komplikací jsou uvedeny v tab. 1.
Table 1. Metody využitelné při genetickém mapování diabetických komplikací. 
V ideálním případě by měly vazebné studie pomocí mini - a mikrosatelitů (vysoce polymorfní repetitivní sekvence DNA) zhruba identifikovat zodpovědný lokus, konkrétní pozice by byla upřesněna pomocí jemnějšího mapování s využitím jednonukleotidových polymorfizmů (single nucleotide polymorphisms, SNPs), konkrétní alely by byly přesně identifikovány sekvenováním a podařilo by se dokonce pomocí studia intermediárního fenotypu, in vitro experimentů a transgenních zvířat objasnit funkční efekt konkrétních alel [8]. Tento ideální scénář ovšem v praxi naráží na celou řadu problémů. V první řadě hned iniciální fáze – genetické mapování – je ve své robustní parametrické formě při studiu komplexních onemocnění obtížně proveditelná. Je problematické odhadnout počet zúčastněných genů a model dědičnosti. Nejednoznačně definovaný fenotyp a vysoká frekvence potencionálně patogenních alel jsou dalším zdrojem matoucích faktorů. A konečně, mutace či polymorfizmy zodpovědné za zvýšenou náchylnost se velmi často nacházejí v nekódujících sekvencích, a studovat jejich funkční efekt je tudíž metodologicky obtížné. Asi nejběžněji využívaným přístupem jsou asociační studie.
Uvažované kandidátní geny
Většina geneticko-epidemiologických studií považovala původně kandidátní geny mikrovaskulárních diabetických komplikací za totožné s kandidátními geny pro kardiovaskulární onemocnění [9]. Postupně se však ukázalo, že komplikace diabetu (zejména mikrovaskulární) a kardiovaskulární onemocnění na aterosklerotickém podkladě nejsou klinicky ani geneticky totožné entity. Rovněž kumulující se poznatky o tom, jak komplexní jsou změny iniciované hyperglykemií, značně rozšířily soubor kandidátních genů. Výběr kandidátních genů je v podstatě otázkou kvalifikovaného odhadu konkrétního experimentátora. Řídí se v zásadě tím, jak se produkt takového genu (enzym, receptor či transkripční faktor) uplatňuje v patogenezi studovaného onemocnění. V první fázi se příslušnými molekulárně biologickými metodami zkoumá, zda je sekvence genu polymorfní a jak jsou eventuální substituce četné. V ideálním případě je rovněž popsán funkční efekt jednotlivých záměn (např. změna afinity k ligandu či substrátu, změněná exprese genu či stabilita mRNA aj). Pokud charakter a frekvence substitucí (nejčastěji SNPs) odpovídají očekávání, provede se asociační studie. Část z uvažovaných kandidátních genů pro diabetické komplikace je uvedena v tab. 2, jejich počet však samozřejmě není konečný.
Table 2. Vybrané kandidátní geny pro pozdní komplikace diabetu. 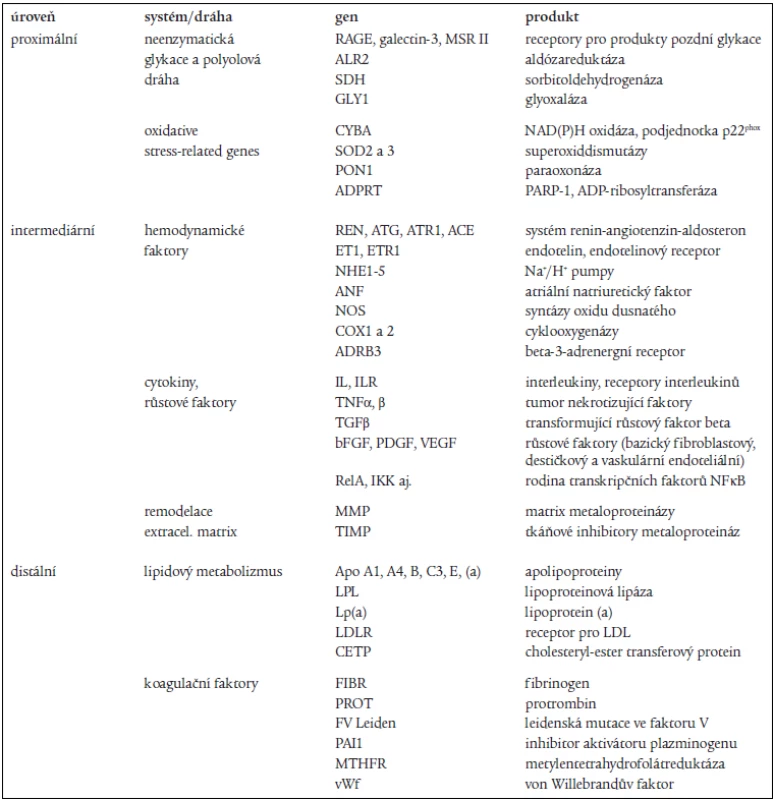
Detailní rozbor výsledků publikovaných asociačních studií s těmito a dalšími kandidátními geny je mimo rámec této práce. V následující části zmíníme pouze asociační studie, které navazovaly na vazebné studie (tab. 3) a studovaly kandidátní geny v lokusech identifikovaných vazebnými studiemi jako potencionálně zodpovědné. Obecně se dá říci, že dosavadní výsledky nejsou ve většině případů studovaných polymorfizmů konzistentní. Iniciální pozitivní publikované asociace nebyly ve většině případů reprodukovány a ani několik málo prozatím provedených genetických metaanalýz nepřineslo jednoznačné závěry. Tento fakt bývá vysvětlován populačními rozdíly, různým výběrem pacientů a kontrolní skupiny či malými počty studovaných jedinců.
Table 3. Genetické studie diabetické nefropatie (DN) u diabetu 1. a 2. typu. 
Genetika mikrovaskulárních komplikací
Diabetická nefropatie
Ze všech typů mikrovaskulárních diabetických komplikací se nejsilnější genetická determinace projevuje u diabetické nefropatie (DN). Patogeneze diabetické nefropatie se sestává z několika fází: mikroalbuminurie, progrese do manifestní proteinurie kombinované s variabilním stupněm chronické renální insuficience a následný rozvoj konečného selhání ledvin (ESRD, end stage renal disease). Jak bylo řečeno v předchozích částech, DN jako fenotyp může být definována jako diskrétní znak – rozhodující je přítomnost perzistentní proteinurie – nebo kontinuálně, stupněm exkrece proteinu (albuminu) do moči zpravidla vyjádřené jako AER nebo tzv. ACR (albumin/creatinine ratio, poměr albumin/kreatinin).
Familiární výskyt diabetické nefropatie byl u obou typů diabetu a různých etnik opakovaně prokázán [10,11,12,13,14,15,16]. Také výsledky studie DCCT potvrdily familiární výskyt [17]. Rovněž skutečnost, že pouze u části diabetiků bez ohledu na trvání a kompenzaci se rozvine DN, podporuje existenci genetické predispozice (obr. 2a). Souhrnné celoživotní riziko DN je u DM1T v průměru přibližně 35 %, maximální incidenci má DN ve 2. dekádě trvání diabetu (přesněji mezi 5.–15. rokem trvání diabetu), poté významně klesá [18]. Pro sourozence diabetiků se toto riziko nicméně značně liší v závislosti na tom, zda první sourozenec byl nebo nebyl postižen DN (riziko 72 % v případě postižení prvního sourozence DN vs 25 % při nepřítomnosti DN) [12]. U DM2T se kumulativní incidence DN po 25 letech trvání choroby pohybuje okolo 25–40 % (velký rozptyl mezi publikovanými výsledky je patrně důsledkem nemožností přesně stanovit začátek onemocnění). Prevalence DN po 30 letech trvání diabetu vykazuje rovněž značné etnické rozdíly, pohybuje se od 80 % u indiánů kmene Pima po 30 % u bělošské (kavkazoidní) populace.
Image 2. Schematické znázornění existence genetické predispozice k diabetu a jeho pozdním komplikacím v populaci. 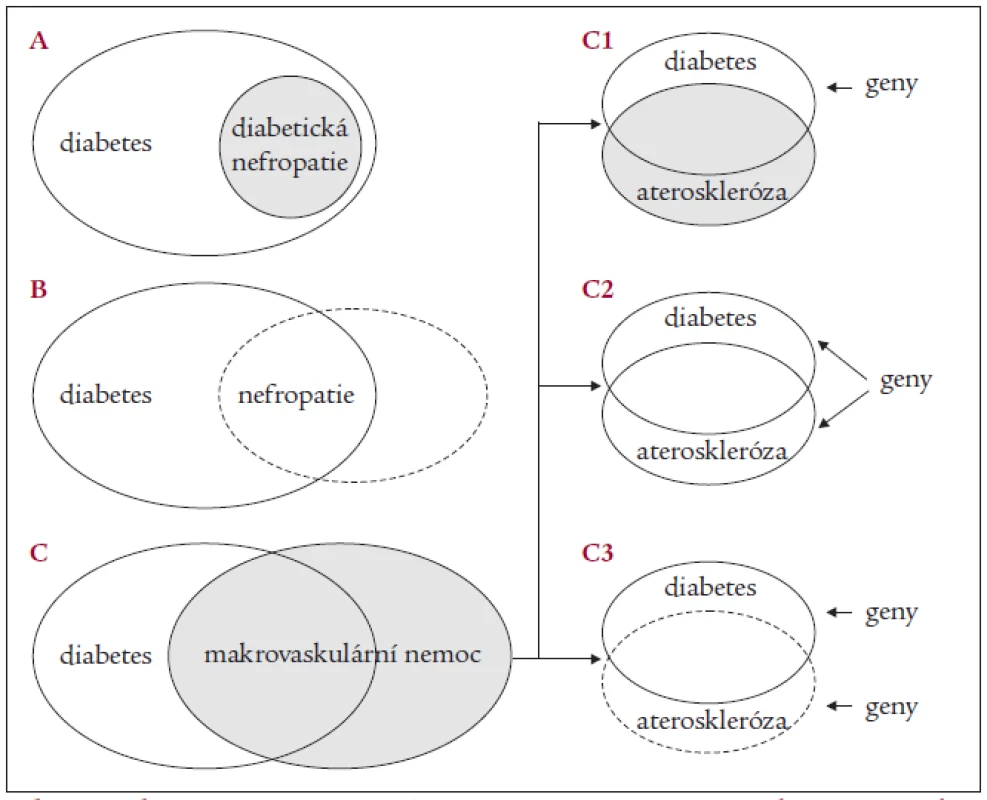
A) Diabetická nefropatie – diabetes je etiopatogeneticky podmínkou sine qua non, avšak pouze u části diabetiků se nezávisle na trvání a kompenzaci rozvine DN. B) Diabetická nefropatie – v populaci existuje společná geneticky determinovaná dispozice k renálnímu poškození, která se projevuje jako dispozice k DN u diabetiků nebo dispozice k nefropatii jako následku jiných onemocnění v nediabetické populaci. C) Značný překryv diabetu a kardiovaskulárních onemocnění (makrovaskulární komplikace) a možná vysvětlení tohoto překryvu. C1 – ateroskleróza je fenotypovým následkem geneticky determinovaných poruch v rámci metabolického syndromu (s nebo bez diabetu) bez vlastní dispozice; C2 – společná genetická příčina diabetu i aterosklerézy, která se v závislosti na spolupůsobení epigenetických faktorů manifestuje izolovaně či společně; C3 – nezávislé dispozice k diabetu a ateroskleróze v populaci ovšem tak časté, že nutně dochází k překryvu (podrobněji viz text). Segregační analýzy u DM2T – indiánů Pima (diskrétní fenotyp – „cut-off“ ACR ≥ 300 mg/g) [19] i u bělochů (kontinuální fenotyp – ACR) [20] – jednotně naznačily pravděpodobnou existenci efektu dominantního („major“) genu v kooperaci s dalšímu polygenními efekty. Hledání konkrétních rizikových lokusů pro DN probíhá intenzivně všemi dostupnými strategiemi u DM1T i DM2T. Parametry odvozené ze segregační analýzy (heritabilita, očekávané alelické frekvence a model dědičnosti) byly využity v několika parametrických vazebných studiích. Doposud byla ovšem pouze jediná z nich (indiáni Pima) skutečně „genome-wide“, tato studie označila jako možný relevantní lokus chromozom 18q [21]. Další, která pracovala pouze s kandidátně vytypovanými lokusy, identifikovala u bělošské populace jako možný lokus náchylnosti chromozom 18q22.3–23 [22]. Neparametrické studie (opět převážně s kandidátní hypotézou) byly mnohem častější. V nich byly jako možné lokusy identifikovány: (i) chromozom 7q (velmi slabě rovněž chromozomy 3q, 9 a 20) u DM2T Pima (konkordantní páry, opět jediná celogenomová) [23], (ii) chromozom 3q u DM1T bělochů (diskordantní páry) [24], (iii) vazebná studie u DM2T afroameričanů neprokázala žádnou vazbu [25]. Nutno zdůraznit, že žádná z uvedených studií neprokázala „přesvědčivou“ vazbu (tzn. logarithm of odds (LOD) > 3,3 pro celogenomové studie) [26] a spadají proto spíše do kategorie „možných“.
Genetická komponenta AER/ACR jako kontinuálního znaku byla studována rovněž v nediabetické populaci. Bylo prokázáno, že heritabilita ACR je obecně, bez ohledu na diabetes, 27%; tzn. po odseparování efektu věku, pohlaví, obezity a diabetu je 27 % z celkové variability ACR určeno genetickými faktory [27]. V jiné studii byla zjištěna heritabilita ACR dokonce 49% [28]. Byla rovněž stanovena genetická korelace mezi ACR a krevním tlakem (fenotypová korelace je notoricky známý fakt). ACR významně geneticky koreluje jak se systolickým (SBP), tak diastolickým tlakem (DBP). Heritabilita obou je přitom podobně jako v případě ACR značná (20–40% u SBP a 15–30% u DBP) [29]. Analogicky byla v jiné studii sledována heritabilita GFR (pomocí kreatininové clearance), kde pro afroamerickou a bělošskou populaci po odseparování efektu věku, pohlaví, obezity, tlaku, terapie a fyzické aktivity výsledky ukazují heritabilitu 17%, respektive 18% [30].
Uvedené údaje jsou v souladu s postulovanou koncepcí rozvoje DN u DM1T, u níž DN etiopatogeneticky vykazuje dvoufázový průběh – genetická komponenta je zřejmě u podskupiny náchylných osob zodpovědná za inicializaci rozvoje DN, protože pouhá úroveň kompenzace glykemie do nástupu mikroalbuminurie nevysvětluje plně pozorovanou incidenci. Progrese DN je pak výsledkem působení negenetických faktorů – kompenzace diabetu, krevního tlaku a efektu biologického věku [18], snad opět s modulujícím přispěním genetické dispozice. Progrese mikroalbuminurie do manifestní proteinurie je významně závislá na kontrole glykemie a krevního tlaku (1,3 % za rok při HbA1c < 8 % vs 6,7 % za rok při HbA1c > 10 %); kumulativní incidence manifestní proteinurie za 10–15 let od nástupu mikroalbuminurie je zhruba 34–47 % [31].
Zajímavé jsou v souvislosti s nezanedbatelnou heritabilitou ACR a GFR úvahy o existenci společné geneticky determinované dispozice k renálnímu selhání resp. ESRD v obecné populaci, která se může projevit jako dispozice k DN u diabetiků či dispozice k nefropatii jako následku jiných onemocnění (např. esenciální hypertenze, chronických glomerulonefritid, systémového lupus erythematodes aj) v nediabetické populaci (obr. 2b) [32]. Pro tuto hypotézu hovoří i nálezy u některých experimentálních zvířecích modelů hypertenze a glomerulosklerózy (např. fawn hooded rats), u kterých byly identifikovány geny zodpovědné za renální selhání (Rf1 a Rf2, renal failure genes) odlišné od lokusů determinujících hypertenzi [33]. Lidský analog genu Rf1 leží na chromozomu 10q24–q26. Na tuto oblast se soustředilo přirozeně několik vazebných studií. Náznaky vazby na 10. chromozom byly zjištěny u afroameričanů (diskrétní fenotyp: ESRD etiologie hypertenzní, chronické glomerulonefritidy a diabetické) [34] i u bělošské populace (kontinuální fenotyp: kreatininová clearance) [35], diskrétní fenotyp: DN [36], nicméně zjištěné lokusy neodpovídají přesné lokalizaci předpokládaného lidského Rf1-genu. Nedávno publikované výsledky jiné neparametrické vazebné studie – HyperGEN (Hypertension Genetic Epidemiology Network), která sleduje genetickou predispozici k rozvoji renálního poškození u esenciální hypertenze, nepotvrdily vazbu kreatininové clearance na chromozom 10, ale naznačily možnou vazbu na chromozom 3 [30]. Tatáž studie rovněž naznačila možnou vazbu ACR na chromozom 19 a 12 [28].
Nesčetné asociační studie s pozičními i funkčními kandidátními geny nevedly prozatím, podobně jako vazebné studie, k jednoznačným výsledkům. Téměř veškeré kandidátní geny uvedené v tab. 2 (a celá řada dalších) byly studovány v souvislosti s DN. Asi největší pozornost byla logicky věnována genetické variabilitě v renin-angiotenzin-aldosteronovém systému (RAAS). Vzhledem k prokazatelné patogenetické roli v rozvoji DN a masivnímu farmakoterapeutickému využití blokátorů jednotlivých komponent RAAS mnozí považovali polymorfizmus genů RAAS, mezi nimi především inzerčně-deleční polymorfizmus v angiotenzin konvertujícím enzymu (I/D ACE), nesynonymní SNP v genu pro angiotenzinogen (AGT M235T) a SNP v 3’UTR genu pro angiotenzinový receptor 1 (A1166→C), za prvořadé kandidátní geny DN. Výsledky celé řady parciálních studií polymorfizmu I/D ACE ve vztahu k DN analyzovalo doposud několik metaanalýz. V analýze zahrnující 49 959 diabetických i nediabetických osob zvyšovalo nosičství alely D riziko makrovaskulárních a renálních mikrovaskulárních komplikací, nikoliv hypertenze [37]. Další metaanalýza, tentokrát pouze na diabeticích (n = 4 773), potvrdila efekt alely D jako rizikového markeru pro DN [38]. Jiná metaanalýza (na 5 336 diabetických pacientech s DN) asociaci I/D ACE s DN u kaukazoidní populace nepotvrdila, u asijské populace vyloučena nebyla [39]. Asociační studie variant AGT M235T a A1166→C jsou rovněž četné, většina z nich však asociaci s DN neprokázala. Jejich metaanalýzy prozatím provedeny nebyly. Bez zajímavosti nejsou výsledky několika málo dosavadních prospektivních studií. Ve francouzské studii zahrnující 310 DM1T s variabilním renálním postižením sledovaných 6 let byla progrese do pokročilejšího stadia DN významně spojena s ACE-fenotypem, alela D vykázala dominantní efekt (ID + DD genotyp versus II) [40]. V dánské studii provedené Steno Diabetes Centrem bylo 169 DM1T pacientů sledováno 6 let, D alela I/D ACE byla asociována s rychlostí nárůstu sérového kreatininu resp. progrese do ESRD [41]. Sumární přehled publikovaných genetických studií u DN podává tab. 3.
Diabetická retinopatie a neuropatie
Prevalence a incidence diabetické retinopatie (DR), na rozdíl od nefropatie, roste kontinuálně s trváním diabetu a při dostatečně dlouhém trvání jsou prakticky všichni diabetici postiženi určitým stupněm retinopatie. Studie DCCT naznačila podobně jako u DN i v případě DR pravděpodobný familiární výskyt [17]. Její genetická složka ovšem zřejmě nebude tak významná a týká se pravděpodobně pouze její nejtěžší formy – proliferativní DR. Vazebné studie provedené u indiánů Pima současně s DN sledovaly i DR [23], veškeré náznaky vazby byly ovšem daleko pod hranicí statistické významnosti. Asociační studie kandidátních genů s DR jsou početné, nicméně nevedly dosud, podobně jako v jiných případech, k jednoznačným závěrům.
Experimentální důkazy pro genetickou predispozici k diabetické neuropatii chybí prozatím úplně.
Genetika makrovaskulárních komplikací
Prevalence kardiovaskulárních onemocnění na aterosklerotickém podkladě u diabetiků je oproti nediabetické populaci podstatně zvýšena. Tento údaj se bez výjimky týká ischemické choroby srdeční, ischemické choroby mozku i ischemické choroby dolních končetin; ve všech 3 případech je prevalence v diabetické populaci zhruba 2 - až 3násobkem prevalence u nediabetiků. Zásadní otázkou z hlediska prevence a léčby kardiovaskulárních onemocnění u diabetiků je ovšem to, do jaké míry jsou obě nemoci spolu etiopatogeneticky svázány. Jak u DM1T, tak DM2T roste riziko onemocnění na aterosklerotickém podkladě s délkou trvání diabetu, avšak není pouhým násobkem rizika ve věkově přiměřené nediabetické populaci. Kumulativní expozice diabetu jako rizikového faktoru kardiovaskulárních onemocnění hraje významnou roli pouze u podskupiny diabetických pacientů. Zdá se, že metabolická dysregulace provázející diabetes má vliv spíše na progresi aterosklerózy než na její iniciaci. Tuto domněnku rovněž podporují pozorování, že kardiovaskulární onemocnění se významně častěji neobjevují u diabetiků v těch populacích, v nichž je jejich výskyt obecně nižší i u nediabetiků [42].
Historicky existuje určitý paradox v pohledu na tentýž problém z hlediska kardiologa a diabetologa. Diabetes je tradičně považován za rizikový faktor kardiovaskulárních onemocnění, a naopak, tzv. makrovaskulární choroba za komplikaci diabetu (s intuitivním předpokladem, že při dobré kompenzaci diabetu lze jejímu rozvoji předejít). Diabetes (zejména DM2T) a v širším pohledu metabolický syndrom s nebo i bez DM2T díky své etiopatogenezi a důsledkům – generalizované dysregulaci metabolizmu – zahrnují skutečně všechny tradiční rizikové faktory kardiovaskulárních onemocnění (hypertenze, dyslipidemie, mikroalbuminurie a hyperinzulinemie), ale navíc i většinu netradičních, a to jako následek hyperglykemií indukovaných změn (zánět, zvýšený oxidační stres a glykoxidace, změněné koagulační a fibrinolytické parametry a další). Značný překryv diabetu a kardiovaskulárních onemocnění v populaci (obr. 2c) je tedy možno vysvětlit několika způsoby: (i) buď jsou kardiovaskulární onemocnění skutečně pouhou „komplikací“ či spíše pozdní fenotypovou manifestací diabetu bez vlastní genetické determinace a jejich výskyt u nediabetiků je opět pozdějším projevem metabolického syndromu bez diabetu (nemá tudíž smysl hledat eventuální genetickou dispozici k makrovaskulárním komplikacím, protože vše je závislé na míře kompenzace), (ii) obě onemocnění mají společný genetický základ a jejich společný výskyt či přítomnost v pouze jedné klinické manifestaci jsou „špičkami téhož ledovce“ (geneticky se jedná o víceméně stejný soubor alel) anebo (iii) jsou predispozice k nim na sobě sice nezávislé, ale v populaci tak časté, že se nutně musí u části projevit současně (dva značně se překrývající „clustery“ genů). Graficky ukazuje uvedené hypotézy obr. 2c1–3.
Proti první hypotéze hovoří výsledky studie UKPDS, která prokázala, že zlepšení kompenzace glykemie intenzivní léčbou inzulinem nebo perorálními antidiabetiky snižuje riziko mikrovaskulárních, ale téměř neovlivňuje riziko makrovaskulárních komplikací [43]. Druhá hypotéza by odpovídala situaci, při níž je dispozice k oběma nemocem sdružena spolu s geneticky determinovanými dalšími poruchami v rámci metabolického syndromu. Analýza komponent metabolického syndromu skutečně prokázala paralelní familiární agregaci diabetu a kardiovaskulárních onemocnění [44] a vzhledem k tomu, že se diagnóza inzulinové rezistence bez manifestního diabetu běžně nestanovuje, je obtížné posoudit její podíl. S plnou platností této hypotézy ovšem nekoresponduje fakt, že i diabetici 1. typu, u kterých není diabetes důsledkem metabolického syndromu, mají zvýšenou prevalenci kardiovaskulárních onemocnění. Pro třetí hypotézu svědčí výsledky prozatím několika málo studií, které hodnotily výskyt aterosklerotického postižení velkých tepen výhradně u diabetiků (konkrétně 2. typu). Přesněji, podobně jako v případě diabetických mikrovaskulárních komplikací sledovaly raději než diskrétní fenotyp kontinuální intermediární fenotypy pro kardiovaskulární onemocnění (a jejich subklinická stadia) a stanovily jejich heritabilitu. Jedna z prvních studií tohoto typu prokázala familiární agregaci kalcifikace medie arterií (MAC) u indiánů Pima, kde riziko MAC u potomků jednoho postiženého rodiče bylo 3,3krát větší, při postižení obou rodičů 8,1krát vyšší, avšak nelišilo se významně podle toho, zda rodiče byli nebo nebyli diabetici [45]! Podobně byla u bělošské a afroamerické diabetické populace prokázána heritabilita kalcifikace koronárních arterií (CAC, h2 = 40 %) [46] a IMT (h2 = 41 %) [47], pochopitelně po odseparování efektu věku, pohlaví, etnika, BMI, hypertenze, dyslipidemie a kouření.
Shrnout zjednodušeně výsledky vazebných studií v nediabetických populacích a obrovského počtu asociačních studií s kandidátními geny pro kardiovaskulární onemocnění v kontextu této práce nelze. Pouze snad výsledky metaanalýz genů RAAS, konkrétně inzerčně-delečního polymorfizmu v ACE, pro srovnání s obdobnými údaji uvedenými pro diabetickou nefropatii. Původní práce Cambiena et al [48] na souboru asi 1 300 osob naznačila asociaci DD-genotypu (spojeného s vyšší hladinou cirkulujícího ACE) s myokardiálním infarktem, zejména u osob s jinak nízkým rizikem (nízký BMI a ApoB). Následovalo velké množství různě rozsáhlých asociačních studií s různým výstupem. Série metaanalýz – Samani et al (celkem 10 563 osob) [49], Agerholm-Larsen et al (32 713 osob) [50] a Keavney et al (10 563 osob) [51] – shodně prokázala, že I/D ACE polymorfizmus (i) ovlivňuje plazmatickou hladinu ACE, (ii) není asociován s hodnotou krevního tlaku ani (iii) s cerebrovaskulárními onemocněními. V případě ischemické choroby srdeční bylo riziko spojené s nosičstvím DD-genotypu nadhodnoceno v malých studiích a s rostoucím počtem studovaných osob klesalo, pohybovalo se mezi 10–15 %. Eventuální terapeutické využití znalostí o I/D ACE-polymorfizmu (identifikace osob neprofitujících z léčby inhibitory ACE) bude jistě předmětem budoucích farmakogenetických studií.
Závěr – využitelnost výsledků pro praxi
Z uvedeného přehledu patofyziologie a genetiky pozdních komplikací diabetu vyplývá, že studium jejich etiopatogeneze je velmi komplexní. Jedná se pravděpodobně o multifaktoriální postižení se značnou interindividuální variabilitou, s určitou genetickou složkou, při kterém je diabetes zdaleka nejběžnějším a nejsilnějším, avšak ne absolutně specifickým etiopatogenetickým faktorem.
Přes pokroky v diagnostice a terapii diabetu zůstávají pozdní komplikace dominantním faktorem morbidity a v případě kardiovaskulárních onemocnění a diabetické nefropatie také mortality v diabetické populaci [52,53]. I v celkové populaci hrají vzhledem k výskytu diabetu významnou roli. Údaje o prevalenci a incidenci komplikací v České republice korespondují zhruba s údaji v ostatních evropských zemích [54,55], ve kterých není etnická různorodost tak dominantní (jako je tomu například ve Spojených státech). Perspektivní význam možnosti predikce komplikací podtrhuje například v případě diabetické nefropatie fakt, že ze všech pacientů zařazených v ČR do chronického dialyzačního programu je 33 % diabetiků [56] a z toho u zhruba 30 % nebyla diagnóza diabetické nefropatie před tím stanovena a nefrologická dispenzarizace započala rovnou dialyzační léčbou [57].
Studiu genetické determinace pozdních diabetických komplikací se v současnosti věnuje celá řada pracovišť, která sledují početně i etnicky různorodé soubory pacientů – od poměrně omezených počtů v jednoduchém designu studie až po vytváření genetických konsorcií sdružujících mnohatisícové soubory pacientů a jejich rodinných příslušníků v komplexně pojatých studiích. Veškeré snahy nicméně sledují zhruba stejné cíle – individualizaci sekundárně preventivních postupů, cílené farmakologické ovlivnění jednotlivých patogenetických komponent a individuální úpravu životního stylu (přístup, který se dnes označuje pojmem „personalised medicine“). Jak bylo řečeno již v první části našeho příspěvku, vzhledem k prozatím omezeným možnostem primárního ovlivnění diabetu by bylo velmi cenné mít alespoň možnost zhodnotit riziko rozvoje dlouhodobých komplikací u osob s již klinicky manifestním diabetem, stratifikovat populaci diabetiků podle míry rizika a úměrně tomu upravit terapii a screening komplikací.
Závěrem se dá konstatovat, že ačkoliv prozatímní nálezy svědčí pro jednoznačnou účast genetických faktorů přinejmenším v patogenezi diabetické nefropatie a většina světových autorit v této oblasti ani v nejmenším nezpochybňuje jejich existenci [58,59,60], nemáme navzdory vynaloženému úsilí v danou chvíli k dispozici žádný konkrétní údaj, který by byl, v souladu s cíli postulovanými v úvodu, klinicky bezprostředně využitelný k predikci rizika. I když alespoň v případě variability v RAAS (zejména I/D ACE) výsledky svědčí pro možnou kauzální úlohu, bude nutné je dále potvrdit prospektivními – ev. Farmakogenetickými studiemi. Další vývoj v této oblasti kriticky závisí na designu budoucích studií a dostupnosti rozsáhlých souborů diabetiků a jejich rodin pro vazebné a asociační analýzy. Jednou z nadějných studií tohoto typu je momentálně probíhající multicentrická multietnická studie The Family Investigation of Nephropathy and Diabetes (FIND), která si klade za cíl na plánovaném počtu asi 10 000 osob provést jednak celogenomovou vazebnou analýzu a rovněž asociační studii s funkčními i pozičními kandidátními geny [61].
Poděkování
Práce vznikla s podporou grantů 303/02/D127 Grantové agentury České republiky, MSM 141100002 a 1K03019 Ministerstva školství, mládeže a tělovýchovy České republiky.
Seznam použitých zkratek
ACE – angiotensin converting enzyme, ACR – albumin/creatinine ratio, AER – albumin excretion rate, ApoB – apolipoprotein B, ASP – affected sib pairs, BMI – body mass index, CAC – coronary artery calcification, DBP – diastolic blood pressure, DCCT – Diabetes Control and Complication Trial, DM1T – diabetes mellitus 1. typu, DM2T – diabetes mellitus 2. typu, DN – diabetická nefropatie, DR – diabetické retinopatie, DSP – discordant sib pairs, ESRD – end stage renal disease, GFR – glomerular filtration rate, IMT – intima/media thickness, LOD – logarithm of odds, MA – metaanalysis, MAC – medial artery calcification, RAAS – renin – angiotenzin–aldosteronový systém, SBP – systolic blood pressure, SNP – single nucleotide polymorphism, TDT – transmission disequilibrium test, UKPDS – United Kingdom Prospective Diabetes Study, UTR – untranslated region
MUDr. Kateřina Kaňková, Ph.D.
www.med.muni.cz
e-mail: kankov@med.muni.cz
Doručeno do redakce: 10. 5. 2004
Přijato po recenzi: 21. 6. 2004
Sources
1. Kaňková K. Molecular pathophysiology of late diabetic complications – hyperglycemia-induced changes. Vnitř Lék 2004; 50 : 756–767.
2. Strowig S, Raskin P. Glycemic control and diabetic complications. Diabetes Care 1992; 15 : 1126–1140.
3. Barbosa J. Nature and nurture: The genetics of diabetic microangiopathy In: Podolsky S, Viswanathan M (eds). Secondary diabetes. The spectrum of diabetic syndromes. New York: Raven Press 1980.
4. Kaňková K. Role of genetic variability in systems of receptor–mediated and enzymatic defence against glycation in the long–term consequences of diabetes mellitus. Biochem Soc Trans 2003; 31 : 1364–1366.
5. Lander ES, Schork NJ. Genetic dissection of complex traits. Science 1994; 265 : 2037–2048.
6. Rogus JJ, Warram JH, Krolewski AS. Genetic studies of late diabetic complications: the overlooked importance of diabetes duration before complication onset. Diabetes 2002; 51 : 1655–1662.
7. Strauch K, Fimmers R, Baur MP et al. How to model a complex trait. 1. General considerations and suggestions. Hum Hered 2003; 55 : 202–210.
8. Glazier AM, Nadeau JH, Aitman TJ. Finding genes that underlie complex traits. Science 2002; 298 : 2345 – 2349.
9. Ruiz J. Diabetes mellitus and the late complications: influence of the genetic factors. Diabetes Metab 1997; 23(Suppl 2): 57–63.
10. Seaquist ER, Goetz FC, Rich S et al. Familial clustering of diabetic kidney disease. Evidence for genetic susceptibility to diabetic nephropathy. N Engl J Med 1989; 320 : 1161–1165.
11. Borch-Johnsen K, Norgaard K, Hommel E et al. Is diabetic nephropathy an inherited complication? Kidney Int 1992; 41 : 719–722.
12. Quinn M, Angelico MC, Warram JH et al. Familial factors determine the development of diabetic nephropathy in patients with IDDM. Diabetologia 1996; 39 : 940–945.
13 Faronato PP, Maioli M, Tonolo G et al. Clustering of albumin excretion rate abnormalities in Caucasian patients with NIDDM. The Italian NIDDM Nephropathy Study Group. Diabetologia 1997; 40 : 816–823.
14. Pettitt DJ, Saad MF, Bennett PH et al. Familial predisposition to renal disease in two generations of Pima Indians with type 2 (non-insulin-dependent) diabetes mellitus. Diabetologia 1990; 33 : 438–443.
15. Canani LH, Gerchman F, Gross JL. Familial clustering of diabetic nephropathy in Brazilian type 2 diabetic patients. Diabetes 1999; 48 : 909–913.
16. Freedman BI, Tuttle AB, Spray BJ. Familial predisposition to nephropathy in African–Americans with non–insulin–dependent diabetes mellitus. Am J Kidney Dis 1995; 25 : 710–713.
17. Clustering of long–term complications in families with diabetes in the diabetes control and complications trial. The Diabetes Control and Complications Trial Research Group. Diabetes 1997; 46 : 1829–1839.
18. Krolewski AS, Warram JH, Christlieb AR et al. The changing natural history of nephropathy in type I diabetes. Am J Med 1985; 78 : 785–794.
19. Imperatore G, Knowler WC, Pettitt DJ et al. Segregation analysis of diabetic nephropathy in Pima Indians. Diabetes 2000; 49 : 1049–1056.
20. Fogarty DG, Hanna LS, Wantman M et al. Segregation analysis of urinary albumin excretion in families with type 2 diabetes. Diabetes 2000; 49 : 1057–1063.
21. Imperatore G, Knowler WC, Nelson RG et al. Genetics of diabetic nephropathy in the Pima Indians. Curr Diab Rep 2001; 1 : 275–281.
22. Vardarli I, Baier LJ, Hanson RL et al. Gene for susceptibility to diabetic nephropathy in type 2 diabetes maps to 18q22.3–23. Kidney Int 2002; 62 : 2176–2183.
23. Imperatore G, Hanson RL, Pettitt DJ et al. Sib-pair linkage analysis for susceptibility genes for microvascular complications among Pima Indians with type 2 diabetes. Pima Diabetes Genes Group. Diabetes 1998; 47 : 821–830.
24. Moczulski DK, Rogus JJ, Antonellis A et al. Major susceptibility locus for nephropathy in type 1 diabetes on chromosome 3q: results of novel discordant sib-pair analysis. Diabetes 1998; 47 : 1164–1169.
25. Yu H, Bowden DW, Spray BJ et al. Linkage analysis between loci in the renin-angiotensin axis and end - stage renal disease in African Americans. J Am Soc Nephrol 1996; 7 : 2559–2564.
26. Lander E, Kruglyak L. Genetic dissection of complex traits: guidelines for interpreting and reporting linkage results. Nat Genet 1995; 11 : 241–247.
27. Fogarty DG, Rich SS, Hanna L et al. Urinary albumin excretion in families with type 2 diabetes is heritable and genetically correlated to blood pressure. Kidney Int 2000; 57 : 250–257.
28. Freedman BI, Beck SR, Rich SS et al. A genome–wide scan for urinary albumin excretion in hypertensive families. Hypertension 2003; 42 : 291–296.
29. Ward R. Familial aggregation and genetic epidemiology of blood pressure. In: Laragh J (ed). Hypertension: Pathophysiology, Diagnosis and Management. New York: Raven Press 1990 : 81–100.
30. DeWan AT, Arnett DK, Atwood LD et al. A genome scan for renal function among hypertensives: the HyperGEN study. Am J Hum Genet 2001; 68 : 136–144.
31. Warram JH, Scott LJ, Hanna LS et al. Progression of microalbuminuria to proteinuria in type 1 diabetes: nonlinear relationship with hyperglycemia. Diabetes 2000; 49 : 94–100.
32. Freedman BI, Bowden DW, Rich SS et al. Genetic initiation of hypertensive and diabetic nephropathy. Am J Hypertens 1998; 11 : 251–257.
33. Brown DM, Provoost AP, Daly MJ et al. Renal disease susceptibility and hypertension are under independent genetic control in the fawn–hooded rat. Nat Genet 1996; 12 : 44–51.
34. Freedman BI, Rich SS, Yu H et al. Linkage heterogeneity of end-stage renal disease on human chromosome 10. Kidney Int 2002; 62 : 770–774.
35. Hunt SC, Hasstedt SJ, Coon H et al. Linkage of creatinine clearance to chromosome 10 in Utah pedigrees replicates a locus for end-stage renal disease in humans and renal failure in the fawnhooded rat. Kidney Int 2002; 62 : 1143–1148.
36. Iyengar SK, Fox KA, Schachere M et al. Linkage analysis of candidate loci for end-stage renal disease due to diabetic nephropathy. J Am Soc Nephrol 2003; 14: S195–S201.
37. Staessen JA, Wang JG, Ginocchio G et al. The deletion/insertion polymorphism of the angiotensin converting enzyme gene and cardiovascular-renal risk. J Hypertens 1997; 15 : 1579–1592.
38. Fujisawa T, Ikegami H, Kawaguchi Y et al. Meta-analysis of association of insertion/deletion polymorphism of angiotensin I-converting enzyme gene with diabetic nephropathy and retinopathy. Diabetologia 1998; 41 : 47–53.
39. Kunz R, Bork JP, Fritsche L et al. Association between the angiotensin-converting enzyme-insertion/deletion polymorphism and diabetic nephropathy: amethodologic appraisal and systematic review. J Am Soc Nephrol 1998; 9 : 1653–1663.
40. Hadjadj S, Fanelli A, Torremocha F et al. Prospective follow-up study of renal function in type 2 diabetes. Arch Mal Coeur Vaiss 2001; 94 : 928–932.
41. Jacobsen P, Tarnow L, Carstensen B et al. Genetic variation in the Renin-Angiotensin system and progression of diabetic nephropathy. J Am Soc Nephrol 2003; 14 : 2843–2850.
42. Krolewski AS, Warram JH, Valsania P et al. Evolving natural history of coronary artery disease in diabetes mellitus. Am J Med 1991; 90 : 56S–61S.
43. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352 : 837–853.
44. Lee KE, Klein BE, Klein R. Familial aggregation of components of the multiple metabolic syndrome in the Framingham Heart and Offspring Cohorts: Genetic Analysis Workshop Problem 1. BMC Genet 2003; 4(Suppl 1): S94.
45. Narayan KM, Pettitt DJ, Hanson RL et al. Familial aggregation of medial arterial calcification in Pima Indians with and without diabetes. Diabetes Care 1996; 19 : 968–971.
46. Wagenknecht LE, Bowden DW, Carr JJ et al. Familial aggregation of coronary artery calcium in families with type 2 diabetes. Diabetes 2001; 50 : 861–866.
47. Lange LA, Bowden DW, Langefeld CD et al. Heritability of carotid artery intima-medial thickness in type 2 diabetes. Stroke 2002; 33 : 1876–1881.
48. Cambien F, Poirier O, Lecerf L et al. Deletion polymorphism in the gene for angiotensin-converting enzyme is a potent risk factor for myocardial infarction. Nature 1992; 359 : 641–644.
49. Samani NJ, Thompson JR, O’Toole L et al. Ameta-analysis of the association of the deletion allele of the angiotensinconverting enzyme gene with myocardial infarction. Circulation 1996; 94 : 708–712.
50. Agerholm-Larsen B, Nordestgaard BG, Tybjaerg-Hansen A. ACE gene polymorphism in cardiovascular disease: meta-analyses of small and large studies in whites. Arterioscler Thromb Vasc Biol 2000; 20 : 484–492.
51. Keavney B, McKenzie C, Parish S et al. Large-scale test of hypothesised associations between the angiotensin-convertingenzyme insertion/deletion polymorphism and myocardial infarction in about 5 000 cases and 6 000 controls. International Studies of Infarct Survival (ISIS) Collaborators. Lancet 2000; 355 : 434–442.
52. Škrha J. Diabetes mellitus – a risk factor for cardiovascular diseases. Vnitř Lék 2001; 47(5): 281–284.
53. Krušová D. Antihypertensives and their importance in the initial stages of diabetic nephropathy. Vnitř Lék 1999; 45(11): 664–669.
54. Krahulec B, Vozar J. Incidence of risk factors and vascular complications in patients with newly diagnosed type 2 diabetes mellitus. Vnitř Lék 2002; 48(11): 1031–1038.
55. Morgan CL, Currie CJ, Stott NC et al. The prevalence of multiple diabetes-related complications. Diabet Med 2000; 17 : 146–151.
56. Rychlík I, Sulková S. Diabetes mellitus and chronic renal insufficiency. Vnitř Lék 2003; 49(5): 395–402.
57. Monhart V. Hypertension and chronic renal insufficiency-chronic kidney failure. Vnitř Lék 2003; 49(5): 388–394.
58. Lindner TH, Monks D, Wanner C et al. Genetic aspects of diabetic nephropathy. Kidney Int 2003; Suppl. S186–S191.
59. Krolewski AS, Ng DP, Canani LH et al. Genetics of diabetic nephropathy: how far are we from finding susceptibility genes? Adv Nephrol Necker Hosp 2001; 31 : 295–315.
60. Bowden DW. Genetics of diabetes complications. Curr Diab Rep 2002; 2 : 191–200.
61. Genetic determinants of diabetic nephropathy: The family investigation of nephropathy and diabetes (FIND). J Am Soc Nephrol 2003; 14: S202–S204.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 4-
All articles in this issue
- Vliv kombinovaného aerobního tréninku na změny autonomní modulace u nemocných po akutním infarktu myokardu
- Pleurální výpotek v interní praxi
- Molekulární patofyziologie pozdních komplikací diabetes mellitus – genetická predispozice k rozvoji diabetických komplikací
- Transplantace kmenových buněk v kardiologii
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
- Jaké jsou znalosti našich lékařů o rizikových faktorech ischemické choroby srdeční? Porovnání se stavem v roce 1991
- Epidemiologická analýza pacientů podstupujících trvalou kardiostimulaci na Interní kardiologické klinice Fakultní nemocnice Brno, pracoviště Bohunice
- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Rehabilitace po infarktu myokardu a revaskularizaci u starších nemocných
- Neobvyklý způsob neinvazivní objektivizace ischemie myokardu chladovou zátěží
- Vyučování etiky na lékařské fakultě: cesta od deskriptivní etiky k mravním normám
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Pleurální výpotek v interní praxi
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

