-
Medical journals
- Career
Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
Authors: L. Brunerová1ihash2 ,2 ,2
Authors‘ workplace: laboratoř patofyziologie metabolizmu 3. lékařské fakulty UK, Praha, vedoucí prof. MUDr. Michal Anděl, CSc. 1; II. interní klinika 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Michal Anděl, CSc. 2; III. interní kardiologická klinika 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC 3
Published in: Vnitř Lék 2005; 51(1): 106-112
Category: Case Reports
Overview
70letá žena byla hospitalizována na naší klinice pro oligurické renální selhání s EKG-obrazem akutního Q-infarktu myokardu, s pozitivními kardiospecifickými enzymy, s regionální poruchou kinetiky dle echokardiografie, bez klinického korelátu bolestí na hrudi. Jako příčina stavu byla diagnostikována akutní myokarditida. K selhání ledvin došlo na prerenálním podkladu v důsledku hypoperfuze ledvin při hemodynamických změnách způsobených myokarditidou a dehydratací. Cílem kazuistiky je upozornit na možnost neobvyklé manifestace akutní myokarditidy imitující akutní transmurální infarkt myokardu.
Klíčová slova:
oligurické renální selhání – akutní infarkt myokardu – akutní myokarditidaÚvod
Akutní myokarditidy (AM) jsou zánětlivá onemocnění myokardu se širokou škálou klinických projevů. Histologicky jsou definovány dle Dallaských kritérií jako zánětlivý infiltrát myokardu s nekrózou nebo degenerací myocytů [21], nověji se využívá tzv. Marburských kritérií a imunohistochemických metod [23]. Etiologicky se uplatňují z infekčních agens především tzv. kardiotropní viry, vzácněji bakterie, protozoa, houby [18], včetně atypických agens, jako toxoplazma [4], leptospira [13], agens způsobující hemolyticko-uremický syndrom [1,2,14], autoimunitní poruchy jako systémové choroby pojiva, včetně vzácné Kawasakiho choroby [6], exogenní faktory (léky, fyzikální a chemické faktory, toxiny) i genetické predispozice [21]. Patofyziologické mechanizmy zahrnují přímé poškození myocytů, sekundární imunitní odpověď, reakce zprostředkované cytokiny a aberantní indukci apoptózy. Epidemiologická data uvádějí incidenci myokarditidy v širokém rozmezí od 2 do 17 případů/100 000 obyvatel [7,21,22].
Klinické projevy kolísají od zcela asymptomatických případů, přes mírné příznaky (bolesti na hrudi, teploty, pocení, dušnost, při virové etiologii chřipkový syndrom), po projevy srdečního selhání (především u velkobuněčných myokarditid), ventrikulárních arytmií, převodních blokád, ale také kardiogenního šoku, či náhlé smrti. Pozdním následkem může být rozvoj dilatační kardiomyopatie.
Laboratorně svědčí pro možnou myokarditidu leukocytóza, zvýšená sedimentace a zánětlivé markery, zvýšení kardiospecifických enzymů, 4násobné zvýšení titru antivirových protilátek a pozitivní kultivační vyšetření. Z pomocných vyšetření má největší význam echokardiografie, která prokazuje regionální či globální poruchu kinetiky a remodelaci levé komory [7,11,21]. EKG-změny jsou obvykle nespecifické a zahrnují arytmie, převodní blokády nespecifické změny ST-T-úseku, velmi vzácně obraz pseudoinfarktu [11,21]. Koronarografie má význam z diferenciálně diagnostického důvodu ve vyloučení ischemické choroby srdeční. Za zlatý standard pro diagnózu myokarditidy byla dlouho pokládána endomyokardiální biopsie (EMB), užití Dallaských kritérií však vedlo ke snížení významu této metody pro výraznou variabilitu v interpretaci nálezu, možnost nezachycení fokálního postižení a pro absenci korelace mezi imunoreaktivitou a histopatologickou diagnózou [23,24].
Léčba AM zahrnuje režimová opatření (klid na lůžku apod.), symptomatickou léčbu arytmií a srdečního selhání. Nesteroidní antiflogistika se nemají v akutním stavu podávat pro riziko zvětšení myokardiální nekrózy [3,11,21]. Efekt steroidů a dalších imunosupresiv nebyl v širokém spektru pacientů s myokarditidou prokázán, u velkobuněčných myokarditid a autoimunitních postižení má však imunosupresivní léčba příznivý účinek. Zatím však nebyl nalezen zcela spolehlivý marker autoimunního procesu [8,11]. Přítomnost závažné dilatační kardiomyopatie může indikovat transplantaci srdce [11,21].
Prognóza závisí na průběhu onemocnění a tíži postižení myokardu (fulminantní myokarditidy s vysokou mortalitou versus asymptomatické průběhy, které odezní bez následků). Pozdním rizikem je rozvoj dilatační kardiomyopatie, proto je nutné pravidelné dlouhodobé sledování pacientů.
Popis případu
Na 2. interní kliniku 3. lékařské fakulty UK a FN Královské Vinohrady Praha byla přijata 70letá pacientka pro 2 týdny progredující námahovou dušnost a otoky dolních končetin, celkovou slabost, nechutenství, bolesti bederní páteře, váhový úbytek, občasné třesavky se zimnicí. Nemocná neudávala bolesti na hrudi, zažívací ani mikční obtíže.
Objektivně jsme při příjmu naměřili arteriální krevní tlak 90/50 mm Hg, centrální žilní tlak (CŽT) +1,5 cm vodního sloupce, srdeční akce byla 100/min, pravidelná, dechová frekvence 26/min. Pacientka byla afebrilní (teplota 36,5 °C), obézní (BMI 32), orientovaná, spolupracující, dušná při minimální námaze, bez ikteru a cyanózy. Při fyzikálním vyšetření hlavy a krku jsme nalezli bledší spojivky a oschlý jazyk, normální nález na krčních orgánech. Poslechový a poklepový nález na plicích byl normální. Na srdci byly slyšitelné 2 ozvy se systolickým šelestem v prekordiu. Na břiše jsme prokázali o 2 cm zvětšená játra, jinak byl nález na břiše, včetně tapottement, negativní. Na dolních končetinách dominoval rozsáhlý lymfedém s macerací kůže a s defektem levého bérce velikosti 5×15 cm.
Rok před přijetím byla pacientka vyšetřena na nefrologii se závěrem: chronická renální insuficience na podkladě tubulointersticiální nefritidy s podílem urátové nefropatie. Poslední kontrola v nefrologické poradně proběhla měsíc před přijetím laboratorní nález stanoví tyto hodnoty: kreatinin 194 μmol/l, hyperkalemie (kalium 6,1 mmol/l), hyperurikemie (kyselina močová 556 μmol/l) a metabolické acidózy (pH 7,25). Pacientka byla dále sledována dermatologem pro chronické lymfatické otoky obou bérců v terénu recidivujících erysipelů a chronické žilní insuficience III. stupně.
Nemocná měla negativní alergickou anamnézu. Z rodinné anamnézy bylo zajímavé, že 1 dcera prodělala nefrektomii ve 43 letech pro svraštělou ledvinu. Gynekologická anamnéza pacientky byla bez pozoruhodností. Před přijetím pacientka užívala furosemid 125 mg denně, allopurinol 200 mg/den a byla substituována železem.
Laboratorně byla při příjmu zachycena v krevním obraze leukocytóza (17,2 × 109/l), v diferenciálním rozpočtu neutrofilie (80 % neutrofilních granulocytů) a lymfopenie (15 % lymfocytů), hemoglobin 127 g/l, mikrocytóza a hypochromie erytrocytů, trombocyty 252 000, sedimentace erytrocytů 26/48, v biochemických odběrech bylo natrium 134 mmol/l, kalium 7,86 mmol/l, chloridy 104 mmol/l, Ca 1,7 mmol/l, P 1,97 mmol/l, urea 68,7 mmol/l, kreatinin 484 μmol/l, sérová amyláza 8,0 μkat/l, glykemie 7,91 mmol/l, osmolarita 351 mOsm/kg, C-reaktivní protein 60,9 mg/l, kyselina močová 317 μmol/l, albumin 37 g/l, jaterní testy v normě (tab. 1). Při vyšetření acidobazické rovnováhy z arteriální krve dominovala metabolická acidóza (pH 7,122, pCO2 1,88 kPa, bikarbonát 4,6 mmol/l, base excess –22,3 mmol/l). Moč byla chemicky negativní, v sedimentu se vyskytly 1–3 erytrocyty/zorné pole a 10–12 leukocytů. Spontánní moč byla kultivačně negativní.
Table 1. Laboratorní výsledky. 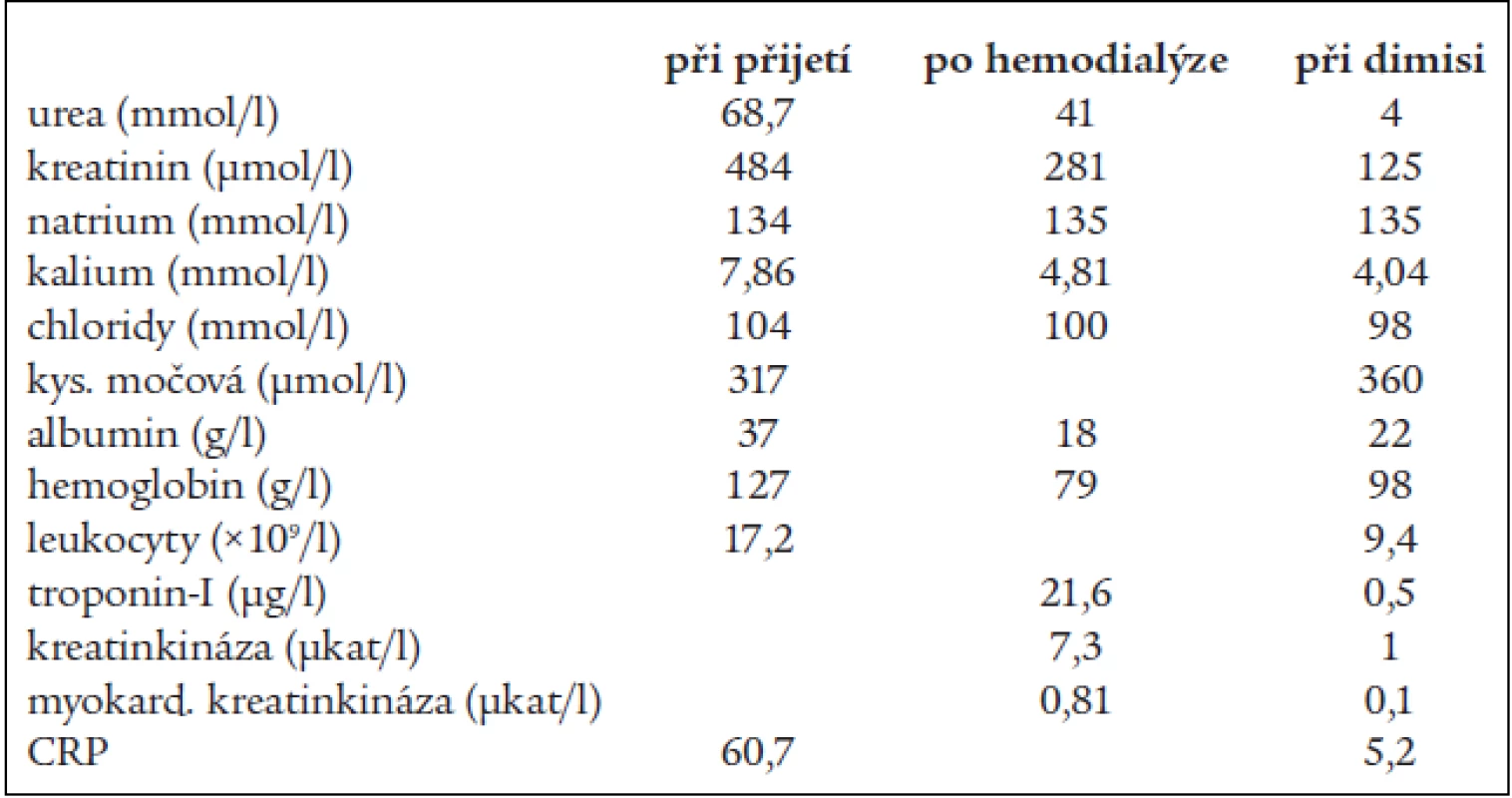
Ve stěru z defektů dolních končetin byl vykultivován Proteus mirabilis, Klebsiella oxytoca, Staphylococcus aureus, hemokultura byla opakovaně negativní.
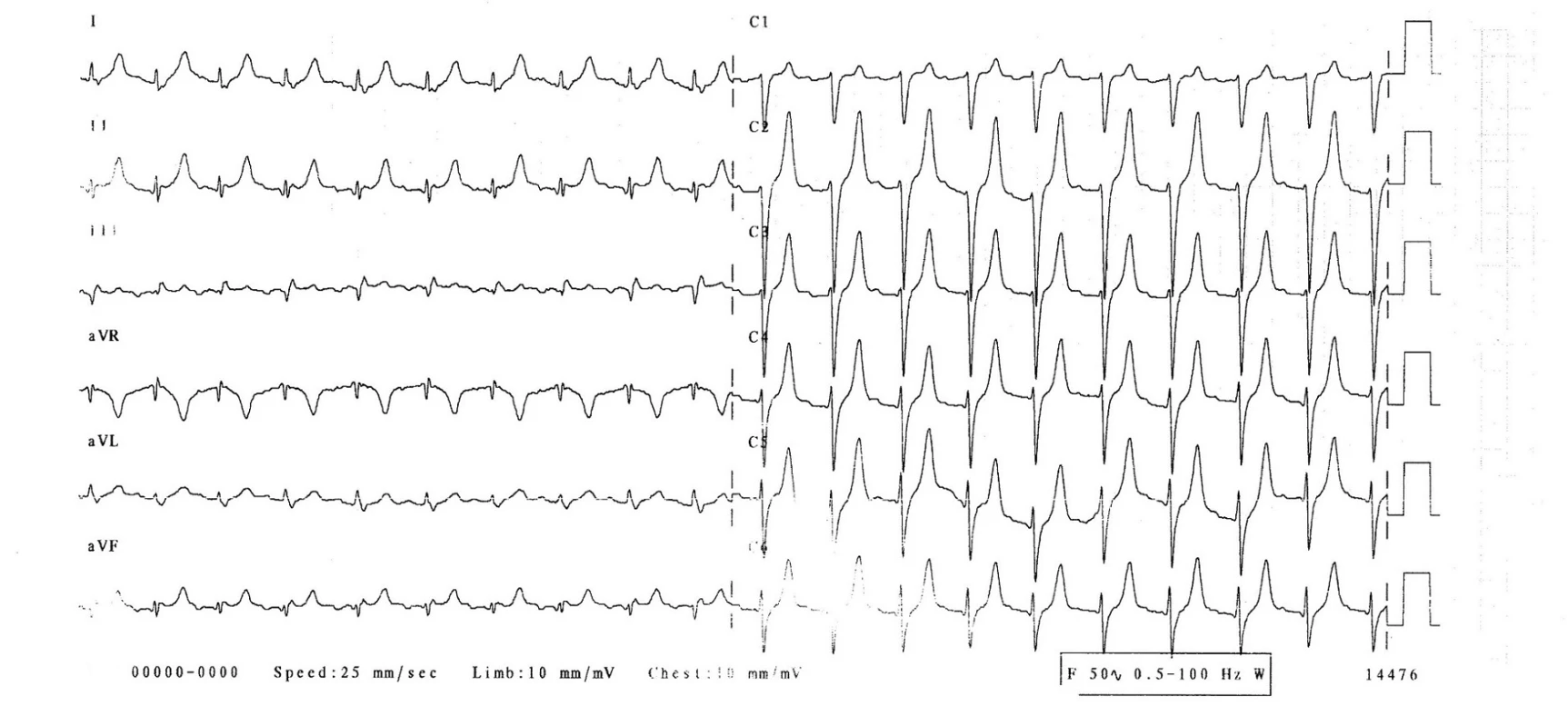
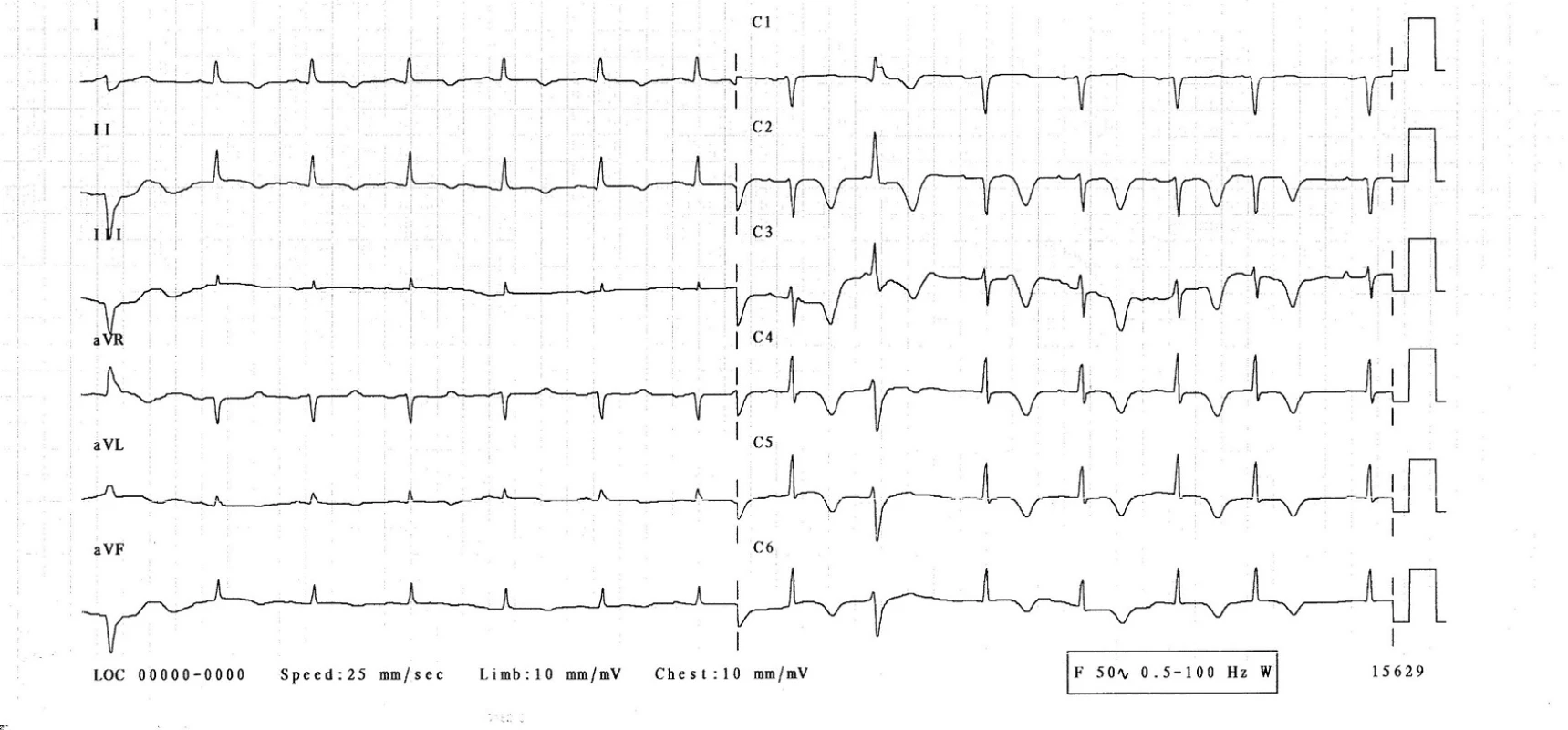
Na EKG (obr. 1) byl sinusový rytmus, srdeční frekvence 120/min, pravidelná, převodní intervaly v normě, známky časné repolarizace, vysoké hrotnaté vlny T. Rentgen hrudníku prokázal zhrubělou cévní kresbu a doleva lehce rozšířené srdce. Sonografista popsal normální sonografii epigastria a ledvin mimo drobné parapelvické cysty.
Léčbu jsme zahájili provedením jedné hemodialýzy, která proběhla bez komplikací. Po hemodialýze byl naměřen centrální žilní tlak +7 cm vodního sloupce, krevní tlak 100/60 mm Hg, laboratorně došlo k poklesu urey na 41 mmol/l, kreatininu na 281 μmol/l, kalia na 4,81 mmol/l, osmolarity na 311 mOsm/kg, k normalizaci acidobazické rovnováhy. Byla zjištěna výrazná hypoalbuminemie 18 g/l a anémie s hemoglobinem 79 g/l, leukocyty poklesly na 10×109/l (tab. 1).
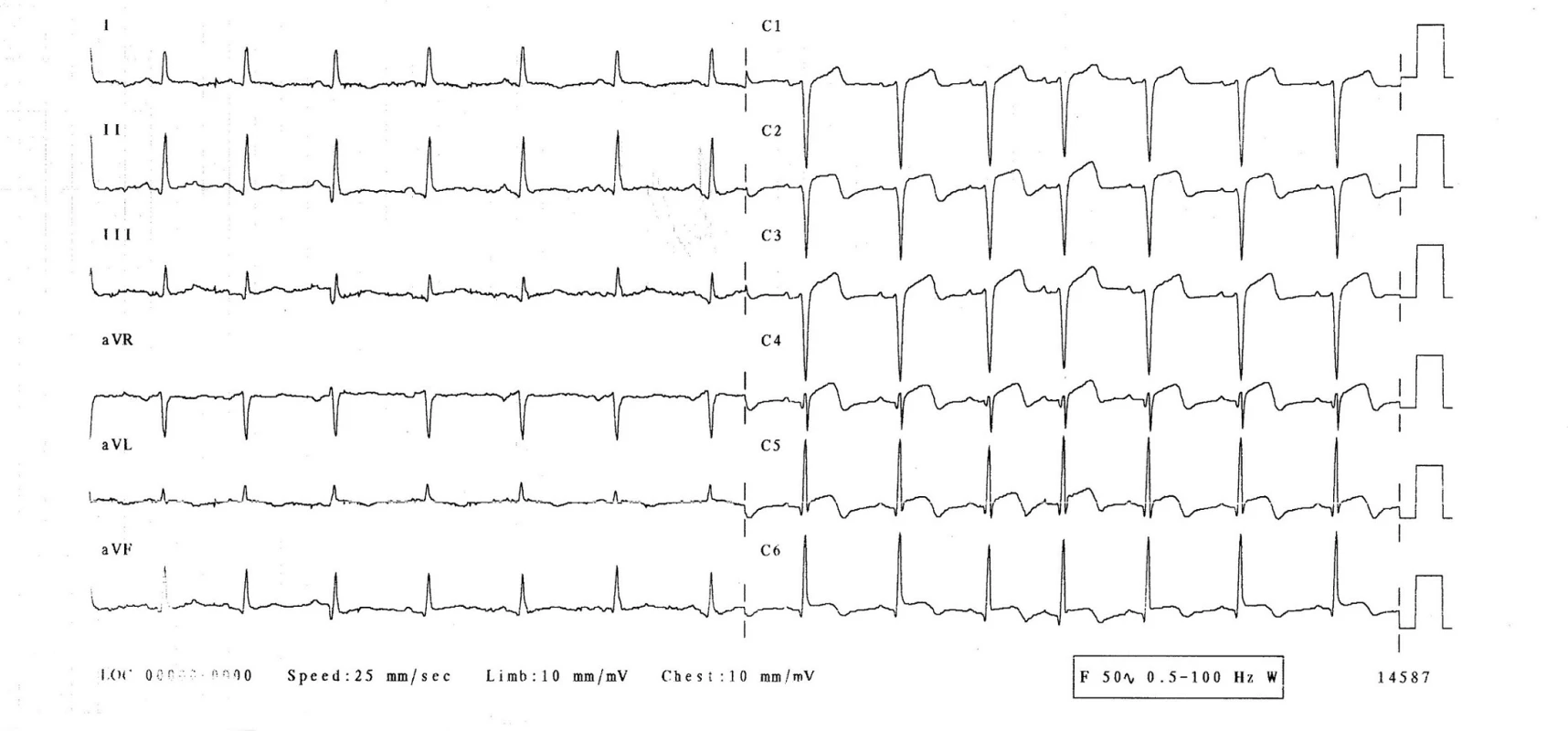
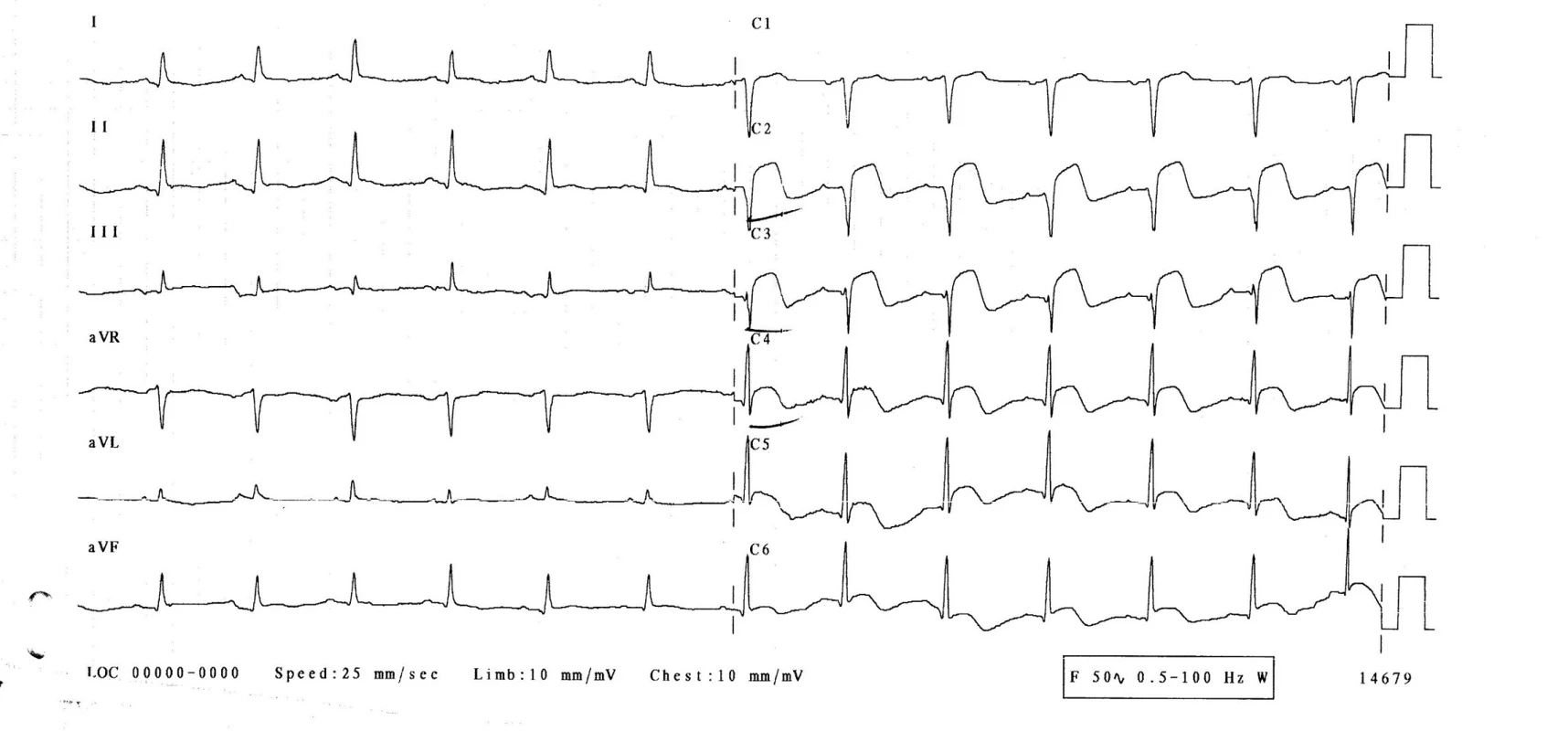
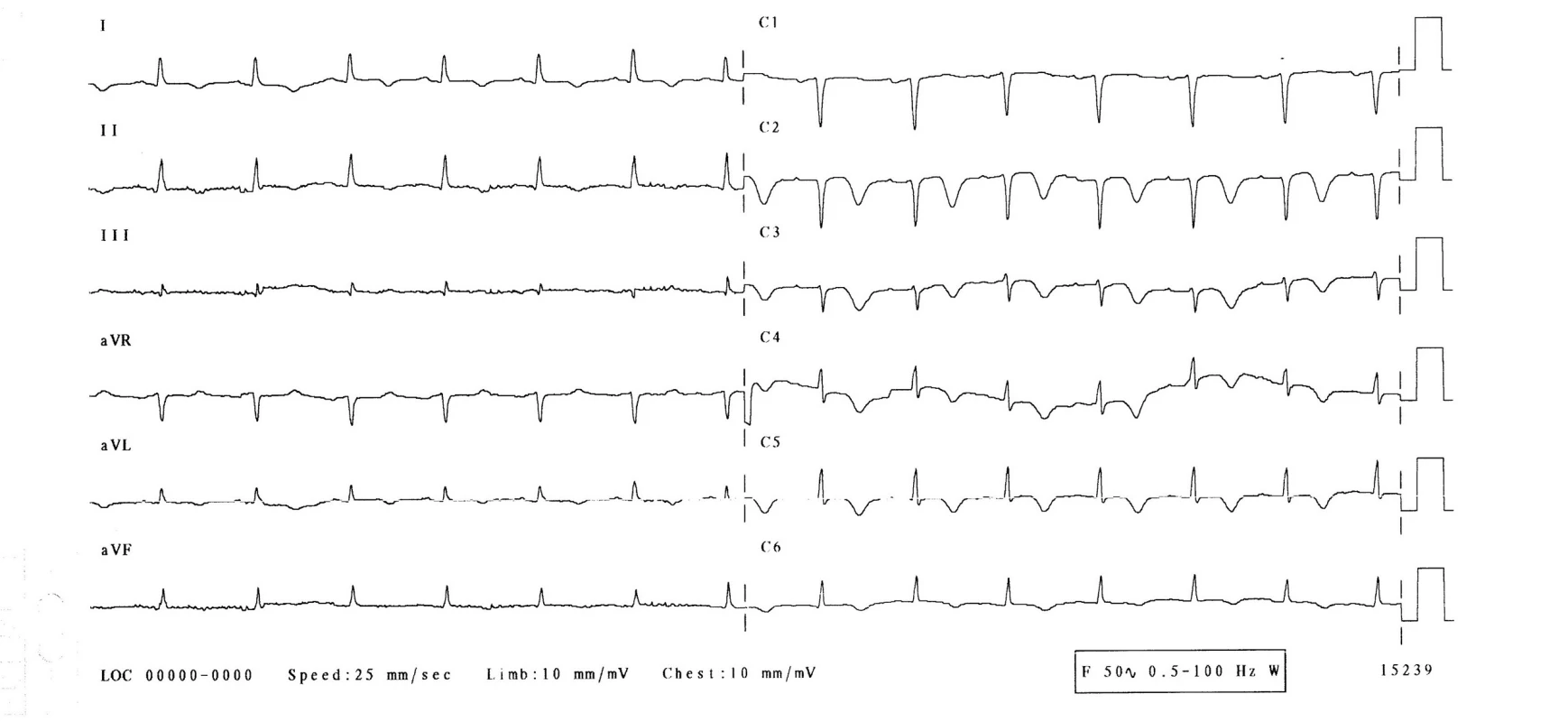
3. den hospitalizace byla pacientka bez obtíží, bez bolestí na hrudi, bez dušnosti. Normotenzní, subfebrilní (teplota 37,2 °C), s tepovou frekvencí 94/min, dechovou frekvencí 20/min, saturací O2 96 %. Při kontrolním EKG-vyšetření se rozvinuly elevace ST-úseku ve svodech V1–6, bez kontralaterálních depresí ST úseku (obr. 2), laboratorně došlo k výraznému zvýšení troponinu-I na 21,6 μg/l, kreatinkinázy 7,30 μkat/l a myokardiálního izoenzymu kreatinkinázy 0,87 μkatl/l. Při echokardiografii byla zjištěna středně snížená ejekční frakce levé komory 40 %, dyskineza septoapikálně, mírná mitrální a trikuspidální regurgitace, perikardiální výpotek nebyl prokázán. Nález byl kardiologem hodnocen jako subakutní infarkt myokardu v oblasti distálního ramus interventricularis anterior. Nebyla indikována urgentní koronarografie. Kardiolog doporučil koronarografii s odstupem (termín určen na 9. den hospitalizace), pacientka byla léčena konzervativně (nízkomolekulární heparin v antikoagulační dávce, antiagregancia). Na EKG 4.–6. den přetrvávaly elevace ST na přední a boční stěně, došlo k rozvoji negativních vln T a kmitu Q ve svodech V1–3 (obr. 3). 22. den přetrvával kmit Q pouze ve svodu V1, V2 a obraz rS ve svodu V3, negativní vlna T ve svodech V2–6 (obr. 4, 5).
Kontrolní echokardiografie 14. den hospitalizace popisovala normální ejekční frakci levé komory, s minimální poruchou kinetiky v oblasti hrotu, průměr levé komory 42 mm, tloušťka myokardu 11 mm v oblasti septa, průměr levé síně 51 mm, pravé komory 30 mm. Kontrolní kardiospecifické enzymy byly již negativní. Koronarografie byla provedena až 20. den hospitalizace se závěrem: normální koronarogram. Kardiolog přehodnotil diagnózu se závěrem akutní myokarditida. EMB pacientka odmítla, ASL-0 a sérologie kardiotropních agens (respirační viry, enteroviry, coxackie viry, viry hepatitid, herpetické viry, HIV, chlamydie, mykoplazma, borrelie, leptospiróza) byla negativní. Protilátky proti myokardu nebyly vyšetřeny.
Pacientka byla dále po celou dobu hospitalizace bez výraznějších obtíží, kardiopulmonálně stabilizovaná (normotenzní, tepová frekvence 80/min, dechová frekvence 18/min, saturace O2 95 %), afebrilní. Pro pozitivní kultivační nález z moči (Proteus mirabilis) bylo nasazeno antibiotikum dle citlivosti.
V době propuštění byl již normální iontogram a acidobazické parametry, orálním glukózovým tolerančním testem byla diagnostikována porušená glukózová tolerance. Přetrvávaly známky renální insuficience mírného až středního stupně (kreatinin 120–130 μml/l, cystatin C 2,6 mg/l, glomerulární filtrace 0,82 ml/sec.) (tab. 1). Opakovaně zjištěná výrazná hypoalbuminemie byla hodnocena jako ztrátová při trofických změnách na dolních končetinách. Mikrocytární hypochromní hyposideremická anémie si vyžádala převod 2 jednotek erytrocytární masy a suplementaci železem. Ztráty erytrocytů do gastrointestinálního traktu jsme neprokázali. Při gynekologickém vyšetření bylo vyjádřeno podezření na tumor malé pánve, proto jsme indikovali CT-vyšetření břicha a malé pánve, které prokázalo myomatózní uterus a incidentalom pravé nadledviny 40×30 mm. Hormonální sekreci incidentalomu jsme neprokázali. Etiologie anémie byla uzavřena jako kombinovaná, jednalo se pravděpodobně o anémii chronických chorob s možnými ztrátami při myomatózním uteru, podíl chronické renální insuficience byl méně pravděpodobný.
Pacientku jsme propustili kardiopulmonálně, metabolicky i renálně kompenzovanou s terapií nízkou dávkou betablokátoru, ACE-inhibitorem, allopurinolem, kyselinou acetylsalicylovou, substituční terapií kalciem, α-D3-vitaminem a železem. Byla doporučena další dispenzarizace nefrologem, kardiologem, endokrinologem, gynekologem a dermatologem.
Diskuse
Myokarditidy se mohou projevovat širokou škálou klinických projevů včetně tzv. pseudoinfarktových změn [9,10,15,19]. V literatuře jsou popsány případy chybně diagnostikovaných myokarditid s typickými obrazy akutního transmurálního infarktu myokardu léčené intravenózní trombolýzou [9]. I v případě naší pacientky byl nález zpočátku hodnocen jako subakutní transmurální infarkt v povodí distálního ramus interventricularis anterior, a až negativní koronarogram ischemickou etiologii vyloučil. Diagnóza myokarditidy byla stanovena per exclusionem po vyloučení ischemické etiologie kardiálního poškození a na základě průběhu onemocnění („chřipkovité příznaky“, obraz kardiální subkompenzace, absence stenokardií, odeznění nemoci bez následků). Sérologie kardiospecifických agens etiologického původce neprokázala, ovšem tyto výsledky jsou pouze nespecifické [11,21].
Diferenciálně diagnosticky jsme zvažovali i koronární vazospazmus, který je ovšem ve světle symptomů a vyšetření málo pravděpodobný, zpětně samozřejmě již neprokazatelný. Pomýšleli jsme též na perikarditidu (vzhledem k iniciálnímu EKG-nálezu elevací úseku ST a vývoji negativních vln T), proti této diagnóze však svědčily klinické symptomy, absence perikardiálního třecího šelestu či perikardiálního výpotku. Bylo možné též uvažovat o uremickém postižení srdce, do jehož obrazu jistě lze zařadit perikarditidu, ovšem v literatuře se nepopisuje klinicky relevantní izolované postižení myokardu při uremii, pouze mikroskopické a funkční změny na úrovni myocytů [12,20].
Diferenciálně diagnosticky lze zvažovat minerálovou dysbalanci (vstupní hypokalcemie, ev. minerálové důsledky chronického podávání kličkového diuretika) jako spolupůsobící noxy na kardiálním postižení [16].
Etiologie renálního selhání nebyla úplně jasná. Pravděpodobně se jednalo o prerenální selhání ledvin s hypoperfuzí na podkladě kombinace masivní diuretické terapie podávané před hospitalizací a nízkého srdečního výdeje při myokarditidě. Po hemodialýze a rehydrataci došlo rychle k úpravě metabolických změn v souvislosti s renálním selháním, k návratu renální funkce k původním hodnotám a k výraznému snížení vstupně „normálních“ hodnot hemoglobinu a albuminu (což svědčilo pro extrémní kontrakci intravaskulárního objemu). Teoreticky bylo možné zvažovat jako primární příčinu stafylokokovou toxinózu (přítomnost Staphylococcus aureus ve stěru z defektů dolních končetin), která mohla postihnout myokard a ledviny. Tato etiologie se však jevila jako krajně nepravděpodobná, vzhledem k odlišnému klinickému a laboratornímu obrazu toxického šokového syndromu [6].
Na přítomné mikrocytární hypochromní anémii se podílela jistě renální insuficience a chronické ztráty při myomatózním uteru. Těžká hypalbuminemie byla pravděpodobně způsobena exsudací albuminu při rozsáhlých defektech dolních končetin, pravděpodobně kombinované s nutriční etiologií. Incidentalom nadledviny nebyl dle provedených vyšetření hormonálně aktivní, bylo doporučeno další pravidelné sledování endokrinologem.
Závěr
Uvedená kazuistika popisuje neobvyklý případ akutní myokarditidy manifestované pseudoinfarktovými EKG-změnami v kombinaci s prerenálním selháním ledvin v terénu chronické renální insuficience. I přesto, že diagnóza myokarditidy byla provedena per exclusionem, domníváme se, že se jedná o zajímavý a poučný nález ukazující na možnou variabilitu klinického obrazu akutní myokarditidy, který lze v praxi snadno mylně interpretovat, a tak vést další léčbu pacienta chybně.
MUDr. Ludmila Brunerová
www.fnkv.cz
e-mail: brunerova@seznam.cz
Doručeno do redakce: 1. 10. 2003
Přijato po recenzi: 9. 3. 2004
Sources
1. Abu Arafeh I, Gray E, Youngson G et al. Myocarditis and haemolytic uremic syndrome. Arch Dis Child 1995; 72 : 46–47.
2. Albaqali A, Ghuloom A, Al Arrayed A et al. Hemolytic uremic syndrome in association with typhoid fever. Am J Kidney Dis 2003; 41 : 709–713.
3. Aschermann M. Myokarditidy. In: Klener P et al. Vnitřní lékařství. 2. vyd. Praha: Galén 2001 : 197–199.
4. Chapman N, MacLennan WJ, Rahilly Met al. Toxoplasma gondii – an unusual cause of myocarditis in old age. Postgrad Med 1995; 7 (71): 168–169.
5. Druml W, Kelly RA, England BK et al. Effects of acute and chronic uremia on active cation transport in rat myocardium. Kidney Int 1990; 38 : 1061–1067.
6. Hájek V, Součková A. Koaguláza pozitivní stafylokoky. In: Bednář M, Fraňková V, Schindler J et al (eds). Lékařská mikrobiologie. Praha: Marvil 1996 : 194–202.
7. Karjalainen J, Heikkila J. Incidence of three presentations of acute myocarditis in young men in military servise. A 20 year experience. Eur Heart J 1999; 20 : 1120–1125.
8. Mason JW, O’onnel JB, Herskowitz A. A Clinical Trial of Immunosuppressive therapy for Myocarditis. N Eng J Med 1995; 333 : 269–275.
9. Millaire A, de Groote P, Decoulx F et al. Outcome after trombolytic therapy of nine cases of myopericarditis misdiagnosed as myocardial infarction. Eur Heart J 1995; 16 : 333–338.
10. Morishita M, Oda A, Okayama A et al. Acute myocarditis with localized left ventricular aneurysma: a report of three cases. J Cardiol 1988; 18 : 553–564.
11. Müllerová J, Novák M, Vítovec J. Myokarditidy. Kardiol Rev 2003; 2 : 56–59.
12. Periyasamy SM, Chen J, Cooney D et al. Effects of uremic serum on isolated cardiomyocyte calcium cycling and contractile function. Kidney Int 2001; 60 : 2367–2376.
13. Ramachandran S, Perera MV. Cardiac and pulmonary involvement in leptospirosis. Trans Soc Trop Med Hyg 1977; 71 : 56–59.
14. Ray CG, Portman JN. Hemolytic uremic syndrome and myocarditis, association with Coxackie B infectin. Am J Dis Child 1971; 122 : 418–420.
15. Saffitz JE, Schwartz DJ. Coxackie viral myocarditis causing transmural right and left ventricular infarction without coronary narrowing. Am J Cardiol 1983; 152 : 644, 646–647.
16. Schwinger RH, Erdmann E. Heart failure and electrolytic disturbances. Methods Find Exp Clin Pharmacol 1992; 14 : 315–325.
17. Senzaki H, Suda M, Noma S et al. Acute heart failure and acute myocardial failure in Kawasaki disease. Acta Ped Jpn 1994; 34 : 443–447.
18. Stomowski C, Homchen H. Malignant diphteria with early myocarditis and acute renal failure. Klin Pedatr 1981; 193 : 404–407.
19. Suliman K, Flatau E, Shimoni Z et al. Rheumatic carditis presenting as acute myocardial infarction. Isr J Med Sci 1985; 21 : 445–450.
20. Szram S, Bartel H. Ultrastructural changes in the myocardium due to acute uremic syndrome. Exp Pathol (Jena) 1976; 12 : 290–294.
21. Tang WHW, Young JB. Myocarditis. EMedicine Journal (www.emedicine.com) October 8, 2002.
22. Wakafuji S, Okada R. Twenty year autopsy statistics of myocarditis incidence in Japan. Jpn Circ J 1986; 50 : 1288–1293.
23. Wojnicz R, Nowalany-Kozielska E, Wodniecki J et al. Immunohistological diagnosis of myocarditis. Potential role of sarcolemmal induction of the MHC and ICAM-1 in the detection of autoimmune mediated myocyte injury. Eur Heart J 1998; 19 : 1564–1572.
24. Wu LA, Lapeyre AC, Cooper LT. Current role of endomyocardial biopsy in the management of dilated cardiomypopathy and myocarditis. Mayo Clinic Proc 2001; 76 : 1030–1038.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 1-
All articles in this issue
- Odkaz sira Williama Oslera
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
- Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu
- Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční
- Úvod do problematiky metabolického syndromu
- Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
- Diabetes mellitus a metabolický syndrom
- Hypertenze jako součást metabolického syndromu
- Obezita a metabolický syndrom
- Dyslipidemie u metabolického syndromu
- Hypertenze a hyperurikemie
- Role pohybové léčby a tělesné zdatnosti v prevenci a léčbě metabolického syndromu
- Akutní infarkt myokardu u pacienta s anamnézou infekční endokarditidy
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Hypertenze a hyperurikemie
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career