-
Medical journals
- Career
Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
: J. Čermák 1; A. Vítek 1; K. Michalová 1; J. Březinová 1; Z. Zemanová 2
: Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc. 1; Centrum nádorové cytogenetiky Ústavu klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha, ředitel prof. MUDr. Tomáš Zima, DrSc. 2
: Vnitř Lék 2005; 51(1): 20-30
: Original Contributions
Cíl práce a metodika:
V retrospektivní analýze 197 nemocných s primárním myelodysplastickým syndromem (MDS) byl zkoumán vztah mezi zařazením nemocných dle FAB či WHO klasifikace a do rizikových podskupin dle Mezinárodního prognostického skórovacího systému (IPSS) a délkou přežití. Krom toho byl srovnáván vliv transplantace krvetvorných buněk (SCT) a podpůrné léčby na délku přežití v jednotlivých podskupinách.Výsledky:
Rozdělení 107 nemocných s refrakterní anémií podle WHO klasifikace prokázalo statisticky významný rozdíl v délce přežití mezi nemocnými s „čistou“ RA a RCMD (78,2 měsíce vs 42,3 měsíce, P = 0,001), pro klasifikaci a prognózu nemocných s delecí dlouhého raménka 5. chromozomu (5q-) měly zásadní význam metody molekulární cytogenetiky (fluorescenční in situ hybridizace – FISH), jež umožnily odlišit nemocné s přídatnými změnami karyotypu a nepříznivou prognózou na rozdíl od nemocných s izolovanou delecí 5q. U nemocných s pokročilými stadii choroby (RAEB, RAEB-T) nepředstavovala samotná chemoterapie statisticky významný přínos pro délku přežití oproti podpůrné léčbě, na druhé straně SCT významně zvýšila délku přežití oproti netransplantovaným nemocným jak u nemocných s RAEB a RAEB-T (38,4 měsíce vs 11,5 měsíce, P < 0,001), tak u nemocných se středním II. a vysokým rizikem dle IPSS (36,8 měsíce vs 12,0 měsíce, P < 0,001). Na druhé straně, SCT významně neovlivnila délku přežití ani u nemocných s RA (62,3 měsíce vs 62,4 měsíce, P > 0,8) ani u nemocných s nízkým a středním I. rizikem (57,2 měsíce vs 60,8 měsíce, P = 0,8), nejspíše díky vysoké incidenci mortality spojené s transplantací. Statisticky významný rozdíl v délce přežití mezi transplantovanými a netransplantovanými nemocnými nebyl přítomen ani při rozdělení nemocných s RA na čistou RA a RCMD dle WHO klasifikace. Teprve podrobnější klasifikace na bázi kombinace WHO klasifikace a cytogenetických rizikových skupin dle IPSS odhalila nemocné s RCMD a „nepříznivým“ karyotypem, kteří bez SCT přežívali pouze 9,2 měsíce na rozdíl od transplantovaných nemocných, u nichž činila průměrná délka přežití 81,8 měsíce. Přítomnost nepříznivých změn karyotypu byla při regresní analýze nejdůležitějším nezávislým parametrem ovlivňujícím délku přežití a riziko leukemické transformace u nemocných s RA.Závěr:
Užití metod molekulární cytogenetiky v kombinaci s klasickou morfologií může dále zpřesnit identifikaci rizikových nemocných s RA, indikovaných k časné SCT i přes relativně vysoké riziko komplikací spojených s transplantací.Klíčová slova:
myelodysplastický syndrom – klasifikace – prognóza – léčba – transplantace – karyotypÚvod
Myelodysplastický syndrom (MDS) je definován jako klonální porucha krvetvorby. Mutace kmenové krvetvorné buňky vede ke vzniku patologického klonu s růstovou výhodou, jenž může postupem doby zcela nahradit normální krvetvorbu. V časné fázi onemocnění bývá většinou přítomen různý stupeň cytopenie v periferní krvi při současném nálezu buněčně bohaté kostní dřeně s morfologickými známkami dysplazie [5,13]. Tento obraz vzniká v důsledku vystupňovaní procesu apoptózy - buněčné smrti krvetvorných buněk následkem zvýšené sekrece některých cytokinů [13]. Pro pokročilou fázi MDS je naopak charakteristický progresivní nárůst nezralých buněk s velmi nízkým stupněm apoptózy, vedoucí k obrazu nadbytku blastů v kostní dřeni a v periferní krvi. Tato fáze onemocnění je již spojena s vysokou pravděpodobností přechodu choroby do akutní leukémie (AL) [5].
Základní klasifikační schéma nemocných s MDS, tzv. FAB (francouzsko-americko-britská) klasifikace z roku 1982 [2] rozděluje nemocné dle nálezu v kostní dřeni a periferní krvi do 5 podskupin (tab. 1). Toto dělení umožňuje základní odlišení nemocných s obecně lepší prognózou a nižším rizikem leukemické transformace v podskupinách refrakterní anémie (RA) a refrakterní anémie se zmnožením prsténčitých sideroblastů (RARS) od nemocných s nepříznivou prognózou a vysokým rizikem přechodu do AL (refrakterní anémie s nadbytkem blastů - RAEB a refrakterní anémie s nadbytkem blastů v transformaci - RAEB-T). Nicméně jednotlivé podtypy FAB klasifikace tvoří poměrně heterogenní skupiny nemocných, u nichž nejsou zohledněny další významné prognostické faktory. V roce 1997 byl na základě podrobné analýzy řady rizikových faktorů u nemocných s MDS publikován tzv. Mezinárodní prognostický skórovací systém (IPSS) [9], jenž dělí nemocné s MDS na základě procenta blastů v kostní dřeni, přítomnosti a charakteru změn karyotypu a počtu cytopenií v periferní krvi do 4 podskupin s odlišnou pravděpodobností délky přežití a přechodu do AL (tab. 2). Nová klasifikace nádorových onemocnění krvetvorby vypracovaná Světovou zdravotnickou organizací (WHO) a zveřejněná v roce 1999 [10] vyděluje z klasifikace MDS jednak nemocné s chronickou myelomonocytární leukémií (CMML), jež jsou řazeni do skupiny smíšených myelodysplasticko-myeloproliferativních onemocnění, jednak nemocné s více než 20 % blastů v kostní dřeni, kteří jsou zařazeni do skupiny akutních myeloidních leukémií (AML) s dysplazií ve více řadách. Skupinu refrakterních anémií tato tzv. WHO klasifikace dělí s přihlédnutím k některým prognostickým faktorům na tzv. „čistou“ RA a RARS s výhradním postižením erytropoézy, refrakterní cytopenii s dysplazií ve více řadách (RCMD), ze které je někdy ještě vyčleňován RCMD s přítomností prsténčitých sideroblastů (RCMD-RS) a tzv. 5q - syndrom s charakteristickou chromozomální přestavbou a morfologickým nálezem [17], jako nová podskupina byl zařazen tzv. neklasifikovatelný MDS (tab. 3).
1. FAB klasifikace nemocných s MDS. 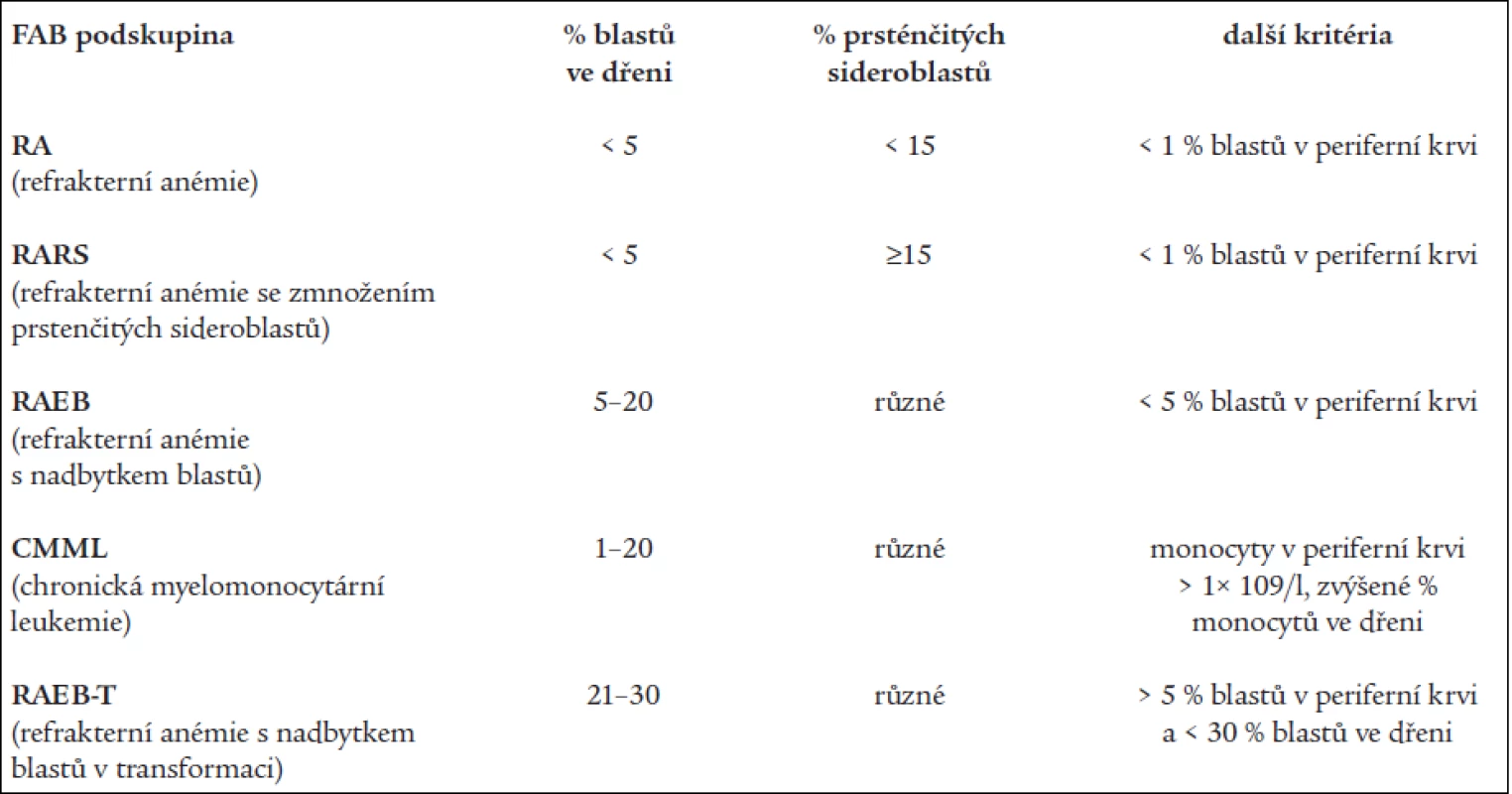
(Dle Bennett JM et al. Br J Haematol 1982; 51: 189–199) 2. Mezinárodní prognostický skórovací systém (IPSS) pro nemocné s MDS. 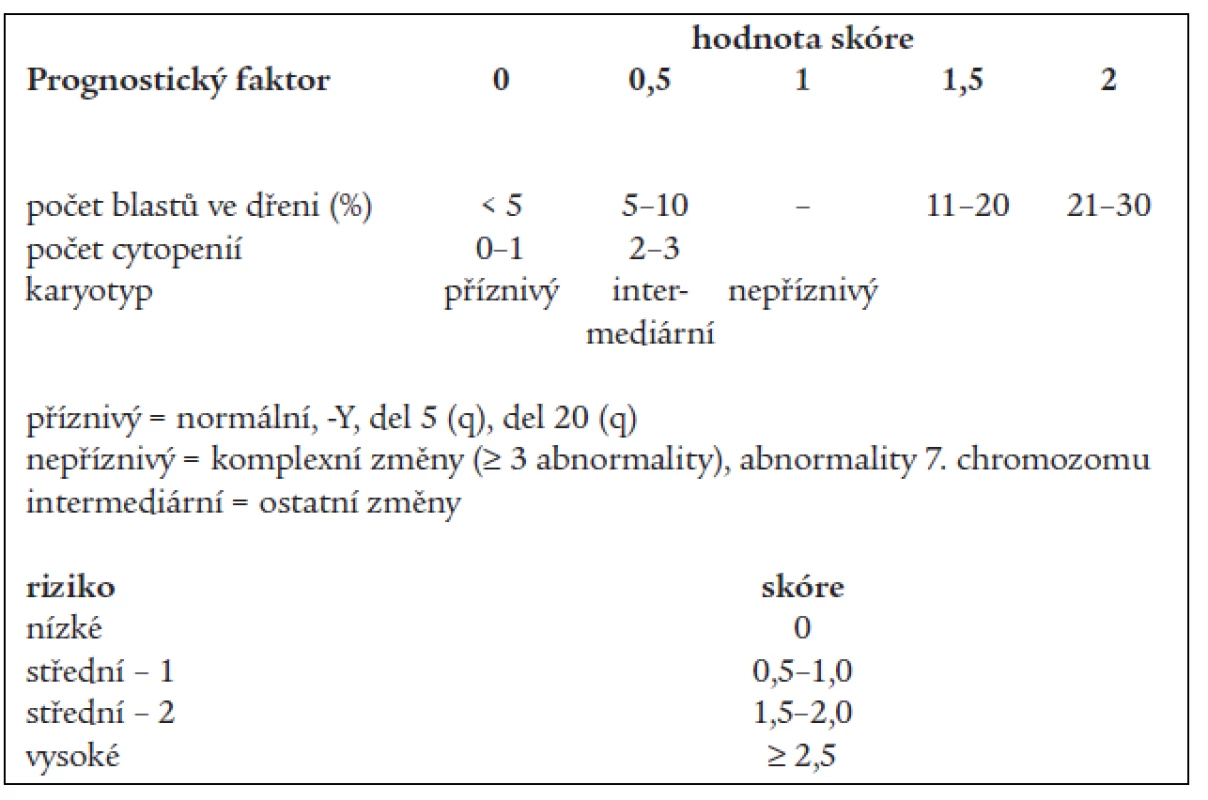
(Dle Greenberg P et al. Blood 1997; 89: 2079–2088) 3. WHO klasifikace myelodysplastického syndromu. 
(Dle Harris NL et al. J Clin Oncol 1999; 17: 3835–3849) Léčba nemocných s MDS se řídí stádiem choroby, prognostickými faktory a věkem nemocných. Konzervativní přístup, zahrnující podpůrnou léčbu (transfuze erytrocytů a krevních destiček, vitaminy, chelatační přípravky) a podávání léků ovlivňujících zejména stupeň buněčné apoptózy (kortikoidy, růstové faktory, imunosupresiva), převládá obecně u nemocných s časnými stadii a nízkým či středním I. rizikem a u starších nemocných [5,15]. Nemocní s nadbytkem blastů a středním II. či vysokým rizikem jsou pak indikování k podávání chemoterapie a k transplantaci krvetvorných buněk, jež dnes představuje jediný kurativní přístup k nemocným s MDS. U mladších nemocných s časnějšími a prognosticky relativně méně závažnými stadii onemocnění může vést transplantace krvetvorných buněk k jejich vyléčení, nicméně představuje stále riskantní výkon spojený s poměrné vysokým stupněm peritransplantační mortality [1,6,16]. Na druhé straně se ukazuje, že při konzervativní léčbě tito nemocní přežívají i bez transplantace v průměru 5-12 let [9]. Je proto třeba na základě analýzy přežití a prognostických faktorů vyčlenit z této skupiny ty nemocné, u kterých představuje transplantace krvetvorných buněk jednoznačný přínos i přes výše zmíněná rizika, a určit též optimální dobu transplantace u těchto nemocných.
V naší studii jsme provedli retrospektivní analýzu nemocných s primárním MDS sledovaných v Ústavu hematologie a krevní transfuze (ÚHKT) v Praze v letech 1980-2000. Byl zkoumán vztah mezi zařazením nemocných dle FAB či WHO klasifikace, délkou přežití a pravděpodobností leukemické transformace, dále byl hodnocen přínos chemoterapie v porovnání s pouhou podpůrnou léčbou u nemocných s pokročilými stadii choroby a srovnáván vliv transplantace krvetvorných buněk a konzervativní léčby na délku přežití nemocných v jednotlivých podskupinách dle FAB či WHO klasifikace a v rizikových skupinách dle IPSS.
Soubor nemocných a metodika
Ve studii bylo hodnoceno 197 nemocných s primárním MDS. Na základě vyšetření periferního krevního obrazu a nálezu v aspirátu a trepanobioptickém vzorku kostní dřeně byli nemocní zařazeni do jednotlivých podskupin dle FAB klasifikace. Při klasifikaci nemocných byla hodnocena vždy nejméně 3 vyšetření krevního obrazu a 2 aspiráty kostní dřeně provedené během 2 měsíců v době diagnózy onemocnění. Jako pomocná metoda pro klasifikaci sloužilo cytochemické vyšetření nátěrů z aspirátu kostní dřeně barvením berlínskou modří na přítomnost železa a vyšetření vzorku kostní dřeně pomocí průtokové cytometrie. Pro klasifikaci nemocných dle WHO klasifikace a IPSS bylo užito výsledků vyšetření karyotypu pomocí standardních metodik čítajících krátkodobou kultivaci krvetvorných buněk z aspirátu kostní dřeně a následné barvení technikou G-pruhování dle Wrighta. K podrobnější analýze karyotypu u nemocných s delecí krátkého raménka chromozomu 5 (5q-) byly užity metody molekulární cytogenetiky - fluorescenční in situ hybridizace (FISH) se specifickou sondou LSI EGR1 (5q31) SpectrumOrange/D5S721, D5S23 (5p15.2) SpectrumGreen (VYSISTM, USA) a celochromozómovými malovacími sondami (CambioTM, Cambridge, Velká Británie) a mnohobarevná FISH (mFISH) s mnohobarevným pruhováním s vysokou rozlišovací schopností (mBAND) se sondami „24 X Cyte“ a „X Cyte 5“ (MetasystemsTM, Altlussheim, SRN).
Ke statistickému zhodnocení byl použit nepárový t-test s Bonferroniho korekcí pro malé soubory a Fisherův test, analýza parametrů ovlivňujících délku přežití byla provedena dle Kaplan-Meiera a pomocí log-rank2 testu a zahrnovala pohlaví, věk, počet cytopenií, hodnotu hemoglobinu (Hb), počet neutrofilů, počet trombocytů, karyotyp (dle IPSS) a přítomnost/nepřítomnost leukemické transformace. Nezávislé proměnné ovlivňující délku přežití a leukemickou transformaci byly studovány regresní analýzou o více proměnných pomocí modelu dle Coxe [3] s hodnocením stejných parametrů jako analýza dle Kaplan-Meiera [11].
Výsledky
Na základě rozboru nálezů v periferní krvi a kostní dřeni bylo 197 nemocných rozděleno následovně do jednotlivých podskupin dle FAB klasifikace: RA - 107 nemocných, RARS - 13 nemocných, RAEB – 33 nemocných, RAEB-T - 34 nemocných, CMML - 10 nemocných. 107 nemocných s RA a 13 nemocných s RARS pak bylo reklasifikováno dle WHO klasifikace následovně: RA - 43 nemocných, RCMD - 60 nemocných, RCMDs - 5 nemocných, 5q - syndrom - 4 nemocní, RARS - 8 nemocných. V tab. 4 je uvedena délka přežití (medián a rozmezí), procento leukemické transformace a pravděpodobnost 3letého přežití v jednotlivých podskupinách dle FAB či WHO klasifikace a dle IPSS. Statisticky významný rozdíl v délce přežití byl nalezen mezi nemocnými s RA a RAEB či RAEB-T (P < 0,001 pro obě skupiny). Obdobný rozdíl byl přítomen i v pravděpodobnosti přežití 3 roky mezi RA a RAEB či RAEB-T (P < 0,001) a RARS a RAEB či RAEB-T (P < 0,001). Při hodnocení nemocných podle WHO klasifikace byl zjištěn statisticky významný rozdíl v délce přežití mezi nemocnými s RA a RCMD (medián 78,2 vs 42,3 měsíce, P = 0,001), stejné rozdíly byly nalezeny i při hodnocení pravděpodobnosti přežití 3 roky. Delece dlouhého raménka 5. chromozomu (5q-) byla bez ohledu na morfologický nález přítomna na základě rutinního vyšetření karyotypu u 29 nemocných s RA dle FAB klasifikace. Pokud byli při hodnocení dle WHO klasifikace s přihlédnutím k cytogenetickému nálezu (tab. 5) bráni tito nemocní jako zvláštní skupina 5q-, byla jejich prognóza významně horší než u nemocných s 5q-syndromem či RA, medián přežití 5q - skupiny byl 36,2 měsíce ve srovnání s nemocnými s RA (85,2 měsíce, P = 0,0002) a RCMD (47,0 měsíce, P > 0,8). Analýza karyotypu pomocí FISH potvrdila deleci v úseku 5q31 jako solitární přestavbu karyotypu pouze u 12 nemocných, 4 nemocní měli deleci 5q31 spojenou s dalšími přestavbami v oblasti dlouhého raménka 5. chromozomu, 13 nemocných pak mělo přestavbu 5q - spojenu s dalšími změnami karyotypu mimo oblast 5q. Nemocní se solitární delecí 5q potvrzenou metodou FISH měli délku přežití srovnatelnou s nemocnými s RA dle WHO klasifikace (85,2 vs. 44,6 měsíce) na rozdíl od nemocných s přídatnými změnami karyotypu lokalizovanými do oblasti 5q (14,1 měsíce) či mimo tuto oblast (35,3 měsíce). Obdobné rozdíly byly přítomny i při hodnocení procenta leukemické transformace (tab. 5).
4. Délka přežití, procento leukemické transformace a pravděpodobnost přežití 3 roky v jednotlivých podskupinách dle FAB či WHO a dle IPSS. 
5. Klasifikace nemocných s refrakterní anémií (RA – dle FAB klasifikace) podle WHO klasifikace a podle kombinace morfologických kritérií dle WHO a cytogenetického nálezu s užitím metod molekulární cytogenetiky. 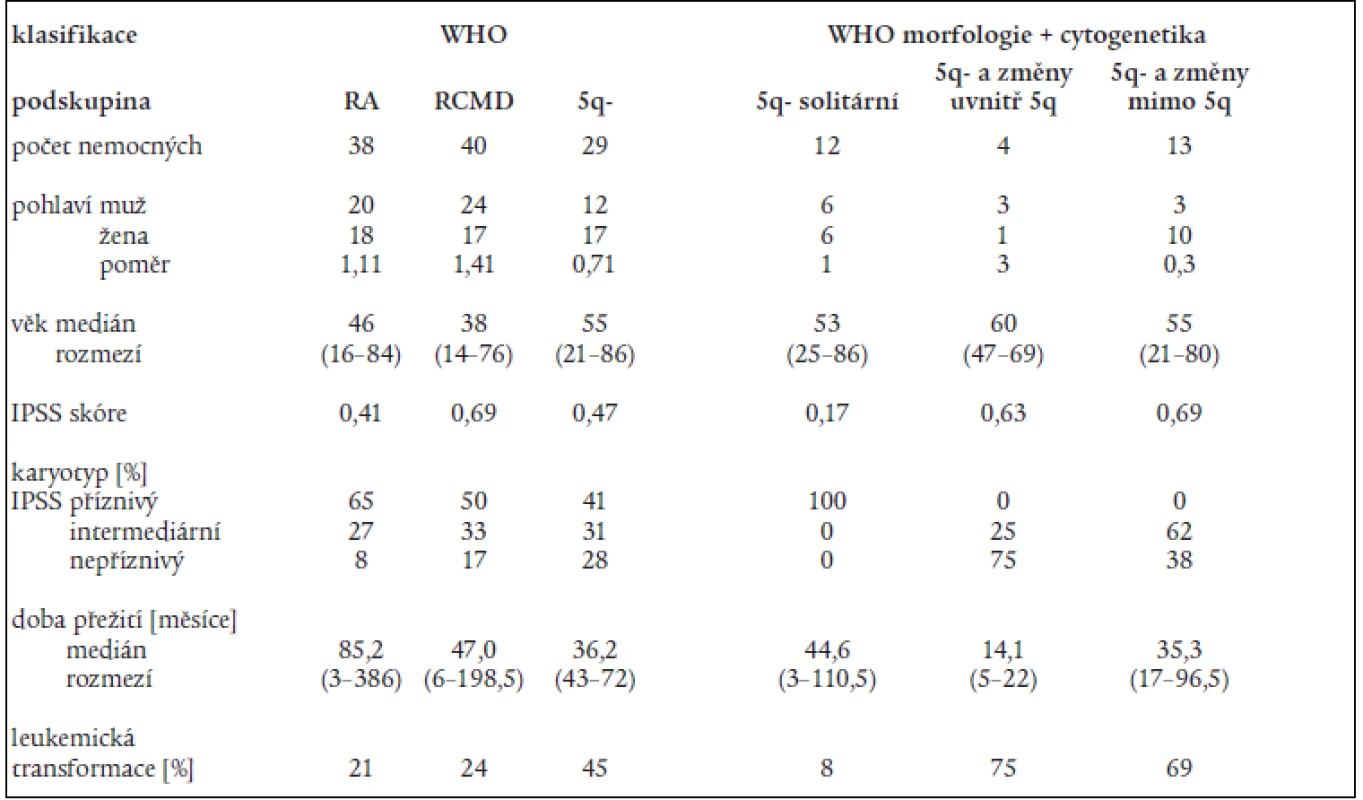
Analýza přežití nemocných v jednotlivých rizikových skupinách dle IPSS (tab. 4) ukázala statisticky významný rozdíl v délce přežití mezi nemocnými s nízkým a středním II. či vysokým rizikem (P < 0,001 pro obě skupiny) a mezi nemocnými se středním I. A středním II. či vysokým rizikem (P < 0,001 pro obě skupiny). Obdobně pravděpodobnost přežití 3 roky se významně lišila mezi nemocnými s nízkým či středním I. rizikem a nemocnými se středním II. či vysokým rizikem (P <0,001).
Kombinovanou chemoterapií (většinou kombinací antracyklinů se standardní či středně vysokou dávkou cytosin arabinosidu) bylo léčeno 12 nemocných s diagnózou RAEB. Medián délky přežití těchto nemocných činil v průměru 11,0 měsíce a statisticky významně se nelišil od přežití 11 nemocných léčených podpůrnou léčbou (8,8 měsíce; P = 0,8). Obě skupiny se nelišily statisticky významně věkem (medián 53,1 vs 65,4 měsíce, P = 0,8). Medián délky přežití 23 nemocných s RAEB-T léčených chemoterapií byla výrazně delší než u 4 nemocných léčených paliativně (13,7 měsíce vs 2,1 měsíce), rozdíl však nebyl statisticky významný (P = 0,2). Medián věku činil u nemocných léčených chemoterapií 52,1 měsíce (meze 19-71 let), u nemocných léčených paliativně 65,3 měsíce (meze 58-82 let).
Transplantace krvetvorných buněk (SCT) byla po standardním myeloablativním přípravném režimu provedena u 34 nemocných (16 nemocných s RA, 10 nemocných s RAEB, 7 nemocných s RAEB-T a 1 nemocný s CMML). U 18 nemocných byla provedena SCT od HLA shodného příbuzného dárce, u 11 nemocných šlo o HLA shodného nepříbuzného dárce z registru, 5 nemocných s RAEB či RAEB-T bylo transplantováno autologním štěpem odebraným v první kompletní remisi choroby. Při hodnocení efektu SCT byl nalezen statisticky významný rozdíl v délce přežití mezi transplantovanými a netransplantovanými nemocnými s RAEB a RAEB-T (38,4 měsíce vs 11,5 měsíce, P < 0,001), stejně tak jako u nemocných se středním II. a vysokým rizikem (36,8 měsíce vs 12,0 měsíce, P = 0,05), SCT rovněž významně zvýšila pravděpodobnost přežití 3 roky jak u nemocných s RAEB a RAEB-T (P < 0,001), tak u nemocných se středním II. a vysokým rizikem (P < 0,001) (tab. 6). Na druhé straně, u nemocných s RA SCT významně neovlivnila ani délku přežití (medián přežití činil 62,3 měsíce u transplantovaných vs 62,4 měsíce u netransplantovaných, P > 0,8), ani pravděpodobnost přežití 3 roky (63 % u transplantovaných vs 58 % u netransplantovaných). Stejně tak nebyl významný rozdíl v délce přežití a v pravděpodobnosti 3letého přežití mezi transplantovanými a netransplantovanými nemocnými s nízkými a středním I. rizikem (tab. 6). I přes nižší věk transplantovaných nemocných nebyly rozdíly ve věku ani v poměru muži/ženy statisticky významné v žádné z hodnocených skupin. Při podrobnějším rozboru transplantovaných nemocných nebyl přítomen rozdíl ani v peritransplantační mortalitě, ani v délce přežití mezi nemocnými transplantovanými od příbuzného či nepříbuzného dárce (66,2 vs 38,3 měsíce; P = 0,07), horší prognóza nemocných po autologní SCT byla dána vysokou incidencí relapsů po transplantaci.
6. Srovnání délky přežití a pravěpodobnosti přežití 3 roky u netransplantovaných (non-SCT) a transplantovaných (SCT) nemocných rozdělených do podskupin dle FAB klasifikace a rizikových skupin dle IPSS. 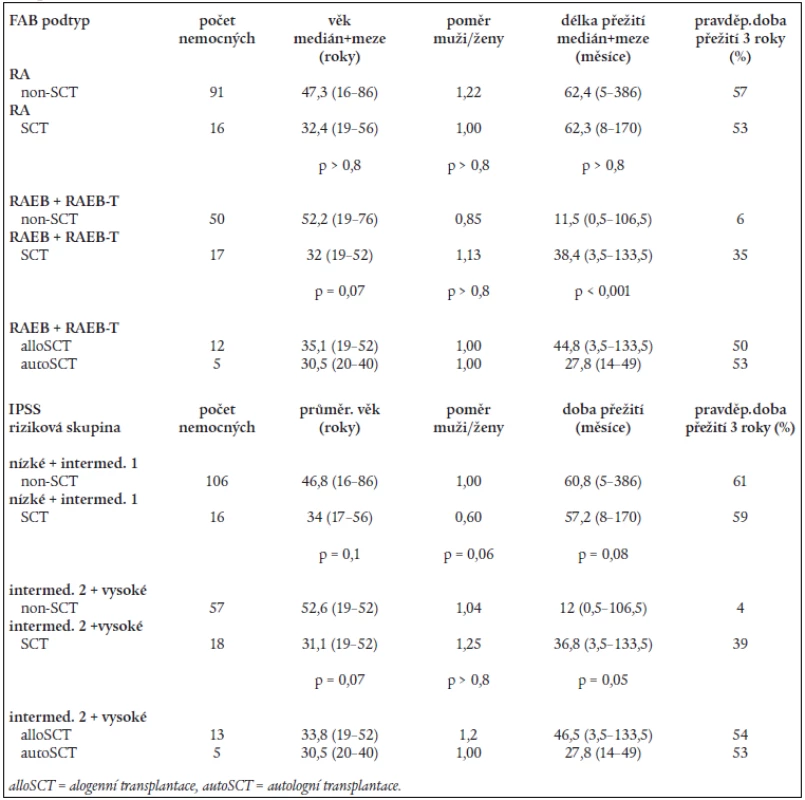
WHO klasifikace nemocných s RA a RARS neprokázala statisticky významný rozdíl v délce přežití mezi transplantovanými a netransplantovanými nemocnými ani u nemocných s „čistou“ RA (64,0 měsíce u SCT vs 91,0 měsíce u netransplantovaných; P = 0,3) ani u nemocných s RCMD (60,8 měsíce u SCT vs 41,2 měsíce u netransplantovaných; P = 0,2), přestože transplantace vedla k významnému snížení rizika leukemické transformace (tab. 7).
7. Věk, délka přežití a procento leukemické transformace u netransplantovaných (non-SCT) a transplantovaných nemocných (SCT) při rozdělení podle WHO klasifikace a podle kombinace WHO klasifikace s prognostickým typem karyotypu dle IPSS. 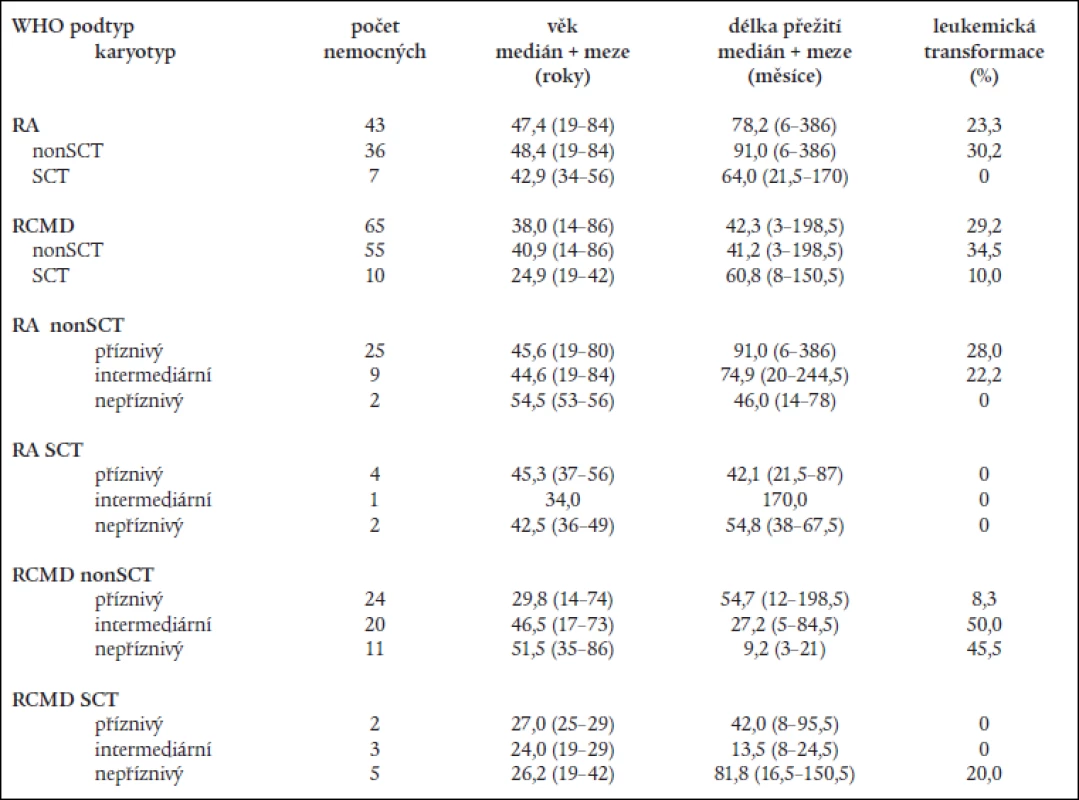
Mortalita spojená s transplantací činila 29 % u nemocných s RA a 60 % u nemocných s RCMD. Podrobnější rozdělení nemocných s RA a RCMD na podkladě rizikových skupin karyotypu dle IPSS neovlivnilo rozdíly mezi transplantovanými a netransplantovanými nemocnými s RA, medián délky přežití transplantovaných nemocných s „příznivým“ karyotypem byl dokonce kratší než u netransplantovaných (42,1 měsíce vs 91,0 měsíce) (tab. 7). Na druhé straně, i když počty nemocných v jednotlivých podskupinách byly poměrně malé a transplantováni byli mladší nemocní, medián délky přežití netransplantovaných nemocných s RCMD a „nepříznivým“ karyotypem činil pouze 9,2 měsíce a 3 roky nepřežil žádný nemocný na rozdíl od transplantovaných nemocných (medián délky přežití: 81,8 měsíce; 3 roky přežívá 80 % nemocných) (tab. 7).
Statistická analýza s jednou proměnnou provedená u nemocných s RA (dle FAB klasifikace) odhalila jako významné proměnné ovlivňující délku přežití věk, karyotyp a přítomnost leukemické transformace (tab. 8). Regresní analýza s více proměnnými ukázala jako nezávislé parametry ovlivňující délku přežití přítomnost „intermediárního“ a „nepříznivého“ karyotypu dle IPSS a věk nad 50 let, karyotyp, mužské pohlaví a věk nad 50 let byly významnými parametry ovlivňujícími leukemickou transformaci (tab. 8).
8. Výsledky statistické analýzy s jednou a více proměnnými u skupiny nemocných s refrakterní anémií (dle FAB klasifikace). 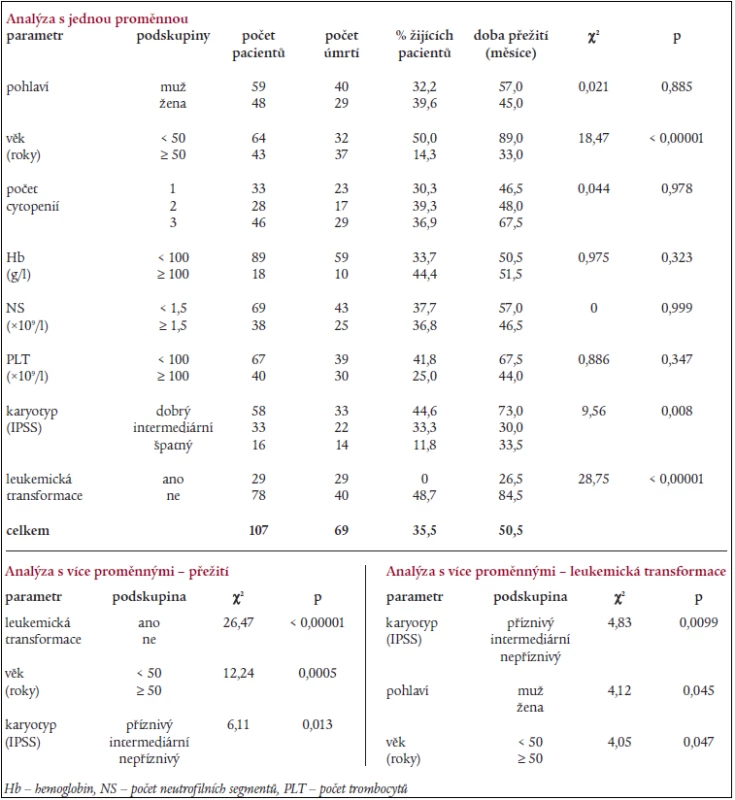
Diskuse
V současné době představují u nemocných s MDS léčebný problém zejména dvě skupiny nemocných. Prvou skupinu tvoří starší nemocní s pokročilými stadii choroby, kteří špatně tolerují kombinovanou cytostatickou léčbu a nejsou vzhledem k věku a celkovému stavu indikováni k provedení SCT. Výsledky naší analýzy potvrdily, že u nemocných s RAEB a RAEB-T, stejně jako u nemocných se středním II. a vysokým rizikem (jež je dáno dle IPSS zejména nárůstem počtu blastů), má pro dlouhodobé přežití nemocných zásadní význam provedení SCT. Samotná chemoterapie nepředstavovala vzhledem k vysoké incidenci závažných komplikací a četnosti relapsů signifikantní přínos oproti pouhé podpůrné léčbě, byly však hodnoceny poměrně malé skupiny nemocných. Průměrná doba přežití netransplantovaných nemocných s RAEB a RAEB-T činila necelý rok a 3 roky přežívala pouze 4 %, resp. 3 % nemocných, podobně jako ve studii Greenberga et al [8], kde nemocní s RAEB a RAEB-T přežívali 0,6 resp. 1,5 roku. Tato nepříznivá prognóza vyvažuje poměrně vysokou peritransplantační mortalitu i u mladších nemocných s RAEB či RAEB-T, jež činí v průměru 40 %. Pro starší nemocné s pokročilými stadii MDS mohou určitou naději znamenat látky s diferenciačním účinkem, u nichž byl prokázán efekt u 50 % nemocných, možný přínos SCT provedené u starších nemocných po méně toxickém přípravném režimu [12] je třeba zhodnotit v rozsáhlejších studiích, na efektivitu autologní SCT u MDS nejsou názory jednoznačné [7,15]. V naší studii měli nemocní po autologní SCT horší prognózu než nemocní po alogenní SCT zejména díky vysoké incidenci relapsů.
Druhý okruh tvoří nemocní s časnějšími a prognosticky relativně méně závažnými stadii MDS, u nichž SCT může přinést vyléčení, ale na druhé straně je stále spojena s nezanedbatelným rizikem. Ve všech rozsáhlých studiích zabývajících se přínosem SCT k léčbě MDS byli nejlepšími kandidáty pro provedení úspěšné alogenní SCT mladší nemocní s méně pokročilými stadii choroby [1,6,14,15,16]. Pravděpodobnost dlouhodobého přežití činí u těchto nemocných při transplantaci časně po stanovení diagnózy 60-75 %, nicméně i u nich se pohybuje mortalita spojená se SCT mezi 20-50 % [1,6,14,16]. Na druhé straně, jak již bylo zmíněno v úvodu, rozsáhlá multicentrická analýza neléčených nemocných s MDS [9] zjistila, že nemocní mladší 60 let s nízkým rizikem (dle IPSS) přežívají v průměru 11,8 let i bez léčby a riziko leukemické transformace u nich představuje pouze 22 % během 10 let trvání choroby, obdobně jako u nemocných s RA (dle FAB klasifikace). U nemocných se středním I. rizikem činila průměrná doba přežití 5,2 roku a u 28 % nemocných došlo během této doby k rozvoji AL. V naší studii nebyl pozorován statisticky významný rozdíl v délce přežití mezi transplantovanými a netransplantovanými nemocnými s RA či nízkým a středním I. rizikem, nelišila se ani pravděpodobnost přežití 3 roky. Tyto nálezy ukazují na nutnost hledání dalších kritérií, která by pomohla vyčlenit nemocné s méně pokročilými stadii choroby, pro něž představuje časná SCT jasný přínos i přes rizika spojená s jejím provedením.
Naše studie prokázala, stejně jako předchozí rozsáhlá německá studie [8], že WHO klasifikace představuje pro nemocné s méně pokročilými stadii MDS přínos zejména tím, že umožňuje vyčlenit prognosticky jednoznačně nepříznivou podskupinu s RCMD ze skupiny refrakterních anémií. Kromě toho bylo prokázáno, že pro klasifikaci a prognózu nemocných s delecí dlouhého raménka 5. chromozomu má spíše než morfologická charakteristika, jak je navrhováno WHO klasifikací [10], význam analýza karyotypu pomocí metod molekulární cytogenetiky, jež v naší práci umožnila odlišit nemocné s přídatnými změnami karyotypu a jednoznačně nepříznivou prognózou od nemocných se solitární delecí 5q. Lze předpokládat, že obdobný přínos pro prognózu nemocných s MDS může mít i analýza dalších chromozomů pomocí FISH či dalších metod molekulární cytogenetiky.
Nicméně ani při hodnocení pouze dle WHO klasifikace nebyl u našich nemocných přítomen statisticky významný rozdíl v délce přežití mezi transplantovanými a netransplantovanými ani u RA, ani u RCMD, přestože SCT významně snížila riziko leukemické transformace. Pokud pomineme poměrně malé počty nemocných v jednotlivých skupinách, zdá se být nejpravděpodobnější příčinou vysoká mortalita spojená s SCT (44 %) na jedné straně, a pomalu probíhající choroba s nízkým rizikem přechodu do AL (24 % pro RA a 0 % pro RARS dle FAB klasifikace 5 let po diagnóze) na straně druhé. Rozdíl mezi počtem přežívajících s RA dle FAB klasifikace se stal významným ve prospěch transplantovaných teprve po 7 letech (48 % vs 33 %). K obdobným závěrům došla i americká pracovní skupina hodnotící riziko spojené se SCT u nemocných s MDS [4]. U nemocných s nízkým či středním I. rizikem dle IPSS byla při časné SCT v době diagnózy pravděpodobnost přežití o 3 roky nižší než u nemocných transplantovaných ve fázi počínající leukemické transformace. U nemocných s nízkým rizikem byla s maximálním efektem na délku přežití spojena SCT 2,5 roku po diagnóze, pokud byla provedena před přechodem do AL. V matematickém modelu pak autoři prokázali, že u nemocných s MDS a nízkým rizikem by měla časná SCT v době diagnózy jednoznačný přínos pouze, pokud by se podařilo snížit mortalitu spojenou s transplantací pod 15 %.
Teprve při kombinované stratifikaci nemocných podle WHO klasifikace a rizikových skupin dle IPSS klasifikace karyotypu byla v naší studii nalezena skupina nemocných s RCMD a „nepříznivým“ karyotypem, u níž byl přínos časné SCT na délku přežití evidentní i přes malý počet hodnocených nemocných v jednotlivých skupinách. Význam karyotypu pro prognózu nemocných s časnými stadii MDS byl podpořen i výsledkem regresní analýzy laboratorních a klinických parametrů, přítomnost nepříznivých změn karotypu byla nejdůležitějším nezávislým parametrem ovlivňujícím jak délku přežití, tak riziko leukemické transformace nemocných s RA dle FAB klasifikace. K obdobnému závěru dospěla i regresní analýza 816 nemocných s primárním MDS při tvorbě IPSS, u nemocných s RA a RARS byly nezávislými parametry ovlivňujícími přežití a rozvoj AML pancytopenie a nepříznivý karyotyp. Naše studie ukázala i význam metody FISH při analýze karyotypu a odhalování přídatných aberací karyotypu, jejichž přítomnost může mít negativní prognostický význam. Užití metod molekulární cytogenetiky v kombinaci s klasickou morfologií může dále zpřesnit identifikaci rizikových nemocných v podskupině refrakterních anémií, indikovaných k časné SCT i přes relativně vysoké riziko komplikací spojených s transplantací.
Práce vznikla v rámci grantového projektu NK/7713-3 Interní grantové agentury Ministerstva zdravotnictví České republiky a výzkumného záměru MZ 00237360001.
MUDr. Jaroslav Čermák, CSc.
Ústav hematologie a krevní transfuze
U nemocnice 1
128 20 Praha 2
Doručeno do redakce: 27. 6. 2003
Přijato po recenzi: 8. 3. 2004
Sources
1. Anderson JE Bone marrow transplantation for myelodysplasia. Blood Reviews 2000; 14 : 63-77.
2. Bennett JM, Catovsky D, Daniel MT et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189-199.
3. Cox DR. Regression models and life-tables. J R Stat Soc 1972; 34 : 187.
4. Cutler C, Lee S, Greenberg P et al. A decision analysis of allogeneic stem cell transplantation for MDS: Delayed transplantation for low risk MDS is associated with improved outcome. Blood 2002; 100 : 74a.
5. Čermák J Myelodysplastický syndrom. In: Mayer J, Starý J. Leukémie. Grada 2002 : 221-234.
6. De Witte T, Zwaan F, Hermans J et al. Allogeneic bone marrow transplantation for secondary leukemia and myelodysplastic syndrome:a survey by the Leukemia Working Party of the European Bone marrow Transplantation Group (EBMTG). Br J Haematol 1990; 74 : 151-155.
7. De Witte T, Suciu S, Verhoef G et al. Intensive chemotherapy followed by allogeneic or autologous stem cell transplantation for patients with myelodysplastic syndromes (MDSs) and acute myeloid leukemia following MDS. Blood 2002; 98 : 2326-2331.
8. Germing U, Gattermann N, Strupp C et al. Validation of the WHO proposals for a new classification of primary myelodysplastic syndromes: a retrospective analysis of 1600 patients. Leuk Res 2000; 24 : 983-992.
9. Greenberg P, Cox C, Le Beau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079-2088.
10. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee Meeting - Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835-3849.
11. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457-481.
12. Parker JE, Shafi T, Pagliuca A et al. Allogeneic stem cell transplantation in the myelodysplastic syndromes: interim results of outcome following reduced-intensity conditioning compared with standard preparative regimens. Br J Haematol 2002; 119 : 144-154.
13. Raza A, Gregory A, Preisler HD. The myelodysplastic syndromes in 1996: complex stem cell disorders confounded by dual actions of cytokines. Leukemia Res 1996; 20 : 881-890.
14. Sierra J, Pérez WS, Rozman C et al. Bone marrow transplantation from HLA-identical siblings as treatment for myelodysplasia. Blood 2002; 100 : 1997-2004.
15. Steensma DP, Tefferi A The myelodysplastic syndrome(s): a perspective and review highlighting current controversies. Leuk Res 2003; 27 : 95-120.
16. Sutton L, Chastang C, Ribaud P et al. Factors influencing outcome in de novo myelodysplastic syndromes treated by allogeneic bone marrow transplantation: a long term study of 71 patients. Blood 1996; 88 : 358-365.
17. Van Den Berghe H, Cassiman JJ, David G et al. Distinct hematological disorder with deletion of long arm of No. 5 chromosome. Nature 1974; 251 : 437.
18. Wijermans P, Lubbert M, Verhoef G et al. Low-dose 5-Aza-2,-deoxycytidine, a DNA hypomethylating agent, for the treatment of high-risk myelodysplastic syndrome: a multicenter phase II study in elderly patients. J Clin Oncol 2000; 18 : 956-962.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 1-
All articles in this issue
- Sir William Osler’s legacy
- Myelodysplastic syndrome in the new millennium. How to classify and cure patients?
- Effect and tolerability of combine therapy fludarabine plus cyclophosphamide in patients with B-chronic lymphocytic leukemia
- Our Experience with the New Organisation of Care of Patients with Acute Upper Gastrointestinal Bleeding
- Power training at the patients after acute myocardial infarction with decreased left ventricular ejection fraction
- Introduction to the metabolic syndrome problematics
- Metabolic syndrome and sympathetic nervous system: is obstructive sleep apnea a key to understanding?
- Diabetes mellitus and metabolic syndrome
- Hypertension as a part of metabolic syndrome
- Obesity and metabolic syndrome
- Dyslipidemia and metabolic syndrome
- Hypertension and hyperuricemy
- The role of exercise therapy and physical fitness in prevention and treatment of metabolic syndrome
- Acute myocardial infarction in patient with history of infective endocarditis
- Extramedullary plasmacytoma of the thyroid gland – a rare vause of a solitary struma nodosa and hyperthyroidism
- Liver disease at alpha-1-antitrypsin deficiency
- Acute myocarditis manifesting as a transmural myocardial infarction accompanied by acute renal failure
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Liver disease at alpha-1-antitrypsin deficiency
- Myelodysplastic syndrome in the new millennium. How to classify and cure patients?
- Hypertension and hyperuricemy
- Extramedullary plasmacytoma of the thyroid gland – a rare vause of a solitary struma nodosa and hyperthyroidism
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

