-
Medical journals
- Career
Léčba poruch vodního a elektrolytového hospodářství ve stáří
: prof. MUDr. Zdeněk Zadák, CSc. 1; RNDr. Mgr. Alena Tichá, Ph.D. 2; MUDr. Radomír Hyšpler, Ph.D. 2
: Centrum pro výzkum a vývoj FN Hradec Králové 1; Ústav klinické biochemie a diagnostiky FN Hradec Králové 2
: Geriatrie a Gerontologie 2019, 8, č. 2: 64-69
: Review Article
Poruchy iontového hospodářství jsou častou a velmi závažnou situací, která se vyskytuje ve stáří. Příčiny poruch vodního a iontového hospodářství jsou založeny na snížené schopnosti starších jedinců adaptovat se na patologické změny v průběhu onemocnění i na zátěž zevního prostředí. Přístup k tomuto typu poruch se v posledních letech výrazně změnil, zejména z hlediska iontového a vodního hospodářství k aspektům intermediárního metabolismu a energetické rovnováhy v průběhu onemocnění. Z tohoto pohledu je úprava vodního a minerálního hospodářství velmi závislá na nutriční podpoře a energetickém zajištění pacienta. Některé z hlavních iontů, např. hořčík a fosfor, získávají v pohledu na onemocnění starších jedinců zvláštní význam a jejich poruchy se podílejí na vzniku klinické situace, kterou shrnujeme pod obrazem „křehký pacient“.
Nový moderní přístup a odlišnosti léčby vodního a iontového hospodářství mají zvláštní důležitost v intenzivní péči a v řešení urgentních stavů. Cílem článku je zdůraznit některé odlišnosti nového pohledu na léčbu poruch vodní a iontové rovnováhy se zvláštním zřetelem na odlišnosti ve stáří.
Klíčová slova:
geriatrický pacient – voda – elektrolyty – energetická rovnováha
Úvod
V posledních letech se významně změnil pohled na vodní a iontovou rovnováhu obecně a ještě výrazněji ve vztahu k věkovému faktoru. Zatímco v období kolem poloviny minulého století byla úprava vodní a iontové rovnováhy zaměřena na bilanční pohled, moderní přístup k této problematice v posledních dekádách je převážně založen na chápání energetického principu. Dříve byly úpravy acidobazické rovnováhy, iontového a vodního hospodářství řešeny velmi izolovaně. Při poruchách složení vnitřního prostředí se léčba zaměřovala převážně na úpravu objemu tělesných tekutin a deficitu iontů podle jejich koncentrací v plazmě. Nynější pohled prokazuje nutnost nejen přívodu chybějících iontů a vody, ale protože jde o výrazně endergonický jev, soustřeďuje se pozornost na energetické zabarvení těchto procesů. Tento přístup je založen na skutečnosti, že v lidském organismu přibližně 60 % celkového denního energetického obratu je spotřebováno na transportní mechanismy iontů ve vnitřním prostředí, převážně na distribuci v intracelulárním a extracelulárním prostoru, tedy na transmembránový transport (1, 2, 9).
Z tohoto pohledu vyplývá, že úprava vodního a iontového hospodářství není možná bez efektivní úpravy metabolických a energetických procesů. Jinými slovy, účinná suplementace chybějících iontů a doplnění vody v intracelulárním i extracelulárním prostoru jsou těsně závislé na mobilizaci a přívodu energetických zdrojů.
Distribuce tělesných tekutin a jejich dynamika
Celková tělesná voda reprezentuje objemy v jednotlivých tělesných kompartmentech, které mají ve stabilizovaném stavu u nemocného vcelku konstantní charakter. Tělesná voda podléhá přibližně 6 % obratu celkové tělesné vody za den. Do organismu vstupuje voda jednak ze zevního prostředí a dále vzniká tzv. metabolická voda v procesu oxidace nutričních substrátů. Množství vody vznikající oxidací energetických substrátů uvádí tab. 1.
1. Voda vznikající oxidací nutričních substrátů 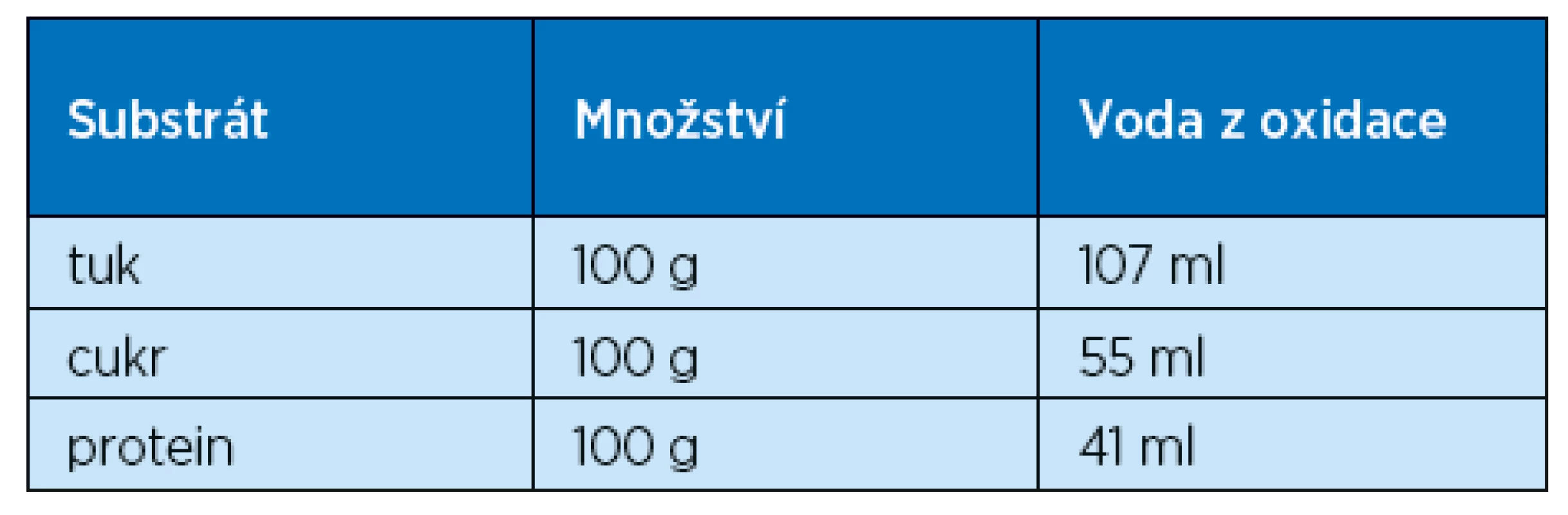
Příjem vody ze zevního prostředí a metabolická voda jsou v těsné rovnováze s výdejem vody, který se ve vyrovnaném stavu skládá z následujících složek:
Výdej vody
- Celkové denní ztráty 2000–2500 ml
- Ztráta vody močí 1000–1500 ml
- Ztráty vody pokožkou 500 ml
- Ztráty vody plícemi 400 ml
- Ztráty vody stolicí 100 ml
Potřeba vody ve vyrovnaném stavu je však velmi odlišná od situace v akutním stavu, zejména v intenzivní péči, kdy dochází ke zvýšeným nárokům na dodatečný příjem vody v závislosti na klinické situaci. Voda je hlavní složkou lidského těla a u zdravého dospělého jedince se pohybuje mezi 55 % až 65 % celkové hmotnosti. Postupem věku se podíl vody snižuje převážně tak, jak ubývá svalová hmota a přibývá podíl tukové hmoty v celkové tělesné hmotnosti. Podíl vody v závislosti na věku udává tab. 2.
2. Obsah vody v dospělosti a ve stáří 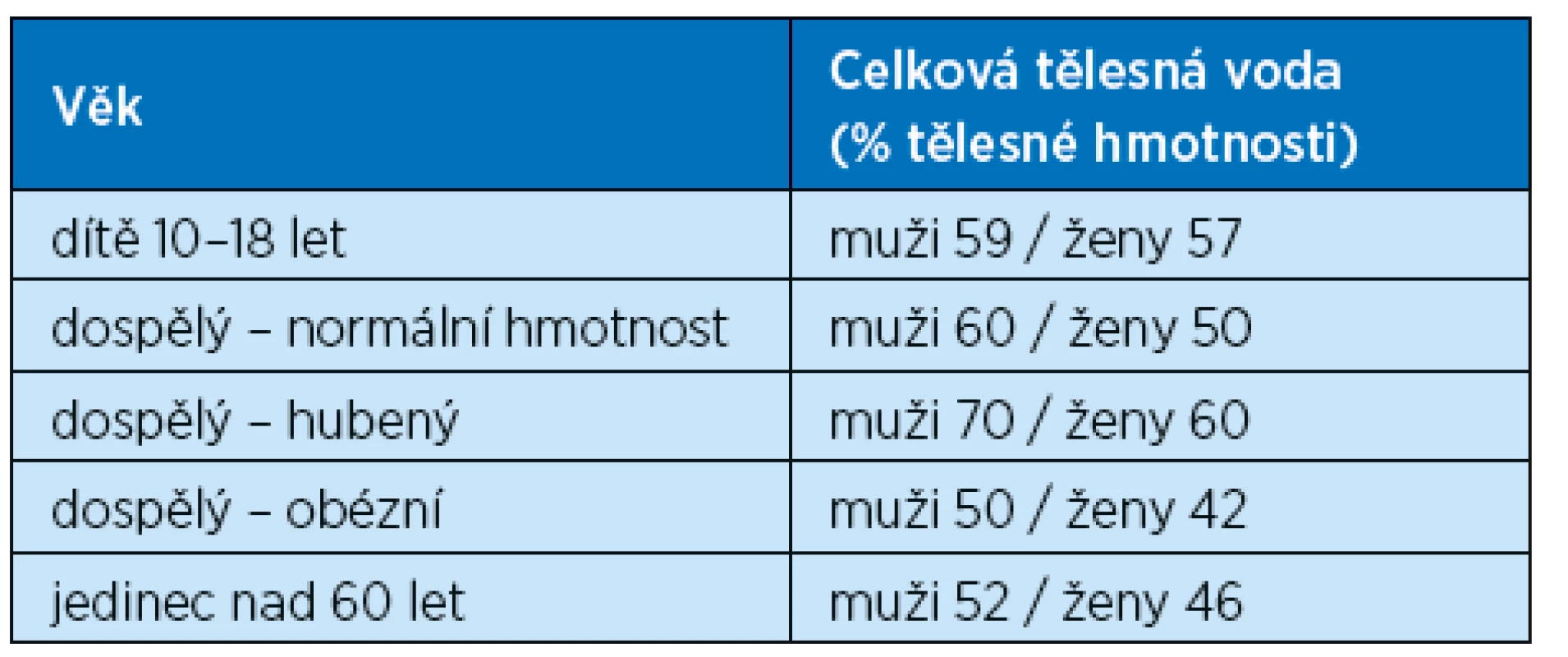
Většina starších osob má vlivem stoupajícího věku menší citlivost ke vnímání žízně, takže tito jedinci jsou zvýšeně ohroženi deficitem čisté bezsolutové vody a tím hypernatremií. Dále je ve stáří snížena schopnost vylučovat čistou vodu především jako důsledek poklesu glomerulární filtrace, případně snížení odpovědi tubulů na ADH. Starší jedinci jsou proto vystaveni vyšší pravděpodobnosti deficitu vody, který je způsoben i nevhodnou polypragmazií ve farmakoterapii (3). Je to způsobeno mimo jiné tím, že mnohá farmaka ovlivňují sekreci ADH a tím ovlivňují účinně metabolismus vody (tab. 3).
3. Farmaka ovlivňující sekreci ADH a vodní metabolismus 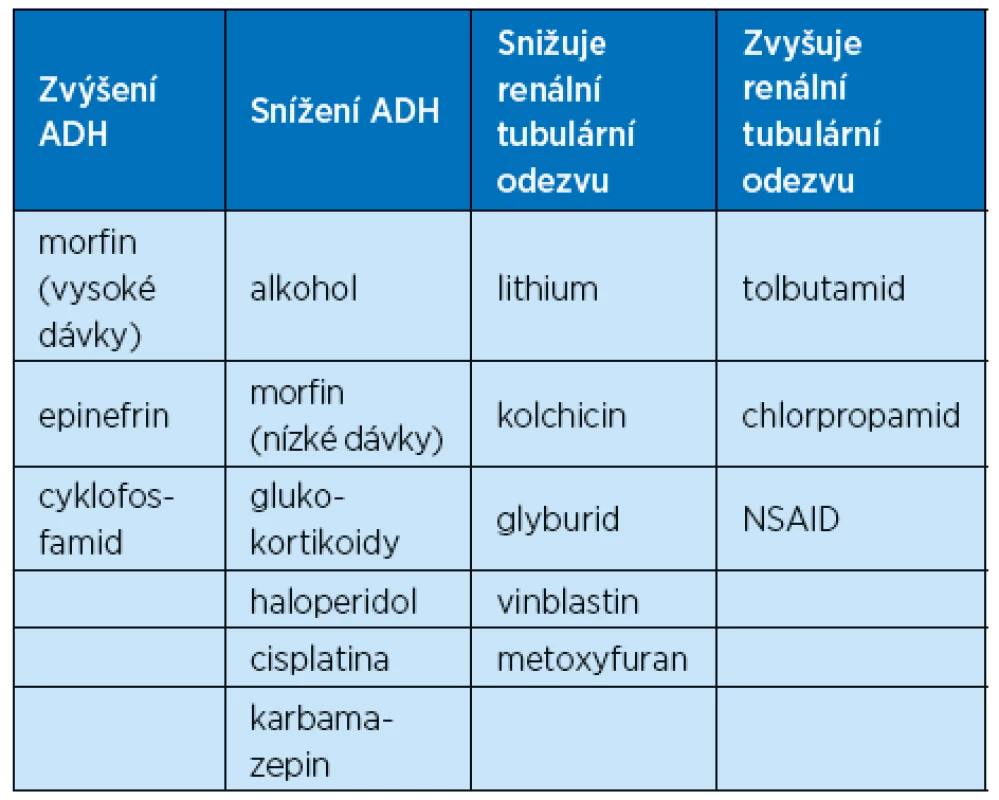
NSAID – nesteroidní antiflogistika / Non-Steroidal Anti-InflammatoryDrugs Pokud jde o rovnováhu čisté bezsolutové vody, existuje mnoho dalších vlivů, které způsobují deficit sekrece antidiuretického hormonu, potlačení žízně, redukci čisté bezsolutové vody, se kterou je spojena hypernatremie. Mezi další příčiny tohoto stavu jsou vedle farmakologických vlivů procesy, které destruují neurohypofýzu, kam patří tumory, granulomatózní onemocnění, cévní mozkové příhody a ve stáří také častý výskyt kraniotraumatu.
Metabolismus hlavních elektrolytů ve vnitřním prostředí
V celé problematice elektrolytového a vodního hospodářství a udržování objemových poměrů v jednotlivých tělesných kompartmentech, musíme mít trvale na paměti, že nejde o mechanické hydrodynamické přesuny tekutin a iontů, ale o významně endergonicky zabarvený děj.
Poruchy metabolismu natria
Se stoupajícím věkem klesá schopnost ledvin šetřit sodík v případech sodíkové deprivace, a naopak vylučovat sodík jako nezbytnou odpověď na přetížení sodíkovým iontem. Poločas pro snížení exkrece sodíku při sodíkové restrikci je u mladých jedinců zhruba 17 hodin, zatímco ve stáří se prodlužuje na 31 hodin. Sklon k omezení schopnosti šetřit sodík ve stáří je vyvolán více mechanismy. Mezi ně patří redukce počtu funkčních nefronů, která vede ke zvýšení osmotické nálože na jeden funkční nefron, čímž dochází k osmotické diuréze a současně se projevuje na věku závislá změna citlivosti renin-aldosteronového systému. Současně se může uplatňovat i redukce v orgánové odpovědi na působení atriálního natriuretického peptidu (4, 9).
Hyponatremie
Koncentrace natria v plazmě je udržována ve velmi těsném rozmezí. Pokles koncentrace sodíku na hodnotu menší než 130 mmol/l je pokládán za klinicky významnou hyponatremii. V závislosti na jejím významu dochází ke klinickým projevům od asymptomatického průběhu až k symptomatologii výrazných centrálně nervových poruch, mezi něž patří útlum, letargie, zmatenost, křečové stavy, případně kóma a smrt. Současně s projevy hyponatremie je zjištěn i významný pokles osmolality plazmy.
Hyponatremie může probíhat v několika formách:
- hyponatremie s deplecí extracelulární tekutiny,
- hyponatremie s normálním objemem extracelulární tekutiny,
- hyponatremie se zvýšením extracelulárního objemu.
U starších pacientů s hyponatremií a normálním objemem extracelulární tekutiny je třeba vždy pátrat po hypothyreóze nebo deficitu sekrece glukokortikoidů. Ve stáří je tento mechanismus častý, protože s postupujícím věkem stoupá frekvence výskytu hypothyreózy.
Mezi další příčiny hyponatremie patří Schwarzův-Bartterův syndrom inadekvátní sekrece ADH (syndrom nepřiměřené sekrece antidiuretického hormonu). Výskyt tohoto syndromu má zvýšený význam s pokračujícím věkem, protože bývá spojen s onemocněním centrálního nervového systému, malignitami a plicními chorobami.
Léčba hyponatremie
Léčebný postup závisí na mechanismu vzniku a závažnosti hyponatremie. Deplece plazmatického sodíku u pacientů s arteriální hypotenzí je třeba korigovat infuzní cestou podáním izotonického roztoku NaCl, případně u závažných stavů podáním hypertonického roztoku NaCl. Přívod sodíku nemá přestoupit 0,3–0,4 mmol/hod., protože ve stáří je zvýšené riziko, že stoupající natremie může vyvolat závažné neurologické komplikace, případně známky kardiálního selhávání a při zhoršení kardiální kompenzace i plicní městnání. U geriatrické populace se doporučuje přívod izotonického roztoku NaCl rychlostí 75–100 ml/hod. po dobu 24 hod., případně u pacientů s projevy srdečních onemocnění je nutné infuzi fyziologického roztoku podávat pomaleji 50–75 ml/hod.
Hypernatremie
Ve stáří patří hypernatremie k poruchám poměrně častým. Klinicky signifikantní je hypernatremie větší než 150 mmol/l plazmy. Protože obsah celkové tělesné vody s postupujícím věkem klesá, dochází ve stáří k dehydrataci snadněji než v mladém věku. S tím souvisí snížené vnímání pocitů žízně. Ve stáří s redukcí počtu funkčních glomerulů a poklesem glomerulární filtrace se zhoršuje schopnost koncentrovat moč a tím šetřit bezsolutovou vodu. Hypernatremie ve stáří je velmi riziková, přináší vysoké riziko morbidity i mortality. Mortalita u starších jedinců s rychlým vzestupem sérové koncentrace sodíku v plazmě více než 60 mmol/l dosahuje až 60 %. Hypernatremie je spojena se somnolencí, slabostí, stuporem, kómatem a křečemi. Klinicky je přítomen nízký kožní turgor, suchost sliznic, hypotenze. Změna intrakraniálního tlaku vede k snížení objemu mozkové tkáně a vzniku spontánních krvácení, případně subdurálního hematomu. Příčinami hypernatremie jsou nejčastěji tyto mechanismy:
- zvýšené ztráty vody, profuzní průjmy, horečka, osmotická diuréza při hyperglykemii;
- sondová výživa s vysokým obsahem proteinů, diabetes incipidus, hyperkalcemie, chronické onemocnění ledvin;
- snížený přívod čisté bezsolutové vody – febrilie, nedostatečný přívod čisté vody, mentální poruchy s defektním vnímáním žízně, imobilita;
- zvýšený příjem sodíku, prolongované infuze izotonického roztoku NaCl, masivní terapie natrium bikarbonátem.
Léčba hypernatremie
Náhrada bezsolutové vody perorálně u pacienta, který je při vědomí. Při alteraci vědomí infuze 5% glukózy, která je zdrojem čisté bezsolutové vody a zároveň vzniká metabolická voda z oxidace glukózy.
Pokud však existuje arteriální hypotenze, je nutné zahájit léčbu izotonickým roztokem NaCl, případně za současného podání infuze izotonického roztoku NaCl a 5% glukózy. U osob léčených infuzí 5% glukózy je nutné dodržovat opatrný přívod 100–125 ml/hod. Je třeba mít na paměti, že rychlejší korekce hypernatremie může vést k mozkovému otoku a je krajně riziková. Úprava plazmatické koncentrace natremie nemá postupovat rychleji než 0,5 mmol/hod.
Poruchy metabolismu draslíku
Hyperkalemie
Pokles koncentrace draslíku je ve stáří významnější než v mládí, protože má souvislost se zmenšováním svalové hmoty a rozvojem sarkopenie ve vyšším věku. Zvýšením plazmatické koncentrace draslíku po cvičeních ve stáří je pravděpodobně způsobeno fluxem draslíku ze svalových tkání do plazmy. Hypoperfuze ledvin ve stáří vede ke snížení glomerulární filtrace a zvyšuje tak riziko hyperkalemie ve stáří. Z iatrogenních vlivů se významně uplatňuje terapie nesteroidními antiinflamatorními léky, které mohou významně redukovat hladinu aldosteronu a tím narušit rovnováhu draslíku. Pacienti trpící hypertenzí a diabetem mívají tubulární acidózu a jsou vystaveni daleko většímu riziku hyperkalemie.
Léčba Hyperkalemie
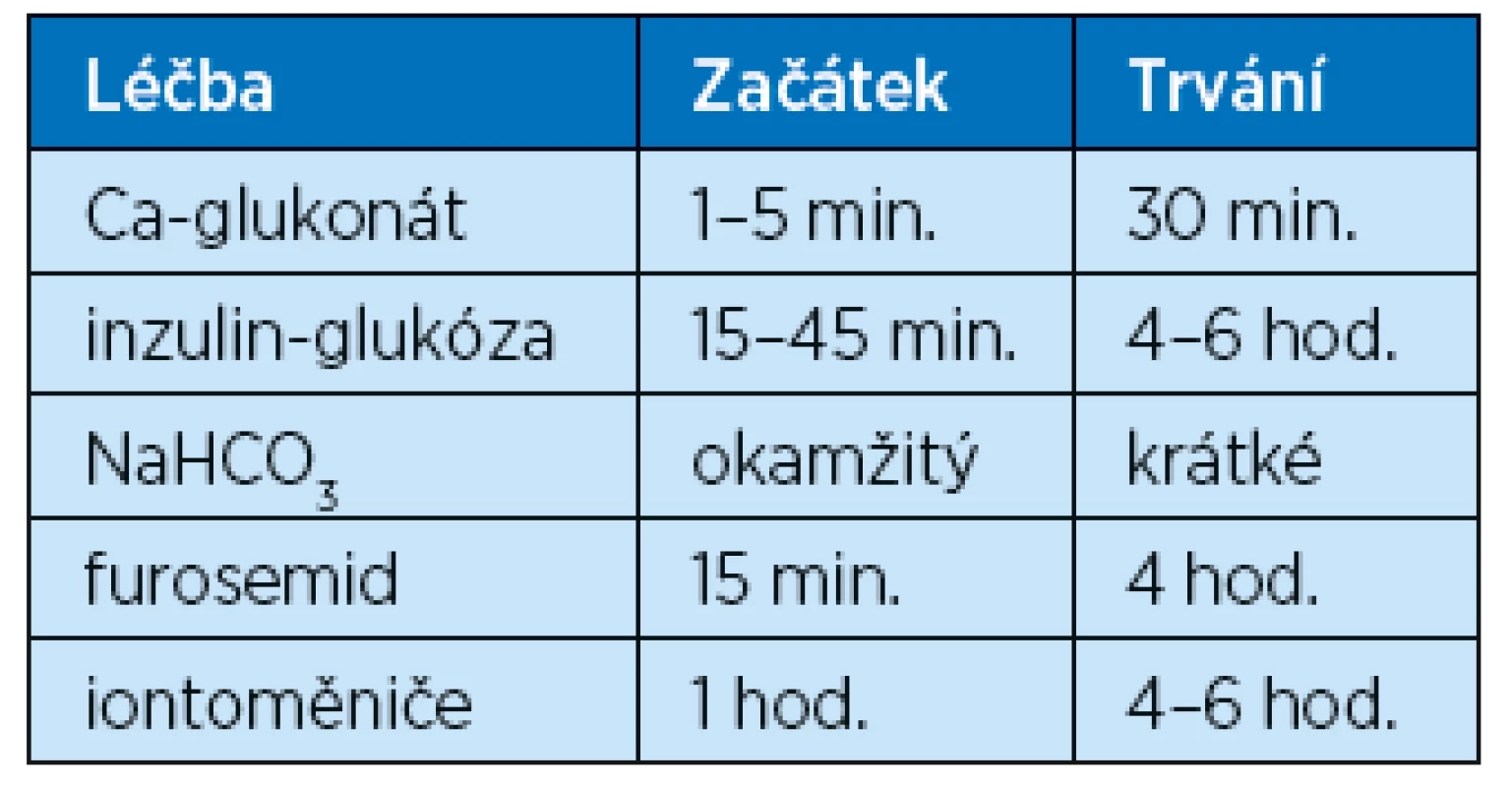
Při zahájení léčby je nezbytné zjistit příčinu hyperkalemie a odstranit její zdroj, pokud to jde, současně se zahájením terapie. Častá příčina je léčba betablokátory, AC inhibitory a nesteroidními antirevmatiky. Častou příčinou je renální insuficience, zejména v souvislosti s poruchami hydratace. Přítomnost rozšíření komplexu QRS v důsledku hyperkalemie má vést k urgentní léčbě. Mezi urgentní opatření patří intravenózní podání kalcia ve formě kalcium glukonikum v dávce 90 mg kalcia během 2–3 min. s cílem upravit poruchu depolarizace membrán buněk srdečního svalu. Pokud je QRS komplex normální a je přítomna vysoká T vlna, doporučuje se podání 10% glukózy s 10 jednotkami krátkodobě působícího inzulinu v intravenózní infuzi. Současně s tímto urgentním zákrokem je nutné zahájit eliminační léčbu, která vede k snížení hladiny draslíku – intravenózní podání furosemidu, použití iontoměničových pryskyřic, případně hemodialýza (tab. 4).
Hypokalemie
Přestože ve stáří je sklon k hyperkalemii, není výskyt hypokalemie u starších jedinců vzácný. Hypokalemie ve stáří souvisí s poruchami výživy, dále častou léčbou diuretiky ve starší populaci. Hypokalemie ve stáří je spojena se změnami na EKG, k nimž patří oploštění vlny T, přítomnost U vlny, prodloužení QR intervalu a snížení voltáže QRS s jeho současným rozšířením. Časté jsou komorové arytmie, které mohou mít maligní charakter. Na klinicky závažné hypokalemii se může podílet současný deficit magnézia, který je často spojen s hypokalemií rezistentní na léčbu. Ve stáří je chronická hypokalemie způsobena často iatrogenně abúzem projímadel. Protrahovaná a hrubší hypokalemie vede k hypokalemické nefróze, neschopnosti tubulů reabsorbovat draslík a tím šetřit draslík pro organismus. Následkem jsou trvale vysoké ztráty kalia močí, které často nelze kompenzovat ani zvýšeným přívodem kalia. Hypokalemická nefróza se prohlubuje a výsledkem jsou chronické a těžko korigovatelné hypokalemie a hypomagnezémie, které mohou mít pro pacienta fatální důsledky (8).
Léčba Hypokalemie
V úvodu je nutné zdůraznit, že hypokalemie, zejména rezistentní na léčbu, je velmi často spojena s hypomagnezemií, po které musíme vždy pátrat a také ji současně s hypokalemií léčit. Při hodnotách kalia 2,5–3,5 mmol/l je možné začít léčbu perorálním přívodem draslíku. Draslík se podává v dávce 30–40 mmol v dobře resorbovatelné formě v intervalech 2–4 hod. při současném monitorování plazmatických koncentrací draslíku a jeho exkrece do moči. Při poklesu kalemie na méně než 2,5 mmol/l, zejména u pacientů s kardiálním onemocněním, je neprodleně zahájena intravenózní aplikace rychlostí 10 mmol/hod. (10 mmolKCl ve 100 ml 5% glukózy rychlostí 100 ml/hod.). Pečlivé monitorování EKG je při této léčbě nezbytné.
Poruchy metabolismu magnézia
Magnézium je mimořádně důležitý iont v enzymatických funkcích, neuromuskulární aktivitě a utváření struktury kostí, ve které je obsaženo 60 % tohoto prvku. Pouze 1 % magnézia je v extracelulární tekutině, převaha magnézia je uložena intracelulárně. Častý deficit magnézia v evropské populaci, zejména ve starších věkových skupinách, je způsoben dvěma hlavními mechanismy:
- nedostatečným příjmem, který je způsoben deficitem magnézia v potravě,
- poruchami absorpce magnézia z potravy, která je způsobena nevhodným složením potravy a současně vysokými ztrátami magnézia do moči (6, 7).
Zvýšený obsah volného tuku v potravě vede k zhoršené biologické dostupnosti hořčíku. Významný deficit hořčíku spojený s jeho deplecí v tělesných tekutinách je vázán na diabetes 2. typu a metabolický syndrom. Deficit hořčíku u diabetiků se prokazatelně a velmi významně uplatňuje na vzniku a rozvoji diabetických komplikací, především diabetické nefropatie a diabetické retinopatie.
Hypomagnezemie
Symptomy a průběh hypomagnezemie se objevují obvykle při poklesu hladin sérového magnézia pod 0,8 mmol/l. Mezi časté symptomy patří svalový třes, fascikulace, ataxie, nystagmus a při pokročilé depleci hořčíku v tělesných tekutinách svalová tetanie. Mezi další symptomy hypomagnezemie patří spavost, únavový syndrom, zmatenost a další hlubší poruchy vědomí. V kardiovaskulární oblasti se deficit magnézia projevuje prodloužením intervalu PR a QT, časté jsou síňové a komorové arytmie.
Léčba hypomagnezemie
Lehká hypomagnezemie se léčí pomalou infuzí 10 ml 40 mmol MgSO4 v 5% glukóze po dobu 24 hod. U závažné hypomagnezemie podáváme bolus magnézium sulfátu a pokračujeme v infuzi 40 mmol magnézia v 5% glukóze v pomalé 24hodinové infuzi. Vzhledem k tomu, že hořčík je primárně intracelulární iont, je řízení deplece hořčíku podle jeho bilance spolehlivější než využití plazmatických hladin koncentrace hořčíku. Alternativně je používáno stanovení hořčíku v erytrocytech.
Hypermagnezemie
Projevy hypermagnezemie tak, jak se vyskytují u starší věkové populace, se manifestují většinou u plazmatických hodnot větších než 4 mmol/l. Hlavními projevy hypermagnezemie jsou neuromuskulární poruchy, hyporeflexie až areflexie, útlum, spavost a svalová slabost. Závažnou poruchou extrémní hypermagnezemie je respirační selhání a z kardiologických syndromů hypotenze, bradykardie, prodloužený PR interval, rozšířený QRS a prodloužení QT. Vzácně při velmi těžké hypermagnezemii, která se vyskytuje při renálním selhání, může vzniknout AV blok III. stupně, případně asystolie. Významné projevy hypermagnezemie se nevyskytují při perorálním podání, ale pouze u intravenózní aplikace vysokých dávek hořčíku a často také jako součást projevů renální insuficience.
Léčba hypermagnezemie
V případech asymptomatické hypermagnezemie omezujeme přívod hořčíku do organismu a zajistíme vyšší obrat tekutin a diurézu, která umožní zvýšené vylučování magnézia do moči. U těžké hypermagnezemie spojené s klinickými projevy podáváme 10% kalcium glukonikum (10 ml 10% kalcium glukonikum během 10 min.), při poruchách ventilace je někdy nutné připojení pacienta na umělou plicní ventilaci. U závažných arytmií spojených s AV blokem je výjimečně nutné využití kardiostimulátoru. Pokud není přítomna renální insuficience, zvyšujeme diurézu infuzí 0,9% roztoku NaCl rychlostí 150 ml/hod. a současně podáním diuretik s cílem zvýšit exkreci magnézia. U pacientů, kde jsou projevy renální insuficience, je mnohdy nutné provedení hemodialýzy.
Poruchy metabolismu kalcia ve stáří
Poruchy metabolismu kalcia se častěji vyskytují ve vyšších věkových skupinách populace. Redukce absorpce kalcia z gastrointestinálního traktu závisí zejména na depleci hladin vitaminu D, zvýšení cirkulující koncentrace parathormonu a vlivu dietních poruch, které jsou spojeny s redukcí vhodných zdrojů vápníku ve výživě a s poruchami gastrointestinálního traktu. Snížení příjmu kalcia v dietě u starších jedinců vede k negativní bilanci kalcia, zhoršení mineralizace kostí a často k výskytu hypokalcemie. Je však nezbytné uvědomit si, že přes negativní celkovou bilanci kalcia v organismu nemusí být hypokalcemie zachycena, protože ve stáří existuje mnoho chorob, které vedou k uvolňování kalcia do oběhu a tím dochází paradoxně k hyperkalcemii, případně se hypokalcemie neprojeví (5).
Hypokalcemie
O hypokalcemii mluvíme, pokud hladina celkového kalcia je menší než 22 mmol/l v plazmě a hladina ionizovaného kalcia menší než 1,1 mmol/l. Ve starších věkových skupinách se vyvíjí osteoporóza i v případě, kdy jsou hladiny sérového kalcia normální, což je způsobeno tím, že se ve vyšším věku mění metabolismus vitaminu D. Při omezení renálních funkcí je porušena tvorba vitaminu 1,25OHD a rovněž klesá absorpce kalcia ze střeva. Vzhledem k tomu, že současně s poruchami příjmu kalcia dochází i k deficitu magnézia, prohlubuje se v organismu s postupujícím věkem tímto mechanismem i deplece kalcia. Hypokalcemie může probíhat i pod obrazem akutního život ohrožujícího stavu s tetaniformními křečemi, karpopedálními spazmy, městnavým srdečním selháním a dysrytmiemi charakterizovanými prodloužením QT intervalu. Latentní sklon ke křečím při hypokalcemii prokazujeme pomocí Chvostkova a Trausseaova příznaku. Příčinu křečí způsobenou deplecí kalcia objektivizujeme stanovením ionizovaného kalcia, fosfatemie a koncentrace PTH v plazmě.
Léčba hypokalcemie
Akutní projevy hypokalcemie, křečové stavy a neuropsychické symptomy léčíme intravenózním podáním 10% kalcium glukonikum v množství 10 ml za 5–10 min. a pokračujeme infuzí 3 ampulí 10% kalcium chloridu v 5% glukóze rychlostí 50 ml/hod. Dále se postupuje podle monitorování hladiny ionizovaného kalcia. V případě, kdy je současně přítomna hypomagnezemie, připojíme parenterální podání magnézia. Doporučuje se současně podání aktivní formy vitaminu D (kalcitriol nebo 1,25OH vitamin D v množství 0,5–2 µg/den).
Hyperkalcemie
Hyperkalcemie je definována jako vzestup celkového korigovaného kalcia většího než 2,63 mmol/l nebo ionizovaného kalcia v plazmě větší než 1,2 mmol/l. Nejčastěji vzniká hyperkalcemie ve stáří při výskytu maligních onemocnění s metastázami do kostí, při léčbě diuretiky thiazidového charakteru, dále při dlouhodobé imobilizaci nemocného a při hypofunkci nadledvinek. Hyperkalcemie u maligních onemocnění se může vyskytnout i bez metastáz do kostí jako součást paraneoplastického syndromu, při kterém se tvoří protein, jenž zčásti funguje jako PTH (PTHrP – parathyreoidrelated protein). U pacientů vyšších věkových kategorií je nutné myslet i na tuberkulózu, která se vyskytuje zejména u starých osob žijících dlouhodobě ve špatných sociálních podmínkách. Hyperkalcemie ve stáří je velmi často přehlédnuta i vzhledem k tomu, že je součástí jiného závažného onemocnění. Typickými projevy hyperkalcemie je anorexie, nauzea až zvracení, zácpa, polyurie, polydypsie. Při pokročilejších stadiích hyperkalcemie patří hypertenze, iritace pankreatu až pankreatitida, vznik peptických vředů, poruchy vědomí, zmatenost až stupor, který může vyústit až v kóma. Je klinická zkušenost, že u některých onemocnění, zejména malignit, které destruují kost a vedou rychle k výrazné hyperkalcemii, je její symptomatologie považována za terminální stav základního onemocnění. Pokud se prokáže hyperkalcemie a je správně a včas léčena, může se stav nemocného natolik zlepšit, že při zvládnutí těžké hyperkalcemie může žít v dobré kvalitě života několik dalších měsíců i déle. Nepoznaná hyperkalcemie způsobena jiným závažným stavem vede k předčasné smrti pacienta, jehož základní onemocnění ve skutečnosti nedospělo k terminálnímu stavu a nerozpoznání této situace je medicínskou chybou.
Léčba hyperkalcemie
U pacientů s projevy dehydratace je prvním opatřením infuze 0,9% NaCl za velmi pečlivé monitorace celkového příjmu infuzí a respektování případně snížené kardiovaskulární výkonnosti u starých jedinců. Po doplnění objemu se doporučuje podat 20–40 mg furosemidu, nikdy však dříve, než je zejména u starších pacientů zajištěna dokonalá náhrada chybějícího extracelulárního objemu. Dalším účinným opatřením je podání kalcitoninu 4 jednotky na kg tělesné hmotnosti každých 12 hodin po dobu 48 hod.
Poruchy metabolismu fosforu ve stáří
Hypofosfatemie
Hypofosfatemie je poměrně častý a mnohdy nepoznaný deficit, jehož výskyt s věkem stoupá. Ve stáří dochází ke snižování schopnosti renální tubulární reabsorpce fosforu, takže snadno dochází k negativní bilanci fosfátu, zejména pokud je snížen jeho příjem, např. při rozvíjející se malnutrici. U malnutričních pacientů se hypofosfatemie často neprojeví, protože při malém obratu nutričních substrátů je i snížena potřeba fosforu pro důležité fosforylační děje včetně tvorby adenozintrifosfátu (ATP). Celotělová významná deplece fosforu se však projeví až v situaci, kdy pacient je intenzivně realimentován a potřeba fosforu se zvýší. V těchto případech se nedostatek fosforu projeví významnými klinickými symptomy. Dochází ke změnám dráždivosti centrálního nervového systému a hlubším poruchám v energetickém metabolismu. Klinicky se deficit fosforu projeví náhlým vznikem agresivity pacienta, jeho zmateností, dochází k prchavým monoparézám, poruchám dýchání, které někdy vyústí až ve stavy apnoe. Porucha vědomí se může rozvinout až do obrazu soporózního stavu, případně kómatu. Jedním z mechanismů, který vede k těmto poruchám, je zhoršená tvorba makroergních fosfátů, ale také nedostatečná tvorba 2,3difosfoglycerátu v erytrocytech, který posunutím disociační křivky hemoglobinu způsobí poruchu přenosu kyslíku vazbou na hemoglobin. Za této situace je kyslík vázán na hemoglobin pevněji a nedojde k jeho uvolnění ani při průchodu tkáněmi s nízkou tenzí kyslíku. Sníží se tím arteriovenózní gradient O2, takže arteriální saturace je přiměřená, avšak přenos kyslíku do tkání je podstatně snížen. Kombinace poruch fosforylace a tvorby makroergních fosfátů současně s defektním přenosem kyslíku do tkání pak vede k zhoršení kontraktility myokardu, rozvoji pestrých neurologických symptomů, poruchám dýchání a celý komplex těchto změn může vyústit ve fatální stav. Hladina plazmatického fosforu je v těchto situacích normální, nebo je pouze lehce snížena, protože předchozí blok fosforylace nevyžadoval větší spotřebu fosfátu. Přehlédnutí tohoto fenoménu a špatná interpretace normálních hladin koncentrace fosforu v plazmě je zásadní medicínskou chybou. Poruchy svalových funkcí, včetně rozvoje rabdomyolýzy svalové slabosti, respirační insuficience a rozvoj neurologické symptomatologie postupují velmi rychle a vyžadují proto urgentní postup.
Léčba hypofosfatemie
Substituce fosforu v urgentních situacích musí být parenterální a používáme k ní anorganickou formu, kterou je12,5% roztok Na2HPO4 nebo K2PO4 podle toho, zda pro nemocného v dané situaci je vhodnější substituovat sodík nebo draslík. Tento koncentrovaný roztok se podává v 5% glukóze nebo 0,45% roztoku NaCl. Při akutních projevech hypofosfatemie je vhodné podat organickou formu fosforu v tukové emulzi, která obsahuje biologicky dobře dostupný fosfatidilcholin a další fosfolipidy, které vstupují rychleji do metabolických dějů než anorganické sloučeniny fosforu.
Hyperfosfatemie
Hyperfosfatemie se nejčastěji vyskytuje u pacientů trpících renálním selháním, kde se hyperfosfatemie podílí na rozvoji renální osteodystrofie. Symptomy závažné hyperfosfatemie jsou podobné jako při hypokalcemii.
Léčba hyperfosfatemie
Zásadním opatřením je restrikce fosforu v dietě podáváním přípravku vázajícího fosfát (kalcium karbonicum, kalcium acetát). Pokud je hyperfosfatemie způsobena renálním selháním, je metodou volby hemodialýza.
Závěr
Poruchy vodní a iontové rovnováhy ve stáří jsou mnohem komplikovanější než u pacientů středního věku a poruchy v této oblasti se významným způsobem podílejí na obrazu „křehkého pacienta“. Hlavní odlišnosti v přístupu k úpravě vodní a iontové rovnováhy proti minulosti tkví v poznatku, že vodní a minerální rovnováha je významným způsobem závislá na vyrovnané nebo pozitivní energetické bilanci a navození anabolického stavu. V případě trvání katabolického stavu je úprava vnitřního prostředí pouhým přívodem vody a iontů neefektivní. Při energeticko-dynamické insuficienci a neschopnosti transmembránových systémů transportovat ionty intracelulárně, případně opačným směrem do extracelulárního prostoru, není možné upravit vodní a iontové hospodářství. Péče o nutriční a energetickou podporu je proto naprosto nezbytnou podmínkou pro zvládnutí minerálního a vodního rozvratu ve všech jeho složkách.
Podpořeno grantem MPO TRIO FV10454.
prof. MUDr. Zdeněk Zadák, CSc.
e-mail: zdenek.zadak@fnhk.cz
Studoval na LF UK v Hradci Králové. Působil jako vojenský lékař, pracoval v izotopové laboratoři Vojenské lékařské akademie v Hradci Králové a ve Vojenském lékařském výzkumném ústavu. Roku 1976 založil na II. interní klinice FN HK metabolickou jednotku intenzivní péče, kterou vedl do roku 1991. Poté se stal přednostou Kliniky gerontologické a metabolické FN HK (nyní III. interní gerontometabolická klinika FN HK). Založil Českou společnost pro parenterální a enterální výživu (nyní Společnost klinické výživy a intenzivní metabolické péče), jejímž byl předsedou do roku 2002. Profesorem pro obor vnitřní lékařství byl jmenován roku 1994. Podílel se na vývoji přípravků pro umělou výživu, aminokyselinových roztoků a tukových emulzí. V roce 2007 byl prezidentem kongresu Evropské společnosti parenterální a enterální výživy (ESPEN) v Praze. V současné době (2019) řešeno 5 grantů (klíčový řešitel) TA ČR, MPO. Spoluautor 13 užitných vzorů, 10 patentů, 1 prototypu. Je zakladatelem Nadace pro rozvoj v oblasti umělé výživy, metabolismu a gerontologie. V současné době vede Centrum pro výzkum a vývoj LF UK a FN HK.
Sources
1. Zadák Z. Výživa v intenzivní péči. 2. rozšíř. aktual. vydání. Praha: Grada 2008.
2. Zadák Z, Tichá A, Hyšpler R. Poruchy vodní a iontové rovnováhy ve stáří. Vnitřnílékařství 2018; 64(11): 1059–1066.
3. Kaška M, Zadák Z, Živný P, et al. Vliv vysokého věku na vnitřní prostředí operovaných. In: Stárnutí populace – důsledky pro současnou medicínu. Česká gerontologická a geriatrická společnost ČLS JEP: Praha 2003.
4. Kazda A. Vnitřní prostředí I – voda, ionty, osmolalita. In: Kazda A. Kritické stavy. Metabolická a laboratorní problematika. Praha: Galén 2012.
5. Zadák Z. Léčba hyperkalcemie. Medicína po promoci 2005; 6(1): 42–44.
6. Zadák Z,Tichá A, Hyšpler R. Suplementace hořčíku – farmakologické mechanismy, metody podání a pasti. Klinická farmakolologie a farmacie 2017; 31(3): 16–18.
7. Hyspler R, Ticha A, Svobodová I, et al. Evaluation of magnesium deficiency in the Czech population and the influence of supplementation by magnesium-rich mineral water. Clinical Nutrition Suppl 2012; 7, Supl 1 : 255–256.
8. Zadák Z, Havel E. Intenzivní medicína na principech vnitřního lékařství. 2. dopl. a přeprac.vydání. Praha: Grada 2018.
9. Lobo DN, Lewington AJP, Allison SP. Basic Concepts of Fluid and Electrolyte Therapy. Melsungen: Bibliomed-Medizinische Verlagsgesellschaft 2013.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2019 Issue 2-
All articles in this issue
- Editorial
- Specifics of acute urological care in elderly patients
- TRUS/MRI fusion prostate biopsy in patient over 65 years – results and complication rate analysis.
- Are robot-assisted radical prostatectomies safe in patients over 65?
- Risk and complications of the robotic partial nephrectomy in patients in age over 65 years
- The treatment of the water and electrolyte disturbances in geriatric patients.
- A Geriatrician in a General Practitioner´s Shoes
- Ohlédnutí za Celostátním gerontologickým kongresem
- DIABETES MELLITUS LÉČBA U STARŠÍCH PACIENTŮ V ČR. Doporučený diagnostický a terapeutický postup pro všeobecné praktické lékaře
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Risk and complications of the robotic partial nephrectomy in patients in age over 65 years
- The treatment of the water and electrolyte disturbances in geriatric patients.
- TRUS/MRI fusion prostate biopsy in patient over 65 years – results and complication rate analysis.
- Are robot-assisted radical prostatectomies safe in patients over 65?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career