-
Medical journals
- Career
Bezkrevní klinické postupy pro zvládnutí závažné anemie a krvácení
Authors: J. Slipac
Authors‘ workplace: Canadian Medical s. r. o., Brno
Published in: Prakt. Lék. 2021; 101(5): 240-250
Category: Reviews
Overview
Pro pacienty, kteří si přejí bezkrevní léčbu, byly během let vypracovány komplexní klinické postupy, jejichž účelem je omezení krevních ztrát, šetření autologní krví, stimulace krvetvorby a lepší tolerance anemie. V tomto přehledu probereme několik osvědčených strategií pro oblast perioperačního managementu, akutní krevní ztráty, úrazu a porodnictví. Při uplatnění těchto strategií přežívají a uzdravují se bez podání alogenní krve i pacienti s extrémně nízkou hladinou hemoglobinu. Navíc zkušenosti získané z bezkrevní léčby vydláždily cestu k rozvoji konceptu Patient Blood Management, který se stal standardem úspěšné léčby všech pacientů, tedy nejen těch, kterým krev podat nemůžeme.
Klíčová slova:
krvácení – anémie – bezkrevní klinické postupy – Patient Blood Management
ÚVOD
Pacienti vyžadují bezkrevní léčbu z různých důvodů, nejčastěji z náboženských, ale můžeme se setkat také s pacienty, kteří odmítají transfuze z obavy z rizik s nimi spojenými, případně s pacienty, u kterých je transfuze jednoznačně kontraindikována. Evropskou komisí je podporovaný program Patient Blood Management (PBM), který je v mnoha zemích již běžně a úspěšně používaný, a jemu je bezkrevní léčba hodně podobná (40). Důraz je především kladen na optimalizaci hematopoézy ke zvýšení hladiny hemoglobinu, minimalizaci krevních ztrát, zlepšení hemostázy a poskytnutí podpůrné léčby s cílem minimalizovat spotřebu a maximalizovat využití kyslíku. Stále více také nabývá na významu autonomie pacienta, jeho práva a informovaný souhlas s léčbou. Hlavním cílem tohoto článku je poskytnout lékařům praktické vodítko, které jim pomůže být na optimální bezkrevní léčbu závažné anemie a krvácení lépe připraveni.
OBECNÉ PRINCIPY BEZKREVNÍ LÉČBY
Praktické poznámky
Pacienti vyhledávají bezkrevní léčbu z různých důvodů a nejznámější skupinou jsou svědkové Jehovovi, kteří odmítají krev na základě svého pevného náboženského přesvědčení. Setkáváme se ale také s pacienty, kteří odmítají transfuze z obavy z rizik s nimi spojenými, s pacienty, u kterých je transfuze jednoznačně kontraindikována, a s pacienty, kteří bezkrevní léčbu preferují jen do určité míry. V případech závažné anemie nebo nadměrné krevní ztráty může dojít mezi lékaři a těmito pacienty ke střetu pevně zakořeněných postojů. Na jedné straně pacienti krev a její hlavní složky striktně odmítají, na straně druhé lékaři tradičně považují krev k záchraně života za nezbytnou. Tento konflikt může nakonec vést k ohrožení života pacienta nebo dokonce i k jeho ztrátě. Pacienti odmítající transfuzi nicméně dychtivě až zarputile vyhledávají všechny jiné moderní způsoby léčby. Péče o tyto pacienty pochopitelně vyžaduje rozdílný přístup, než je obecně přijatým standardem. Bohužel je stále časté, že místo toho, aby se vynaložilo úsilí k vyřešení této nelehké situace, se těmto pacientům léčba buď zcela odepře, nebo jsou tito pacienti nuceni, aby přijali léčbu proti své vůli. Mnohem konstruktivnější je přetavit konflikt ve spolupráci, a tak najít společné řešení, které povede k dobrým výsledkům a současně bude respektovat přání pacientů a jejich hodnoty.
Během let byly pro tyto pacienty vypracovány komplexní strategie léčby, které se ve světě jako celek nazývají Program bezkrevní medicíny a chirurgie (Bloodless Medicine and Surgery – BMS) (14, 30, 34, 38). Ústředními body tohoto programu je optimalizovat hematopoézu ke zvýšení hladiny hemoglobinu, minimalizovat krevní ztráty (např. omezením krevních ztrát a omezením zbytečných diagnostických odběrů krve), zlepšit hemostázu a poskytnout podpůrnou léčbu k minimalizaci spotřeby a maximalizaci využití kyslíku. Velmi důležité je pečlivé naplánování léčby předem (např. při elektivní operaci, porodu a chemoterapii), a to s ohledem na očekávané události spojené s krevní ztrátou a anemií. Pečlivý a včasný screening anemie a její léčba a také brzké vyjádření přání pacienta ohledně krevní transfuze a její zřetelný zápis do zdravotnické dokumentace jsou pro úspěšnou práci multidisciplinárního týmu nezbytné.
S léčbou těchto pacientů mají zkušenosti lékaři i u nás, avšak ne v takovém rozsahu jako ve větších zemích (16). Proto je prospěšné zahraniční zkušenosti využít, zvláště když jsou volně dostupné (12). Jaké jsou výsledky? Vysoce kvalitní studie na toto téma (převážně retrospektivní kohortové studie s kontrolními skupinami, často na poli kardiochirurgie, tedy oboru s velkými krevními ztrátami) ukázaly, že bezkrevní léčba vede k podobným klinickým výsledkům, co se týká morbidity a mortality, jako tradiční léčba, a v některých ohledech i lepším (20, 34, 35, 46, 49).
Ne všichni pacienti, kteří odmítají krevní transfuzi, odmítají stejné krevní přípravky. Každému pacientovi by se tedy mělo předem jasně vysvětlit, o kterých konkrétních krevních přípravcích lékařský tým uvažuje, že budou během operace nebo po ní potřebné, jaká jsou jejich rizika, jaké riziko přináší jejich odmítnutí a jaké alternativy jsou dostupné. Získání dříve vysloveného přání a informovaného souhlasu o tom, co je a co není přijatelné, by se mělo provést co nejdříve, aby se tomu mohl léčebný plán přizpůsobit. Ve zdravotnické dokumentaci to bude jasně a zřetelně uvedeno.
Pacienti vyžadující bezkrevní léčbu obvykle nepřijímají transfuzi plné krve a jejích základních složek, tedy červených krvinek, bílých krvinek, plazmy a krevních destiček. Nepřijatelný je obvykle také předoperační odběr krev k autotransfuzi. Někteří budou souhlasit s přípravky, které jsou deriváty základních složek. Možná tedy přijmou takové přípravky, jako je kryoprecipitát, koncentrát fibrinogenu, koncentrát protrombinového komplexu (PCC), fibrinová lepidla, destičkový gel a roztoky lidského albuminu. Mezi postupy některými pacienty akceptované patří akutní normovolemická hemodiluce, rekuperace krve během operace nebo po ní, hemodialýza, mimotělní oběh a extrakorporální membránová oxygenace (ECMO). Přehled uvádí tabulka 1.
Table 1. Doporučené položky do formuláře zjišťujícího přípravky a postupy přijatelné pro pacienta 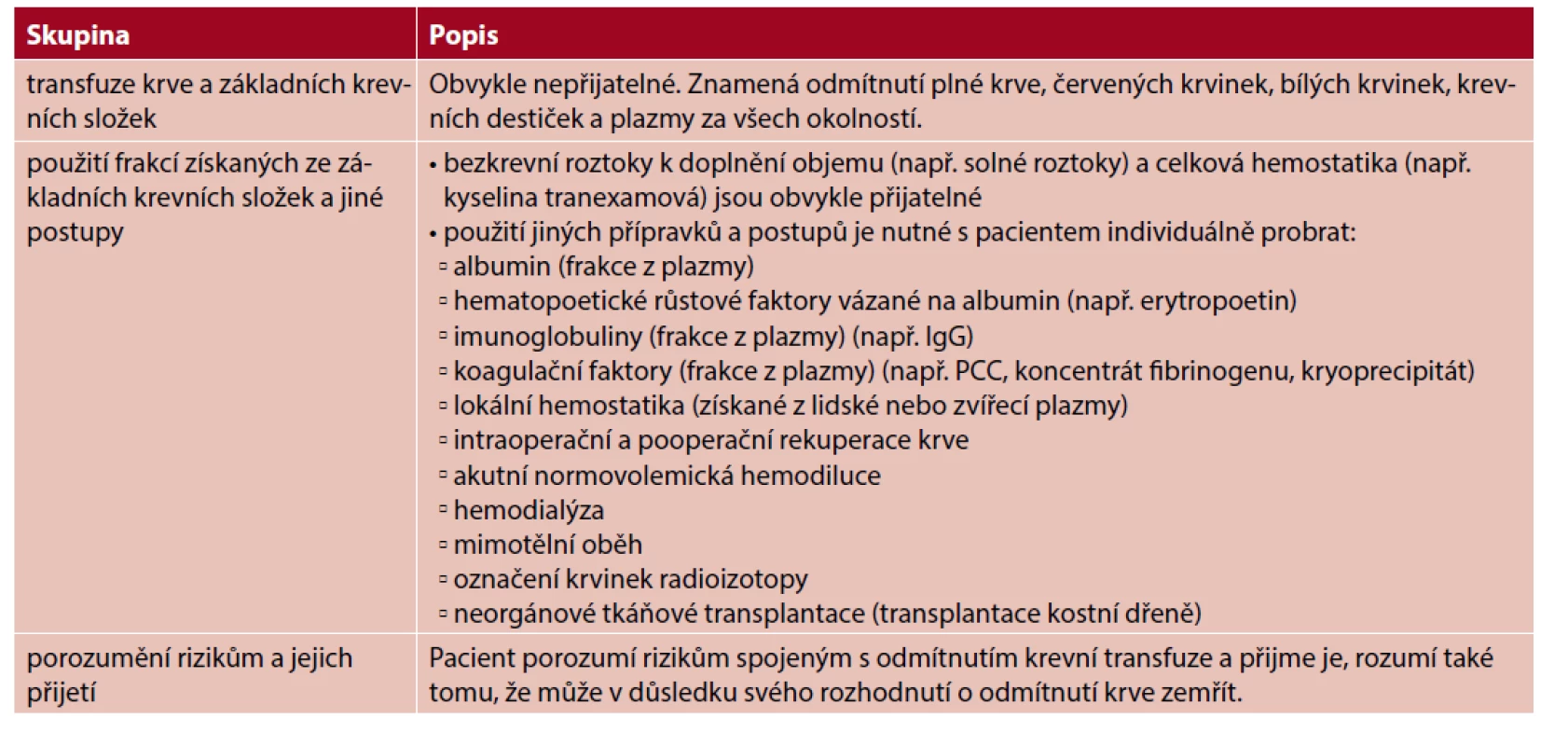
MANAGEMENT ZÁVAŽNÉ ANEMIE
Stále není zcela jasné, od jaké hodnoty hemoglobinu (Hb) u pacientů morbidita a mortalita výrazně roste. Existují totiž zprávy o pacientech, kteří s malými nebo žádnými následky přežili při tak nízké koncentraci Hb, jako je 20 g/l, zatímco jiní s Hb v rozmezí 50–60 g/l nepřežili (36). Zdá se pravděpodobné, že takzvaný kritický Hb se liší od pacienta k pacientovi v závislosti na jeho individuálních požadavcích na kyslík, na jeho adaptivní reakci na anemii a na jeho rezervní kapacitě na úrovni různých orgánů a buněk. Tato hodnota Hb se také může u stejného pacienta měnit v závislosti na objemu plazmy a dalších faktorech.
Pokud jde o pacienty, kteří nepřijímají krevní transfuzi, je velmi důležité porozumět jejich individuální reakci na anemii. Pro přežití těchto pacientů s život ohrožující anemií je využití znalostí fyziologie nezbytné. U zdravých jedinců v klidu je obsah kyslíku dopravený do tkání normálně nejméně čtyřikrát větší než obsah aktuálně v tělesných tkáních skutečně využitý. Jinými slovy, poměr dodávky kyslíku (DO2) k jeho spotřebě (VO2) je normálně udržován na poměru 4 : 1. Nicméně v určitých patofyziologických stavech, např. při těžké anemii, při srdečním selhání nebo závažném ARDS, je tento poměr narušen. Je-li poměr DO2 : VO2 menší než 2 : 1, VO2 se může stát závislým na DO2 a projeví se neschopností udržet v tkáních metabolismus závislý na kyslíku, což vede k anaerobnímu metabolismu a šoku (41). Je důležité si připomenout, že DO2 je produktem obsahu kyslíku v arteriální krvi a rychlosti toku krve, který je představovaný srdečním výdejem. Při kritické anemii tělo kompenzačně zvyšuje srdeční výdej, a to převážně zvýšením srdeční frekvence a současně snížením systémové cévní rezistence. Normálně je jen nepatrné množství kyslíku rozpuštěno v plazmě, obecně méně než 1 % celkového obsahu kyslíku v arteriální krvi, a většina kyslíku transportovaného do tkání je vázána na hemoglobin. Prakticky vyjádřeno, určující hodnotou pro obsah kyslíku v krvi je koncentrace hemoglobinu. Pokud by hemoglobin neexistoval vůbec a tělo bylo závislé na rozpuštěném kyslíku, dostačující srdeční výdej k udržení adekvátní DO2 by musel být okolo 300 l/min, což je fyziologicky nemožné.
Publikovaná data naznačují, že spotřeba kyslíku (VO2) se stává závislou na dodávce (DO2) při hladině Hb v rozmezí 45–40 g/l (34), a to může být tedy hladina, při které se objevují známky klinického šoku (např. symptomy kriticky narušené dodávky kyslíku vedoucí nakonec k orgánové dysfunkci). Potom je nezbytné přistoupit k agresivním protektivním postupům, aby se poměr DO2 : VO2 zvýšil. Pokud se zaznamená aktivní krvácení, musí se bez odkladu vynaložit všechno úsilí na odhalení jeho zdroje a jeho zastavení, což je logickým postupem u všech pacientů bez ohledu na to, jestli krev přijímají, nebo ne.
Je nezbytné zajistit dostatečný oběhový objem, aby se zachovala perfuze, protože většina orgánů jen chabě prospívá, pokud je anemie doprovázena hypovolemií (15). Je nutné poznamenat, že plíce jsou velmi citlivé na nadměrnou hydrataci, a tak by se kvůli správné funkci plic mělo obou extrémů vyvarovat (1). Zvětšení oběhového objemu zředí Hb a dočasně sníží jeho koncentraci, ale nesníží masu červených krvinek v oběhu, což může být zavádějící, pokud se lékař soustředí jen na hodnotu Hb. Výběr roztoků je v této situaci méně kontroverzní než v jiných, protože zde upřednostňujeme efekt zvýšené viskozity na udržování dodávky kyslíku a zachování funkční kapilární denzity (FCD), a to podle dostupných studií poskytuje hydroxyetylškrob (HES) (25). Obávaný je negativní vliv HES na koagulaci. I když se in vitro efekt HES na koagulaci nemusí nezbytně převést na in vivo efekt, některé studie informují o souvislosti mezi použitím HES a zvýšeným krvácením (44). Mnohé z těchto studií jsou ale observační (což komplikuje rozlišení mezi krvácením vyvolaným HES a HES podaným jako reakci na krvácení) a data jsou stále kontroverzní (47). Na druhé straně HES se ukázal jako přínosný pro obnovení krevního toku v mikrocirkulaci. Pokud se však potřebujeme vyhnout negativnímu účinku na koagulaci, upřednostníme balancované roztoky želatiny (4, 43). Každá krevní ztráta vede ke ztrátě železa, a proto je doplnění železa pro obnovu Hb zcela nezbytné a přidání látek stimulujících erytropoézu (ESA) kompenzační odpověď na anemii maximalizuje (2, 17).
Při život ohrožující anemii je zásobování kyslíkem silně omezeno. Pakliže kyslík vázaný na Hb v krvi výrazně poklesne, nabývá na významu kyslík rozpuštěný v plazmě, který může při zvýšení parciálního tlaku kyslíku (PaO2) nyní představovat až 30 nebo více procent dodávky kyslíku (8). Protože se objevují zprávy o zhoršení klinického stavu pacientů při hyperoxii, je rozumné, aby cílový PO2 byl natolik vysoký, že zajistí adekvátní množství kyslíku rozpuštěného v plazmě, a současně nebyl vysoký příliš, aby neúměrně zvýšil riziko poškození (11). Přijatelným limitem může být PO2 okolo 250 Torr (33,3 kPa).
Během těžké anemie je zajištění podpůrné léčby nezbytné (tab. 2). Obavy ohledně vysoké koncentrace vdechovaného kyslíku jsou u této populace obecně zveličovány a u každého nového plicního infiltrátu by se mělo uvažovat o souvislosti s infekcí nebo tekutinami.
Table 2. Návrh protokolu managementu závažné anemie u pacientů, kterým nelze podat krev 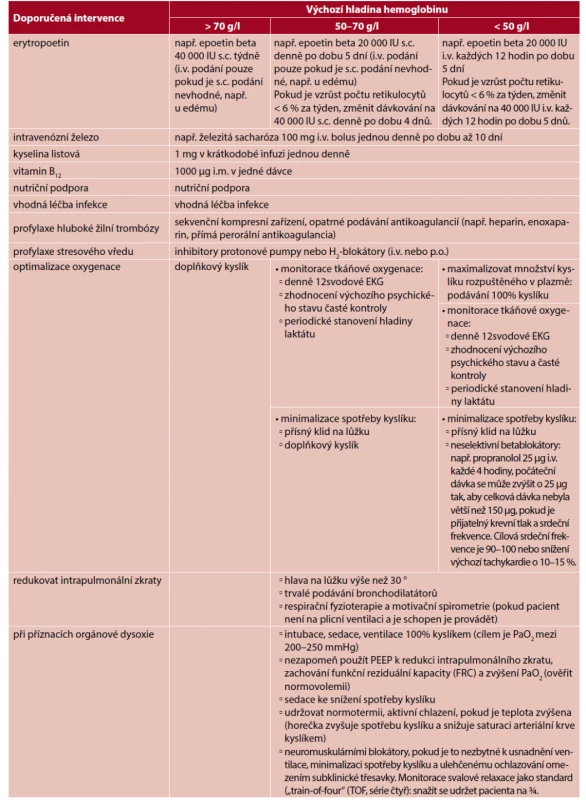
Horečka se musí léčit, protože jinak zvyšuje srdeční frekvenci. Ochlazování sice může snížit spotřebu kyslíku, ale pokud vede ke třesavce, nakonec se spotřeba kyslíku zvýší a ochlazování také může vést ke koagulopatii. Podání nízké dávky neselektivního betablokátoru může pomoci snížit srdeční frekvenci a další projevy tachykardie, které mají na srdeční výdej minimální účinek. Navíc tyto látky blokují konverzi T4–T3, čímž se metabolické požadavky snižují (37). Neselektivní betablokátory v této situaci ale musíme podávat opatrně, protože vyšší dávka může mít negativní dopad na srdeční výdej a povede k hypoxii koncových orgánů, např. mozku. Umělá plicní ventilace (řízená ventilace u pacientů na sedaci nebo podpůrná ventilace) je dalším postupem, který pomáhá snížit respirační zátěž a s tím spojenou spotřebu kyslíku.
Po celou dobu je zásadní vyvarovat se opakovaných odběrů krve. Mnohé z nich nakonec totiž nejsou pro určení léčby nebo její změnu nezbytné. Point-of-care testování (POCT) u ventilovaných pacientů vyžaduje jen malé množství krve (kapky nebo mililitry) a může se provádět denně, abychom se ujistili, že oxygenace je adekvátní, pH je normální pro uvolňování kyslíku a že další parametry reagují na léčbu. Úplný krevní obraz s retikulocyty, frakcí nezralých retikulocytů a obsahem hemoglobinu v retikulocytech (vypočítaná hodnota) by se měl provádět 18–24 h po započetí podávání železa nebo ESA, aby se ozřejmila odpověď na léčbu (tab. 3). Další laboratorní vyšetření by se mělo provádět, jen pokud je absolutně nezbytné. Pokud není indikováno jinak, časné ukončení ventilace a extubace jsou doporučovány při Hb nad 45 g/l a dostatečné produkci retikulocytů. Hodnocení psychického stavu je také velmi důležité, protože jakákoliv doprovodná somnolence nebo oslabení porozumění znamenají, že spotřeba kyslíku se stává závislou na dodávce, a tento stav se musí rychle a efektivně zvrátit.
Table 3. Návrh rozvrhu laboratorních vyšetření pro management závažné anemie u pacientů, kterým nelze podat krev 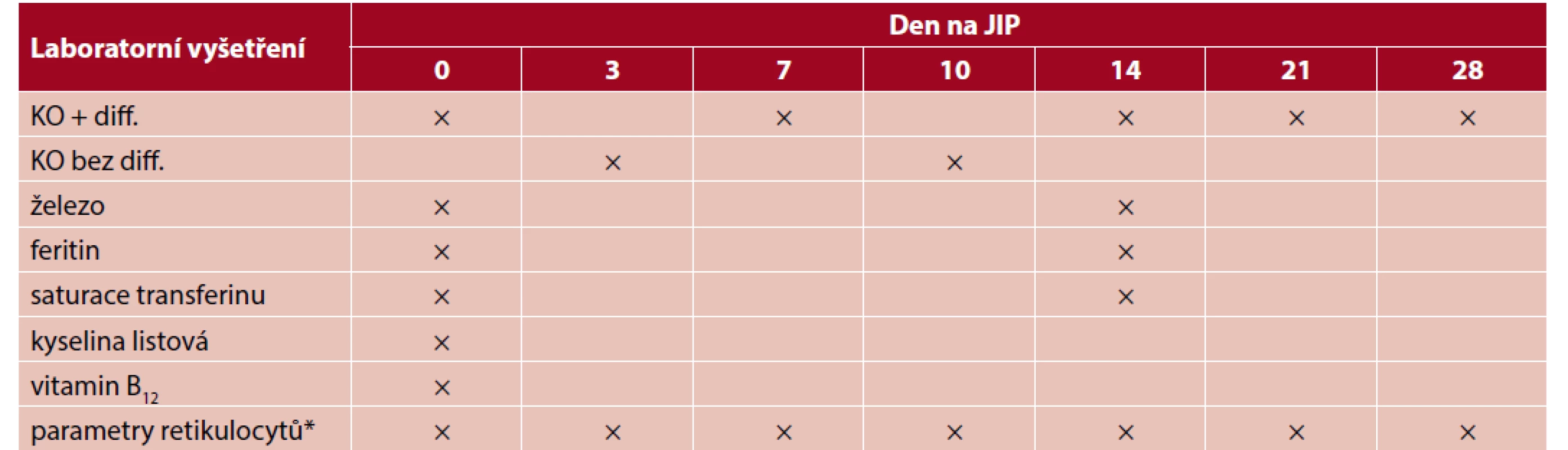
*parametry retikulocytů: absolutní a relativní počet, obsah hemoglobinu v retikulocytu, frakce nezralých retikulocytů.
Pozn.: Odběry krve na všechna laboratorní vyšetření se provádějí pouze za použití zkumavek pro novorozence, aby se minimalizovalo plýtvání krví. Nepřijatelný je rutinní režim odběrů (konečné rozhodnutí je vždy na ošetřujícím lékaři), s výjimkou stanovení krevních plynů jednou denně u intubovaných pacientů na plicní ventilaci.Lze očekávat, že na tuto léčbu bude dobře reagovat mnoho pacientů. Pokud však léčba není úspěšná, bylo by vhodné ke zvýšení dodávky kyslíku zvážit podání umělých přenašečů kyslíku, ale ty u nás nejsou dostupné. S jejich pomocí je možné překlenout dobu těžké anemie, dokud pacientova kostní dřeň neprodukuje dostatek červených krvinek (22).
KLINICKÉ POSTUPY PRO PLÁNOVANÉ OPERACE
Většina perioperačních bezkrevních postupů je součástí programu Patient Blood Management (PBM), který se již úspěšně a běžně v mnoha zemích používá (41). Pro úspěšnou léčbu je nezbytné být s tímto programem dobře seznámen a jednotlivé postupy a metody důsledně využívat. Základní principy jsou uvedeny v tabulce 4. Cílem je, aby se předešlo situaci, kdy by byla krevní transfuze indikována.
Table 4. Perioperační bezkrevní postupy 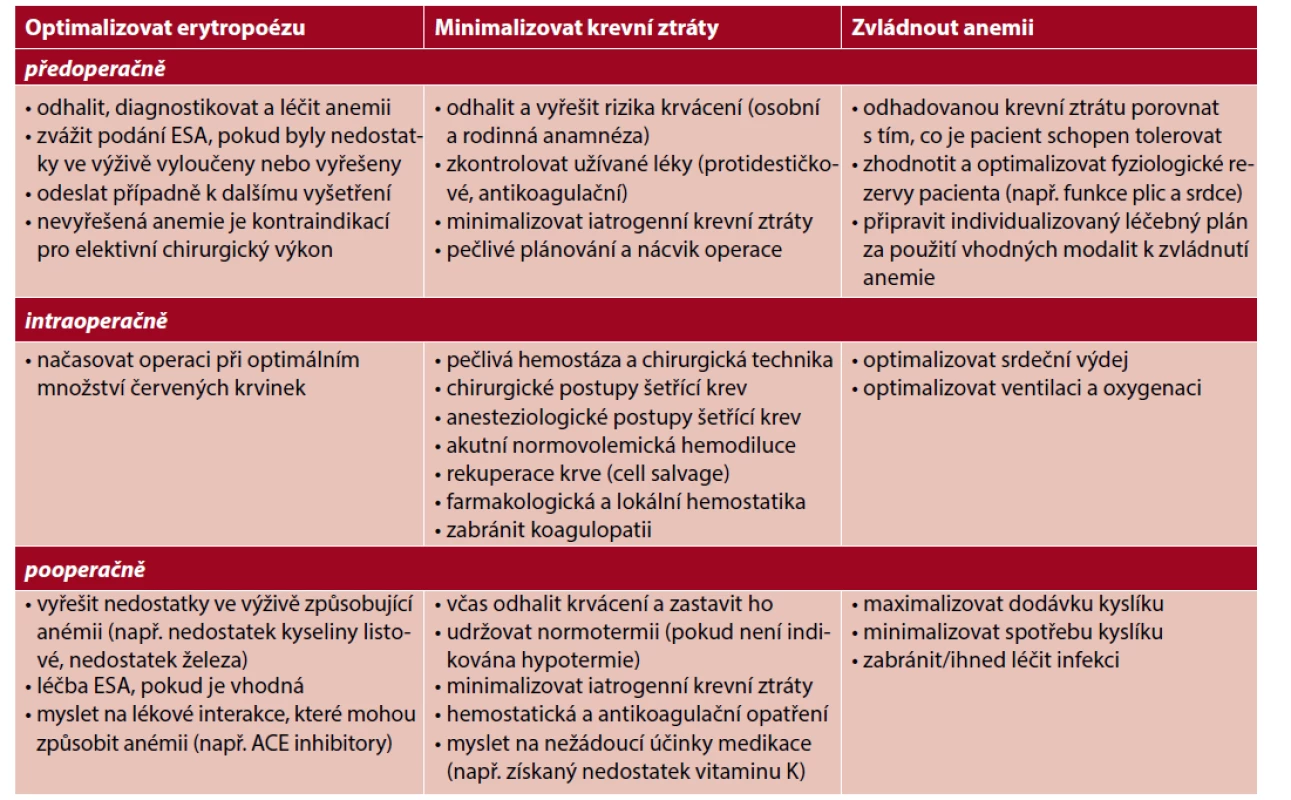
Předoperační plánování a optimalizace
Před operací by se mělo pacientům jasně vysvětlit, o kterých krevních přípravcích lékařský tým uvažuje, že budou během operace nebo po ní potřebné, jaké riziko přináší jejich odmítnutí a jaké jsou dostupné alternativy a postupy šetřící pacientovu krev. Ve zdravotnické dokumentaci se musí jasně zaznamenat, se kterými léčebnými postupy a přípravky pacient souhlasí a se kterými nesouhlasí. Předoperační multidisciplinární diskuze k naplánování postupů je klíčová a měli by se jí minimálně účastnit zkušený chirurg, zkušený anesteziolog a zkušený hematolog (14).
Zcela zásadní úlohu pro úspěšný výsledek operace hraje odhalení, diagnostika a léčba předoperační anemie. Pokud se očekává krevní ztráta větší než 500 ml a hemoglobin pacienta je nižší než 130 g/l nebo se odhalí nedostatek železa, je nutné zahájit léčbu pomocí přípravků i.v. železa a erytropoetinu, a to nejlépe 4 týdny před plánovanou operací. Podrobnosti léčby předoperační anemie již byly dostatečně publikovány (23, 42). Algoritmus diagnostiky anemie uvádí schéma 1.
Schéma 1 Algoritmus diagnostiky perioperační anemie 
TSAT – saturace transferinu, CRP – C-reaktivní protein Obdobně je nutné včas odhalit a náležitě upravit předoperační koagulopatii. Zvláštní pozornost by se měla věnovat rozumnému přerušení jakékoliv farmakologické léčby, která narušuje funkci koagulace a krevních destiček.
Hlavním kompenzačním orgánem při velké krevní ztrátě s následnou závažnou anemií je srdce (zvýšení srdečního výdeje), které je také orgánem s největším rizikem anemické hypoxie. Proto je nezbytné předoperačně diagnostikovat a léčit každé kardiovaskulární onemocnění a do dne operace maximálně zlepšit funkci srdce. To stejné platí pro funkci plic. Při zhoršování anemie roste pro zajištění tkáňové oxygenace úloha fyzikálně rozpuštěného kyslíku (O2) v plazmě a maximální využití supranormálních inspiračních frakcí O2 vyžaduje optimální funkci dýchacího systému.
Intraoperační péče
K omezení operačních krevních ztrát lze využít různé chirurgické a anesteziologické postupy, které jsou součástí programu Patient Blood Management. Přehled možností minimalizace operačních krevních ztrát uvádí tabulka 5.
Table 5. Možnosti minimalizace operačních krevních ztrát 
Nejúčinnějším postupem zůstává rychlá a zručná chirurgická technika zkušeného chirurga. Výhodné je použití minimálně invazivních postupů, vhodná volba typu anestezie (preference regionální spíše než celkové), atraumatické disekce tkání a účinné, pečlivé a časné stavění i malých zdrojů krvácení (např. koagulace argonovým paprskem, fibrinová lepidla, lokální hemostatika) (39). Při řízené hypotenzní anestezii se farmakologicky snižuje systolický tlak na 80–90 mmHg nebo střední arteriální tlak na 50 mmHg, čímž se redukují arteriální krevní ztráty v operačním poli.
Akutní normovolemická hemodiluce (ANH) je postup, při kterém se krev předoperačně odebere a je nahrazena krystaloidy nebo koloidy. To umožňuje, že další krevní ztráty obsahují v jednotce objemu méně červených krvinek a předem odebraná krev může být podle potřeby znovu podána. Oproti krvi ze cell saveru je výhodou této krve, že obsahuje plně funkční trombocyty a koagulační faktory (33).
Intraoperační rekuperace krve se skládá ze sběru, promývání, filtrace a retransfuze autologní krve přímo nasávané z operačního pole (26). Takto připravené jednotky červených krvinek mají vysoký hematokrit, ale jsou zcela zbaveny koagulačních faktorů a krevních destiček. S patřičnými úpravami (např. použití leukofiltru) lze výhodně použít rekuperaci krve také při onkologických operacích (50).
Pozornost je třeba věnovat managementu koagulace (schéma 2), který začíná zajištěním a udržením základních podmínek hemostázy, tedy normotermie, normálního pH a dostatku kalcia. Hypotermie negativně ovlivňuje jak funkci destiček, tak koagulačních faktorů a zvyšuje fibrinolýzu. Metabolická acidóza ke zhoršení koagulace dále přispívá, takže je třeba dbát na udržování normotermie účinným zahříváním pacienta i infuzních roztoků, acidózu účinně korigovat a hladinu ionizovaného kalcia udržovat v normálním rozmezí.
Schéma 2 Pyramida bezkrevního managementu koagulace v závislosti na intenzitě krevní ztráty 
FVIII – koagulační faktor VIII, FFP – čerstvě zmražená plazma, PCC – koncentrát protrombinového komplexu, rFVIIa – rekombinantní aktivovaný faktor VII Při významných krevních ztrátách dáváme přednost infuzním roztokům, které mají nejmenší negativní účinek na koagulaci. Tekutinovou resuscitaci se doporučuje zahájit podáním balancovaných roztoků krystaloidů a při nutnosti použití syntetických koloidů upřednostňujeme balancované roztoky želatiny. Pro tvorbu stabilní hemostatické zátky rezistentní k předčasné fibrinolýze je nutné dostatečné množství trombinu, pro jehož vznik je nezbytný především dostatek fibrinogenu. Doplnění objemu při krevních ztrátách způsobuje diluci všech složek koagulace a nakonec vede k diluční koagulopatii. První koagulační faktor, který klesne pod požadovanou hodnotu, je právě fibrinogen. Jeho nedostatek je nutné včas a dostatečně nahradit. K identifikaci a cílené léčbě koagulačních poruch se doporučuje využít viskoelastometrických metod. Podání kyseliny tranexamové intravenózně je bezpečné a účinné, nezvyšuje riziko tromboembolických příhod a je již standardním postupem (19, 29, 45). Terapeutické podání desmopresinu mobilizuje dostupný faktor VII, zvyšuje aktivitu von Willebrandova faktoru a stimuluje agregaci destiček. Stabilita sraženiny se může přídavně zvýšit podáním koncentrátu faktoru XIII. V případě masivního krvácení se může zvážit „off-label“ podání rekombinantního faktoru VIIa (13).
Pooperační péče
Pacienti se závažnou pooperační anemií (Hb < 50–60 g/l u mladých zdravých pacientů, Hb < 80 g/l u starších pacientů s kardiopulmonálním onemocněním) by měli být sledování na jednotkách intenzivní péče. K cílům pooperační péče patří minimalizovat pokračující krevní ztráty, podporovat hemostázu, vyřešit poruchy koagulace a optimalizovat dodávku a spotřebu kyslíku. Pokud se anemie zhorší, musí se včas přistoupit k operační revizi a zvážit navození celkové anestezie, intubaci, hyperoxickou ventilaci a svalovou relaxaci. Co nejdříve je třeba optimalizovat koagulaci a zahájit antifibrinolytickou léčbu. Pokud je to možné, provádíme rekuperaci krve z drénů. Zcela nezbytné je omezit laboratorní odběry krve na minimum a používat odběrové zkumavky s malými objemy (pediatrické, POCT). Erytropoézu posílíme podáváním i.v. železa, erytropoetinu, vitaminu B12 a kyseliny listové (14, 24).
Na případ akutní krevní ztráty je třeba být dobře připraven, reagovat rychle a využít včas všechny dostupné metody šetření krví a posílení pacientovy erytropoézy (38). Možný algoritmus představuje schéma 3.
Schéma 3 Postup managementu akutní pooperační krevní ztráty 
ESA – látky stimulující erytropoézu, HBOC – umělé přenašeče kyslíku na bázi hemoglobinu,
PCC – koncentrát protrombinového komplexu, rFVIIa – rekombinantní aktivovaný faktor VIIMANAGEMENT ÚRAZOVÉHO KRVÁCENÍ
Celkově je postup při traumatickém krvácení podobný jako u akutní perioperační krevní ztráty, jak bylo již probráno výše. Je třeba pečlivě provést všechny pro pacienta přijatelné postupy podle vydaných doporučení pro zvládnutí krvácení a koagulopatie při traumatu (4, 43). Nestabilní pacienti se závažným krvácením vyžadují bezprostřední urgentní zákroky a plýtvání drahocenným časem na přesvědčování, aby přijali krev, a neznalost bezkrevních postupů může zpozdit potřebné intervence natolik, že ohrozí život pacienta. Zásadní pro úspěšnou léčbu je co nejrychlejší zastavení krvácení. Prioritami jsou postupy zahrnující tzv. damage control surgery (fázové ošetření nitrodutinových poranění a poranění končetin) a dosažení chirurgické kontroly zdroje krvácení. Doporučuje se zvážit možnost a proveditelnost ošetření lokalizovaného zdroje krvácení metodami intervenční radiologie.
K identifikaci typu koagulační poruchy při traumatem indukované koagulopatii (trauma induced coagulopathy) a k její monitoraci je výhodné použít viskoelastometrické metody (ROTEM, TEG). Připomeneme nutnost časného podání dostatečného množství fibrinogenu a kyseliny tranexamové, jejíž účinnost je nejvyšší při podání do 1 hodiny od úrazu, podání po 3 hodinách od traumatu již není efektivní (6, 31). Použití rekombinantního lidského aktivovaného faktoru VII (rFVIIa) u traumatu patří do kategorie tzv. off-label podání. Faktor VIIa aktivuje faktor IX a X i bez přítomnosti tkáňového faktoru, a tak dochází k překlenutí nedostatečné tvorby trombinu. Jedná se o lék vysoce účinný a bezpečný (avšak s relativně krátkým poločasem asi 3–4 h) a jeho účinek není ovlivněn hypotermií. Má výrazné synergické účinky s antifibrinolytiky. V případě jeho podání je vhodné nečekat na rozvoj hemoragického šoku, podat zavčas dostatečnou dávku (100–200 μg/kg) a při nedostatečném efektu dávku zvýšit (5, 13).
Po zástavě krvácení je nutné pečlivě využít postupy výše uvedeného managementu závažné anemie a podniknout všechny kroky k prevenci recidivy krvácení a možných komplikací souvisejících s léčbou koagulační poruchy, tedy zahájit mechanickou a farmakologickou profylaxi hluboké žilní trombózy co nejdříve. Lékaři obecně mají z léčby pacientů s velkými poraněními, kteří nepřijímají krev, obavy. Nicméně data z retrospektivních studií ukazují na podobné výsledky v mortalitě i morbiditě jako u pacientů, kteří krev přijímají (10, 48).
MANAGEMENT PERIPARTÁLNÍ HEMORAGIE
Peripartální krvácení (postpartum hemorrhage – PPH) je celosvětově hlavní příčinou mateřské mortality, je nevyzpytatelné a těžko předvídatelné, protože se z 60 % vyskytuje u žen bez rizikových faktorů. Zvlášť důležité je se na něj dobře připravit u pacientek, kterým nemůžeme podat krev. Tyto pacientky by měly porod plánovat v zařízeních, která mají s vysoce rizikovými těhotenstvími zkušenosti a která jsou ke zvládání PPH a dalších komplikací vybavena. Již při prvním vyšetření v těhotenství by ženy měl být informovány o jejich zvýšeném riziku morbidity a mortality spojeném s PPH, o postupech ke snížení rizika PPH a o dostupné léčbě (včetně poporodní hysterektomie).
Rizikovým faktorem, který lze účinně odstranit, je předporodní anemie, která se u nás vyskytuje asi u 20 % žen. Pro korekci anemie lze použít podobný algoritmus jako pro korekci předoperační anemie, při nedostatku železa využít účinné podání i.v. přípravků železa a nezapomenout na negativní vliv častého užívání antidepresiv u žen.
Stejně jako u každého akutního krvácení hraje při zvládnutí PPH klíčovou úlohu čas. Opožděná rozhodnutí o účinných intervencích a nesprávně stanovená velikost krvácení vystavují pacientku vážnému riziku a jsou hlavními přispěvateli poporodní mortality. Takže dobře vypracovaný plán, jehož rychlá a účinná realizace je pečlivě a dostatečně nacvičena, může zachránit život bez ohledu na to, zda pacientka přijímá nebo nepřijímá krevní transfuzi. Zásady úspěšné bezkrevní léčby uvádí tabulka 6. Většina vydaných doporučení se může použít i u pacientek, kterým nemůžeme podat krev (3, 27, 28). Do managementu PPH obvykle patří doplnění objemu i.v. roztoky, uterotonika (nejčastější příčina PPH je atonie dělohy), sešití lacerace genitálu a manévry včetně masáže dělohy. Připomínám nutnost náhrady fibrinogenu v dostatečné dávce (21) a časné podání kyseliny tranexamové, jejíž účinnost a bezpečnost již byla dostatečně ověřena a její profylaktické podání je efektivní při císařském řezu (7, 32).
Table 6. Zásady bezkrevní péče v porodnictví 
Výhodou je použití viskoelastometrických metod k managementu koagulace a své místo má také podání rFVIIa (9). Použití rekuperace krve se prokázalo jako účinné a bezpečné jak u vaginálního porodu, tak při císařském řezu (18).
Jednotlivé kroky by však u pacientek, kterým nemůžeme podat krev, měly postupovat rychleji a časněji, a s větší naléhavostí přistoupíme k operaci. Je věcí úsudku porodníka, jestli chirurgická metoda bude umístění Bakriho balónu, použití B-Lynchovy kompresní sutury, embolizace uterinních arterií intervenčním radiologem nebo provedení hysterektomie jako definitivní zástavy krvácení.
Závažné PPH je většinou vždy spojeno se závažnou nebo život ohrožující anemií, a jak je jednou krvácení zastaveno, je pro uzdravení nezbytné se zaměřit na včasnou a razantní léčbu anemie. Účinné postupy a podpůrné strategie již byly popsány v kapitole o managementu závažné anemie. Nezapomeneme také na profylaxi trombembolismu.
ZÁVĚR
Pacienti, kterým nemůžeme podat krev, mohou být úspěšně léčeni při pečlivém využití moderních bezkrevních postupů a dostupných léčiv v kombinaci s razantní léčbou anemie a kvalitní podpůrnou péčí, a to i v situacích závažné anemie a krvácení. Individualizovaný a podrobný plán léčby, včasné vyjasnění postupů a přípravků přijatelných pro pacienta, multidisciplinární týmový přístup, minimalizace krevních ztrát a priorita rychlé zástavy krvácení, společně s předoperační optimalizací erytropoézy a koagulace, jsou pro úspěšnou léčbu klíčové. Navíc zkušenosti získané z bezkrevní léčby vydláždily cestu k rozvoji konceptu Patient Blood Management, který se stal standardem úspěšné léčby všech pacientů, tedy nejen těch, kterým krev podat nemůžeme.
Střet zájmů: žádný.
adresa pro korespondenci:
MUDr. Josip Slipac
Canadian Medical s.r.o.
Jánská 2,
602 00 Brno
e-mail: slipac.josip@gmail.com
Sources
1. Besen BA, Gobatto AL, Melro LM, et al. Fluid and electrolyte overload in critically ill patients: an overview. World J Crit Care Med 2015; 4(2): 116–129.
2. Beverina I, Razionale G, Ranzini M, et al. Early intravenous iron administration in the Emergency Department reduces red blood cell unit transfusion, hospitalisation, re-transfusion, length of stay and costs. Blood Transfus 2020; 18(2): 106–116.
3. Bienstock JL, Eke AC, Hueppchen NA. Postpartum hemorrhage. N Engl J Med 2021; 384(17): 1635–1645.
4. Blatný J, Bláha J, Cvachovec K, a kol. Diagnostika a léčba život ohrožujícího krvácení u dospělých pacientů v intenzivní a perioperační péči. Československý mezioborový doporučený postup. Anest Intenziv Med 2017; 28 : 263–269.
5. Blatný J. Krvácení a jeho léčba – (nejen) hematologický problém. Interní Med 2009; 11(3): 120–122.
6. CRASH-3 trial collaborators. Effects of tranexamic acid on death, disability, vascular occlusive events and other morbidities in patients with acute traumatic brain injury (CRASH-3): a randomised, placebo-controlled trial. Lancet 2019; 394(10210): 1713–1723.
7. WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet 2017; 389(10084): 2105–2116.
8. Feiner JR, Finlay-Morreale HE, Toy P, et al. High oxygen partial pressure decreases anemia-induced heart rate increase equivalent to transfusion. Anesthesiology 2011; 115(3): 492–498.
9. Franchini M, Franchi M, Bergamini V, et al. The use of recombinant activated FVII in postpartum hemorrhage. Clin Obstet Gynecol 2010; 53(1): 219–227.
10. Georgiou C, Inaba K, DuBose J, et al. Optimizing outcomes in the Jehovah’s witness following trauma: special management concerns for a unique population. Eur J Trauma Emerg Surg 2009; 35(4): 383.
11. Girardis M, Busani S, Damiani E, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the oxygen-ICU randomized clinical trial. JAMA 2016; 316(15): 1583–1589.
12. Johnson-Arbor K, Verstraete R. Bloodless Management of the anemic patient in the emergency department. Ann Emerg Med 2021; S0196-0644(21)00515-1.
13. Kandane-Rathnayake RK, Isbister JP, Zatta AJ, et al. Australian and New Zealand Haemostasis Registry Steering Committee. Use of recombinant activated factor VII in Jehovah’s Witness patients with critical bleeding. ANZ J Surg 2013; 83(3): 155–160.
14. Klein AA, Bailey CR, Charlton A, et al. Association of Anaesthetists: Anaesthesia and peri-operative care for Jehovah’s Witnesses and patients who refuse blood. Anaesthesia 2019; 74(1): 74–82.
15. Kromker M, Lauscher P, Kertscho H, et al. Anemia tolerance during normo-, hypo - and hypervolemia. Transfusion 2017; 57(3): 613–621.
16. Kudela M, Pilka R, Dzvincuk P, et al. Bloodless surgery and gynecological patients among Jehovahs Witnesses. Čes. Gynekol. 2021; 86(2): 110–113.
17. Lasocki S, Pène F, Ait-Oufella H, et al. Management and prevention of anemia (acute bleeding excluded) in adult critical care patients. Ann Intensive Care 2020; 10(1): 97.
18. Liu Y, Li X, Che X, Zhao G, Xu M. Intraoperative cell salvage for obstetrics: a prospective randomized controlled clinical trial. BMC Pregnancy Childbirth 2020; 20(1): 452.
19. Lošťák J, Gallo J, Večeřa M, a kol. Lokální aplikace kyseliny tranexamové u TEP kyčle snižuje krevní ztráty a spotřebu krevních transfuzí. Acta Chir Orthop Traumatol Cech 2017; 84(4): 254–262.
20. Marinakis S, Van der Linden P, Tortora R, et al. Outcomes from cardiac surgery in Jehovah’s Witness patients: experience over twenty – one years. J Cardiothorac Surg 2016; 11(1): 67.
21. Matsunaga S, Takai Y, Seki H. Fibrinogen for the management of critical obstetric hemorrhage. J Obstet Gynaecol Res 2019; 45(1): 13–21.
22. Muñoz C, Aletti F, Govender K, et al. Resuscitation after hemorrhagic shock in the microcirculation: targeting optimal oxygen delivery in the design of artificial blood substitutes. Front Med (Lausanne) 2020; 7 : 585638.
23. Muñoz M, Acheson AG, Auerbach M, et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. Anaesthesia 2017; 72 : 233–247.
24. Muñoz M, Acheson AG, Bisbe E, et al. An international consensus statement on the management of postoperative anaemia after major surgical procedures. Anaesthesia 2018; 73(11): 1418–1431.
25. Naumann DN, Beaven A, Dretzke, et al. Searching for the optimal fluid to restore microcirculatory flow dynamics after haemorrhagic shock: a systematic review of preclinical studies. Shock 2016; 46(6): 609–622.
26. Neef V, Vo L, Herrmann E, et al. The association between intraoperative cell salvage and red blood cell transfusion in cardiac surgery – an observational study in a patient blood management centre. Anaesthesiol Intensive Ther 2021; 53(1): 1–9.
27. Nguyen TN, Boyd ME. Bloodless management of postpartum hemorrhage and Jehovah’s Witnesses. J Obstet Gynaecol Can 2019; 41(6): 743–744.
28. Pařízek A, Binder T, Bláha J, a kol. Diagnostika a léčba peripartálního život ohrožujícího krvácení. Česko-slovenský mezioborový konsenzus. Čes. Gynekol. 2018; 83(2): 151–158.
29. Porter SB, White LJ, Osagiede O, et al. Tranexamic acid administration is not associated with an increase in complications in high-risk patients undergoing primary total knee or total hip arthroplasty: A retrospective case-control study of 38,220 patients. J Arthroplasty 2020; 35(1): 45–51.e3.
30. Resar LM, Frank SM. Bloodless medicine: what to do when you can’t transfuse. Hematology Am Soc Hematol Educ Program 2014; 2014 : 553–558.
31. Roberts I, Shakur H, Coats T, et al. The CRASH-2 trial: a randomised controlled trial and economic evaluation of the effects of tranexamic acid on death, vascular occlusive events and transfusion requirement in bleeding trauma patients. Health Technol Assess 2013; 17(10): 1–79.
32. Sentilhes L, Sénat MV, Le Lous M, et al. Groupe de recherche en obstétrique et gynécologie. Tranexamic acid for the prevention of blood loss after cesarean delivery. N Engl J Med 2021; 384(17): 1623–1634.
33. Shander A, Brown J, Licker M, et al. Standards and best practice for acute normovolemic hemodilution: evidence-based consensus recommendations. J Cardiothorac Vasc Anesth 2020; 34(7): 1755–1760.
34. Shander A, Goodnough LT. Management of anemia in patients who decline blood transfusion. Am J Hematol 2018; 93(9): 1183 – 1191.
35. Shander A, Javidroozi M, Gianatiempo C, et al. Outcomes of protocol-driven care of critically ill severely anemic patients for whom blood transfusion is not an option. Crit Care Med 2016; 44(6): 1109–1115.
36. Shander A, Javidroozi M, Naqvi S, et al. An update on mortality and morbidity in patients with very low postoperative hemoglobin levels who decline blood transfusion. Transfusion 2014; 54 (10 Pt 2): 2688–2695.
37. Shander A, Javidroozi M. Blood conservation strategies and the management of perioperative anaemia. Curr Opin Anaesthesiol 2015; 28(3): 356–363.
38. Scharman CD, Burger D, Shatzel JJ, et al. Treatment of individuals who cannot receive blood products for religious or other reasons. Am J Hematol 2017; 92(12): 1370–1381.
39. Slipac J. Bezkrevní medicína. 2. aktualizované vydání. Praha: Triton 2011.
40. Slipac J. Evropská příručka osvědčených postupů Patient Blood Management. Prakt. Lék. 2017; 97(5): 206–213.
41. Slipac J. Patient Blood Managment – Proč? Praha: Triton 2020.
42. Slipac J. Předoperační anemie: výskyt, příčiny, následky, diagnostika a léčba. Prakt. Lék. 2018; 98(3): 99–103.
43. Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care 2019; 23(1): 98.
44. Ševčíková S, Durila M, Vymazal T. Vliv infuzních roztoků na krevní srážlivost. Anest Intenziv Med 2018; 29(5): 258–264.
45. Taeuber I, Weibel S, Herrmann E, et al. Association of intravenous tranexamic acid with thromboembolic events and mortality: a systematic review, meta-analysis, and meta-regression. JAMA Surg 2021; 156(6): e210884.
46. Tan GM, Guinn NR, Frank SM, Shander A. Proceedings from the Society for advancement of blood management Annual meeting 2017: Management dilemmas of the surgical patient – when blood is not an option. Anesth Analg 2019; 128(1): 144–151.
47. van Der Linden P, James M, Mythen M, Weiskopf RB. Safety of modern starches used during surgery. Anesth Analg 2013; 116(1): 35–48.
48. Varela JE, Gomez-Marin O, Fleming LE, Cohn SM. The risk of death for Jehovah’s Witnesses after major trauma. J Trauma 2003; 54(5): 967–972.
49. Vasques F, Kinnunen EM, Pol M, et al. Outcome of Jehovah’s Witnesses after adult cardiac surgery: systematic review and meta-analysis ofcomparative studies. Transfusion 2016; 56(8): 2146–2153.
50. Wu WW, Zhang WY, Zhang WH, et al. Survival analysis of intraoperative blood salvage for patients with malignancy disease: A PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore) 2019; 98(27): e16040.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2021 Issue 5-
All articles in this issue
- Bezkrevní klinické postupy pro zvládnutí závažné anemie a krvácení
- Důsledek akutního nedostatku pohybu: „detraining“ a celkový pokles funkční kapacity
- Hyaluronát ve světle nových studií
- Názory občanů České republiky na vybrané aspekty činnosti všeobecných praktických lékařů – 2020
- Je veřejnost dostatečně informována o významu očkování proti pertusi v dospělosti?
- Vybrané rizikové faktory cévní mozkové příhody
- Akromegália – poddiagnostikované ochorenie s vážnymi komplikáciami
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vybrané rizikové faktory cévní mozkové příhody
- Bezkrevní klinické postupy pro zvládnutí závažné anemie a krvácení
- Je veřejnost dostatečně informována o významu očkování proti pertusi v dospělosti?
- Akromegália – poddiagnostikované ochorenie s vážnymi komplikáciami
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

