-
Medical journals
- Career
Změny v hladinách prolinu v moči mohou korelovat s úspěšností operační léčby karcinomu prostaty
Authors: Z. Heger 1,2; N. Cernei 1,2; J. Gumulec 2,3; Š. Veselý 4; O. Zítka 1,2; M. Masařík 2,3; V. Adam 1,2; R. Kizek 1,2
Authors‘ workplace: Mendelova univerzita v Brně, Ústav chemie a biochemie, Vedoucí: doc. RNDr. Vojtěch Adam, Ph. D. 1; Vysoké učení technické v Brně, Středoevropský technologický institut, Vedoucí: prof. Ing. Radimír Vrba, CSc. 2; Masarykova Univerzita v Brně, Lékařská fakulta, Ústav patologické fyziologie, Vedoucí: prof. MUDr. Anna Vašků, CSc. 3; 2. lékařská fakulta Univerzity Karlovy a FNM, Praha, Urologická klinika, Přednosta: prof. MUDr. Marek Babjuk, CSc. 4
Published in: Prakt. Lék. 2015; 95(1): 31-35
Category: Of different specialties
Overview
Od roku 1980 je pro sledování stavu nádorového onemocnění prostaty používáno stanovení prostatického specifického antigenu (PSA) v krevním séru, následované dalšími diagnostickými postupy. Relativní spolehlivost komplexu těchto vyšetření je vykoupena nepříjemným, invazivním poškozením tkáně. Z toho důvodu se v nynější době hledají molekuly, které by mohly stresové situace eliminovat a zvýšit záchyt (diagnostické markery) a také poskytnout informace o úspěšnosti operační léčby karcinomu prostaty (CaP). Naše výsledky srovnání dvou skupin pacientů (n = 30) ukazují, že pacienti, u kterých není jasné, zda byl karcinom operační léčbou kompletně odstraněn, vykazují v moči významně vyšší hladiny prolinu než pacienti, kteří byli po 6.–8. měsících po radikální prostatektomii prohlášeni za vyléčené. Ačkoliv se prolin jeví jako slibný prognostický biomarker, k potvrzení jeho spolehlivosti je nutná rozsáhlá studie velkého souboru dlouhodobě sledovaných pacientů.
Klíčová slova:
karcinom prostaty – biomarker – prognóza – iontově výměnná chromatografie – prolinÚVOD
V Evropě a Spojených státech amerických je karcinom prostaty (CaP) nejčastějším typem nádorového onemocnění u mužů v rozmezí 45–85 let (1, 2). Incidence roste ročně přibližně o 2–3 % a za posledních 15 let se počet nahlášených nemocných ztrojnásobil (1). Předpokládá se, že se u mladších mužů rozvíjejí agresivnější formy onemocnění než u starších ročníků (3). Příčinou vzniku všech zhoubných nádorů je řada změn v některých buňkách, v jejichž důsledku začnou tyto buňky vykazovat abnormální chování (4), nekontrolovaně se množí na úkor zdravé tkáně, kterou tím ničí (4). Mechanismus vzniku a vývoje karcinomu prostaty není zcela podrobně objasněn, avšak v současné době již bylo identifikováno několik rizikových faktorů odpovědných za vznik a progresi tohoto onemocnění. Jedná se zejména o etnický původ, genetické predispozice, věk, obezitu a životní styl (5). Bylo zjištěno, že s každou započatou dekádou života se riziko vzniku karcinomu prostaty zdvojnásobuje (6) a rozvoj jak benigních, tak maligních novotvarů je úzce spřízněn s rodinou anamnézou, zejména s dříve diagnostikovanými nádory prostaty či prsu (7). Zajímavostí také je, že incidence karcinomu prostaty je přibližně o 70 % vyšší u etnických černochů v porovnání s ostatními rasami (8), což bývá vysvětlováno vyšší expozicí androgenům v průběhu života v porovnání s jinými etnickými skupinami. V současné době se diagnostika karcinomu prostaty zakládá na stanovení hladiny prostatického specifického antigenu (PSA) v séru, digitálním rektálním vyšetření a následnou biopsii. Ačkoliv se diagnostické postupy neustále vyvíjí, při diagnózách karcinomů prostaty dochází stále k falešně pozitivním či negativním výsledkům (9), což mnohdy vede ke zbytečnému provedení invazivní biopsie (10). Z hlediska diagnostického i prognostického jsou hledány další biomarkery, které by mohly zvýšit specificitu a efektivitu diagnostických postupů a pomoci evaluovat úspěšnost aplikované léčby.
POTENCIONÁLNÍ BIOMARKERY KARCINOMU PROSTATY
PSA je doposud jediným biomarkerem karcinomu prostaty, který je používán v klinické praxi (11), nicméně bylo identifikováno několik faktorů, které zvyšují jeho hladinu v séru – jako zánět močových cest (12, 13) či jízda na kole (14). Pacienti s vyšší hladinou PSA jsou indikováni k transrektální biopsii pod ultrazvukovou kontrolou. Toto vyšetření vykazuje výbornou efektivitu, avšak je časově náročné a hlavně invazivní, což je pro pacienta velmi nepříjemné (15). Na tomto místě je také třeba zdůraznit, že i přes značný vývoj v invazivní diagnostice jsou pacienti stálé ohroženi nežádoucími komplikacemi při odběru bioptátu. Nejen z těchto důvodu jsou proto v současné době zkoumány nové ne-invazivní markery, které by v budoucnu výše zmíněné skutečnosti mohly eliminovat (16). Jako matrice pro identifikaci těchto molekul by ideálně měla posloužit moč, která je jednou z nejlépe dostupných tělesných tekutin. V literatuře již bylo popsáno mnoho potencionálních diagnostických biomarkerů, z nichž nejlepší výsledky byly prokázány u annexinu A3 (ANXA3) (17, 18), PCA3 (prostate cancer antigen 3) (19, 20), arginin amidázy (20), sarkosinu (N-methylgycin) (9, 22, 23) a prolinu (3, 24). Nepolární aminokyselina prolin (C5H9NO2) byla již dříve vyhodnocena jako potencionálně vhodný diagnostický marker, jejíž hladiny se u pacientů s maligními novotvary prostaty rapidně liší od pacientů zdravých (25). Metabolismus prolinu hraje významnou roli v apoptických signalizačních drahách (26) a prolin dehydrogenáza (PRODH), katalyzující první krok v degradaci prolinu (obr. 1) odpovídá za řízení exprese strážce genomu – proteinu p53 (27). Ačkoliv naše dřívější studie potvrdila diagnostický potenciál prolinu (3), cílem této studie bylo provést pilotní experimentální studii určení hladiny prolinu v moči pacientů s diagnostikovaným karcinomem prostaty.
Image 1. Metabolická dráha oxidace prolinu na glutamát a jeho další konverze na glutamin (převzato z Natarajan et al. a volně přepracováno) P5C – 1-pyrolin 5-karboxylát; 1.5.99.8 – prolin dehydrogenáza/oxidáza; 1.5.1.2 – P5C reduktáza; GSA – glutamyl- gama-semialdehyd; 2.7.2.11 – P5C syntáza; 1.5.1.12 – P5C dehydrogenáza; 3.5.1.2 – glutamináza; 6.3.1.2 – glutamin syntáza; 2.6.1.13 – orninit aminotransferáza 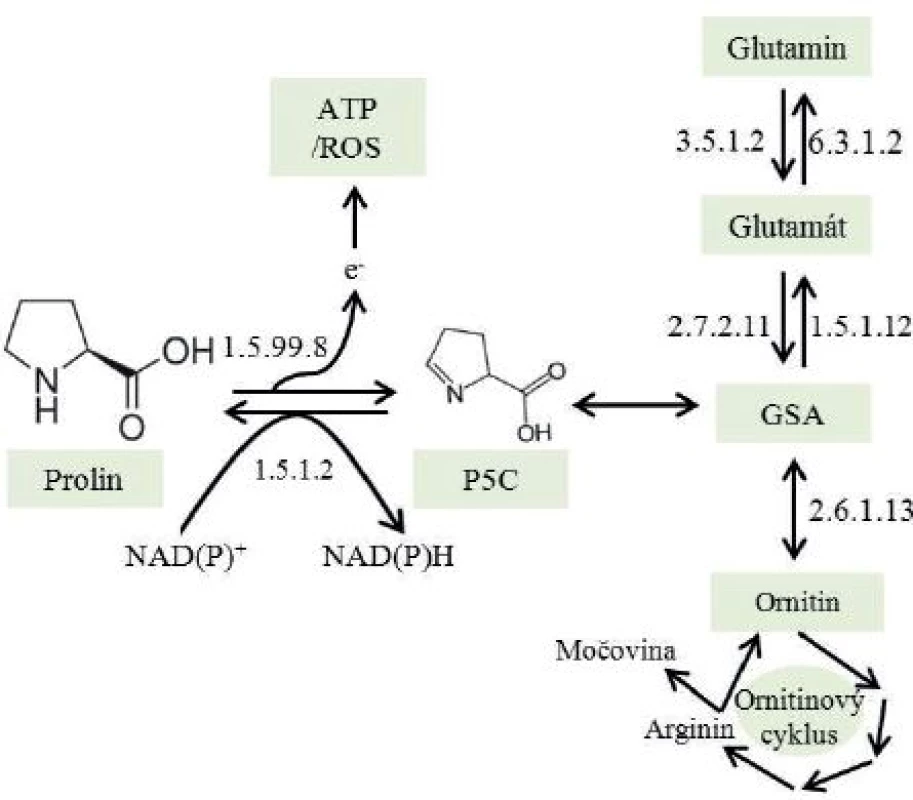
MATERIÁL A METODY
Klinické vzorky moči pacientů s karcinomem prostaty
V rámci experimentální práce byly použity vzorky moči (n = 60) získané od pacientů s karcinomem prostaty. Vzorky byly získány z Fakultní nemocnice v Motole v Praze a zpracovány se souhlasem etické komise (referenční číslo EK-377/13). Všichni pacienti byli podrobeni radikální prostatektomii a na základě pozorování byli rozděleni na dvě experimentální skupiny. První skupinu tvořili pacienti s potvrzeným pozitivním chirurgickým okrajem (n = 15). Pozitivní chirurgický okraj byl definován jako přítomnost nádorových buněk ve značeném okraji resekovaného preparátu. Druhá skupina byla tvořena pacienty, kteří byli prohlášeni po 6–8 měsících za vyléčené (n = 15). V každé skupině byly analyzovány vzorky odebrané před radikální prostatektomií a 3 měsíce po ní.
Příprava klinických vzorků pro analýzu
Před vlastní analýzou byly vzorky moči podrobeny kyselé hydrolýze v mikrovlnném reaktoru MW 3000 (Anton Paar, Graz, Rakousko). Po přidání ředícího pufru sodíkového cyklu (5 ml C4H10O2S; 0,10 g N3Na; 11 g NaCl; 14 g C6H8O7 na 1 l vody) byly vzorky centrifugovány při 25 000 g, 4 °C po dobu 20 minut v mikrocentrifuze 5417R (Eppendorf AG, Hamburg, Německo). Po centrifugaci byly vzorky naředěny neutralizačním roztokem (0,6 M NaOH, rozpuštěný v ředícím pufru Na cyklu). Takto připravené vzorky byly analyzovány pomocí iontově-výměnné kapalinové chromatografie (podrobnosti o použité metodě jsou uveřejněny v pracích (3, 28, 29).
Statistické vyhodnocení
Pro statistickou analýzu rozdílů mezi jednotlivými skupinami byla použita analýza rozptylu pro opakovaná měření (Repeated measures ANOVA). K porovnání hladiny prolinu byl dále aplikován test Fischer LSD pro testování post-hoc. Hladina významnosti k zamítnutí nulové hypotézy byla stanovena na p < 0,05, pokud není uvedeno jinak. Pro statistické analýzy byl použit software Statistica 10 (StatSoft, Inc., Tulsa, OK, USA).
VÝSLEDKY A DISKUZE
Prolin je jediná sekundární aminokyselina, která je utilizována pro inkorporaci do struktury proteinů. Katabolizován je vlastní metabolickou cestou, kde hlavním enzymem transformujícím prolin na 1-pyrolin-5-karboxylát (P5C) je prolin dehydrogenáza/oxidáza (PRODH/POX). Indukce aktivity PRODH/POX je závislá na rozličných stresových faktorech. Mezi ně je řazena genotoxicita (mutace v p53, receptorech aktivovaných proliferátory peroxizomů – PPAR*gama) (30) či nutriční stres (glukózová deprivace) (31). Metabolická degradace prolinu vlivem POX dává za vznik prolin-dependentním reaktivním kyslíkovým radikálům (ROS), zejména superoxidům, které modulují buněčnou apoptózu (32). Bylo také dokázáno, že transkripční faktor Myc, jehož over-exprese je sledována u mnoha typů nádorových onemocnění, může down-regulovat expresi POX/PRODH, a tím inhibovat jeho funkci – katabolýzu prolinu a tvorbu ROS, vedoucí k apoptóze. Dalším důležitým spojením mezi prolinem a kancerogenezí je potenciál některých, v nádorech silně exprimovaných miRNA (zejména miR-23b*), inhibovat aktivitu POX (33). Z výše zmíněných skutečností vyplývá, že onkologická onemocnění, ač jsou značně heterogenní, zachovávají si určité charakteristiky (over-exprese MYC či miRNA), které ovlivňují metabolickou konverzi prolinu na P5C. Alterace v metabolismu prolinu tedy může vést k jeho zvýšenému množství, detekovatelnému ve vzorcích moči, jak bylo pozorováno v naší předchozí práci (3). U pacientů směřujících k remisi onemocnění se předpokládá návrat ke správně pracujícímu metabolismu prolinu, a tím se objevuje důležitý otazník – může být pooperační prognóza onkologických pacientů založena na determinaci prolinu v moči? V naší pilotní studii byly analyzovány vzorky moči pacientů s diagnostikovaným karcinomem prostaty před a po radikální prostatektomii. Gleasonovo skóre bylo u všech pacientů stanoveno v rozsahu 5–7. Nejdříve byla sledována hladina prolinu v obou sledovaných skupinách (obr. 2A). Pro základní porovnání hladin prolinu byla provedena adjustace ostatních proměnných (v tomto případě času). Z toho důvodu byl pro obě skupiny proveden součet (M0 + M3) a ten byl zprůměrován. Z obrázku 2A je zřejmé, že pacienti v remisi mají v porovnání s pacienty s pozitivním chirurgickým okrajem cca 0,8krát nižší hladinu prolinu v moči, F (1,28) = 0,78, p = 0,39. Tento výsledek ale nemá přílišnou výpovědní hodnotu ve smyslu prognostické role prolinu, jelikož nepopisuje trend změny jeho koncentrací v čase. Z toho důvodu jsme provedli analýzu kombinovaného efektu sledovaných faktorů na hladinu prolinu (obr. 2B) F (1,28) = 1,66, p = 0,21. Z obrázku 2B je patrné, že zatímco v čase M0, tedy u pacientů v předoperačním stadiu je v koncentraci prolinu moči mezi oběma skupinami pouze nepatrný rozdíl, nicméně v čase M3 a je již rozdíl značný. Pro lepší posouzení hodnot prolinu byla popisná statistika vynesena do tabulky 1.
Image 2. Statistické porovnání mezi jednotlivými analyzovanými skupinami. Statistické znázornění porovnání hladiny prolinu (A) mezi jednotlivými skupinami, (B) mezi jednotlivými skupinami, kombinováno se znázorněním časových závislostí (M0 = předoperační skupina, n = 15 pro pozitivní chirurgické okraje a n = 15 pro remisi; M3 = pooperační skupina, n = 15 pro pozitivní chirurgické okraje a n = 15 pro remisi). Data byla statisticky analyzována pomocí metody analýzy rozptylu pro opakovaná měření a neparametrickým testem Fisher LSD pro testování post-hoc, pomocí programu Statistica 10. Hladina významnosti byla stanovena na p < 0,05. 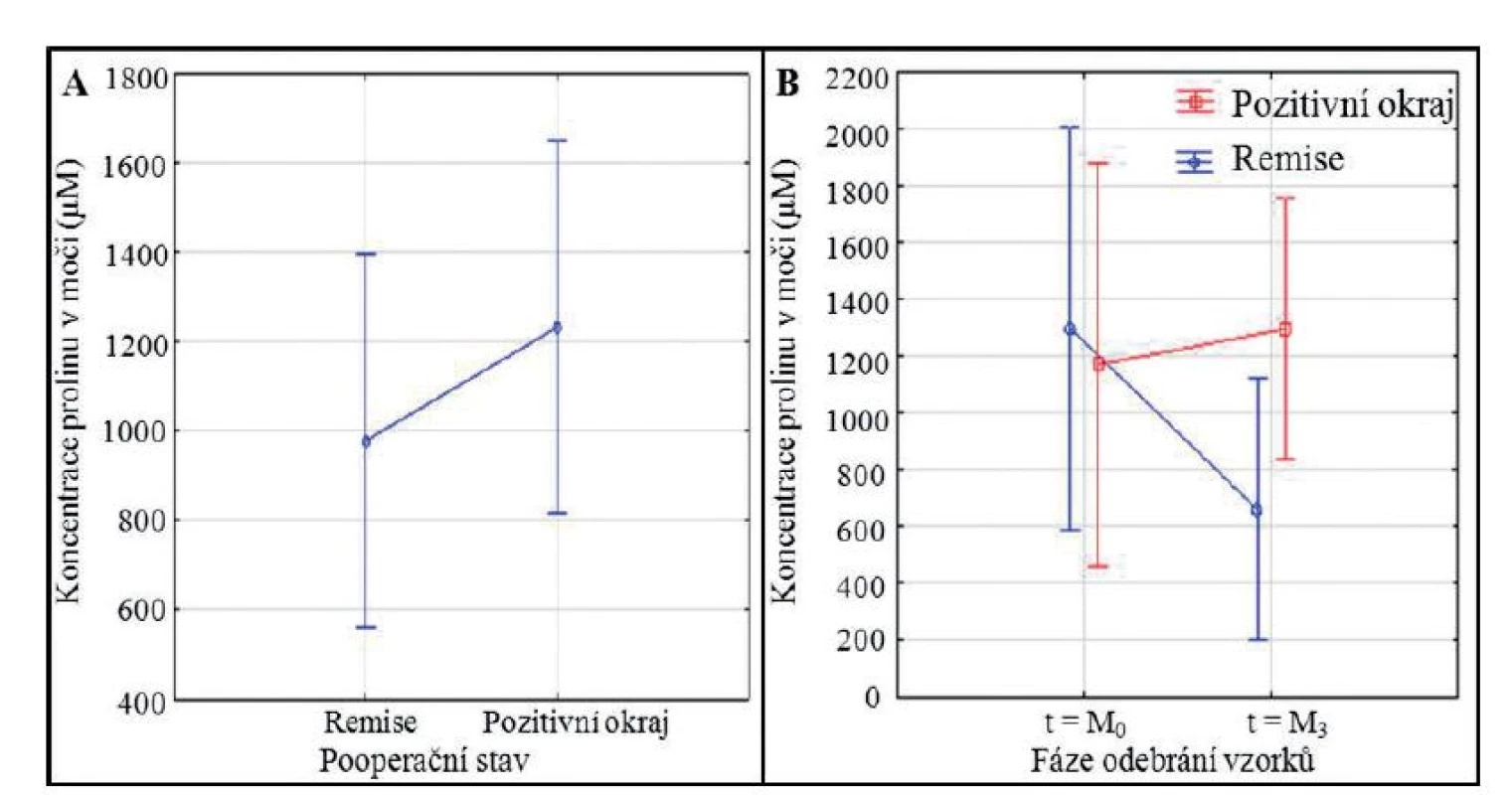
Table 1. Popisná statistika hladiny prolinu v moči u jednotlivých skupin, ukazující statistické porovnání mezi skupinou s relapsem a remisí sledovaných ve dvou fázích (předoperační a pooperační) 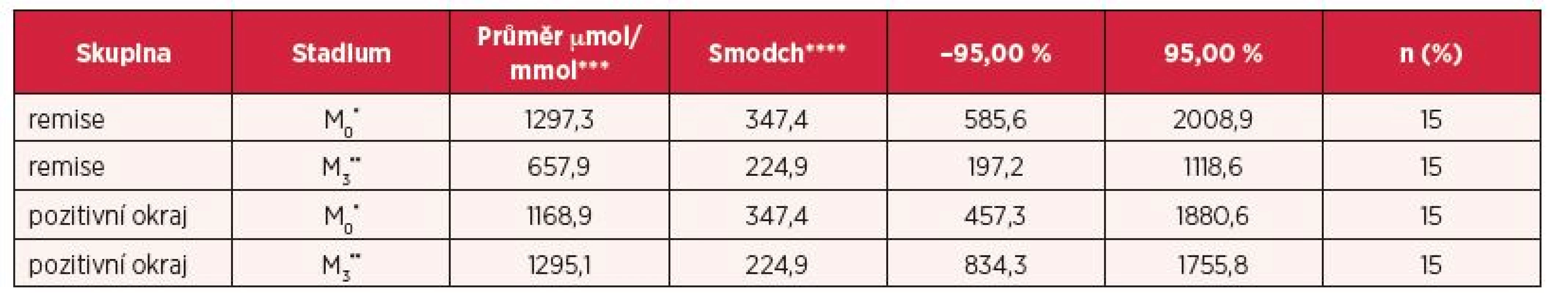
*předoperační odběr vzorků, **pooperační odběr vzorků (3 měsíce po radikální prostatektomii), ***μmol/mmol kreatininu, ****směrodatná odchylka Z výše zmíněných skutečností lze usuzovat, že zatímco před operací (M0) není v koncentraci prolinu v moči u obou skupin výrazný rozdíl (1297,3 µmol/mmol kreatininu pro remisi, 1168,9 µmol/mmol kreatininu pozitivní chirurgické okraje), pooperační hodnoty v odběrech 3 měsíce po operaci (M3) již vykazují značný rozdíl v hodnotách prolinu (657,9 µmol/mmol kreatininu pro remisi, 1295,1 µmol/mmol kreatininu pro pozitivní chirurgické okraje). Hladina prolinu je tedy u pacientů v remisi téměř 2krát nižší v porovnání s pacienty s vysokým rizikem relapsu. Tento jev je pravděpodobně spojen s návratem k ne-alterovanému prolinovému metabolismu, který již není ovlivňován over-expresí transkripčních faktorů či miRNA. To lze usuzovat i ze stagnace prolinu u skupiny pacientů s pozitivním okrajem (relaps M0 = 1168,9 µmol/mmol kreatininu, M3 = 1295,1 µmol/mmol kreatininu), u nichž pravděpodobně zůstává metabolismus prolinu patologicky narušen. Tuto hypotézu je nicméně potřeba řádně otestovat na rozsáhlé kohortě pacientů. Z našich pilotních výsledků vyplývá, že pokles hladiny prolinu po léčebném zákroku může sloužit pro monitoring zdravotního stavu pacienta a poskytnout velmi důležité informace o průběhu zotavovací fáze. V další fázi bude důležité také sledování poklesu či stagnace koncentrací prolinu v moči v kratších časových úsecích, díky čemuž může být stanoven statisticky významný časový bod s nejvyšší výpovědní prognostickou hodnotou.
ZÁVĚR
V této studii bylo předvedeno, že i jednoduše, ne-invazivně identifikovatelné molekuly, kam řadíme aminokyseliny obsažené v moči (v našem případě prolin) souvisejí s přítomností karcinomu prostaty, a proto si zaslouží naši plnou pozornost. I přes velký posun v proteomických či metabolomických technikách, které nabízí high-throughput screening rozsáhlého množství nejrůznějších molekul, nejčastěji proteinů, je stále možné navázat na práci Sreekumara a kolegů (22), kteří identifikovali diagnosticko-prognostický potenciál aminokyseliny sarkosinu, která stále vyvolává ve vědecko-lékařské obci velké diskuze. Prolin může sloužit jako jednoduše detekovatelný pomocný biomarker ukazující na prognózu pacientů s karcinomem prostaty.
Seznam použitých zkratek
ANOVA analýza rozptylu
ANXA3 annexin A3
CAP karcinom prostaty
GSA glutamyl-gama-semialdehyd
MYC myelocytomatosis onkogen
p53 tumor supresor fosfoprotein p53
P5C 1-pyrolin-5-karboxylát
PCA3 prostate cancer antigen 3
PPAR*gama proliferátory peroxizomů
PRODH/POX prolin dehydrogenáza/oxidáza
PSA prostatický specifický antigen
ROS reaktivní kyslíkové radikály
Práce byla zpracována za finanční podpory projektu CEITEC CZ.1.05/1.1.00/02.0068.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. Ing. René Kizek, Ph.D.
Ústav chemie a biochemie MENDELU
Zemědělská 1, 613 00 Brno
e-mail: kizek@sci.muni.cz
Sources
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin 2013; 63 : 11–30.
2. Boyle P, Ferlay J. Cancer incidence and mortality in Europe, 2004. Ann Oncol 2005; 16 : 481–488.
3. Heger Z, Cernei N, Gumulec J, et al. Determination of common urine substances as an assay for improving prostate carcinoma diagnostics. Oncol Rep 2014; 31 : 1846–1854.
4. Boyd LK, Mao X, Xue L, et al. High-resolution genome-wide copy-number analysis suggests a monoclonal origin of multifocal prostate cancer. Genes Chromosomes Cancer 2012; 51 : 579–589.
5. Zelenko Z, Gallagher EJ. Diabetes and Cancer. Endocrinol Metab Clin North Am 2014; 43 : 167–185.
6. Astigueta JC, Abad MA, Morante C, et al. Characteristics of metastatic prostate cancer ocurring in patients under 50 years of age. Actas Urol Esp 2010; 34 : 327–332.
7. Bjartell A. Genetic markers and the risk of developing prostate cancer. Eur Urol 2011; 60 : 29–31.
8. Tindall EA, Monare LR, Petersen DC, et al. Clinical presentation of prostate cancer in black South Africans. Prostate 2014; 74 : 880–891.
9. Cernei N, Heger Z, Gumulec J, et al. Sarcosine as a potential prostate cancer biomarker-a review. Int J Mol Sci 2013; 14 : 13893–13908.
10. Abu Aboud O, Weiss RH. New opportunities from the cancer metabolome. Clin Chem 2013; 59 : 138–146.
11. Brawer MK. Prostate-specific antigen. Semin Surg Oncol 2000; 18 : 3–9.
12. Abrams P, Chapple C, Khoury S, et al. Evaluation and treatment of lower urinary tract symptoms in older men. J Urol 2013; 189: S93–S101.
13. Hung SF, Chung SD, Kuo HC. Increased serum C-reactive protein level is associated with increased storage lower urinary tract symptoms in men with benign prostatic hyperplasia. Plos One 2014. DOI: 10.1371/journal.pone.0085588
14. Kindermann W, Lehmann V, Herrmann M, et al. Influencing of the PSA concentration in serum by physical exercise (especially bicycle riding). Urologe 2011; 50 : 188–196.
15. Bitencourt AGV, Tyng CJ, Pinto PNV, et al. Percutaneous biopsy based on PET/CT findings in cancer patients technique, indications, and results. Clin Nucl Med 2012; 37: E95–E97.
16. Rubio-Briones J, Casanova-Salas I, Fernandez-Serra A, et al. Non-invasive diagnosis of prostate cancer: serum and urine markers. Arch Esp Urol 2013; 66 : 440–452.
17. Jamaspishvili T, Kral M, Khomeriki I, et al. Urine markers in monitoring for prostate cancer. Prostate Cancer and Prostatic Dis 2010; 13 : 12–19.
18. Schostak M, Schwall GP, Poznanovic S, et al. Annexin A3 in urine: a highly specific noninvasive marker for prostate cancer early detection. J Urol 2009; 181 : 343–353.
19. Goode RR, Marshall SJ, Duff M, et al. Use of PCA3 in detecting prostate cancer in initial and repeat prostate biopsy patients. Prostate 2013; 73 : 48–53.
20. Day JR, Jost M, Reynolds MA, et al. PCA3: From basic molecular science to the clinical lab. Cancer Lett 2011; 301 : 1–6.
21. Matsuda Y, Miyashita A, Fujimoto Y, et al. Clinical application of basic arginine amidase in human male urine. Biol Pharm Bull 1996; 19 : 1083–1085.
22. Sreekumar A, Poisson LM, Rajendiran TM, et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature 2009; 457 : 910–914.
23. Cernei N, Zitka O, Ryvolova M, et al. Spectrometric and electrochemical analysis of sarcosine as a potential prostate carcinoma marker. Int J Electrochem Sci 2012; 7 : 4286–4301.
24. Mukherjee S, Cruz-Rodriguez O, Bolton E, et al. The in vivo role of androgen receptor SUMOylation as revealed by androgen insensitivity syndrome and prostate cancer mutations targeting the proline/glycine residues of synergy control motifs. J Biol Chem 2012; 287 : 31195–31206.
25. Xie TX, Zhou G, Zhao M, et al. Serine substitution of proline at codon 151 of TP53 confers gain of function activity leading to anoikis resistance and tumor progression of head and neck cancer cells. Laryngoscope. 2013; 123 : 1416–1423.
26. Shamsipur M, Naseri MT, Babri M. Quantification of candidate prostate cancer metabolite biomarkers in urine using dispersive derivatization liquid-liquid microextraction followed by gas and liquid chromatography-mass spectrometry. J Pharm Biomed Anal 2013; 81–82 : 65–75.
27. Natarajan SK, Zhu W, Liang X, et al. Proline dehydrogenase is essential for proline protection against hydrogen peroxide-induced cell death. Free Radic Biol Med 2012; 53 : 1181–1191.
28. Cernei N, Zitka O, Skalickova S, et al. Sarkosin v moči pacientů se zhoubným nádorem prostaty. Prakt. Lék. 2012; 92 : 444–448.
29. Cernei N, Masarik M, Gumulec J, et al. Determination of sarcosine as possible tumour marker of prostate tumours. J Biochem Tech 2010; 2: S7–S8.
30. Pandhare J, Cooper SK, Phang JM. Proline oxidase, a proapoptotic gene, is induced by troglitazone – Evidence for both peroxisome proliferator-activated receptor gamma-dependent and -independent mechanisms. J Biol Chem 2006; 281 : 2044–2052.
31. Pandhare J, Donald SP, Cooper SK, et al. Regulation and function of proline oxidase under nutrient stress. J Cell Biochem 2009; 107 : 759–768.
32. Liu Y, Borchert GL, Surazynski A, et al. Proline oxidase activates both intrinsic and extrinsic pathways for apoptosis: the role of ROS/superoxides, NFAT and MEK/ERK signaling. Oncogene 2006; 25 : 5640–5647.
33. Liu W, Le A, Hancock C, et al. Reprogramming of proline and glutamine metabolism contributes to the proliferative and metabolic responses regulated by oncogenic transcription factor c-MYC. Proc Natl Acad Sci USA 2012; 109 : 8983–8988.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2015 Issue 1-
All articles in this issue
- Virové hemoragické horečky
- Současná léčba pyogenního abscesu jater – zkušenosti Chirurgické kliniky FN Plzeň
- Dopady holokaustu na zdraví přeživších
- Intervence v prevenci pádů seniorů v institucích: přehledová studie
- Změny v hladinách prolinu v moči mohou korelovat s úspěšností operační léčby karcinomu prostaty
- Klostridiová flegmóna břišní stěny u obézní pacientky s Crohnovou chorobou
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současná léčba pyogenního abscesu jater – zkušenosti Chirurgické kliniky FN Plzeň
- Klostridiová flegmóna břišní stěny u obézní pacientky s Crohnovou chorobou
- Virové hemoragické horečky
- Dopady holokaustu na zdraví přeživších
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

