-
Medical journals
- Career
Biosimilární léčba v dětské gastroenterologii – současný pohled
Authors: Bronský J.
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN v Motole, Praha
Published in: Gastroent Hepatol 2022; 76(1): 42-45
Category:
doi: https://doi.org/10.48095/ccgh202242Overview
Biosimilární léčiva (BSL) jsou v oboru gastroenterologie používána od roku 2013, kdy byl schválen Evropskou lékovou agenturou biosimilární infliximab pro léčbu idiopatických střevních onemocnění (IBD). Pohled na tato léčiva se v průběhu jejich používání významně změnil. Nejprve byla BSL používána s velkými rozpaky, zejména z důvodu nedostatku publikovaných údajů o jejich efektivitě a bezpečnosti a také z důvodu nedostatku klinické zkušenosti. V průběhu následujících let byla publikována řada studií, které postupně podporují jejich místo v léčbě IBD a v současné době jsou již BSL běžně podávána pacientům naivním k biologické léčbě a v řadě center je prováděn i tzv. switch z originálního přípravku na BSL. V pediatrii dlouhou dobu přetrvával rezervovanější postoj k jejich klinickému použití, ale s narůstajícím množstvím publikovaných dat se také v pediatrii běžně dostávají do klinické praxe. Tento souhrnný článek popisuje vývoj přístupu jak mezinárodních, tak tuzemských odborných společností i lékařů-kliniků k používání BSL a uvádí odkazy na nově publikované studie biosimilárních léčivých přípravků.
Klíčová slova:
biologická léčba – pediatrie – biosimilární léčiva – evropská léková agentura – switch – extrapolace
Úvodem
Biosimilární léčiva (BSL) používaná v oboru gastroenterologie jsou komplexní proteinové molekuly, které jsou vyrobeny pomocí biotechnologií nebo z přírodních zdrojů a které jsou prokazatelně „dostatečně podobné“ (sufficiently similar) biologickému léku, který byl schválen regulační agenturou. V medicíně jsou BSL obecně používána již velmi dlouhou dobu. Mnoho let před jejich příchodem do gastroenterologie měli s BSL zkušenosti lékaři jiných odborností. Jednalo se např. o biosimilární erytropoetin, genotropin, filgrastin či inzulin [1].
Příchod BSL do gastroenterologické praxe
Prvním BSL schváleným pro léčbu idiopatických střevních onemocnění (IBD) byl v roce 2013 infliximab (IFX). V době jeho schválení Evropskou lékovou agenturou (EMA) vyvolal příchod BSL na trh řadu kontroverzí a vášnivých diskuzí. Zpočátku panovala mezi lékařskou veřejností obava, zda budou BSL stejně účinná a bezpečná jako originální léčivé přípravky. Mezi odbornými společnostmi probíhaly diskuze na tato témata a byla také publikována řada více či méně rezervovaných odborných stanovisek [2–8]. Mezi kontroverzní body patřily otázky, zda lze extrapolovat data mezi různými klinickými indikacemi a věkovými skupinami, zda přechod na BSL uskutečňovat paušálně u všech pacientů nově indikovaných na biologickou léčbu (BL) či jen u selektované skupiny pacientů – a na základě jakých kritérií. Diskutována byla zodpovědnost a role ošetřujícího lékaře při výběru léčby i ekonomické aspekty a role managementu jednotlivých zdravotnických zařízení. Velkou otázkou bylo, zda kromě pacientů naivních k BL zvažovat BSL také u již léčených pacientů (tedy zda je vhodný a možný případný „switch“), řešila se otázka zaměnitelnosti jednotlivých BSL (interchangeability). Otázkou bylo, zda a jakým způsobem informovat pacienta, že bude dostávat BSL, a jak prospektivně a systematicky monitorovat účinnost a případné nežádoucí účinky léčby. V ČR byla tato témata o to naléhavější, že jsme se stali (z důvodu ukončení platnosti patentu originálního IFX) jednou z prvních zemí, kde byla BSL zaváděna (spolu se Slovenskem, Polskem, Maďarskem a dalšími).
Pohled na BSL v pediatrii
S postupem klinické praxe již dnes považujeme řadu výše uvedených otázek za vyřešenou. Přispělo k tomu velké množství dat, která se za poslední desetiletí během používání BSL v gastroenterologii podařilo shromáždit. Pediatrická praxe zůstávala a možná stále zůstává k některým výše uvedeným aspektům konzervativnější než gastroenterologie dospělých, ale i v pediatrii došlo od zavedení BSL k významnému názorovému posunu. Důvodem pro větší opatrnost byly pochyby o přenositelnosti poznatků ze studií na dospělých pacientech do pediatrie a také obavy z možného selhání léčby s nejistotou dalšího postupu vzhledem k omezenému množství BL schválených v pediatrické indikaci. Důraz byl kladen především na bezpečnost dětského pacienta a nutnost ponechání rozhodnutí o léčbě v rukou ošetřujícího lékaře s omezeným důrazem na ekonomické aspekty léčby. Svou roli hrálo i určité právní vakuum v oblasti zavádění BSL do léčebného schématu v ČR. Naopak pro včasné zavedení BSL do běžné klinické praxe svědčilo předpokládané významné snížení finančních nákladů BL s možností nabídnout terapii většímu množství pacientů, podpořené historickou zkušeností z jiných oborů.
První stanoviska odborných společností
První stanovisko mezinárodní odborné společnosti (ECCO – European Crohn’s and Colitis Organisation) z roku 2013 bylo k paušálnímu použití BSL rezervované, zdůrazňovalo nutnost posuzování účinnosti a bezpečnosti BSL v oblasti IBD a nevhodnost provádění paušálního switche z ekonomických důvodů [4]. Pediatrické stanovisko Porto IBD working group Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN) k BSL bylo vydáno v roce 2015 [2]. Závěrem tohoto stanoviska expertů se uvádí, že se vstupem BSL na trh lze očekávat snížení ceny léčby i pro dětské pacienty, ale při extrapolaci dat od dospělých pacientů s revmatoidní artritidou je třeba opatrnosti. Do budoucna bylo doporučeno zavést postmarketingové sledování efektivity, bezpečnosti a imunogenicity BSL. Switch u dětí nebyl podporován [2].
Doporučené postupy v ČR a vývoj mezinárodních doporučení
Problematice BSL se v ČR věnovala klinická doporučení jak pro léčbu dospělých pacientů s IBD [6,7], tak dětských pacientů [8]. Doporučení pro dospělé pacienty uvádí, že: „Dostupné informace v současné době potvrzují shodnou efektivitu a bezpečnost BSL a originálního IFX a rozhodnutí o typu použitého léčiva by mělo být v kompetenci ošetřujícího lékaře,“ [6,7]. Pediatrická doporučení z téhož období jsou konzervativnější a uvádějí, že: „BSL lze v pediatrii použít v indikacích schválených EMA a Státním ústavem pro kontrolu léčiv (SÚKL). Preferováno je použití u pacientů naivních k BL. Switch u pacienta, který je v remisi na originální BL, se nedoporučuje. Důležitý je důsledný monitoring a hlášení nežádoucích účinků BSL. O zahájení terapie BSL rozhoduje ošetřující lékař,“ [8]. Toto stanovisko bylo v souladu s výše citovaným stanoviskem ESPGHAN [2].
Stanovisko ESPGHAN bylo v roce 2019 renovováno na základě nových dat o efektivitě a bezpečnosti BSL [3]. Nově se uvádí, že switch originálního IFX na BSL může být zvážen u dětí s IBD v klinické remisi, nejdříve však po podání alespoň tří indukčních dávek. Mnohonásobné switche (mezi originálním léčivem a BSL nebo mezi více BSL) nejsou podporovány [3]. Také stanovisko ECCO pro dospělé pacienty doznalo změn a nově uvádí, že switch z originálního léčiva na BSL je akceptovatelný. Rezervovaný postoj zůstává k tzv. reverznímu switchi a mnohočetným switchům. Předpokladem pro switch je předchozí podrobná diskuze mezi lékařem a pacientem – dle lokálních doporučení [5].
Nová data z oblasti BSL
V odborné literatuře lze dnes najít řadu vědeckých publikací k tématu BSL – v gastroenterologii obecně se jedná o stovky prací, z toho bezmála 50 je věnováno dětské populaci. Také narůstá množství publikací, jejichž primárním cílem není posouzení efektivity či bezpečnosti BSL v konkrétní klinické situaci [9–33], ale BSL jsou zde používána jako léčiva v rámci obecné klinické studie týkající se BL, a to obvykle z důvodu jejich dobré dostupnosti a příznivé ceny v konkrétním centru. Jedná se např. o porovnání subkutánního a intravenózního IFX (CT-P13) v udržovací léčbě [34] nebo o porovnání step-up a top-down přístupu v použití BL u dětí [35].
Nedávno vydané review italských autorů shrnuje dosavadní poznatky o použití BSL IFX v pediatrii [36]. Bylo nalezeno osm publikací, z nichž čtyři (tři prospektivní a jedna retrospektivní) hodnotily účinnost BSL IFX v indukční fázi. Klinická odpověď BSL dosahuje 86–90 % a remise 67–68 % a je srovnatelná s originálním léčivem. Obdobné výsledky byly publikovány ve čtyřech prospektivních studiích zaměřených na pacienty, u nichž byl proveden switch z originálního IFX na BSL. Nejčastěji popisovanými nežádoucími účinky BSL byly mírné infekty horních cest dýchacích a BSL se zdá stejně bezpečný jako referenční léčivo. Imunogenicita nebyla switchem významně ovlivněna [36].
Současný stav schvalování BSL
Ke konci roku 2021 bylo evidováno celkem 33 BSL k 11 referenčním produktům schváleným americkým Úřadem pro kontrolu léčiv (FDA – Food and Drug Administration) [1], z toho 11 BSL je z oblasti léčby IBD (7x adalimumab – ADA, 4x IFX). V procesu schvalování je však řádově větší množství produktů [37]. V současné době je v ČR v oboru gastroenterologie k dispozici několik BSL vycházejících jak z molekuly ADA, tak IFX (tab. 1). Obvyklá doba od podání žádosti do schválení produktu FDA je 12 měsíců. V roce 2021 byl však FDA schválen pouze jeden nový BSL v oblasti IBD (Yusimry – ADA). Důvodem zpomalení procesu příchodu nových BSL na trh může být současná pandemie covidu-19. Současný farmaceutický výzkum je také významně zaměřen na průkaz efektivity a bezpečnosti opakovaných switchů a zaměnitelnosti (interchangeability). Předpokládané snížení nákladů na léčbu udávané výrobci je 15–57 % v závislosti na referenčním produktu. Nižší cena je důvodem postupně vzrůstajícího podílu BSL na trhu BL. V případě BSL IFX se v USA jednalo o více než 25% podíl na trhu ke konci druhého čtvrtletí 2021 [1]. Podle dotazníkové studie mezi dětskými IBD centry v Evropě a v USA mělo s použitím BSL zkušenosti cca 40 % pracovišť [38]. Recentní italská studie uvádí zkušenost s BSL u 20 z 26 dětských IBD center včetně bohaté zkušenosti se switchem v udržovací fázi léčby [39].
Table 1. Seznam biosimilárních léčiv v oboru gastroenterologie (řazeno abecedně, zdroj: AISLP).
Tab. 1. List of biosimilar drugs in the field of gastroenterology (in alphabetical order, source: AISLP).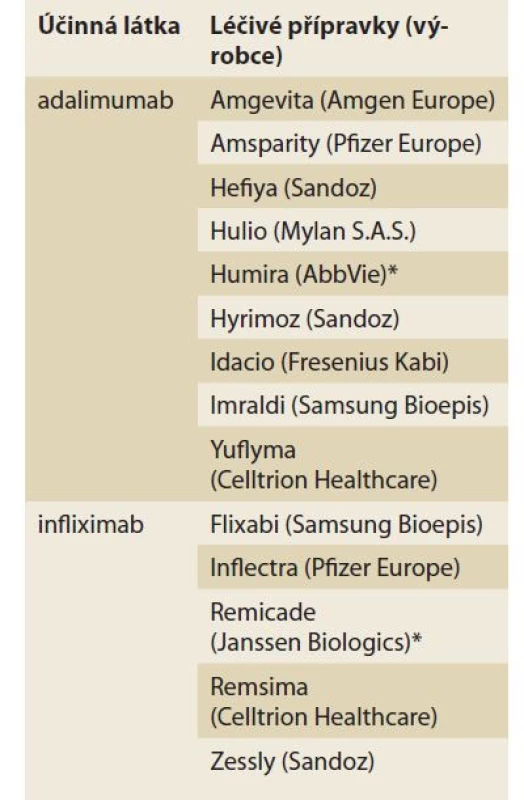
* originální (referenční) přípravek Závěrem
Závěrem lze říci, že od roku 2013, kdy byl schválen první BSL v oblasti gastroenterologie, doznala celá tato oblast významných změn a od počátečního ostýchavého postoje odborné veřejnosti jsme se postupně dostali do situace, kdy je použití BSL zcela běžnou součástí klinické praxe. Dostupná data o efektivitě a bezpečnosti BSL umožňují nasazení BSL u pacienta naivního k biologické léčbě a v řadě zdravotnických zařízení je běžně prováděn switch mezi jednotlivými preparáty. V oblasti dětské gastroenterologie stále převládá rezervovanější přístup, kdy v některých centrech jsou BSL používána u pacientů naivních k BL, ale switch u dětských IBD pacientů v klinické remisi je stále předmětem odborných diskuzí. Je pravděpodobné, že s příchodem nových dat z klinických studií a větších zkušeností s BSL u pediatrických pacientů dojde ke změně stanovisek odborných společností a následně i ke změně klinické praxe ve smyslu širšího použití BSL i v dětské gastroenterologii.
ORCID autora
J. Bronský ORCID 0000-0002-2641-7280.
Doručeno/Submitted: 20. 1. 2022
Přijato/Accepted: 24. 1. 2022
prof. MUDr. Jiří Bronský, Ph.D.
Oddělení dětské gastroenterologie
Pediatrická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Tento článek vznikl s podporou společnosti Sandoz.
Sources
1. Biosimilars 2021 Year in Review [online]. Available from: https: //www.fr.com/biosimilars - 2021-year-in-review/.
2. de Ridder L, Waterman M, Turner D et al. Use of biosimilars in paediatric inflammatory bowel disease: a position statement of the ESPGHAN paediatric IBD porto group. J Pediatr Gastroenterol Nutr 2015; 61 (4): 503–508. doi: 10.1097/MPG.0000000000000903.
3. de Ridder L, Assa A, Bronsky J et al. Use of biosimilars in pediatric inflammatory bowel disease: an updated position statement of the pediatric IBD porto group of ESPGHAN. J Pediatr Gastroenterol Nutr 2019; 68 (1): 144–153. doi: 10.1097/MPG.0000000000002141.
4. Danese S, Gomollon F. Governing board and operational board of ECCO. ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). J Crohns Colitis 2013; 7 (7): 586–589. doi: 10.1016/j.crohns.2013.03.011.
5. Danese S, Fiorino G, Raine T et al. ECCO position statement on the use of biosimilars for inflammatory bowel disease – an update. J Crohns Colitis 2017; 11 (1): 26–34. doi: 10.1093/ecco-jcc/jjw198.
6. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70 (1): 11–27. doi: 10.14735/amgh201611.
7. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73 (1): 11–24. doi: 10.14735/amgh201911.
8. Bronský J, Beránková K, Černá Z et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí – doplněk k 1. vydání. Gastroent Hepatol 2017; 71 (1): 11–18. doi: 10.14735/amgh201711.
9. Haifer C, Srinivasan A, An YK et al. Switching Australian patients with moderate to severe inflammatory bowel disease from originator to biosimilar infliximab: a multicentre, parallel cohort study. Med J Aust 2021; 214 (3): 128–133. doi: 10.5694/mja2.50824.
10. Martínez-Feito A, Bravo-Gallego LY, Hernández-Breijo B et al. Infliximab concentrations in two non-switching cohorts of patients with inflammatory bowel disease: originator vs. biosimilar. Sci Rep 2020; 10 (1): 17099. doi: 10.1038/s41598-020-74235-1.
11. Nikkonen A, Kolho KL. Infliximab and its biosimilar produced similar first-year therapy outcomes in patients with inflammatory bowel disease. Acta Paediatr 2020; 109 (4): 836–841. doi: 10.1111/apa.15026.
12. Kamat N, Kedia S, Ghoshal UC et al. Effectiveness and safety of adalimumab biosimilar in inflammatory bowel disease: a multicenter study. Indian J Gastroenterol 2019; 38 (1): 44–54. doi: 10.1007/s12664-018-0922-1.
13. van Hoeve K, Dreesen E, Hoffman I et al. Efficacy, pharmacokinetics, and immunogenicity is not affected by switching from infliximab originator to a biosimilar in pediatric patients with inflammatory bowel disease. Ther Drug Monit 2019; 41 (3): 317–324. doi: 10.1097/FTD.0000000000000601.
14. Bálint A, Rutka M, Kolar M et al. Infliximab biosimilar CT-P13 therapy is effective in maintaining endoscopic remission in ulcerative colitis – results from multicenter observational cohort. Expert Opin Biol Ther 2018; 18 (11): 1181–1187. doi: 10.1080/14712598.2018.1530758.
15. Armuzzi A, Fiorino G, Variola A et al. The PROSIT cohort of infliximab biosimilar in IBD: a prolonged follow-up on the effectiveness and safety across Italy. Inflamm Bowel Dis 2019; 25 (3): 568–579. doi: 10.1093/ibd/izy264.
16. Gervais L, McLean LL, Wilson ML et al. Switching from originator to biosimilar infliximab in paediatric inflammatory bowel disease is feasible and uneventful. J Pediatr Gastroenterol Nutr 2018; 67 (6): 745–748. doi: 10.1097/MPG.0000000000002091.
17. Smits LJT, van Esch AAJ, Derikx LAAP et al. Drug survival and immunogenicity after switching from remicade to biosimilar CT-P13 in inflammatory bowel disease patients: two-year follow-up of a prospective observational cohort study. Inflamm Bowel Dis 2019; 25 (1): 172–179. doi: 10.1093/ibd/izy227.
18. Høivik ML, Buer LCT, Cvancarova M et al. Switching from originator to biosimilar infliximab – real world data of a prospective 18 months follow-up of a single-centre IBD population. Scand J Gastroenterol 2018; 53 (6): 692–699. doi: 10.1080/00365521.2018.1463391.
19. Chanchlani N, Mortier K, Williams LJ et al. Use of infliximab biosimilar versus originator in a pediatric United Kingdom inflammatory bowel disease induction cohort. J Pediatr Gastroenterol Nutr 2018; 67 (4): 513–519. doi: 10.1097/MPG.0000000000002011.
20. Binkhorst L, Sobels A, Stuyt R et al. Short article: switching to a infliximab biosimilar: short-term results of clinical monitoring in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol 2018; 30 (7): 699–703. doi: 10.1097/MEG.0000000000001113.
21. Kang B, Lee Y, Lee K et al. Long-term outcomes after switching to CT-P13 in pediatric-onset inflammatory bowel disease: a single-center prospective observational study. Inflamm Bowel Dis 2018; 24 (3): 607–616. doi: 10.1093/ibd/izx047.
22. Farkas K, Rutka M, Ferenci T et al. Infliximab biosimilar CT-P13 therapy is effective and safe in maintaining remission in Crohn‘s disease and ulcerative colitis – experiences from a single center. Expert Opin Biol Ther 2017; 17 (11): 1325–1332. doi: 10.1080/14712598.2017.1363885.
23. Smits LJT, Grelack A, Derikx LAAP et al. Long-term clinical outcomes after switching from Remicade® to biosimilar CT-P13 in inflammatory bowel disease. Dig Dis Sci 2017; 62 (11): 3117–3122. doi: 10.1007/s10620-017-4661-4.
24. Reinisch W, Jahnsen J, Schreiber S et al. Evaluation of the cross-reactivity of antidrug antibodies to CT-P13 and infliximab reference product (Remicade): an analysis using immunoassays tagged with both agents. BioDrugs 2017; 31 (3): 223–237. doi: 10.1007/s40259-017-0219-4.
25. Jahnsen J, Kaasen Jørgensen K. Experience with biosimilar infliximab (Remsima®) in Norway. Dig Dis 2017; 35 (1–2): 83–90. doi: 10.1159/000449088.
26. Razanskaite V, Bettey M, Downey L et al. Biosimilar infliximab in inflammatory bowel disease: outcomes of a managed switching programme. J Crohns Colitis 2017; 11 (6): 690–696. doi: 10.1093/ecco-jcc/jjw216.
27. Fiorino G, Manetti N, Armuzzi A et al. The PROSIT-BIO cohort: a prospective observational study of patients with inflammatory bowel disease treated with infliximab biosimilar. Inflamm Bowel Dis 2017; 23 (2): 233–243. doi: 10.1097/MIB.0000000000000995.
28. Buer LC, Moum BA, Cvancarova M et al. Switching from Remicade® to Remsima® is well tolerated and feasible: a prospective, open-label study. J Crohns Colitis 2017; 11 (3): 297–304. doi: 10.1093/ecco-jcc/jjw166.
29. Farkas K, Rutka M, Golovics PA et al. Efficacy of infliximab biosimilar CT-P13 induction therapy on mucosal healing in ulcerative colitis. J Crohns Colitis 2016; 10 (11): 1273–1278. doi: 10.1093/ecco-jcc/jjw085.
30. Smits LJ, Derikx LA, de Jong DJ et al. Clinical outcomes following a switch from Remicade® to the biosimilar CT-P13 in inflammatory bowel disease patients: a prospective observational cohort study. J Crohns Colitis 2016; 10 (11): 1287–1293. doi: 10.1093/ecco-jcc/jjw087.
31. Keil R, Wasserbauer M, Zádorová Z et al. Clinical monitoring: infliximab biosimilar CT-P13 in the treatment of Crohn‘s disease and ulcerative colitis. Scand J Gastroenterol 2016; 51 (9): 1062–1068. doi: 10.3109/00365521.2016.1149 883.
32. Sieczkowska J, Jarzębicka D, Banaszkiewicz A et al. Switching between infliximab originator and biosimilar in paediatric patients with inflammatory bowel disease. Preliminary observations. J Crohns Colitis 2016; 10 (2): 127–132. doi: 10.1093/ecco-jcc/jjv233.
33. Park SH, Kim YH, Lee JH et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev Gastroenterol Hepatol 2015; 9 (Suppl 1): 35–44. doi: 10.1586/17474124.2015.1091309.
34. Schreiber S, Ben-Horin S, Leszczyszyn J et al. Randomized controlled trial: subcutaneous vs intravenous infliximab CT-P13 maintenance in inflammatory bowel disease. Gastroenterology 2021; 160 (7): 2340–2353. doi: 10.1053/j.gastro.2021.02.068.
35. Jongsma MME, Aardoom MA, Cozijnsen MA et al. First-line treatment with infliximab versus conventional treatment in children with newly diagnosed moderate-to-severe Crohn‘s disease: an open-label multicentre randomised controlled trial. Gut 2022; 71 (1): 34–42. doi: 10.1136/gutjnl-2020-322339.
36. Dipasquale V, Romano C. Biosimilar infliximab in paediatric inflammatory bowel disease: efficacy, immunogenicity and safety. J Clin Pharm Ther 2020; 45 (6): 1228–1234. doi: 10.1111/jcpt.13239.
37. FDA-TRACK: Center for Drug Evaluation & Research – Pre-Approval Safety Review – Biosimilars Dashboard. 2021 [online]. Available from: https: //www.fda.gov/about-fda/fda-track-agency-wide-program-performance/fda-track-center-drug-evaluation-research-pre-approval-safety-review-biosimilars-dashboard.
38. Bronsky J, de Ridder L, Ruemmele FM et al. Diagnostic and therapeutic approach in paediatric inflammatory bowel diseases: results from a clinical practice survey. J Pediatr Gastroenterol Nutr 2019; 68 (5): 676–683. doi: 10.1097/MPG.0000000000002233.
39. Dipasquale V, Martinelli M, Aloi M et al. Real-life use of biosimilars in pediatric inflammatory bowel disease: a nation-wide web survey on behalf of the SIGENP IBD working group. Paediatr Drugs 2022; 24 (1): 57–62. doi: 10.1007/s40272-021-00486-8.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2022 Issue 1-
All articles in this issue
- Perspektivní rok 2022
- Buďme optimisty!
- Kvíz z klinické praxe
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
- Komplikovaný průběh Crohnovy nemoci tenkého střeva u nemocné v osmém decenniu
- Point-of-care metoda měření hladiny infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty na biologické léčbě
- Biosimilární léčba v dětské gastroenterologii – současný pohled
- Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Výběr z mezinárodních časopisů
- Odešla mimořádná osobnost české gastroenterologie – Ivo Skála (17. 12. 1933 – 10. 2. 2022)
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: IBD
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

