-
Medical journals
- Career
Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
Authors: O. Urban 1,2; P. Fojtík 1; Přemysl Falt 1,2; M. Kliment 1,2; O. Mikolájek 1; M. Mazur 1; A. Foltýs 1; P. Holéczy 1,2; R. Andělová 3; M. Baník 3; I. Kasperčík 3; P. Barabáš 4; J. Richter 4
Authors‘ workplace: Vzdělávací a výzkumný institut AGEL, o. p. s., pobočka Ostrava-Vítkovice, Vítkovická nemocnice a. s., Centrum péče o zažívací trakt 1; LF OU v Ostravě 2; Patologie, Laboratoře AGEL a. s., Nový Jičín 3; Komplexní onkologické centrum, Nový Jičín 4
Published in: Gastroent Hepatol 2015; 69(1): 65-69
Category: Digestive Endoscopy: Original Article
doi: https://doi.org/10.14735/amgh201565Overview
Prezentujeme prospektivně sledovaný soubor 25 nemocných s žaludeční lézí léčených endoskopickou submukózní disekcí (G ‑ ESD). Cílem studie je posoudit krátkodobé výsledky léčby.
Metody:
Do studie byli zařazeni všichni nemocní, u kterých byla provedena G ‑ ESD v období 11/ 2011 – 10/ 2014. Léze byly indikovány podle rozšířených (expanded) kritérií. Za ukazatele krátkodobých výsledků léčby jsme považovali en bloc resekci, R0 resekci, kurativní resekci a výskyt komplikací.Výsledky:
Definitivní histologické vyšetření diagnostikovalo neoplazii ve 20 (80 %) případech. Z nich bylo en bloc, R0 a kurativní resekce dosaženo u 17 (85 %), 17 (85 %) a 16 (80 %). Perforace se vyskytla u dvou (8 %) nemocných, u jednoho (4 %) z nich byla řešena chirurgicky. Třicetidenní mortalita byla nulová.Závěry:
Prezentujeme první soubor G ‑ ESD v České republice. Dosáhli jsme krátkodobých výsledků léčby srovnatelných s daty z východoasijských center. Limitací výsledků je výběrový charakter souboru.Klíčová slova:
adenokarcinom žaludku – endoskopická submukózní disekce – R0 resekce
Adenokarcinom žaludku je celosvětově čtvrtým nejčastějším zhoubným nádorem. Je příčinou 10 % nádorových úmrtí. Nejvyšší incidence onemocnění je hlášena z Koreje, kde v roce 2012 dosáhla hodnoty 41,8 % [1]. V České republice byly v roce 2010 incidence a mortalita u mužů 18,5 %, resp. 14,5 % a u žen 11,8 %, resp. 9,3 % [2].
Jedinou nadějí na vyléčení je resekce nádoru, která je v Evropě a USA nejčastěji provedena chirurgicky. Ačkoli je standardní resekce žaludku nejradikálnějším způsobem lokoregionální léčby, je spojena se závažnými komplikacemi a sníženou kvalitou života [3]. V Japonsku a Koreji se proto standardem léčby povrchových stadií onemocnění staly endoskopická slizniční resekce (EMR) a endoskopická submukózní disekce (ESD), které ve srovnání s chirurgickou léčbou poskytují stejné dlouhodobé přežívání při nižším výskytu komplikací a vyšší kvalitě života [4].
ESD je technicky náročná metoda. V západních zemích s nízkou incidencí adenokarcinomu žaludku je dosud prováděna sporadicky v několika centrech. Rovněž publikace na téma žaludeční ESD (G ‑ ESD) v západních zemích jsou nečetné.
Cílem naší studie je popsat krátkodobé výsledky 25 prospektivně sledovaných G ‑ ESD provedených v moravském gastroenterologickém centru.
Soubor nemocných a metoda
Prezentujeme prospektivně sledovaný soubor nemocných léčených v Centru péče o zažívací trakt Vítkovické nemocnice v Ostravě v období 11/ 2011 – 10/ 2014. Do souboru jsme zařadili všechny nemocné, kteří v uvedeném období podstoupili G ‑ ESD.
Ke G ‑ ESD jsme indikovali dysplazii nebo karcinom v případech, které endoskopista považoval za technicky zvládnutelné.
Karcinomy jsme ke G ‑ ESD indikovali podle tzv. rozšířených kritérií (expanded criteria) podle Japonské společnosti pro karcinom žaludku (JGCA): 1. dobře diferencovaný intramukózní adenokarcinom bez ulcerace jakékoli velikosti; 2. dobře diferencovaný exulcerovaný intramukózní adenokarcinom menší 30 mm; 3. dobře diferencovaný sm1 invadující adenokarcinom menší 30 mm a 4. nízce diferencovaný intramukózní karcinom menší 20 mm [5,6].
U všech nemocných bylo provedeno endosonografické (EUS) vyšetření, nejčastěji s použitím vysokofrekvenční minisondy s pracovními frekvencemi 20 MHz nebo 30 MHz.
Za ukazatele krátkodobých výsledků léčby G ‑ ESD jsme považovali en bloc resekci, R0 resekci, kurativní resekci a výskyt komplikací. Za en bloc jsme označili resekci neoplazie včetně koagulačních značek v jednom bloku bez fragmentace – posuzoval endoskopista. Za R0 jsme považovali en bloc resekci negativní na přítomnost nádorové tkáně ve vertikální a horizontální resekční linii při histologickém vyšetření – posuzoval patolog. V případě, kdy okraj nemohl být histologicky zhodnocen, jsme resekci označili jako Rx. V případě histologicky pozitivního resekčního okraje se jednalo o resekci R1. Za kurativní jsme považovali R0 resekci bez přítomnosti histologických známek nepříznivé prognózy, tj. lymfovaskulární invaze nebo submukózní nádorové invaze > 500 µm.
U nemocných s nekurativní resekcí jsme indikovali chirurgickou léčbu, bylo‑li operační riziko přijatelné a nemocný s operací souhlasil.
Před výkonem podepsal každý nemocný informovaný souhlas, jehož součástí bylo uvedení chirurgické léčby jako alternativy ESD. V případech histologicky ověřeného karcinomu jsme léčebný postup konzultovali na mezioborovém onkologickém semináři. Studie proběhla v souladu s etickými principy Helsinské deklarace a v souladu se zásadami správné klinické praxe.
Všechny výkony provedl jeden endoskopista (prim. Ondřej Urban) s předchozí praxí asi 20 G ‑ ESD. Ve studijním období prováděl kromě G ‑ ESD rovněž ESD v jiných lokalizacích s frekvencí 25 výkonů ročně. G ‑ ESD jsme prováděli v analgosedaci nebo v celkové anestezii. Demarkační linii jsme diagnostikovali chromoendoskopií s 0,2% indigokarminem nebo virtuální chromoendoskopií s využitím narrow ‑ band imaging (NBI) módu. Obvod léze jsme označili koagulačními značkami ve vzdálenosti 2 mm od demarkační linie. K submukózní injekci jsme použili hyperosmolární roztok nebo fyziologický roztok, vždy s příměsí adrenalinu 100 000 : 1 a několika kapek metylenové modři. Cirkulární incize a submukózní disekce byly nejčastěji provedeny nástrojem IT ‑ knife 2, dále IT ‑ knife, IT ‑ knife nano, Dual ‑ knife (všechny Olympus) a Flush ‑ knife (Fujifilm). K cirkulární incizi a submukózní disekci byl použit proud Endocut (ERBE, 80/ 60 W). Krvácení ze submukózních cév bylo ošetřeno koagulací nástrojem pro disekci nebo koagulačními kleštěmi (coagrasper) s použitím koagulačního proudu.
Resekované léze byly vybaveny, rozepjaty a fixovány na korkové podložce. En bloc resekce byla potvrzena identifikací koagulačních značek. Léze byla změřena posuvným měřítkem a vyfotografována (obr. 1 – 5). Preparát byl fixován ve formalinu. Histologické vyšetření bylo provedeno týmem patologů se zkušeností s hodnocením více než 1 000 EMR a několika desítek ESD.
Image 1. Povrchová neoplastická léze typu 0–IIa+IIc velikosti 66 × 40 mm v antru žaludku. Fig. 1. Superficial neoplastic lesion, type 0–IIa+IIc, size 66 × 40 mm, location gastric antrum. 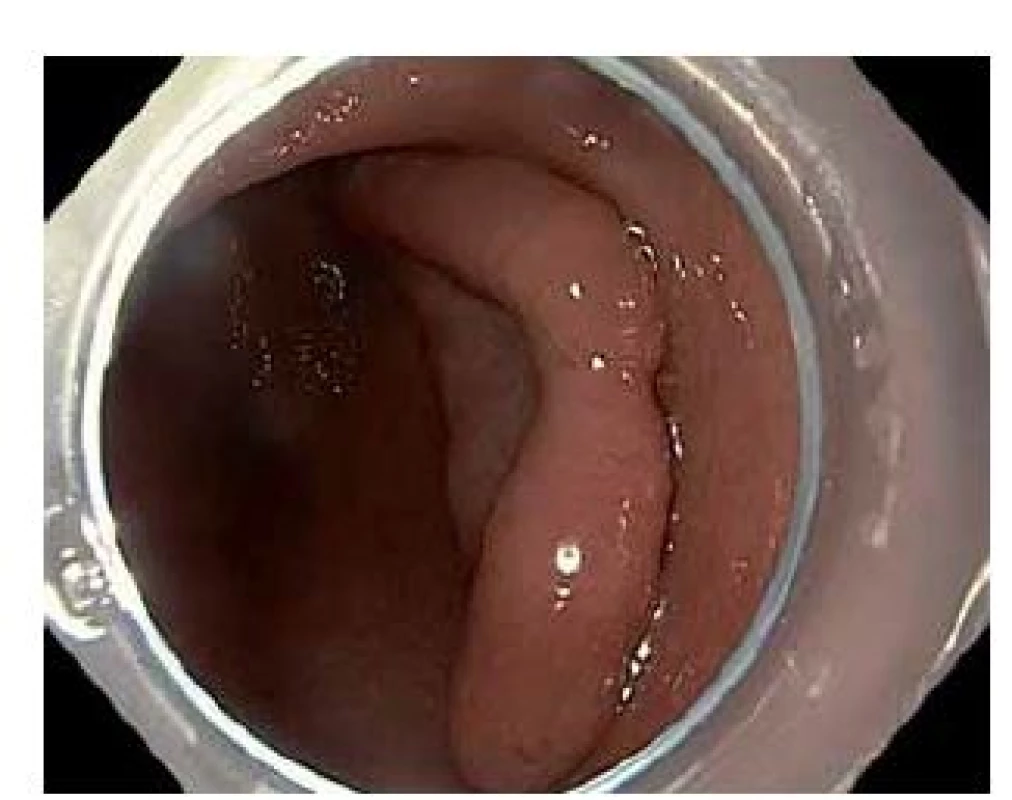
Image 2. Cirkulární incize nástrojem IT-knife2. Fig. 2. Circumferential incision made using IT-knife 2. 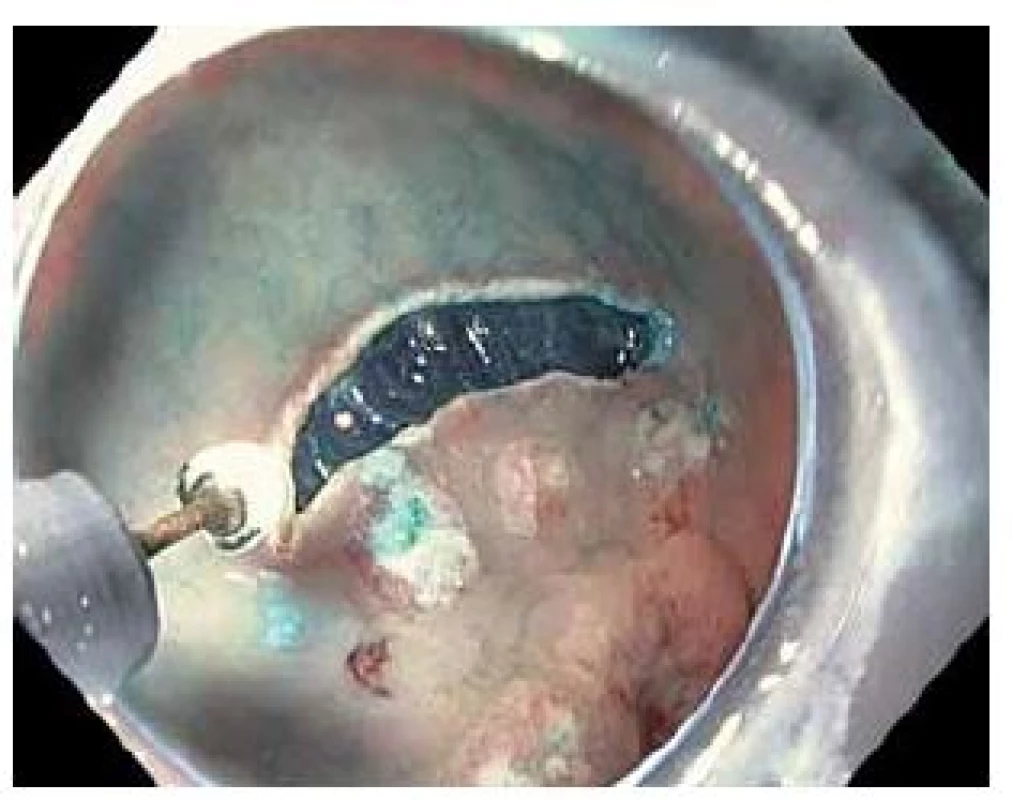
Image 3. Submukózní disekce. Submukóza zbarvena metylenovou modří. Fig. 3. Submucosal dissection. Submucosal layer stained by methylen blue. 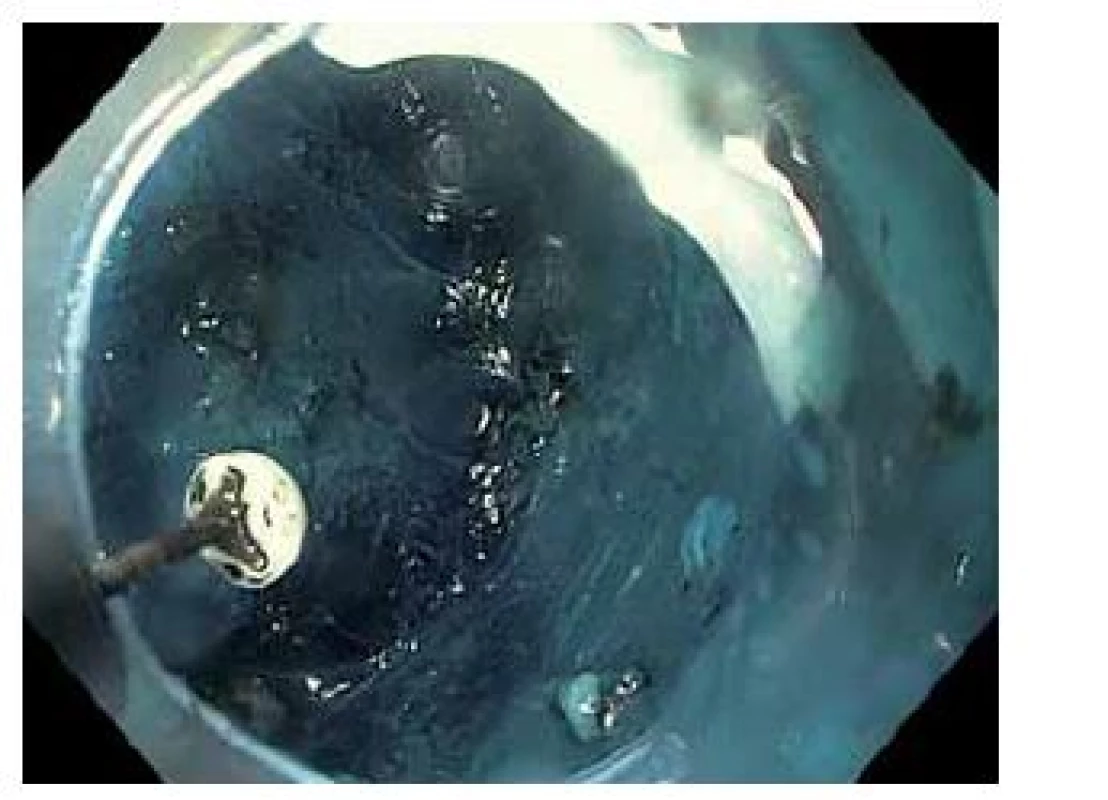
Image 4. Spodina po endoskopické submukózní disekci. Fig. 4 Arteficial ulcer after endoscopic submucosal dissection. 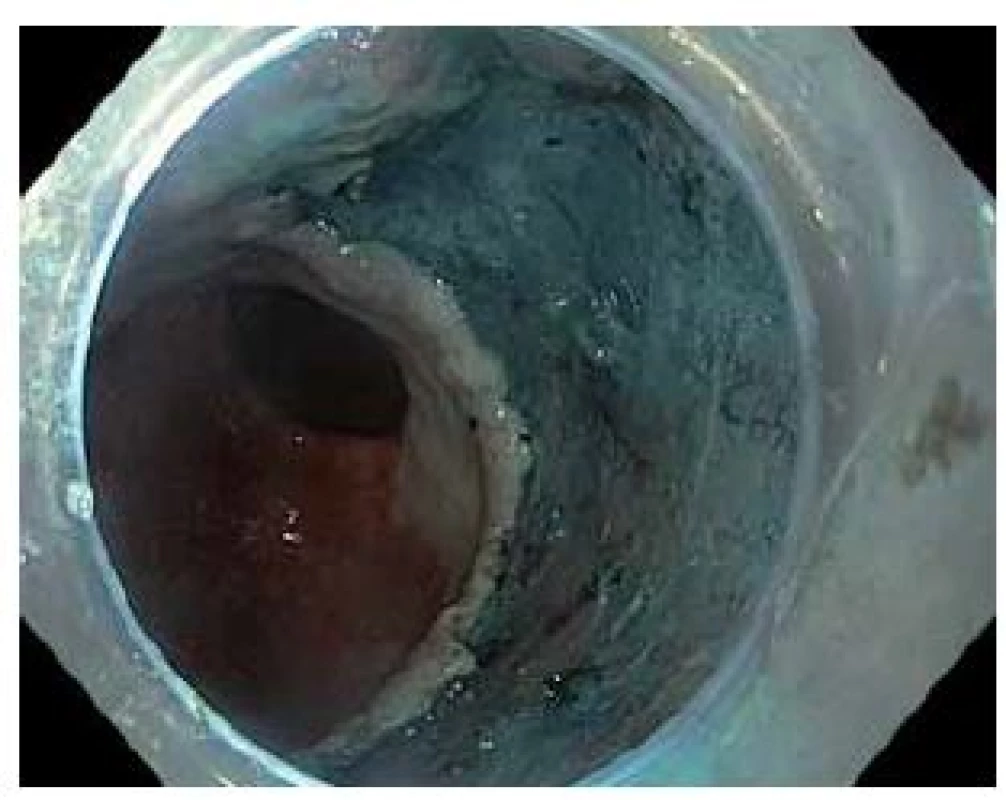
Image 5. Resekát rozměrů 75 × 40 mm fixován na korkové podložce (histologicky tubulovilózní adenom s ložisky intramukózního karcinomu, kurativní resekce). Fig. 5. Resected specimen, size 75 × 40 mm, stretched on a corc plate ( histology reveals tubulo-villous adenoma with multiple foci of intramucosal carcinoma, curative resection). 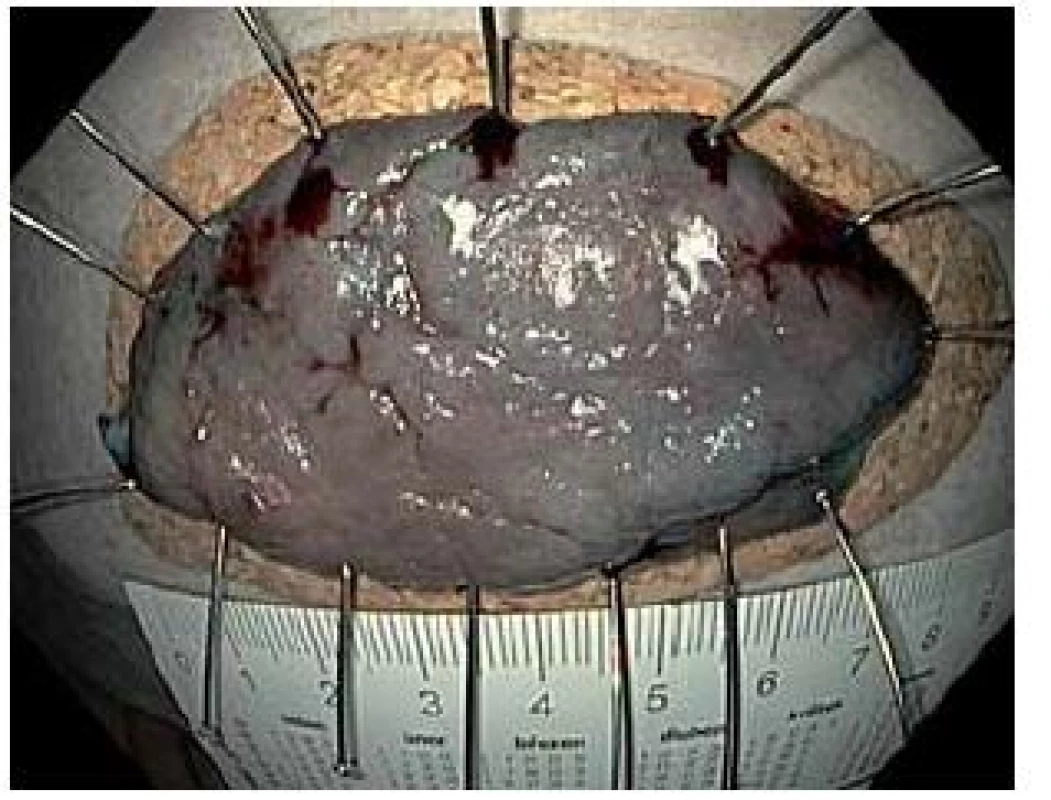
Všichni nemocní po G ‑ ESD byli hospitalizováni. V den zákroku jsme vyloučili příjem per os a aplikovali intravenózně blokátor protonové pumpy (PPI). První pooperační den jsme povolili tekutiny, druhý měkkou stravu a třetí šetřicí dietu. Délka hospitalizace nekomplikovaných případů byla 3 – 4 dny. V perorálním podávání PPI jsme pokračovali do první endoskopické kontroly. V případě pozitivity jsme indikovali léčbu infekce H. pylori.
Nemocné jsme dispenzarizovali podle modifikovaných doporučení navržených Gotodou. V případech po kurativní resekci podle guidelines kritérií kontrolujeme pouze endoskopicky za tři a dvanáct měsíců a dále každoročně. V případech kurativní resekce podle expandovaných kritérií indikujeme po roce navíc také CT vyšetření. Nemocné po nekurativní resekci, kteří nepodstoupili operaci, sledujeme individuálně [6].
Výsledky
Do studie jsme zařadili 25 nemocných (14 žen a 11 mužů) průměrného věku 71,5 (40 – 90) let, u kterých jsme provedli celkem 25 G ‑ ESD.
Celkem 15 (60 %) lézí bylo lokalizováno v antru, tři (12 %) angulárně, tři (12 %) v těle, tři (12 %) subkardiálně a jedna (4 %) v kardii.
Průměrná velikost léze byla 20 (5 – 66) mm. Průměrný operační čas od zavedení endoskopu do vybavení resekátu byl 95 (20 – 240) min.
Typ léze byl 0 – Is v sedmi (28 %) případech, 0 – IIa v deseti (40 %), 0II – b v jednom (4 %), 0 – IIa+IIc v pěti (20 %) a 0 – IIa+III v jednom (4 %). V jednom (4 %) zbývajícím případě se jednalo o subepiteliální lézi.
Postresekční histologické vyšetření zjistilo neoplastickou lézi ve 20 (80 %) případech, zbylých pět (20 %) lézí bylo neneoplastických. Ve třech (12 %) případech se jednalo o low ‑ grade dysplazii (LGD), v pěti (20 %) o high‑grade dysplazii (HGD), v pěti (20 %) o intramukózní karcinom (T1m), ve třech (12 %) o karcinom s invazí do horní třetiny submukózy (T1sm1), ve dvou (8 %) o karcinom s masivní submukózní invazí (T1 > sm1) a ve dvou (8 %) o neuroendokrinní tumor (NET, dříve karcinoid). V případech neneoplastických lézí se ve třech (12 %) případech jednalo o léze hyperplastické, v jednom (4 %) o intestinální metaplazii a v jednom (4 %) o aberantní pankreas. Výsledek předresekční klešťové biopsie se shodoval s finální histologickou diagnózou ve 14 (56 %) případech, ve čtyřech (16 %) případech došlo ke změně diagnózy, ve čtyřech (16 %) případech se jednalo o podhodnocení (understaging) a ve třech (12 %) o nadhodnocení (overstaging).
Krátkodobé výsledky léčby jsme vyhodnotili u 20 lézí s definitivní diagnózou neoplazie. En bloc resekce jsme dosáhli v 17 (85 %) případech, R0 resekce v 17 (85 %) případech a kurativní resekce v 16 (80 %).
Celkem ve čtyřech (20 %) případech nekurativní resekce se dvakrát jednalo o přítomnost neoplazie v laterálním resekčním okraji při histologickém vyšetření (R1). Jeden z těchto nemocných zemřel dva měsíce po výkonu z kardiálních příčin ve věku 90 let, druhý je sledován bez známek recidivy při kontrolní gastroskopii za tři a šest měsíců a stav hodnotíme jako úplnou remisi. U dalšího nemocného s hlenotvorným karcinomem invadujícím do sm1 byla realizována chirurgická léčba. Poslední nemocné s R1 resekcí nízce diferencovaného karcinomu s pozitivním laterálním resekčním okrajem byl následně zjištěn inoperabilní karcinom pankreatu.
Perforace se vyskytla u dvou (8 %) nemocných. V jednom případě se jednalo o intraprocedurální perforaci, která byla uzavřena klipováním, výkon byl dokončen s kurativním výsledkem a stav zvládnut konzervativně. Ve druhém případě se jednalo o opožděnou perforaci 24 hod po výkonu, bylo vyřešeno suturou z laparoskopického přístupu, což si vyžádalo prodloužení hospitalizace o deset dnů. Krvácení vyžadující emergentní endoskopické ošetření, transfuzi nebo chirurgický zákrok jsme nezaznamenali. Třicetidenní mortalita v souboru byla nulová.
Diskuze
Časný karcinom žaludku (EGC) je definován jako karcinom s invazí maximálně do submukózy (T1) bez ohledu na postižení lymfatických uzlin. Pokud infiltruje pouze sliznici (T1m) nebo přilehlou třetinu submukózy (T1sm1), má v zemích jihovýchodní Asie endoskopická léčba přednost před chirurgickou, protože je při stejných onkologických výsledcích zatížena menším rizikem komplikací a poskytuje vyšší kvalitu života.
G ‑ ESD zavedli do klinické praxe Japonci H. Ono a M. Ohkuwa v roce 2001 [7,8]. Metoda se rychle rozšířila a v roce 2012 bylo v Japonsku provedeno 39 000 G ‑ ESD, což představovalo 31 % z incidence 125 700 karcinomů žaludku. V roce 2013 toto číslo dále vzrostlo na 42 100 [9]. Ve srovnání s EMR poskytuje ESD častěji R0 resekci, čehož praktickým dopadem je nižší výskyt rekurence neoplazie. V současné době je na většině asijských pracovišť v žaludku prováděna pouze ESD.
Z Japonska se metoda rychle rozšířila nejprve na Korejský poloostrov a do Číny, později také na západní polokouli. Sdělení o první ESD v České republice jsme publikovali v roce 2006 [10]. Registr ESD v naší zemi neexistuje. Kvalifikovaným odhadem založeným na osobní komunikaci je u nás ročně provedeno asi 20 G ‑ ESD. Nedostatek informací o výsledcích léčby z domácích center může být jedním z důvodů nedostatečného povědomí o možnostech endoskopické léčby především v chirurgické a onkologické obci. Převládá nesprávný názor, že jedinou nadějí pro nemocného s karcinomem žaludku je chirurgická léčba. Důsledkem tohoto stavu je, že mnozí kandidáti endoskopické léčby jsou zbytečně vystavování rizikům chirurgické intervence, přičemž se často jedná o osoby staré a polymorbidní. V jedné ze srovnávacích studií se komplikace vyskytly v 5 % endoskopicky a 33 % chirurgicky léčených nemocných [4]. Zároveň je však nutné akceptovat, že 5 – 11 % endoskopicky léčených nemocných bude po G ‑ ESD stejně indikováno k chirurgické resekci. V těchto případech je možné chápat G ‑ ESD jako nejpřesnější stagingovou metodu. Ze studií je známo, že ESD nemá vliv na výsledek následné chirurgické resekce [11].
V této práci seznamujeme s výsledky léčby 20 nemocných. Jak en bloc, tak R0 resekce jsme dosáhli v 85 % případů. Toto číslo je srovnatelné s 92 %, resp. 82 % z metaanalýzy asijských dat a mírně horší než 92 %, resp. 91 % z recentně publikovaného portugalského souboru [12,13]. Kurativní resekce jsme dosáhli v 80 %. Toto číslo je shodné s výsledkem uvedeným v největším japonském souboru čítajícím 3 788 nemocných a 82 % v souboru portugalském, čítajícím 136 nemocných [14].
Významnými komplikacemi G ‑ ESD jsou zejména perforace a opožděné krvácení. Jsou reportovány v 1,2 – 9,7 %, resp. 1,8 – 16 % [12,13]. V recentní metaanalýze 28 japonských publikací, z nichž každá obsahovala soubor nejméně 300 ESD, bylo riziko perforace 1,2 – 5 %, opožděné perforace 0,5 % a opožděného krvácení 0 – 15,6 %. Rizikovým faktorem byla ESD v orální třetině žaludku. Perforaci bylo možné většinou uzavřít endoskopicky pomocí klipů, ale tato komplikace měla vliv na výsledek léčby, protože úspěšnost en bloc resekce klesla z 94 % na 74 % [15]. V našem souboru se vyskytla jediná intraprocedurální perforace při G ‑ ESD léze lokalizované subkardiálně u pacienta s pořadovým číslem 2, která byla vyřešena klipováním a neměla vliv na kurativní výsledek výkonu. Jediná opožděná perforace byla lokalizována v antru a vyskytla se u pacienta číslo 17. Byla vyřešena suturou z laparoskopického přístupu, G ‑ ESD byla kurativní. Významné krvácení se v našem souboru nevyskytlo, což je ovlivněno malou velikostí souboru. Z dalších komplikací jsme zaznamenali substenózu antra u jednoho nemocného.
Naše práce má celou řadu limitací. Především je náš soubor malý a zatížený chybou výběru způsobenou snahou minimalizovat výskyt komplikací. Dále musíme připustit, že karcinomy tvořily pouze 50 % našeho souboru. V dalších 20 % se však jednalo o HGD, která je v Asii často popisována jako neinvazivní intramukózní karcinom a v dalších 8 % se jednalo o NET, dříve karcinoid. Navíc, jak již bylo zmíněno výše, shoda mezi předintervenční a definitivní histologickou diagnózou byla pouze v 56 %. Podobné číslo nacházíme i v jiných pracích a to potvrzuje, že v mnoha případech rozhodne až definitivní histologické vyšetření o tom, zda se jedná o ESD kurativní nebo stagingovou. Lze také namítat, že prezentujeme pouze krátkodobá data. Nicméně je známo, že dosažení kurativní resekce je prediktivní pro dlouhodobou remisi onemocnění. Nemocné dále sledujeme. A konečně, výsledky léčby selektovaného souboru v jediném centru samozřejmě nelze zobecňovat. Zůstává však otázkou, kolik center, resp. endoskopických týmů kompetentních pro G ‑ ESD v naší zemi potřebujeme.
Závěr
Prezentujeme soubor 25 G ‑ ESD provedených v moravském gastroenterologickém centru. Podle našeho vědomí se jedná o první prezentovaný soubor v České republice. Prokazujeme, že G ‑ ESD je v našem centru zavedenou metodou. V selektovaném souboru nemocných jsme dosáhli krátkodobých výsledků srovnatelných s východoasijskými a nejlepšími evropskými centry. Metodu G ‑ ESD proto považujeme za zavedenou do klinické praxe. G ‑ ESD se také v naší zemi stala metodou první volby v léčbě povrchových neoplazií žaludku a její „nedostupnost“ by již neměla být důvodem k indikaci chirurgické terapie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 12. 2014
Přijato: 27. 1. 2015
MU Dr. Ondřej Urban, Ph.D.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zalužanského 1195/ 15 703 84 Ostrava
ondrej.urban@nemvitkovice.cz
Sources
1. Jemal A, Bray F, Center MM et al. Global cancer statistics. CA Cancer J Clin 2011; 61(2): 69 – 90. doi: 10.3322/ caac.20107.
2. Česká onkologická společnost ČLS JEP. [online]. Dostupné z: http:/ / www.linkos.cz/ .
3. Kodera Y, Sasako M, Yamamoto S et al. Identification of risk facors for the development of complications following extended and superextended lymphadenectomies for gastric cancer. Br J Surg 2005; 92(9): 1103 – 1109.
4. Chiu PW, Teoh HY, To KF et al. Endoscopic submucosal dissection (ESD) compared with gastrectomy for treatment of early gastric neoplasia: a retrospective cohort study. Surg Endosc 2012; 26(12): 3584 – 3591. doi: 10.1007/ s00464 ‑ 012 ‑ 2371 ‑ 8.
5. Gotoda T, Yanagisawa A, Sasako M et al.Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000; 3(4): 219 – 225.
6. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer 2011; 14(2): 113 – 123. doi: 10.1007/ s10120 ‑ 011 ‑ 0042 ‑ 4.
7. Ono H, Kondo H, Gotoda T et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001; 48(2): 225 – 229.
8. Ohkuwa M, Hosokawa K, Boku N et al. New endoscopic treatment for intramucosal gastric tumors using an insulated ‑ tip diathermic knife. Endoscopy 2001; 33(3): 221 – 226.
9. Ganjoho.jp [online in Japanese]. Available from: http:/ / ganjoho.jp/ public/ statistics/ pub/ statistics01.html.
10. Urban O, Vítek P, Fojtík P et al. Endoscopic submucosal dissection. Initial experience in the Czech Republic. Folia Gastroenterol Hepatol 2006; 4(1): 4 – 10.
11. Jung H, Bae JM,Choi MG et al. Surgical outcome after incomplete endoscopic submucosal dissection of gastric cancer. Br J Surg 2011; 98(1): 73 – 78. doi: 10.1002/ bjs.7274.
12. Lian J, Chen S, Zhang Y et al. A meta‑analysis of endoscopic submucosal dissection and EMR for early gastric cancer. Gastrointest Endosc 2012; 76(4): 763 – 770. doi: 10.1016/ j.gie.2012.06.014.
13. Park YM, Cho E, Kang HY et al. The effectiveness and safety of endoscopic submucosal dissection compared with endoscopic mucosal resection for early gastric cancer: a systematic review and metaanalysis. Surg Endosc 2011; 25(8): 2666 – 2677. doi: 10.1007/ s00464 ‑ 011 ‑ 1627 ‑ z.
14. Pimentel ‑ Nunes P, Mourao F, Veloso N et al. Long‑term follow‑up after endoscopic resection of gastric superficial neoplastic lesions in Portugal. Endoscopy 2014; 46(11): 933 – 940. doi: 10.1055/ s ‑ 0034 ‑ 1377348.
15. Toyokawa T, Inaba T, Omote S et al. Risk factors for perforation and delayed bleeding associated with endoscopic submucosal dissection for early gastric neoplasms: analysis of 1123 lesions. J Gastroenterol Hepatol 2012; 27(5): 907 – 912. doi: 10.1111/ j.1440 ‑ 1746.2011.07039.x.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2015 Issue 1-
All articles in this issue
- Novinky v roce 2015
- Nejen anti-TNF živ je IBD pacient
- Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
- Vedolizumab v léčbě ulcerózní kolitidy
- Topická léčba idiopatických střevních zánětů
- Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení
- Imunoablační léčba a autologní transplantace hematopoetických kmenových buněk u pacienta s agresivní formou Crohnovy nemoci refrakterní na medikamentózní terapii
- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
- Syndróm bakteriálneho prerastania
- Exviera, Viekirax
- Preparáty firmy Nutricia v enterální výživě u dětí
- Noví členové redakční rady časopisu
- Výzva ke spolupráci
- VIII. beskydský endoskopický workshop
- Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocí
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Syndróm bakteriálneho prerastania
- Topická léčba idiopatických střevních zánětů
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

