-
Medical journals
- Career
Vitamín D a metabolický syndróm u žien so syndrómom polycystických ovárií
Authors: Jana Figurová 1; Ingrid Dravecká 1; Jana Petríková 1; Martin Javorský 2; Darina Petrášová 3; Ivica Lazúrová 1
Authors‘ workplace: I. interná klinika LF UPJŠ a UN L. Pasteura, Košice, primár MUDr. Mikuláš Szakács 1; IV. interná klinika LF UPJŠ a UN L. Pasteura, Košice, prednosta prof. MUDr. Ivan Tkáč, PhD. 2; Laboratórium výskumných biomodelov LF UPJŠ, Košice, vedúci pracoviska RNDr. Darina Petrášová, PhD. 3
Published in: Forum Diab 2014; 3(3): 143-148
Category: Topic
Overview
Úvod:
Syndróm polycystických ovárií (PCOS) je jednou z najčastejšie sa vyskytujúcich endokrinopatií žien reprodukčného veku s prevalenciou 4–18 %. Okrem poruchy menštruačného cyklu s následnými poruchami plodnosti, hyperandrogenémie a jej kožných prejavov, nachádzame u týchto žien aj početné metabolické abnormality, a to vysoký výskyt jednotlivých prejavov metabolického syndrómu (MetS) a kardiovaskulárnych rizikových faktorov. Výskyt hypovitaminózy D v populácii pacientov so znakmi MetS, ako aj v skupine žien s PCOS, potencuje skúmanie o možnom podiele vitamínu D na fenotypovom prejave PCOS.Cieľ štúdie:
Určiť saturáciu organizmu vitamínom D u žien s PCOS a v kontrolnej skupine (KS), posúdiť vzťah hypovitaminózy D k jednotlivých znakom MetS pri PCOS.Metódy:
25(OH)D, základné antropometrické a metabolické parametre, celkové množstvo tukového tkaniva a jeho distribúcia v androidnej a gynoidnej oblasti boli stanovené v súbore 99 žien s diagnózou PCOS podľa Rotterdamských kritérií a u 66 žien KS.Výsledky:
Nepotvrdili sme signifikantný rozdiel v priemerných sérových hladinách 25(OH)D medzi PCOS a KS (24,79 ± 10,77 vs 25,07 ± 10,14 ng/ml, p = 0,868). Pacientky s PCOS spĺňajúce kritéria MetS mali signifikantne nižšie hodnoty 25(OH)D v porovnaní s PCOS bez MetS (20,6 ± 8,3 vs 25,9 ± 11,3 ng/ml; p = 0,049). Hypovitaminózne PCOS pacientky mali vyššie hladiny triacylglycerolov s hraničnou signifikanciou (1,44 ± 0,93 vs 1,03 ± 0,46; p = 0,051) a trend k vyššiemu HOMA-indexu: medián/percentil: 2,24 (1,38; 3,51) vs 1,85 (1,04; 3,68); p = 0,467 v porovnaní s PCOS ženami s normálnou saturáciou vitamínom D. 25(OH)D pozitívne koreloval s HDL-cholesterolom (r = 0,159; p = 0,043) u všetkých jedincov.Záver:
Nízke hladiny 25(OH)D nie sú asociované s PCOS samotným, ale s jednotlivými zložkami MetS pri PCOS.Kľúčové slová:
syndróm polycystických ovárií – vitamín D – metabolický syndróm – inzulínová rezistenciaÚvod
Syndróm polycystických ovárií (PCOS) je jednou z najčastejšie sa vyskytujúcich endokrinopatií žien reprodukčného veku a zároveň vedúcou príčinou infertility s maximom výskytu medzi 20. a 30. rokom života. Podľa typu aplikovaných diagnostických kritérií sa uvádza, že touto endokrinopatiou je postihnutých 4–18 % žien fertilného veku [1].
Okrem poruchy menštruačného cyklu s následnými poruchami plodnosti, hyperandrogenémie a jej kožných prejavov, nachádzame u týchto žien aj početné metabolické abnormality, a to vysoký výskyt jednotlivých prejavov metabolického syndrómu (MetS) a kardiovaskulárnych rizikových faktorov: abdominálna obezita, dyslipidémia, inzulínova rezistencia (IR), porucha glukózovej tolerancie (PGT), zvýšená prevalencia diabetes mellitus 2. typu (DM2T) a zvýšené riziko rozvoja kardiovaskulárnych ochorení (artériovej hypertenzie, subklinickej aterosklerózy a ischemickej choroby srdca (ICHS)) [2]. Vzhľadom k vysokej prevalencii ochorenia a k častej koincidencii s metabolickými chorobami sa v súvislosti s PCOS hovorí o modernej globálnej pandémii, tzv. diabezita [3].
Etiológia a patogenéza syndrómu dodnes nie je známa a jej presnejšie pochopenie by mohlo prispieť k lepšiemu manažmentu pacientiek s touto frekventnou endokrinopatiou. V posledných rokoch sa objavujú štúdie, ktoré sledujú metabolizmus vitamínu D vo vybraných skupinách populácie s nálezom signifikantne nižších hladín vitamínu D u pacientov s MetS [4]. Výskyt hypovitaminózy D bol popísaný aj v sporadických prácach sledujúcich metabolizmus vitamínu D a kalcia u žien s PCOS [5–7]. Vitamín D môže zasahovať do rozvoja ochorenia ovplyvnením génovej transkripcie génov regulujúcich glukózový a lipidový metabolizmus, ako hormonálny modulátor sa môže podieľať na ovplyvnení inzulínového metabolizmu a regulácií reprodukčných funkcií [8].
Cieľom práce bolo posúdiť stav saturácie organizmu vitamínom D v selektovanej skupine žien s PCOS a v kontrolnej skupine (KS), posúdiť hladiny vitamínu D v podskupine PCOS pacientiek s MetS a vzťah hypovitaminózy D k jednotlivým komponentom MetS pri PCOS.
Súbory a metódy
Táto prospektívna observačná štúdia analyzuje 99 žien s diagnózou PCOS podľa Rotterdamských kritérií [9], ktoré boli primárne identifikované v gynekologických, endokrinologických a diabetologických ambulanciách spolupracujúcich špecialistov z regiónu Košického kraja a následne vyšetrené na I. internej klinike Univerzitnej nemocnice L. Pasteura v Košiciach v období máj 2010 až marec 2013. Priemerný vek PCOS pacientiek zaradených do štúdie bol 29 ± 5 rokov (rozpätie 20–41 rokov, medián 29 rokov). Metabolický syndróm bol definovaný podľa National Cholesterol Education Program (NCEP) a the Adult Treatment Panel III (ATP III) odporúčaní u všetkých účastníkov štúdie [10].
Kontrolný súbor pozostával zo 66 pravidelne menštruujúcich premenopauzálnych žien fertilného veku bez klinicky manifestných prejavov hyperandrogenizmu. Priemerný vek žien v KS bol 28 ± 4 rokov (rozpätie 21–44 rokov, medián 28 rokov).
Od všetkých účastníkov štúdie bol vopred získaný informovaný súhlas s dobrovoľnou účasťou na klinickej štúdii a jej prevedenie bolo schválené Etickou komisiou Univerzitnej Nemocnice L. Pasteura v Košiciach.
U všetkých PCOS žien a v KS boli stanovené základné antropometrické parametre: výška, hmotnosť, BMI, obvod pása, obvod bokov. BMI bol vypočítaný ako pomer hmotnosť/výška v metroch štvorcových (kg/m2). V oboch sledovaných skupinách sme vyšetrili vybrané endokrinné a biochemické parametre: glykémia nalačno (glukóza0, referenčné rozhranie 4,1–6,1 mmol/l), inzulín v plazme nalačno (inzulín0 referenčné rozhranie 2–25 µIU/ml), lipidový profil: celkový cholesterol (referenčné rozhranie 2,57–5,2 mmol/l), HDL-cholesterol (ženy > 1,3 mmol/l), LDL-cholesterol (referenčné rozhranie 1,15–3,34 mmol/l), triacylglyceroly (TAG, referenčné rozhranie 0,42–2,26 mmol/l), 25-hydroxyvitamín D – 25(OH)D, referenčné rozhranie 20–50 ng/ml. Inzulín v plazme bol stanovený RIA metódou za použitia súpravy firmy Immunotech France. Sérové hodnoty 25(OH)D boli stanovené komerčne dostupnými RIA (radio-immunoassay) setmi firmy Immunodiagnostic systems s intra a inter-assay variačnými koeficientmi (CV %) 5,0 vs 7,3 % v RIA laboratóriu v Košiciach. Ostatné biochemické parametre boli stanovené použitím rutinných metód na Oddelení klinickej biochémie UN LP v Košiciach.
Vzorky krvi boli odobraté medzi 7 : 00–9 : 00 hodinou ráno po 12-hodinovom hladovaní vo včasnej folikulárnej fáze spontánne nastupujúceho alebo progestínom indukovaného menštruačného cyklu.
Inzulínová rezistencia bola hodnotená na základe stanovenia indexu inzulínovej rezistencie HOMA (homeostasis model assessment – HOMA-IR), vypočítaná bola nasledovne:
HOMA-IR = glykémia nalačno (mmol/l) × sérový inzulín nalačno (µIU/ml)/22,5
Podľa odporúčaní pre hraničné hodnoty vitamínu D používané v klinickej praxi bola hypovitaminóza D definovaná v tejto štúdií ako sérové hodnoty 25(OH)D < 30 ng/ml [11].
Stanovenie celkového množstva tukového tkaniva, rovnako ako jeho podiel v androidnej a gynoidnej oblasti, bolo realizované v PCOS a v KS v rámci merania celkovej kompozície tela za pomoci röntgenového kostného denzitometra Lunar model Prodigy firmy GE Healthcare Lunar so softvérom enCORE v štandardnom scanovacom móde dávkou žiarenia 0,4 µGy. Výsledky zloženia sú uvedené ako tuk v percentách celkového tkaniva a tuk v percentách v androidnej a gynoidnej oblasti záujmu.
Predkladané dáta sú prezentované ako aritmetický priemer ± štandardná odchýlka (x ± SD), prípadne ako medián (25., 75. percentil). Porovnanie rozdielov v kvantitatívnych premenných medzi sledovanými súbormi bolo realizované pomocou Studentovho T-testu. V prípade významných rozdielov medzi rozptylmi bola použitá neparametrická obdoba T-testu – Mann-Whitneyho U-test. Štatistické závislosti medzi sledovanými premennými boli zhodnotené jednoduchou a viacrozmernou lineárnou regresnou analýzou a korelačnou analýzou so stanovením Pearsonovho korelačného koeficientu r.
Výsledky
Základné antropometrické a metabolické charakteristiky PCOS a KS sú sumarizované v tab. 1. Porovnaním súboru PCOS pacientiek a KS zisťujeme nesignifikantné rozdiely vo vekovom priemere a v hodnotách 25(OH)D, signifikantné rozdiely vo všetkých ostatných porovnávaných antropometrických a metabolických parametroch. Celkové množstvo tukového tkaniva a jeho distribúciu v androidnej a gynoidnej oblasti pri PCOS a v KS znázorňuje graf 1.
Table 1. Základné antropometrické a metabolické charakteristiky PCOS a KS 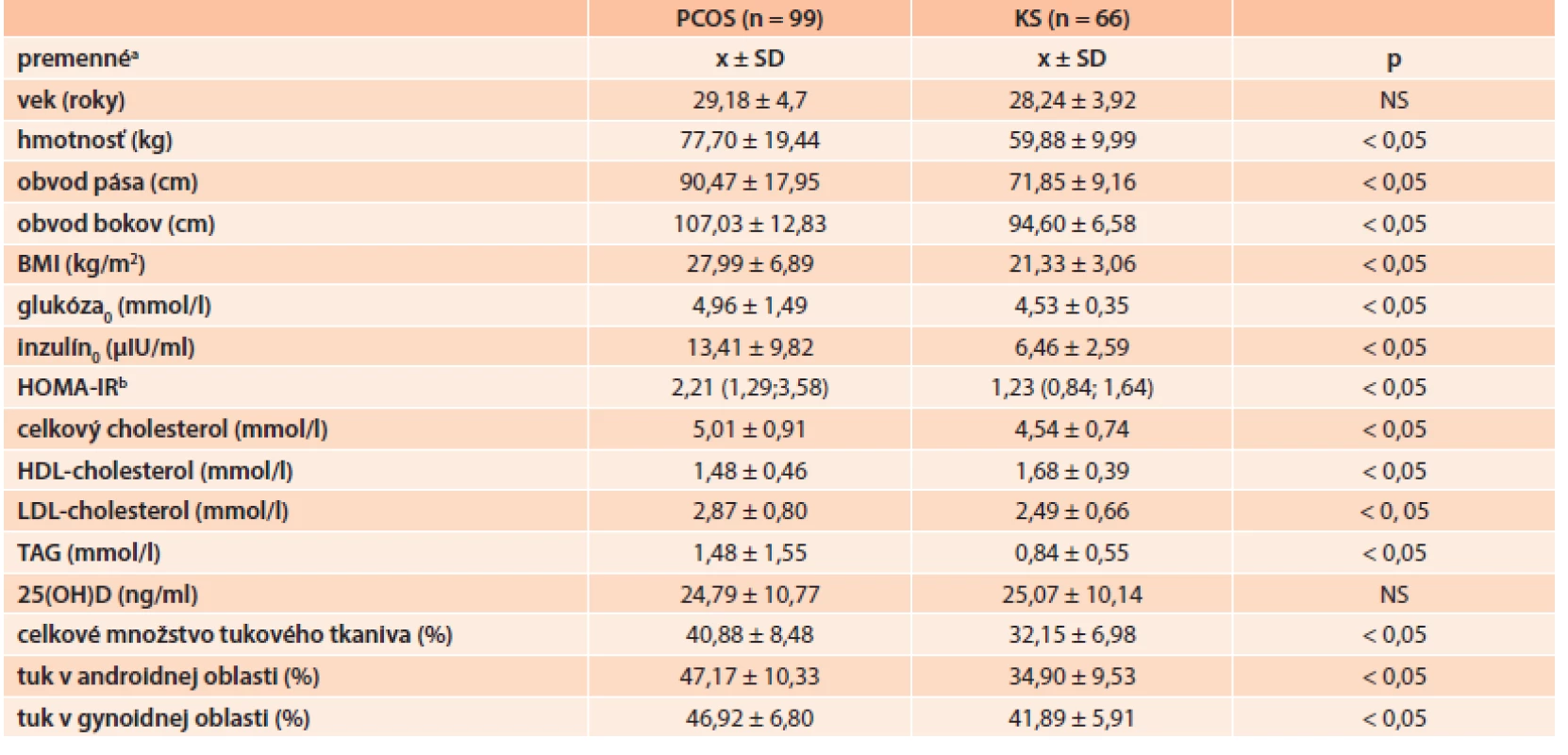
a premenné sú zobrazené ako priemer ± smerodajná odchýlka b HOMA-IR je zobrazený ako medián (25., 75. percentil) Graph 1. Celkové množstvo tukového tkaniva a jeho distribúcia v androidnej a gynoidnej oblasti pri PCOS a v KS 
Porovnaním výsledkov sérových hladín 25(OH)D, tab. 1, ktorý je považovaný za marker saturácie organizmu vitamínom D, v skupine PCOS pacientiek a v KS môžeme konštatovať, že:
- sme nepotvrdili signifikantný rozdiel v priemerných sérových hladinách 25(OH)D medzi PCOS a KS (24,79 ± 10,77 vs 25,07 ± 10,14 ng/ml; p = 0,868)
- prevalencia hypovitaminózy D bola vysoká a signifikantne sa nelíšila v oboch sledovaných skupinách, 79 z 99 PCOS žien (80 %) a 46 z 66 žien (70 %) KS sa prezentovali nedostatočnou saturáciou organizmu vitamínom D (p = 0,138)
21 z 99 PCOS žien (21 %) spĺňalo kritéria MetS podľa NCEP ATPIII odporúčaní, v KS nespĺňala kritéria žiadna z probandiek. Pacientky s PCOS spĺňajúce kritéria MetS mali signifikantne nižšie hodnoty 25(OH)D v porovnaní s PCOS bez MetS (20,6 ± 8,3 vs 25,9 ± 11,3 ng/ml; p = 0,049).
Potencionálny podiel vitamínu D na fenotypovom prejave ochorenia sme sledovali porovnaním jednotlivých premenných u podskupín PCOS rozdelených podľa saturácie organizmu vitamínom D (tab. 2). Porovnaním podskupín PCOS pacientiek rozdelených podľa saturácie vitamínom D sme zistili, že:
- hypovitaminózne PCOS pacientky mali vyššie sérové hladiny triacylglycerolov s hraničnou štatistickou signifikanciou v porovnaní s PCOS s dostatočnou saturáciou vitamínom D (1,44 ± 0,93 vs 1,03 ± 0,46 mmol/l; p = 0,051)
- hypovitaminózne PCOS pacientky mali tendenciu k vyšším hodnotám HOMA-IR, obvodu pása, BMI a k nižším hodnotám HDL-cholesterolu v porovnaní s PCOS pacientkami s dostatočnou saturáciou vitamínom D, avšak tieto rozdiely nedosahovali hranicu štatistickej signifikantnosti
- u hypovitaminóznych PCOS pacientiek pozorujeme tendenciu k vyšším hodnotám celkového množstva tukového tkaniva v porovnaní s PCOS pacientkami s dostatočnou saturáciou vitamínom D, avšak tento rozdiel nedosahoval hranicu štatistickej signifikantnosti, rozdiel v distribúcii telesného tuku v závislosti od saturácie organizmu vitamínom D u žien s PCOS nepozorujeme (graf 3)
Table 2. Porovnanie jednotlivých komponentov MetS, celkového množstva tukového tkaniva a jeho distribúcie v podskupinách PCOS pacientiek podľa saturácie organizmu vitamínom D 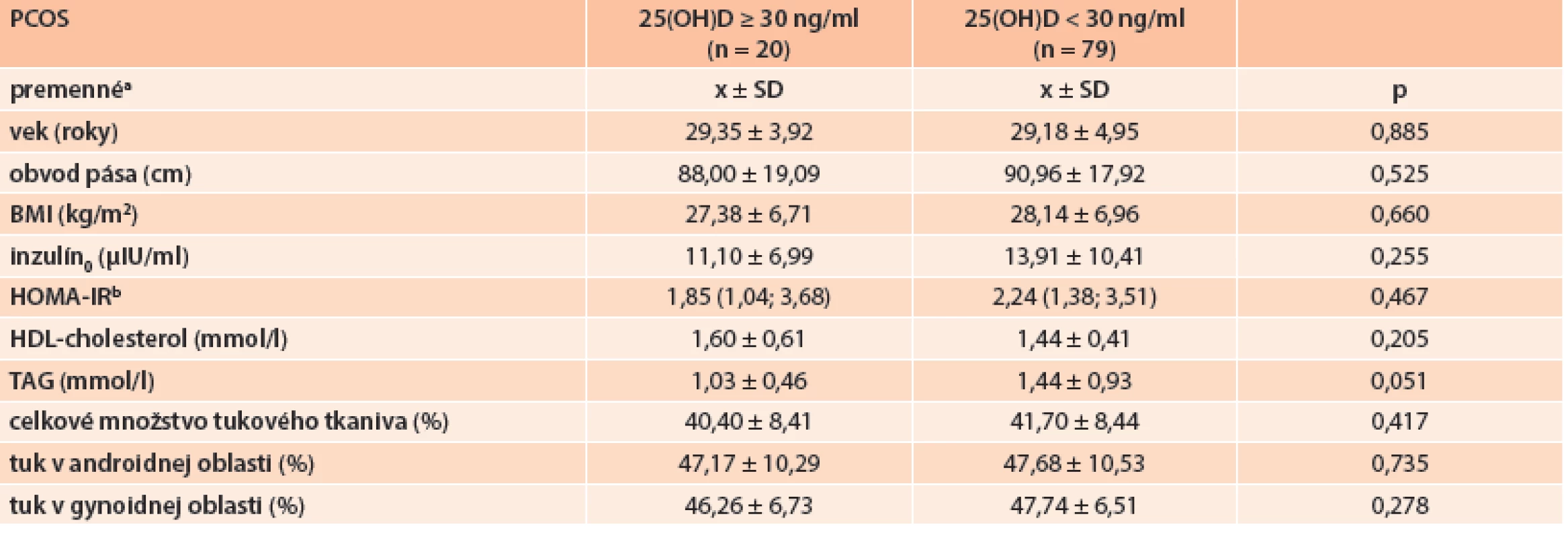
a premenné sú zobrazené ako priemer ± smerodajná odchýlka b HOMA-IR je zobrazený ako medián (25., 75. percentil) Graph 2. Celkové množstvo tukového tkaniva a jeho distribúcia v androidnej a gynoidnej oblasti u PCOS podľa saturácie organizmu vitamínom D 
Použitím lineárnej regresnej analýzy sme zhodnotili vzťah sérových koncentrácií 25(OH)D a jednotlivých komponentov MetS v PCOS súbore (tab. 3). Zistili sme pozitívnu koreláciu sérových hladín 25(OH)D s HDL-cholesterolom. Tento vzťah sme pozorovali v oboch skupinách – u PCOS pacientov, ako aj v KS (Pearsonovo skóre r = 0,159; p = 0,043), graf 2.
Table 3. Korelácia hladín 25(OH)D a jednotlivých komponentov MetS, celkového množstva tukového tkaniva a jeho distribúcie v PCOS skupine 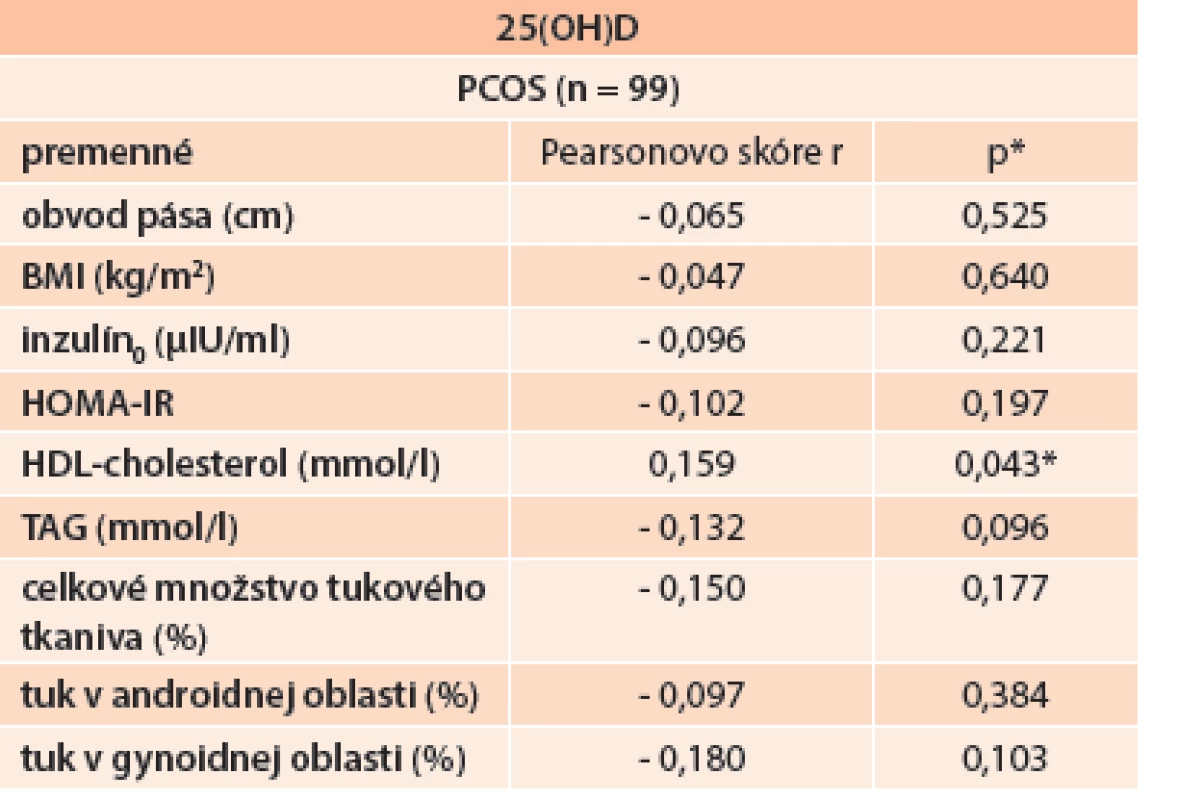
* p < 0,05 je štatisticky významné Graph 3. Pozitívna korelácia sérových hladín 25(OH)D s HDL-cholesterolom 
Diskusia
Ženy s PCOS predstavujú z hľadiska výskytu metabolických abnormalít veľmi heterogénnu skupinu. Výskyt metabolických prejavov ochorenia nie je nevyhnutnou súčasťou klinického obrazu PCOS a v jednotlivých štúdiách varíruje v závislosti od etnickej príslušnosti a životného štýlu sledovanej populácie. V našom súbore bola nadváha alebo obezita (BMI > 25 kg/m2) prítomná u 60 % žien s PCOS, ale len u 11 % žien KS, IR u 46,5 % žien s PCOS a u 3,03 % žien KS, kritéria MetS (podľa NCEP ATP III) spĺňalo 21 % PCOS žien a žiadna z probandiek KS, DM2T bol prítomný u 3,03 % PCOS žien. Populácia PCOS pacientiek sa rovnako signifikantne líšila vo všetkých sledovaných antropometrických a metabolických parametroch, ako aj v celkovom množstve tukového tkaniva a jeho distribúcii v androidnej a gynoidnej oblasti. Z uvedeného vyplýva, že PCOS pacientky majú vyššiu prevalenciu metabolických abnormalít, a teda rizikovejší kardiovaskulárny profil v porovnaní so zdravými ženami rovnakého veku. Predstavujú tak skupinu žien s mnohými pridruženými zdravotnými rizikami – predovšetkým rozvojom DM2T a kardiovaskulárnych ochorení v nižšom veku [2].
Napriek tomuto heterogénnemu metabolickému profilu žien s PCOS a KS sme v oboch skupinách nepotvrdili signifikantný rozdiel v priemerných sérových hladinách 25(OH)D, prevalencia hypovitaminózy D bola vysoká a signifikantne sa nelíšila v oboch sledovaných skupinách (80 % PCOS vs 70 % KS; p = 0,138).
Dáta o saturácii organizmu vitamínom D pri PCOS sú limitované a značne varírujú podľa typu štúdie. Niektoré štúdie poukazujú na nález rovnakých priemerných sérových hladín 25(OH)D u PCOS žien a v KS [12,13], čo je v súlade s našimi výsledkami. Avšak Wehr et al nachádzajú nižšie sérové hladiny vitamínu D u PCOS žien v porovnaní s KS (25,7 ng/ml vs 32 ng/ml) [14].
Vysoká prevalencia hypovitaminózy D je aktuálnym celosvetovým problémom a podľa dostupných údajov 10–60 % dospelej populácie má sérové hladiny 25(OH)D < 20 ng/ml [15]. Vzhľadom k postupnému odhaľovaniu pleiotropných účinkov vitamínu D na funkciu viacerých orgánových systémov sa predpokladá, že hypovitaminóza D môže u predisponovaných jedincov zvyšovať riziko rozvoja mnohých chronických ochorení, eventuálne ovplyvňovať ich fenotypový prejav [8].
V našom súbore ďalej zaznamenávame, že pacientky s PCOS spĺňajúce kritéria MetS mali signifikantne nižšie hodnoty 25(OH)D v porovnaní s PCOS bez znakov MetS. V súlade s naším pozorovaním je aj práca autorov Wehr et al, ktorí dokumentujú nález signifikantne nižších sérových hodnôt 25(OH)D v populácii PCOS s MetS (17,3 vs 25,8 ng/ml; p < 0,05) [14]. Otázkou, ktorá vyvstáva z nášho pozorovania, je príčina tohoto vzťahu. Je otázne, či hypovitaminóza D potencuje rozvoj jednotlivých znakov MetS v rizikovej skupine žien s PCO syndrómom alebo naopak, či prítomnosť MetS a abdominálnej obezity ako jednej z hlavných komponentov MetS vedie k sekundárnej hypovitaminóze D v dôsledku jeho liposolubility. Silná asociácia 25(OH)D a BMI pri PCOS je popisovaná mnohými autormi, ale jej presná príčina je stále nejasná [6]. Z dostupných prác je známe, že vitamín D môže zasahovať do rozvoja ochorenia ovplyvnením génovej transkripcie génov regulujúcich glukózový a lipidový metabolizmus, ako hormonálny modulátor sa môže podieľať na ovplyvnení inzulínového metabolizmu. Deficit vitamínu D tak môže vplývať na zvýraznenie symptómov pri PCOS [8].
Analýza celkového množstva tukového tkaniva a jeho distribúcie v androidnej a gynoidnej oblasti v našej skupine PCOS však nevykazovala signifikantný rozdiel medzi podskupinami hypovitaminóznych PCOS žien a PCOS žien s dostatočnou saturáciou vitamínom D, čo nepodporuje hypotézu sekundárnej hypovitaminózy D pri obezite v dôsledku jeho zvýšenej sekvestrácie v tukovom tkanive. Naopak môže poukazovať na podiel hypovitaminózy D na závažnejšom fenotypovom prejave PCOS v zmysle metabolických abnormalít.
Podľa mnohých autorov sú nízke hladiny vitamínu D signifikantne asociované s jednotlivými komponentami MetS pri PCOS, predovšetkým s IR [4], navyše ďalšie výsledky poukazujú aj na asociáciu hypovitaminózy D s dyslipidémiou a obezitou [6]. V našej štúdii sme pozorovali trend k vyššiemu indexu inzulínovej rezistencie HOMA a k nižším hodnotám HDL-cholesterolu v subpopulácii hypovitaminóznych PCOS žien, ako aj vyššie sérové hladiny triacylglycerolov s hraničnou štatistickou signifikanciou v subpopulácii hypovitaminóznych PCOS žien v porovnaní s PCOS ženami s dostatočnou saturáciou vitamínom D. Pri korelačnej analýze 25(OH)D a jednotlivých komponentov MetS v PCOS súbore sme zistili pozitívnu koreláciu sérových hladín 25(OH)D s HDL-cholesterolom, koreláciu 25(OH)D s ostatnými znakmi MetS nedokumentujeme.
Viaceré observačné štúdie však potvrdili prítomnosť korelácie 25(OH)D a jednotlivých komponentov MetS: negatívnu koreláciu medzi 25(OH)D a BMI, hmotnosťou, obvodom pásu, glykémiou a inzulinémiou nalačno, hladinou triacylglycerolov a pozitívnu koreláciu medzi sérovými hladinami 25(OH)D a hladinou HDL-cholesterolu (všetky p < 0,05). V multivariantnej regresnej analýze sledujúcej 25(OH)D, BMI a vek boli hodnoty 25(OH)D a BMI nezávislými prediktormi indexu inzulínovej rezistencie HOMA (HOMA-IR) s nálezom signifikantnej korelácie medzi 25(OH)D a HOMA-IR [14,6].
Tieto výsledky svedčia v prospech hypotézy, že nízke hladiny 25(OH)D sú asociované s jednotlivými zložkami MetS a IR u žien s PCOS [14]. Hypovitaminóza D je spájaná predovšetkým s IR a MetS pri PCOS, ale nie s PCOS samotným [6].
MUDr. Jana Figurová
jana.angelovicova@gmail.com
I. interná klinika LF UPJŠ a UNLP, Košice
MUDr. Ingrid Dravecká, PhD.
MUDr. Jana Petríková, PhD.
MUDr. Martin Javorský, PhD.
RNDr. Darina Petrášová, PhD.
prof. MUDr. Ivica Lazúrová, CSc., FRCP
www.unlp.sk
Doručené do redakcie 16. 9. 2014
Prijaté do tlače po recenzii 30. 9. 2014
Sources
1. March WA, Moore VM, Willson KJ et al. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod 2010; 25(2): 544–551.
2. Alexander CJ, Tangchitnob EP, Lepor NE. Polycystic ovary syndrome: a major unrecognized cardiovascular risk factor in women. Rev Obstet Gynecol 2009; 2(4): 232–239.
3. Azziz R, Woods KS, Reyna R et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab 2004; 89(6): 2745–2749.
4. Chiu KC, Chu A, Go VLW et al. Hypovitaminosis D is associated with insulin resistance and β-cell dysfunction. Am J Clin Nutr 2004; 79(5): 820–825.
5. Thys-Jacobs S, Donovan D, Papadopoulos A et al. Vitamin D and calcium dysregulation in the polycystic ovarian syndrome. Steroids 1999; 64(6): 430–435.
6. Hahn S, Haselhorst U, Tan S et al. Low serum 25-hydroxyvitamin D concentrations are associated with insulin resistance and obesity in women with polycystic ovary syndrome. Exp Clin Endocrinol Diabetes 2006; 114(10): 577–583.
7. Selimoglu H, Duran C, Kiyici S et al. The effect of vitamin D replacement therapy on insulin resistance and androgen levels in women with polycystic ovary syndrome. J Endocrinol Invest 2010; 33(4): 234–238.
8. Mahmoudi T. Genetic variation in the vitamin D receptor and polycystic ovary syndrome risk. Fertil Steril 2009; 92(4): 1381–1383.
9. Fauser BC, Tarlatzis BC, Rebar RW et al. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril 2012; 97(1):28–38.
10. National Cholesterol Education Program (NCEP). Expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult Treatment panel III). Circulation 2002; 106(25): 3143–3421.
11. Bouillon R, Van Schoor NM, Gielen E et al. Optimal vitamin D status: a critical analysis on the basis of evidence-based medicine. Clin Endocrinol Metab 2013; 98(8):1283–304.
12. Li HWR, Brereton RE, Anderson RA et al. Vitamin D deficiency is common and associated with metabolic risk factors in patients with polycystic ovary syndrome. Metabolism 2011; 60(10): 1475–81.
13. Panidis D, Balaris C, Farmakiotis D et al. Serum parathyroid hormone concentrations are increased in women with polycystic ovary syndrome. Clin Chem 2005; 51(9): 1691–1697.
14. Wehr E, Trummer O, Giuliani A et al. Vitamin D associated polymorphisms are related to insulin resistance and vitamin D deficiency in polycystic ovary syndrome. Eur J Endocrinol 2011; 164(5): 741–749.
15. Lips, P. Worldwide status of vitamin D nutrition. J Steroid Bioch Mol Biol 2010; 121(1–2): 297–300.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2014 Issue 3-
All articles in this issue
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
- Diabetes mellitus a ochorenia štítnej žľazy
- Vitamín D a metabolický syndróm u žien so syndrómom polycystických ovárií
- Metabolický syndróm a pečeň
-
Účinnosť a znášanlivosť vildagliptínu ako lieku druhej voľby v porovnaní s inými perorálnymi antidiabetikami pri diabetes mellitus 2. typu
Celosvetová observačná štúdia v podmienkach reálnej klinickej praxe (EDGE – výsledky subanalýzy pacientov zaradených na Slovensku) - Register kľúčových slov, autorov a lektorov
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diabetes mellitus a ochorenia štítnej žľazy
- Metabolický syndróm a pečeň
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

