-
Medical journals
- Career
Poruchy metabolizmu cukrů u Cushingova syndromu
: Michal Kršek
: III. interní klinika - klinika endokrinologie a metabolizmu1. LF UK a Všeobecná fakultní nemocnice, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA, Praha, Česká republika
: Forum Diab 2014; 3(3): 123-127
: Foreign Post
Cushingův syndrom (CS) je vzácné onemocnění způsobené zvýšenou sekrecí kortizolu a jeho působením na organizmus spojené se zvýšenou morbiditou a mortalitou, především kardiovaskulární. Zvýšená morbidita a mortalita je do značené míry důsledkem metabolických změn obdobných metabolickému syndromu. Podstatným klinickým příznakem CS je porucha glukózové tolerance, se kterou se v různém stupni setkáváme u více než poloviny pacientů. Na její etiopatogenezi se podílí především účinek kortizolu na orgány a tkáně organizmu, jehož důsledkem je inzulinová rezistence. Pro prognózu je důležité aktivní vyhledávání pacientů s poruchou glukózového metabolizmu, její včasná léčba a těsná kontrola diabetes mellitus. Některé metabolické změny přetrvávají i po vyléčení CS a pro prognózu pacientů je nezbytné je aktivně vyhledávat a důsledně intervenovat. Článek přináší souhrn současných poznatků o těchto změnách, především se zřetelem k diabetes mellitus u CS, jeho etiopatogenezi, klinickým aspektům a léčbě.
Kľúčové slová:
Cushingův syndrom – diabetes mellitus – metabolické poruchy –patogenezeÚvod
Cushingův syndrom (CS) je onemocnění vznikající v důsledku zvýšené autonomní produkce kortizolu v kůře nadledvin a jeho zvýšeného působení na buňky, tkáně a orgány lidského těla [1]. Vzhledem ke komplexnosti účinků kortizolu se jedná o onemocnění postihující prakticky celý organizmus, které je provázené velkým množstvím klinických příznaků. Klinický obraz CS a jeho jednotlivé součásti se mohou u různých pacientů vyskytovat v různé míře v závislosti na řadě okolností. Mezi základní klinické příznaky patří vzestup hmotnosti, centrální obezita, ukládání tuku v oblasti obličeje (měsícovitý oblasti), šíje (býčí šíje, buffalo hump), v supraklavikulární oblasti a na dalších místech (například spinální lipomatóza). Na kůži se v typických případech vyskytují široké purpurové strie, a to nejen na břiše, ale často i na hýždích, stehnech, axilách, prsou. Především u žen se v závislosti na aktivitě onemocnění a výši nadprodukce androgenů můžeme setkat s hirzutizmem, akné, alopecií (obr). Kůže je snadno zranitelná, rány se hůře hojí, častá je snadná tvorba hematomů a kožní infekce. Svaly v důsledku nadprodukce kortizolu atrofují, je přítomna svalová slabost, končetiny jsou tenké. Dochází k úbytku kostní hmoty, osteopenii a osteoporóze. Komplexním účinkem dochází k retenci sodíku, vody a arteriální hypertenzi. CS je provázen celou řadou metabolických odchylek, které budou rozebrány níže [2]. Neléčený CS je život ohrožující onemocnění spojené s významně zvýšenou morbiditou a mortalitou (dvojnásobnou až čtyřnásobnou v porovnání s obecnou populací). Nezbytná je proto jeho včasná diagnostika a diferenciální diagnostika a zároveň časná, správná a pokud možno etiologicky cílená léčba [3,4].
1. Habitus pacientky s Cushingovým syndromem. Z archivu autora. 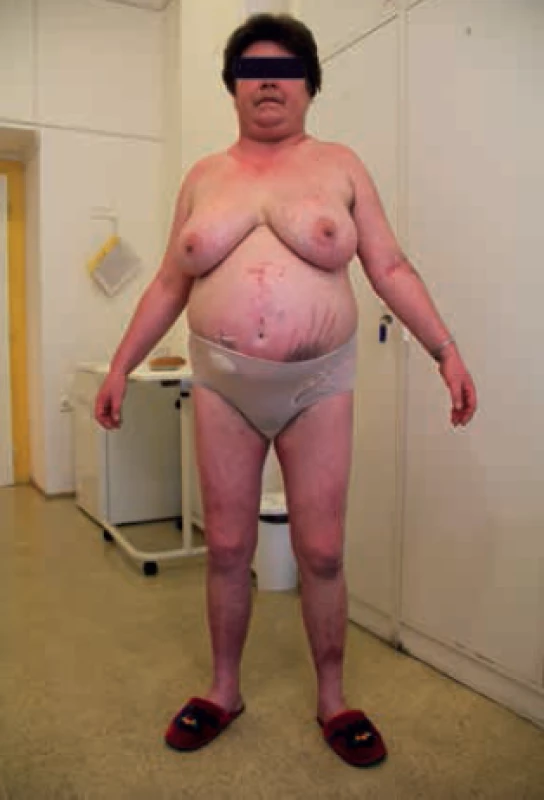
Metabolické poruchy u Cushingova syndromu
Pacienti s CS jsou postiženi komplexem odchylek odpovídajících metabolickému syndromu. Patří mezi ně obezita (zejména centrální), porucha metabolizmu glukózy, dyslipidemie a hypertenze. Soubor těchto odchylek společně s hyperkoagulabilitou krve pacientů s CS rozhodující měrou přispívá k jejich významně zvýšenému kardiovaskulárnímu riziku, morbiditě a mortalitě. Diagnostická kritéria metabolického syndromu splňuje pravděpodobně více než 60 % pacientů s CS a u přibližně 30 % pacientů s aktivním CS je zjišťována přítomnost aterosklerotických plátů [5,6].
V patogenezi metabolického syndromu u CS hraje pravděpodobně zásadní úlohu přítomnost viscerální obezity, kterou nacházíme u většiny pacientů, podle některých studií i u více než 90 % [7,8]. Patogeneze viscerální obezity u CS není detailně známá, ale podílí se na ní pravděpodobně více faktorů, mezi nimiž hraje zásadní úlohu kortizol. Kortizol zvyšuje chuť k jídlu a stimuluje diferenciaci adipocytů [9,10]. Dalším jeho účinkem je stimulace aktivity lipoproteinové lipázy, která je výraznější ve viscerální tukové tkáni v porovnání s podkožní tukovou tkání [11]. Experimentální data naznačují důležitou patogenetickou roli změn aktivity AMP aktivované proteinové kinázy (AMPK). Ve studii zkoumající aktivitu AMPK ve viscerálním tuku odebraném pacientům s CS syndromem v průběhu břišní operace byla zjištěna její o 70 % nižší aktivita v porovnání s kontrolní skupinou [12]. Zároveň bylo u pacientů s CS zjištěno více než dvojnásobné zvýšení exprese syntázy mastných kyselin, které následně vede k ukládání tuku v abdominální oblasti.
Dalším podstatným faktorem vedoucím k rozvoji metabolického syndromu je inzulinová rezistence, která patří k základním znakům CS. Roli zde hraje opět kortizol, který svými přímými účinky ovlivňuje inzulinovou signalizační kaskádu, transport glukózy a oxidaci glukózy a nepřímo ovlivňuje glukózový metabolizmus prostřednictvím metabolizmu tuků a bílkovin [13].
Poruchy metabolizmu glukózy u Cushingova syndromu
Porucha metabolizmu glukózy patří k prominentním klinickým příznaků CS a jejich hlavním příznakům je inzulinová rezistence způsobená expozicí zvýšeným koncentracím kortizolu. U více než 50 % pacientů se setkáváme s některou z následujících poruch: zvýšená glykemie nalačno (IFG), porucha glukózové tolerance (IGT) nebo manifestní diabetes mellitus (DM). Předpokládá se však, že uvedené poruchy jsou poddiagnostikované a že pokud bychom rutinně prováděli u všech pacientů s CS orální glukózový toleranční test (oGTT), došli bychom k vyšším číslům.
Patogeneze poruch metabolizmu glukózy u Cushingova syndromu
Hlavním patogenetickým faktorem poruch metabolizmu glukózy u CS jsou zvýšené cirkulující koncentrace kortizolu, které interferují s glukózovým metabolizmem na řadě úrovní. Pankreatické beta-buňky na svém povrchu exprimují glukokortikoidní receptory a bylo prokázáno, že glukokortikoidy vedou k jejich dysfunkci. Konkrétně dochází k alteraci vychytávání glukózy beta-buňkami a k poruše metabolizmu glukózy v nich a následně k porušené exocytóze sekrečních granul obsahujících inzulin [14]. Krátkodobé podávání glukokortikoidů vede rovněž ke snížení inzulinotropního účinku GLP1 (glucagon-like peptide 1) [15]. Hlavním mechanizmem rozvoje glukózové intolerance a DM u CS je glukokortikoidy indukovaná inzulinová rezistence periferních tkání, zejména pak v játrech, příčně pruhované svalové a tukové tkáni. Ve svalové a tukové tkáni kortizol vede postreceptorovým mechanizmem k alteraci všech účinků inzulinu. V játrech dochází účinkem glukokortikoidů ke zvýšení glukoneogeneze a glykogenolýzy, ve svalové a tukové tkáni dochází ke snížení vychytávání a metabolizmu glukózy, v tukové tkáni dochází navíc ke zvýšení lipolýzy a uvolňování volných mastných kyselin do oběhu [16]. Kromě uvedených účinků kortizol moduluje expresi a aktivitu některých adipokinů, např. adiponektinu, leptinu, rezistinu a apelinu, a prostřednictvím nich rovněž ovlivňuje inzulinovou senzitivitu. Shrnutí základních patofyziologických mechanizmů poruchy glukózového metabolizmu u CS ukazuje schéma [17]. Aminokyseliny uvolňované ve zvýšené míře díky akcentovanému katabolizmu bílkovin jsou používány k rovněž zvýšené glukoneogeneze.
Schéma patofyziologických mechanizmů vzniku diabetes mellitus u Cushingova syndromu. Upraveno podle [17] ![Schéma patofyziologických mechanizmů vzniku diabetes mellitus u Cushingova syndromu. Upraveno podle [17]](https://pl-master.mdcdn.cz/media/image/0a0886501d8a69bafc3d7e563d60ca2f.png?version=1537792191)
Vybrané klinické aspekty poruch metabolizmu glukózy u Cushingova syndromu
Vznik DM u CS syndromu souvisí s nadprodukcí kortizolu a jeho klinický obraz je proto obdobný u všech etiologických forem CS. Některé studie prokazují, že vznik DM nezávisí na stupni obezity a že hlavním patogenetickým faktorem je samotná hyperkortizolemie. Tuto představu prokazují i studie, které dokládají pozitivní korelaci glykémie nalačno a koncentrací kortizolu v krvi i vylučováním volného močového kortizolu [18]. Porucha glukózové tolerance a DM jsou prokazovány i u pacientů s incidentalomem nadledviny a tzv. subklinickým CS, a to v korelaci s jejich věkem, velikostí incidentalomu, noční kortizolémií a koncentrací kortizolu v dexametazonovém supresním testu s nízkou dávkou dexametazonu [19,20]. Jak bylo uvedeno výše, poruchy glukózového metabolismu jsou u pacientů s CS poddiagnostikované. Vzhledem k významně zvýšené morbiditě a mortalitě pacientů s Cushingovým syndromem bychom diagnostiku neměli opírat pouze o hodnotu glykémie nalačno, ale poruchy glukózové tolerance bychom měli aktivně vyhledávat pomocí oGTT.
Léčba poruch metabolizmu glukózy u Cushingova syndromu
Vzhledem k tomu, že CS je vzácné onemocnění, neexistuje mnoho vědeckých podkladů, na základě kterých by bylo možné učinit specifická a na důkazech založená doporučení pro léčbu DM u těchto pacientů.
Základem léčby je léčba základního onemocnění, jejíž popis přesahuje rámec tohoto sdělení, a která je popsána jinde [4].
V akutní fázi při závažné dekompenzaci DM je potřebné rychlé dosažení uspokojivé kontroly DM a často k němu používáme intravenózní infuzní aplikaci inzulinu nebo intenzifikovanou inzulinovou terapii. U pacientů v závažném stavu a s jasnou diagnózou CS můžeme inzulinovou terapii kombinovat s léčbou snižující koncentraci kortizolu.
V chronické léčbě DM jsou základem léčby režimová a dietní opatření. U pacientů s CS se vzhledem k jejich katabolizmu musíme vyvarovat energeticky deficitních dietních režimů. Rovněž si musíme uvědomit, že tito pacienti obvykle nejsou schopni absolvovat náročnější fyzický trénink, doporučujeme proto pravidelné cvičení dle individuální tolerance.
Medikamentózní léčbu obvykle zahajujeme podáváním metforminu. Při jeho nedostatečném účinku přichází do úvahy přidání derivátů sulfonylurey. Některé publikace uvádějí možnost léčby pomocí agonistů PPARγ, a to zejména u Cushingovy nemoci, u které bylo u některých jedinců po jejich podání zaznamenáno i snížení hormonální aktivity základního onemocnění. Nejsou však k dispozici větší studie, které by dlouhodobý příznivý účinek podání agonistů PPARγ jednoznačně prokázaly, a navíc si musíme být vědomi možnosti kumulace potenciálních nežádoucích kardiovaskulárních účinků. Pro léčbu inkretiny rovněž nemáme u pacientů s CS dostatek důkazů, ale lze se domnívat, že je u nich vhodná, podobně jako u pacientů s DM 2. typu [21].
Pokud nedosáhneme dostatečné kontroly DM dietními a režimovými opatřeními v kombinaci s perorálními antitiabetiky nebo analogy GLP1, je indikováno zahájení inzulinové terapie.
Léčba ostatních metabolických poruch a snižování kardiovaskulárního rizika
Při léčbě pacientů s CS si musíme uvědomit, že u většiny z nich je přítomna celá řada koincidujících poruch, které se podílejí na zhoršování jejich prognózy a kardiovaskulárního rizika. Při léčbě proto musíme aktivně ovlivňovat i tyto přidružené poruchy. Konkrétně, kromě snahy o těsnou kontrolu DM, se musíme snažit o dosažení cílových hodnot sérových lipoproteinů a kontroly arteriálního krevního tlaku. Vhodná by byla i redukce hmotnosti, ale v aktivním stadiu onemocnění nejsou redukční režimy doporučovány, protože bychom mohli dále zhoršit katabolizmus pacientů způsobený hyperkortizolizmem. Redukci hmotnosti proto odsouváme až do období po vyléčení CS. Po vyléčení CS musíme vzhledem k prokázanému perzistujícímu zvýšení kardiovaskulárního rizika pacienty dlouhodobě sledovat a pokračovat u nich dlouhodobě v intervenci přetrvávajících kardiovaskulárních rizikových faktorů [22].
Léčba Cushingova syndromu a její vliv na poruchy glukózového metabolizmu
Léčba CS závisí na jeho etiologii a je podrobně popsána v jiných publikacích [4]. Obecně lze říci, že pokud pomocí jakékoliv terapeutické modality (s výjimkou léčby pasireotidem) odstraníme hyperkortizolizmus, vytvoříme předpoklad k vymizení klinických příznaků CS včetně metabolických. Regrese jednotlivých příznaků trvá různou dobu, která se může pohybovat od několika týdnů po několik let.
Pokud se omezíme na regresi metabolických příznaků včetně poruchy glukózového metabolizmu, tak si je třeba uvědomit, že v případě úspěšné kurativní léčby CS odstraníme hlavní patogenetický faktor, kterým je hyperkortizolemie, ale v řadě případů u pacienta po různou dobu přetrvává metabolický syndrom včetně viscerální obezity. I po úspěšné léčbě CS je třeba důsledně korigovat všechny přítomné odchylky a složky metabolického syndromu, a to v této fázi již i včetně důsledných dietních a režimových opatření.
V posledních letech se do armamentária konzervativní léčby Cushingovy nemoci dostává multiligandový superaktivní analog somatostatinu pasireotid [23]. Pasireotid je schopen v monoterapii nebo v kombinační terapii podstatnou měrou snížit produkci ACTH v buňkách ACTH produkujících tumorů hypofýzy. Pasireotid působí na jednotlivé podtypy somatostatinových receptorů (SSTR1, SSTR2, SSTR3, SSTR5) nejen v hypofýze, ale i v dalších tkáních organizmu. Jeho působení na beta-buňky pankreatu vede ke snížení sekrece inzulinu a působení na endokrinní buňky střeva vede ke snížení sekrece GLP1. To vede ke vzniku IFG, IGT či DM u více než 70 % pacientů s Cushingovou nemocí. V průběhu léčby pasireotidem je tedy nutno pravidelně monitorovat glykemie. Před zahájením léčby pasireotidem se doporučuje provést oGTT. U pacientů s normálním výsledkem je doporučeno monitorovat glykemie několikrát v průběhu dne nalačno a 2 hodiny po jídle, a to v prvním týdnu léčby 2krát týdně, v dalších týdnech 1krát týdně. U pacientů s IFG, IGT nebo DM se doporučuje denní monitorování a zahájení léčby. Zahajujeme dietou a režimovými opatřeními podobně jako u DM 2. typu. Medikamentózní léčbou první volby je nasazení metforminu. Pokud režimová opatření a metformin nestačí ke kontrole DM, tak vzhledem k patogenezi pasireotidem indukovaného DM se doporučuje zahájení inkretinové léčby, a to v první linii inhibitory DPP4. Při neúspěchu léčby kombinací metforminu s inhibitorem DPP4 je doporučeno nahradit inhibotor DPP4 analogem GLP1. V případě i nadále nedostatečné kontroly DM se doporučuje zahájit léčbu kombinací metforminu a aplikace dlouhodobého inzulinového analoga v jedné denní dávce [24].
Exogenní Cushingův syndrom
Endogenní CS, kterému je věnován tento článek, je onemocnění vzácné. V běžné praxi se daleko častěji setkáváme s exogenním (iatrogenním) CS v důsledku dlouhodobé léčby glukokortikoidy. Riziko vzniku DM při chronické léčbě glukokortikoidy se odhaduje na 1,5–2,5 % pro nově vzniklý diabetes. Monitorování takových pacientů pomocí pouze glykemie nalačno vede k podhodnocení diagnózy DM oproti provedení oGTT [24]. K léčbě DM indukovaného kortikoterapií přistupujeme obdobně jako k DM u Cushingova syndromu.
prof. MUDr. Michal Kršek, CSc.
michal.krsek@lf1.cuni.cz
III. interní klinika – klinika endokrinologie a metabolizmu, 1. LF UK a Všeobecná fakultní nemocnice, Praha, Česká republika
www.vfn.cz, www.lf1.cuni.cz
Doručené do redakcie 20. 8. 2014
Prijaté do tlače po recenzii 13. 9. 2014
Sources
1. Cushing H. The basophil adenomas of the pituitary body and their clinical manifestations (pituitary basophilism). Bull Johns Hopkins Hosp 1932; 50 : 137–195.
2. Ross EJ, Linch DC. Cushing’s syndrome-Killing disease: Discriminatory value of signs and symptoms aiding early diagnosis. Lancet 1982 2(8299): 646–649.
3. Newell-Price J. Diagnosis/differential diagnosis of Cushing‘ s syndrome: a review of best practice. Best Pract Res Clin Endocrinol Metab 2009; 23(Suppl 1): S5-S14.
4. Kršek M, Čáp J, Hána V et al. Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti. Diabetologie, metabolismus, endokrinologie, výživa 2013; 16(1): 63–71.
5. Faggiano A, Pivonello R, Spiezia S et al. Cardiovascular risk factors and common carotid artery calibre and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission. J Clin Endocrinol Metab 2003; 88(6): 2527–2533.
6. Pivonello R, Faggiano A, Lombardi G et al. The metabolic syndrome and cardiovascular risk in Cushing’s syndrome. Endocrinol Metab Clin North Am 2005; 34(2): 327–339.
7. Newell-Price J, Bertagna X, Grossman AB et al. Cushing’s syndrome. Lancet 2006; 367(9522): 1605–1617.
8. Burt MG, Gibney J, Ho KK. Characterization of the metabolic phenotypes of Cushing’s syndrome and growth hormone deficiency: a study of body composition and energy metabolism. Clin Endocrinol (Oxf) 2006; 64(4): 436–443.
9. Tataranni PA, Larson DE, Snitker S et al. Effects of glucocorticoids on energy metabolism and food intake in humans. Am J Physiol 1996; 271(2 Pt 1) E317-E325. Dostupné z http: <http://ajpendo.physiology.org/content/271/2/E317>.
10. Ahdjoudj S, Lasmoles F, Oyajobi BO et al. Reciprocal control of osteoblast/chondroblast and osteoblast/adipocyte differentiation of multipotential clonal human marrow stromal F/STRO-1(+) cells. J Cell Biochem 2001; 81(1): 23–38.
11. Taskinen MR, Nikkila EA, Pelkonen R et al. Plasma lipoproteins, lipolytic enzymes, and very low density lipoprotein triglyceride turnover in Cushing’s syndrome. J Clin Endocrinol Metab 1983; 57(3): 619–626.
12. Kola B, Christ-Crain M, Lolli F et al. Changes in adenosine 5´-monophosphate-activated protein kinase as a mechanism of visceral obesity in Cushing’s syndrome. J Clin Endocrinol Metab 2008; 93(12): 4969–4973.
13. Qi D, Rodrigues B. Glucocorticoids produce whole body insulin resistance with changes in cardiac metabolism. Am J Physiol Endocrinol Metab 2007; 292(3): E654-E667. Dostupné z DOI: <http://doi:10.1152/ajpendo.00453.2006>.
14. van Raalte DH, Ouwens DM, Diamant M. Novel insights into glucocorticoid-mediated diabetogenic effects: towards expansion of therapeutic options? Eur J Clin Invest 2009; 39(2): 81–93.
15. Hansen KB, Vilsbøll T, Bagger JI et al. Reduced glucose tolerance and insulin resistance induced by steroid treatment, relative physical inactivity and high-calorie diet impairs the incretin effect in healthy subjects. J Clin Endocrinol Metab 2010; 95(7): 3309–3317.
16. Pivonello R, De Leo M, Vitale P et al. Pathophysiology of diabetes mellitus in Cushing’s syndrome. Neuroendocrinology 2010; 92(Suppl 1): 77–81.
17. Mazziotti G, Gazzaruso C, Giustina A. Diabetes in Cushing syndrome: basic and clinical aspects. Trends in Endocrinology and Metabolism 2011; 22(12): 499–506.
18. Mancini T, Kola B, Mantero F et al. High cardiovascular risk in patients with Cushing’s syndrome according to 1999 WHO/ISH guidelines. Clin Endocrinol 2004; 61(6): 768–777.
19. Muscogiuri G, Sorice GP, Prioletta A et al. The size of adrenal incidentalomas correlates with insulin resistence. Is there a caue-effect relationship? Clin Endocrinol 2011; 74(3): 300–305.
20. Morelli V, Masserini B, Salcuni AS et al. Subclinical hypercortisolism: correlation between biochemical diagnostic criteria and clinical aspects. Clin Endocrinol 2010; 73(2): 161–166.
21. Munir A, Newell-Price J. Management of diabetes mellitus in Cushing’s syndrome. Neuroendocrinology 2010; 92(Suppl 1): 82–85.
22. Colao A, Pivonello R, Spiezia S et al. Persistence of increased cardiovascular risk in patients with Cushing’s disease after five years of successful cure. J Clin Endocrinol Metab 1999; 84(8): 2664–2672.
23. Colao A, De Block C, Gaztambide MS et al. Managing hyperglycemia in patients with Cushing’s disease treated with pasireotide: medical expert recommendations. Pituitary 2014; 17(2): 180–186.
24. Clore JN, Thurby-Hay L. Glucocorticoid-induced hyperglycemia. Endocr Pract 2009; 15(5): 469–474.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2014 Issue 3-
All articles in this issue
- Disorders of carbohydrate metabolism in Cushing‘s syndrome
- Osteoporosis and diabetes mellitus
- Diabetes mellitus and thyroid diseases
- Vitamin D and the Metabolic Syndrome among Women with the Polycystic Ovarian Syndrome
- Metabolic syndrome and liver
-
The efficiency and tolerability of vildagliptin as the second-line drug as compared with other oral antidiabetics for diabetes mellitus type 2:
Worldwide Observation Study in the conditions of clinical practice (EDGE – results of the subanalysis of included patients in Slovakia) - Index of keywords, authors and reviewers
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diabetes mellitus and thyroid diseases
- Metabolic syndrome and liver
- Disorders of carbohydrate metabolism in Cushing‘s syndrome
- Osteoporosis and diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

