-
Medical journals
- Career
Mykobakteriózy – nejčastější původci
Authors: V. Ulmann 1; R. Kozel 2; I. Tudík 3; I. Pavlík 4
Authors‘ workplace: Centrum klinických laboratoří, Oddělení bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě, Ostrava 1; Pneumologie a ftizeologie (plicní), Městská nemocnice Ostrava, p. o., Ostrava 2; Oddělení pneumologie a ftizeologie, Sanatorium Jablunkov, a. s., Jablunkov 3; Ústav teritoriálních studií, Fakulta regionálního rozvoje a mezinárodních studií, Mendelova univerzita v Brně, Brno 4
Published in: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 3, s. 151-163
Category: Review Article
Overview
Počet diagnostikovaných onemocnění vyvolaných netuberkulózními mykobakteriemi u predisponovaných jedinců zůstává v České republice každoročně konstantní. Jejich klinické uplatnění je variabilní a závisí na vlastnostech konkrétního druhu, jeho přítomnosti a kvantity v bezprostředním okolí člověka. Mezi nejčastější klinicky zaznamenávané druhy patří Mycobacterium avium, M. kansasii a M. xenopi. Nejvýznamnějším zdrojem M. avium je rašelina a z ní odvozené produkty. Sekundárně osídluje teplovodní systémy, které jsou velice rizikové z hlediska expozice (především vířivky). M. kansasii je stále přítomno ve vodách v oblastech ovlivněných průmyslovou a důlní činností. Jeho recentně vyčleněné genetické varianty jsou obvykle zcela bez klinického významu, nicméně mohou být přítomny jako kontaminace ve zdravotnických přípravcích. M. xenopi trvale osídluje většinu teplovodních systémů a jeho praktická všudypřítomnost ovlivňuje správné diagnostické závěry u nejasného nálezu při zobrazovacích metodách. Iniciace antibiotické léčby, která nemusí být vždy úspěšná, by měla probíhat na základě komplexního posouzení stavu pacienta, nálezu a jeho progrese. Ani výsledky laboratorních vyšetření nemusí být při rozhodování vždy směrodatné.
Klíčová slova:
léčba – klinické projevy – mykobakteriózy – M. avium – M. kansasii – M. xenopi – zdroje infekce
1. ÚVOD
Zatím co nových případů klasické tuberkulózy meziročně v České republice ubývá, počty případů jiných mykobakterióz stabilně oscilují průměrně kolem 100 případů ročně. Skutečností je trvalá přítomnost a obtížná eradikace nejčastěji izolovaných druhů Mycobacterium avium, M. kansasii a M. xenopi ve vodovodních systémech, rašelině a zahradních substrátech s rašelinou. Expozice a infekce netuberkulózními druhy mykobakterií (NTM) nepředstavuje pro většinu populace zásadní ohrožení jejich zdravotního stavu. U jedinců predisponovaných funkčním postižením orgánů a imunity přináší sekundární mykobakteriální onemocnění výrazné zdravotní omezení a zhoršení prognózy dožití. Terapie mykobakterióz je mnohdy komplikována rezistencí vyvolávajících kmenů NTM na antibiotika a antituberkulotika. Terapie bývá dlouhodobá s kombinací antibiotických preparátů, fyziologicky značně zatěžující pacienta a někdy zbytečná. Povědomí o vlastnostech, výskytu a rozdílném patogenním potenciálu významných druhů NTM může nápomoci k adekvátnímu řešení jednotlivých pacientů. I po mnoha dekádách výzkumu zůstávají v oblasti epidemiologie a klinického uplatnění NTM mnohé neodhalené skutečnosti. Některé neaktuální informace se léta opakují a v případě řešení problematiky na klinické úrovni přináší rozpaky a obavy při řešení léčby pacientů. Cílem tohoto přehledu je proto oživení povědomí o mykobakteriózách, které jsou v současné době šířeji rozpracovány v zahraniční literatuře. Tyto zdroje nebývají z praktického hlediska klinickými pracovníky v České republice (ČR) sledovány, nebo jsou pro potenciální čtenáře obtížně dostupné (placené přístupy k článkům apod.). Rovněž chceme prezentovat část dosažených poznatků o výskytu nejčastěji izolovaných druhů NTM, které jsme zatím získali při řešení čtyřletého projektu (2020–2023) Agentury zdravotnického výzkumu zaměřeného na epidemiologii, fyziologii a klinické aspekty mykobakterióz.
2. NETUBERKULÓZNÍ MYKOBAKTERIE – TAXONOMIE A VÝSKYT
V současnosti je do rodu Mycobacterium řazeno více než 190 dalších druhů a poddruhů, které nepatří do skupiny obligátních patogenů člověka, tedy zástupci komplexu M. tuberculosis a M. leprae [1]. Tyto mikroorganismy, označované jako NTM, jsou rozšířené v prostředí a mnohdy tvoří i jeho přirozenou součást [2, 3]. Ve vztahu k onemocnění člověka je jejich uplatnění pouze oportunní (příležitostné) a jejich schopnost vyvolat onemocnění (mykobakteriózu) je podstatně podmíněna několika faktory.
Stěžejní je ve vztahu k potenciální infekci NTM hostitelského organismu míra přítomnosti konkrétního druhu NTM ve zdroji (intenzita kontaminace), či obecněji v prostředí [4]. Infekční dávka nutná pro zvýšení pravděpodobnosti rozvoje klinického onemocnění u vnímavého pacienta je až o tři řády vyšší oproti dávce, při které je schopen původce humánní tuberkulózy způsobit infekci [5].
3. MYKOBAKTERIÓZY
Mykobakterióza způsobená NTM byla diagnostikována v ČR v letech 2000–2020 celkem u 2 218 pacientů (tab. 1). Jejich počet se pohyboval v tomto období mezi 87 pacienty v roce 2020 a 128 pacienty v roce 2018. Roční počty hlášených případů s nově potvrzeným onemocněním (mykobakteriózou) zůstávaly na rozdíl od konzistentního ústupu tuberkulózy v ČR téměř konstantní. Za 21leté sledované období to bylo průměrně 105,6 pacientů ročně. K nejčastějším původcům mykobakterióz patřili zástupci komplexu M. avium-intracellulare (MAIC; 925; 41,7 % pacientů), M. kansasii (596; 26,9 % pacientů) a M. xenopi (299; 13,5 % pacientů). Ostatní druhy NTM byly diagnostikovány u 378 (17,0 %) pacientů (tab. 2).
Mykobakteriózy významným způsobem ovlivňují prognózu a kvalitu života pacientů, které souvisí se zdlouhavou a nákladnou léčbou, prolongací hospitalizace, chronicitou onemocnění, které často relabuje z důvodů lékové rezistence NTM anebo reinfekce. Obecně představují mykobakteriózy diagnostický problém spojený s vyššími finančními náklady na léčbu a rekonvalescenci [5]. Interhumánní přenos NTM nebyl dosud uspokojivě potvrzen a člověk jako zdroj dalšího šíření je prakticky vyloučen [3]. Pouze u pacientů s cystickou fibrózou (CF) se vyskytly v posledních několika letech úvahy o interhumánním přenosu NTM ve zdravotnických zařízeních [6]. Rovněž tato hypotéza však dosud nebyla patřičným výzkumem doložena [7].
Post infekční dynamika průběhu kolonizace či onemocnění pacientů je rovněž ovlivněna vlastnostmi samotných NTM. Společné pro všechny zástupce rodu Mycobacterium jsou vysoká odolnost vůči chemickým (včetně antiinfektiv i dezinfekcí) a fyzikálním vlivům. Ta je dána unikátní stavbou jejich buněčné stěny, mimořádnou nutriční nenáročností a potenciálnímu přechodu do metabolicky neaktivního (dormantního) stavu. Všechny tyto mimořádné vlastnosti jim umožnují přežívání ve vysoce nepříznivých podmínkách (kyselé a nutričně chudé prostředí). Při současném působení výše zmíněných rizikových faktorů jsou tyto vlastnosti nápomocny při interakci s lidským organismem a jeho infekcí. Jednotlivé druhy NTM se ve fyziologii a adaptabilitě značně liší. NTM jsou přizpůsobeny odolávat faktorům vnějšího prostředí mnohem lépe než obligátně patogenní druhy patřící do komplexu M. tuberculosis a M. leprae. V lokalitách jejich výskytu jsou mykobakterie velmi obtížně eliminovatelné [8].
Z epidemiologického hlediska zřejmě nejvýznamnější, ovšem striktně individuální je dispozice (vnímavost) jedince k mykobakteriální nákaze způsobené NTM. Klinický význam environmentálních druhů je omezený, nebo u mnohých dosud sporný. Organismus zdravého jedince může být po určitou dobu kolonizován bez zjevného ovlivnění zdravotního stavu. Zásadním rozdílem oproti obligátním patogenům je u většiny druhů NTM absence faktorů modulujících reakci buněčného imunitního systému. Proto jsou i nestimulované alveolární makrofágy schopny primární infekci spolehlivě eliminovat a většina druhů NTM nepřežije fagocytózu [9]. Rizikem pro rozvoj mykobakteriózy je přítomnost primárního poškození funkčnosti orgánů a imunitního systému. Predisponujícími faktory jsou především infekce HIV, imunosupresivní léčba po transplantacích, leukémie, chronické metabolické poruchy jako diabetes, ale také dlouhodobý abúzus alkoholu, pneumokonióza a geneticky podmíněné poruchy funkčnosti buněčné imunity [10]. Nejdůležitější ve vztahu k onemocnění mykobakteriózou jsou především postižení plic jako chronická obstrukční plicní nemoc (CHOPN), CF, kouření, pneumokonióza, post tuberkulózní a jiná infekční fibróza, idiopatická a geneticky podmíněná onemocnění související s elasticitou stěn bronchů či ciliární poruchy.
Obstrukce dýchacích cest, post zánětlivá fibrotizace plicního parenchymu a bronchiektázie při výše popsaných stavech snižují samočistící funkci postižených oblastí, omezují krevní zásobení a prostupnost buněk imunitního systémů [11]. Takto změněná tkáň umožnuje zachycení mykobakteriálních buněk a jejich dlouhodobé přežívání. NTM využívají toto prostředí a množí se. Po dobu i několika let, kdy je schopen buněčný imunitní systém jejich šíření v lokalitě infekce regulovat, nedochází k rozvoji onemocnění se systémovými příznaky. Tento stav by bylo možno charakterizovat jako chronickou kolonizaci NTM. U pacientů není dlouhodobě pozorována zásadní změna zdravotního stavu ani nálezu při vyšetření plic zobrazovacími metodami. Přesto je v těchto případech již možný opakovaný mikroskopický záchyt mykobakteriálních buněk ve vzorcích odebraných z dolních dýchacích cest [12]. Dosud diskutabilní zůstává při kolonizaci NTM a patogenezi patologických změn role bronchiektázií. Jednoznačně jde o predisponující faktor v případě jejich přítomnosti u preexpozičně postiženého pacienta. Současně nelze vyloučit tvorbu bronchiektázií postexpozičně vlivem trvalé zánětlivé reakce v lokalitě, dané přítomnosti mykobakterií u jiných postižení souvisejících s poruchou jejich samočistící funkce (pectus excavatum, věk, kouření, ciliární poruchy a jiné). Při vyčerpání, nebo disfunkci obranných mechanismů dochází k nekontrolovanému množení NTM a k jejich dalšímu šíření v postiženém orgánu. Iniciovány jsou specifické obranné mechanismy buněčné imunity [13]. Makrofágy jsou stimulovány aktivovanými CD4 T-lymfocyty, CD8 lymfocyty navozují apoptózu buněk a dochází k rozvoji rozpadového procesu s granulomatózními změnami. Systémová zánětlivá reakce se projeví příznaky nejčastěji zahrnujícími nechutenství, chronické subfebrilie až febrilie, váhový úbytek, vyčerpanost, dušnost, později produktivní expektoraci s objektivním klinickým nálezem a progresivními změnami při zobrazovacích metodách [14].
Poměrně specifický je průběh extrapulmonárního onemocnění. Žádný z druhů NTM není schopen proni kat nepoškozenou kůží a sliznicemi. Cesta vstupu NTM do hlubších struktur tkání je umožněna traumatizujícím poraněním, nebo sekundární hemolymfatickou diseminací z primárně plicního ložiska. Mezi nejčastěji zaznamenávaná mimoplicní onemocnění v ČR patří kožní granulomatózy a orofaciální lymfadenitidy zejména u dětí do 3 let věku. Vzácnější jsou diseminované infekce a postižení osteoartikulárního aparátu [15].
Table 1. Infekce způsobené zástupci komplexu Mycobacterium tuberculosis a netuberkulózními mykobakteriemi v České republice v letech 2000–2020Table 1. Infections caused by members of the Mycobacterium tuberculosis complex and non-tuberculous mycobacteria in the Czech Republic in 2000–2020 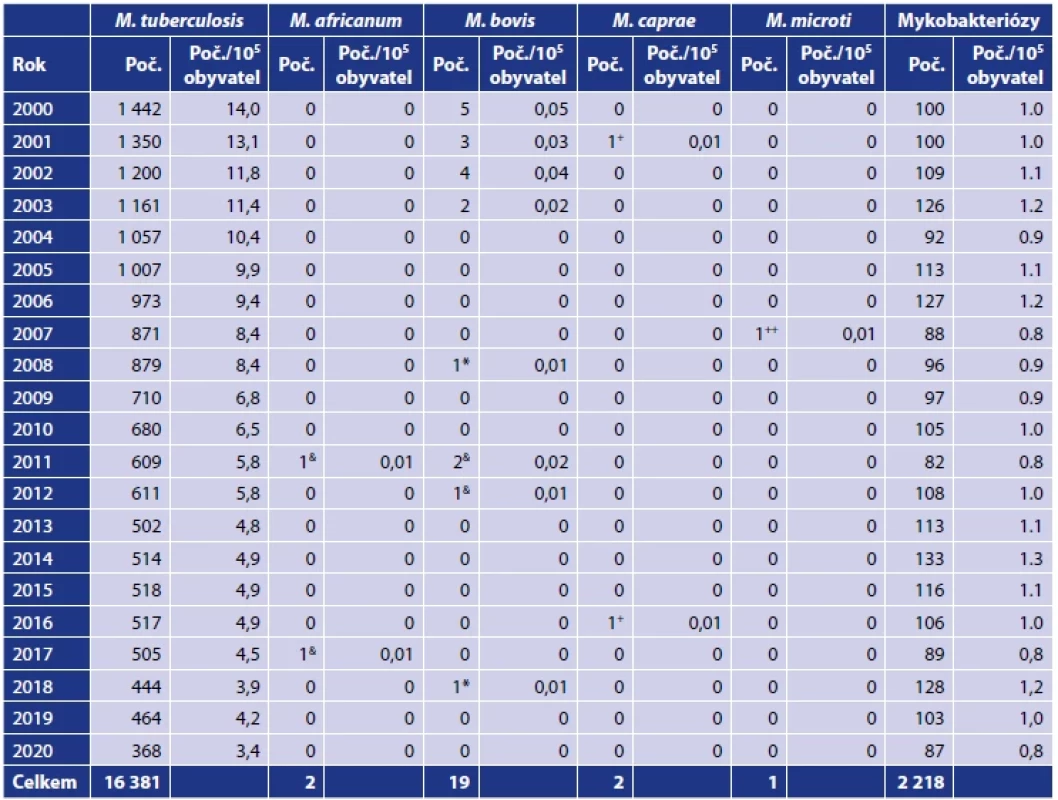
Zdroj: Ústav zdravotnických informací a statistiky, Praha, 2001–2021.Source: Institute of Health Information and Statistics, Prague, 2001–2021. Vysvětlivky: (M.) Mycobacterium, (+) M. caprae bylo identifikováno v letech 2001 a 2016 ve Zdravotním ústavu se sídlem v Ostravě, (++) jeden izolát M. microti identifikován ve Zdravotním ústavu se sídlem v Ostravě, (&) první izolát M. africanum popsala v roce 2011 Svobodová [178] a druhý izolát M. africanum byl popsán v roce 2017 ve Zdravotním ústavu se sídlem v Ostravě, (*) jeden izolát M. bovis ssp. bovis identifikovali Bártů et al. [7] a druhý izolát M. bovis ssp. bovis byl identifikován v roce 2018 ve Zdravotním ústavu se sídlem v Ostravě. .Note: (M.) Mycobacterium, (+) M. caprae was identified in the years 2001 and 2016 in the Public Health Institute Ostrava, (++) one isolate of M. microti identified in the Public Health Institute Ostrava, (&) the first M. africanum isolate was described in 2011 by Svobodova [178] and the second M. africanum isolate was described in 2017 at the Public Health Institute Ostrava, (*) one isolate of M. bovis ssp. bovis was identified by Bártů et al. [7], and the second M. bovis ssp. bovis isolate was identified in 2018 at the Public Health Institute Ostrava. Table 2. Mykobakteriální infekce způsobené netuberkulózními mykobakteriemi v České republice v letech 2000–2020Table 2. Mycobacterial infections caused by non-tuberculous mycobacteria in the Czech Republic in 2000–2020 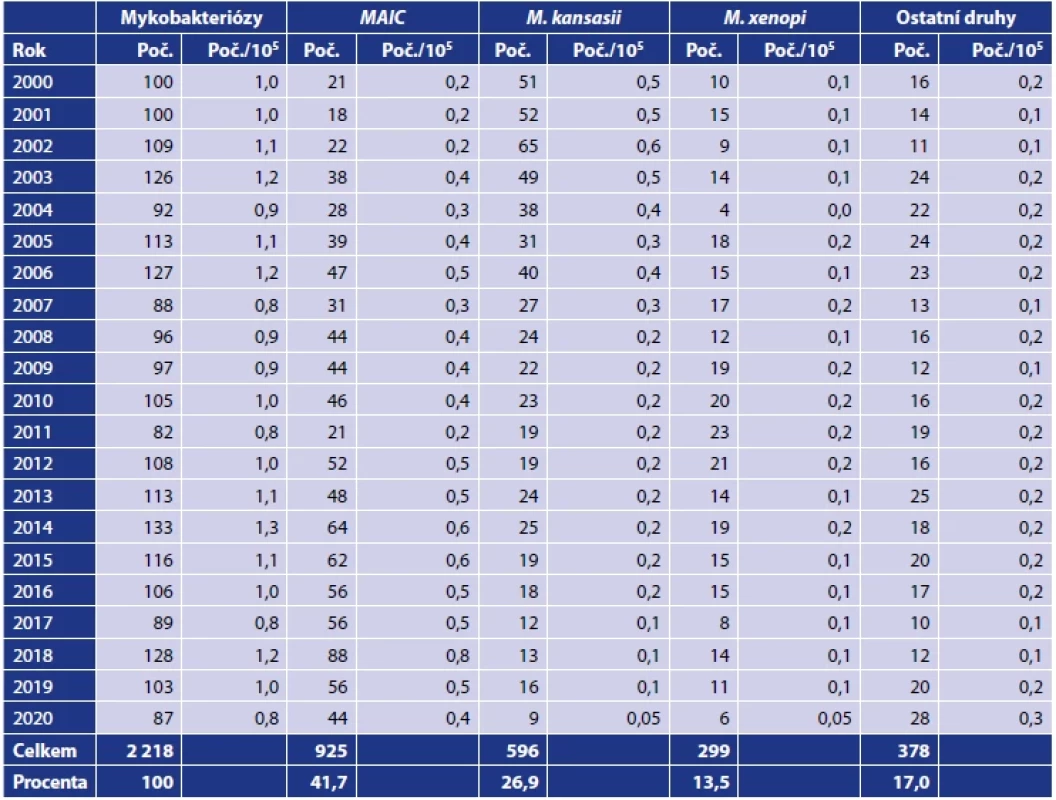
Zdroj: Ústav zdravotnických informací a statistiky, Praha, 2001–2021 [206].Source: Institute of Health Information and Statistics, Prague, 2001–2021 [178].Vysvětlivky: (M.) Mycobacterium, (MAIC) komplex M. avium-intracellulare.Note: (M.) Mycobacterium, (MAIC) komplex M. avium-intracellulare. 4. VLASTNOSTI A UPLATNĚNÍ NEJČASTĚJI IZOLOVANÝCH DRUHŮ
4.1 Mycobacterium avium komplex (MAC)
4.1.1 Vlastnosti a zdroje
V současné době tento komplex zahrnuje tři zásadně se lišící poddruhy (M. avium subsp. avium, M. avium subsp. paratuberculosis a M. avium subsp. hominissuis) [16, 17].
M. avium subsp. avium (MAA) a M. avium subsp. paratuberculosis (MAP) jsou typickými, hospodářsky a veterinárně významnými původci aviární a bovinní mykobakteriózy u ptáků a přežvýkavců [18]. MAA nejčastěji postihuje domácí drůbež, která se jeví jako primární rezervoár [19]. M. avium subsp. paratuberculosis je původcem tzv. Johneho choroby. Toto devastující onemocnění tenkého a tlustého střeva je mezi zvířaty vysoce přenosné a výskyt v chovech vede k značným hospodářským ztrátám. Nápadné patologické nálezy asociující Crohnovu chorobu a další idiopatická střevní onemocnění u lidí, zavdaly již samotnému Bernardu Crohnovi podnět k intenzivnímu studiu možných souvislostí s tímto poddruhem. Přímá asociace MAP však zůstává dosud kontroverzní [20]. M. avium subsp. hominissuis (MAH) je naproti tomu typickým původcem plicních [21] i mimoplicních mykobakterióz člověka (obr. 1) [22]. Tento fakt je podmíněn odlišnou fyziologií a adaptabilitou tohoto poddruhu [23]. Na základě těchto skutečností je tedy možné ptáky (donedávna stále uvažované) a s nimi související produkty v současné době jako primární zdroj infekce vyloučit.
Zástupci komplexu MAIC vynikají mimořádnou genetickou a potažmo morfologickou variabilitou. Jde o jednu z nepřizpůsobivějších skupin druhů NTM, schopných adaptovat se a permanentně osídlit širokou škálu různých matric v prostředí. Dalším jejich častým rezervoárem je potrubí pro rozvod teplé užitkové vody jak v domácnostech, tak v průmyslu [24]. K vysoké koncentraci potenciálně infekčního inokula dochází zejména ve špatně udržovaných teplovodních rezervoárech; především vířivky patří k nejrizikovějším zdrojům [25].
Významným, námi recentně potvrzeným přírodním zdrojem, jsou rašeliniště (včetně tuzemských) jako primární a přirozené prostředí výskytu MAH. Masivní přítomnost životaschopných (množících se) mykobakterií byla zjištěna rovněž ve skladovaných a použitých zahradnických substrátech s rašelinou [25]. Stejné riziko představují i zahradní substráty s guánem netopýrů, které bývá také často kolonizováno MAH [26].
Image 1. (a). M. avium ssp. hominissuis na Löwenstein-Jensenově půdě, 14denní kultura.Obr. 1 (b). M. avium ssp. hominissuis, samostatné drobné krátké tyčky, barvení dle Ziehl-Neelsena, zvětšeno 1 000x (foto V. Ulmann)Figure 1 (a). M. avium ssp. hominissuis on Löwenstein-Jensen medium, 14-day culture. Figure 1 (b). M. avium ssp. hominissuis,individual small short rods, staining according to Ziehl-Neelsen, magnification 1,000x (Photo V. Ulmann) 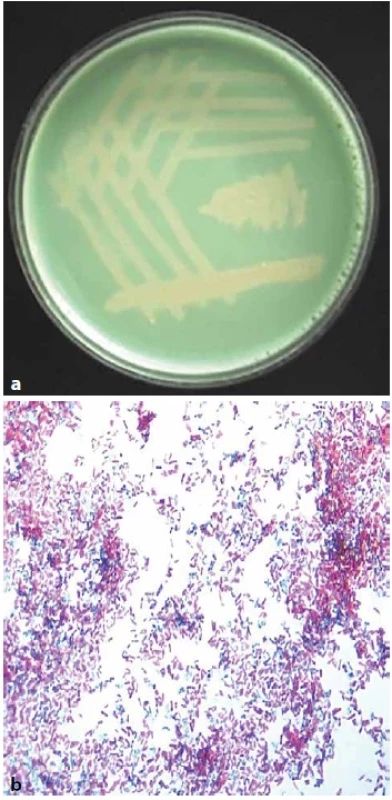
4.1.2 Onemocnění
Klinický význam spočívá ve většině případů v sekundární perzistentní kolonizaci postižených plic. Diseminované infekce jsou zaznamenávány vzácněji, a to především u silně imunokompromitovaných pacientů [27]. Iniciace onemocnění je nejčastěji zjištěna po exacerbaci pulmonálních potíží s progresí změn bronchiektaticko-nodulárního charakteru [14]. Fenoménem posledního desetiletí je pozvolný nárůst mimoplicních infekcí. Diagnostikovány bývají především krční lymfadenitidy u dětí ve věku 1–3 let. Nejčastějším původcem bývá MAH (obr. 2). Plicní onemocnění je u dětí v této věkové kategorii velmi vzácné. Pravděpodobně je to s přispěním přirozených a u dětí plně funkčních anatomicko-fyziologických poměrů organismu. Výjimkou mohou být plicní kolonizace pacientů s CF. Nejčastěji je tento stav diagnostikován u adolescentů, méně častěji u dospělých pacientů [29].
Z hlediska fyziologie a morfologie jde o druh, který je schopný vytvářet odolný, zarůstající biofilm jak na umělých površích (stěny vodovodního potrubí a vodních rezervoárů), tak i ve tkáních pacientů.
Image 2. Obr. 2. Pacientka, ročník 1968, plicní mykobakterióza, mikrobiologicky opakovaně od roku 2015 pozitivní ve sputu i bronchoalveolární laváži (M. avium ssp. hominissuis), chronická kolonizace s exacerbacemi, léčena opakovaně kombinací: Clarythromycin, Amikacin a Rifampicin, t. č. bez terapie (klinicky i subjektivně bez závažných obtíží), predispozice (astenický morfotyp, Lady Windermere syndrom, bronchiektazie, astma bronchiale, genetický podklad – matka rovněž infikována M. avium ssp. ominissuis), nákaza nejpravděpodobněji získána z vodovodního řadu v místě bydliště (kultivačním vyšetřením bylo zachyceno v roce 2015 M. avium ssp. hominissuis). RTG plic, patologický nález v horní třetině pravého plicního pole / pruhovité stíny s projasněními laterálně / a v dolní třetině plicního pole vlevo / nehomogenní syté zastínění s projasněním nad zevním kostofrenickým úhlem v dolní třetině plicního pole (R. Kozel). Figure 2. Female patient, born in 1968, pulmonary mycobacteriosis, microbiologically repeatedly positive in sputum and bronchoalveolar lavage since 2015 (M. avium ssp. hominissuis), chronic colonization with exacerbations, repeatedly treated with a combination of Clarythromycin, Amikacin and Rifampicin, that time without therapy (clinically and subjectively without serious problems), predisposition (asthenic morphotype, Lady Windermere Syndrome, bronchiectasis, bronchial asthma, genetic background – mother also infected with M. avium ssp. hominissuis), infection most likely acquired from the water supply system at the place of residence (culture examination was positive for M. avium ssp. hominissuis in 2015). X-ray of the lungs, pathological finding in the upper third of the right lung field / striated shadows with clearing laterally / and in the lower third of the lung field on the left / inhomogeneous saturated shading with clearing above the external costophrenic angle in the lower third of the lung field (R. Kozel). 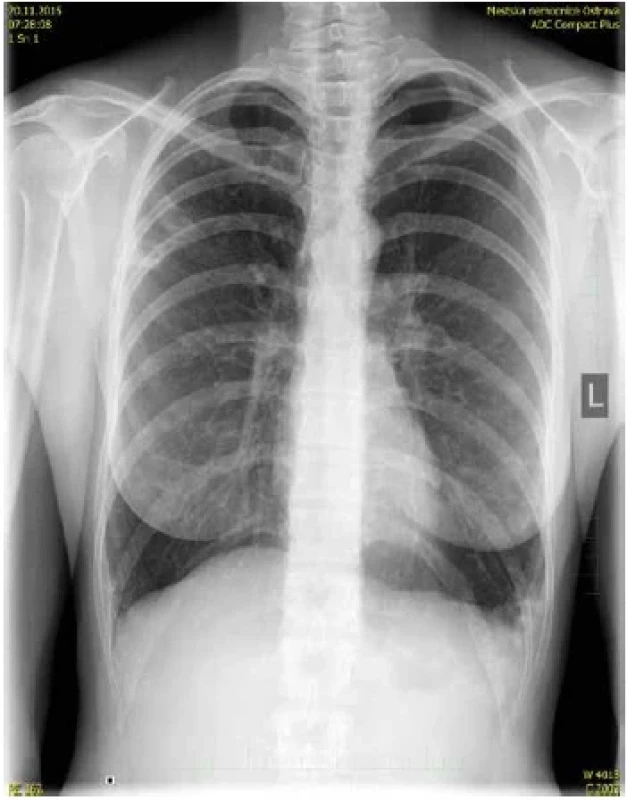
4.1.3 Léčba
Zástupci komplexu MAIC jsou přirozeně rezistentní na klasická antituberkulotika (isoniazid a etambutol) a hraničně rezistentní na rifampicin. Citlivost k aminoglykosidům bývá zachována [30]. Dlouhodobá monoterapie makrolidy vede k selekci rezistentních mutantů kmenů. Léčba by proto měla být prováděna vždy v kombinaci vhodných antiinfektiv podle profilu citlivosti konkrétního kmene.
Nejzásadnější je vždy posouzení celkového stavu pacienta a zvážení benefitu dlouhodobé, velmi zatěžující antibiotické terapie. Přechodná, ale i chronická kolonizace nemusí pro pacienta představovat zásadní zdravotní komplikaci. Proto je vhodné kombinovanou terapii zahájit až po objektivně zjištěných změnách zdravotního stavu a nálezu. Dlouhodobě stabilní, ohraničené nálezy bronchiektaticko-nodulárního charakteru lze řešit observačním přístupem s kontrolami v rámci pravidelných prohlídek.
Jiná situace je u mimoplicních afekcí, rozsáhlých rozpadových a nodulárních nálezů, u kterých je antibiotická terapie vždy nezbytná, nejlépe, pokud je to možné, spojená s chirurgickým řešením. Tento postup je v současnosti nejvíce uplatňován v případech postižení lymfatických uzlin u dětí, kdy samotná exstirpace může být terapeutická.
Základními antibiotiky pro léčbu jsou makrolidy, volitelně je možno použít klarithromycin nebo azitromycin (v dávce 500 mg/den). Léčba nodulárního onemocnění, pokud je iniciována, je nutná dále v kombinaci s rifampicinem (10 mg/kg; max. 600 mg/den) a etambutolem (15 mg/kg/den).
U neprogresivní formy bez závažných systémových příznaků je možné dávkování 3x týdně se zvýšenou dávkou etambutolu na 25 mg/kg/den). Kontroverze podání léků, na které je druh přirozeně rezistentní, je vyvrácena doloženou synergií výše zmíněné kombinace. Ta spočívá v potencování účinku makrolidů a výsledném snížení doby léčby a urychlení debacilizace pacientů [31, 32].
Závažnější rozpadové, rozsáhlé nodulární, diseminované a mimoplicní formy mohou být doplněny parenterálním podáním aminoglykosidů s preferencí amikacinu v dávkování 10–15 mg/kg 3x týdně s možností eskalace, či deeskalace dávkování s kontrolou hladiny.
Celková délka terapie je minimálně 12 měsíců, kdy je průběžně sledována debacilizace opakovaným laboratorním vyšetřením adekvátních klinických vzorků. V tomto ohledu se jeví velmi vhodné monitorování prostředí pacienta vyšetřením vzorků vody, zeminy a zjištění přítomnosti rašelinných produktů v domácnosti pro vyloučení opakované re-expozice pacienta NTM.
Onemocnění kmeny rezistentními na makrolidy, zejména u pacientů trvale predisponovaných, jsou velmi komplikovaně léčitelné. Potřebná je vysoce zatěžující léčba kombinací rifampicinu, chinolonu, clofaziminu s inhalačním podáním nebulizovaného amikacinu, nebo bedaquilinu [33]. Vyšetřování citlivosti na náhradní léky není v ČR ve většině laboratoří rutinně prováděno. Stanovení profilu citlivosti na základní a náhradní léky je prováděno v centrech s dlouhodobou zkušeností s metodikou (Národní referenční laboratoř, regionální pobočky Zdravotního ústavu a Mikrobiologické kliniky fakultních nemocnic). Stanovení by mělo být prováděno podle aktuálních postupů vydaných Institutem pro klinické a laboratorní standardy (Clinical and Laboratory Standards Institute – CLSI), formou stanovení minimálních inhibičních koncentrací v tekutém médiu. Správnost postupů laboratoře je dlouhodobě prověřována v dostupných programech externího hodnocení kvality.
Nejnovější doporučení pro léčbu mykobakteriálních infekcí jsou komplexně zpracována v kooperačním dokumentu Americké hrudní a Evropské pneumologické společnosti (ATS/ERS) z roku 2020 [31]. Dříve vydaná doporučení ATS (2007) byla převzata do tuzemských doporučení, vydaných a revidovaných v roce 2023 Českou pneumologickou a ftizeologickou společností. Vzhledem k absenci nových účinných léků zůstávají stávající i dřívější doporučení platná.
4.2 Komplex Mycobacterium kansasii
4.2.1Vlastnosti a zdroje
Tento druh je pomalu rostoucí fotochromogenní mykobakterie (obr. 3). Již od 90. let 20. století let bylo známo pět genotypů M. kansasii, které jsou označovány I–V [34], přičemž recentně byly identifikovány genotypy VI [35] a VII [36]. Genotypy II–VI byly v roce 2020 definitivně reklasifikovány na samostatné druhy:
M. persicum (genotyp II), M. pseudokansasii (genotyp III), M. ostraviense (genotyp IV), M. innocens (genotyp V) a M. attenuatum (genotyp VI) [37]. Z ekologického hlediska je zajímavý jejich rozdílný výskyt u pacientů a v prostředí. Genotyp I („klasické“ M. kansasii) je celosvětově nejčastěji izolován u pacientů (obr. 4). Naproti tomu izoláty genotypu II jsou izolovány jak u pacientů, tak z prostředí. Genotypy III–VI jsou zřídka izolovány u pacientů, ale jsou přítomny ve vzorcích životního prostředí; nejčastěji ve vodovodní vodě a v biofilmech [34, 36].
Fyziologie druhu je unikátní. Klasické M. kansasii (genotyp I) jako jedno z mála NTM (dalšími jsou například M. marinum a M. szulgai) je vybaveno mechanismy umožňujícími úspěšnou adaptaci na lidský organismus. Obecně by bylo možné M. kansasii charakterizovat jako mezičlánek oportunních a obligátně patogenních mykobakterií. Stejně jako M. tuberculosis je i M. kansasii geneticky vybaveno k produkci imunomodulačních antigenních proteinů asociovaných s virulencí (Early Secreted Antigenic Target, ESAT-6 a Culture Filtrate Protein, CFP 10) [37]. Současně je M. kansasii schopno produkce glykolipidu (metylátu-trehalózy), který umožňuje agregaci dělících se buněk do kompaktních provazcovitých útvarů (cord factor) [38].
V uhelných dolech je velkým problémem prach vznikající při těžbě, drcení a při následném transportu a manipulaci s vytěženým uhlím. Pro snížení prašnosti je třeba velkého množství vody. Ta je většinou přiváděna do dolů z povrchových zdrojů, nejčastěji řeky, méně častěji jezera či přehrady. Užitková voda je upravována dvěma způsoby dle svého použití. První druh vody, tzv. užitková „technologická“ voda se používá pro snížení prašnosti přímo při těžbě uhlí v dolech a při jeho manipulaci na povrchu. Je ošetřována pouze sedimentací s následnou chlorací a není před používáním předehřívána. Tato užitková technologická voda je po použití v dolech čerpána na povrch, kde sedimentuje v povrchových nádržích a následně je odváděna zpět do řek. M. kansasii nebylo v tomto typu vody prokázáno (tab. 3).
Druhý druh užitkové vody je určen k „hygienickým“ účelům. Používá se v hygienických zařízeních dolů (v umývárnách) pro pracovníky z podpovrchových i povrchových provozů. Tato voda je ošetřována (upravována) filtrací přes otevřené pískové filtry, nebo stojaté rychlofiltry, příp. jiná zařízení s následnou chlorací. Před použitím je předehřívána dvěma způsoby. Při prvním způsobu je voda předehřívána na 42–45 °C k přímé spotřebě (v této vodě i v biofilmu bylo M. kansasii prokázáno, viz tab. 3). Při druhém způsobu je voda předehřívána na 90 °C. Takto připravená voda je přímo před spotřebou ochlazena naředěním studenou vodou (v této vodě nebylo M. kansasii prokázáno, viz tab. 3). Následně však M. kansasii bylo prokázáno až v biofilmech sprchových hlavic, ve kterých teplota dosahuje při výtoku pro růst M. kansasii optimální teploty 30–35 °C (viz tab. 3) [39].
Z hlediska ekologie jde o poměrně specializovaný druh, který se v mnoha vlastnostech liší od ostatních environmentálních NTM. Adaptován je na relativně úzké oblasti výskytu, a proto je považován za endemitní druh NTM. Typickým rezervoárem je voda v průmyslově změněné krajině v ČR i v zahraničí [3]. Nejčastěji jsou to deponie důlní odpadní vody, odkud dochází k jeho dalšímu horizontálnímu šíření. Ve volné přírodě a jiných námi studovaných matricích dosud zachycen nebyl [26]. M. kansasii bylo nejčastěji izolováno z důlních sprchových vývodů a z infekčního aerosolu vzniklého při sprchování. Tento výsledek byl přijat již před více než 50 lety jako jeden z nejpravděpodobnějších přenosových mechanismů odpovědných za šíření infekce M. kansasii. Tato hypotéza byla pozdějšími studiemi potvrzena a platí dodnes [40].
Image 3. (a). M. kansasii na Löwenstein-Jensenově půdě, test fotochromogenity (nalevo světlem exponovaná polovina kultury,napravo světlem neexponovaná polovina kultury). Obr. 3 (b). M. kansasii, tvorba provazcovitých útvarů při kultivaci in vitro(tzv. cording), barvení dle Ziehl-Neelsena, zvětšeno 1 000 x (foto V. Ulmann).Figure 3 (a). M. kansasii on Löwenstein-Jensen medium, photochromogenicity test (left half of culture exposed to light and right half of culture not exposed to light). Figure 3 (b). M. kansasii, cord-like formations (so-called cording) during in vitro cultivation,staining according to Ziehl-Neelsen, magnification 1,000x (Photo V. Ulmann). 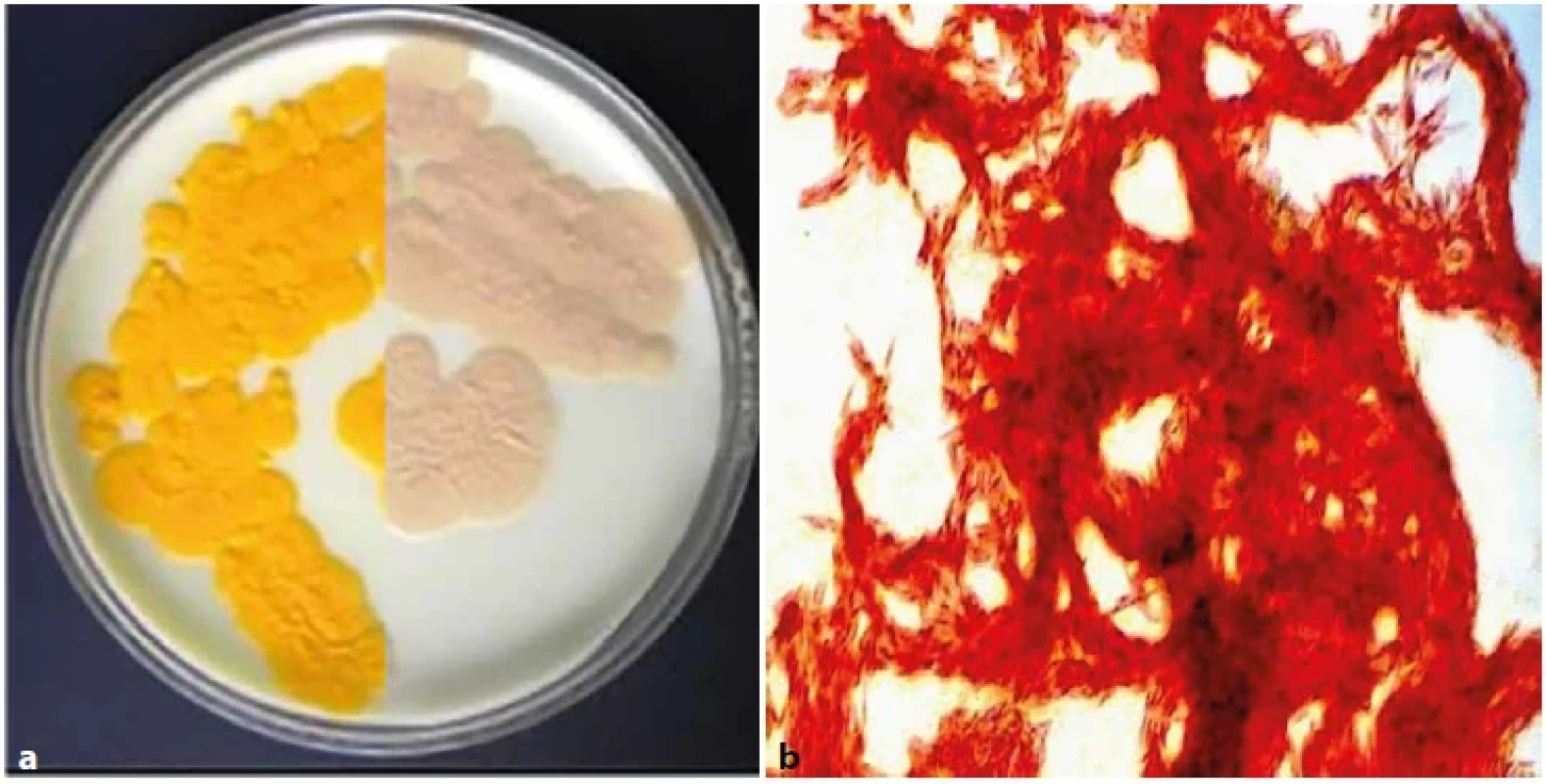
Image 4. Pacient, ročník 1968, horník, kuřák. Kultivačně opakovaně prokázáno M. kansasii (genotyp I), mikroskopické vyšetření ze sputa po barvení dle Ziehl-Neelsena silně pozitivní (+++), oboustranná plicní rozpadová mykobakterióza. Obr. 4 (a). RTG plic. ZP nativní, patologický nález v horní a střední třetině obou plicních polí, více vlevo, s nálezem nepravidelných tlustostěnných dutin.Obr. 4 (b). CT plic. Patologický nález nepravidelných tlustostěnných dutin oboustranně, v okolí dutin s drobnými větvícími se uzly, více vlevo (I. Tudík).Figure 4. Patient, born in 1968, miner, smoker. Culture repeatedly confirmed M. kansasii (genotype I), microscopic examination of sputum after staining according to Ziehl-Neelsen strongly positive (+++), bilateral pulmonary disintegration mycobacteriosis. Giant. Figure 4 (a). X-ray of the lungs. ZP native, pathological finding in the upper and middle third of both lung fields, more to the left, with the finding of irregular thick-walled cavities. Figure 4 (b). CT lung. Pathological finding of irregular thick-walled sinuses on both sides, around the sinuses with small branching nodes, more to the left (I. Tudík). 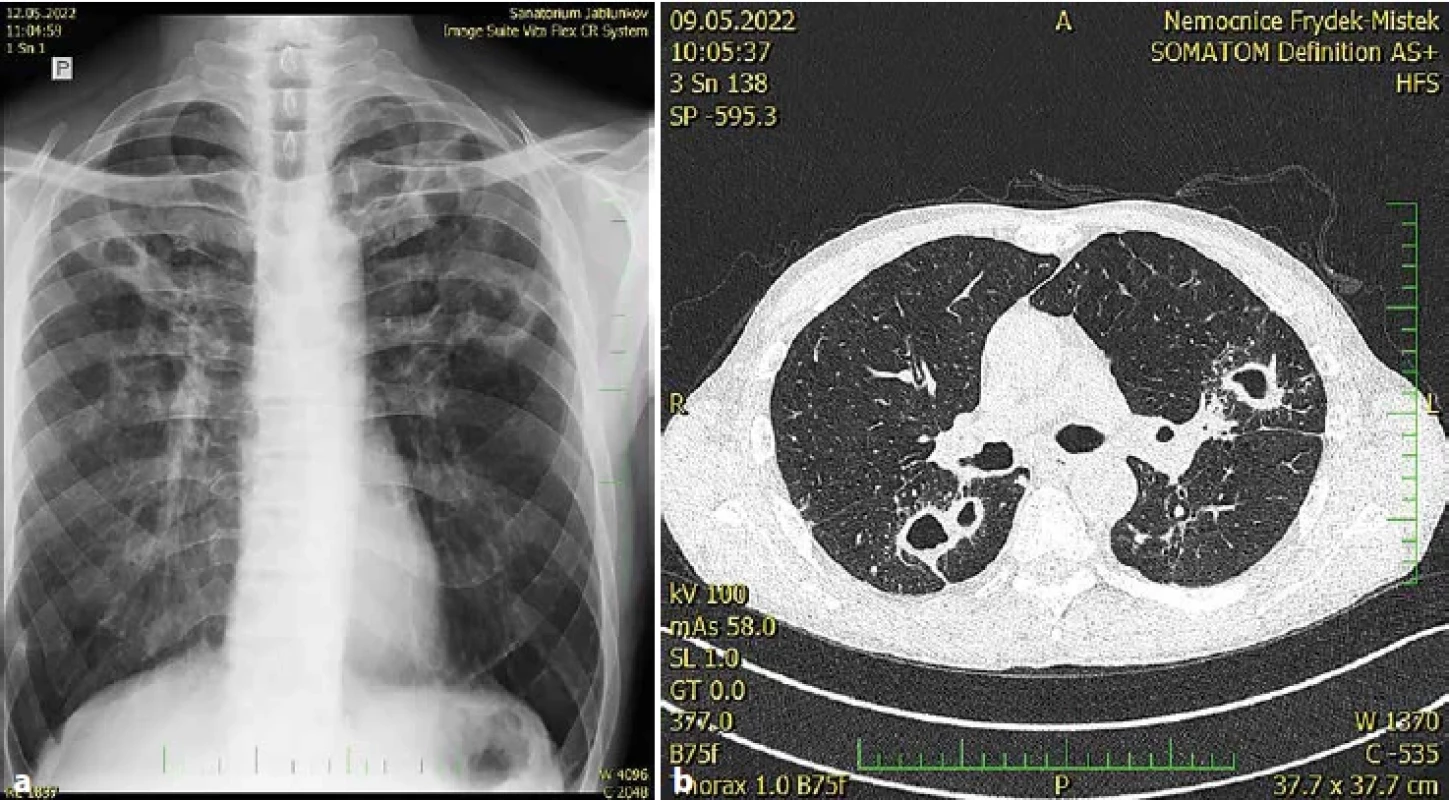
Table 3. Netuberkulózní mykobakterie v České republice v různých složkách vodního prostředíTable 3. Nontuberculous mycobacteria in the Czech Republic in various components of the water environment 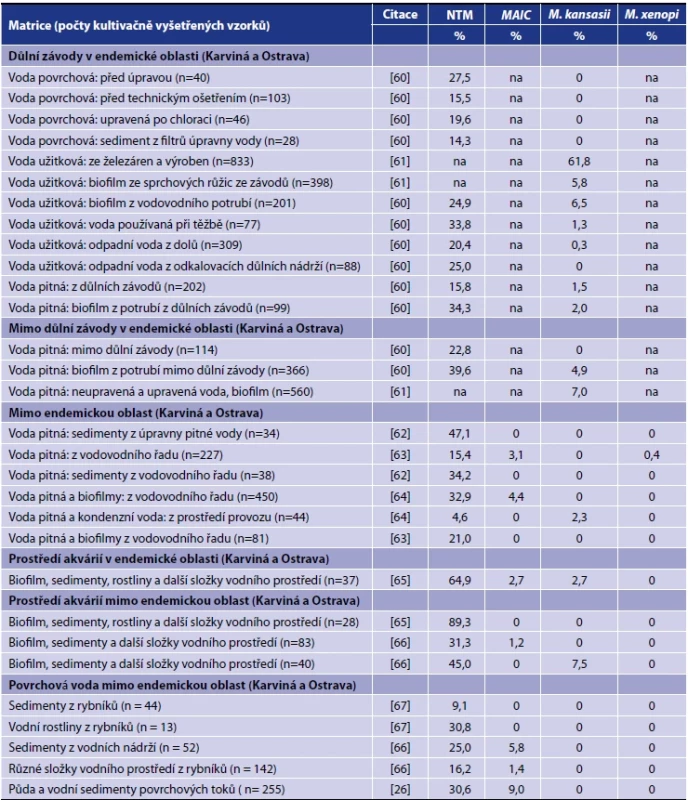
Vysvětlivky: (M.) Mycobacterium, (MAIC) komplex M. avium-intracellulare, (na) neuvedeno.Note: (M.) Mycobacterium, (MAIC) M. avium-intracellulare complex, (na) not specified. 4.2.2 Onemocnění
U člověka je etiologickým agens převážně plicních onemocnění. Významné je tedy klinické uplatnění klasického druhu původního genotypu I (M. kansasii). Většina izolátů pocházejících od pacientů je klinicky relevantních. Pacienti jsou diagnostikováni především v oblastech s těžkým průmyslem (zejména s kamenouhelnými doly) a v městských aglomeracích s hustou zástavbou doprovázenou vysokou prašností. Infekce u lidí způsobované M. kansasii nemají explozivní charakter jako klasické bakteriální infekce šířící se vodou. K onemocnění dochází jen u predisponovaných jedinců, kteří jsou opakovaně vystaveni velké bakteriální náloži pocházející nejčastěji z vodního zdroje. Přestože nemocní s rozpadovou plicní formou nezřídka produkují mikroskopicky detekovatelné a kvantitativně významné množství mykobakteriálních buněk ve sputu, nebyl interhumánní přenos rovněž u tohoto původce prokázán [41].
Vektorem M. kansasii je infekční aerosol a vstupní bránou je respirační trakt. Přesto u imunitně kompetentních a jinak zdravých jedinců (včetně dětí) je většina post inhalačního inokula úspěšně eliminována přirozenými obrannými mechanismy a k rozvoji onemocnění dochází jen u jedinců predisponovaných [42, 43].
V ČR je nejčastější profesní expozice pracovníků dolů a těžkého průmyslu. Predisponujícím onemocněním je pneumokonióza významně spojená s kouřením a abúzem alkoholu. Kouření tabáku samotné, pravděpodobně i vlivem ciliární dyskineze, bez expozice zátěžovému pracovnímu prostředí se jeví rovněž jako stěžejní rizikový faktor [45]. S rozvojem a zvýšením dostupnosti metod přesné identifikace mykobakterií je možno odlišit potenciálně virulentnější kmeny (jednotlivé druhy komplexu) druhu M. kansasii a relativně objektivizovat riziko rozvoje onemocnění v kontextu celkového stavu, nálezu a kondice pacienta, s cílem opět zabránit nepotřebné fyziologické zátěži dlouhodobou antibiotickou terapií, zejména při nespecifickém nálezu.
4.2.3 Léčba
Typické, rozpadové formy onemocnění vyžadují léčbu vždy. Na paměti je potřeba mít několik skutečností: nevirulentní druhy komplexu M. kansasii mohou kontaminovat roztoky v laboratorním i klinickém prostředí. Pseudoepidemie v rámci klinických zařízení jsou evidovány (rovněž na našich pracovištích) [44].
Většina onemocnění probíhá formou rozpadového procesu asociujícího se s klasickou tuberkulózu (při zobrazovacích metodách a klinickém vyšetření nelze odlišit). M. kansasii se vyznačuje stabilní citlivostí k antituberkulotikům s výjimkou hraniční rezistence na isoniazid a přirozenou rezistencí k pyrazinamidu [45]. Dřívější léčebné režimy byly relativně úspěšně vedeny standardní antituberkulózní čtyřkombinací léků (isoniazid, rifampicin, etambutol a pyrazinamid). V posledních 10 letech je však více preferována – s ohledem na variabilní dopad pyrazinamidu a isoniazidu na debacilizaci, metabolickou zátěž pacienta a empiricky prokázanou efektivitu – léčba omezená pouze na makrolidové preparáty: azitromycin (klarithromycin) 500 mg/den v kombinaci s rifampicinem (10 mg/kg; max. 600 mg/ den) a etambutolem (15 mg/kg/den) [31, 44].
4.3 Mycobacterium xenopi
4.3.1 Vlastnosti a zdroje
M. xenopi bylo poprvé izolováno z granulomatózních kožních změn drápatek vodních (Xenopus laevis), které byly používány k laboratornímu testování gravidity žen [46]. Jeho teplotní růstové optimum je 40–45 °C a ve vodovodních systémech pro teplou vodu je schopno přežívat až do teploty 64 °C (obr. 5). Tím je do značné míry z ekologického hlediska předurčeno, kde se nejčastěji tento druh mykobakterií vyskytuje [47]. M. xenopi je proto úspěšným kolonizátorem umělých vodovodních systémů užitkové i pitné vody. Nejvhodnější jsou pro kumulaci, přežívání a dlouhodobou perzistenci jak M. kansasii, tak i M. xenopi, zařízení pro zásobníkový ohřev vody a distribuční systém s nimi spojený [48].
Mimo rezistenci k teplotě vyšší než 50 °C je vybaveno mechanismy k přežití v prostředí chudém na živiny. V nádržích a v rozvodných potrubích výměníkových jednotek nahromaděné organické i anorganické látky umožňují shlukováním a růstem různých mikroorganismů včetně prvoků tvorbu biofilmů. V nich se za vhodných teplotních podmínek množí také různé druhy NTM včetně prevalujícího M. xenopi. Důležité faktory posilující odolnost NTM ve vodním prostředí jsou tedy teplota, pH, usazeniny v potrubí, shlukování mikroorganismů a dostupnost nutričních faktorů pocházejících z organických látek: železo, dusitany a sulfitová redukční činidla a látky se sníženým obsahem chlórů [49]. Jeho přítomnost byla zaznamenána v užitkové vodě určené pro hygienu zaměstnanců v průmyslu, v pitné vodě domácností a ve vodě používané v klinických a laboratorních zařízeních [48].
Image 5. (a). M. xenopi na Löwenstein-Jensenově půdě, 14denní kultura. Obr. 5 (b). M. xenopi, tvorba hnízdovitých útvarů (tzv. clustering) někdy označovaných jako ptačí hnízda, barvení dle Ziehl-Neelsena, zvětšeno 1 000x (foto V. Ulmann).Figure 5 (a). M. xenopi on Löwenstein-Jensen medium, 14-day culture. Figure 5 (b). M. xenopi, formation of nest-like formations (so-called clustering) sometimes referred to as bird’s nests, staining according to Ziehl-Neelsen, magnification 1,000x (Photo V. Ulmann). 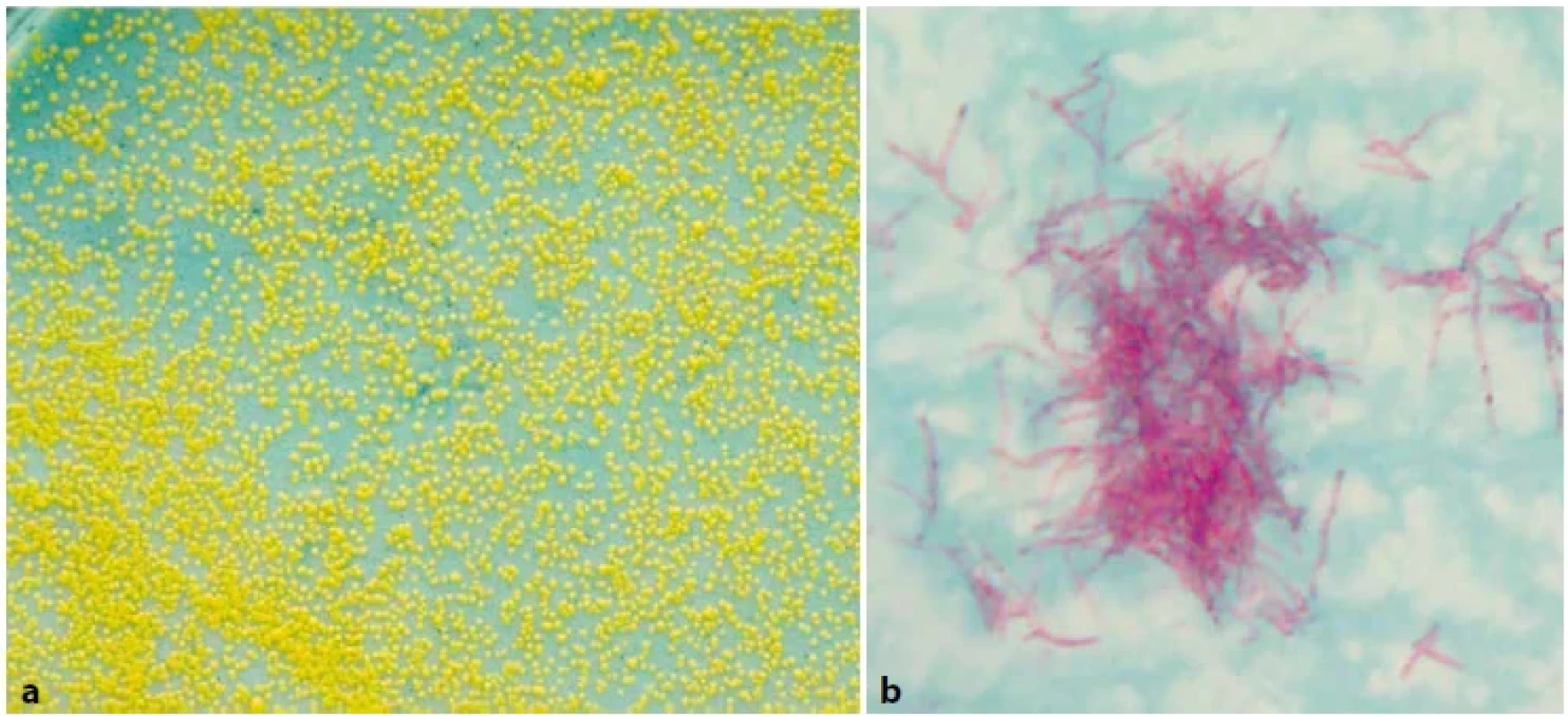
4.3.2 Onemocnění
Tento druh bývá velmi často izolován z biologického materiálu pacientů; jeho klinické uplatnění je však méně časté [49]. Jedna z jeho fyziologických adaptací je schopnost tvorby kompaktních buněčných útvarů (tzv. ptačí hnízda, shluky množících se mykobakterií zůstávají při sobě a jsou podobné hnízdům ptáků), které odolávají interakci s imunitním systémem hostitele (obr. 5) [50]. V praxi je nejčastěji možné se setkat s perzistentními, velmi úzce lokalizovanými kolonizacemi plic pacientů predisponovaných chronickou obstrukční nemocí (muži) v kombinaci s abúzem alkoholu a prodělanou tuberkulózou (ženy). Rekolonizace tkáně změněné po prodělané TBC je poměrně častá a výsledkem je přetrvávání plicního nálezu typického pro TBC (rozpadová dutina) [52].
Obdobně jako jiné druhy NTM, tak i M. xenopi bývá nezřídka náhodně izolováno u pacientů s podezřením, nebo již prokázaným karcinomem plic. Přetrvávající nález asociující neoplastický proces může být na základě perzistentní kolonizace segmentu plic M. xenopi, nebo jde o skutečnou malignitu. Zejména u kuřáků je proto vždy v rámci diagnostiky vhodné provedení bronchoskopie, či transtorakální biopsie následně vyšetřené histologicky i mikrobiologicky s cílenou kultivací na mykobakterie [53].
Nejčastější příčinou záchytu M. xenopi v laboratoři jsou však jednorázové sekundární kontaminace. Mimoplicní onemocnění způsobovaná M. xenopi jsou u nás i v zahraničí vzácná [54]. Tento druh je schopen kolonizovat zařízení pro destilaci vody, povrchy endoskopů (bronchoskopů), a po expozici také transientně sliznici úst a dolních cest dýchacích [54]. Záchyty ze vzorků odebíraných při bronchoskopii jsou mnohdy považovány za diagnostické, ovšem v případě M. xenopi mohou i mnohem pravděpodobněji představovat kontaminaci. S těmito eventualitami je nutno při diferenciální diagnostice počítat a každý podezřelý nález konzultovat s laboratoří.
4.3.3 Léčba
Terapie mykobakterióz způsobovaných M. xenopi není komplikovaná. U tohoto druhu NTM nevznikají tak často rezistence na antituberkulotika a chemoterapeutika, jako je tomu u většiny ostatních klinicky významných druhů NTM [31]. Empirická léčba s kombinací makrolidových antibiotik, rifampicinu a etambutolu je proto dostatečně účinná pro eliminaci onemocnění u většiny pacientů [56]. V některých případech je žádoucí zároveň chirurgická excize lokalizovaného plicního ložiska.
5. ZÁVĚR A DOPORUČENÍ
Je zjevné, že s infekcemi a následnými onemocněními způsobenými druhy komplexu M. avium se budeme nadále setkávat. U pacientů s chronickými a ireverzibilními predispozicemi je důležité zamezení opakované expozice infekčnímu zdroji. Vyhledání tohoto zdroje v rámci bezprostředního okolí pacienta by mohlo být součástí komplexního řešení každého komplikovaného případu. Laboratorní vyšetření potenciálně infekčních zdrojů je v současnosti proveditelné a v podstatě rutinně dostupné. Dosavadní průzkum našeho týmu naznačuje vyšší potenciál pevných matric rašelinného původu, oproti dříve uvažovaným vodním zdrojům.
Nesmírnou překážkou efektivní terapie je vzrůstající rezistence a perzistence kmenů komplexu MAIC na makrolidová antibiotika. V současnosti jsou dostupné metody molekulárně biologické detekce mutací genomu tyto rezistence podmiňující. Oproti standardním fenotypovým (kultivačním) metodám je možné zjištění případné rezistence mnohem rychleji.
Mimo uvedené druhy je pozorován trend nového výskytu, včetně klinického uplatnění dalších zajímavých druhů NTM. V posledních pěti letech vrůstá záchytnost v souvislosti s onemocněním u pacientů dospělých i dětí vyvolaných M. malmoense. U pacientů s CF zhoršuje prognózu záchyt M. abscessus. Fenoménem poslední doby je také výskyt M. intracellulare a M. chimaera v termoregulačních přístrojích na kardiochirurgických jednotkách. Prozatím neopsán zůstává původ infekcí a dopad v laboratořích frekventně izolovaných dvou druhů: M. arupense a M. kumamotonense.
Poděkování
Tato práce vznikla za finanční podpory Agentury zdravotnického výzkumu ČR (projekt č. NU20-09-00114).Do redakce došlo dne 23. 10. 2022.
Adresa pro korespondenci:
prof. MVDr. Ivo Pavlík, CSc.
Ústav teritoriálních studií
Fakulta regionálního rozvoje a mezinárodních studií
Mendelova univerzita v Brně
tř. Generála Píky 7
613 00 Brno
e-mail: ivo.pavlik@mendelu.cz
Sources
- LPSN. List of Prokaryotic Names with Standing in Nomenclature. Available online: https://lpsn.dsmz.de/ (17.7.2022).
- Kazda J. The Ecology of Mycobacteria; Kluwer Academic Publishers: Dordrecht, The Netherlands; Boston, MA, USA; London, UK, 2000; 72 s.
- Kazda J, Pavlik I, Falkinham J, et al. The Ecology of Mycobacteria: Impact on Animal’s and Human’s Health. Dordrecht: Springer, 2009. 520 s.
- Horváthová A, Kazda J, Bartl J, et al. Výskyt podmienečne patogénnych mykobaktérií v prostredí a ich vplyv na živý organizmus. Vet Med-Czech, 1997;42(7):191–212.
- Gramegna A, Lombardi A, Lorè NI, et al. Innate and adaptive lymphocytes in non-tuberculous mycobacteria lung disease: A review. Front Immunol, 2022;13 : 927049.
- Trovato A, Baldan R, Costa D, et al. Molecular typing of Mycobacterium abscessus isolated from cystic fibrosis patients. Int J Mycobacteriol, 2017;6(2):138–141.
- Davidson RM, Nick SE, Kammlade SM, et al. Genomic analysis of a hospital-associated outbreak of Mycobacterium abscessus: Implications on transmission. J Clin Microbiol, 2022;60(1):e0154721.
- Norton GJ, Williams M, Falkinham JO 3rd, Honda JR. Physical measures to reduce exposure to tap water-associated nontuberculous mycobacteria. Front Public Health, 2020;8 : 190.
- Feng Z, Bai X, Wang T, et al. Differential responses by human macrophages to infection with Mycobacterium tuberculosis and non-tuberculous mycobacteria. Front Microbiol, 2020;11 : 116.
- Noma K, Mizoguchi Y, Tsumura M, Okada S. Mendelian susceptibility to mycobacterial diseases: state of the art. Clin Microbiol Infect. 2022;28(11):1429–1434. Epub 2022; Erratum in: Clin Microbiol Infect. 2022; PMID: 35283318.
- Warheit-Niemi HI, Edwards SJ, SenGupta S, et al. Fibrotic lung disease inhibits immune responses to staphylococcal pneumonia via impaired neutrophil and macrophage function. JCI Insight, 2022;7(4):e152690.
- Chien JY, Lai CC, Sheng WH, et al. Pulmonary infection and colonization with nontuberculous mycobacteria, Taiwan, 2000 – 2012. Emerg Infect Dis, 2014;20(8):1382–1385.
- Bonaiti G, Pesci A, Marruchella A, et al. Nontuberculous mycobacteria in noncystic fibrosis bronchiectasis. Biomed Res Int, 2015 : 197950.
- Haque AK. The pathology and pathophysiology of mycobacterial infections. J Thorac Imaging, 1990;5(2):8–16.
- Zdravotnická statistika České republiky: Tuberkulóza a respirační nemoci. Praha: Ústav zdravotnických informací a statistiky; 2001–2021.
- Bartos M, Hlozek P, Svastova P, et al. Identification of members of Mycobacterium avium species by Accu-Probes, serotyping, and single IS900, IS901, IS1245 and IS901-flanking region PCR with internal standards. J Microbiol Methods, 2006;64 : 333–345.
- Mijs W, de Hass P, Rossau R, et al. Molecular evidence to support a proposal to reserve the designation Mycobacterium avium subsp. avium for bird-type isolates and ‘M. avium subsp. hominissuis’ for the human/porcine type of M. avium. Int J Syst Evol Microbiol, 2002;52 : 1505–1518.
- Pavlik I, Svastova P, Bartl J, et al. Relationship between IS901 in the Mycobacterium avium complex strains isolated from birds, animals, humans, and the environment and virulence for poultry. Clin Diagn Lab Immunol, 2000;7(2):212–217.
- Kaevska M, Slana I, Kralik P, et al. Examination of Mycobacterium avium subsp. avium distribution in naturally infected hens by culture and triplex quantitative real time PCR. Vet Med-Czech, 2010;55(7):325–330.
- Agrawal G, Aitken J, Hamblin H, et al. Putting Crohn’s on the MAP: Five common questions on the contribution of Mycobacterium avium subspecies paratuberculosis to the pathophysiology of Crohn’s Disease. Dig Dis Sci, 2021;66(2):348–358.
- Matern WM, Jenquin RL, Bader JS, Karakousis PC. Identifying the essential genes of Mycobacterium avium subsp. hominissuis with Tn-Seq using a rank-based filter procedure. Sci Rep, 2020;10(1):1095.
- Kaevska M, Slana I, Kralik P, et al. “Mycobacterium avium subsp. hominissuis” in neck lymph nodes of children and their environment examined by culture and triplex quantitative real-time PCR. J Clin Microbiol, 2011;49(1):167–172.
- Thegerström J, Jönsson B, Brudin L, et al. Mycobacterium avium subsp. avium and subsp. hominissuis give different cytokine responses after in vitro stimulation of human blood mononuclear cells. PLoS One, 2012;7(4).
- Ulmann V, Kracalikova A, Dziedzinska R. Mycobacteria in water used for personal hygiene in heavy industry and collieries: A potential risk for employees. Int J Environ Res Public Health, 2015;12(3):2870–2877.
- Waletzko B, Lin PL, Lopez SMC. “Hot Tub Lung” With M. avium complex in an immunocompetent adolescent. Pediatr Infect Dis J, 2023;42(3):e84-e87.
- Ulmann V, Modrá H, Babak V, et al. Recovery of mycobacteria from heavily contaminated environmental matrices. Microorganisms, 2021;9(10):2178.
- Pavlik I, Ulmann V, Modra H, et al. Nontuberculous mycobacteria prevalence in bats’ guano from caves and attics of buildings studied by culture and qPCR examinations. Microorganisms, 2021;9(11):2236.
- Janda A, Mejstříková E, Salzer U, et al. Deficit transkripčního faktoru GATA-2: nová imunodeficience se širokým fenotypovým spektrem. První pacienti diagnostikovaní v České republice a přehled literatury. Čes-slov pediatr, 2013;68(2):101–112.
- Zhou Y, Mu W, Zhang J, et al. Global prevalence of non-tuberculous mycobacteria in adults with non-cystic fibrosis bronchiectasis 2006–2021: A systematic review and meta-analysis. BMJ Open, 2022;12(8):e055672.
- Rojony R, Martin M, Campeau A, et al. Quantitative analysis of Mycobacterium avium subsp. hominissuis proteome in response to antibiotics and during exposure to different environmental conditions. Clin Proteomics, 2019;16 : 39.
- Corrigendum to: Treatment of Nontuberculous Mycobacterial Pulmonary Disease: An Official ATS/ERS/ESCMID/IDSA Clinical Practice Guideline. Clin Infect Dis, 2020;71(11):3023. Erratum for: Clin Infect Dis, 2020;71(4):e1-e36.
- Kim HJ, Lee JS, Kwak N, et al. Role of ethambutol and rifampicin in the treatment of Mycobacterium avium complex pulmonary disease. BMC Pulm Med, 2019;19(1).
- Kwon YS, Koh WJ, Daley CL. Treatment of Mycobacterium avium complex pulmonary disease. Tuberc Respir Dis (Seoul), 2019;82(1):15–26.
- Picardeau M, Prod’Hom G, Raskine L, et al. Genotypic characterization of five subspecies of Mycobacterium kansasii. J Clin Microbiol, 1997;35(1):25–32.
- Murugaiyan J, Lewin A, Kamal E, et al. MALDI spectra database for rapid discrimination and subtyping of Mycobacterium kansasii. Front Microbiol, 2018;9 : 587.
- Jagielski T, Borówka P, Bakuła Z, et al. Genomic insights into the Mycobacterium kansasii complex: An update. Front Microbiol, 2020;10 : 2918.
- Johnston JC, Chiang L, Elwood K. Mycobacterium kansasii. Microbiol Spectr, 2017;5(1).
- Fujita Y, Naka T, McNeil MR, et al. Intact molecular characterization of cord factor (trehalose 6,6’-dimycolate) from nine species of mycobacteria by MALDI-TOF mass spectrometry. Microbiology (Reading), 2005;151(Pt 10):3403–3416.
- Pavlik I, Ulmann V, Hubelova D, et al. Nontuberculous mycobacteria as sapronoses: A review. Microorganisms, 2022;10 : 1345.
- Ali J. A multidisciplinary approach to the management of nontuberculous mycobacterial lung disease: A clinical perspective. Expert Rev Respir Med, 2021;15(5):663–673.
- Ricketts WM, O’Shaughnessy TC, van Ingen J. Human-to-human transmission of Mycobacterium kansasii or victims of a shared source? Eur Respir J, 2014;44(4):1085–1087.
- Kim JH, Seo KW, Shin Y, et al. Risk factors for developing Mycobacterium kansasii lung disease: A case-control study in Korea. Medicine (Baltimore), 2019;98(5):e14281.
- Maliwan N, Zvetina JR. Clinical features and follow up of 302 patients with Mycobacterium kansasii pulmonary infection: a 50 year experience. Postgrad Med J, 2005;81(958):530–533.
- Tudik I, Ulmann V. Retrospective analysis of patients with pulmonary Mycobacterium kansasii infection. Stud Pneumol Phthiseol, 2013;73(6):214–221.
- Saleeb P, Olivier KN. Pulmonary nontuberculous mycobacterial disease: New insights into risk factors for susceptibility, epidemiology, and approaches to management in immunocompetent and immunocompromised patients. Curr Infect Dis Rep, 2010;12(3):198–203.
- Schwabacher H. A strain of Mycobacterium isolated from skin lesions of a cold-blooded animal, Xenopus laevis, and its relation to atypical acid-fast bacilli occurring in man. J Hyg (Lond), 1959;57 : 57–67.
- Modra H, Bartos M, Hribova P, et al. Detection of mycobacteria in the environment of the Moravian Karst (Bull Rock Cave and the relevant water catchment area): the impact of water sediment, earthworm castings and bat guano. Vet Med-Czech, 2017;62 : 153–168.
- Sniadack DH, Ostroff SM, Karlix MA, et al. A nosocomial pseudo-outbreak of Mycobacterium xenopi due to a contaminated potable water supply: Lessons in prevention. Infect Control Hosp Epidemiol, 1993;14(11):636–641.
- Modra H, Ulmann V, Caha J, et al. Socio-economic and environmental factors related to spatial differences in human non-tuberculous mycobacterial diseases in the Czech Republic. Int J Environ Res Public Health, 2019;16(20):3969.
- Vijay S, Mukkayyan N, Ajitkumar P. Highly deviated asymmetric division in very low proportion of mycobacterial mid-log phase cells. Open Microbiol J, 2014;8 : 40–50.
- Mogami R, Goldenberg T, de Marca PG, Mello FC, Lopes AJ. Pulmonary infection caused by Mycobacterium kansasii: Findings on computed tomography of the chest. Radiol Bras, 2016;49(4):209213.
- Damaraju D, Jamieson F, Chedore P, Marras TK. Isolation of non-tuberculous mycobacteria among patients with pulmonary tuberculosis in Ontario, Canada. Int J Tuberc Lung Dis, 2013;17(5):676–681.
- Fogla S, Pansare VM, Camero LG, et al. Cavitary lung lesion suspicious for malignancy reveals Mycobacterium xenopi. Respir Med Case Rep, 2018;23 : 83–85.
- van Ingen J, Boeree MJ, de Lange WC, et al. Mycobacterium xenopi clinical relevance and determinants, the Netherlands. Emerg Infect Dis, 2008;14(3):385–389.
- Bennett SN, Peterson DE, Johnson DR, et al. Bronchoscopy-associated Mycobacterium xenopi pseudoinfections. Am J Respir Crit Care Med, 1994;150(1):245–250.
- Andréjak C, Almeida DV, Tyagi S, et al. Improving existing tools for Mycobacterium xenopi treatment: assessment of drug combinations and characterization of mouse models of infection and chemotherapy. J Antimicrob Chemother, 2013;68(3):659–665.
- Ulmann V, Modrá H, Bartoš M, et al. Epidemiologie vybraných zástupců komplexu Mycobacterium tuberculosis v České republice v letech 2000–2016. Epidemiol Mikrobiol Imunol, 2018;67(4):184–190.
- Svobodová J. Případy tuberkulózy v ČR v letech 2009–2012 vyvolané neobvyklými druhy komplexu Mycobacterium tuberculosis. Zprávy Centra epidemiologie a mikrobiologie, 2013;22(1):12–14.
- Bártů V, Müllerová M, Kalina P, et al. Tuberkulóza vyvolaná Mycobacteriem bovis. Stud Pneumol Phthiseol, 2009;69(1):5–7.
- Kaustová J, Olsovský Z, Kubín M, et al. Endemic occurrence of Mycobacterium kansasii in water-supply systems. J Hyg Epidemiol Microbiol Immunol, 1981;25(1):24–30.
- Chobot S, Malis J, Sebakova H, et al. Endemic incidence of infections caused by Mycobacterium kansasii in the Karvina district in 1968–1995 (analysis of epidemiological data-review). Cent Eur J Public Health, 1997;5(4):164–173.
- Klanicova B, Seda J, Slana I, et al. The tracing of mycobacteria in drinking water supply systems by culture, conventional, and real time PCRs. Curr Microbiol, 2013;67(6):725–731.
- Krizova K, Matlova L, Horvathova A, et al. Mycobacteria in the environment of pig farms in the Czech Republic between 2003 and 2007. Vet Med-Czech, 2010;55(2):55–69.
- Matlova L, Dvorska L, Bartl J, et al. Mycobacteria isolated from the environment of pig farms in the Czech Republic during the years 1996 to 2002. Vet Med-Czech, 2003;48(12):343–357.
- Beran V, Matlova L, Dvorska L, et al. Distribution of mycobacteria in clinically healthy ornamental fish and their aquarium environment. J Fish Dis, 2006;29(7):383–393.
- Slany M, Makovcova J, Jezek P, et al. Relative prevalence of Mycobacterium marinum in fish collected from aquaria and natural freshwaters in central Europe. J Fish Dis, 2014;37(6):527–533.
- Klanicová B, Slaný M, Slaná I. Analysis of sediments and plants from the system of five fishponds in the Czech Republic using culture and PCR methods. Sci Total Environ, 2014;472 : 851–854.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2023 Issue 3-
All articles in this issue
- Monitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
- Úloha endogénnych retrovírusov v ľudskom organizme
- Mykobakteriózy – nejčastější původci
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Lidská babesióza
- Detekce superantigenů u izolátů Streptococcus pyogenes na základě dat celogenomové sekvenace
- Prevalencia meticilín-rezistentného Staphylococcus aureus medzi obyvateľmi domovov dôchodcov na Slovensku
- Vzpomínka na RNDr. Václava Rupeše, CSc.
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mykobakteriózy – nejčastější původci
- Lidská babesióza
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

