-
Medical journals
- Career
Virus hepatitidy E
Authors: M. Kubánková 1; V. Němeček 2; P. Chalupa 3; M. Mihalčin 4; P. Vašíčková 1
Authors‘ workplace: Výzkumný ústav veterinárního lékařství, v. v. i., Brno 1; Státní zdravotní ústav, Národní referenční laboratoř pro virové hepatitidy, Praha 2; Klinika infekčních nemocí, 1. lékařská fakulta, Univerzita Karlova v Praze a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 3; Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta Masarykovy univerzity, Brno 4
Published in: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 1, s. 4-14
Category: Review Article
Overview
Počet prokázaných případů hepatitidy E (HE) v České republice má vzrůstající tendenci a to zřejmě z důvodu zavedení nových diagnostických postupů a také většího povědomí o HE. Zdroje onemocnění zůstávají ve většině případů nepotvrzené nebo zcela nejasné. Původce onemocnění virus hepatitidy E (HEV) patří do čeledi Hepeviridae, v rámci které byly popsány kmeny HEV od různých druhů zvířat z třídy savců, ptáků a ryb. HEV je rozšířen v chovech prasat domácích a v populacích prasat divokých po celém světě. Prasata domácí i divoká jsou považována za významné rezervoáry HEV. Konzumace nedostatečně tepelně upraveného masa a vnitřností z rezervoárových zvířat je z hlediska zoonotického přenosu HEV riziková. Cílem tohoto článku je shrnutí nových poznatků o HEV.
Klíčová slova:
hepatitida E – zoonóza – alimentární infekceÚVOD
Virus hepatitidy E (HEV) je častým etiologickým agens akutní hepatitidy v rozvojových zemích Asie a Afriky. V souvislosti s tamními nevhodnými hygienickými podmínkami a s poměrně snadným fekálním znečištěním pitné vody je příčinou jak rozsáhlých epidemií, tak velkého počtu sporadických případů onemocnění hepatitidou E (HE). HE byla proto v minulých letech považována za onemocnění, které se svým geografickým výskytem omezovalo na rozvojové země [1]. Avšak vzrůstající počet lokálně získaných případů HE ve vyspělých zemích poukázal na další možné zdroje a cesty přenosu HEV, a zvýšil tak zájem široké veřejnosti o toto nové („emerging“) onemocnění [2].
Podobná situace je zaznamenána i v České republice (ČR). Od roku 1996 je výskyt HE sledován a hlášen do informačního systému EPIDAT. S novými diagnostickými postupy se celkový počet onemocnění nejenom mnohonásobně zvýšil, ale velice se změnil poměr případů importované HE k lokálně získané HE [3]. V roce 2012 z celkového počtu 249 hlášených případů bylo pouze 9 případů spojeno s pobytem v zahraničí [4, 5]. Ve většině případů se jednalo o HE získanou na území ČR. Zoonotický přenos HEV po konzumaci nedostatečně tepelně připravených pokrmů z masa nebo vnitřností (zejména jater) prasat domácích (Sus scrofa f. domestica), prasat divokých (Sus scrofa) nebo jelenů sika (Cervus nippon) byl popsán v zahraničí [6]. V ČR byly zaznamenány případy alimentárních infekcí HE ve spojitosti s masnými produkty ze zabijaček, avšak bez přímého průkazu. Vzhledem k poměrně dlouhé inkubační době onemocnění (2–8 týdnů) se ve většině případů nepodaří dohledat a následně potvrdit zdroj HE [7, 8].
V evropských zemích je v lidské populaci zaznamenána poměrně vysoká prevalence protilátek proti HEV třídy IgG, která je značně variabilní jak mezi zeměmi, tak i mezi regiony určitých zemí. Vedle akutních případů HE, které u jedinců s dobrým stavem imunitního systému probíhají bez komplikací a nepřecházejí do chronicity, se vyskytují i chronické případy HE u imunosuprimovaných pacientů. U pacientů se současně probíhajícím onemocněním jater může mít HE fulminantní průběh a vyústit až v jaterní selhání. Takové případy zůstávají otevřené bez odhalení cesty přenosu a zdroje onemocnění [9].
V nedávné době byly izolovány kmeny HEV u dalších druhů zvířat rozšiřující hostitelskou diverzitu viru. Lze předpokládat, že i další zvířata mohou sloužit jako rezervoáry HEV a následně se podílet na šíření onemocnění v lidské populaci [10]. Nicméně tyto možnosti musí být ještě ověřeny.
CHARAKTERISTIKA A TAXONOMIE VIRU HEPATITIDY E
HEV taxonomicky náleží do čeledi Hepeviridae. Samotná čeleď Hepeviridae zahrnuje velké množství kmenů HEV a HEV-like viruses (viry podobné HEV), které byly získány od širokého spektra hostitelů z třídy savců, ptáků a ryb [11]. V současné době se diskutuje o několika návrzích na změnu klasifikace v rámci čeledi Hepeviridae týkající se rodů, druhů a genotypů [11, 12]. Běžně používané taxonomické dělení čeledi do rodu Hepevirus a samostatně stojící skupiny aviárních kmenů se na základě analýzy existujících sekvencí HEV a nově objevených izolátů HEV u rozmanitých druhů zvířat (např. u losů, norků, velbloudů a ryb) ukazuje jako nevyhovující. Je proto navrhováno rozdělení čeledi do rodů Orthohepevirus, který zahrnuje všechny savčí a aviární izoláty HEV, a Piscihepevirus pro izoláty HEV získané z ryb (tab. 1). Tento systém by měl usnadnit orientaci při správném zařazování nově se objevujících izolátů HEV [13].
Table 1. Navrhovaná klasifikace čeledi Hepeviridae [24] Table 1. Proposed classification of the family Hepeviridae [24] ![Navrhovaná klasifikace čeledi Hepeviridae [24]
Table 1. Proposed classification of the family Hepeviridae [24]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/23b8132f41c9d346f021ae7e94921b33.jpg)
HEV je malý (27–34 nm), sférický, neobalený virus, jehož genom obsahuje nesegmentované 7,2 kb dlouhé vlákno ribonukleové kyseliny (RNA) s pozitivní polaritou, které se skládá ze tří částečně se překrývajících čtecích rámců (ORF1, 2, 3) a krátkých nekódující oblastí na 5´ i 3´konci. 5´ konec je opatřen tzv. čepičkou nezbytnou pro infekčnost virových částic [14]. ORF1 tvoří největší úsek genomu HEV kódující nestrukturální proteiny zodpovědné za replikaci viru. Jedním z těchto proteinů je RNA-dependentní RNA-polymeráza (RdRp). Aktivita RdRp postrádá opravné mechanismy při replikaci genomu viru a to vede k významné genetické variabilitě HEV (1,4–1,72 x 10-3 substitucí na bázi za rok) [15]. ORF2 je relativně vysoce konzervovaná část genomu kódující jediný protein virové kapsidy, který je zodpovědný za interakce s hostitelskou buňkou a indukci tvorby neutralizačních protilátek [16]. Nejmenší část genomu, ORF3, kóduje imunogenní fosfoprotein, který se zapojuje do morfogeneze a uvolňování virionu z hostitelských buněk. Jeho významnější úloha je v interakcích s intracelulárními i extracelulárními proteiny (kinázami) v hepatocytech. Tyto interakce negativně modulují obranné mechanismy imunitního systému, a tak chrání virem napadený hepatocyt [1, 17].
STARÉ, NOVÉ ONEMOCNĚNÍ, HISTORIE
HE je pravděpodobně daleko starší onemocnění, než se předpokládalo. Ve studii zabývající se historií HE byl jako jeden z hlavních rysů použit počet úmrtí těhotných žen během epidemií hepatitid. Podle tohoto kritéria byl možný výskyt HE popsán již v roce 1794 v Německu. V 19. století a na začátku 20. století se velký počet epidemií HE objevil v USA, Austrálii, ale hlavně v západní Evropě a jejích koloniích. Po druhé světové válce začalo případů ubývat a naopak se začaly více objevovat na Středním východě, v Asii a v Africe [18]. Tento jev je přisuzován postupnému zavedení kanalizačního systému a lepšímu zabezpečení zdrojů pitné vody v Evropě, a tak k vytlačení genotypů 1 a 2 HEV do oblastí Asie a Afriky (obr. 1) [9, 18].
Image 1. Rozšíření genotypů viru hepatitidy E (HEV) ve světě Fig. 1. Distribution of HEV genotypes in the world 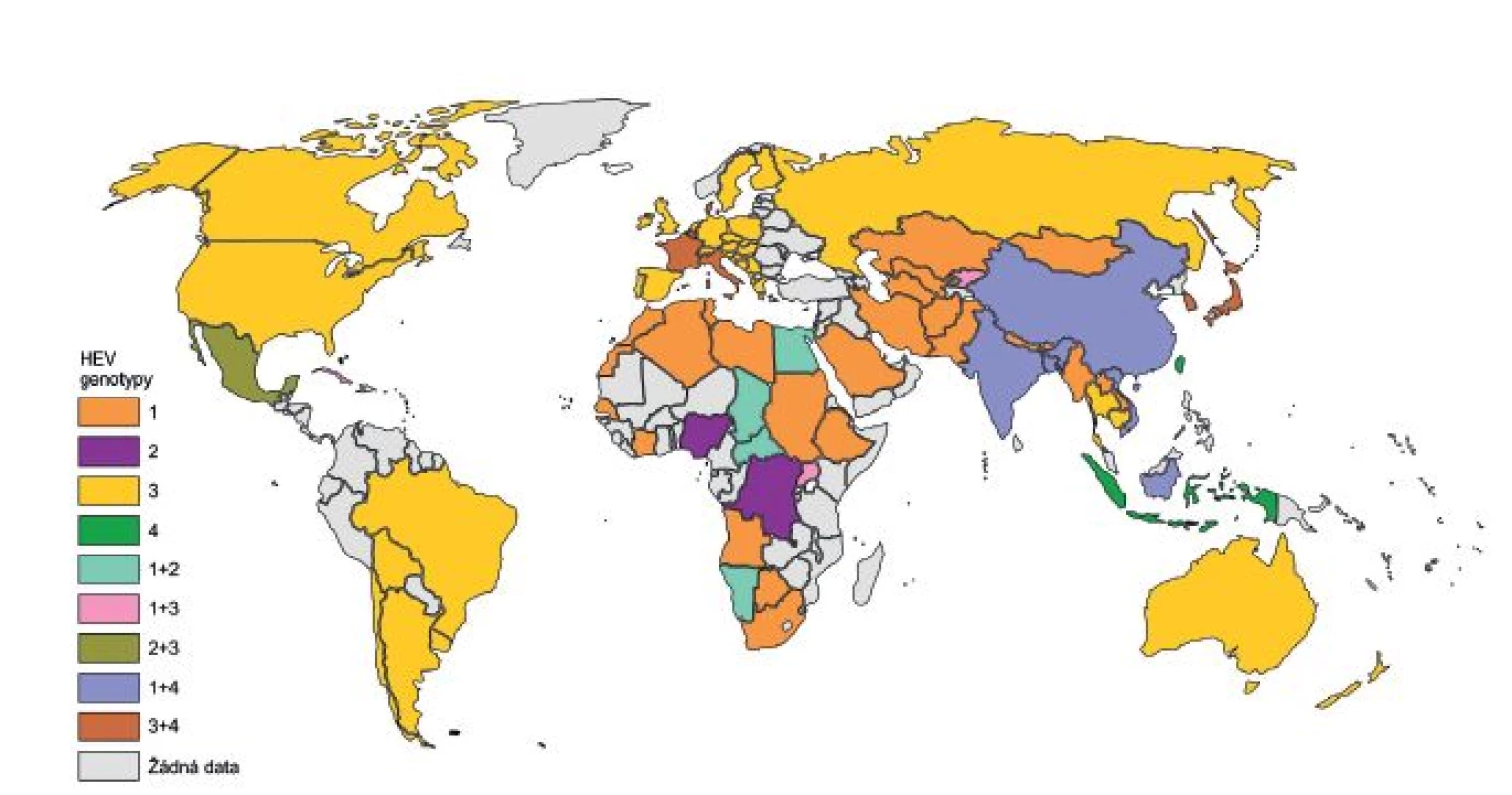
Upraveno dle [10, 17, 25] Adapted from [10, 17, 25] Jako první popsaná epidemie HE je uváděna epidemie, která proběhla v 50. letech minulého století v indickém Dillí, kde onemocnělo přes 29 tisíc lidí, a byla původně přisuzována viru hepatitidy A (HAV). Retrospektivně provedené sérologické analýzy, které byly uskutečněny o téměř 30 let později díky studiím několika epidemií v Kašmíru, vyvrátily HAV jako původce onemocnění [19]. Onemocnění bylo označováno jako hepatitida non-A, non-B. V roce 1983 byly virové částice původce identifikovány elektronovou mikroskopií, a to ve vzorcích stolice dobrovolníka po perorální infekci suspenzí stolice od pacienta s hepatitidou non-A, non-B [20]. Virus byl poté pojmenován HEV. V roce 1990 byl jeho genom naklonován a následně sekvenován [14, 21].
Epidemie HE jsou zaznamenávány jak v Asii, tak v Africe, se značně převažujícími počty epidemií v Indii. Díky ekonomickým poměrům v rozvojových zemích lze předpokládat, že značná část epidemií HE není vůbec doložena [19]. Poslední velké epidemie, obě čítající kolem čtyř až pěti tisíc případů HE, proběhly v roce 2012 v Indii a v roce 2013 v Súdánu (tab. 2) [17, 22]. Na základě sérologických dat je odhadováno, že jedna třetina celosvětové populace byla infikována HEV nebo přišla do kontaktu s jemu podobným agens. Jenom v samotné Indii je předpokládaný výskyt přes 2,2 milionů případů ročně [19].
Table 2. Epidemie hepatitidy E – genotypy 1 a 2 Table 2. Epidemics of hepatitis E – genotypes 1 and 2 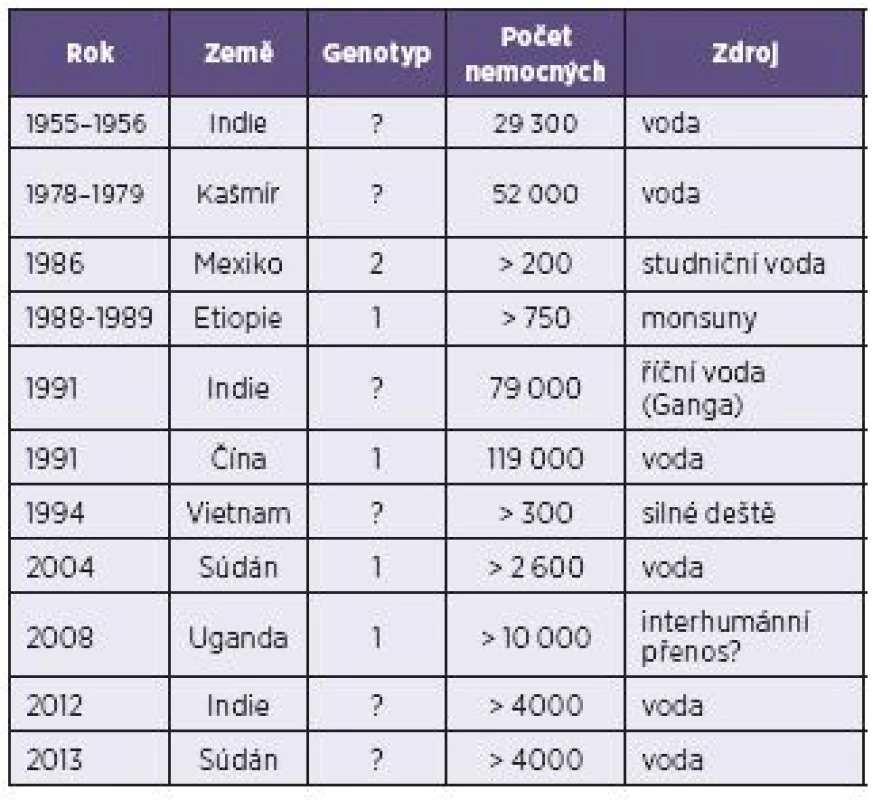
VIRUS HEPATITIDY E A LIDÉ
Kmeny HEV infikující člověka jsou klasifikovány do čtyř genotypů. Podle sekvenční a fylogenetické analýzy je možno genotypy dělit do několika podskupin: genotyp 1 (1a–1e), genotyp 2 (2a–2b), genotyp 3 (3a–3j) a genotyp 4 (4a–4g) [23]. Podle některých autorů je toto dělení sporné a kritéria pro přiřazování izolátů HEV do jednoho z těchto čtyř genotypů nedostatečná. Zvyšující se počet popsaných izolátů HEV a hostitelů zvyšuje počet potenciálně nových genotypů nebo dokonce rodů v rámci čeledi Hepeviridae (viz tab. 1) [2]. Například v nedávně době byly v Japonsku u prasat divokých popsány možné dva nové genotypy (genotyp 5 a 6 HEV) [24]. Pro epidemiologické účely je vhodné stanovení fylogenetických příbuzností analyzovaných kmenů, a tak určení možného původu infekce. Všechny genotypy patří k jednomu sérotypu [16].
Genotypy se od sebe výrazně odlišují svým geografickým rozmístěním a v souvislosti s tím i odlišnou epidemiologií (viz obr. 1) [25]. Jsou popisována dvě epidemiologicky různá schémata, která korelují s prevalencí HE v rozvojových zemích (genotyp 1 a 2 HEV) a ve vyspělých zemích (genotyp 3 a 4 HEV) [26]. HE je řazena mezi onemocnění přenášené alimentární cestou, a to hlavně kontaminovanou vodou nebo potravinami. K přenosu HEV může dojít ale i po kontaktu s infikovanými zvířaty a lidmi [9].
Genotypy 1 a 2 HEV infikují výhradně člověka, a to v rozvojových zemích Asie, Afriky a Střední Ameriky, kde jsou častou příčinou rozsáhlých epidemií i sporadických případů HE. Byly rovněž získány od pacientů z vyspělých zemí, kteří do těchto oblastí pouze cestovali [27]. Hlavní mechanismus šíření infekce je fekálně-orální přenos. Zejména v nedostatečných hygienických podmínkách dochází ke kontaminaci pitné a užitkové vody, často ve spojitosti se silnými dešti a záplavami, a tak k relativně snadnému šíření HEV a k infekci velkého počtu lidí (viz tab. 2). V těchto oblastech onemocní HE nejčastěji lidé ve věkovém rozmezí 15–30 let s celkovou letalitou < 1 %, která dosahuje vysokých hodnot (okolo 25 %) u těhotných žen ve třetím trimestru v důsledku častého fulminantního průběhu HE, kdy se rozvine akutní jaterní selhání. To je pravděpodobně způsobeno zvýšenými hodnotami hormonů (estrogenu, progesteronu a humánního choriového gonadotropinu) v souvislosti s dysregulací imunitního systému (zejména monocytů a makrofágů) a replikací viru [28]. Konzervativní léčba není účinná, nebo nedojde k provedení transplantace jater. Přenos z člověka na člověka je popsán a vyskytuje se v závislosti na úrovni hygienických podmínek [29]. Genotyp 1 je také zodpovědný za zvýšenou letalitu (až 70%) u pacientů se současně probíhajícím chronickým onemocněním jater [9].
Genotypy 3 a 4 HEV pocházejí od lidí zejména ze zemí se sporadickým výskytem HE a byly izolovány i od různých druhů zvířat po celém světě. Genotyp 3 byl u lidí prokázán v Severní Americe, Evropě, Japonsku, Austrálii a na Novém Zélandu. Genotyp 4 je svou geografickou distribucí omezen na asijské země (převážně Čína a Japonsko). Avšak v nedávné době byl genotyp 4 izolován u pacientů, kteří neuvedli cestu do asijských zemí, i v evropských zemích, a to konkrétně ve Francii [30], Německu [31], Itálii [32] a Dánsku [33]. Zdroje těchto genotypů a cesty jejich přenosu jsou v mnoha případech nejasné. Nicméně jsou doloženy případy infekce HEV z vyspělých zemí po konzumaci nedostatečně tepelně upraveného vepřového masa a vnitřností, nebo zvěřiny z divokých prasat a jelenů, které potvrzují zoonotický přenos [34–37].
Genotypy 3 a 4 HEV způsobují klinicky patrné onemocnění nejčastěji u mužů středního až pokročilejšího věku. Počet případů popsaných u mužů převyšuje třikrát počet případů u žen. V provedené studii v ČR byl poměr mužů a žen u infekcí HEV, které byly způsobeny genotypem 3, stanoven na 40 : 7. U většiny mužů bývá v anamnéze často uvedena větší konzumace alkoholu [4]. Přibližně 67–98 % infekcí probíhá u zdravých jedinců asymptomaticky. Jsou zaznamenány případy s fulminantním průběhem onemocnění u pacientů s preexistujícím onemocněním jater či přechod do chronicity u imunosuprimovaných pacientů. Přenos z člověka na člověka je v některých případech na základě sérologie zvažován i v ČR [7], ale pravděpodobně netvoří hlavní mechanismus přenosu [9].
VIRUS HEPATITIDY E U ZVÍŘAT
HEV jako jediný virus způsobující hepatitidu je schopen infikovat i jiná zvířata než primáty [38]. V poslední době vzrůstá počet živočišných druhů, u kterých byl identifikován přímo HEV či HEV-like viruses (respektive jeho genom, RNA) nebo protilátky proti HEV či jemu podobné agens [2].
Roku 1997 v USA byl poprvé HEV popsán u prasat domácích [39]. Postupně byly izolovány kmeny HEV u prasat domácích i v dalších zemích s vysokou produkcí vepřového masa. Po provedené fylogenetické analýze byly tyto kmeny zařazeny do genotypů 3 a 4 [23]. Bez ohledu na stupeň endemicity v určitých regionech v lidské populaci byl HEV zjištěn u prasat domácích po celém světě [40]. Dnes jsou prasata (domácí i divoká) považována za významný rezervoár HEV a ve většině případů jsou lidské kmeny HEV sekvenčně velice podobné (ne-li shodné) s prasečími kmeny HEV pocházejícími ze stejných geografických oblastí [41, 42]. U prasat domácích a pravděpodobně i divokých probíhá infekce HEV bez zjevných klinických příznaků. Mikroskopicky lze v jaterním parenchymu detekovat multifokální lymfoplazmatickou hepatitidu s lokálně hepatocelulární nekrózou. Nejcitlivější k infekci jsou jedinci od 2 do 4 měsíců stáří. K přenosu mezi prasaty dochází fekálně orální cestou. Vylučování viru výkaly trvá průměrně 3–7 týdnů. U prasat divokých byly izolovány kmeny HEV genotypu 3 a 4 [43]. V Japonsku byly také u prasat divokých identifikovány kmeny HEV fylogeneticky velmi odlišné, které jsou zařazeny do genotypů 5 a 6 [24]. Tyto dva nové genotypy nebyly zatím prokázány u lidí a jejich možný zoonotický potenciál nebyl dosud stanoven.
V Indii je za všechny humánní případy zodpovědný genotyp 1 HEV, ale u prasat byl izolován pouze genotyp 4 [44]. Žádné izoláty HEV od zvířat nepatří ke genotypům 1 a 2. Příležitostné záchyty takových izolátů, například u koní [45] nebo prasat domácích [46], nebyly dalšími testy potvrzeny, a pravděpodobně se tak jednalo o laboratorní kontaminaci [26].
HEV genotyp 3 byl izolován i od zástupců čeledi jelenovitých (Cervidae), a to konkrétně u jelena sika (Cervus nippon) [35], jelena lesního (Cervus elaphus) [47], srnce obecného (Capreolus capreolus) [48] a nově i u losa evropského (Alces alces) [49]. HEV byl získán i od muflona obecného (Ovis musimon) [50]. Jelenovití jsou společně s prasaty domácími i divokými v souvislosti se zoonotickým přenosem považováni za rezervoáry HEV v prostředí [51]. Vzhledem k zjištěným nižším prevalencím HEV u jelenovitých jsou tato zvířata v porovnání s prasaty domácími i divokými méně významným rezervoárem viru [2, 52].
Poměrně nedávno byl HEV identifikován u farmově chovaných králíků domácích (Oryctolagus cuniculus) ve Francii, USA a Číně [53–55]. Tyto izoláty byly zařazeny z hlediska příbuznosti ke genotypu 3. Podobně je tomu i u promyk (Herpestes japonicus) v Japonsku. Experimentálně se podařilo infikovat králičími kmeny HEV prasata domácí a primáty [56]. Přenos na člověka dosud nebyl popsán (tab. 3).
Table 3. Experimentální mezidruhový přenos viru hepatitidy E (HEV) Table 3. Experimental interspecies transmission of hepatitis E virus (HEV) 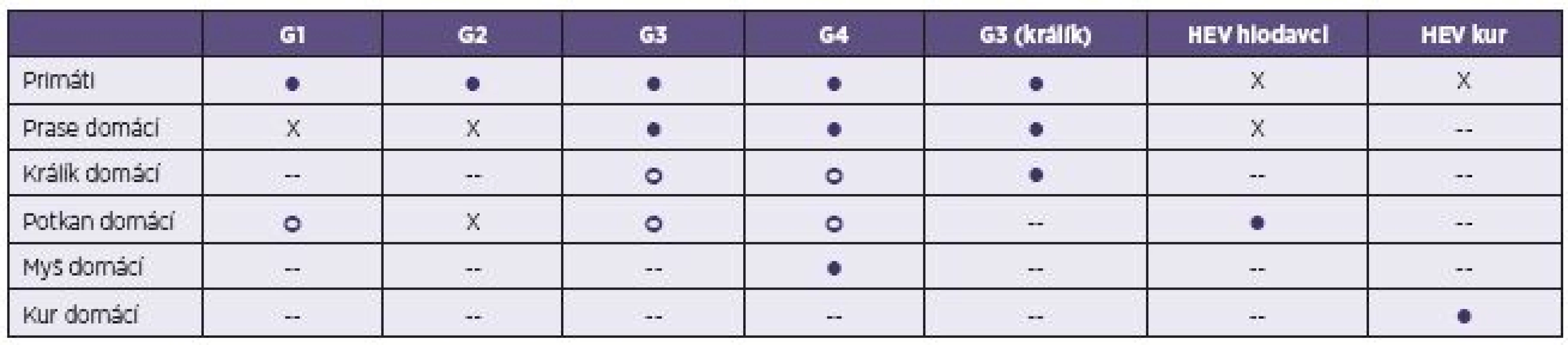
Upraveno podle [10]. Adapted from [10]. G1 – HEV genotyp 1, G2 – HEV genotyp 2, G3 – HEV genotyp 3, G4 – HEV genotyp 4 ● – úspěšná infekce (sérokonverze a vylučování viru), X – neúspěšná infekce, ○ – rozdílné výsledky provedených pokusů v závislosti na použití kmene HEV nebo pouze genomu viru, -- neprovedeno. G1 – HEV genotype 1, G2 – HEV genotype 2, G3 – HEV genotype 3, G4 – HEV genotype 4 ● – successful infection (seroconversion and virus excretion), X – unsuccessful infection, ○ – discordant results of experiments, depending on whether the HEV or HEV genome was used, -- not tested. U různých druhů hlodavců (Muridae a Soricidae) byly identifikovány geneticky odlišné kmeny, které sdílí jen 60% podobnost sekvencí genomu s ostatními savčími izoláty, a proto je navrženo řadit je do druhu Orthohepevirus C společně s kmeny HEV získanými od fretek (Mustela putorius) v Nizozemsku [24, 57]. Vedle těchto kmenů byly v USA u hlodavců izolovány i kmeny patřící ke genotypu 3 HEV [58].
V chovech drůbeže byly nejprve v Kanadě izolovány kmeny HEV zodpovědné za syndrom „hepatitis-splenomegaly“ (HS). Později byly případy HS hlášeny i z dalších zemí (USA, Čína, Španělsko a další) [59, 60]. Naproti tomu v Austrálii je aviární HEV spojen s onemocněním „big liver and spleen disease“. Předpokládá se, že se jedná o různé kmeny patřící do čeledi Hepeviridae [61]. Oproti kmenům HEV izolovaným u savců mají aviární izoláty HEV menší genom (6,6 kb) a jejich sekvence sdílí se savčími izoláty pouze 50–60% podobnost. Aviární izoláty jsou proto navrženy řadit do druhu Orthohepevirus B [24]. Onemocnění probíhá u drůbeže především subklinicky a není přenosné na člověka (tab. 3).
Kmeny HEV byly izolovány i u ryb, konkrétně u pstruhů žlutohrdlých (Oncorhynchus clarkii) v USA [62] a u různých druhů netopýrů (Hipposideridae, Phyllostomidae a Vespertilionidae) po celém světě [63]. Jedná se o fylogeneticky vzdálené kmeny a z tohoto důvodu jsou v navrhované klasifikaci izoláty netopýrů zařazeny do druhu Orthohepevirus D a izoláty ryb do samostatného rodu Piscihepevirus (viz tab. 1) [24].
Protilátky proti HEV byly sérologicky prokázány u různých druhů hospodářských (skot, ovce a kozy) i domácích zvířat (psi a kočky). To naznačuje, že zvířata buď prodělala infekci HEV, nebo pouze přišla do styku s agens antigenně podobným tomuto viru [11].
ZOONÓZA
Zoonotický potenciál HEV byl dlouhodobě diskutován po zjištění přítomnosti tohoto viru v chovech prasat domácích po celém světě a zvláště pak po úspěšném provedení experimentů na zvířatech, kdy byl potvrzen mezidruhový přenos viru. Prasata domácí se ukázala jako senzitivní k infekci lidskými kmeny HEV (genotyp 3 a 4), navíc protilátky získané od přirozeně infikovaných prasat HEV křížově reagovaly s lidskými kmeny HEV. V opačném případě se podařilo infikovat laboratorní primáty genotypem 3 izolovaným z prasat domácích (viz tab. 3) [39]. Další indikací zoonotického přenosu byl průkaz blízce geneticky příbuzných izolátů HEV od prasat divokých a domácích s lidskými izoláty [36].
V roce 2003 byl zoonotický přenos HE potvrzen na případech v Japonsku, kde došlo k onemocnění několika lidí po konzumaci masa nebo vnitřností pocházejících z prasat divokých a jelenů sika [34, 35]. Následně se podařilo získat sekvence genomu HEV z masa a jater, které vykazovaly blízkou příbuznost nebo dokonce byly identické s izoláty získanými od pacientů, kteří HE onemocněli [64, 65].
U domácích a divokých prasat, ani u jelenovitých HEV nevyvolává žádné klinické příznaky [43]. Veterinární prohlídkou nelze infikovaná zvířata odhalit. HEV může být přítomen v mase a orgánech (zejména játrech), které makroskopicky nejeví žádné změny [66]. RNA HEV byla detekována ve vepřových játrech pocházejících z tržní sítě v evropských zemích: 4 % v Německu [42], 1,3 % ve Velké Británii [67], 6 % v Nizozemí [68] a 11 % v Americe [69]. RNA HEV se podařila detekovat v 7 ze 12 vzorků ve Francii v tamní specialitě figatellu. Jedná se o výrobek původem z Korsiky s vysokým podílem vepřových jater, který se pouze několik dnů udí a dále se velmi často konzumuje tepelně neošetřený [37]. Infekční částice HEV se podařilo v tomto typu výrobku prokázat i kultivačně [70]. Přímý průkaz alimentárního přenosu HEV byl potvrzen po získání identických sekvencí z klinických vzorků od pacienta a ze zbytku konzumovaného výrobku [65]. Ve Španělsku byl poměrně nedávno popsán případ HE u pacienta po konzumaci vepřového masa. Získané sekvence byly identické [71].
SITUACE V ČESKÉ REPUBLICE
Studie provedené na našem území potvrdily výskyt HEV genotypu 3 u volně žijící zvěře i v chovech prasat domácích. Pro detekci RNA HEV byly použity vzorky séra, žluče, střevního obsahu a jater. U prasat domácích po odstavu byla RNA HEV detekována u 37,5 % (12/32) jedinců pocházejících ze sedmi různých chovů. Virová RNA byla nejčastěji prokázána ve vzorcích žluče (40 %), jater (16,1 %) a séra (3,2 %) [72]. Další studie byly zaměřeny na jatečná prasata domácí, u nichž byla zjištěna prevalence 8 % (3/40). HEV RNA byla detekována i v mase poražených prasat [73]. U divokých zvířat je i v ČR dominující výskyt HEV v populacích prasat divokých, a to jak volně žijících, tak i chovaných v oborách. Celkem byla zjištěna prevalence 18,42 % ve volnosti a 23,46 % v oborách. Dále byla RNA HEV prokázána u jelenovité zvěře (jelena lesního, srnce obecného a daňka obecného) a mufloní zvěře [50, 52]. Při zaměření se na detekci RNA HEV v různých typech masných výrobků z tržní sítě (klobásy, ochucené mleté maso, játrová zavářka a tatarský biftek) byl ve všech 89 vzorcích výsledek negativní [74], avšak v dalších 100 vyšetřovaných vzorcích mletého vepřového masa byl jeden vzorek pozitivní (nepublikovaná data).
ODOLNOST V PROSTŘEDÍ
HEV patří k neobaleným virům, u nichž je obecně známá vyšší odolnost k podmínkám vnějšího prostředí než u virů obalených. Jedná se o virus přenosný fekálně-orální cestou, proto lze předpokládat jeho schopnost dlouhodobě přetrvávat v infekčním stavu v prostředí mimo hostitelský organismus nebo kontaminované potravině a následně po pozření jeho rezistenci k inaktivaci žaludečními kyselinami [75]. Odolnost viru může zvyšovat i přítomnost organických látek (zejména tuků a bílkovin) v potravině, ale i v prostředí [76, 77].
V současné době existuje poměrně málo studií věnujících se teplotní odolnosti HEV v potravinách nebo v prostředí. Podstatnou překážkou studií, které mají za cíl stanovení doby infekčnosti HEV mimo organismus hostitele, je právě přímý průkaz infekčních virových částic. Průkaz RNA HEV použitím reverzně transkripční polymerázové řetězové reakce v reálném čase (RT-qPCR) ani kvantifikace virové nálože není v přímém vztahu k infekčnosti virových částic. HEV je velice obtížně kultivovatelný a v současné době neexistuje univerzální postup pro kultivaci tohoto viru, který by bylo možné využívat v rutinní laboratorní diagnostice. K úspěšné infekci buněčných kultur je třeba poměrně vysoká koncentrace viru, která se ve vzorcích potravin nebo prostředí běžně nevyskytuje [78]. Dalšími překážkami stěžujícími kultivaci je typ buněčné linie, který je citlivý k určitému genotypu HEV. Nevýhodou je i pomalý replikační cyklus viru společně s nepřítomností cytopatického efektu. Vedle kultivace lze k průkazu infekčního viru využít zvířecí modely (prasata domácí) k experimentálním infekcím. Po prodělané infekci dochází k vylučování viru a tvorbě protilátek [79]. Pokusy na zvířatech jsou finančně náročné a v rámci dodržování tzv. 3R priorit (Reduction, Refinement, Replacement) je cílem takové experimenty minimalizovat a pokusit se najít alternativní postupy.
Studie zaměřené na sledování vztahu teploty a času potřebných k inaktivaci viru a k objasnění jeho teplotní stability při skladování byly provedeny v suspenzi jater a výkalů [75, 80, 81]. Výsledky ukázaly, že HEV přežívá působení teploty 56 °C po dobu jedné hodiny a k jeho inaktivaci dochází až při teplotách nad 71 °C [75, 80]. V porovnání s HAV je HEV teplotně labilnější a pravděpodobně existuje variabilita v citlivosti k teplotě mezi jednotlivými genotypy i izoláty [80]. Při zkoumání vlivu nízkých teplot na HEV v suspenzi jater byla RNA HEV detekována po 70 dnech skladování při 4 °C. To nasvědčuje tomu, že HEV je schopný přežít relativně dlouhou dobu v prostředí [81].
Vzhledem k tomu, že jsou případy onemocnění HE spojovány s konzumací syrového nebo nedostatečně tepelně ošetřeného masa a masných produktů a replikace HEV probíhá zejména v hepatocytech, byly další studie zaměřeny na teplotní inaktivaci HEV přímo v játrech a výrobku z jater [75, 77]. Játra získaná z tržní sítě, která obsahovala infekční částice HEV [69], byla ošetřena běžnými kulinářskými postupy; byla vařena (100 °C) a smažena (191 °C) po dobu pěti minut při dosažení minimální vnitřní teploty 71 °C. Z takto tepelně upravených jater byla vytvořena suspenze, která byla následně intravenózně aplikována prasatům domácím. Prasata neprojevila žádné známky infekce, proto lze usuzovat, že v takto tepelně ošetřených vepřových játrech došlo k úspěšné inaktivaci infekčního HEV [75]. Je třeba zmínit, že v této studii byly použity 0,5–1 cm3 velké kostky vepřových jater, proto by čas potřebný k inaktivaci HEV ve větším objemu jater měl být úměrně delší [75].
Vepřová játra jsou součástí masných výrobků, v nichž další složky (zejména tuk) mohou mít vliv na stabilitu a tepelnou rezistenci HEV. Byla proto zkoumána termální inaktivace HEV během přípravy výrobku paté (paštika). Použitá vepřová játra jako hlavní surovina získaná z experimentálně infikovaných prasat obsahovala HEV genotyp 3. K teplenému opracování výrobku byly použity různé kombinace teploty a času využívané ve zpracovatelských závodech. Dostatečný vliv na inaktivaci HEV mělo pouze použití teploty 71 °C po dobu 20 minut, kdy došlo k poklesu titru HEV (genomového ekvivalentu) téměř o 3 řády a prasata domácí po intravenózní aplikaci suspenze nejevila známky infekce [77].
Výše popsané experimenty nebyly provedeny na dostatečném počtu zvířat. Intravenózní aplikace, která byla v rámci uvedených experimentů použita, není zcela vhodná, a to z důvodu omezení vlivu gastrointestinálního traktu na stabilitu HEV [79]. Také k vyvolání infekce intravenózní aplikací suspenze HEV je potřeba daleko menší množství virových částic v porovnání s perorálním podáním. Lze proto výsledky brát pouze orientačně, nicméně je nelze podceňovat.
Ve vyhlášce č. 326/2001 Sb., o potravinách a tabákových výrobcích a o změně a doplnění některých souvisejících zákonů, ve znění pozdějších předpisů, pro maso, masné výrobky, ryby, ostatní vodní živočichy a výrobky z nich, vejce a výrobky z nich, je tepelně opracovaným masným výrobkem výrobek (např. játrová paštika), u kterého bylo ve všech částech dosaženo minimálně tepelného účinku odpovídajícího působení teploty 70 °C po dobu 10 minut. Tato teplota nemusí být podle výše zmíněných studií dostačující k inaktivaci HEV. Podobně je tomu například i u přípravy mírně propečených steaků (tzv. rare) z vepřového masa, kde by vnitřní teplota masa neměla přesáhnout 56 °C, aby si maso zachovalo požadovanou šťavnatost, strukturu a chuť.
PROBLEMATIKA DIAGNOSTIKY VIROVÉ HEPATITIDY E
HE je klinicky neodlišitelná od jiných virových hepatitid a ve většině případů probíhá asymptomaticky. V minulosti byla HE díky nedostupnosti vhodných diagnostických metod snadno zaměnitelná za virovou hepatitidu typu A [19]. V závislosti na virové náloži (množství virových částic, které skutečně vyvolaly infekci) HEV a na imunitním stavu jedince může HE probíhat jako akutní hepatitida. V komplikovaných případech (např. nejčastěji při dalším onemocnění jater) může vyústit až v subakutní jaterní selhání [4]. Přechod HE do chronické formy byl zaznamenán u imunosuprimovaných pacientů, především u HIV pozitivních, dále u některých malignit – například u T-buněčného lymfomu, a pokud k akutní HE dojde v období po transplantaci. V těchto případech lze pozorovat progresi onemocnění přes chronickou HE až do jaterní cirhózy [82]. Inkubační doba HE se pohybuje od 2 do 8 týdnů. Virémie je prokazatelná několik dnů před vznikem symptomů a po nástupu prvních klinických příznaků onemocnění rychle odeznívá. Klinické příznaky mohou zahrnovat ikterus, horečku, zvracení, bolest břicha a chřipce podobné příznaky. Anikterické případy onemocnění nejsou výjimečné, a tak jsou často jediným příznakem zvýšené hodnoty jaterních enzymů (ALT, AST, GGT) a bilirubinu [83]. Vzhledem k tomu, že v rozvinutých zemích onemocní HE nejčastěji lidé ve střední a starší věkové kategorii (genotyp 3 HEV), může být etiologie HE opomenuta a za příčinu hepatitidy je považováno polékové nebo toxické postižení jater. Diagnóza HE by tedy měla být brána v úvahu u každého pacienta suspektního na akutní virovou hepatitidu, a to bez ohledu na jeho věk nebo cestovatelskou anamnézu [9, 84]. Přesto HE nebývá primárně zařazena do první linie diferenciálních diagnostických vyšetření při akutních hepatitidách [85].
Pro rutinní laboratorní diagnostiku HE je vhodné využít kombinace sérologických testů (detekce protilátek IgG a IgM proti HEV) společně s molekulárně biologickými metodami (detekce genomu resp. RNA HEV) v biologických vzorcích (stolice, krev, sérum, plazma, případně bioptát jater) [4]. Zcela zásadním krokem jakékoliv laboratorní diagnostiky je správný odběr vzorků a jejich uchování před samotným vyšetřením. U lokálně získaných HE, u nichž je podezření na alimentární infekci, je vzhledem k dlouhé inkubační době velice nesnadné dohledat zdroj takové infekce. Pokud se jedná o potravinu, ta v období vzniku onemocnění nebývá již dostupná, nebo jsou její zbytky zcela nevhodně skladovány. Vzorky pro vyšetření molekulárně biologickými metodami musí být uskladněny při teplotě -70 °C, pokud není vyšetření provedeno ve stejný den odběru. V případě vzorků klinického materiálu od pacientů je hlavním problémem správné načasování odběru. S objevením se klinických příznaků HE klesá koncentrace RNA HEV jak v krvi, tak i ve stolici. Ve stolici je možné RNA HEV detekovat ještě další dva až tři týdny, ale jsou popsány i extrémní případy, kdy byla RNA HEV detekovaná i 121. den od počátku onemocnění [86].
Molekulárně biologické metody jsou časově méně náročné a vedle detekce RNA HEV umožňují i stanovení virové nálože ve vzorku (RT-qPCR). Avšak jejich značnou nevýhodou je neschopnost rozlišit infekční a neinfekční virové částice, respektive zda získaná RNA pochází z virových částic schopných infekce. Neinfekční virové částice mají často porušen proteinový obal, a tak je molekula genomu vystavena vnějším podmínkám. Zároveň je nutno si uvědomit nižší stabilitu proteiny nechráněných molekul RNA, které tvoří genom viru. Lze proto ve vzorku předpokládat infekční virové částice na základě detekce RNA HEV metodou RT-qPCR. Do současné doby bylo zavedeno a publikováno velké množství systémů RT-qPCR pro průkaz HEV. Přesto vzhledem k vysoké variabilitě genomu tohoto viru je pouze několik systémů „univerzálních“, tzn. je schopno zachytit kmeny HEV patřící do čtyř výše zmiňovaných genotypů. Řešením tohoto možného problému je zavedení takového systému RT-qPCR, který umožní detekci dvou nezávislých oblastí genomu HEV, čímž je zvýšena pravděpodobnost záchytu různých izolátů HEV ve vyšetřovaných matricích [50]. Molekulárně biologické metody také umožní analýzu sekvencí genomu získaných izolátů HEV, na jejímž základě je možné rozdělení získaných izolátů HEV do příslušných genotypů a subtypů [23]. Porovnávání genomů získaných izolátů (jak od lidí, zvířat či z prostředí) je vhodné z epidemiologického hlediska a lze jím stanovit vztahy mezi případy onemocnění, možné zdroje infekce a cestu přenosu [42].
SÉROLOGICKÁ DIAGNOSTIKA
Sérologická diagnostika HE je založena na průkazu protilátek (anti-HEV) třídy IgM. U člověka mohou být prokazatelné několik dnů před prvními příznaky onemocnění. Tyto protilátky přetrvávají obvykle 3–6 měsíců, přičemž po 3 měsících nejsou prokazatelné přibližně u 50 % pacientů [87]. S odstupem několika dnů jsou prokazatelné i protilátky ve třídě IgG. Jejich nález může jednak sloužit k podpoře specificity průkazu protilátek ve třídě IgM, ale zejména k průkazu prodělané infekce a epidemiologicky k zjišťování prevalence infekce HEV v obecné populaci a v různých subpopulacích, např. dárců krve nebo plazmy, a v profesních nebo rizikových skupinách. Anti-HEV IgG protilátky u většiny pacientů přetrvávají alespoň jeden rok, ale často mohou být prokazatelné řadu let, někdy i déle než deset let po infekci [88].
Sérologické testy pro HE prošly poměrně dlouhým vývojem z hlediska volby vhodných virových antigenů, způsobu jejich přípravy jako syntetických nebo různě exprimovaných rekombinantních proteinů a použití proteinu ve formě dimeru. Komerční testy jsou konstruovány na bázi kapsidového proteinu (ORF2) a proteinu kódovaném ORF3 využívající antigeny odvozené z genotypu 1 a 2. Pouze jeden EIA (Enzyme immunoassay) test využívá i protein odvozený od genotypu 3 (Mikrogen, Německo). HEV má sice pouze jeden sérotyp, ale je otázkou, jak citlivé budou testy konstruované a ověřované primárně pro využití v oblastech vysoce endemických pro genotyp 1 a 2 v oblastech neendemických s dominantním výskytem genotypu 3 nebo 4.
Rozdíly v citlivosti i specificitě jednotlivých diagnostických testů EIA pro stanovení IgM byly popsány v řadě prací [89–92]. Podrobné porovnání osmi komerčních diagnostických testů pro stanovení anti-HEV IgM z hlediska analytické i diagnostické citlivosti a specificity provedli Pas et al., 2013. Rovněž vyhodnotili i přínos kombinované detekce anti-HEV IgM a IgG testy jednotlivých výrobců. Nejvyšší specificita (99%) z testů pro stanovení anti-HEV IgM byla zjištěna u testu Wantai (Čína). Rozdíly související s citlivostí a specificitou testů pro průkaz protilátek anti-HEV IgG mohou významně ovlivnit výsledky séroprevalenčních studií [93–95]. Potvrdilo se však, že použití antigenů odvozených z genotypů 1 a 2 přes rozdílnou citlivost i specifitu testů lze využívat i pro diagnostiku infekcí HEV vyvolaných genotypem 3. Byly vyvinuty imunoblotové konfirmační testy pro stanovení anti-HEV IgM i IgG protilátek (Mikrogen, Německo), využívající tři antigeny z oblasti kódované ORF2 a jeden antigen z ORF3 oblasti. Použití konfirmačního testu u vzorků reaktivních v EIA testech může přispět ke zvýšení specificity detekce anti-HEV protilátek [90], ale je publikován i názor, že při diagnostice kombinující použití shodně vysoce specifických testů a stanovení RNA HEV není konfirmace imunoblotovým testem potřebná [96]. Pro zlepšení diagnostiky časné fáze HEV infekce byl vyvinut test k průkazu HEV antigenu v séru nebo stolici. Stanovení HEV antigenu dobře koreluje s kvantitativním průkazem RNA HEV, ale oproti stanovení RNA HEV má nižší citlivost [97]. National Institute for Biological Standardization and Control poskytuje referenční preparát WHO pro kvantitativní stanovení anti-HEV IgG s koncentracemi definovanými v mezinárodních jednotkách IU/L [98].
TERAPIE
Podle stavu pacienta a podle zvyklosti pracoviště je léčba akutní infekce HEV symptomatická a podpůrná (podávání parenterální tekutiny, antiemetika, analgetika či hepatoprotektiva). U infekcí s těžkým průběhem, ať už při preexistujícím onemocnění jater nebo u imunodeficitu, byly v malých studiích zkoušeny léky s antivirovým působením. V současné době jsou k dispozici tři možnosti léčby:
- použití pegylovaného interferonu alfa (PEG-IFN-α),
- antivirotika ribavirinu,
- jejich kombinace.
Zřejmě pro četné vedlejší účinky léčby PEG-IFN-α většina autorů zkouší účinek ribavirinu v monoterapii, u kterého bylo doposud popsáno nejširší spektrum využití a vykazuje úspěšné potlačení virémie. Po 2–10 měsících léčby vedl k dosažení virové suprese u pacientů po různých typech orgánových transplantací, pacientů s leukémií či nakažených virem HIV. Dosud není jednoznačně stanoveno dávkování ani délka trvání léčby. V případě, že je konzervativní léčba u těžkých forem bez efektu, je třeba co nejdříve kontaktovat transplantační centrum. Chronická infekce HEV se vyskytuje většinou při těžké poruše imunity. Pokud se jedná o imunodeficit způsobený imunosupresivní terapii, k dosažení virové clearance postačovalo ve 20–50 % případů snížení úrovně imunosuprese. Doporučené postupy léčby HE nebyly ještě vytvořeny, proto stále zůstávají na experimentální úrovni [99].
ZÁVĚR
Výskyt HE se dnes již nevztahuje pouze na rozvojové země, ale má globální charakter. V endemických oblastech rozvojových zemí je hlavním problémem vysoké procento letality gravidních žen a velký počet nemocných při epidemiích [19]. Vývoj vakcíny a její použití v těchto oblastech je více než nezbytné. Rekombinantní vakcína proti HE je komerčně dostupná zatím pouze v Číně [100]. Ve vyspělých zemích narůstá počet lokálně získaných případů HE. Pouze zlomek těchto případů je objasněn s prokázaným zdrojem HEV. Problémem mohou být případy chronické HE u imunosuprimovaných pacientů.
Nových izolátů HEV, které byly detekovány u širokého spektra živočišných druhů, přibývá. S tím souvisí i potřeba využití návrhu nové klasifikace uvnitř čeledě Hepeviridae. Experimentální infekce primátů byly v některých směrech úspěšné. Tyto poznatky mohou mít vliv při hodnocení možnosti přenosu HEV na člověka a na šíření HEV v prostředí. Nicméně je třeba dalších studií, které se budou věnovat této problematice. Velice diskutovaným tématem je stabilita HEV v prostředí a hlavně v potravinách, a to z důvodu alimentárního přenosu HEV. Je třeba zmínit, že doložené případy alimentárních HE pocházejí z oblastí s určitými stravovacími návyky (Francie, Španělsko a Japonsko) a s produkcí tamních specialit. Lidé by se měli vyvarovat konzumace nedostatečně tepelně upravených potravin a to nejenom při zahraničních pobytech.
Genotyp 4 HEV byl donedávna izolován od zvířat a lidí jenom v asijských zemích. Pravděpodobně vlivem obchodu se zvířaty a potravinami dochází k rozšiřování tohoto genotypu i v Evropě.
Poděkování
Výsledky projektu LO1218 byly získány za finanční podpory MŠMT v rámci programu NPU I a grantu MZ NT13884-4/2012.
Do redakce došlo dne 5. 6. 2015.
Adresa pro korespondenci:
MVDr. Monika Kubánková
Výzkumný ústav veterinárního lékařství, v. v. i.
Hudcova 70
621 00 Brno
e-mail: kubankova@vri.cz
Sources
1. Arends JE, Ghisetti V, Irving W, et al. Hepatitis E: An emerging infection in high income countries. J Clin Virol, 2014;59(2):81–88.
2. Van der Poel WHM. Food and environmental routes of Hepatitis E virus transmission. Current Opinion in Virology, 2014;4 : 91–96.
3. Trmal J, Benes C, Trnkova M. Differences in the incidence of viral hepatitis A and E in the Czech Republic. Epidemiol Mikrobiol Imunol, 2013;62(1):19–25.
4. Chalupa P, Vasickova P, Pavlik I, et al. Endemic Hepatitis E in the Czech Republic. Clin Infect Dis, 2014;58(4):509–516.
5. SZÚ. Vybrané infekční nemoci v ČR v letech 2005–2014 – absolutně. Dostupný na www: http://www.szu.cz/publikace/data/vybrane-infekcni-nemoci-v-cr-v-letech-2003-2012-absolutne.
6. Miyashita K, Kang JH, Saga A, et al. Three cases of acute or fulminant hepatitis E caused by ingestion of pork meat and entrails in Hokkaido, Japan: Zoonotic food-borne transmission of hepatitis E virus and public health concerns. Hepatol Res, 2012;42(9):870–878.
7. Pazderkova J, Sajbertova J, Dlouhy P, et al. Rodinný výskyt hepatitidy typu E v důsledku primární alimentární infekce. Prakti Lék, 2009;89(5):265–267.
8. Trmal J, Pavlik I, Vasickova P, et al. Outbreaks of viral hepatitis E in the Czech Republic? Epidemiol Mikrobiol Imunol, 2012;61(1–2):15–20.
9. Scobie L, Dalton HR. Hepatitis E: source and route of infection, clinical manifestations and new developments. J Viral Hepat, 2013;20(1):1–11.
10. Johne R, Dremsek P, Reetz J, et al. Hepeviridae: An expanding family of vertebrate viruses. Infect, Genet Evol, 2014;27 : 212–229.
11. Meng XJ. Zoonotic and foodborne transmission of hepatitis E virus. Seminar Liver Dis, 2013;33(1):41–49.
12. Smith DB, Purdy MA, Simmonds P. Genetic variability and the classification of hepatitis E virus. J Virol, 2013;87(8):4161–4169.
13. Smith DB, Simmonds P, Jameel S, et al. Consensus proposals for classification of the family Hepeviridae. J Gen Virol, 2014;95(Pt 10):2223–2232.
14. Tam AW, Smith MM, Guerra ME, et al. Hepatitis E virus (HEV): Molecular cloning and sequencing of the full-length viral genome. Virology, 1991;185(1):120–131.
15. Takahashi K, Toyota J, Karino Y, et al. Estimation of the mutation rate of hepatitis E virus based on a set of closely related 7.5-year-apart isolates from Sapporo, Japan. Hepatol Res, 2004;29(4):212–215.
16. Guo H, Zhou E-M, Sun ZF, et al. Identification of B-cell epitopes in the capsid protein of avian hepatitis E virus (avian HEV) that are common to human and swine HEVs or unique to avian HEV. J Gen Virol, 2006;87(1):217–223.
17. Perez-Gracia MT, Suay B, Mateos-Lindemann ML. Hepatitis E: An emerging disease. Infec Genet and Evol, 2014;22 : 40–59.
18. Teo CG. Fatal outbreaks of jaundice in pregnancy and the epidemic history of hepatitis E. Epidemiol Infect, 2012;140(5):767–787.
19. Khuroo MS. Discovery of hepatitis E: The epidemic non-A, non-B hepatitis 30 years down the memory lane. Virus Res, 2011;161(1):3–14.
20. Balayan MS, Andjaparidze AG, Savinskaya SS, et al. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route. Intervirology, 1983;20(1):23–31.
21. Reyes G, Purdy M, Kim J, et al. Isolation of a cDNA from the virus responsible for enterically transmitted non-A, non-B hepatitis. Science, 1990;247(4948):1335–1339.
22. Control CfD and Prevention. Investigation of hepatitis E outbreak among refugees-Upper Nile, South Sudan, 2012-2013. MMWR. Morbidity and mortality weekly report, 2013;62(29):581.
23. Lu L, Li C, Hagedorn CH. Phylogenetic analysis of global hepatitis E virus sequences: genetic diversity, subtypes and zoonosis. Rev Med Virol, 2006;16(1):5–36.
24. Smith DB, Simmonds P, Jameel S, et al. Consensus proposals for classification of the family Hepeviridae. J Gen Virol, 2014.
25. Pischke S, Behrendt P, Bock C-T, et al. Hepatitis E in Germany – an under-reported infectious disease. Dtsch Arztebl International, 2014;111(35-36):577–583.
26. Aggarwal R, Naik S. Epidemiology of hepatitis E: current status. J Gastroenterol Hepatol, 2009;24(9):1484–1493.
27. Buti M, Clemente-Casares P, Jardi R, et al. Sporadic cases of acute autochthonous hepatitis E in Spain. J Hepatol, 2004;41(1):126–131.
28. Sehgal R, Patra S, David P, et al. Impaired monocyte-macrophage functions and defective tool-like receptor signalling in hepatitis E virus infected pregnant women with acute liver failure. Hepatology, 2015; 62(6):1683–1696.
29. Teshale EH, Grytdal SP, Howard C, et al. Evidence of person-to-person transmission of hepatitis E virus during a large outbreak in Northern Uganda. Clin Infect Dis, 2010;50(7):1006–1010.
30. Tesse S, Lioure B, Fornecker L, et al. Circulation of genotype 4 hepatitis E virus in Europe: first autochthonous hepatitis E infection in France. J Clin Virol, 2012;54(2):197–200.
31. Wichmann O, Schimanski S, Koch J, et al. Phylogenetic and case-control study on hepatitis E virus infection in Germany. J Infect Dis, 2008;198(12):1732–1741.
32. Garbuglia AR, Scognamiglio P, Petrosillo N, et al. Hepatitis E virus genotype 4 outbreak, Italy, 2011. Emer Infect Dis, 2013;19(1):110.
33. Midgley S, Vestergaard HT, Dalgaard C, et al. Hepatitis E virus genotype 4, Denmark, 2012. Emer Infect Dis, 2014;20(1):156–157.
34. Matsuda H, Okada K, Takahashi K, et al. Severe hepatitis E virus infection after ingestion of uncooked liver from a wild boar. J Infect Dis, 2003;188(6):944.
35. Tei S, Kitajima N, Takahashi K, et al. Zoonotic transmission of hepatitis E virus from deer to human beings. The Lancet, 2003;362(9381):371–373.
36. Yazaki Y, Mizuo H, Takahashi M, et al. Sporadic acute or fulminant hepatitis E in Hokkaido, Japan, may be food-borne, as suggested by the presence of hepatitis E virus in pig liver as food. J Gen Virol, 2003;84(9):2351–2357.
37. Colson P, Borentain P, Queyriaux B, et al. Pig liver sausage as a source of hepatitis E virus transmission to humans. J Infect Dis, 2010;202(6):825–834.
38. Pavio N, Meng XJ, Renou C. Zoonotic hepatitis E: animal reservoirs and emerging risks. Vet Res, 2010;41(6):46.
39. Meng X-J, Purcell RH, Halbur PG, et al. A novel virus in swine is closely related to the human hepatitis E virus. PNatlAcad Sci USA, 1997;94(18):9860–9865.
40. Meng XJ. Hepatitis E virus: animal reservoirs and zoonotic risk. Vet Microbiol, 2010;140(3-4):256–265.
41. van der Poel WHM, Verschoor F, van der Heide R, et al. Hepatitis E virus sequences in swine related to sequences in humans, the Netherlands. Emer Infect Dis, 2001;7(6):970–976.
42. Wenzel JJ, Preiss J, Schemmerer M, et al. Detection of hepatitis E virus (HEV) from porcine livers in Southeastern Germany and high sequence homology to human HEV isolates. J Clin Virol, 2011;52(1):50–54.
43. Meng XJ. From barnyard to food table: the omnipresence of hepatitis E virus and risk for zoonotic infection and food safety. Virus Res, 2011;161(1):23–30.
44. Arankalle VA, Chobe LP, Joshi MV, et al. Human and swine hepatitis E viruses from Western India belong to different genotypes. J Hepatol, 2002;36(3):417–425.
45. Saad MD, Hussein HA, Bashandy MM, et al. Hepatitis E virus infection in work horses in Egypt. Infect Genet Evol, 2007;7(3):368–373.
46. Caron M, Enouf V, Than S, et al. Identification of genotype 1 hepatitis E virus in samples from swine in Cambodia. J Clin Microbiol, 2006;44(9):3440–3442.
47. Forgach P, Nowotny N, Erdelyi K, et al. Detection of hepatitis E virus in samples of animal origin collected in Hungary. Vet Microbiol, 2010;143(2-4):106–116.
48. Reuter G, Fodor D, Forgách P, et al. Characterization and zoonotic potential of endemic hepatitis E virus (HEV) strains in humans and animals in Hungary. J Clin Virol, 2009;44(4):277–281.
49. Lin J, Norder H, Uhlhorn H, et al. Novel hepatitis E like virus found in Swedish moose. J Gen Virol, 2014;95 : 557–570.
50. Vasickova P, Kralik P, Slana I, et al. Optimisation of a triplex real time RT-PCR for detection of hepatitis E virus RNA and validation on biological samples. J Virol Methods, 2012;180(1-2):38–42.
51. Takahashi K, Kitajima N, Abe N, et al. Complete or near-complete nucleotide sequences of hepatitis E virus genome recovered from a wild boar, a deer, and four patients who ate the deer. Virology, 2004;330(2):501–505.
52. Kubankova M, Kralik P, Lamka J, et al. Prevalence of hepatitis E virus in populations of wild animals in comparison with animals bred in game enclosures. Food Environ Virol, 2015; 7(2):159–163.
53. Zhao C, Ma Z, Harrison TJ, et al. A novel genotype of hepatitis E virus prevalent among farmed rabbits in China. J Med Virol, 2009;81(8):1371–1379.
54. Cossaboom CM, Córdoba L, Cao D, et al. Complete genome sequence of hepatitis E virus from rabbits in the United States. J Virol, 2012;86(23):13124–13125.
55. Izopet J, Dubois M, Bertagnoli S, et al. Hepatitis E virus strains in rabbits and evidence of a closely related strain in humans, France. Emerging Infect Dis, 2012;18(8):1274–1281.
56. Liu P, Bu Q-N, Wang L, et al. Transmission of hepatitis E virus from rabbits to cynomolgus macaques. Emerg Infect Dis, 2013;19(4):559.
57. Raj VS, Smits SL, Pas SD, et al. Novel hepatitis E virus in ferrets, the Netherlands. Emerg Infect Dis, 2012;18(8):1369–1370.
58. Lack JB, Volk K, Van Den Bussche RA. Hepatitis E virus genotype 3 in wild rats, United States. Emerg Infect Dis, 2012;18(8):1268–1273.
59. Haqshenas G, Shivaprasad H, Woolcock P, et al. Genetic identification and characterization of a novel virus related to human hepatitis E virus from chickens with hepatitis–splenomegaly syndrome in the United States. J Gen Virol, 2001;82(10):2449–2462.
60. Marek A, Bilic I, Prokofieva I, et al. Phylogenetic analysis of avian hepatitis E virus samples from European and Australian chicken flocks supports the existence of a different genus within the Hepeviridae comprising at least three different genotypes. Vet Microbiol, 2010;145(1–2):54–61.
61. Payne CJ, Ellis TM, Plant SL, et al. Sequence data suggests big liver and spleen disease virus (BLSV) is genetically related to hepatitis E virus. Vet Microbiol, 1999;68(1–2):119–125.
62. Batts W, Yun S, Hedrick R, et al. A novel member of the family Hepeviridae from cutthroat trout (Oncorhynchus clarkii). Virus Res, 2011;158(1):116–123.
63. Drexler JF, Seelen A, Corman VM, et al. Bats worldwide carry hepatitis E virus-related viruses that form a putative novel genus within the family Hepeviridae. J Virol, 2012;86(17):9134–9147.
64. Li T-C, Chijiwa K, Sera N, et al. Hepatitis E virus transmission from wild boar meat. Emerging Infect Dis, 2005;11(12):1958–1960.
65. Renou C, Afonso A-MR, Pavio N. Foodborne transmission of hepatitis E virus from raw pork liver sausage, France. Emerg Infect Dis, 2014;20(11):1945–1947.
66. Leblanc D, Poitras E, Gagne MJ, et al. Hepatitis E virus load in swine organs and tissues at slaughterhouse determined by real-time RT-PCR. Int J Food Microbiol, 2010;139(3):206–209.
67. Banks M, Martelli F, Grierson S, et al. Hepatitis E virus in retail pig livers. Vet Rec, 2010;166(1):29.
68. Bouwknegt M, Lodder-Verschoor F, van der Poel WH, et al. Hepatitis E virus RNA in commercial porcine livers in The Netherlands. J Food Prot, 2007;70(12):2889–2895.
69. Feagins AR, Opriessnig T, Guenette DK, et al. Detection and characterization of infectious Hepatitis E virus from commercial pig livers sold in local grocery stores in the USA. J Gen Virol, 2007;88(Pt 3):912–917.
70. Berto A, Grierson S, Hakze-van der Honing R, et al. Hepatitis E virus in pork liver sausage, France. Emerg Infect Dis, 2013;19(2):264–266.
71. Riveiro-Barciela M, Minguez B, Girones R, et al. Phylogenetic demonstration of hepatitis E infection transmitted by pork meat ingestion. J Clin Gastroenterol, 2015; 49(2):165–168.
72. Vasickova P, Psikal I, Widen F, et al. Detection and genetic characterisation of Hepatitis E virus in Czech pig production herds. Res Vet Sci, 2009;87(1):143–148.
73. Di Bartolo I, Diez-Valcarce M, Vasickova P, et al. Hepatitis E virus in pork production chain in Czech Republic, Italy, and Spain, 2010. Emerg Infect Dis, 2012;18(8):1282–1289.
74. Lorencova A, Vasickova P, Makovcova J, et al. Presence of Mycobacterium avium subspecies and hepatitis E virus in raw meat products. Journal of Food Protection, 2014;77(2):335–338.
75. Feagins AR, Opriessnig T, Guenette DK, et al. Inactivation of infectious hepatitis E virus present in commercial pig livers sold in local grocery stores in the United States. Int J Food Microbiol, 2008;123(1-2):32–37.
76. Yunoki M, Yamamoto S, Tanaka H, et al. Extent of hepatitis E virus elimination is affected by stabilizers present in plasma products and pore size of nanofilters. Vox Sang, 2008;95(2):94–100.
77. Barnaud E, Rogee S, Garry P, et al. Thermal inactivation of infectious hepatitis E virus in experimentally contaminated food. Appl Environ Microbiol, 2012;78(15):5153–5159.
78. Okamoto H. Culture systems for hepatitis E virus. J Gastroenterol, 2013;48(2):147–158.
79. Bouwknegt M, Rutjes SA, Reusken C, et al. The course of hepatitis E virus infection in pigs after contact-infection and intravenous inoculation. BMC Vet Res, 2009;5.
80. Emerson SU, Arankalle VA, Purcell RH. Thermal stability of hepatitis E virus. J Infect Dis, 2005;192(5):930–933.
81. Schielke A, Filter M, Appel B, et al. Thermal stability of hepatitis E virus assessed by a molecular biological approach. Virol J, 2011;8 : 487.
82. Hoofnagle JH, Nelson KE, Purcell RH. Hepatitis E. New Engl J Med, 2012;367(13):1237–1244.
83. Mirazo S, Ramos N, Mainardi V, et al. Transmission, diagnosis, and management of hepatitis E: an update. Hepat Med, 2014;6 : 45.
84. Holub M, Korinkova M, Chalupa P. A case of acute hepatitis E acquired in the Czech Republic. Casopis lekaru ceskych, 2008;148(11):549–551.
85. Kruttgen A, Scheithauer S, Hausler M, et al. First report of an autochthonous hepatitis E virus genotype 3 infection in a 5 month old female child in Germany. J Clin Virol, 2011;50(2):175–176.
86. Takahashi M, Tanaka T, Azuma M, et al. Prolonged fecal shedding of hepatitis E virus (HEV) during sporadic acute hepatitis E: evaluation of infectivity of HEV in fecal specimens in a cell culture system. J Clin Microbiol, 2007;45(11):3671–3679.
87. Khudyakov Y, Kamili S. Serological diagnostics of hepatitis E virus infection. Virus Res, 2011;161(1):84–92.
88. Chadha M, Walimbe A, Arankalle V. Retrospective serological analysis of hepatitis E patients: a long-term follow-up study. J Viral Hepatitis, 1999;6(6):457–461.
89. Mast EE, Alter MJ, Holland PV, et al. Evaluation of assays for antibody to hepatitis E virus by a serum panel. Hepatology, 1998;27(3):857–861.
90. Herremans M, Bakker J, Duizer E, et al. Use of serological assays for diagnosis of hepatitis E virus genotype 1 and 3 infections in a setting of low endemicity. Clin Vac Immunol, 2007;14(5):562–568.
91. Zhou H, Jiang C, Li L, et al. Comparison of the reliability of two ELISA kits for detecting IgM antibody against hepatitis E virus. Zhonghua yu fang yi xue za zhi (Chinese journal of preventive medicine), 2008;42(9):667–671.
92. Drobeniuc J, Meng J, Reuter G, et al. Serologic assays specific to immunoglobulin M antibodies against hepatitis E virus: pangenotypic evaluation of performances. Clin Infect Dis, 2010;51(3):e24–e27.
93. Bendall R, Ellis V, Ijaz S, et al. A comparison of two commercially available anti-HEV IgG kits and a re-evaluation of anti-HEV IgG seroprevalence data in developed countries. J Med Virol, 2010;82(5):799–805.
94. Schnegg A, Bürgisser P, André C, et al. An analysis of the benefit of using HEV genotype 3 antigens in detecting anti-HEV IgG in a European population. PloS one, 2013;8(5):e62980.
95. Wenzel JJ, Preiss J, Schemmerer M, et al. Test performance characteristics of Anti-HEV IgG assays strongly influence hepatitis E seroprevalence estimates. J Infect Dis, 2013;207(3):497–500.
96. Pas SD, Streefkerk RH, Pronk M, et al. Diagnostic performance of selected commercial HEV IgM and IgG ELISAs for immunocompromised and immunocompetent patients. J Clin Virol, 2013;58(4):629–634.
97. Zhao C, Geng Y, Harrison T, et al. Evaluation of an antigen-capture EIA for the diagnosis of hepatitis E virus infection. J Viral Hepatitis, 2015; 22(11):957–963.
98. National Institute for Biological Standardization and Control. Dostupný na www: http://www.nibsc.org/.
99. Abbas Z, Afzal R. Hepatitis E: when to treat and how to treat. Antivir Ther, 2014;19(2):125–131.
100. Nelson KE, Shih JW, Zhang J, et al. Hepatitis E vaccine to prevent morbidity and mortality during epidemics. In Open Forum Infectious Diseases. 2014. Oxford University Press.
101. Teshale EH, Hu DJ, Holmberg SD. The two faces of hepatitis E virus. Clin Infect Dis, 2010;51(3):328–334.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2016 Issue 1-
All articles in this issue
- Prevalence Candida pelliculosa, Candida utilis a Candida fabianii ve Fakultní nemocnici Olomouc – epidemiologická studie
- Přínos avidity IgG protilátek u příušnic ve vysoce proočkované populaci v kontextu s ostatními sérologickými metodami laboratorní diagnostiky příušnic a současnou epidemiologickou situací
- Posuzování invalidity u infekčních onemocnění
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- Virus hepatitidy E
- Antibiotická léčba klostridiové kolitidy
- Prevalence infekčních komplikací u popálených pacientů vyžadujících intenzivní péči: data z panevropské studie
- Chřipka u dětské populace v Istanbulu – zkušenosti jednoho centra 2009–2014
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibiotická léčba klostridiové kolitidy
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- Virus hepatitidy E
- Posuzování invalidity u infekčních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

