-
Medical journals
- Career
Antibiotická léčba klostridiové kolitidy
: J. Beneš; S. Polívková
: Klinika infekčních nemocí 3. LF UK, Nemocnice Na Bulovce, Praha
: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 1, s. 15-24
: Review Article
Autoři porovnávají výhody a nevýhody jednotlivých antibiotik používaných v léčbě klostridiové kolitidy (CDI) z hlediska jejich farmakokinetických a farmakodynamických vlastností. Z toho pak vyvozují závěry o optimálním využití těchto antibiotik v klinické praxi. Metronidazol je vhodný pro léčbu lehkých forem nemoci, které jsou v zásadě samoúpravné. Vankomycin je spolehlivý při usmrcování klostridií, léčba je však zatížena značným rizikem rekurencí. Tomu je možné čelit zkrácením léčebné kúry na 7 dní a následným zařazením dalšího postupu, který brání rekurenci (pulse, taper, chaser) nebo přímo obnovuje střevní ekosystém (transplantace stolice). Fidaxomicin působí rychleji než vankomycin a je spojen s menším rizikem rekurencí, může být proto s výhodou využit při hrozícím rozvoji ileu a rovněž u nemocných, jejichž zdravotní stav nedovoluje dlouhou dobu léčby. Doba podávání fidaxomicinu by mohla být zkrácena až na 5 dní. Rifaximin nemá v terapii CDI jasné postavení, protože nejsou k dispozici přesvědčivá data o jeho účinnosti v této indikaci. Navíc existuje vysoké riziko vzniku a šíření rezistence. Tigecyklin se jeví jako perspektivní antibiotikum pro parenterální léčbu CDI; podle dostupných údajů by měl být účinnější než intravenózní metronidazol, který je doposud považován za lék volby.
Klostridiová kolitida bývá spojena se střevní dysmikrobií, která je hlavní příčinou rekurencí. Těžkou dysmikrobii nemůže vyřešit podání žádných antibiotik, ale pouze obnova střevní mikroflóry. Jediným osvědčeným řešením v současné době je transplantace stolice od zdravého dárce.Klíčová slova:
Clostridium difficile – klostridiová kolitida – metronidazol – vankomycin – fidaxomicin – rifaximin – tigecyklinÚVOD
Klostridiová kolitida (Clostridium difficile infection, dále CDI) je život ohrožující onemocnění s trvale narůstající incidencí. Hlavními predispozicemi pro vznik tohoto onemocnění jsou antibiotická léčba, choroby postihující střevní trakt, pobyt v nemocnici a věk nad 65 let [1].
Na jaře 2014 byl obhájen a publikován nový doporučený postup diagnostiky a léčby této nemoci [2]. Jeho text vycházel z aktualizovaného doporučovaného postupu [3], který v předchozím roce vytvořil tým odborníků sdružených v Evropské pracovní skupině zabývající se klostridiovou kolitidou (ESCMID Study Group for Clostridium difficile, ESGCD).
Ačkoli od vydání doporučeného postupu uplynul celý rok, ukazuje se, že mnozí lékaři v ČR stále neznají důvody, které k vytvoření nových doporučení vedly, neuvědomují si dostatečně výhody a nevýhody jednotlivých léčebných postupů a nedokáží správně rozlišovat indikace k používání jednotlivých přípravků. Náš článek by měl pomoci ve výběru optimální terapie pro konkrétní pacienty trpící klostridiovou kolitidou. Předkládáme čtenářům přehled současných literárních znalostí, ale také několik vysvětlujících hypotéz, které umožňují lépe pochopit souvislosti.
ANTIBIOTIKA U PRŮJMOVÝCH ONEMOCNĚNÍ
Antibiotická léčba průjmových onemocnění představuje specifickou situaci, která je odlišná od používání antibiotik v jiných indikacích. Většinu běžných bakteriálních infekcí lze charakterizovat jako stav, kdy mikrobi pronikli do tkání organismu, kde škodí. Jestliže se podaří je rychle vyhubit, obnoví se původní uspořádání, čili navrátí se pocit zdraví.
U průjmových onemocnění, zejména nejsou-li spojena s invazí do hlubších tkání, je nemoc vždy spjata se střevní dysmikrobií. K návratu do zdravého stavu je nutné potlačit růst patogenů, ale současně i obnovit mikrobiální ekosystém. Za těchto okolností může být antibiotická léčba vnímána jako dvojsečná, neboť sice usmrcuje patogenní bakterie, ale současně dále rozvrací ekosystém. To je důvod, proč například v léčbě salmonelóz váháme s podáním antibiotik, i když pacient má horečku a zánětlivé ukazatele jsou zvýšeny natolik, že by u jiného typu infekce představovaly jasnou indikaci pro takový terapeutický zásah. Toho si byli vědomi již staří klinici, kteří varovali, že podání antibiotik u salmonelózy paradoxně prodlouží vylučování salmonel [4]. Platí tedy, že je-li stav nemocného natolik závažný, že se rozhodneme antibiotika podat, měli bychom vždy volit přípravky s co nejužším spektrem, abychom postihli vyvolavatele nemoci selektivně a pokud možno nezasahovali do zbývajícího mikrobiomu.
KOMPLEXNÍ LÉČBA KLOSTRIDIOVÉ KOLITIDY
Léčbu CDI můžeme rozdělit do tří skupin opatření, z nichž každé má jiný cíl:
- a) zahubení přemnožených klostridií ve střevním traktu, případně zábrana jejich patogenního působení (inhibice toxinů);
- b) obnova fyziologické mikroflóry;
- c) symptomatická terapie zahrnující zejména rehydrataci a rehabilitaci nemocných.
Všechny tyto složky jsou pro uzdravení důležité.
Náš článek je přednostně věnován léčebným postupům spadajícím do první jmenované skupiny. Druhá skupina opatření, čili postupy směřující k obnově fyziologické mikroflóry, je zmíněna jen okrajově, aby bylo zřejmé, jaké je její místo v komplexní léčbě CDI a v čem se od první skupiny odlišuje. Symptomatická terapie CDI je shodná jako symptomatická terapie průjmových onemocnění jiné etiologie, a proto není potřeba ji na tomto místě rozvádět.
ANTIBIOTIKA POUŽÍVANÁ V TERAPII KLOSTRIDIOVÉ KOLITIDY
Z hlediska farmakokinetiky můžeme antibiotika používaná v léčbě CDI rozdělit do dvou skupin.
První skupinu tvoří přípravky, které se podávají orálně a nevstřebávají se z GIT. Mezi ně patří vankomycin, teikoplanin, fidaxomicin a rifaximin. Tento způsob léčby je založen na skutečnosti, že C. difficile nevyvolává invazivní infekce a tedy není zapotřebí dosahovat systémového antibakteriálního účinku. Přednosti takové léčby jsou zřejmé: Orálně podané nevstřebatelné antibiotikum se nedostane do krve a do tkání a tím je zajištěna jeho netoxičnost a minimální riziko nežádoucích účinků. Na druhé straně je nutné mít na zřeteli i limity této léčby: Přípravky z této skupiny se na místo svého působení, čili do oblasti tlustého střeva, dostávají výhradně peristaltikou. To znamená, že poruchy střevní peristaltiky, zejména rozvoj subileu nebo ileu, mohou způsobit selhání terapie.
Pozn.: Sníženou účinnost léčby mohou způsobit i stavy, které brání dobrému promísení střevního obsahu, a tak znemožní dobrý průnik antibiotika k bakteriím přisedlým na střevní epitel. Jde především o různé anatomické deformity (divertikuly, srůsty) nebo o lokální poruchy střevní inervace (např. v důsledku předchozí operace). Do jisté míry je možné takové omezení farmakokinetiky kompenzovat vyšším dávkováním. To bylo zatím doporučeno pouze u vankomycinu [2, 3]. U ostatních přípravků je situace zjevně obdobná, zatím však nebyly provedeny žádné studie, které by dokládaly, že stejný přístup má být uplatněn i u nich.
Do druhé skupiny řadíme antibiotika, která se do střevního lumen dostanou intestinální sekrecí (metronidazol, tigecyklin). Tento způsob léčby není závislý na peristaltice, a proto jej lze použít i při rozvoji ileu. Účinnost léčby je však závislá na intenzitě zánětu a velikosti exsudace. Jinými slovy, terapeutický přínos těchto přípravků bude omezený u nemocných s nízkými zánětlivými parametry, ale také v situaci, kdy se ve střevní stěně začnou tvořit nekrózy.
Z hlediska farmakodynamiky lze mezi antibiotiky užívanými proti C. difficile vyčlenit také dvě skupiny, které se navzájem liší svým mechanismem účinku.
První skupina zahrnuje baktericidní antibiotika, která poškozují buněčnou stěnu nebo buněčnou membránu klostridií (vankomycin, teikoplanin), nebo zasahují do jejich intermediárního metabolismu (metronidazol). Tato antibiotika spolehlivě usmrcují C. difficile při dosažení baktericidních koncentrací, je však užitečné vědět, že subinhibiční koncentrace těchto antibiotik mohou působit jako stresující podnět a naopak vyprovokovat bakterie ke zvýšené tvorbě toxinů [5].
Druhou skupinu tvoří antibiotika, která inhibují proteosyntézu bakterií (fidaxomicin, tigecyklin). Paradoxně tyto přípravky působí rychleji než antibiotika první skupiny. Důvodem je skutečnost, že patogenita klostridií je dána výhradně tvorbou exotoxinů, a tu je možné tímto způsobem nejrychleji a nejefektivněji zastavit.
POROVNÁNÍ JEDNOTLIVÝCH PŘÍPRAVKŮ
Metronidazol působí baktericidně na většinu striktně anaerobních bakterií, s výjimkou aktinomycet, propionibakterií a bifidobakterií. Podávaný lék se chová jako prodrug. Je aktivován v redukčním prostředí, které vzniká v bakteriích při anaerobním metabolismu, a pak se nespecificky váže na molekuly DNA i různých enzymů, a tak inhibuje jejich funkci [6]. Účinek metronidazolu na jednotlivé složky střevní mikroflóry ukazuje tabulka 1.
1. Nejvýznamnější kultivovatelní zástupci fyziologické mikroflóry tlustého střeva Table 1. The most important culturable representatives of the physiological flora of the large intestine 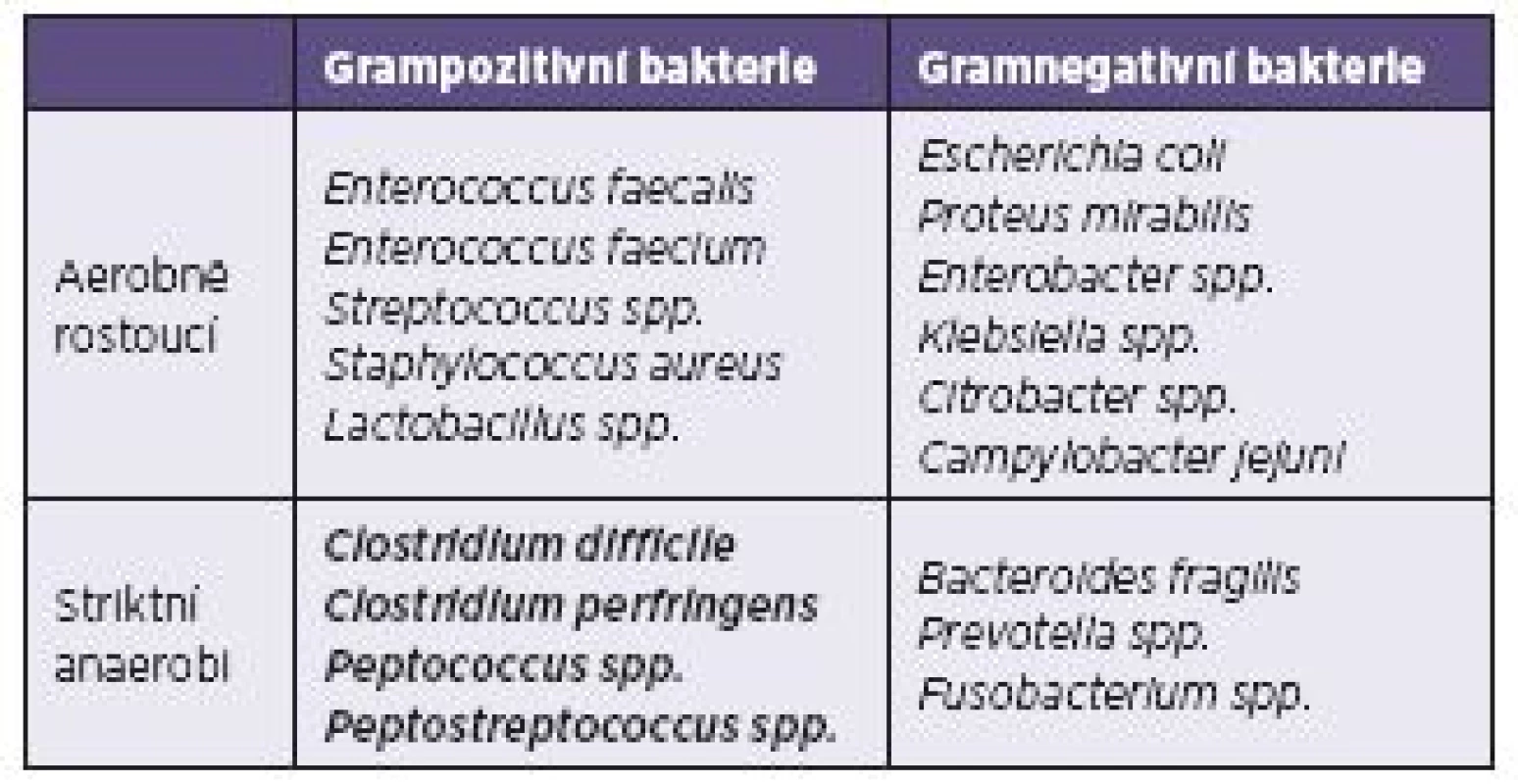
Metronidazol působí na všechny vyznačené anaerobní bakterie (obě dolní pole v tabulce), vankomycin na všechny grampozitivní bakterie s výjimkou laktobacilů (dvě pole tvořící prostřední sloupec), fidaxomicin na bakterie vyznačené tučným písmem (jediné pole v tabulce). Metronidazole is effective against all indicated anaerobic bacteria (both bottom fields of the table), vancomycin is effective against all gram-positive bacteria but lactobacilli (two fields making up the central column), fidaxomicin is effective against the bacteria shown in bold (a single field of the table). Při orálním podání se více než 90 % podané dávky vstřebává již v horních částech střevního traktu a přechází do krve. Orální podání má tedy prakticky stejný terapeutický účinek jako podání parenterální. Většina podaného metronidazolu se v játrech přetváří na méně účinné metabolity. Vylučování metabolizovaného i nemetabolizovaného antibiotika se děje převážně močí. Do stolice se za klidových podmínek dostane jen asi 14 % původně podaného množství, z čehož větší část připadá na metabolity [6]. Při infekčním průjmovém onemocnění se metronidazol navíc dostává do střeva v zánětlivém exsudátu. Přímé měření koncentrace metronidazolu ve stolici bylo provedeno jen v jediné studii uskutečněné v roce 1986: autoři zjistili při standardním dávkování v tekuté stolici 9,3 mg metronidazolu/l, v polotekuté stolici 3,3 mg/l a ve formované stolici 1,2 mg/l [7]. Tyto hodnoty jsou o dva řády nižší než koncentrace jiných antibiotik používaných v léčbě CDI – tabulka 2.
2. Antibiotika používaná v léčbě CDIa Table 2. Antibiotics used in the treatment of CDIa 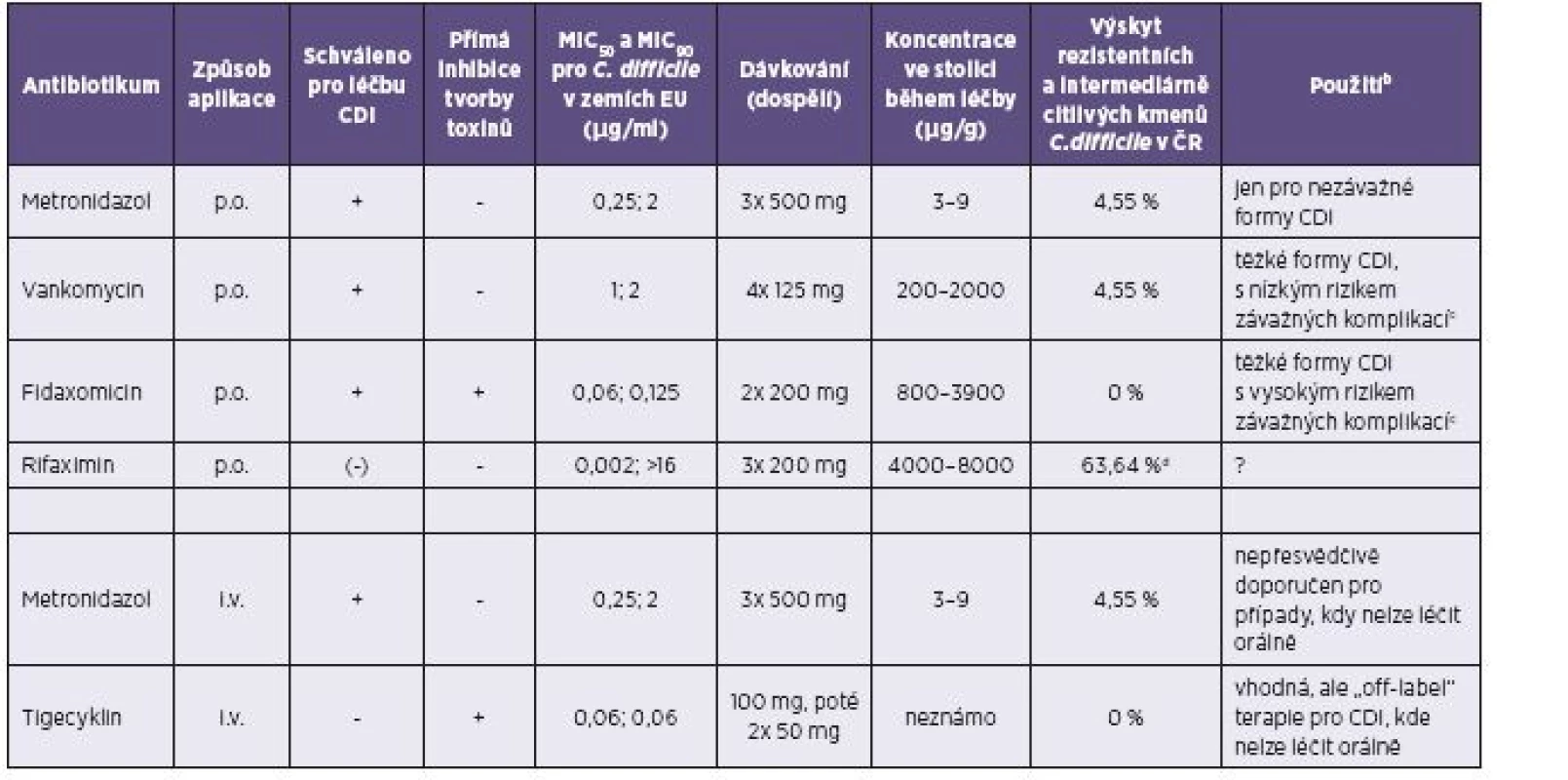
a pouze přípravky registrované v ČR; zdrojem údajů o citlivosti klostridií je [71] b argumenty jsou uvedeny v textu c hrozící rozvoj toxického megakolon nebo stav, kdy případná rekurence kolitidy by pacienta významně poškodila d měřeno pro rifampicin Komentář k tabulce: Za povšimnutí stojí velmi nízká koncentrace metronidazolu ve stolici ve srovnání s ostatními orálně podávanými antibiotiky; to vysvětluje nízkou účinnou metronidazolu. Koncentrace metronidazolu ve stolici sice převyšují hodnoty MIC, ale je potřeba vzít v úvahu fakt, že stolice nepředstavuje homogenní prostředí srovnatelné s vodným roztokem. Zdá se, že spolehlivé účinnosti v takovém prostředí dosáhne jen takové antibiotikum, jehož koncentrace převyšují hodnotu MIC stonásobně. a only products registered in the Czech Republic; data taken from [71] b arguments are given in the text c impending toxic megacolon or any condition where colitis recurrence is likely to cause significant damage to the patient d measured for rifampicin Footnote: It is worth noting that very low concentrations of metronidazole are present in the stool in comparison with other oral antibiotics; this fact explains the low efficacy of metronidazole. Stool concentrations of metronidazole are superior to the MIC values, but it should be taken into account that the stool is not a homogeneous environment comparable to an aqueous solution. In such an environment, only antibiotics present in concentrations that are 100 times as high as the MIC values appear to be reliably effective. Nepříznivá farmakokinetika metronidazolu vysvětluje jeho významně nižší účinnost, respektive menší spolehlivost oproti vankomycinu a fidaxomicinu – tabulka 3. Na základě uvedených výsledků byl metronidazol jednoznačně nedoporučen pro léčbu závažných případů CDI [2, 3]. Metronidazol rovněž není vhodný pro léčbu rekurentních forem CDI, mimo jiné kvůli riziku neurotoxicity, která byla pozorována při opakovaném nebo dlouhodobém podávání tohoto antibiotika [2, 8].
Hlavní předností metronidazolu je jeho nízká cena a všeobecná dostupnost. Indikací pro jeho podání proto nadále zůstávají lehké formy klostridiové kolitidy, které pacienta neohrožují; nelze přitom vyloučit, že v některých případech se účinnost této léčby blíží placebu, protože vylučování metronidazolu do střeva je při malé zánětlivé reakci nízké. Je možné si představit, že metronidazol působí spíše jako jakási pojistka pro případ nepříznivého průběhu nemoci: Mírná forma CDI je v zásadě samoúpravná, nevadí tedy, že metronidazol se v terapii téměř neuplatňuje. Jestliže infekce začne být agresivnější, zvětší se intenzita exsudace a tedy i účinek antibiotika. Když se stav opět začne upravovat, bude vylučování metronidazolu do střeva klesat zpět na původní hodnotu.
Vankomycin je glykopeptidové antibiotikum, které působí na většinu lékařsky významných grampozitivních bakterií. Přirozenou rezistencí se vyznačují pouze Erysipelothrix rhusopathiae a bakterie rodů Leuconostoc, Pediococcus a Lactobacillus [6].
Po orálním podání se vankomycin nevstřebává. V literatuře existuje několik kazuistik popisujících přestup vankomycinu z GIT do krve, jde však o zcela ojedinělé případy [9, 10]. Koncentrace vankomycinu ve stolici při dávkování 4krát 125 mg dosahuje 200–2 000 mg/l [9, 11]. Léčebný efekt režimu 4krát 125 mg p. o. byl u nemocných osob bez poruchy peristaltiky stejný jako při podání 4krát 500 mg p. o. [12]; nižší dávkování se tedy jeví jako plně dostačující, nejsou-li přítomny poruchy střevní motility zmíněné výše.
Vankomycin v léčbě CDI je účinný a spolehlivý, hlavním problémem však zůstává příliš široké spektrum působnosti, jehož důsledkem bývá těžká střevní dysmikrobie na konci léčebné kúry (viz tab. 1). Tato dysmikrobie je zpravidla významnější než po podání metronidazolu, což souvisí s podstatně vyššími dosaženými hladinami vankomycinu ve stolici (viz tab. 2).
Dysmikrobie se nemusí klinicky nijak projevovat, rozhodně ale zvyšuje vnímavost k rekurenci klostridiové kolitidy [8]. Bylo proto navrženo několik postupů, které by měly pomoci obnovit přirozenou mikroflóru a současně bránit přemnožení klostridií. Tyto postupy byly koncipovány tak, aby navazovaly na standardní vankomycinovou kúru v délce 10 dní.
- a) Pulzní doléčení (v anglosaské literatuře „pulse“) spočívá v podávání vankomycinu v dávce 125–500 mg/den p. o., vždy jednou za 2–3 dny, po dobu 3 týdnů nebo i déle.
- b) Postupné snižování denní dávky (v anglosaské literatuře „taper“) znamená pozvolnou redukci dávkování vankomycinu z původních 4krát 125 mg na 3krát 125 mg, 2krát 125 mg a posléze 1krát 125 mg. Každý z těchto režimů se podává 1–2 týdny.
- c) Doléčení jiným přípravkem (v anglosaské literatuře „chaser“), který má méně destruktivní dopad na střevní mikrobiom. Pro takové doléčení doporučují někteří autoři rifaximin [8, 13, 14], jiní Saccharomyces boulardii [15], a existuje i studie, v níž byl jako chaser použit fidaxomicin [16].
Všechny uvedené postupy znamenají prodloužení doby léčby, zvýšené náklady na léčbu a také problémy s dodržováním předepsaného režimu, zejména u nemocných, kteří již byli propuštěni do domácí péče. První dvě varianty, založené na postupném vysazování vankomycinu, jsou spojeny s vytvářením nízkých hladin tohoto antibiotika ve stolici. To podporuje adaptaci střevních bakterií, zejména šíření vankomycin-rezistentních enterokoků. Podle našich vlastních zkušeností se rezistentní enterokoky při soustavném používání orálního vankomycinu objeví v nemocničním prostředí během několika let.
Fidaxomicin je makrocyklické antibiotikum, svou strukturou a mechanismem účinku podobné makrolidům. Po orálním podání se nevstřebává z GIT a jeho spektrum působení je velmi úzké. Zahrnuje klostridia (MICC. perfringens 0,015 mg/l; MICC. difficile ≤ 0,125 mg/l), mikrokoky (MIC ≤ 0,125 mg/l), peptokoky (MIC ≤ 0,5 mg/l), peptostreptokoky (MIC ≤ 1 mg/l) a Bacillus cereus (MIC ≤ 1 mg/l) [17]. Popisek pod tabulkou 1 ukazuje, o co má fidaxomicin šetrnější vliv na střevní mikroflóru než metronidazol nebo vankomycin. Fidaxomicin se ve střevním traktu částečně metabolizuje, přičemž jeho metabolit je rovněž antibioticky účinný. Koncentrace fixadomicinu ve stolici dosahuje již během 24 hodin po podání hodnoty 639–2 710 mg/kg a koncentrace jeho metabolitu dalších 213–1 210 mg/kg [18].
Fixadomicin vychází ve studiích stejně účinný a bezpečný jako vankomycin, má však ve srovnání s ním několik výhod:
- a) působí rychleji, protože zablokuje v bakteriích tvorbu toxinů [19];
- b) působí déle, protože vykazuje post-antibiotický efekt (PAE) v délce 12 hodin – na rozdíl od vankomycinu nebo metronidazolu, kde PAE činí jen 0–3 hodiny [20];
- c) snižuje nakažlivost nemocných tím, že inhibuje u klostridií tvorbu spór [21]. Snížení tvorby spór pak spolu s méně destruktivním účinkem na střevní mikroflóru způsobuje prokazatelně nižší náchylnost k rekurencím u nemocných léčených fidaxomicinem – tabulka 3.
3. Porovnání klinické účinnosti tří nejčastěji používaných antibiotik, s využitím metaanalýz [72–75] Table 3. Meta-analysis-based comparison of the efficacy of three most commonly used antibiotics [72–75] ![Porovnání klinické účinnosti tří nejčastěji používaných antibiotik, s využitím metaanalýz [72–75]
Table 3. Meta-analysis-based comparison of the efficacy of three most commonly used antibiotics [72–75]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/87edb9a9768f45eae37dfe3283a9b2f8.jpg)
MET – metronidazol, VAN – vankomycin, FID – fidaxomicin; CDI – Clostridium difficile infection ≈ velmi podobné výsledky obou srovnávaných antibiotik; ≤ horší výsledky u prvního z obou antibiotik (statisticky ale neprůkazné); < statisticky významně horší výsledky u prvního z obou antibiotik Primární úspěšnost ukazuje bezprostřední efekt léčby, nezohledňuje pozdní komplikace (rekurence). Trvalá úspěšnost ukazuje, kolik nemocných zůstalo vyléčených i po skončení léčby (doba sledování činí obvykle 2 měsíce). MET – metronidazole, VAN – vancomycin, FID – fidaxomicin; CDI – Clostridium difficile infection ≈ highly similar outcomes of both antibiotics; ≤ poorer (but statistically non-significantly) outcomes of the first one of the two antibiotics; < statistically significantly poorer outcomes of the first one of the antibiotics Primary success reflects the immediate therapeutic effect regardless of later complications (recurrences). Long-term success reflects post-treatment recurrence free survival (at two-month follow-up). V této souvislosti je namístě citovat výsledky studie, která porovnávala efekt fidaxomicinu proti vankomycinu u nemocných, kteří kromě léčby CDI dostávali ještě celkově antibiotika kvůli jiné infekci. Při podávání fidaxomicinu byla zjištěna vyšší úspěšnost léčby (90% vs. 79%, p = 0,04) a nižší četnost rekurencí (17% vs. 29%, p = 0,048) [22]. Podobně vyšší úspěšnost léčby vykazoval fidaxomicin i v jiných podobných situacích, které disponují k těžšímu průběhu kolitidy (pacienti s maligními nádory, s renálním selháním, pokročilý věk) [23]. Fidaxomicin je tedy v současnosti nejúčinnějším antibiotikem v léčbě CDI.
Hlavní nevýhodou fidaxomicinu je jeho vysoká cena. Z tohoto důvodu zůstává základním lékem středně těžkých a těžkých případů klostridiové kolitidy vankomycin. Ve dvou situacích jsou však přednosti fidaxomicinu natolik zásadní, že opravňují k jeho použití jako léku první volby:
- První z nich je progredující forma CDI, kdy pacientovi ustává peristaltika a bezprostředně hrozí rozvoj toxického megakolon. Podání vankomycinu je v tomto případě nevhodné, protože jeho účinek nastupuje v průměru až třetí den léčby [24, 25]. Fidaxomicin působí rychleji a může tedy ještě nepříznivý vývoj zvrátit [26]. Pacient však musí dostat antibiotikum dříve, než se peristaltika úplně zastaví; po vzniku ileózního stavu ztrácí podání orálních léků smysl.
- Druhou přednostní indikací fidaxomicinu je stav, kdy nelze riskovat rekurenci klostridiové kolitidy. Typickým příkladem je pacient, který je těžce imunosuprimovaný, dekompenzovaný nebo vyčerpaný, eventuálně který onemocní klostridiovou kolitidou v době, kdy se připravuje k neodkladné operaci. Ve všech těchto případech je riziko rekurence CDI spojeno s neúnosným zhoršením prognózy.
Mnoho lékařů se domnívá, že fidaxomicin je vhodný zejména k terapii rekurentních forem CDI. Tento názor považujeme za zkreslený: Fidaxomicin sice oproti jiným přípravkům šetří střevní mikroflóru, tento účinek se však může projevit jen u pacientů, u nichž je střevní mikrobiom dosud zachován – čili při první nebo druhé atace CDI. U pacientů s vícečetnými atakami nemoci, kde je střevní mikroflóra již zcela rozvrácena, naopak už jen těžko můžeme od fidaxomicinu očekávat lepší výsledky léčby než od vankomycinu [27, 28]. V takovém případě je nutné použít léčebné postupy, které jsou zaměřeny na obnovu mikroflóry, v první řadě transplantace stolice. Výčet těchto postupů je obsažen v poslední části tohoto sdělení.
Pozn.: Někteří experti doporučují zakončit fidaxomicinovou léčbu postupným vysazováním antibiotika, podobně jako u vankomycinu [28]. Smysl tohoto opatření je však podle našeho mínění sporný. Riziko rekurencí je při podání fidaxomicinu významně nižší než po podání vankomycinu, čili přínos tohoto opatření bude nižší, a naopak citelně stoupá celková cena léčby.
Rifaximin je antibiotikum příbuzné rifampicinu, s velmi širokým spektrem účinku, které zahrnuje většinu grampozitivních a mnohé gramnegativní bakterie, a to aerobně i anaerobně rostoucí [6]. Po orálním podání se na rozdíl od rifampicinu nevstřebává z GIT, více než 96 % se vylučuje v nezměněné formě stolicí [29]. Koncentrace antibiotika ve stolici dosahují 4000–8000 mg/g [6].
Rifaximin je registrován pro léčbu akutních i chronických střevních infekcí a průjmů způsobených narušením rovnováhy střevní flóry (letní průjmy, cestovní průjmy, enterokolitidy), v textu SPC však není uvedena klostridiová kolitida jako indikace. Dostupná literatura neobsahuje solidní studie, které by prokazovaly účinnost tohoto antibiotika v léčbě CDI. Na malém souboru byla dokumentována non-inferiorita rifaximinu vůči vankomycinu [30], existuje též pilotní práce naznačující příznivou odpověď na rifaximin u nemocných, kde selhal metronidazol [31], tyto výsledky však nejsou dostatečně přesvědčivé.
Někteří autoři soudí, že rifaximin nenarušuje střevní mikrobiom tolik jako širokospektré peniciliny a cefalosporiny, linkosamidy nebo ciprofloxacin (hlavní vyvolavatelé post-antibiotické kolitidy) nebo jako vankomycin [8]. Tato myšlenka je zajímavá a podporuje ji skutečnost, že se rifaximin v několika studiích osvědčil v profylaxi (chaser) i léčbě relapsů po vankomycinové kúře [13–15]. Jedním z možných vysvětlení by paradoxně mohlo být jeho široké spektrum účinku. Rifaximin působí na všechny čtyři skupiny střevních bakterií vyznačené v tabulce 1, což může být menší zlo než jednostranná dysmikrobie. Touto hypotézou by bylo možné vysvětlit poměrně nízký podíl rekurencí po tigecyklinu (viz dále) a také fakt, že karbapenemy jako antibiotika s nejširším a přitom vyváženým spektrem účinku mají menší tendenci způsobit recidivující CDI než aminopeniciliny nebo cefalosporiny 2. a 3. generace.
Problémy komplikující využívání rifaximinu v léčbě CDI jsou dvojího rázu. Především stále chybějí studie, které by účinnost tohoto antibiotika spolehlivě doložily. Druhým a významnějším problémem jsou obavy z rezistence. Rifaximin je chemickou strukturou, mechanismem působení i spektrem účinku podobný rifampicinu a je známo, že rezistence na rifampicin vznikají snadno a rychle. Rifampicin se proto podává jen ve vybraných jasně definovaných situacích a pokud možno v kombinaci s jinými antibiotiky. Podle analgie s rifampicinem je tedy možné očekávat, že soustavné podávání rifaximinu v nemocničním prostředí povede k brzkému rozšíření rezistence na toto antibiotikum jak mezi kmeny C. difficile, tak i mezi dalšími střevními bakteriemi [14, 32, 33]. V České republice dosahuje rezistence C. difficile k rifampicinu hodnoty téměř 64 % (viz tab. 2) [71]. Rifaximin proto v našich podmínkách považujeme za nevhodný pro empirickou terapii CDI.
Tigecyklin je širokospektré parenterální antibiotikum tetracyklinové řady, vysoce účinné vůči C. difficile (viz tab. 2). Podává se výhradně parenterálně a do střevního lumen se dostává biliární exkrecí, takže do střeva přichází v nemetabolizované (aktivní) formě téměř 60 % z celkového množství podaného antibiotika [6, 34]. Při klostridiové kolitidě lze ještě navíc očekávat přídatné zvýšení koncentrace tigecyklinu ve střevním obsahu v důsledku zánětlivé exkrece (mechanismus popsaný u metronidazolu).
Tigecyklin má ve srovnání s intravenózním metronidazolem několik předností: Především jeho mechanismus účinku spočívá v inhibici proteosyntézy bakterií, čili po jeho podání rychleji ustává tvorba toxinů. Zásahem do proteosyntézy znemožňuje tigecyklin klostridiím i sporulaci, čímž snižuje infekciozitu nemoci [35]. Koncentrace tigecyklinu ve stolici nemocných nebyly přímo zjišťovány v žádné studii, ale z rozboru farmakokinetických dat je zřejmé, že tigecyklin dosahuje ve střevním obsahu podstatně vyšších koncentrací než metronidazol [14]. Praktická účinnost tigecyklinu byla ověřena na myším modelu [36] a dále v několika menších klinických studiích a kazuistikách [37, 38].
Nevýhodou tigecyklinu je skutečnost, že zatím není registrován pro léčbu CDI, jeho podání v této indikaci je tedy off-label. Studie porovnávající účinek tigecyklinu v léčbě CDI s jinými antibiotiky nebyly dosud provedeny, nejsou tedy k dispozici údaje o tom, jestli se tigecyklin vyrovná účinnosti vankomycinu nebo fidaxomicinu. Nedostatek dat spolu s poměrně vysokou cenou nedovolují zařadit tigecyklin mezi běžné léky CDI. Nicméně u nemocných, kde nelze použít orální terapii, se tigecyklin jeví jako perspektivní a pravděpodobně nejúčinnější přípravek.
DALŠÍ ANTIBIOTIKA POUŽITELNÁ V LÉČBĚ CDI
V literatuře se kromě výše zmíněných přípravků píše ještě o několika dalších antibiotikách, u nichž byla prokázána větší či menší účinnost v terapii klostridiové kolitidy. Údaje o těchto antibiotikách jsou však zatím neúplné a žádné z těchto antibiotik také nemá určenu pozici v terapeutických algoritmech. Ze čtyř níže popsaných přípravků je v současnosti v ČR registrován a používán pouze teikoplanin. Nitazoxanid je registrován a používán v USA a řadě dalších států. Zbývající dvě antibiotika, surotomycin a cadazolid, se nacházejí ve fázi III klinických zkoušek.
Teikoplanin je glykopeptidové antibiotikum příbuzné vankomycinu. Jeho spektrum účinku je prakticky identické. Teikoplanin se stejně jako vankomycin při orálním podávání nevstřebává z GIT, jeho koncentrace ve stolici však nebyly měřeny. Doporučené dávkování pro léčbu CDI činí 2krát 100 mg [14], v SPC je pro tuto indikaci uvedeno rozpětí 2krát 100–200 mg. Domníváme se, že vyšší dávkování (2krát 200 mg) je analogií vyššího dávkování vankomycinu (4krát 500 mg), které přichází v úvahu při poruchách peristaltiky. V literatuře jsou jen dvě studie porovnávající účinek vankomycinu proti teikoplaninu při léčbě CDI [39, 40]. V obou vychází teikoplanin jako srovnatelně účinný, ale s nižším rizikem rekurencí. Žádná z těchto studií však nebyla hodnocena jako spolehlivá vzhledem k malému počtu pacientů v porovnávaných skupinách, absenci zaslepení a vysokému riziku zkreslení výsledků (bias) [30]. Lze uzavřít, že teikoplanin je ve srovnání s vankomycinem dražší a obtížněji dostupný, přitom jeho přínos oproti vankomycinu nebyl zatím přesvědčivě prokázán. Teikoplanin proto není lékem volby CDI v evropských ani amerických doporučených postupech.
Nitazoxanid je thiazolidové antibiotikum, chemickou strukturou příbuzné metronidazolu. Podobně jako metronidazol jde o prodrug, které se nejprve metabolizuje na aktivní formu (tizoxanid) a poté v mikrobních buňkách zablokuje anaerobní metabolismus. Jeho spektrum účinku zahrnuje anaerobně žijící bakterie a prvoky. V USA je registrován pro léčbu kryptosporidiózy a giardiózy. Hodnota MIC90 pro C. difficile činí 0,125 mg/l, rozpětí MIC je 0,03–5 mg/l [8]. Nitazoxanid se vstřebává z GIT v závislosti na příjmu potravy, po metabolizaci se vylučuje ze dvou třetin stolicí a z jedné třetiny močí [6]. Doporučené dávkování pro léčbu CDI je 500 mg 2krát denně. Ve dvou prospektivních studiích vyšla účinnost nitazoxanidu při léčbě CDI srovnatelná s metronidazolem a s vankomycinem [6, 8].
Surotomycin (CB-183,315) je nově vyvíjené úzkospektré lipopeptidové antibiotikum, které působí baktericidně, podobně jako daptomycin, tj. destrukcí buněčné membrány bakterií. Po orálním podání se jen nepatrně absorbuje z GIT. Hodnoty MIC pro různé kmeny C. difficile byly naměřeny v rozsahu 0,5–2 mg/l [41, 42]. Surotomycin se profiluje jako možná náhrada vankomycinu. Oproti vankomycinu by měl mít několik předností:
- a) rychlejší nástup účinku, neboť lipopeptidy působí rychle baktericidně, na rozdíl od glykopeptidů);
- b) menší sklon k rekurencím, neboť jeho spektrum je užší, a tedy i změny střevního mikrobiomu nebudou tak rozsáhlé jako u vankomycinu;
- c) větší komfort léčby, neboť se užívá jen dvakrát denně, konkrétně 125–250 mg po 12 hodinách [41, 43].
Cadazolid je nově vyvíjené antibiotikum ze skupiny oxazolidinonů, čili podobné linezolidu. Mechanismus účinku spočívá v inhibici proteosyntézy, u C. difficile tedy zabraňuje tvorbě toxinů i tvorbě spór [44]. Hodnoty MIC pro C. difficile se pohybují v rozsahu 0,12–0,5 mg/l. Cadazolid se užívá orálně v dávce 250 mg po 12 hodinách. Jeho absorbce z GIT je zanedbatelná. V pilotní studii vyšel cadazolid srovnatelně účinný s vankomycinem [45].
KOMBINACE ANTIBIOTIK V LÉČBĚ CDI
Podání kombinace antibiotik při léčbě CDI je ve většině případů zbytečné, protože účinnost vankomycinu nebo fidaxomicinu je i u těžkých forem nemoci považována za dostatečnou [8]. Tento názor však platí poměrně krátkou dobu: Ještě v roce 2010 byla pro léčbu těžkých a komplikovaných případů CDI doporučována kombinace vankomycinu s i. v. metronidazolem. Tato kombinace byla zakomponována do tehdy platných evropských a amerických guidelines a následně převzata do českých Doporučených postupů z roku 2012 [46]. Brzy se nicméně ukázalo, že samotný vankomycin je při zachované peristaltice dostatečně účinný a není nutné jeho účinek posilovat. Kombinace tedy nezvýší účinnost léčby, ale zato zvyšuje pravděpodobnost rekurencí, protože destrukce postihne tři čtvrtiny bakteriálního ekosystému ve střevě (viz tab. 1).
Nové evropské i české doporučené postupy [2, 3] proto kombinaci orálního vankomycinu s i. v. metronidazolem nepodporují. Jedinou výjimkou je situace, kdy peristaltika selhává a orální antibiotika tedy přestávají být účinná. Přidání intravenózně podávaného antibiotika, jehož účinek není na peristaltice závislý, je v tomto případě namístě. V této kritické době, kdy se pacient nachází v bezprostředním ohrožení života, je cílem léčby dopravit do střeva účinná antibiotika jakýmkoli způsobem; možnost poškození zbývajícího mikrobiomu a s tím spojená obava z rekurencí CDI v budoucnu je zde irelevantní.
Nabízí se však otázka, zda právě kombinace orálního vankomycinu s i. v. metronidazolem bude pro danou situaci nejvhodnější. Text platných guidelines [2, 3] je vymezen požadavkem, aby byly důsledně dodrženy principy medicíny založené na důkazech (EBM, evidence-based medicine). Bohužel, je krajně obtížné zorganizovat prospektivní multicentrickou studii, která by mohla spolehlivě určit správnou léčbu u tak vzácné a současně tak dramaticky probíhající nemoci, jakou je CDI s rozvíjejícím se ileem. K dispozici jsou pouze data z retrospektivní studie z roku 2001, kde byl pro léčbu kolitidy použit i. v. metronidazol, eventuálně v kombinaci s vankomycinem [47]. To je důvodem, proč pouze tato kombinace je nyní v dané situaci doporučena.
V dnešní době by bylo logicky nejvhodnější doporučit místo vankomycinu rychleji působící fidaxomicin a místo i. v. metronidazolu podat tigecyklin. Argumenty pro tuto záměnu jsou uvedeny výše, vyplývají z popisu jednotlivých přípravků a z údajů obsažených v tabulce 2. Fidaxomicin lze místo vankomycinu použít i k výplachům střeva [48]. Nicméně, ačkoli se kombinace fidaxomicinu s tigecyklinem jeví jako nejúčinnější pro zvládnutí kritického stavu, není a zřejmě ještě dlouho nebude k dispozici dostatek objektivních důkazů pro toto tvrzení. Princip EBM, původně vyvinutý k ochraně nemocných, se v podobných situacích dostává do slepé uličky a ve svých důsledcích působí kontraproduktivně.
DOBA ANTIBIOTICKÉ LÉČBY CDI
Původní doba doporučené antibiotické léčby CDI činila 10–14 dnů; 14denní doba byla zvolena s ohledem na pomalou klinickou odpověď na metronidazol [49]. Nicméně jednotlivá antibiotika používaná v terapii CDI se značně liší rychlostí svého účinku: Při léčbě vankomycinem vymizely příznaky nemoci v průměru za 3 dny, zatímco při podávání metronidazolu ustoupily až za 4,6 dne [50]. Jiní autoři pozorovali ústup nemoci při léčbě vankomycinem do 5 dnů, zatímco při podávání metronidazolu neustaly průjmy u části pacientů ani za 10 dnů [51]. Naproti tomu léčebný efekt fidaxomicinu nastává již během 24–48 hod [26] a naše vlastní zkušenosti to potvrzují.
Z toho vyplývají dva závěry: Především, účinek podávané léčby je nutné posuzovat podle toho, jaké antibiotikum bylo zvoleno. Jestliže fidaxomicin nezabere do 48 hodin, je možno hovořit o selhání terapie a hledat jinou etiologii obtíží. Naopak jestliže při podávání metronidazolu trvají průjmy ještě čtvrtý den léčby (a stav pacienta se nehorší), není třeba se znepokojovat.
Zadruhé vyvstává otázka, jak dlouho by antibiotická léčba měla trvat. Vycházíme z přesvědčení, že každá antibiotická léčba by obecně měla být co nejkratší, a to kvůli zkrácení doby selekčního tlaku, zlepšení compliance, snížení rizika nežádoucích účinků a samozřejmě i kvůli minimalizaci nákladů. U průjmových onemocnění k tomu přistupuje požadavek nerozvracet zbytečně střevní mikrobiom; i to podporuje tlak na omezení doby antibiotické léčby na nejmenší únosnou míru.
Domníváme se, že léčba metronidazolem by měla trvat 10 dní, jestliže je klinicky úspěšná, tj. jestliže se efekt dostaví do 5. dne. Pokud průjmy do 5 dnů neustoupí, doporučujeme přejít na jiné antibiotikum. U vankomycinu, který je v eliminaci klostridií ze střevního traktu podstatně účinnější, by klinické zlepšení mělo být patrné již během 3 dnů a poté by měla stačit 7denní léčebná kúra. Uvážíme-li údaje uvedené v tabulce 2, neměla by být ve střevě po takové terapii již žádná živá klostridia. Tuto léčbu lze poté doplnit některým z postupů, které brání časné rekurenci. K dispozici je řada opatření, od aplikace nižších dávek antibiotika (pulse, taper) po dobu 1–2 týdnů, přes podání protilátek proti klostridiovým toxinům (viz níže) až k transplantaci stolice. U fidaxomicinu by analogicky při dobré klinické odpovědi měla být plně postačující 5denní kúra, čili polovina současně doporučované doby. Profylaxe časné rekurence po této léčbě by poté byla oprávněná jen v případech, kdy pacient zůstává v prostředí plném klostridiových spór.
V zájmu objektivity musíme dodat, že všechna uvedená doporučení jsou sice logická, ale zůstávají na úrovni hypotéz, dokud nebudou ověřeny praxí.
MOŽNOSTI INHIBICE KLOSTRIDIOVÝCH TOXINŮ
Tento způsob léčby vyplývá z faktu, že patogenita C. difficile závisí výhradně na tvorbě toxinů. Mikrob nemá jiné faktory patogenity. Netoxigenní kmeny C. difficile jsou nepatogenní [52]. Léčba zaměřená k inhibici toxinů může tedy v některých případech nahradit antibiotickou terapii.
Pro dosažení inhibice toxinů byly vyvinuty různé postupy, které se navzájem velice liší způsobem aplikace (jednorázově vs. opakovaně), rychlostí účinku (okamžitě při podání protilátek vs. za několik týdnů při aktivní imunizaci), vlivem na střevní mikroflóru (monoklonální protilátky působí selektivně proti toxinům, ostatní postupy mohou mikroflóru ovlivnit) a ovšem i svou účinností.
- a) Léky vážící toxiny ve střevním lumen: Patří sem syntetické polymery na bázi pryskyřice, které jsou primárně používány k léčbě dyslipidémií, protože na sebe vážou cholesterol a žlučové kyseliny (cholestyramin, kolestipol), a dále polymery vyvinuté speciálně pro vazbu klostridiových toxinů (tolevamer). Bohužel, účinnost těchto látek v léčbě CDI se ukázala jako nedostatečná [8, 53], proto nebyly zařazeny do Doporučených postupů.
- b) Protilátky proti toxinům A a B: Přípravky tohoto druhu byly použity jak v léčbě akutní CDI, tak i v profylaxi rekurencí. Intravenózně podaný roztok imunoglobulinů (IVIG) v dávce 150–400 mg/kg hmotnosti zlepšil průběh CDI ve dvou malých retrospektivních studiích (14 a 5 pacientů) a několika kazuistikách, dosud však nebyl publikován důkaz o účinnosti této léčby v dostatečně velké prospektivní kontrolované studii [8, 54]. Větší naděje vzbuzuje podávání monoklonálních protilátek. Zatím byla publikována jen jedna randomizovaná, dvojitě zaslepená studie, která prokázala velmi významné snížení četnosti rekurencí CDI po podání lidských monoklonálních protilátek proti toxinům A a B (7% vs. 25%; p < 0,001) [55]. V současné době běží navazující rozsáhlá studie, která sleduje výskyt rekurencí po podání lidských monoklonálních protilátek proti toxinu B (jedno rameno) a proti toxinům A a B (druhé rameno) [8].
Jinou cestou se vydali finští výzkumníci, kteří imunizovali krávy vakcínou vyrobenou z C. difficile a pacientům s CDI podávali 3krát denně orálně výtažek z kolostra; tato léčba byla stejně účinná jako terapie metronidazolem [56]. - c) Vakcíny proti toxinům A a B: Tyto vakcíny jsou vyvíjeny dvěma firmami, nacházejí se ve fázi III a ve fázi II klinických zkoušek [8].
- d) Přípravky obsahující Saccharomyces boulardii: S. boulardii tvoří proteázu, která štěpí toxin A a navíc i receptory, na které se tento toxin váže. Tím se podstatně snižuje patogenní potenciál klostridií [57]. S. boulardii je jediným probiotikem, u něhož byla prokázána účinnost v léčbě CDI, i když terapeutický efekt nedosahoval účinnosti antibiotik [2, 54]. Bohužel podávání S. boulardii je u imunosuprimovaných osob spojeno s rizikem, že tato kvasinka sama vyvolá infekci, která může nabýt charakteru sepse [58].
OBNOVA FYZIOLOGICKÉ STŘEVNÍ MIKROFLÓRY
Tato složka léčby je u klostridiové kolitidy významnější než u jiných střevních infekcí. Je tomu tak ze dvou důvodů, které spolu souvisejí. Prvním důvodem je skutečnost, že C. difficile je podmíněným patogenem. Patří mezi bakterie běžně kolonizující střevní trakt a jeho patogenita se uplatní teprve poté, co jiné střevní bakterie byly vyhubeny. Zdravý člověk je tedy vůči nemoci odolný, zatímco u jedinců s dysmikrobií stačí k vyvolání choroby jen malé množství spór [59]. Druhým důvodem je dlouhodobé zamoření okolí nemocného člověka spórami. Tyto spóry se po zvládnutí akutní ataky stávají příčinou rekurencí.
Obnova fyziologické mikroflóry není striktně vzato metodou léčby CDI, protože nemá přímý vliv na průběh klostridiové infekce. Je to opatření k léčbě následků CDI a současně zajišťuje profylaxi rekurencí. Považujeme proto za nevhodné porovnávat například úspěšnost fekální bakterioterapie s léčbou vankomycinem – každý z těchto léčebných postupů má jiný účel a uplatňuje se v jiné fázi nemoci. Nejprve se podává antibiotikum, které zahubí klostridia, a následně se použije metoda obnovující mikroflóru. Obě metody se tedy doplňují, nemá smysl je stavět proti sobě.
Obnovu fyziologické mikroflóry je možné uskutečňovat několikerým způsobem:
- Fekální bakterioterapie („transplantace stolice“): Tato metoda spočívá v přenosu živé střevní mikroflóry od zdravého dárce. Výhodou je přenos velkého množství mikroorganismů (cca 100 g čerstvé stolice, která obsahuje asi 1012 bakterií). To je řádově více, než kolik je obsaženo v běžně používaných probiotických kúrách. Druhou výhodou je přenos střevního mikrobiomu v celé jeho komplexitě. Odhaduje se, že ve střevním traktu zdravého člověka žije několik tisíc druhů bakterií a archeí a jsou zde dále přítomny i viry, houby a protozoa; všechny tyto mikroorganismy tvoří ekosystém provázaný spoustou zpětných vazeb a navíc ještě korigovaný slizničními protilátkami. Dárcovská stolice se pacientovi aplikuje jednorázově, nazojejunální sondou nebo rektální cestou, buď vysokým klysmatem, nebo s pomocí endoskopu zavedeného až do céka. Úspěšnost této terapie u rekurentních forem CDI činí v průměru 90 % případů [52, 60].
Kromě transplantace dárcovské stolice existují snahy o vývoj umělé stolice s definovaným složením mikroorganismů; klinická studie s přípravkem RBX2660 již probíhá v USA a Kanadě [61]. - Probiotika a prebiotika: Těchto přípravků bylo vyvinuto mnoho, mnohé z nich nemají statut léku a jsou prodávány jako potravní doplňky. Studií zaměřených na využití těchto přípravků v léčbě a profylaxi CDI bylo provedeno jen několik. Kromě Saccharomyces boulardii zmíněného výše (4 studie) byl zkoumán léčebný přínos laktobacilů (3 studie) a přínos z podání netoxigenního kmene C. difficile (1 studie). Všechny studie byly provedeny na malém počtu nemocných (≤ 50 osob) a úspěšnost léčby se pohybovala v rozpětí 35–67 % [54]. Probiotika se tedy nezdají být přínosná v terapii CDI. Tento názor zastávají i autoři evropských doporučených postupů [3].
Jiná situace je u profylaxe CDI, případně u profylaxe rekurence CDI, kdy probiotika zřejmě určitý příznivý efekt vykazují [62–64]. Pro jejich použití v této indikaci svědčí i minimální výskyt nežádoucích účinků [65, 66]. Z praktického hlediska jen vyvstává otázka, zda je podání probiotik přínosnější než například doplnění běžné stravy o živý jogurt, který se v prevenci postantibiotické kolitidy rovněž osvědčil [67].
Je pozoruhodné, že probiotika se v jednotlivých případech CDI jeví jako užitečná, ale poté v kontrolovaných studiích není jejich přínos prokazatelný [64, 66, 68]. Jedním z možných vysvětlení je velká diverzita mikrobiomů. V roce 2011 byl v časopise Nature otištěn článek popisující tři druhy střevních mikrobiomů – enterotypů [69]. Podle tohoto článku hrají například laktobacily významnou úlohu jen v jednom z těchto tří enterotypů. Lze se tedy domýšlet, že právě u tohoto jednoho enterotypu bude mít podání laktobacilového probiotika příznivý vliv, zatímco u zbývajících dvou enterotypů nepovede ke zlepšení stavu. Pak by bylo zřejmé, proč studie zkoumající efekt laktobacilů u neselektovaných pacientů s CDI nemůže prokázat přínos. Pro názornost je možné si představit, že bez znalosti enterotypů používáme probiotika podobně náhodným způsobem, jako byly před sto lety aplikovány krevní transfuze před objevem krevních skupin.
Ve skutečnosti je však situace mnohem složitější, protože rozdělení mikrobiomů do tří skupin je příliš hrubé. Mikrobiomy jednotlivých lidí se liší podle diety, tělesné konstituce, ale také podle věku a ročního období [70]. Není tedy dosud jasné, zda vůbec existuje nějaké univerzálně vhodné probiotikum nebo univerzálně využitelný dárce stolice. V každém případě bude potřeba najít metody, které umožní zjistit typ mikrobiomu, který je vlastní konkrétnímu pacientovi, a rovněž metody, které dokáží objektivně určit míru rozvratu mikrobiomu. Pak teprve bude možné vést léčbu cílenou podle individuálních potřeb.
Prohlášení o střetu zájmů: J. Beneš se zúčastnil kongresu ECCMID v roce 2014 a 2015 na základě pozvání firmy Astellas. Napsání tohoto článku však nebylo firmou Astellas iniciováno ani podporováno.
Do redakce došlo dne 1. 7. 2015.
Adresa pro korespondenci:
prof. MUDr. Jiří Beneš, CSc.
Klinika infekčních nemocí 3. LF UK
Nemocnice na Bulovce
Budínova 67
180 81 Praha 8
e-mail: benes.infekce@seznam.cz.
Sources
1. Bauer MP, Notermans DW, van Benthem BH, et al. Clostridium difficile infection in Europe: a hospital-based survey. Lancet, 2011;377(9759):63–73.
2. Beneš J, Husa P, Nyč O, Polívková S. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile. Klin. Mikrobiol. Inf. Lék., 2014;20(2):56–66.
3. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): update of the treatment guidance document for Clostridium difficile infection (CDI). Dostupné z: http://onlinelibrary.wiley.com/doi/10.1111/1469-0691.12418/pdf.
4. Havlík J, a kol. Infektologie. Učebnice pro lékařské fakulty. Praha: Avicenum, 1990, p. 151.
5. Gerber M, Walch C, Löffler B, et al. Effect of sub-MIC concentrations of metronidazole, vancomycin, clindamycin and linezolid on toxin gene transcription and production in Clostridium difficile. J Med Microbiol, 2008;57(6):776–783.
6. Grayson ML, et al. (eds): Kucers‘ The Use of Antibiotics, 6th ed. London: Hodder Arnold, 2010.
7. Bolton RP, Culshaw MA. Faecal metronidazole concentrations during oral and intravenous therapy for antibiotic associated colitis due to Clostridium difficile. Gut, 1986;27(10):1169–1172.
8. Soriano MM, Johnson S. Treatment of Clostridium difficile infections. Infect Dis Clin North Am, 2015;29(1):93–108.
9. Aradhyula S, Manian FA, Hafidh SA, Bhutto SS, Alpert MA. Significant absorption of oral vancomycin in a patient with Clostridium difficile colitis and normal renal function. South Med J, 2006;99(5):518–520.
10. Chihara S, Shimizu R, Furukata S, Hoshino K. Oral vancomycin may have significant absorption in patients with Clostridium difficile colitis. Scand J Infect Dis, 2011; 43(2):149–150.
11. Keighley MR, Burdon DW, Arabi Y, et al. Randomised controlled trial of vancomycin for pseudomembranous colitis and postoperative diarrhoea. Br Med J, 1978;2(6153):1667–1669.
12. Fekety R, Silva J, Kauffman C, Buggy B, Deery HG. Treatment of antibiotic-associated Clostridium difficile colitis with oral vancomycin: comparison of two dosage regimens. Am J Med, 1989;86 : 15–19.
13. Garey KW, Ghantoji SS, Shah DN, et al. A randomized, double-blind, placebo-controlled pilot study to assess the ability of rifaximin to prevent recurrent diarrhoea in patients with Clostridium difficile infection. J Antimicrob Chemother, 2011;66(12):2850–2855.
14. Ritter AS, Petri WA Jr. New developments in chemotherapeutic options for Clostridium difficile colitis. Curr Opin Infect Dis, 2013;26(5):461–470.
15. Johnson S, Schriever C, Patel U, et al. Rifaximin Redux: treatment of recurrent Clostridium difficile infections with rifaximin immediately post-vancomycin treatment. Anaerobe, 2009;15(6):290–291.
16. Soriano MM, Danziger LH, Gerding DN, Johnson S. Novel fidaxomicin treatment Regimens for patients with multiple Clostridium difficile infection recurrences that are refractory to standard therapies. Open Forum Infect Dis, 2014;1(2): ofu069.
17. Mullane K. Fidaxomicin in Clostridium difficile infection: latest evidence and clinical guidance. Ther Adv Chronic Dis, 2014;5(2):69–84.
18. Shue YK, Sears PS, Shangle S, et al. Safety, tolerance, and pharmacokinetic studies of OPT-80 in healthy volunteers following single and multiple oral doses. Antimicrob Agents Chemother, 2008;52(4):1391–1395.
19. Babakhani F, Bouillaut L, Sears P, et al. Fidaxomicin inhibits toxin production in Clostridium difficile. J Antimicrob Chemother, 2013;68(3):515–522.
20. Babakhani F, Gomez A, Robert N, Sears P. Postantibiotic effect of fidaxomicin and its major metabolite, OP-1118, against Clostridium difficile. Antimicrob Agents Chemother, 2011;55(9):4427–4429.
21. Babakhani F, Bouillaut L, Gomez A, et al. Fidaxomicin inhibits spore production in Clostridium difficile. Clin Infect Dis, 2012;55(Suppl 2):S162–169.
22. Mullane KM, Miller MA, Weiss K, et al. Efficacy of fidaxomicin versus vancomycin as therapy for Clostridium difficile infection in individuals taking concomitant antibiotics for other concurrent infections. Clin Infect Dis, 2011;53(5):440-447.
23. Chaparro-Rojas F, Mullane KM. Emerging therapies for Clostridium difficile infection – focus on fidaxomicin. Infect Drug Resist, 2013;6 : 41–53.
24. Wilcox MH, Howe R. Diarrhoea caused by Clostridium difficile: response time for treatment with metronidazole and vancomycin. J Antimicrob Chemother, 1995;36(4):673–679.
25. Al-Nassir WN, Sethi AK, Nerandzic MM, et al. Comparison of clinical and microbiological response to treatment of Clostridium difficile-associated disease with metronidazole and vancomycin. Clin Infect Dis, 2008;47(1):56–62.
26. Louie TJ, Miller MA, Mullane KM, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med, 2011;364(5):422–431.
27. Orenstein R. Fidaxomicin failures in recurrent Clostridium difficile infection: a problem of timing. Clin Infect Dis, 2012;55(4):613–614.
28. Soriano MM, Danziger LH, Gerding DN, Johnson S. Novel fidaxomicin treatment regimens for patients with multiple Clostridium difficile infection recurrences that are refractory to standard therapies. Open Forum Infect Dis, 2014;1(2):ofu069.
29. Scarpignato C, Pelosini I. Rifaximin, a poorly absorbed antibiotic: pharmacology and clinical potential. Chemotherapy, 2005;51(Suppl 1):36–66.
30. Nelson RL, Kelsey P, Leeman H, et al. Antibiotic treatment for Clostridium difficile-associated diarrhea in adults. Cochrane Database Syst Rev, 2011; CD004610.
31. Basu P, Dinani A, Rayapudi K, et al. Rifaximin therapy for metronidazole-unresponsive Clostridium difficile infection: a prospective pilot trial. Therap Adv Gastroenterol, 2010; 3 : 221–225.
32. Mattila E, Arkkila P, Mattila PS, et al. Rifaximin in the treatment of recurrent Clostridium difficile infection. Aliment Pharmacol Ther, 2012;37 : 122–128.
33. Carman RJ, Boone JH, Grover H, et al. In vivo selection of rifamycin-resistant Clostridium difficile during rifaximin therapy. Antimicrob Agents Chemother, 2012;56 : 6019–6020.
34. Hoffmann M, DeMaio W, Jordan RA, et al. Metabolism, excretion, and pharmacokinetics of [14C]tigecycline, a first-in-class glycylcycline antibiotic, after intravenous infusion to healthy male subjects. Drug Metab Dispos, 2007;35(9):1543–1553.
35. Aldape MJ, Heeney DD, Bryant AE, Stevens DL. Tigecycline suppresses toxin A and B production and sporulation in Clostridium difficile. J Antimicrob Chemother, 2015;70(1): 153–159.
36. Theriot CM, Schumacher CA, Bassis CM, et al. Effects of tigecycline and vancomycin administration on established Clostridium difficile infection. Antimicrob Agents Chemother, 2015;59(3):1596–1604.
37. Britt NS, Steed ME, Potter EM, Clough LA. Tigecycline for the Treatment of Severe and Severe Complicated Clostridium difficile Infection. Infect Dis Ther, 2014. [Epub ahead of print].
38. Larson KC, Belliveau PP, Spooner LM. Tigecycline for the treatment of severe Clostridium difficile infection. Ann Pharmacother, 2011;45(7-8):1005–1010.
39. de Lalla F, Nicolin R, Rinaldi E, et al. Prospective study of oral teicoplanin versus oral vancomycin for therapy of pseudomembranous colitis and Clostridium difficile-associated diarrhea. Antimicrob Agents Chemother, 1992;36(10):2192–2196.
40. Wenisch C, Parschalk B, Hasenhündl M, et al. Comparison of vancomycin, teicoplanin, metronidazole, and fusidic acid for the treatment of Clostridium difficile-associated diarrhea. Clin Infect Dis, 1996;22(5):813–818.
41. Mascio CT, Chesnel L, Thorne G, Silverman JA. Surotomycin demonstrates low in vitro frequency of resistance and rapid bactericidal activity in Clostridium difficile, Enterococcus faecalis, and Enterococcus faecium. Antimicrob Agents Chemother, 2014;58(7):3976–3982.
42. Alam MZ, Wu X, Mascio C, et al. Mode of action and bactericidal properties of surotomycin against growing and non-growing Clostridium difficile. Antimicrob Agents Chemother, 2015. [Epub ahead of print]
43. Chilton CH, Crowther GS, Todhunter SL, et al. Efficacy of surotomycin in an in vitro gut model of Clostridium difficile infection. J Antimicrob Chemother, 2014;69(9):2426–2433.
44. Locher HH, Seiler P, Chen X, et al. In vitro and in vivo antibacterial evaluation of cadazolid, a new antibiotic for treatment of Clostridium difficile infections. Antimicrob Agents Chemother, 2014;58(2):892–900.
45. Baldoni D, Gutierrez M, Timmer W, Dingemanse J. Cadazolid, a novel antibiotic with potent activity against Clostridium difficile: safety, tolerability and pharmacokinetics in healthy subjects following single and multiple oral doses. J Antimicrob Chemother, 2014;69(3):706–714.
46. Beneš J, Husa P, Nyč O. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile. Klin mikrobiol inf lék, 2012;18(5):160–167.
47. Friedenberg F, Fernandez A, Kaul V, et al. Intravenous metronidazole for the treatment of Clostridium difficile colitis. Dis Colon Rectum, 2001;44 : 1176–1180.
48. Longin P, Valeckova M, Bilek A, et al. Local application of fidaxomicin in a patient with subtotal colectomy following recurring Clostridium difficile infection. JMM Case Reports, 2014;1. Published online 2014.
49. Cohen SH, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol, 2010;31(5):431–455.
50. Wilcox MH, Howe R. Diarrhoea caused by Clostridium difficile: response time for treatment with metronidazole and vancomycin. J Antimicrob Chemother, 1995;36(4):673–679.
51. Al-Nassir WN, Sethi AK, Nerandzic MM, et al. Comparison of clinical and microbiological response to treatment of Clostridium difficile-associated disease with metronidazole and vancomycin. Clin Infect Dis, 2008;47(1):56–62.
52. Thielman NM, Wilson KH. Antibiotic-associated colitis. In: Manell GL, Bennett JE, Dolin R (eds.): Mandell, Douuglas, and Bennett´s Principles and Practice of Infectious Diseases, 7th ed. Churchill Livingstone Elsevier 2010, pp 1375–1388.
53. Johnson S, Louie TJ, Gerding DN, et al. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis, 2014;59(3):345–354.
54. O'Horo JC, Jindai K, Kunzer B, Safdar N. Treatment of recurrent Clostridium difficile infection: a systematic review. Infection, 2014;42(1):43–59.
55. Lowy I, Molrine DC, Leav BA, et al. Treatment with monoclonal antibodies against Clostridium difficile toxins. N Engl J Med, 2010;362(3):197–205.
56. Mattila E, Anttila VJ, Broas M, et al. A randomized, double-blind study comparing Clostridium difficile immune whey and metronidazole for recurrent Clostridium difficile-associated diarrhoea: efficacy and safety data of a prematurely interrupted trial. Scand J Infect Dis, 2008;40(9):702–708.
57. Fitzpatrick LR. Probiotics for the treatment of Clostridium difficile associated disease. World J Gastrointest Pathophysiol, 2013;4(3):47–52.
58. Thygesen JB, Glerup H, Tarp B. Saccharomyces boulardii fungemia caused by treatment with a probioticum. BMJ Case Reports, 2012;10.1136/bcr.06.2011.4412.
59. Yakob L, Riley TV, Paterson DL, Clements AC. Clostridium difficile exposure as an insidious source of infection in healthcare settings: an epidemiological model. BMC Infect Dis, 2013;13 : 376.
60. Borgia G, Maraolo AE, Foggia M, et al. Fecal microbiota transplantation for Clostridium difficile infection: back to the future. Expert Opin Biol Ther, 2015;15(7):1001–1014.
61. http://www.rebiotix.com/index.php/rebiotix-clinical-program/punch-cd-2-clinical-trial
62. Pattani R, Palda VA, Hwang SW, Shah PS. Probiotics for the prevention of antibiotic-associated diarrhea and Clostridium difficile infection among hospitalized patients: systematic review and meta-analysis. Open Med, 2013;7(2):e56–67.
63. Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA, 2012;307(18): 1959–1969.
64. Hickson M. Probiotics in the prevention of antibiotic-associated diarrhoea and Clostridium difficile infection. Therap Adv Gastroenterol, 2011;4(3):185–197.
65. Hempel S, Newberry S, Ruelaz A, et al. Safety of probiotics used to reduce risk and prevent or treat disease. Evid Rep Technol Assess, 2011;(200):1–645.
66. Issa I, Moucari R. Probiotics for antibiotic-associated diarrhea: Do we have a verdict? World J Gastroenterol, 2014;20(47):17788–1795.
67. Beniwal RS, Arena VC, Thomas L, et al. A randomized trial of yogurt for prevention of antibiotic-associated diarrhea. Dig Dis Sci, 2003;48(10):2077–2082.
68. Allen SJ, Wareham K, Wang D, et al. Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difficile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet, 2013; 382(9900):1249–1257.
69. Arumugam M, Raes J, Pelletier E, et al. Enterotypes of the human gut microbiome. Nature, 2011;473(7346):174–180.
70. Davenport ER, Mizrahi-Man O, Michelini K, et al. Seasonal variation in human gut microbiome composition. PLoS One, 2014;9(3): e90731.
71. Freeman J, Vernon J, Morris K, et al. Pan-European longitudinal surveillance of antibiotic resistance among prevalent Clostridium difficile ribotypes. Clin Microbiol Infect, 2015;21(3): 248.e9–248.e16.
72. Cornely OA, Nathwani D, Ivanescu C, et al. Clinical efficacy of fidaxomicin compared with vancomycin and metronidazole in Clostridium difficile infections: a meta-analysis and indirect treatment comparison. J Antimicrob Chemother, 2014;69(11):2892–2900.
73. Crook DW, Walker AS, Kean Y, et al. Fidaxomicin Versus Vancomycin for Clostridium difficile Infection: Meta-analysis of Pivotal Randomized Controlled Trials. Clin Infect Dis, 2012;55(Suppl 2):S93–103.
74. Bagdasarian N, Rao K, Malani PN. Diagnosis and treatment of Clostridium difficile in adults: a systematic review. JAMA, 2015;313(4):398–408.
75. Di X, Bai N, Zhang X, et al. A meta-analysis of metronidazole and vancomycin for the treatment of Clostridium difficile infection, stratified by disease severity. Braz J Infect Dis, 2015 [Epub ahead of print].
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2016 Issue 1-
All articles in this issue
- The prevalence of Candida pelliculosa, Candida utilis, and Candida fabianii in the Olomouc University Hospital: epidemiological study
- The benefit from mumps virus IgG antibody avidity testing in the population with high vaccine coverage in the context of other serological methods for laboratory diagnosis of mumps and the current epidemiological
- Assessment of invalidity as a result of infectious diseases
- Infectious and other somatic comorbidity in problem drug users – results of a cross-sectional study with medical examination
- Hepatitidis E virus
- Antibiotic treatment of clostridial colitis
- Prevalence of infectious complications in burn patients requiring intensive care: data from a pan-European study
- Influenza in the pediatric population in Istanbul: a one center experience 2009–2014
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibiotic treatment of clostridial colitis
- Infectious and other somatic comorbidity in problem drug users – results of a cross-sectional study with medical examination
- Hepatitidis E virus
- Assessment of invalidity as a result of infectious diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

