-
Medical journals
- Career
Transplantace dělohy v léčbě ženské neplodnosti z pohledu patologa
Authors: Jan Balko 1; Josef Zámečník 1; Roman Chmel 2
Authors‘ workplace: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 1; Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha 2
Published in: Čes.-slov. Patol., 58, 2022, No. 1, p. 57-60
Category:
Overview
Transplantace dělohy představuje novou experimentální metodu léčby absolutního uterinního faktoru infertility, který postihuje 3-5 % neplodných žen. Jedná se zejména o ženy s uterinní agenezí, některými závažnými kongenitálními malformacemi dělohy, získanými chorobami dělohy vedoucími k neplodnosti a stavy po hysterektomii u žen fertilního věku. Umožnění reprodukce biologicky vlastních potomků řadí transplantaci dělohy mezi jednu z možností léčby sterility pomocí metod asistované reprodukce, která však bývá v současnosti některými etiky označována jako příliš radikální. Analýza stavu novorozenců narozených z transplantované dělohy ukazuje vysokou míru porodů dětí pomocí císařského řezu ve stádiu zralosti nebo lehké nezralosti a nenaznačuje závažnější zdravotní komplikace na straně matek ani dětí. Transplantace dělohy je proto dnes vnímána jako nadějná metoda léčby absolutního uterinního faktoru infertility, která má potenciál doplnit další cesty vedoucí k dosažení mateřství u žen s nefunkční či absentující dělohou, tedy surogátní těhotenství a adopci.
Patolog je podobně jako v případě dalších orgánových transplantací jedním ze základních členů multidisciplinárního týmu. Jeho hlavní role spočívá v hodnocení rejekčních změn uterinních alograftů ve vzorcích z biopsie ektocervixu děložního hrdla, která je dosud jedinou možností kontroly hrozící rejekce transplantované dělohy. Evaluace známek rejekce dělohy vychází z platného tzv. provizorního skórovacího systému navrženého švédskými průkopníky na poli výzkumu transplantace dělohy, který slovem provizorní ve svém názvu naznačuje potřebu dalšího výzkumu této problematiky.
Klíčová slova:
transplantace – děloha – rejekce – cervikální biopsie – grading
Transplantace dělohy (UTx) představuje novou experimentální metodu léčby absolutního uterinního faktoru infertility (AUFI), který postihuje 3-5 % neplodných žen. Jedná se zejména o ženy s uterinní agenezí, závažnými malformacemi dělohy, získanými chorobami dělohy ovlivňujícími fertilitu (např. intrauterinní adheze a leiomyomy deformující děložní dutinu) a pacientky ve fertilním věku po hysterektomii (1). UTx neslouží k záchraně života a zdraví (jako např. transplantace srdce, plic, jater či ledvin), ale patří do skupiny tzv. vaskulárně - kompozitních alotransplantací (např. transplantace obličeje a ruky), které jsou určené ke zvýšení kvality života a zkvalitnění sociální integrace jedinců do společnosti. UTx se však jiným orgánovým transplantacím vymyká zejména tím, že jde o jedinou primárně plánovanou dočasnou transplantací a užívání imunosupresivní terapie je proto nutné pouze do doby naplnění reprodukčních cílů příjemkyně. Poté je děložní štěp z těla vyjmut a antirejekční léčba může být ukončena. Možnost reprodukce biologicky vlastních potomků řadí UTx mezi metody asistované reprodukce, ale některými zastánci adopcí bývá označována jako příliš náročná a relativně radikální forma lidské reprodukce (2).
HISTORIE TRANSPLANTACE DĚLOHY
První humánní transplantace dělohy proběhla v roce 2000 v Saudské Arábii, kdy příjemkyně dělohy přijala štěp od nepříbuzné žijící dárkyně. Ačkoli samotný odběr i transplantace proběhly úspěšně, po 3 měsících od operace byla zjištěna nekróza graftu kvůli dehiscenci utero-vaginální anastomózy a následnému prolapsu dělohy do pochvy s okluzí uterinních cév (3). V průběhu následujících dvou desetiletí od tohoto pokusu se z UTx vyvinula nadějná experimentální metoda léčby neplodnosti, která by se mohla po stádiu ověřování stát v budoucnu standardní léčebnou metodou (4,5). V roce 2014 se ve Švédsku narodilo císařským řezem první dítě z dělohy transplantované od žijící dárkyně (6). Na tento porod navazovaly další, přičemž některé z příjemkyň dělohy porodily dvě děti a až poté podstoupily hysterektomii (7). První dítě z dělohy kadaverózní dárkyně se narodilo v roce 2017 v Brazílii (8).
Počátky uterinního transplantačního programu v České republice se datují do let 2014-2015, kdy proběhla studie s iniciální kohortou 50 českých pacientek s kongenitální agenezí dělohy a pochvy (syndromem Mayer-Rokitansky-Küster-Hauser) a neovaginou vytvořenou technikou podle Vecchiettiho (9). Z těchto zájemkyň o UTx se rekrutovala část pacientek, které se staly příjemkyněmi transplantované dělohy v České republice po roce 2016, přičemž 5 žen obdrželo dělohu od žijících a 5 od kadaverózních dárkyň. Celkem 7 případů UTx bylo funkčně úspěšných, všechny tyto ženy podstoupily embryotransfery v rámci asistované reprodukce a první porod zdravého dítěte po UTx proběhl v Praze ve 35. gestačním týdnu (10,11).
ETICKÉ ASPEKTY TRANSPLANTACE DĚLOHY
UTx byla již od počátku spojena s řadou kontroverzí etických, medicínských, psychologických a náboženských aspektů. Zastánci této složité léčby neplodnosti ji obhajují jako de facto jedinou kauzální terapeutickou možnost, která ženám s AUFI zajistí jak geneticky, tak zejména biologicky vlastního potomka (biologická matka je vždy ta, která dítě porodí). Ve srovnání s žijícími dárci ledvin a části jater obhájcové UTx rovněž zdůrazňují nižší riziko vzniku závažných komplikací u žijících dárkyň dělohy (12). Navíc ve srovnání se surogátním těhotenstvím, které umožňuje zajistit neplodnému páru geneticky vlastní dítě cestou náhradní těhotné, je UTx spojena s eticky akceptovatelným přijetím všech rizik spojených s otěhotněním, graviditou a porodem samotnou příjemkyní dělohy.
Kritici UTx na druhou stranu zdůrazňují zejména chirurgickou náročnost jak odběru děložního štěpu od žijící dárkyně, tak i samotné transplantace, ale upozorňují i na rizika vyplývající z užívání imunosuprese, a to za cenu “pouhého” zvýšení kvality života a nikoli za cenu jeho záchrany jako u jiných orgánových transplantací. Některé kontroverze však mohou být spojeny i s dárcovstvím dělohy od zemřelých dárkyň. Souhrn aktuálních etických postojů k této experimentální metodě léčby AUFI byl recentně publikován i v české odborné literatuře (13).
PATOLOGICKÉ ASPEKTY TRANSPLANTACE DĚLOHY
Bioptické vyšetření transplantované dělohy
Podobně jako v případě jiných orgánových transplantací je role patologa v rámci UTx nezastupitelná a spočívá zejména v hodnocení hrozících známek rejekce v transplantované děloze. Diagnostika rejekce se neobejde bez bioptického ověření, protože žádná méně invazivní metoda kontroly známek rejekce nebyla dosud objevena. Podmínkou kvalitní histopatologické diagnostiky je gynekologem technicky správně provedená biopsie z ektocervixu, ideálně pod kolposkopickou kontrolou místa optimálního odběru z děložního hrdla transplantované dělohy, což může být problémem zejména v případě potransplantační stenózy utero-vaginální anastomózy, která způsobuje horší viditelnost exocervixu nacházejícího se nad stenózou (14).
V případě UTx se kontrolní biopsie odebírá z exocervixu děložního hrdla a díky přerušení inervace dělohy při jejím odběru od dárkyně je sice pro pacientku nekomfortní, ale fakticky nebolestivá. Stále není zcela jisté, zda zánětlivé změny v exocervixu korelují s eventuálními zánětlivými (rejekčními) změnami ve zbytku dělohy, avšak nedávná švédská studie sedmi explantovaných děloh po transplantaci potvrdila reprezentativnost exocervikálních odběrů pro celou dělohu (15). Bioptický odběr se opakuje v pravidelných intervalech po transplantaci, před otěhotněním, ale i v průběhu gravidity (4,6,8,10,16). Pokud je rejekce histopatologicky potvrzena, provádí se po podání antirejekční léčby či po úpravě udržovací imunosupresivní léčby opakovaná biopsie k vyloučení perzistence známek rejekce, což může oddálit následující embryotransfery čekáním na zhojení místa odběru tkáně z ektocervixu a zároveň i prodlužovat dobu užívání imunosupresiv.
Stanovení stupně rejekce je založeno na provizorním skórovacím systému švédských autorů, které hodnotí zánětlivý infiltrát v exocervixu (17). Tato klasifikace dělí histopatologické (subklinické) rejekční změny na mírné (grade 1), střední (grade 2) a těžké (grade 3), přičemž zároveň představuje i kategorii tzv. hraničních (borderline) změn (grade 0) známou z kontroly známek rejekce u jiných orgánových transplantací.
Provizorní skórovací systém rejekčních změn po transplantaci dělohy
V rámci současně platné klasifikace morfologie rejekčních změn se rozpoznávají 4 kategorie (17), které jsou definovány následujícími rysy a graficky znázorněny na přiloženém schématu (obr. 1).
Image 1. Schéma provizorního skórovacího systému rejekčních změn po UTx.
A) Normální cervikální biopsie s izolovanými zánětlivými buňkami. B) Borderline změny definované shlukujícími se zánětlivými buňkami s převahou lymfocytů v oblasti epitelo-stromální junkce s intraepiteliálním influxem leukocytů. C) Grade 1 rejekce charakterizovaná ložiskovým smíšeným zánětlivým infiltrátem s převahou lymfocytů v oblasti epitelo-stromální junkce. D) Grade 2 rejekce charakterizovaná ložiskovým až splývajícím smíšeným zánětlivým infiltrátem s převahou lymfocytů v oblasti epitelo-stromální junkce, doprovázená redukcí šíře epitelu a stromálním edémem. E) Grade 3 rejekce s nápadným difuzním smíšeným zánětlivým infiltrátem. Epiteliální eroze/ulcerace mohou být přítomny.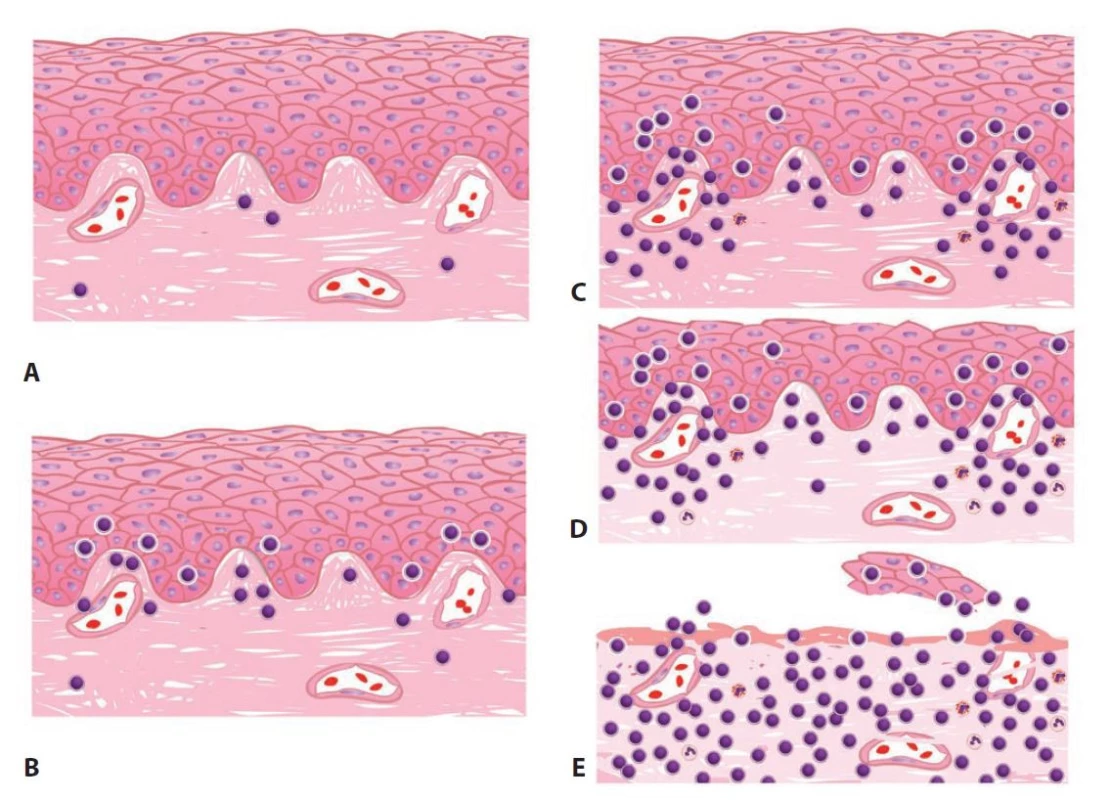
Grade 1 (mírná rejekce) je charakterizován mírným smíšeným zánětlivým infiltrátem s dominancí lymfocytů, které se nacházejí zejména na epitelo-stromální junkci exocervixu (v oblasti superficiálního stromatu a stratum basale dlaždicového epitelu). Zánětlivá infiltrace bývá ložisková až splývající a epitel nevykazuje regresivní změny s výjimkou ojedinělých apoptóz keratinocytů.
Grade 2 (střední rejekce) obsahuje v oblasti epitelo-stromální junkce splývající smíšený zánět s vyjádřeným intraepiteliálním influxem leukocytů. Kromě převažujících lymfocytů lze pozorovat účast četnějších neutrofilních granulocytů. Dlaždicový epitel může být fokálně ztenčený, edematózně prosáklý a obsahovat disperzní apoptotická tělíska.
Grade 3 (těžkou rejekci) definuje přítomnost nápadného difuzního smíšeného zánětlivého infiltrátu s převahou lymfocytů a účastí hojných neutrofilních a eozinofilních granulocytů. V dlaždicovém epitelu lze kromě apoptotických tělísek po zaniklých keratinocytech pozorovat eroze až ulcerace s nekrotizací výstelky i přilehlého stromatu.
Provizorní skórovací systém děložních alograftů dále uvádí kategorii tzv. hraničních (borderline) změn. Tu představují malé nesplývající aglomeráty lymfocytů, jež lze nalézt zejména v epitelo-stromální junkci. V epitelu je může doprovázet intercelulární edém; v intersticiu se nachází převážně ve stromálních papilách. Význam těchto aglomerátů ve vztahu k rejekci je zatím nejistý, jejich přítomnost byla totiž prokázána i u zdravých žen s vlastní dělohou (18).
Prozatímní klasifikace hodnotila pouze celulární rejekční změny, pro humorální rejekci dělohy stále chybí spolehlivá data. Dosud byla publikována pouze izolovaná kazuistika popisující výskyt protrahované smíšené celulární a humorální rejekce u pacientky s uterinním alograftem (19).
ZÁVĚR
Dosud bylo ve světě provedeno přibližně 80 transplantací dělohy, díky nimž se ženám s AUFI narodilo celkem 31 dětí (20). Recentně publikovaná analýza potvrdila vysokou míru (79 %) porodů v termínu nebo krátce před stádiem zralosti a zároveň neprokázala žádné závažnější zdravotní komplikace na straně matek ani dětí, které by nebylo možné vyléčit standardními gynekologicko-porodnickými a neonatologickými léčebnými postupy (21). Ačkoli UTx čelí řadě nezodpovězených etických otázek, je vnímána jako nadějná experimentální léčba AUFI, jejíž efektivita a bezpečnost by měla být potvrzena v dohledné době po ukončení studií probíhající v mnoha zemích světa. Role patologa spočívá zejména v hodnocení rejekčních změn uterinních alograftů. Evaluace rejekcí dělohy vychází z dosud platného provizorního skórovacího systému švédských autorů (17), který však již ve svém názvu odráží nezbytnost dalšího výzkumu a možnost jeho úpravy v budoucnu. Odborná publikační aktivita zabývající se patologickými aspekty léčby neplodnosti pomocí UTx je sice minimální, ale probíhající studie by mohly v dohledné době přinést nové obohacující výsledky.
PODĚKOVÁNÍ
Podpořeno MZ ČR - RVO FN v Motole 00064203.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Jan Balko
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
V Úvalu 84/1, 150 06 Praha 5
tel.: 728 218 139
e-mail: Jan.Balko@fnmotol.cz
Sources
1. Brännström M, Dahm Kähler P, Greite R, Mölne J, Díaz-García C, Tullius SG. Uterus Transplantation: A Rapidly Expanding Field. Transplantation 2018; 102(4): 569-577.
2. Chmel R. Syndrom Mayer-Rokitansky-Küster-Hauser, diagnostické a terapeutické možnosti. Praha: Maxdorf; 2021 : 54-72.
3. Fageeh W, Raffa H, Jabbad H, Marzouki A. Transplantation of the human uterus. Int J Gynaecol Obstet 2002; 76(3): 245-51.
4. Brännström M, Johannesson L, Dahm - Kähler P, et al. First clinical uterus transplantation trial: a six-month report. Fertil Steril 2014; 101(5): 1228-1236.
5. Brännström M, Boccio MV, Pittman J. Uterus transplantation: the science and clinical update. Curr Opin Physiol 2020; 13 : 49-54.
6. Brännström M, Johannesson L, Bokström H, et al. Livebirth after uterus transplantation. Lancet 2015; 385(9968): 607-616.
7. Dahm-Kähler P, Diaz-Garcia C, Brännström M. Human uterus transplantation in focus. Br Med Bull 2016; 117(1): 69-78.
8. Ejzenberg D, Andraus W, Baratelli Carelli Mendes LR, et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet 2019; 392(10165): 2697-2704.
9. Chmel R, Nováčková M, Pastor Z, Froněk J. The interest of women with Mayer–Rokitansky – Küster–Hauser syndrome and laparoscopic Vecchietti neovagina in uterus transplantation. J Pediatr Adolesc Gynecol 2018; 31(5): 480-484.
10. Chmel R, Nováčková M, Janoušek L, et al. Revaluation and lessons learned from the first 9 cases of a Czech uterus transplantation trial: four deceased donor and 5 living donor uterus transplantations. Am J Transplant 2019; 19(3): 855-864.
11. Chmel R, Čekal M, Pastor Z, et al. Assisted reproductive techniques and pregnancy results in women with Mayer–Rokitansky–Küster – Hauser syndrome undergoing uterus transplantation: the Czech experience. J Pediatr Adolesc Gynecol 2020; 33(4): 410-414.
12. Testa G, Koon EC, Johannesson L. Living Donor Uterus Transplant and Surrogacy: Ethical Analysis According to the Principle of Equipoise. Am J Transplant 2017; 17(4): 912-916.
13. Chmel R, Nováčková M, Čekal M, Chmel R, Pastor Z. Aktuální etické aspekty léčby absolutního uterinního faktoru neplodnosti pomocí transplantace dělohy. Česká gynekologie 2021; 86(1): 40-45.
14. Chmel, R, Nováčková M, Pastor Z. Lessons learned from the Czech uterus transplant trial related to surgical technique that may affect reproductive success. Aust N Z J Obstet Gynaecol 2020; 60(4): 625-627.
15. Broecker V, Brännström M, Ekberg J, Dahm - Kähler P, Mölne J. Uterus transplantation: histological findings in explants at elective hysterectomy. Am J Transplant 2021; 21(2): 798-808.
16. Brucker SY, Strowitzki T, Taran FA, et al. Living - donor uterus transplantation: Pre-, intra-, and postoperative parameters relevant to surgical success, pregnancy, and obstetrics with live births. J Clin Med 2020; 9 : 2458.
17. Mölne J, Broecker V, Ekberg J, Nilsson O, Dahm-Kähler P, Brännström M. Monitoring of human uterus transplantation with cervical biopsies: a provisional scoring system for rejection. Am J Transplant 2017; 17(6): 1628 - 1636.
18. Balko J, Nováčková M, Škapa P, et al. Histopathological examination of the ectocervical biopsy in non-transplanted uteri: A study contributing to the provisional scoring system of subclinical graft rejection after uterus transplantation. Acta Obstet Gynecol Scand 2022; 101(1): 37-45.
19. Flyckt R, Falcone T, Quintini C, et al. First birth from a deceased donor uterus in the United States: from severe graft rejection to successful cesarean delivery. Am J Obstet Gynecol 2020; 223(2): 143-151.
20. Richards EG, Farrell RM, Ricci S, Perni U, Quintini C, Tzakis A, Falcone T. Uterus transplantation: state of the art in 2021. J Assist Reprod Genet 2021; 38(9): 2251-2259.
21. Johannesson L, Testa G, Putman JM, et al. Twelve Live Births After Uterus Transplantation in the Dallas Uterus Transplant Study. Obstet Gynecol 2021; 137(2): 241-249.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2022 Issue 1-
All articles in this issue
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu
- Při volbě patologie nebylo třeba dlouhého váhaní
- 'PATOLOGIE GIT
- 'HEMATOPATOLOGIE
- 'NEUROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- 'HISTORIE PATOLOGIE
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Morfologie zánětlivých střevních onemocnění (IBD)
- Zemřel MUDr. Jiří Kudrmann (24. 10. 1928 – 21. 1. 2022)
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Penilní parafinom: kazuistika
- Transplantace dělohy v léčbě ženské neplodnosti z pohledu patologa
- Prof. MUDr. Boris Habanec, DrSc., 90letý.
- Životné jubileum prof. MUDr. Lukáša Planka, CSc.
- DOPIS REDAKCI
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Morfologie zánětlivých střevních onemocnění (IBD)
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Penilní parafinom: kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

