-
Medical journals
- Career
Praktické využití imunohistochemie a genetiky v diagnostice nádorů varlat
Authors: Květoslava Michalová 1; Michael Michal 1,2; Milan Hora 3; Ondřej Hes 1; Michal Michal 1
Authors‘ workplace: Šiklův ústav patologie, Univerzita Karlova, Fakultní nemocnice v Plzni 1; Biomedicínské centrum, Univerzita Karlova, Fakultní nemocnice v Plzni 2; Urologická klinika, Univerzita Karlova, Fakultní nemocnice v Plzni 3
Published in: Čes.-slov. Patol., 56, 2020, No. 3, p. 153-160
Category: Reviews Article
Overview
Převážná většina testikulárních tumorů je diagnostikována na základě morfologie, imunohistochemie (IHC) a molekulární genetika bývá potřeba k diagnóze pouze malého podílu případů. Stejně jako v jiných oblastech patologie by i zde měly být pomocné diagnostické metody indikovány uvážlivě, hodnoceny v korelaci s morfologií, sérologií a klinickým nálezem. Pokud jsou nezbytné, před jejich efektivním použitím by měl mít patolog jasno o poměrně úzké diferenciální diagnóze, která je daná morfologií. Germinální tumory (GT) jsou zdaleka nejčastějšími tumory varlete, s prevalencí až 95 %. Punc důležitosti jim dává fakt, že jde o nejčastější solidní tumory vyskytující se u mužů mezi 20. a 30. rokem života a že mají při včasné a správné diagnóze výbornou prognózu. Z hlediska molekulární genetiky stojí GT zatím stranou trendu poslední doby stratifikovat nádorové jednotky dle molekulárních alterací. Je to zvláště díky jejich nízké mutační zátěži, neboť hlavní genetickou abnormalitou jsou chromozomální numerické aberace. S ohledem na četnost výskytu GT mezi testikulárními tumory a na to, že morfologie je většinou diagnosticky nejhodnotnější, je přehledový článek zaměřen převážně na germinální neoplazie a důraz je kladen i na morfologickou stránku. Ze sex-cord stromálních tumorů je pojednáváno pouze o kategorii Sertoli cell tumorů, NOS, jelikož bývají často diagnosticky svízelné. Přehledový článek je z praktických důvodů pojat převážně z hlediska diferenciální diagnózy a zahrnuje pouze jednotky, jejichž záměna má klinický význam.
Klíčová slova:
nádory varlat – testis – imunohistochemie – molekulární genetika
Nádory varlat jsou v porovnání s ostatními solidními nádory vzácné. Incidence zhoubných nádorů varlete v České republice dlouhodobě mírně stoupá, zatímco mortalita má opačný trend. V letech 2009-2016 se mortalita konzistentně pohybovala kolem 44 (absolutní počet za celou ČR). Poměr mortalita/incidence byl v roce 2016 42/498, tedy 8,4 % (novější data nejsou k dispozici) (1). Správně diagnostikované testikulární tumory, zvláště to platí o germinálních neoplaziích, jsou často vyléčitelné. Germinální tumory (GT) jsou dle aktuální WHO klasifikace (1)členěny na základě přítomnosti či absence GCNIS (germ cell neoplasia in situ; GCNIS, dříve IGCNU) do dvou biologicky odlišných skupin: GT odvozené od GCNIS a GT vznikající bez souvislosti s GCNIS. Dle terapeutického přístupu jsou však GT členěny na seminomy a non-seminomy. Seminomy stadia I (bez prokazatelných metastáz), IIA (metastázy v retroperitoneu o velikosti do 2 cm) a IIB (metastázy v retroperitoneu o velikosti 2-5 cm či více než 5 zasažených lymfatických uzlin do velikosti 5 cm) bývaly po dlouhá léta léčeny radioterapií, kdežto non-seminomy chemoterapií. V posledních letech nastává na základě prospektivních randomizovaných studií u seminomů stadia I, IIA a IIB odklon od toxické radioterapie k méně toxické chemoterapii. U seminomů stadia I se však používá jiný typ chemoterapie: monoterapie karboplatinou namísto kombinované chemoterapie (BEP=bleomycin, etoposid a cisplatina) užívané u non-seminomů. U seminomů i non-seminomů stádia I dochází ke snižování počtu cyklů. U seminomů IIA-IIB je možno volit mezi radioterapií retroperitonea a kombinovanou chemoterapií BEP ve 3 cyklech. U postchemoterapeutické reziduální masy je též odlišný postup u seminomů a non-seminomů(2). Umět rozlišit mezi jednotlivými typy germinálních tumorů a zvláště správně diagnostikovat seminom je tudíž z hlediska odlišné léčby podstatné.
Germinální tumory (GT) odvozené od GCNIS
Jde o histopatologicky poměrně homogenní skupinu maligních tumorů zahrnující seminom, embryonální karcinom, trofoblastické tumory, postpubertální yolk sac tumor a postpubertální teratom. Tumory odvozené od GCNIS tvoří drtivou většinu GT. Morfologický obraz je většinou dostačující i k subtypizaci GT této skupiny, k imunohistochemickému (IHC) a molekulárně genetickému vyšetření tak přistupujeme pouze v nejednoznačných případech.
Morfologické a IHC znaky
GCNIS derivované GT jsou rozpoznatelné na základě morfologie: důležitým vodítkem je přítomnost GCNIS v okolí tumoru. Vzhled GCNIS je nezávislý na histologickém typu invazivního tumoru. GCNIS histologicky představují maligní germinální buňky, které jsou větší než spermatogonie, mají nepravidelná hranatá jádra s viditelnými jadérky a objemnou světlou cytoplazmu danou přítomností glykogenu (obr. 1). Připomínají tak buňky seminomu. Buď souvisle lemují semenotvorné kanálky nebo se v nich šíří pagetoidně a potom je můžeme vidět promíchané se Sertoliho buňkami. Postižené semenotvorné kanálky mají výrazně sníženou či úplně vymizelou spermatogenezi a často ztluštělou a hyalinizovanou bazální membránu, v některých případech obsahují drobné amorfní či koncentrické kalcifikace. V diagnostice GCNIS lze využít přítomnosti cytoplazmatického glykogenu, který bude pozitivní v barvení PAS(3) (nenádorové buňky budou negativní). Použitelnými IHC markery pro průkaz GCNIS jsou markery germinálních buněk OCT3/4, NANOG, LIN28 (všechny nukleárně pozitivní), D2-40 či PLAP (obě membranózně/cytoplazmaticky pozitivní), neboť tyto protilátky nereagují s normálními spermatogoniemi(4). Nedoporučujeme používat marker germinálních buněk SALL4 (5) a CD117 (6,7) neboť barví i nenádorové spermatogonie.Nejužitečnější diskriminační protilátkou je OCT3/4, protože je spolehlivě pozitivní v GCNIS a negativní nebo pouze vzácně pozitivní v jiných germinálních buňkách (obr. 1) – zvláště důležitá je jeho negativita v germinálních buňkách s poruchou vyzrávání. Nevýhodou protilátky PLAP je její nižší senzitivita.
Image 1. Germinální tubuly s pagetoidním šířením GCNIS. Nádorové buňky připomínají buňky seminomu, mají objemnou světlou cytoplazmu a nepravidelná hranatá jádra (A). Protilátka OCT3/4 je nukleárně pozitivní v tubulech postižených GCNIS, v nenádorových tubulech je negativní (B). 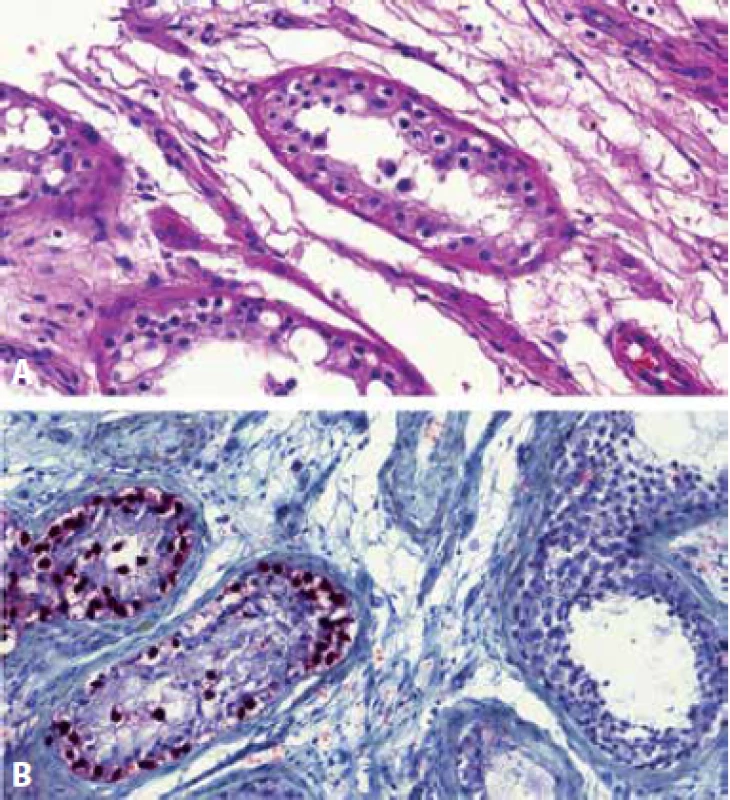
V imunohistochemické diferenciální diagnóze invazivních germinálních tumorů lze využít embryonální markery pluripotenceOCT3/4, SALL4, NANOG a LIN28, exprimované v primordiálních buňkách (gonocytech). Za nejužitečnější marker se považuje OCT3/4. Je nukleárně pozitivní v seminomu a embryonálním karcinomu, negativní v yolk sac tumoru, choriokarcinomu, spermatocytickém tumoru a všech ostatních testikulárních tumorech (viz schéma 1). V dalším textu jsou z hlediska diferenciální diagnózy diskutovány jednotky, jejichž rozlišení má klinický význam a s nimiž se v rutinní praxi setkáváme poměrně často.
Seminom versus embryonální karcinom (EK)
Seminom nejčastěji roste v kompaktních nepravidelných hnízdech a pruzích oddělených tenkými fibrózními septy. Buňky seminomu jsou histologicky podobné primordiálním buňkám embrya, uniformní, světlé či eosinofilní, s výraznými cytoplazmatickými membránami a centrálně uloženým, charakteristicky hranatým jádrem s jedním či dvěma jadérky. Dobře známá je příměs lymfocytárního infiltrátu a poměrně často i epiteloidních granulomů (8,9). Embryonální karcinom je oproti seminomu architektonicky výrazně více heterogenní, často je v jednom tumoru vidět kombinace papilárních a pseudoglandulárních struktur, solidních pruhů a hnízd (10). Buňky EK jsou epiteloidní, podstatně více anaplastické než buňky seminomu, bez zřetelných buněčných hranic. Jádra EK jsou ve srovnání se seminomem větší, nepravidelná, opticky průsvitná (vezikulární), překrývají se a obsahují mnohočetná jadérka (často více než 2)(11). Denzní lymfocytární celulizace či granulomatózní reakce sice nejsou v EK zdaleka tak časté jako v seminomech, ale mohou se zde také vyskytovat (12). Imunohistochemicky reagují jak seminomy, tak EK pozitivně s markery germinálních buněk (OCT3/4, SALL4, NANOG, LIN28)(13-15). V IHC diferenciální diagnóze se doporučuje použít panel protilátek s opačnou reaktivitou v seminomu a EK. Sem řadíme CD117 (receptor tyrozin kinázy, pozitivní na cytoplazmatické membráně téměř 100 % seminomů, negativní v EK (16-19)), D2-40 (transmembránový mukoprotein, membránově pozitivní v seminomech, negativní v EK, přičemž asi třetina EK může být slabě pozitivní na apikálním povrchu buněk (20-24)), SOX17 (transkripční faktor nukleárně pozitivní v seminomech, negativní v EK(25,26)), CD30 (člen rodiny receptorů TNF, difuzně membranózně pozitivní v EK, v seminomech negativní; někdy můžeme v seminomu vidět ojedinělé CD30+ buňky, avšak nikoliv difúzní pozitivitu (27-30)), AE1/3 (širokospektrý cytokeratinový (CK) koktejl, cytoplazmaticky pozitivní v EK a všech non-seminomech, v seminomu může být slabě, většinou tečkovitě (dot-like) pozitivní (27,31)). Jako metodu první volby se doporučuje zvolit panel dvou protilátek čítající CD117 a CD30(7). Je třeba mít na paměti, že jak pozitivita s OCT3/4, tak pozitivita s CD30 může vymizet po chemoterapii (32,33).
Seminom versus yolk sac tumor (YST)
Yolk sac tumor se vyskytuje ve velkém množství růstových variant, dle aktuální WHO klasifikace jich je popisováno 11(1). Histologickou podobnost se seminomem má na svědomí solidní růstová varianta YST, tvořena populací polygonálních buněk se světlou cytoplazmou a dobře rozpoznatelnými cytoplazmatickými membránami. Buňky YST jsou však více pleomorfní, stejně jako jejich jádra, těm navíc chybí hranatý vzhled typický pro seminom(34). V YST mohou být roztroušené lymfocyty, avšak nápadná příměs lymfocytárního infiltrátu chybí, stejně jako fibrózní septa (35). YST se navíc málokdy vyskytuje jen v jedné růstové variantě, typické jsou kombinace několika z nich v jednom tumoru (36). Důkladný sampling proto bude v tomto případě diagnosticky nejvíce užitečný, neboť s velkou pravděpodobností odhalí vedle solidní, seminoma-like varianty i další, nejčastěji mikrocystickou/retikulární. Dalším pomocným diagnostickým znakem YST je nález shluků hyalinních globulí, vyskytujících se nejčastěji intracytoplazmaticky. K odlišení YST od seminomu může být nápomocná i serologická hladina alfa-fetoproteinu (AFP), výrazně zvýšená u YST(37). Elevace AFP naopak vždy zpochybňuje diagnózu čistého seminomu, v takových případech by se vždy mělo uvažovat o smíšeném GT a pátrat po komponentě YST(38,39).
Jako IHC markery užitečné k odlišení YST od seminomu mohou být využity glypican 3 (difúzně silně pozitivní v YST, v seminomech spolehlivě negativní (35)), OCT3/4 (negativní v YST, pozitivní v seminomu (39)), nízko-molekulární CK (difúzně silně pozitivní v YST, v seminomech většinou negativní (40), AE1-3 může v seminomech vykazovat slabou dot-like pozitivitu (27,41)) a AFP (pozitivní v YST, avšak často fokálně a různě silně, navíc až 1/4 YST může být negativní (31), seminomy jsou negativní). Vzhledem k mínusům, které v rozvaze YST versus seminom mají CK a AFP, se jako nejlepší diskriminátor jeví panel dvou protilátek sestávající z glypicanu 3 a OCT3/4 (7).
Seminom se syncytiotrofoblastickými elementy versus choriokarcinom (obr. 2)
Image 2. Seminom s početnými syncytiotrofoblastickými elementy (A) a rozsáhlými hemoragiemi (B), obraz vzbuzující obavy z bifazického choriokarcinomu (syncytiotrofoblast + cytotrofoblast). Malobuněčná komponenta je nukleárně pozitivní v průkazu OCT3/4, což spolehlivě dokládá, že se jedná o buňky seminomu a nikoliv cytotrofoblastu (C). 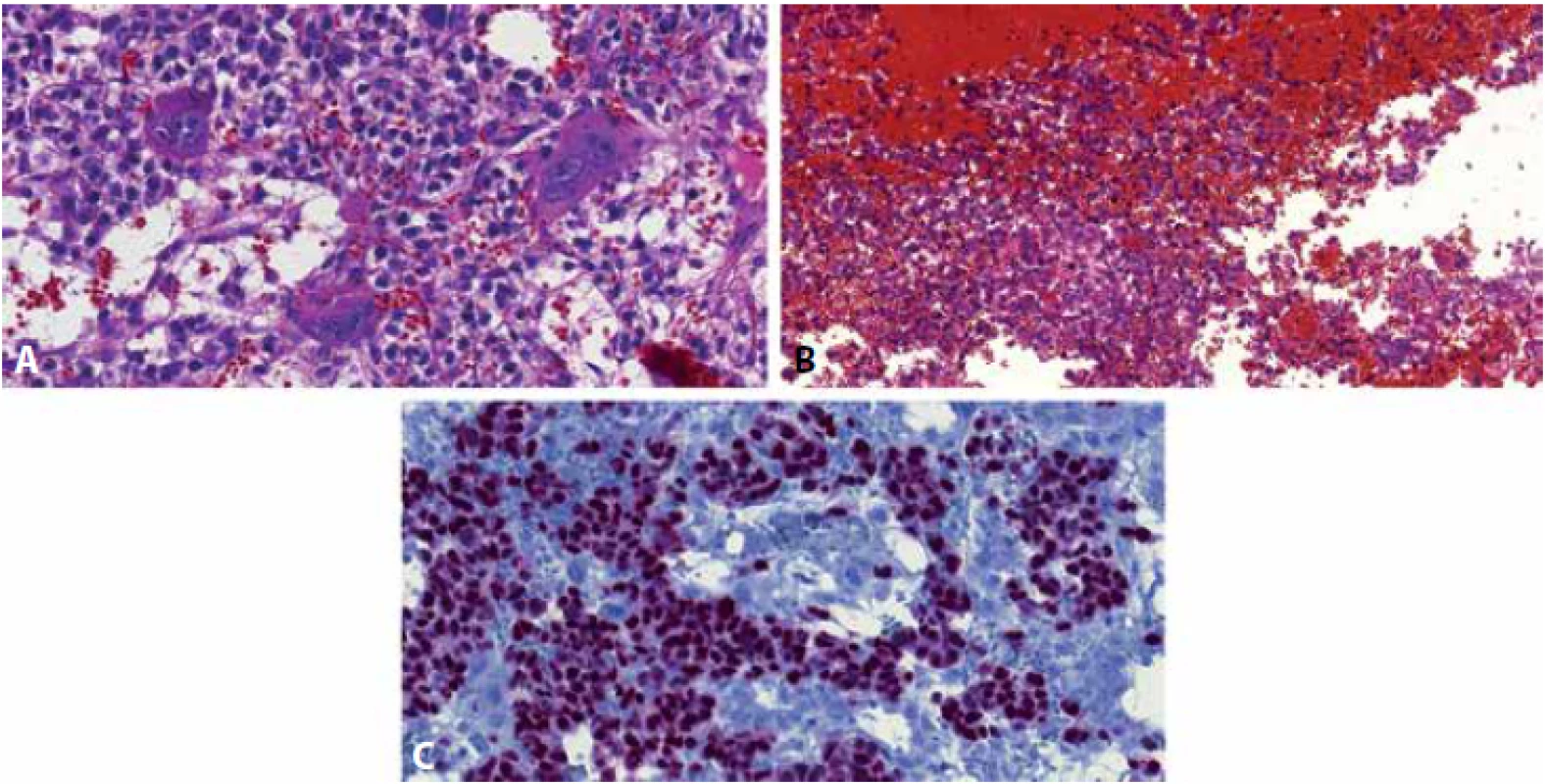
Je dobře známo, že 10-20 % seminomů může obsahovat syncytiotrofoblastické elementy (42,43). Ve většině případů jde o malé množství syncytiotrofoblastů izolovaně roztroušených mezi strukturami seminomu a nevzbuzujících tak obavy z choriokarcinomu. Existují však případy, kde jsou syncytiotrofoblasty přítomny ve shlucích, a zvláště pokud jsou obklopeny krvácivými plochami (což je časté), vyvstává otázka, zda se díváme na seminom se syncytiotrofoblasty či na bifazický choriokarcinom. Rozlišení těchto dvou jednotek je zásadní, jelikož seminom s příměsí syncytiotrofoblastů se léčí jako čistý seminom, kdežto choriokarcinom přirozeně jako non-seminom. Důležité je zhodnotit distribuci syncytiotrofoblastů, které jsou v seminomu fokální, v choriokarcinomu tvoří větší plochy zavzaté do celkové stavby tumoru. Diagnostické je potom rozpoznání povahy malobuněčné komponenty, zdali se jedná o buňky seminomu či cytotrofoblastu. V porovnání se seminomem jsou buňky cytotrofoblastu více pleomorfní. V tomto případě je IHC velmi nápomocná, konkrétně aplikace protilátky OCT3/4, která obarví buňky seminomu, kdežto buňky cytotrofoblastu budou negativní (15,39,44). Marker syncytiotrofoblastů, hCG, nemá v tomto případě význam, jelikož obarví syncytiotrofoblasty v choriokarcinomu i v seminomu, kdežto v cytotrofoblastu i buňkách seminomu bude negativní. Zvýšená sérová hladina hCG je typická pro choriokarcinom. Je však třeba mít na paměti, že hCG v séru může být zvýšeno u jakéhokoliv germinálního tumoru, včetně čistých seminomů bez syncytiotrofoblastických elementů (45,46). U seminomu se syncytiotrofoblasty je pak hCG zvýšeno pravidelně. Sérologický nález je tudíž nutné pečlivě korelovat s morfologií a IHC, v případě přetrvávajících pochybností bývá nejužitečnější obsáhlý sampling.
Molekulárně genetické vlastnosti
Germinální buňky jsou biologicky jedinečné, z důvodu zachování integrity genomu napříč generacemi jsou evolučně nuceny být relativně odolné k akumulaci de novo mutací (47). GT kopírují vlastnosti geminálních buněk, mutační zátěž je velmi nízká a hlavní genetickou abnormalitou jsou tak chromozomální numerické aberace. Diagnosticky nejhodnotnější aneuploidií je nadpočetný chromozom 12p (nejčastěji ve formě izochromozomu 12), definující tuto skupinu GT (48-50). Zisk chromozomu 12p vede k přerůstání GCNIS přes bazální membránu, nezávislosti germinálních buněk na Sertoliho buňkách a následnému vzniku invazivního tumoru (51). Z toho plyne, že i12 je přítomen i v prekurzorové GCNIS, ale pouze té, která je spojena s invazivním tumorem. V GCNIS, která není asociována s invazivním tumorem, chybí. Dalšími rekurentními, ale nikoliv konzistentně přítomnými aberacemi jsou zisky chromozomů 7,8,21, 22 a X (52). Mezi mutacemi jednotlivých genů je nejčastěji mutovaný gen KIT(52). Celo-exomové analýzy GT varlete neměly doposud praktické využití, ježto neodhalily diagnosticky, prognosticky či terapeuticky přínosné exprese mnohočetných genů (gene signatures), driver mutace ani porušené signální dráhy (52-55).
Germinální tumory bez souvislosti s GCNIS
Tato skupina je menší než předchozí a tumory sem zařazené výrazně vzácnější. Zahrnuje spermatocytický tumor (dříve spermatocytický seminom) a prepubertální typ yolk sac tumoru a teratomu. Jde o benigní či indolentní tumory, molekulárně geneticky nejasně vyhraněné (amplifikace 12p chybí), pacienti jsou bez vývojových poruch. Vzácně se prepubertální typy yolk sac tumoru a teratomu vyskytují i u postpubertálních pacientů (starších 12 let) (56,57), což může být způsobeno buď pozdním projevem tumoru, který má pacient od dětství či vzácněji opožděnou manifestací tumorů prepubertálního typu v dospělosti. Biologické chování těchto tumorů je potom stejné jako u „pravých“ prepubertálních typů. Naopak, prepubertální pacienti s poruchou pohlavního vývoje mohou vyvinout postpubertální typy tumorů (GT odvozené od GCNIS)(58,59).
Spermatocytický tumor (obr. 3)
Měl by být jasně vyčleněn od klasického seminomu, s kterým ho dlouhý čas kromě podobného názvu pojila domněnka, že se jedná o příbuzné tumory. Zásadní odlišností je biologické chování, prognóza, a z toho vyplývající terapeutický přístup k oběma lézím. Spermatocytický tumor je na rozdíl od klasického seminomu indolentní (pokud nepočítáme vzácné, ale vysoce agresivní případy spermatocytického tumoru vyskytujícího se se sarkomem (60)), metastatický rozsev byl doposud popsán jen u hrstky případů (61-65). Za zmínku stojí, že vůbec první případ metastazujícího spermatocytického tumoru popsal slovenský patolog Jozef Maťoška (65). Další odlišností spermatocytického tumoru je jeho výskyt exkluzivně ve varleti a bez asociace s jinými germinálními tumory. Histologicky roste difúzně či ve formě mnohočetných nodulů oddělených tenkými fibrózními septy. Charakteristické je edematózní stroma, které dává tumoru v malém zvětšení mikrocystický, takzvaně „potrhaný“ vzhled. Při větším zvětšení jsou patrné buňky s denzní eozinofilní cytoplazmou a kulatým jádrem, zastoupené ve třech velikostech: 1)nejmenší, připomínající lymfocyty, 2) prostřední, nejpočetnější, velikostně odpovídající buňkám seminomu a 3) největší, často mnohojaderné, dosahující až 100 mikrometrů v průměru (obr. 2). Lymfocytární infiltrát a granulomatózní reakce, typické pro seminom, jsou vzácné či chybí, stejně jako GCNIS v okolí tumoru.
Image 3. Spermatocytický tumor roste difúzně v edematózním stromatu, charakteristický je takzvaný „potrhaný“ vzhled, viditelný v malém zvětšení (A). Při větším zvětšení jsou patrné pravidelné buňky třech velikostí: 1) nejmenší, připomínající lymfocyty, 2) prostřední, nejpočetnější, velikostně odpovídající buňkám seminomu a 3) největší, často mnohojaderné, dosahující až 100 mikrometrů v průměru (B). Imunohistochemicky jsou nádorové buňky nukleárně pozitivní v průkazu DMRT1 (C) a negativní v reakci s NANOG (D) a OCT3/4 (E). 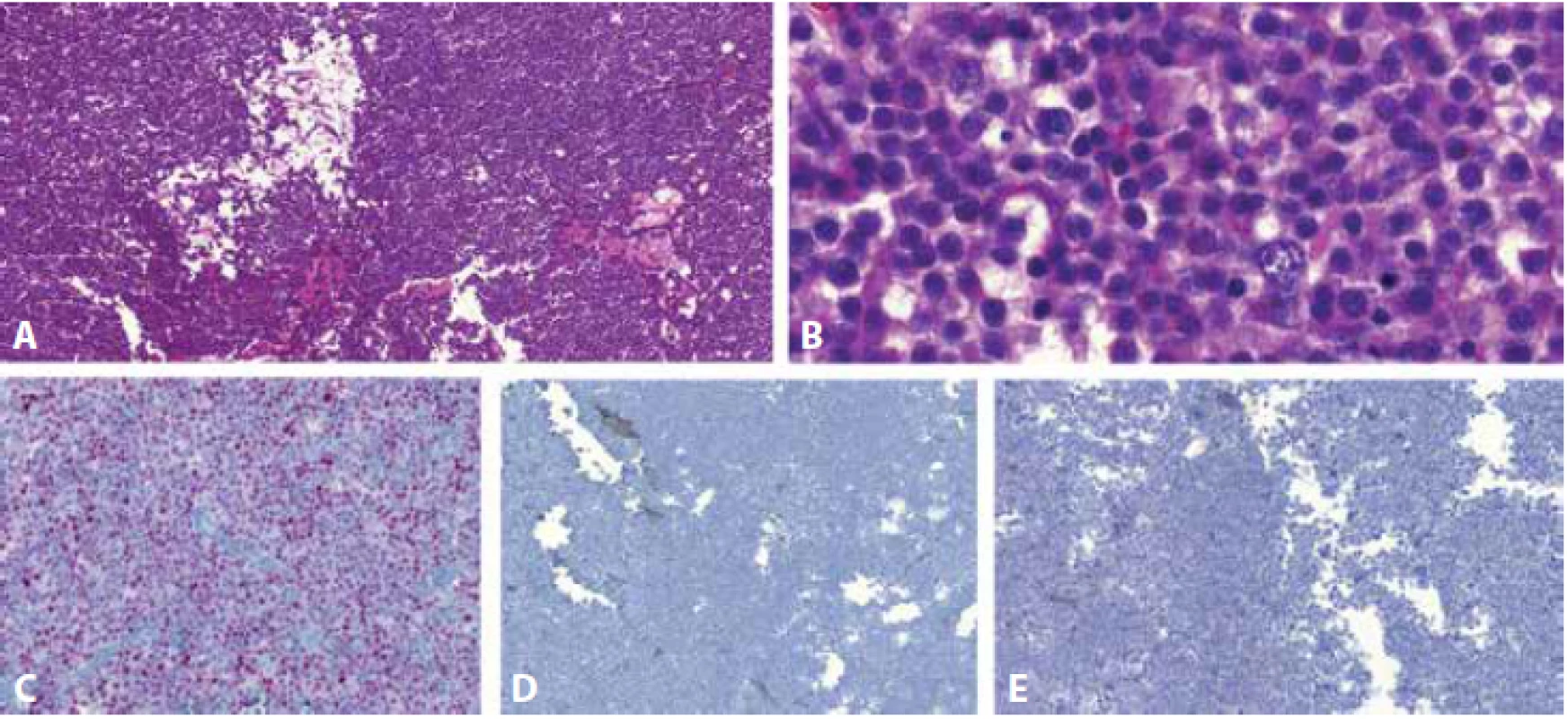
Spermatocytický tumor se od seminomu liší i prekurzorovou buňkou, pochází ze spermatogonií s počínající diferenciací do primárních spermatocytů (66), tedy z postnatální germinální buňky. Neexprimuje tudíž některé markery primordiálních germinálních buněk a gonocytů, jmenovitě OCT3/4, NANOG, LIN28, což je diagnosticky velmi užitečné (67). SALL4 a CD117, další z markerů běžně užívaných v diagnostice GT, barví spermatogonie a tím i spermatocytický tumor. Jako slibná protilátka se do nedávna jevila DMRT1, která však, jak se později ukázalo, rychle ztrácí senzitivitu a pro její labilitu je nevhodná k rutinnímu používání (66). Pokud protilátka funguje, je nukleárně pozitivní ve spermatogoniích a v menším rozsahu i ve zralých Sertoliho buňkách (68).
V nedávné době byla publikována rozsáhlá analýza celo-genomového sekvenování 29 spermatocytických tumorů, umožňující vhled do patogeneze tohoto relativně vzácného tumoru. Byly prokázány extenzivní aneuploidie postihující celé chromozomy, s rekurentními zisky chromozomu 9 a 20 a ztrátou chromozomu 7 (47). Na chromozomu 9 je umístěn gen DMRT1 inhibující přechod z mitózy do meiózy a na chromozomu 7 sídlí gen Stra8, iniciující meiózu. Kombinace zisku promitotických a ztráty promeitiockých chromozomů vede k neschopnosti kontroly buněčného dělení, diferencující se spermatogonie nejsou schopné vstoupit do meiózy a opakovaně se dělí mitózou. Též bylo prokázáno, že spermatocytické tumory jsou mutačně klidné, mutační zátěž odpovídá prepubertálním typům GT. Nejčastěji se vyskytují mutace FGFR3, HRAS a NRAS, avšak pravděpodobně jsou to pouze passenger mutace náhodně se akumulující během progrese tumoru, a nikoliv driver mutace (1,47). Amplifikace chromozomu 12p chybí.
Prepubertální typ teratomu
Zatímco postpubertální typ teratomu vyrůstá z maligní prekurzorové germinální buňky (buď ze seminomu či GCNIS) procesem diferenciace přes jeden ze základních typů GT (YST/EK/choriokarcinom) do teratomu (69,70), podobný patogenetický proces není prokázán u prepubertálního typu. Jsou mezi nimi patrné i morfologické rozdíly, prepubertální teratom nemá v okolí GCNIS, nemá cytologické atypie a častěji obsahuje organoidní struktury diferencované do té míry, že připomínají normální tkáně (imunofenotyp teratomu též koresponduje s imunofenotypem příslušné buněčné linie). Léze jako epidermoidní a dermoidní cysta a dobře diferencovaný neuroendokrinní tumor testis (karcinoid) patří do kategorie prepubertálního teratomu (1). Dělení teratomů na zralý a nezralý nemá význam, klinicky významné je pouze odlišení prepubertálního od postpubertálního typu (1). Prepubertální typ, alespoň dle dostupných informací, nemetastazuje (71,72), kdežto metastatický potenciál postpubertálních teratomů se pohybuje mezi 22-37 % (1,73). V teratomu prepubertálního typu nebyly doposud prokázány žádné molekulárně genetické abnormality (1,74). Amplifikace chromozomu 12p z definice chybí (56).
Prepubertální typ yolk sac tumoru
Histologicky i imunohistochemicky je prepubertální typ YST neodlišitelný od svého postpubertálního protějšku (75). Liší se od něj absencí GCNIS a tím, že se nejčastěji vyskytuje v čisté formě, kdežto postpubertální YST je typicky k vidění jako komponenta smíšeného GT. V kombinaci s jiným tumorem byl prepubertální YST spatřen pouze s prepubertálním teratomem (76). Molekulárně geneticky byly prokázány zisky chromozomů 1q, 12(p13), 20q a 22 a ztráty 1p, 4 a 6q (74,77-79). Amplifikace krátkého raménka chromozomu 12 chybí.
Image 4. Smíšený germinální tumor sestávající z komponenty embryonálního karcinomu (EK) a yolk sac tumoru (YST). EK je složen ze solidně, pseudoglandulárně či alveolárně uspořádaných anaplastických epiteloidních buněk. YST je tvořen drobnějšími, zploštělými germinálními buňkami uspořádanými mikrocysticky a retikulárně (A). Protilátka glypican 3 barví membranozně a cytoplazmaticky buňky YST, struktury EK jsou negativní (B). CD30 je cytoplazmaticky a membranozně pozitivní v EK, negativní v YST (C). OCT3/4 je nukleárně pozitivní v EK, v YST negativní (D). 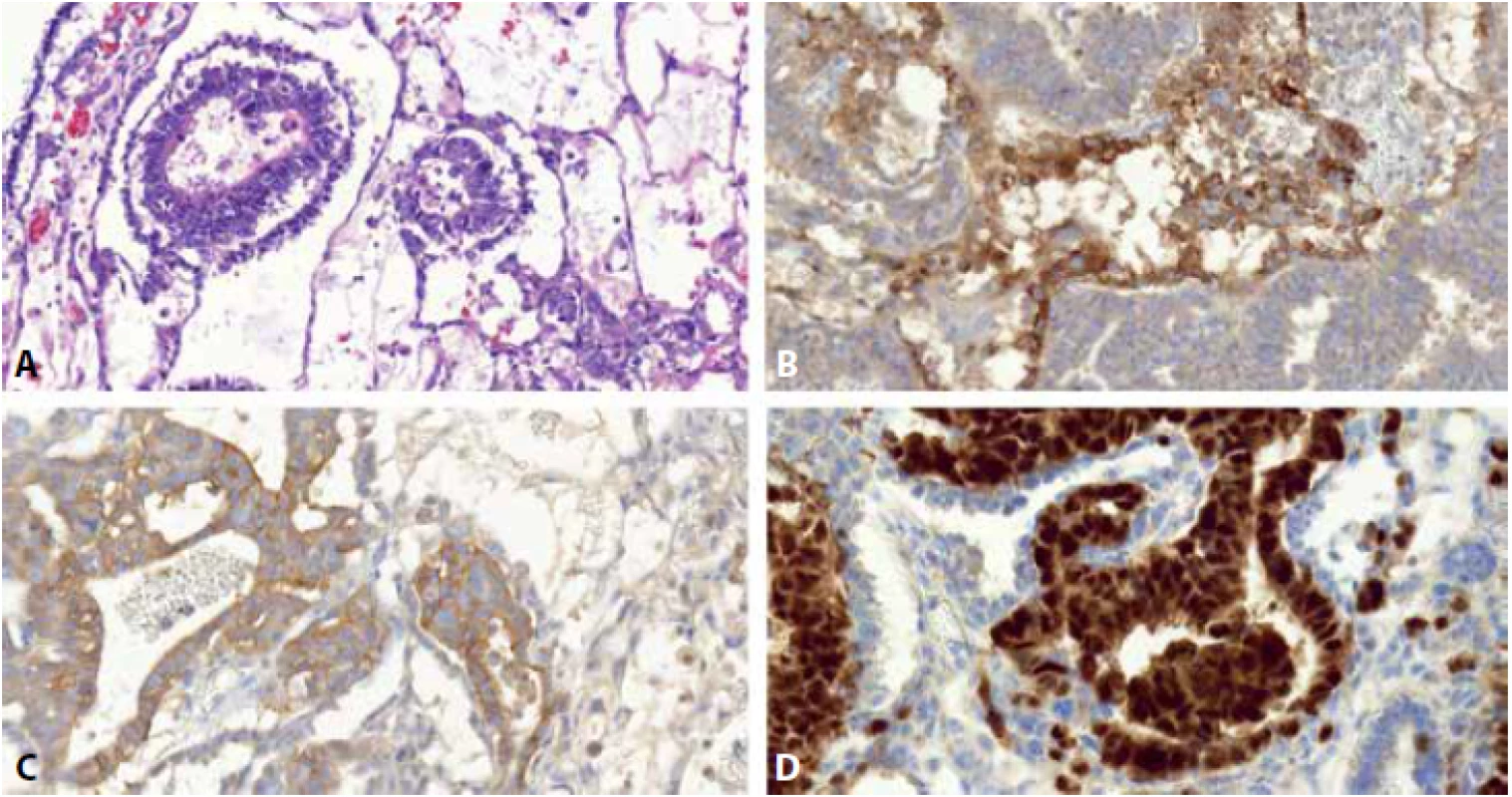
Sex-cord stromální tumory
Sertoli cell tumory, NOS
Skupina Sertoli cell tumorů, NOS (SCT) je tvořena v mnoha aspektech velmi nesourodými tumory. Z hlediska morfologie je za jediný charakteristický znak považována přítomnost tubulárních struktur. Podobně neuceleně se jeví imunoprofil, dle aktuální WHO klasifikace je 50 % SCT pozitivních s inhibinem a 60-70 % s kalretininem (markery sex-cord stromální diferenciace) (1,80,81), což stěží lze považovat za definici a pouze to reflektuje jejich heterogenitu.Rovněž molekulární charakteristika je vágní, některé SCT nesou mutace genu CTNNB1 kódujícího β-catenin (80,82) nebo aneuploidie chromozomu X, 2 a 19 (83) a jiné ne. Popsaná heterogenita možná z části spočívá i v tom, že kategorie SCT v sobě skrývá více jednotek. Jako příklad můžeme uvést tumor, který v nedávné době popsala naše skupina nejprve pod názvem pankreatický analog solidního pseudopapilárního tumoru varlete (84), později byl název upraven na solidní pseudopapilární tumor (SPT) varlete (85,86). Morfologicky jde o uniformní tumory, velmi podobné SPT pankreatu, s přesně definovaným imunoprofilem (pozitivita mj. s β-cateninem, CD10, CD56, NSE, negativita s inhibinem, kalretininem, chromograninem a markery germinálních buněk) a genotypem (mutace genu CTNNB1), jež je identický se SPT pankreatu (87-89). Na základě tohoto zjištění jsme navrhovali Sertoli cell tumory, NOS „očistit“ od SPT varlete, neboť tyto jsou evidentně distinktní jednotkou zasluhující být v samostatné kategorii (85,86). Skupina prestižních amerických autorů tento koncept zásadně odmítá, neuznává SPT varlete jako samostatnou jednotku a řadí je právě pod SCT (90). Nicméně, oproti mlhavě definovaným SCT, pod které při troše snahy může spadat téměř jakýkoliv primární non-germinální tumor varlete, SPT varlete představují morfologicky uniformní skupinu tumorů s přesně definovaným imunoprofilem a genotypem, jež je identický se SPT pankreatu. Navíc, stejné tumory jsou již dlouhodobě uznávanou jednotkou v ovariální patologii (91) a není důvod, proč by identické tumory nemohly být i ve varleti a proč by nelogicky měly patřit pod SCT, zatímco v ovariu jsou dávno nazývány solidní pseudopapilární tumor.
Sertoli cell tumory, NOS mohou růst v solidních světlobuněčných formacích a mohou obsahovat příměs lymfocytárního infiltrátu (92). V takových případech může být velmi obtížné je odlišit od seminomu. V převážné většině případů mohou být odlišeny s pomocí morfologie. SCT mají v porovnání se seminomy menší jádra, méně viditelná jadérka a méně mitóz. Dalším užitečným znakem je tubulární architektonika SCT. Je však třeba mít na paměti, že tubulární formace se mohou vyskytnout i v seminomu (93-95). Naopak, SCT nebude mít nikdy v okolí tumoru přítomnou GCNIS, kdežto seminom pravidelně. Pokud musíme přistoupit k IHC, je nejužitečnějším diskriminačním markerem SALL4 (pozitivní v seminomu, negativní v SCT). Jako protilátky s opačnou reaktivitou se doporučují použít markery sex-cord stromální diferenciace, nejlépe inhibin a kalretinin. Jak je, nicméně, zmíněno výše, velká část SCT je s inhibinem a kalretininem negativní a tak se v této situaci přikládá větší význam reaktivitě se SALL4.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Květoslava Michalová, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
Sources
1. Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part A: Renal, Penile, and Testicular Tumours. Eur Urol 2016; 70(1): 93-105.
2. EAU guidelines: Testicular cancer. https://uroweb.org/guideline/testicular-cancer/
3. Coffin CM, Ewing S, Dehner LP. Frequency of intratubular germ cell neoplasia with invasive testicular germ cell tumors. Histologic and immunocytochemical features. Arch Pathol Lab Med 1985; 109(6): 555-559.
4. Chieffi P. An up-date on epigenetic and molecular markers in testicular germ cell tumors. Intractable Rare Dis Res 2017; 6(4): 319-321.
5. Miettinen M, Wang Z, McCue PA, Sarlomo-Rikala M, Rys J, et al. SALL4 expression in germ cell and non-germ cell tumors: a systematic immunohistochemical study of 3215 cases. Am J Surg Pathol 2014; 38(3): 410-420.
6. Grieco V, Banco B, Giudice C, Mosca F, Finazzi M. Immunohistochemical expression of the KIT protein (CD117) in normal and neoplastic canine testes. J Comp Pathol 2010; 142(2-3): 213-217.
7. Ulbright TM, Tickoo SK, Berney DM, Srigley JR. Best practices recommendations in the application of immunohistochemistry in testicular tumors: report from the International Society of Urological Pathology consensus conference. Am J Surg Pathol 2014; 38(8): e50-59.
8. Cope NJ, McCullagh P, Sarsfield PT. Tumour responding accessory cells in testicular seminoma: an immunohistochemical study. Histopathology 1999; 34(6): 510-516.
9. Wei YQ, Hang ZB, Liu KF. In situ observation of inflammatory cell-tumor cell interaction in human seminomas (germinomas): light, electron microscopic, and immunohistochemical study. Hum Pathol 1992; 23(4): 421-428.
10. Kao CS, Ulbright TM, Young RH, Idrees MT. Testicular embryonal carcinoma: a morphologic study of 180 cases highlighting unusual and unemphasized aspects. Am J Surg Pathol 2014; 38(5): 689-697.
11. Pierce GB, Abell MR. Embryonal carcinoma of the testis. Pathol Annu 1970; 5 : 27-60.
12. Grigor KM. Embryonal carcinoma of testis simulating seminoma. J Clin Pathol 1987; 40(11): 1388.
13. Santagata S, Ligon KL, Hornick JL. Embryonic stem cell transcription factor signatures in the diagnosis of primary and metastatic germ cell tumors. Am J Surg Pathol 2007; 31(6): 836-845.
14. Cao D, Allan RW, Cheng L, Peng Y, Guo CC, et al. RNA-binding protein LIN28 is a marker for testicular germ cell tumors. Hum Pathol 2011; 42(5): 710-718.
15. Cao D, Li J, Guo CC, Allan RW, Humphrey PA. SALL4 is a novel diagnostic marker for testicular germ cell tumors. Am J Surg Pathol 2009; 33(7): 1065-1077.
16. Rajpert-De Meyts E, Skakkebaek NE. Expression of the c-kit protein product in carcinoma-in-situ and invasive testicular germ cell tumours. Int J Androl 1994; 17(2): 85-92.
17. Izquierdo MA, Van der Valk P, Van Ark-Otte J, Rubio G, Germa-Lluch JR, et al. Differential expression of the c-kit proto-oncogene in germ cell tumours. J Pathol 1995; 177(3): 253-258.
18. Strohmeyer T, Reese D, Press M, Ackermann R, Hartmann M, et al. Expression of the c-kit proto-oncogene and its ligand stem cell factor (SCF) in normal and malignant human testicular tissue. J Urol 1995; 153(2): 511-515.
19. Leroy X, Augusto D, Leteurtre E, Gosselin B. CD30 and CD117 (c-kit) used in combination are useful for distinguishing embryonal carcinoma from seminoma. J Histochem Cytochem 2002; 50(2): 283-285.
20. Lau SK, Weiss LM, Chu PG. D2-40 immunohistochemistry in the differential diagnosis of seminoma and embryonal carcinoma: a comparative immunohistochemical study with KIT (CD117) and CD30. Mod Pathol 2007; 20(3): 320-325.
21. Iczkowski KA, Butler SL, Shanks JH, Hossain D, Schall A, et al. Trials of new germ cell immunohistochemical stains in 93 extragonadal and metastatic germ cell tumors. Hum Pathol 2008; 39(2): 275-281.
22. Idrees M, Saxena R, Cheng L, Ulbright TM, Badve S. Podoplanin, a novel marker for seminoma: A comparison study evaluating immunohistochemical expression of podoplanin and OCT3/4. Ann Diagn Pathol 2010; 14(5): 331-336.
23. Kato Y, Sasagawa I, Kaneko M, Osawa M, Fujita N, et al. Aggrus: a diagnostic marker that distinguishes seminoma from embryonal carcinoma in testicular germ cell tumors. Oncogene 2004; 23(52): 8552-8556.
24. Yu H, Pinkus GS, Hornick JL. Diffuse membranous immunoreactivity for podoplanin (D2-40) distinguishes primary and metastatic seminomas from other germ cell tumors and metastatic neoplasms. Am J Clin Pathol 2007; 128(5): 767-775.
25. de Jong J, Stoop H, Gillis AJ, van Gurp RJ, van de Geijn GJ, et al. Differential expression of SOX17 and SOX2 in germ cells and stem cells has biological and clinical implications. J Pathol 2008; 215(1): 21-30.
26. Nonaka D. Differential expression of SOX2 and SOX17 in testicular germ cell tumors. Am J Clin Pathol 2009; 131(5): 731-736.
27. Cheville JC, Rao S, Iczkowski KA, Lohse CM, Pankratz VS. Cytokeratin expression in seminoma of the human testis. Am J Clin Pathol 2000; 113(4): 583-588.
28. Ferreiro JA. Ber-H2 expression in testicular germ cell tumors. Hum Pathol 1994; 25(5): 522-524.
29. Hittmair A, Rogatsch H, Hobisch A, Mikuz G, Feichtinger H. CD30 expression in seminoma. Hum Pathol 1996; 27(11): 1166-1171.
30. Pallesen G, Hamilton-Dutoit SJ. Ki-1 (CD30) antigen is regularly expressed by tumor cells of embryonal carcinoma. Am J Pathol 1988; 133(3): 446-450.
31. Niehans GA, Manivel JC, Copland GT, Scheithauer BW, Wick MR. Immunohistochemistry of germ cell and trophoblastic neoplasms. Cancer 1988; 62(6): 1113-1123.
32. Sung MT, Jones TD, Beck SD, Foster RS, Cheng L. OCT4 is superior to CD30 in the diagnosis of metastatic embryonal carcinomas after chemotherapy. Hum Pathol 2006; 37(6): 662-667.
33. Berney DM, Shamash J, Pieroni K, Oliver RT. Loss of CD30 expression in metastatic embryonal carcinoma: the effects of chemotherapy? Histopathology 2001; 39(4): 382-385.
34. Emerson RE, Ulbright TM. Morphological approach to tumours of the testis and paratestis. J Clin Pathol 2007; 60(8): 866-880.
35. Ye H, Ulbright TM. Difficult differential diagnoses in testicular pathology. Arch Pathol Lab Med 2012; 136(4): 435-446.
36. Kao CS, Idrees MT, Young RH, Ulbright TM. Solid pattern yolk sac tumor: a morphologic and immunohistochemical study of 52 cases. Am J Surg Pathol 2012; 36(3): 360-367.
37. Talerman A. Endodermal sinus (yolk sac) tumor elements in testicular germ-cell tumors in adults: comparison of prospective and retrospective studies. Cancer 1980; 46(5):1213-1217.
38. Milose JC, Filson CP, Weizer AZ, Hafez KS, Montgomery JS. Role of biochemical markers in testicular cancer: diagnosis, staging, and surveillance. Open Access J Urol 2011; 4 : 1-8.
39. Jones TD, Ulbright TM, Eble JN, Baldridge LA, Cheng L. OCT4 staining in testicular tumors: a sensitive and specific marker for seminoma and embryonal carcinoma. Am J Surg Pathol 2004; 28(7): 935-940.
40. Eglen DE, Ulbright TM. The differential diagnosis of yolk sac tumor and seminoma. Usefulness of cytokeratin, alpha-fetoprotein, and alpha-1-antitrypsin immunoperoxidase reactions. Am J Clin Pathol 1987; 88(3): 328-332.
41. Miettinen M, Virtanen I, Talerman A. Intermediate filament proteins in human testis and testicular germ-cell tumors. Am J Pathol 1985; 120(3): 402-410.
42. von Hochstetter AR, Sigg C, Saremaslani P, Hedinger C. The significance of giant cells in human testicular seminomas. A clinico-pathological study. Virchows Arch A Pathol Anat Histopathol 1985; 407(3): 309-322.
43. Mostofi FK, Sesterhenn IA. Pathology of germ cell tumors of testes. Prog Clin Biol Res 1985; 203 : 1-34.
44. Looijenga LH, Stoop H, de Leeuw HP, de Gouveia Brazao CA, Gillis AJ, et al. POU5F1 (OCT3/4) identifies cells with pluripotent potential in human germ cell tumors. Cancer Res 2003; 63(9): 2244-2250.
45. Hes O, Pivovarcikova K, Stehlik J, Martinek P, Vanecek T, et al. Choriogonadotropin positive seminoma-a clinicopathological and molecular genetic study of 15 cases. Ann Diagn Pathol 2014; 18(2): 89-94.
46. Weissbach L, Bussar-Maatz R, Lohrs U, Schubert GE, Mann K, et al. Prognostic factors in seminomas with special respect to HCG: results of a prospective multicenter study. Seminoma Study Group. Eur Urol 1999; 36(6):601-608.
47. Giannoulatou E, Maher GJ, Ding Z, Gillis AJM, Dorssers LCJ, et al. Whole-genome sequencing of spermatocytic tumors provides insights into the mutational processes operating in the male germline. PLoS One 2017; 12(5): e0178169.
48. Sandberg AA, Meloni AM, Suijkerbuijk RF. Reviews of chromosome studies in urological tumors. III. Cytogenetics and genes in testicular tumors. J Urol 1996; 155(5): 1531-1556.
49. Atkin NB, Baker MC. Specific chromosome change, i(12p), in testicular tumours? Lancet 1982; 2(8311): 1349.
50. Atkin NB, Baker MC. i(12p): specific chromosomal marker in seminoma and malignant teratoma of the testis? Cancer Genet Cytogenet 1983; 10(2): 199-204.
51. Sheikine Y, Genega E, Melamed J, Lee P, Reuter VE, et al. Molecular genetics of testicular germ cell tumors. Am J Cancer Res 2012; 2(2): 153-1567.
52. Litchfield K, Summersgill B, Yost S, Sultana R, Labreche K, et al. Whole-exome sequencing reveals the mutational spectrum of testicular germ cell tumours. Nat Commun 2015; 6 5973.
53. Brabrand S, Johannessen B, Axcrona U, Kraggerud SM, Berg KG, et al. Exome sequencing of bilateral testicular germ cell tumors suggests independent development lineages. Neoplasia 2015; 17(2): 167-174.
54. Cutcutache I, Suzuki Y, Tan IB, Ramgopal S, Zhang S, et al. Exome-wide sequencing shows low mutation rates and identifies novel mutated genes in seminomas. Eur Urol 2015; 68(1): 77-83.
55. Taylor-Weiner A, Zack T, O’Donnell E, Guerriero JL, Bernard B, et al. Genomic evolution and chemoresistance in germ-cell tumours. Nature 2016; 540(7631): 114-118.
56. Zhang C, Berney DM, Hirsch MS, Cheng L, Ulbright TM. Evidence supporting the existence of benign teratomas of the postpubertal testis: a clinical, histopathologic, and molecular genetic analysis of 25 cases. Am J Surg Pathol 2013; 37(6): 827-835.
57. Oosterhuis JW, Stoop JA, Rijlaarsdam MA, Biermann K, Smit VT, et al. Pediatric germ cell tumors presenting beyond childhood? Andrology 2015; 3(1): 70-77.
58. Muller J, Skakkebaek NE, Ritzen M, Ploen L, Petersen KE. Carcinoma in situ of the testis in children with 45,X/46,XY gonadal dysgenesis. J Pediatr 1985; 106(3): 431-436.
59. Slowikowska-Hilczer J, Romer TE, Kula K. Neoplastic potential of germ cells in relation to disturbances of gonadal organogenesis and changes in karyotype. J Androl 2003; 24(2): 270-278.
60. Trivedi P, Pasricha S, Gupta A. Spermatocytic seminoma associated with undifferentiated sarcoma: a rare case report. Indian J Pathol Microbiol 2011; 54(1): 138-140.
61. Lombardi M, Valli M, Brisigotti M, Rosai J. Spermatocytic seminoma: review of the literature and description of a new case of the anaplastic variant. Int J Surg Pathol 2011; 19(1): 5-10.
62. Mikuz G, Bohm GW, Behrend M, Schafer G, Colecchia M, et al. Therapy-resistant metastasizing anaplastic spermatocytic seminoma: a cytogenetic hybrid: a case report. Anal Quant Cytopathol Histpathol 2014; 36(3): 177-182.
63. Horn T, Schulz S, Maurer T, Gschwend JE, Kubler HR. Poor efficacy of BEP polychemotherapy in metastatic spermatocytic seminoma. Med Oncol 2011; 28 Suppl 1: S423-425.
64. Steiner H, Gozzi C, Verdorfer I, Mikuz G, Bartsch G, et al. Metastatic spermatocytic seminoma--an extremely rare disease: Part 2. Eur Urol 2006; 49(1): 408-409.
65. Matoska J, Ondrus D, Hornak M. Metastatic spermatocytic seminoma. A case report with light microscopic, ultrastructural, and immunohistochemical findings. Cancer 1988; 62(6): 1197-1201.
66. Roth LM, Michal M, Michal M, Jr., Cheng L. Protein expression of the transcription factors DMRT1, TCLF5, and OCT4 in selected germ cell neoplasms of the testis. Hum Pathol 2018; 82 : 68-75.
67. Cummings OW, Ulbright TM, Eble JN, Roth LM. Spermatocytic seminoma: an immunohistochemical study. Hum Pathol 1994; 25(1): 54-59.
68. Jorgensen A, Nielsen JE, Blomberg Jensen M, Graem N, Rajpert-De Meyts E. Analysis of meiosis regulators in human gonads: a sexually dimorphic spatio-temporal expression pattern suggests involvement of DMRT1 in meiotic entry. Mol Hum Reprod 2012; 18(11): 523-534.
69. Ulbright TM. Germ cell tumors of the gonads: a selective review emphasizing problems in differential diagnosis, newly appreciated, and controversial issues. Mod Pathol 2005; 18 Suppl 2: S61-79.
70. Ulbright TM. Gonadal teratomas: a review and speculation. Adv Anat Pathol 2004; 11(1): 10-23.
71. Grady RW, Ross JH, Kay R. Epidemiological features of testicular teratoma in a prepubertal population. J Urol 1997; 158(3 Pt 2): 1191-1192.
72. Visfeldt J, Jorgensen N, Muller J, Moller H, Skakkebaek NE. Testicular germ cell tumours of childhood in Denmark, 1943-1989: incidence and evaluation of histology using immunohistochemical techniques. J Pathol 1994; 174(1): 39-47.
73. Leibovitch I, Foster RS, Ulbright TM, Donohue JP. Adult primary pure teratoma of the testis. The Indiana experience. Cancer 1995; 75(9): 2244-2250.
74. Mostert M, Rosenberg C, Stoop H, Schuyer M, Timmer A, et al. Comparative genomic and in situ hybridization of germ cell tumors of the infantile testis. Lab Invest 2000; 80(7): 1055-1064.
75. Ulbright TM, Young RH. Testicular and paratesticular tumors and tumor-like lesions in the first 2 decades. Semin Diagn Pathol 2014; 31(5): 323-381.
76. Williamson SR, Delahunt B, Magi-Galluzzi C, Algaba F, Egevad L, et al. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70(4): 335-346.
77. Perlman EJ, Hu J, Ho D, Cushing B, Lauer S, et al. Genetic analysis of childhood endodermal sinus tumors by comparative genomic hybridization. J Pediatr Hematol Oncol 2000; 22(2): 100-105.
78. Schneider DT, Schuster AE, Fritsch MK, Hu J, Olson T, et al. Multipoint imprinting analysis indicates a common precursor cell for gonadal and nongonadal pediatric germ cell tumors. Cancer Res 2001; 61(19): 7268-7276.
79. Veltman IM, Schepens MT, Looijenga LH, Strong LC, van Kessel AG. Germ cell tumours in neonates and infants: a distinct subgroup? APMIS 2003; 111(1): 152-160; discussion 60.
80. Perrone F, Bertolotti A, Montemurro G, Paolini B, Pierotti MA, et al. Frequent mutation and nuclear localization of beta-catenin in sertoli cell tumors of the testis. Am J Surg Pathol 2014; 38(1): 66-71.
81. Zhang C, Ulbright TM. Nuclear localization of beta-catenin in sertoli cell tumors and other sex cord-stromal tumors of the testis: an immunohistochemical study of 87 cases. Am J Surg Pathol 2015; 39(10): 1390-1394.
82. Colecchia M. Observations on the paper “sclerosing Sertoli cell tumor of the testis: a clinicopathologic study of 20 cases” by Kao et al. Am J Surg Pathol 2014; 38(8): 1160.
83. Verdorfer I, Hollrigl A, Strasser U, Susani M, Hartmann A, et al. Molecular-cytogenetic characterisation of sex cord-stromal tumours: CGH analysis in sertoli cell tumours of the testis. Virchows Arch 2007; 450(4): 425-431.
84. Michal M, Bulimbasic S, Coric M, Sedivcova M, Kazakov DV, et al. Pancreatic analogue solid pseudopapillary neoplasm arising in the paratesticular location. The first case report. Hum Pathol 2016; 56 : 52-56.
85. Michalova K, Michal M, Jr., Kazakov DV, Sedivcova M, Hes O, et al. Primary signet ring stromal tumor of the testis: a study of 13 cases indicating their phenotypic and genotypic analogy to pancreatic solid pseudopapillary neoplasm. Hum Pathol 2017; 67 : 85-93.
86. Michalova K, Michal M, Sedivcova M, Kazakov DV, Bacchi C, et al. Solid pseudopapillary neoplasm (SPN) of the testis: Comprehensive mutational analysis of 6 testicular and 8 pancreatic SPNs. Ann Diagn Pathol 2018; 35 : 42-47.
87. Notohara K, Hamazaki S, Tsukayama C, Nakamoto S, Kawabata K, et al. Solid-pseudopapillary tumor of the pancreas: immunohistochemical localization of neuroendocrine markers and CD10. Am J Surg Pathol 2000; 24(10): 1361-1371.
88. Serra S, Chetty R. Revision 2: an immunohistochemical approach and evaluation of solid pseudopapillary tumour of the pancreas. J Clin Pathol 2008; 61(11): 1153-1159.
89. Tanaka Y, Kato K, Notohara K, Hojo H, Ijiri R, et al. Frequent beta-catenin mutation and cytoplasmic/nuclear accumulation in pancreatic solid-pseudopapillary neoplasm. Cancer Res 2001; 61(23): 8401-8404.
90. Ulbright TM, Young RH. Pseudo-”solid pseudopapillary neoplasms” of the testis: in reality Sertoli cell tumors. Hum Pathol 2019; 83 : 228-230.
91. Deshpande V, Oliva E, Young RH. Solid pseudopapillary neoplasm of the ovary: a report of 3 primary ovarian tumors resembling those of the pancreas. Am J Surg Pathol 2010; 34(10): 1514-1520.
92. Henley JD, Young RH, Ulbright TM. Malignant Sertoli cell tumors of the testis: a study of 13 examples of a neoplasm frequently misinterpreted as seminoma. Am J Surg Pathol 2002; 26(5): 541-550.
93. Ulbright TM, Young RH. Seminoma with tubular, microcystic, and related patterns: a study of 28 cases of unusual morphologic variants that often cause confusion with yolk sac tumor. Am J Surg Pathol 2005; 29(4): 500-505.
94. Young RH, Finlayson N, Scully RE. Tubular seminoma. Report of a case. Arch Pathol Lab Med 1989; 113(4): 414-416.
95. Zavala-Pompa A, Ro JY, el-Naggar AK, Amin MB, Ordonez NG, et al. Tubular seminoma. An immunohistochemical and DNA flow-cytometric study of four cases. Am J Clin Pathol 1994; 102(4): 397-401.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2020 Issue 3-
All articles in this issue
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Praktické využití imunohistochemie a genetiky v diagnostice nádorů varlat
- Využití imunohistochemie v patologii prostaty
- Gossypibóm – imitujúci recidívu nádoru mandibuly: kazuistika
- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Karcinom z Merkelových buněk se skvamózní diferenciací – kazuistika
- Praktická imunohistochémia v genitourinárnej patológii
- Profesor Ivo Šteiner osmdesátiletý
- Monitor aneb nemělo by vám uniknout, že...
- Monitor aneb nemělo by vám uniknout, že...
- Diagnostic Histopathology of Tumors
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie v patologii prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


