-
Medical journals
- Career
Využití imunohistochemie při diagnostice lézí vývodného močového traktu
Authors: Kristýna Pivovarčíková; Marián Švajdler; Ondřej Hes
Authors‘ workplace: Šiklův ústav patologie LF UK a FN Plzeň
Published in: Čes.-slov. Patol., 56, 2020, No. 3, p. 140-152
Category: Reviews Article
Overview
Univerzální imunohistochemický marker či imunohistochemický panel pro uroteliální origo neexistuje. K užití jednotlivých imunohistochemických markerů je vždy nutno přistupovat v kontextu konkrétní zvažované diferenciální diagnózy. V tomto přehledovém článku nastíníme tři základní okruhy využití imunohistochemie a vybraných molekulárně genetických metod při diagnostice lézí vývodného močového traktu – odlišení benigních a maligních změn urotelu, nejčastější „pitfalls“ a non-uroteliální neoplázie.
Klíčová slova:
uroteliální karcinom – imunohistochemie – nested varianta uroteliálního karcinomu – uroteliální carcinoma in situ – karcinom prostaty
Uroteliální karcinom (UC) je dobře znám pro své divergentní diferenciace a množství morfologických variant a podtypů. Při užívání imunohistochemie v rámci lézí vylučovacího močového traktu je vždy nutné mít na paměti základní pravidlo - univerzální imunohistochemický marker či imunohistochemický panel pro uroteliální origo neexistuje. K užití jednotlivých imunohistochemických markerů (ať už samostatně, jako tzv. single marker, nebo v kombinaci několika barvení) je vždy nutno přistupovat v kontextu konkrétního případu a konkrétní zvažované diferenciální diagnózy (1). Markery užitečné a diagnostické v konkrétním případě mohou v jiném případě vést ke zcela nesprávné diagnóze, proto je vždy nutné k jednotlivým případům přistupovat individuálně.
IMUNOHISTOCHEMICKÉ MARKERY UROTELIÁLNÍHO ORIGA
Mezi pro uroteliální origo nejčastěji užívaná imunohistochemická barvení patří CK7, CK20, HMWCK (high molecular weight cytokeratins), p63, GATA3, procento udávané pozitivity se u těchto markerů v literatuře samozřejmě liší.
UC je jedním z mála tumorů, který často souběžně koexprimuje CK7 a CK20. CK7 je asi nejspolehlivější a nejznámější marker urotelu, s udávanou frekvencí až 80-100 % UC (2,3), zároveň je však markerem zcela nespecifickým. V literatuře udávaná pozitivita CK20 u UC se v různých studiích velmi liší (22-64 %) (2,4-7), dle našich zkušeností však v praxi dosahuje hodnot vyšších, než je udáváno v literatuře. Více jak 2/3 UC pak koexprimuje oba markery současně, což je znak který není příliš častý u jiných tumorů (mezi jinými nádory, u nichž je udávána koexprese CK7 a CK20 zmiňujeme např. mucinózní adenokarcinom ovaria, adenokarcinom pankreatobiliárního typu, adenokarcinom žaludku).
GATA3 je nukleární transkripční faktor, jehož pozitivita je v různých pracích udávána ve více jak 90 % UC (8,9). Barvení GATA3 je však dobře známo svou častou pozitivitou u velmi širokého spektra různých lézí (tab. 1) (8,10). V kontrastu k počátečnímu nadšení tak nízká specificita limituje užití GATA3 jako univerzálního imunohistochemického markeru uroteliáního origa. Exprese GATA3 klesá s dediferenciací tumoru (2) a GATA3 má též limitovaný diagnostický význam v diagnostice sarkomatoidního UC (s udávanou pozitivitou pouze u cca 16 % těchto případů (11)).
Table 1. Exprese GATA3 různými tkáněmi a nádory – převzato Cox et kol. (10). 
Tzv. high molecular weight cytokeratins (HMWCK, z nichž nejčastěji v této indikaci užívaný cytokeratin CK5/6) jsou pozitivní až u 80 % UC (7), avšak též zcela postrádají specificitu pro uroteliální origo. P63 je pozitivní u 73-88 % UC (2,12,13) a stejně jako u jiných markerů - exprese klesá s dediferenciací tumoru (2,12).
Uroplakiny jsou markery terminální uroteliální diferenciace (14). Jako první byla na trh uvedena protilátka proti uroplakinu III, který je považován za specifický marker uroteliální diferenciace neoplázie, avšak též dobře známý jsou ne příliš vysokou sensitivitou (dle literatury sensitivita 20-60 % (2,7,15,16)). Navíc se zdá, že exprese tohoto markeru je výrazně ovlivněna stupněm diferenciace tumoru (klesá se zvyšujícím se gradem tumoru) (2). Po relativním neúspěchu této protilátky byl na trh následně uveden i další z rodiny uroplakinů – uroplakin II. Tato protilátka by měla dosahovat identické specificity jako uroplakin III, avšak vyšší sensitivity (17-19), některé práce udávají sensitivitu až 83 % (9). I tato protilátka se však netěší přílišné oblibě, v reálné praxi totiž většinou nedosahuje v literatuře udávané sensitivity.
BENIGNÍ VERSUS MALIGNÍ
Jak na poli plochých tak papilárních uroteliálních neinvazivních lézí se v klinické praxi často setkáváme s případy, které nelze snadno stratifikovat z hlediska dignity a působí tak nemalé obtíže. V těchto případech pak většinou nejsou stanovena jasná a jednoznačná morfologická diagnostická kritéria a tedy se celkem logicky nabízí sáhnout po nějakém užitečném imunohistochemickém markeru. Bohužel, na tomto poli není imunohistochemie příliš nápomocna a naopak její užití často patologa akorát svede na scestí. Byla publikována celá řada prací využívajících různá barvení k odlišení dignity uroteliálních lézí, výstup do každodenní patologické praxe je však velice limitován, imunohistochemický profil jednotlivých lézí nebyl ani orientačně definován. Zlatým standardem tak zůstává důraz na morfologii léze a selský rozum odečítajícího patologa. Z hlediska diferenciálně diagnostické rozvahy budou v následujícím textu probrány tři obtížné okruhy – uroteliální ploché léze, low-grade uroteliální papilární neoplázie a uroteliální léze s invertovaným typem růstu.
Uroteliální ploché léze
Mezi tzv. uroteliální ploché léze mohou být řazeny reaktivní změny/atypie urotelu, uroteliální proliferace nejistého maligního potenciálu (dříve nazývaná uroteliální hyperplázie), uroteliální dysplázie a uroteliální carcinoma in situ (CIS).
Dlouho by se dalo hovořit o možnostech odlišení reaktivních změn urotelu a uroteliálního karcinoma in situ (high-grade uroteliální plochá léze) a o užití různých imunohistochemických barvení, ovšem i po dlouhé diskuzi lze dojít k jen velmi neuspokojivým a rozporuplným závěrům. Konečný dopad na pacienta je však především v této indikaci velice zásadní, neboť neléčený CIS nese signifikantní riziko progrese do invazivního karcinomu (20,21) (bez léčby cca 54 % případů CIS progreduje do svalovinu infiltrujícího uroteliálního karcinomu (22)) a proto perzistující (refrakterní) CIS je indikací k radikální cystektomii (22).
Četní autoři se snažili do rutinní praxe zavést různé pomocné markery, všechny však nakonec ukázaly ve vlastní klinické praxi velkou nespolehlivost. Většina autorů ve svých studiích využívala kohorty případů, u nichž již na základě prosté morfologie (a barvení HE) byla definitivní diagnóza (benigní versus maligní) zcela evidentní a nepůsobily žádné diagnostické rozpaky. V reálné praxi však neaplikujeme imunohistochemické barvení na případy, u nichž již z barvení HE jednoznačně víme, na kterou stranu spektra se máme přiklonit. K imunohistochemickému vyšetření se snižujeme až v případech, u nichž jsme si v základním barvení hematoxylin-eosinem o dignitě léze nejistí. A právě pouze velmi limitované množství prací se soustředilo na studium různých imunohistochemických barvení v morfologicky nejasných/nevyhraněných případech (23). Studie pak porovnávaly různé markery, především CK20, p53, dále pak např. i CD44, Ki67, AMACR, HER2/neu (23-28).
Opakovaně byl různými autory k odlišení reaktivních změn a uroteliálního CIS doporučován panel protilátek CK20, p53 a CD44, tedy si zaslouží komentář. CK20 je v non-neoplastickém epitelu limitováno pouze na povrchovou vrstvu deštníčkových buněk (umbrella cells), pozitivita CK20 v celé tloušťce epitelu je považována za marker high-grade uroteliální neoplázie (24,25,29). p53 může být pozitivní v non-neoplastickém urotelu (pozitivita většinou slabá, nerovnoměrná a predominantně v bazální a parabazální části urotelu), zatímco u CIS je udávána silná a difúzní pozitivita p53 ve většině případů (24,25). U CIS je typická ztráta exprese CD44 (nutné je mít na paměti, že reaktivita CD44 v CIS je závislá na jeho specifickém histologickém typu, neboť v tzv. pagetoidním typu CIS může být v CD44 zastižena zvýšená reaktivita atypických reaktivních buněk na pozadí, avšak negativita vlastních buněk CIS – celkově však může působit jako pozitivní (30)). Zatímco normální urotel je CD44 pozitivní v bazální a parabazální vrstvě a urotel s reaktivními změnami vykazuje CD44 reaktivitu v celé tloušťce urotelu (24). CK20 by tak měl být marker CIS, naopak CD 44 marker reaktivní uroteliální léze.
Reálné klinické zkušenosti však jasně ukazují, že tyto výsledky nejsou pravidlem a často lze bohužel v těchto barveních dosáhnout falešnou pozitivitu (27,31). Imunohistochemické vyšetření tak opravdu nemůže být upřednostňováno před vlastní morfologií vyšetřované léze a imunohistochemický profil léze musí být vždy hodnocen v kontextu morfologie. Dále je nutno mít na paměti (jak už bylo naznačeno výše), že uroteliální CIS může vykazovat různé morfologické varianty (32) a ne všechny případy mají plně vyznačenou jadernou pleomorfii, postižení urotelu v celé tloušťce či vysoký nukleocytoplazmatický poměr (30).
Již takto velmi nejasné situaci pak vůbec nepomáhá existence kategorií uroteliální proliferace nejistého maligního potenciálu a uroteliální dysplázie (3), tedy lézí s vysokou interobservační variabilitou a jen vágní morfologickou definicí. Obtížně klasifikovatelné atypie urotelu u pacienta s předchozí anamnézou UC by však vždy měli být varovným znakem (23).
Low-grade uroteliální papilární neoplázie
Low-grade uroteliální papilární léze jsou skupinou zahrnující uroteliální papilom, papilární uroteliální neoplázii nízkého maligního potenciálu (papillary urothelial neoplasia of low malignant potential/PUNLMP) a low-grade neinvazivní papilární UC, jejich vzájemné odlišení může často vyvolat diagnostické rozpaky. Ve všech případech se jedná o exofytické papilární léze s různě vyjádřenou architektonickou a cytologickou alterací urotelu (u uroteliálního papilomu pouze s tvorbou papil urotelu normálního vzhledu a tloušťky, u PUNLMP s tvorbou papil a mírným rozšířením epiteliální vrstvy, se zcela minimálními cytologickými atypiemi a u low-grade UC s vyznačeným papilárním uspořádáním a mírnými cytoarchitektonickými atypiemi (3)).
Ojedinělé práce se snažily imunohistochemicky definovat jednotlivé léze a najít vhodný pomocný marker pro nejasné případy, avšak ne příliš úspěšně – v klinické praxi se tak v této indikaci imunohistochemická barvení nepoužívají. Zcela okrajově zde pouze zmíníme, že PUNLMP a uroteliální papilom by dle dostupných dat měly vykazovat pozitivitu CK20 jen v povrchových vrstvách, naopak UC bývá difúzně pozitivní. Zkoušeny byly i jiné markery (např. FGFR3, MUC1, p53, Ki67 (33-35)), avšak prakticky bez odezvy.
Dobrou zprávou pro patologa je tak alespoň fakt, že z hlediska stratifikace pacientů pro další léčbu, urologové nedělají rozdíl v managementu u pacientů s PUNLMP a low-grade neinvazivním UC a obě léze spadají do stejné low-risk kategorie doporučených postupů Evropské asociace urologů (EAU) (22), odlišení tedy má jen minimální klinický význam (nikoliv léčebný), spočívající ve stigmatizaci pacienta „karcinomovou“ diagnózou.
Uroteliální léze s invertovaným typem růstu
Poslední skupinou, u níž se patolog často dostává do diagnostických rozpaků, jsou uroteliální léze s invertovaným způsobem růstu. Mezi nimi nutno zmínit nenádorové změny urotelu (kterými jsou von Brunnovy čepy a tzv. „floridní brunnerióza“, cystitis cystica a glandularis), benigní neoplázie (invertovaný uroteliální papilom) a maligní nádorové změny (zahrnující predominantně invertovaně rostoucí UC, kolonizaci von Brunnových čepů uroteliálním CIS a tzv. nested variantu UC a large nested variantu UC).
Floridní brunnerióza (též nazývaná floridní proliferace von Brunnových čepů) je častou lézí urotraktu, mikroskopicky charakterizovaná proliferací okrouhlých pravidelných uroteliálních hnízd v lamina propria, místy s tvorbou lumin, někdy i cystickou dilatací (cystitis cystica), bez cytologických atypií, bez zvýšené mitotické aktivity. Cystitis glandularis je variací na dané téma, kdy čepy v lamina propria jsou tvořeny buď žlazovými strukturami, lemovanými cylindrickým (může nabývat mucinózní vzhled) či kubickým epitelem (tzv. typická glandulární cystitis, epitel může být i mnohovrstevný) nebo je charakterizovaná přítomností nepravidelných, často větvených tubulárních struktur, lemovaných buňkami vzhledu pohárkových buněk, celkově tak léze svým vzhledem připomíná sliznici tlustého střeva (tzv. intestinální typ cystitis glandularis).
Invertovaný papilom má typicky během cystoskopického vyšetření klinikem udávaný hladký povrch, histologicky netvoří exofytické papily (důležitý znak) a nikdy neinvaduje do muscularis propria. Skládá se z jemných nesplývajících fibrovaskulárních papil lemovaných urotelem se zachovalou buněčnou stratifikací, normální tloušťkou a vzhledem (bez cytologických atypií), na povrchu s jasně vyjádřenou vrstvou deštníčkových buněk. Cytokeratin CK20 reaguje pouze v povrchové vrstvě deštníčkových buněk a proliferace (značená pomocí protilátky Ki67) je u invertovaného papilomu nízká (<5 %) (3).
Nested UC (NVUC) je variantou UC s jen minimálními cytologickými atypiemi, nízkou mitotickou aktivitou a absencí stromální reakce. Architektonicky většinou vytváří malá, těsně nahloučená hnízda (imponující pouze jako invertovaný růst nádoru), místy anastomozující ve větší ostrůvky. Large nested varianta UC (LNVUC) se pak vyznačuje invazivní invertovanou komponentou tvořící objemnější hnízda, zároveň pak i častěji bývá doprovázen exofytickou papilární komponentou UC (36,37). V obou případech se jedná o velmi blandně vyhlížející tumor, který je však dobře znám svou vysokou agresivitou, podmíněnou především tím, že ve většině případů se již v době diagnózy jedná o pokročilý (tzv. high-stage) tumor (38). V literatuře typicky udávaným jednoznačným diagnostickým kritériem pro nested UC je přítomnost infiltrace muscularis propria (3,39). Různé práce zkoušely četné imunohistochemické markery pro odlišení tohoto tumoru od reaktivních změn urotelu (p21, p27, p53, EGF-R, bcl-2 a MIB1 (40), MIB1, p53, p 27 a CK20 (39)). Všechny tyto však u obou lézí vykazují značnou variabilitu barvení, překryvný imunoprofil a specifické „cut-off“ hodnoty tak nelze pro diagnostické účely nastavit (39). Práce autorů Zhong a kol. prokázala přítomnost TERT promotorové mutace u 85 % případů NVUC a 80 % případů LNVUC, naopak benigní léze napodobující tyto UC byly ve všech případech negativní. To ukazuje, že genetický průkaz TERT mutace by mohl být dobrým biomarkerem v této indikaci, samozřejmě ne zcela spolehlivým (41).
NA CO SI DÁT POZOR, ANEB NEJČASTĚJŠÍ „PITFALLS“ MOČOVÉHO TRAKTU
Nefrogenní adenom (NA)
Nefrogenní adenom (obr. 1), dříve označovaný též jako nefrogenní metaplázie, je relativně vzácná benigní léze, která se může vyskytnout prakticky kdekoliv od renální pánvičky až po uretru, s nejvyšší četností v močovém měchýři (42,43). Léze často vzniká v souvislosti s chronickým zánětem, lithiázou, či předchozí instrumentací močových cest a traumatem. Mazal a kol. ve své práci prokázali, že NA je odvozen od tubulárních epitelií, které se implantovaly v místech uroteliálního poškození (44). Nefrogenní adenom může mít mikroskopicky různý vzhled, vykazovat tubulární, cystické, papilární uspořádání, či tvořit plochou lézi. Sestává z kubických až nízkých cylindrických buněk s eozinofilní cytoplazmou a „cvočkovitým“ vzhledem.
Image 1. Nefrogenní adenom - papilární struktury kryté jednou vrstvou kubického epitelu (A) s typickým “cvočkovitým/hobnail” vzhledem (B). Léze je pozitivní v imunohistochemickém průzaku CK7 (C), CK20 (D), PAX8 (E) a v racemáze/AMACR (F). 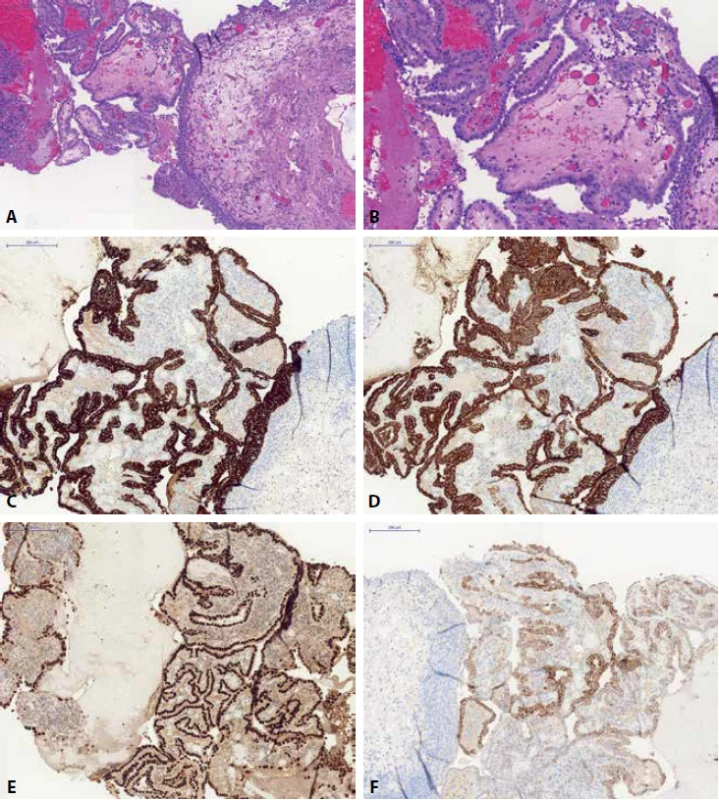
Nefrogenní adenom je pozitivní v CK7, racemáze (AMACR), PAX8, PAX2, CD10, EMA a vimentinu. Exprese GATA3 byla prokázána až u 40 % případů NA (45). Cytokeratiny a GATA3 tak v diferenciální diagnostice NA a uroteliální neoplázie nejsou zcela nejvhodnějšími markery. Opatrně pak nutno přistupovat i k PAX8 a vimentinu, neboť tyto dva markery mohou být pozitivní i u části UC, proto je nutno postupovat obezřetně, nejlépe v panelu různých protilátek. I přes různými studiemi prokázanou pozitivitu PAX8 u 17 % UC močového měchýře (46) a pozitivitu PAX8 u nenádorových urotelií renální pánvičky a močovodu a u 23 % uroteliálních karcinomů renální pánvičky (47) však PAX8 považujeme za nejlepší marker v této indikaci. Dalším dobrým markerem v diferenciální diagnóze NA a UC může být i p63, které je v NA negativní (48).
Endometrióza
Endometrióza (obr. 2) se v močovém traktu, stejně jako v jiných lokalitách, histologicky vyznačuje přítomností endometriálních žlázek a endometriálního stromatu (nemusí být vždy přítomno), v okolí často s depozity hemosiderinu. Stejně tak lze v močovém traktu najít i endocervikózu (mucinózní endocervikální typ epitelu ve stěně např. močového měchýře) a endosalpingiózu (epitelové struktury luminálně s řasinkami). Všechny tři léze mohou být přítomny současně, toto pak bývá označováno pojmen „müllerianóza“. Imunohistochemicky je endometrióza (ale i endosalpingióza a endocervikóza) pozitivní v průkazu PAX8 a estrogenových receptorů (ER). Endometriální stroma je pozitivní v průkazu CD10.
Image 2. Část stěny močového měchýře s ložisky endometriózy. Na povrchu patrný urotel, hluboko ve stěně pak ložiska vitálních endometriální struktur, propagující se až hluboko do muscularis propria (A). Patrná je přítomnost glandulární i stromální komponenty (B). Imunohistochemicky je typická jaderná pozitivita glandulárních struktur v PAX8 (C) a pozitivita endometriálního stromatu v CD10 (D). 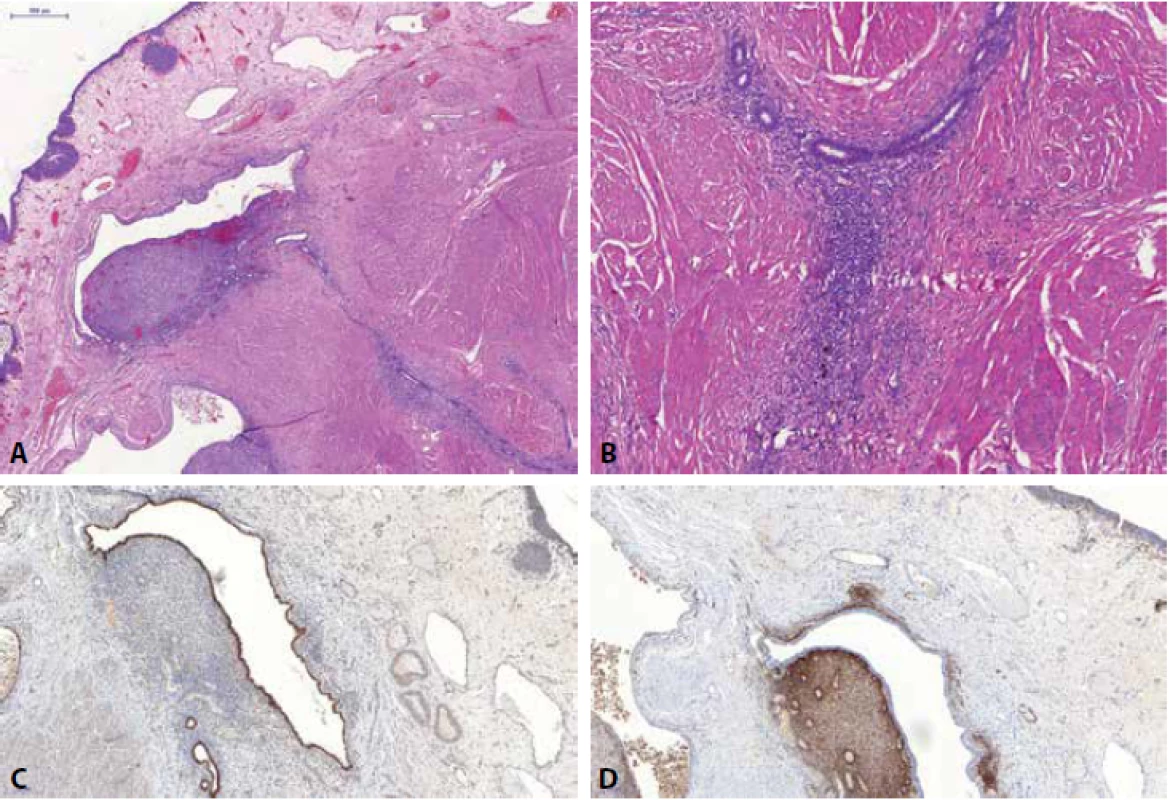
Paragangliom
Paragangliom (obr. 3) je raritní lézí vyskytující se v močovém měchýři, představuje cca 0,05 % všech tumorů močového měchýře (3) a vytváří intramurální masu. Svým vzhledem odpovídá paragangliomům v jiných lokalizacích – tumor sestává z polygonálních (chromafinních) buněk, uspořádaných v kompaktní hnízda, separovaná delikátními septy s jemnou vaskulární sítí (tvořící tak tzv. typické „Zellballen“). Na periferii „Zellballen“ a rozptýlené mezi polygonálními chromafiními nádorovými buňkami jsou tzv. Sustentakulární buňky, které jsou pozitivní v imunohistochemickém průkazu S100, S100 pak též někdy přibarvuje neoplastické chromafinní buňky, avšak slaběji než buňky sustentakulární (49). Paragangliom typicky exprimuje chromogranin A a synaptofyzin a je vimentin pozitivní. Až 83 % paragangliomů močového měchýře vykazuje expresi GATA3 (50). Naopak negativní je tumor v průkazu cytokeratinů (cytokeratiny mohou být zřídka pozitivní u spinálních paragangliomů (51)).
Image 3. Paragangliom močového měchýře tvořící tzv. typické „Zellballen“ (A) (B). Nádor je negativní v průkazu cytokeratinu CK7 (C), přítomna je jaderná exprese v GATA3 (D) a typická pozitivita nádorových buněk v chromograninu A (E). Na periferii „Zellballen“ a rozptýlené mezi polygonálními chromafinními nádorovými buňkami jsou tzv. Sustentakulární buňky, které jsou pozitivní v imunohistochemickém průkazu S100 (F). 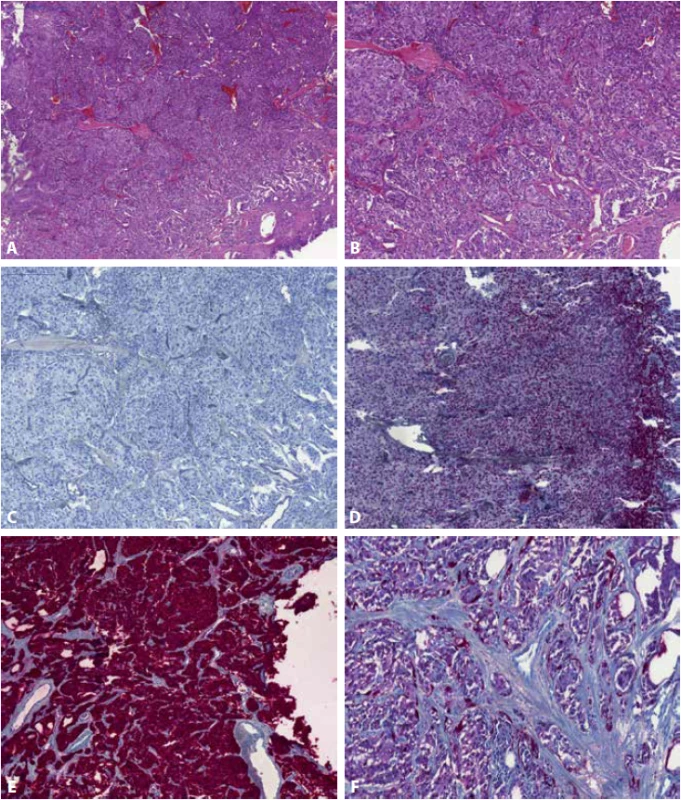
Prostata nebo urotel?
Je známo, že špatně diferencovaný (high-grade) prostatický adenokarcinom (PCa) může mít obdobnou morfologii jako high-grade UC (obr. 4). To může způsobit nemalé diagnostické rozpaky, popř. vést i k zcela nesprávné definitivní diagnóze s výrazným dopadem na léčebný postup u pacienta. Tento fenomén překryvné morfologie u UC a PCa byl poprvé popsán v roce 2002 autory Mai a kol. (52). V anglické literatuře pak bývají tyto nádory často označovány jako „prostatic adenocarcinoma mimicking urothelial carcinoma“ (53).
Image 4. High-grade prostatický adenokarcinom napodobující uroteliální karcinom (prostatic adenocarcinoma mimicking urothelial carcinoma) - nádor je velice heterogenní, zastiženy jednak okrsky utvářející papilární/pseudopapilární struktury, s četnými odběrovými artefakty (A, B), místy pak nádor vytváří solidní okrsky (C). V materiálu však byly zastiženy i struktury napodobující mikropapilární uspořádání (D) a naznačená tvorba glandulárních struktur (E). Jádra mají výrazná prominentní jadérka (F). 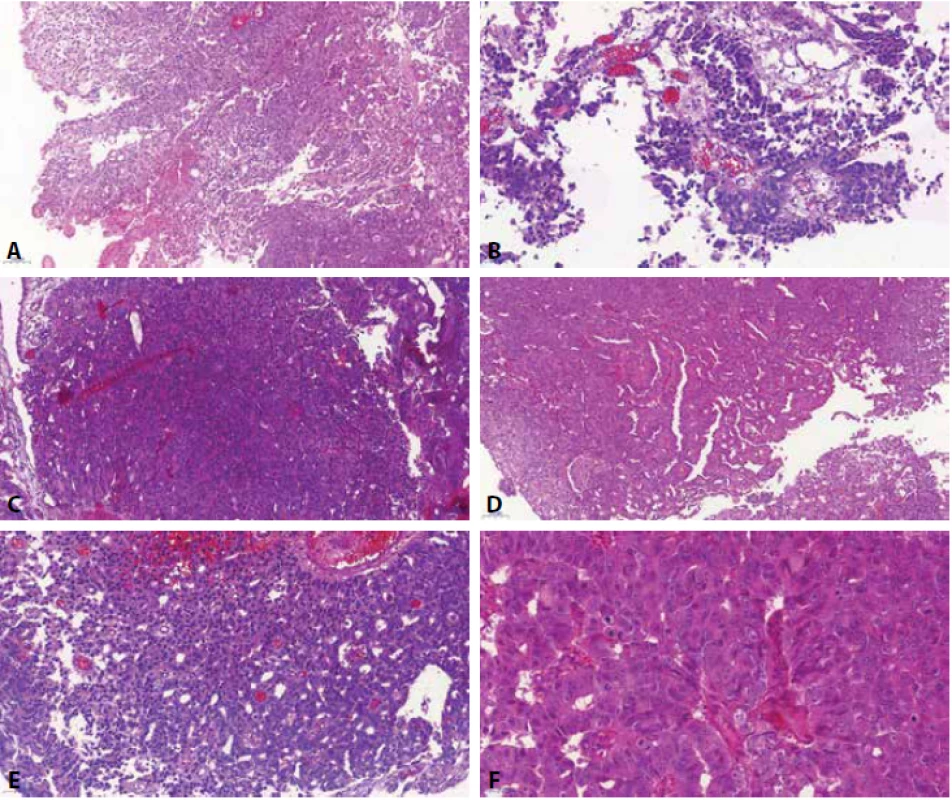
V klasických případech high-grade UC je popisována výrazná jaderná pleomorfie, eozinofilní cytoplazma, briskní mitotická aktivita a především současná přítomnost „povrchové neoplázie“ (papilární uroteliální neoplázie či ploché léze - CIS) ve vyšetřovaném vzorku. U prostatického adenokarcinomu naopak většinou očekáváme acinární či kribriformní architektoniku, minimální jaderný pleomorfismus, prominentní jadérka, „foamy“ až světlou cytoplazmu a nižší mitotickou aktivitu. High-grade PCa však dokáže vytvořit i zcela odlišný morfologický obraz, spíše odpovídající UC, a to včetně fokální tvorby papilárních/pseudopapilárních struktur (53).
Pro odlišení těchto dvou nádorových entit byla anglickou literaturou v minulosti doporučována celá škála imunohistochemických markerů. V současné době se však zdá, že největší specificity a senzitivity v této indikaci lze dosáhnout při užití dvou hlavních markerů – GATA3 (pozitivní v UC) a NKX3.1 (pozitivní v PCa) (obr. 5). Existuje velmi limitované množství studií prokazující pozitivitu GATA3 u PCa, např. Tian a kol. zaznamenali slabou a fokální pozitivitu GATA3 u 5 % případů high-grade UC (9), jiné studie na druhou stranu deklarují absolutní negativitu PCa při GATA3 barvení (54). GATA3 je však často pozitivní v benigních prostatických žlázkách vykazujících postradiační atypie (55), což je též nutné brát v potaz. Naopak exprese NKX3.1 u UC nebyla ve velkých studií prokázána (13,56) a sensitivita NKX3.1 u PCa je nejčastěji udávána okolo 90 % případů (13,56,57) – tyto skutečnosti tak činní NKX3.1 jedním z nejlepších markerů v této indikaci a zároveň též patrně nejlepším v současné době dostupným a známým markerem prostatického origa vůbec.
Image 5. Imunohistochemický obraz u high-grade prostatického adenokarcinomu napodobujícího uroteliální karcinom - nádorové buňky jsou negativní v CK7 - pozitivní vnitřní kontrola je povrchový urotel, který je pozitivní (A), negativní v CK20 (B) a GATA3 (C). Naopak nádor exprimuje NKX3.1 - jaderná pozitivita (D). 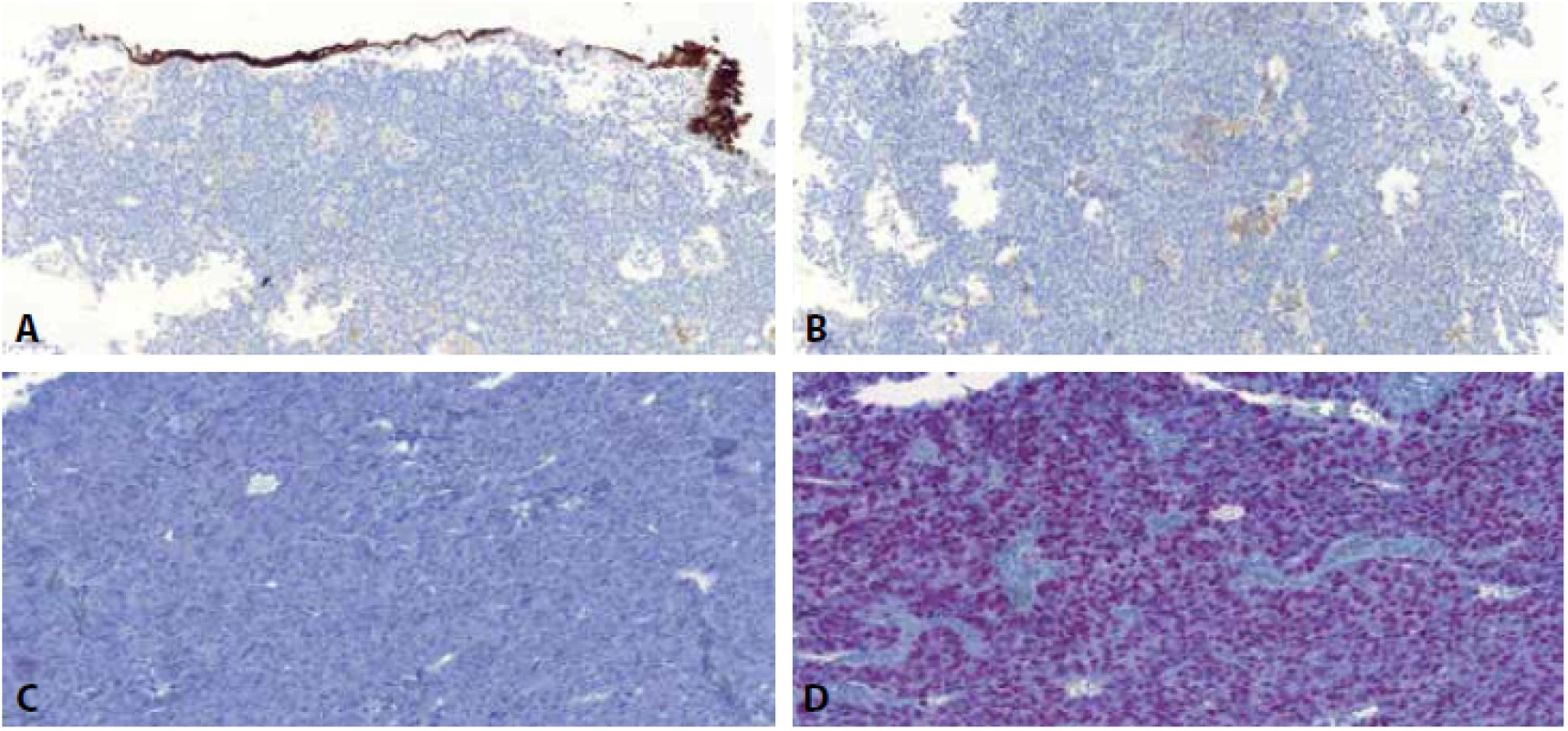
K ostatním markerům uvádíme jen krátký komentář. Koexprese CK7 a CK20 má v této indikaci limitované užití, neboť oba markery mohou být pozitivní v části PCa (4,6,58,59). HMWCK může být pozitivní u malé části PCa (2-6 % PCa (6,59)). Ani p63 není spolehlivý marker – byla popsána skupina prostatických adenokarcinomů s aberatní expresí p63 (60-62). Z konvenčně používaných prostatických markerů – PSMA je pozitivní u 17 % UC (63), PAPH až u 11-18 % UC (13, 59), PSA může být negativní u části high-grade PCa (3-27 % high-grade PCa (6,57-59,64)) a exprese PSA je též velmi variabilní u pacientů po hormonální léčbě (65).
NÁDOR JINÝ NEŽ UROTELIÁLNÍ KARCINOM?
Účelem tohoto přehledového článku není okomentovat všechny léze a neoplázie vyskytující se v močovém traktu. Proto dále zde krátce okomentujeme pouze tři relativně častější nádory - dle našeho názoru léze, na které lze v rámci větší patologické praxe běžně narazit, jsou diagnostickou výzvou a často posílány ke konzultačnímu vyšetření. Skoro nejzásadnější je při diagnostice těchto lézí znalost anamnézy pacienta, neboť v rámci diferenciální diagnózy by vždy mělo být pomýšleno na sekundární postižení urotraktu (ať už metastatické, či šíření tzv. per continuitatem).
Problematika diferenciální diagnostiky uroteliálního versus renálního origa neoplázie bude zmíněna v přehledovém článku o využití imunohistochemie u renálních neoplázií.
Neoplázie vývodných močových cest se skvamózním vzhledem
Primární dlaždicobuněčný karcinom močového měchýře je vzácnou lézí, s udávanou frekvencí výskytu méně než 3 % nádorů močového měchýře (3,66,67). Diferenciálně diagnosticky je důležité odlišit primární „čistý“ dlaždicobuněčný karcinom, uroteliální karcinom s dlaždicobuněčnou diferenciací a sekundární postižení (prorůstání/metastáza) především z anogenitální oblasti (např. u žen – prorůstání karcinomu cervixu). Dobře známý je fakt, že cervikální karcinom může napodobovat často variabilní a nespecifický vzhled UC, stejně tak cervikální karcinom může kolonizovat povrchový urotel a napodobovat tak uroteliální CIS (68). Imunohistochemie obecně není moc nápomocná.
Primární dlaždicobuněčný karcinom močového měchýře vykazuje stejný imunohistochemický profil jako dlaždicobuněčné karcinomy v jiných lokalitách, s pozitivitou cytokeratinů CK5/6, CK7, p63 a p40. Imunohistochemický profil je tedy zcela překryvný s UC (obr. 6).
Image 6. High-grade uroteliální karcinom u mladé pacientky (37 let). Nádor roste hluboko ve stěně močového měchýře, podrůstá normální urotel (A) a infiltruje až mezi hladkosvalové svazky muscularis propria (B). Fokálně povrchový urotel se známkami high grade uroteliální ploché léze, dosahující až kvalit carcinoma in situ (C). Nádor je difúzně pozitivní v cytokeratinech CK7 (D) a CK20 (E), převážně negativní v GATA3 (reagují jen ojedinělé buňky) (F). Nádor je difúzně silně pozitivní v p63 a exprese p16 vykazuje signifikantní pozitivitu. 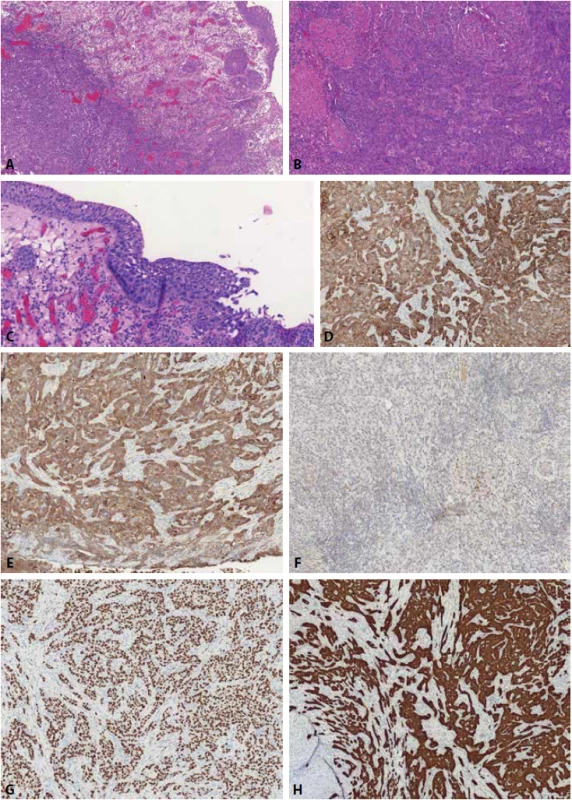
Mluvíme-li specificky o odlišení prorůstajícího dlaždicobuněčného karcinomu cervixu a UC s dlaždicobuněčnou diferenciací je nutné mít na paměti, že až 1/3 cervikálních karcinomů je GATA3 pozitivní (8,68,69). Cervikální je obyčejně CK7+/CK20-, naopak UC je většinou CK7+/CK20+, na pozitivitu CK20 však nelze spoléhat. Exprese proteinu p16 je u dlaždicobuněčného karcinomu cervixu využívána jako surogátní imunohistochemický marker pro průkaz high-risk HPV (negativita p16 hovoří spíše proti cervikálnímu origu, avšak může být i v malém množství případů cervikálního karcinomu (68)). p16 pozitivitu lze prokázat cca u 1/3 UC a u 1/3 primárních skvamózních karcinomů močového měchýře (70), p16 pozitivita však v močových cestách nekoreluje s přítomností HPV infekce (70,71) (p16 tak v močovém měchýři nemůže být považován za surogátní marker HPV infekce (70)). Vlastní molekulárně-genetický průkaz HPV má nejasný význam – různé studie došly ke konfliktním výsledkům pokud jde o roli HPV v etiologii tumorů močového měchýře. Většina doposud uskutečněných studií se soustředila na detekci HPV DNA ve vzorku, minimální množství studií analyzovalo expresi virového genomu v nádorových buňkách (72). Část studií resolutně odmítá asociaci tumorů močového měchýře s průkazem HPV (73), jiné udávají prevalenci HPV mezi 0-60 % (práce detekující jak HPV DNA, tak zkoumající expresi onkogenů E6/E7 na úrovni mRNA a/nebo E7 proteinů) (70,72,74-77). Ani průkaz TERT promotorové mutace nemá v této indikaci význam, TERT promotorová mutace byla popsána u 80 % primárních skvamózních karcinomů močového měchýře (78), u více jak 70 % UC (79,80) a v cca 21 % případů karcinomu cervixu (81).
Při hodnocení těchto lézí je tedy kritický mnohostranný přístup kombinující pečlivé morfologické zhodnocení, imunohistochemii a především klinicko-patologickou korelaci, která je pro správnou diagnózu absolutně nejdůležitější.
Neoplázie vývodných močových cest s adenokarcinomovým vzhledem
V rámci vývodných močových cest WHO 2016 rozlišuje „non-urachální“ adenokarcinom (enterický, mucinózní, smíšený a blíže nespecifikovaný) a urachální karcinom, kdy většina urachálních karcinomů jsou právě adenokarcinomy (cystický a necystický, se svými variantami) (3). Diferenciálně diagnosticky však v rámci lézí s glandulární architektonikou nelze opomenout ani případy UC s predominantní glandulární diferenciací a sekundární postižení močového měchýře metastatickým rozsevem adenokarcinomu různých lokalizací a především při prorůstaní adenokarcinomu střeva.
Non-urachální adenokarcinom je léze vznikající na podkladě glandulární metaplasie a představuje asi 0,5-2 % všech malignit močového měchýře (3). Urachální adenokarcinom vzniká z urachálních zbytků a je vzácnější než adenokarcinom non-urachální. Primární non-urachální adenokarcinom močového měchýře je pozitivní v CK20, CDX2 (3), variabilně pozitivní v CK7, CEA (82) a popsaná je i exprese GATA3 (83). Jaderná pozitivita ß-cateninu svědčí spíše pro kolonické origo se sekundárním postižením močového měchýře, avšak tato může být přítomna i u primárních adenokarcinomů močového měchýře (1). Urachální adenokarcinom stejně jako adenokarcinom non-urachální exprimuje často CDX2, CK20, je variabilně pozitivní v CK7 a ß-cathenin je též negativní ve většině případů (bez jaderné pozitivity) (84). Celkově tak na základě morfologie a imunohistochemického profilu léze nelze jednoznačně odlišit mezi primárním adenokarcinomem močového měchýře a sekundárním postižením močového měchýře při prorůstání adenokarcinomu střeva, u všech těchto lézí je nutná klinicko-patologická korelace. V nejasných případech doporučujeme do definitivní histologické zprávy uvést klinickým lékařům limitace histologického vyšetření a doporučit jim provedení dalších invazivních vyšetření k vyloučení primárního origa léze mimo vylučovací močový trakt.
Diagnóza UC s predominantně glandulární diferenciací je závislá na identifikaci oblastí s typickou morfologií UC, důležitý je tedy excesivní „sampling“ léze. Okrsky s glandulární diferenciací vykazují pozitivitu CDX2, CK20, p63, GATA3 a HMWCK (3), použití imunohistochemie tak též nemá žádný přínos.
Neoplázie vývodných močových cest s neuroendokrinní diferenciací
Malobuněčný karcinom s neuroendokrinními rysy představuje méně než 1 % všech neoplázií močového měchýře, ostatní neuroendokrinní léze (velkobuněčný neuroendokrinní karcinom a dobře diferencovaný neuroendokrinní tumor) jsou v močových cestách ještě vzácnější (3). Může se vyskytovat v „čisté“ formě, většinou však je smíšeně s jinými karcinomy (až 2/3 případů) (85), nejčastěji s UC (obr. 7).
Image 7. Malobuněčný karcinom s neuroendokrinními rysy smíšený s UC (A). Přítomen je jak klasický exofyticky rostoucí papilární UC (B), tak solidní okrsky tvořené high-grade karcinomem s neuroendokrinními rysy (C). UC je pozitivní v barvení CK7, naopak komponenta malobuněčného karcinomu je v CK7 negativní (D). Obě komponenty jsou pozitivní v průkazu GATA3 (neuroendokrinní karcinom pouze fokálně) (E). Malobuněčný karcinom pak vykazuje pozitivitu v barvení s neuroendokrinními markery - INSM1 (F), synaptofyzin (G), CD56 (H). 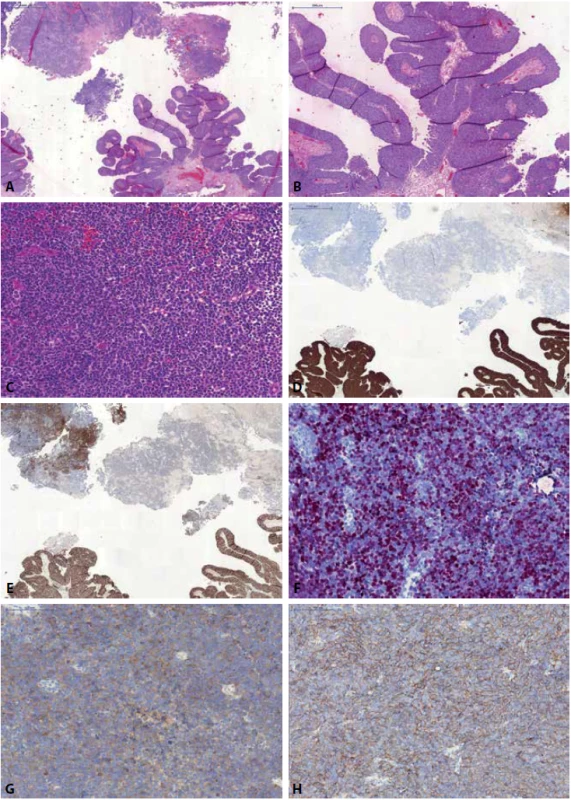
Imunohistochemicky jsou tyto tumory pozitivní v průkazu synaptofyzinu (73 %), chromograninu (47 %), CD57 (30-55 %), CD56 (95 %), neuron specifické enolázy (100 %) (85). Relativně novým markerem neuroendokrinních tumorů je INSM1 (insulinoma-associated protein 1), což je transkripční faktor, hrající významnou roli v neuroendokrinní diferenciaci a zdá se tak být velmi slibným imunohistochemickým markerem neuroendokrinních neoplázií (86). Jedná se o zcela nový marker, proto práce stanovující frekvenci exprese INSM1 v různých lézích vylučovacího močového traktu nejsou v současné době zatím k dispozici. Z markerů urotelu bývá malobuněčný karcinom močového měchýře pozitivní v K903 (60 %), CK7 (47 %) (85), nádor též exprimuje GATA3 (32 %) (87). Další často pozitivní marker je TTF-1 (39-50 %) (88,89) a udávána je i častá pozitivita p16 (90). CK20 a p63 jsou u malobuněčných karcinomů močového traktu většinou negativní (91). Práce autorů Wang a kol. též prokázala negativitu barvení Rb1 až u 90 % případů malobuněčného karcinomu močového měchýře a tito pacienti by tak nejspíše do budoucna mohli být vhodnými kandidáty pro RB1 cílenou terapii (85). TERT promotorová mutace obyčejně typická pro UC byla nalezena i u významné části malobuněčných karcinomů (92).
V případech malobuněčného karcinomu močového měchýře u pacientů s v minulosti či simultánně diagnostikovaným karcinomem prostaty, by měla být zvážena též možnost sekundárního postižení měchýře neuroendokrinní tumorem s origem v prostatě (relativně častý jev v konzultační praxi). Tato problematika bude podrobněji probrána v imunohistochemickém článku věnujícím se prostatě. Dále v této situaci připadá diferenciálně diagnosticky v úvahu ještě metastáza malobuněčného karcinomu z jiné (další) lokality, lymfom, či špatně diferencovaný UC.
ZÁVĚR
Při indikaci imunohistochemického vyšetření by patolog měl vždy přistupovat s určitou diagnostickou rozvahou, volit vhodné markery v dané diferenciální diagnostice užitečné a neužívat barvení, která v dané situace není možné jednoznačně interpretovat. Základem i tak ovšem zůstává důraz na selský rozum patologa a morfologii vlastní léze.
PODĚKOVÁNÍ
Podpořeno programem rozvoje vědních oborů Karlovy univerzity (Projekt Q39) a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
tel.: +420377404633
e-mail: pivovarcikovak@fnplzen.cz
Sources
1. Amin MB, Trpkov K, Lopez-Beltran A, Grignon D, Members of the IIiDUPG. Best practices recommendations in the application of immunohistochemistry in the bladder lesions: report from the International Society of Urologic Pathology consensus conference. Am J Surg Pathol 2014; 38(8): e20-34.
2. Paner GP, Annaiah C, Gulmann C, et al. Immunohistochemical evaluation of novel and traditional markers associated with urothelial differentiation in a spectrum of variants of urothelial carcinoma of the urinary bladder. Hum Pathol 2014; 45(7): 1473-1482.
3. Moch H, Humphrey PA, Ulbright TM, Reuter VE. WHO classification of tumours of the urinary system and male genital organs. Lyon: IARC; 2016.
4. Bassily NH, Vallorosi CJ, Akdas G, Montie JE, Rubin MA. Coordinate expression of cytokeratins 7 and 20 in prostate adenocarcinoma and bladder urothelial carcinoma. Am J Clin Pathol 2000; 113(3): 383-388.
5. Chu P, Wu E, Weiss LM. Cytokeratin 7 and cytokeratin 20 expression in epithelial neoplasms: a survey of 435 cases. Mod Pathol 2000; 13(9): 962-972.
6. Genega EM, Hutchinson B, Reuter VE, Gaudin PB. Immunophenotype of high-grade prostatic adenocarcinoma and urothelial carcinoma. Mod Pathol 2000; 13(11): 1186-1191.
7. Parker DC, Folpe AL, Bell J, et al. Potential utility of uroplakin III, thrombomodulin, high molecular weight cytokeratin, and cytokeratin 20 in noninvasive, invasive, and metastatic urothelial (transitional cell) carcinomas. Am J Surg Pathol 2003; 27(1): 1-10.
8. Miettinen M, McCue PA, Sarlomo-Rikala M, et al. GATA3: a multispecific but potentially useful marker in surgical pathology: a systematic analysis of 2500 epithelial and nonepithelial tumors. Am J Surg Pathol 2014; 38(1): 13-22.
9. Tian W, Guner G, Miyamoto H, et al. Utility of uroplakin II expression as a marker of urothelial carcinoma. Hum Pathol 2015; 46(1): 58-64.
10. Cox RM, Magi-Galluzzi C, McKenney JK. Immunohistochemical Pitfalls in Genitourinary Pathology: 2018 Update. Adv Anat Pathol 2018; 25(6): 387-399.
11. Liang Y, Heitzman J, Kamat AM, Dinney CP, Czerniak B, Guo CC. Differential expression of GATA-3 in urothelial carcinoma variants. Hum Pathol 2014; 45(7): 1466-1472.
12. Comperat E, Camparo P, Haus R, et al. Immunohistochemical expression of p63, p53 and MIB-1 in urinary bladder carcinoma. A tissue microarray study of 158 cases. Virchows Arch 2006; 448(3): 319-324.
13. Oh WJ, Chung AM, Kim JS, et al. Differential Immunohistochemical Profiles for Distinguishing Prostate Carcinoma and Urothelial Carcinoma. J Pathol Transl Med 2016; 50(5): 345-354.
14. Wu XR, Lin JH, Walz T, et al. Mammalian uroplakins. A group of highly conserved urothelial differentiation-related membrane proteins. J Biol Chem 1994; 269(18): 13716-1324.
15. Kaufmann O, Volmerig J, Dietel M. Uroplakin III is a highly specific and moderately sensitive immunohistochemical marker for primary and metastatic urothelial carcinomas. Am J Clin Pathol 2000; 113(5): 683-687.
16. Brown HM, Wilkinson EJ. Uroplakin-III to distinguish primary vulvar Paget disease from Paget disease secondary to urothelial carcinoma. Hum Pathol 2002; 33(5): 545-548.
17. Hoang LL, Tacha DE, Qi W, et al. A newly developed uroplakin II antibody with increased sensitivity in urothelial carcinoma of the bladder. Arch Pathol Lab Med 2014; 138(7): 943-9.
18. Li W, Liang Y, Deavers MT, et al. Uroplakin II is a more sensitive immunohistochemical marker than uroplakin III in urothelial carcinoma and its variants. Am J Clin Pathol 2014; 142(6): 864-871.
19. Smith SC, Mohanty SK, Kunju LP, et al. Uroplakin II outperforms uroplakin III in diagnostically challenging settings. Histopathology 2014; 65(1): 132-138.
20. Lamm DL. Carcinoma in situ. Urol Clin North Am 1992; 19(3): 499-508.
21. Cheng L, Cheville JC, Neumann RM, et al. Survival of patients with carcinoma in situ of the urinary bladder. Cancer 1999; 85(11): 2469-2474.
22. Babjuk M, Burger M, Compérat E, et al. Non-muscle-invasive Bladder Cancer. EAU Guidelines Edn presented at the EAU Annual Congress Copenhagen 2018. Arnhem, The Netherlands: EAU Guidelines Office; 2018.
23. Arias-Stella JA, 3rd, Shah AB, Gupta NS, Williamson SR. CK20 and p53 Immunohistochemical Staining Patterns in Urinary Bladder Specimens With Equivocal Atypia. Arch Pathol Lab Med 2018; 142(1): 64-69.
24. McKenney JK, Desai S, Cohen C, Amin MB. Discriminatory immunohistochemical staining of urothelial carcinoma in situ and non-neoplastic urothelium: an analysis of cytokeratin 20, p53, and CD44 antigens. Am J Surg Pathol 2001; 25(8): 1074-1078.
25. Mallofre C, Castillo M, Morente V, Sole M. Immunohistochemical expression of CK20, p53, and Ki-67 as objective markers of urothelial dysplasia. Mod Pathol 2003; 16(3): 187-191.
26. Aron M, Luthringer DJ, McKenney JK, et al. Utility of a triple antibody cocktail intraurothelial neoplasm-3 (IUN-3-CK20/CD44s/p53) and alpha-methylacyl-CoA racemase (AMACR) in the distinction of urothelial carcinoma in situ (CIS) and reactive urothelial atypia. Am J Surg Pathol 2013; 37(12): 1815-1823.
27. Jung S, Wu C, Eslami Z, et al. The role of immunohistochemistry in the diagnosis of flat urothelial lesions: a study using CK20, CK5/6, P53, Cd138, and Her2/Neu. Ann Diagn Pathol 2014; 18(1): 27-32.
28. Asgari M, Nabi Maybodi M, Abolhasani M. Differential diagnosis of urothelial carcinoma in situ from non-neoplastic urothelia: Analysis of CK20, CD44, P53 and Ki67. Med J Islam Repub Iran 2016; 30 : 400.
29. Harnden P, Eardley I, Joyce AD, Southgate J. Cytokeratin 20 as an objective marker of urothelial dysplasia. Br J Urol 1996; 78(6): 870-875.
30. McKenney JK. Precursor lesions of the urinary bladder. Histopathology 2019; 74(1): 68-76.
31. Mai KT, Busca A, Belanger EC. Flat Intraurothelial Neoplasia Exhibiting Diffuse Immunoreactivity for CD44 and Cytokeratin 5 (Urothelial Stem Cell/Basal Cell Markers): A Variant of Intraurothelial Neoplasia Commonly Associated With Muscle-invasive Urothelial Carcinoma. Appl Immunohistochem Mol Morphol 2017; 25(7): 505-512.
32. McKenney JK, Gomez JA, Desai S, Lee MW, Amin MB. Morphologic expressions of urothelial carcinoma in situ: a detailed evaluation of its histologic patterns with emphasis on carcinoma in situ with microinvasion. Am J Surg Pathol 2001; 25(3): 356-362.
33. Barbisan F, Santinelli A, Mazzucchelli R, et al. Strong immunohistochemical expression of fibroblast growth factor receptor 3, superficial staining pattern of cytokeratin 20, and low proliferative activity define those papillary urothelial neoplasms of low malignant potential that do not recur. Cancer 2008; 112(3): 636-644.
34. Garbar C, Mascaux C. Expression of MUC1 (Ma695) in noninvasive papillary urothelial neoplasm according to the 2004 World Health Organization classification of the noninvasive urothelial neoplasm. An immunologic tool for the pathologist? Anal Quant Cytol Histol 2011; 33(5): 277-782.
35. Kaymaz E, Ozer E, Unverdi H, Hucumenoglu S. Evaluation of MUC1 and P53 expressions in noninvasive papillary urothelial neoplasms of bladder, their relationship with tumor grade and role in the differential diagnosis. Indian J Pathol Microbiol 2017; 60(4): 510-514.
36. Cox R, Epstein JI. Large nested variant of urothelial carcinoma: 23 cases mimicking von Brunn nests and inverted growth pattern of noninvasive papillary urothelial carcinoma. Am J Surg Pathol 2011; 35(9): 1337-1342.
37. Comperat E, McKenney JK, Hartmann A, et al. Large nested variant of urothelial carcinoma: a clinicopathological study of 36 cases. Histopathology 2017; 71(5): 703-710.
38. Beltran AL, Cheng L, Montironi R, et al. Clinicopathological characteristics and outcome of nested carcinoma of the urinary bladder. Virchows Arch 2014; 465(2): 199-205.
39. Volmar KE, Chan TY, De Marzo AM, Epstein JI. Florid von Brunn nests mimicking urothelial carcinoma: a morphologic and immunohistochemical comparison to the nested variant of urothelial carcinoma. Am J Surg Pathol 2003; 27(9): 1243-1252.
40. Lin O, Cardillo M, Dalbagni G, Linkov I, Hutchinson B, Reuter VE. Nested variant of urothelial carcinoma: a clinicopathologic and immunohistochemical study of 12 cases. Mod Pathol 2003; 16(12): 1289-1298.
41. Zhong M, Tian W, Zhuge J, et al. Distinguishing nested variants of urothelial carcinoma from benign mimickers by TERT promoter mutation. Am J Surg Pathol 2015; 39(1): 127-131.
42. Oliva E, Young RH. Nephrogenic adenoma of the urinary tract: a review of the microscopic appearance of 80 cases with emphasis on unusual features. Mod Pathol 1995; 8(7): 722-730.
43. Amin W, Parwani AV. Nephrogenic adenoma. Pathol Res Pract 2010; 206(10): 659-662.
44. Mazal PR, Schaufler R, Altenhuber-Muller R, et al. Derivation of nephrogenic adenomas from renal tubular cells in kidney-transplant recipients. N Engl J Med 2002; 347(9): 653-659.
45. McDaniel AS, Chinnaiyan AM, Siddiqui J, McKenney JK, Mehra R. Immunohistochemical staining characteristics of nephrogenic adenoma using the PIN-4 cocktail (p63, AMACR, and CK903) and GATA-3. Am J Surg Pathol 2014; 38(12): 1664-1671.
46. Laury AR, Perets R, Piao H, et al. A comprehensive analysis of PAX8 expression in human epithelial tumors. Am J Surg Pathol 2011; 35(6): 816-826.
47. Tong GX, Yu WM, Beaubier NT, et al. Expression of PAX8 in normal and neoplastic renal tissues: an immunohistochemical study. Mod Pathol 2009; 22(9): 1218-1227.
48. Lopez JI, Schiavo-Lena M, Corominas-Cishek A, et al. Nephrogenic adenoma of the urinary tract: clinical, histological, and immunohistochemical characteristics. Virchows Arch 2013; 463(6): 819-825.
49. Lloyd RV, Blaivas M, Wilson BS. Distribution of chromogranin and S100 protein in normal and abnormal adrenal medullary tissues. Arch Pathol Lab Med 1985; 109(7): 633-635.
50. So JS, Epstein JI. GATA3 expression in paragangliomas: a pitfall potentially leading to misdiagnosis of urothelial carcinoma. Mod Pathol 2013; 26(10): 1365-1370.
51. Chetty R, Pillay P, Jaichand V. Cytokeratin expression in adrenal phaeochromocytomas and extra-adrenal paragangliomas. J Clin Pathol 1998; 51(6): 477-478.
52. Mai KT, Collins JP, Veinot JP. Prostatic adenocarcinoma with urothelial (transitional cell) carcinoma features. Appl Immunohistochem Mol Morphol 2002; 10(3): 231-236.
53. Gordetsky J, Epstein JI. Pseudopapillary features in prostatic adenocarcinoma mimicking urothelial carcinoma: a diagnostic pitfall. Am J Surg Pathol 2014; 38(7): 941-945.
54. Mohanty SK, Smith SC, Chang E, et al. Evaluation of contemporary prostate and urothelial lineage biomarkers in a consecutive cohort of poorly differentiated bladder neck carcinomas. Am J Clin Pathol 2014; 142(2): 173-183.
55. Wobker SE, Khararjian A, Epstein JI. GATA3 Positivity in Benign Radiated Prostate Glands: A Potential Diagnostic Pitfall. Am J Surg Pathol 2017; 41(4): 557-563.
56. Gelmann EP, Bowen C, Bubendorf L. Expression of NKX3.1 in normal and malignant tissues. Prostate 2003; 55(2): 111-117.
57. Chuang AY, DeMarzo AM, Veltri RW, Sharma RB, Bieberich CJ, Epstein JI. Immunohistochemical differentiation of high-grade prostate carcinoma from urothelial carcinoma. Am J Surg Pathol 2007; 31(8): 1246-1255.
58. Mhawech P, Uchida T, Pelte MF. Immunohistochemical profile of high-grade urothelial bladder carcinoma and prostate adenocarcinoma. Hum Pathol 2002; 33(11): 1136-1140.
59. Kunju LP, Mehra R, Snyder M, Shah RB. Prostate-specific antigen, high-molecular-weight cytokeratin (clone 34betaE12), and/or p63: an optimal immunohistochemical panel to distinguish poorly differentiated prostate adenocarcinoma from urothelial carcinoma. Am J Clin Pathol 2006; 125(5): 675-681.
60. Osunkoya AO, Hansel DE, Sun X, Netto GJ, Epstein JI. Aberrant diffuse expression of p63 in adenocarcinoma of the prostate on needle biopsy and radical prostatectomy: report of 21 cases. Am J Surg Pathol 2008; 32(3): 461-467.
61. Giannico GA, Ross HM, Lotan T, Epstein JI. Aberrant expression of p63 in adenocarcinoma of the prostate: a radical prostatectomy study. Am J Surg Pathol 2013; 37(9): 1401-1406.
62. Tan HL, Haffner MC, Esopi DM, et al. Prostate adenocarcinomas aberrantly expressing p63 are molecularly distinct from usual-type prostatic adenocarcinomas. Mod Pathol 2015; 28(3): 446-456.
63. Mhawech-Fauceglia P, Zhang S, Terracciano L, et al. Prostate-specific membrane antigen (PSMA) protein expression in normal and neoplastic tissues and its sensitivity and specificity in prostate adenocarcinoma: an immunohistochemical study using mutiple tumour tissue microarray technique. Histopathology 2007; 50(4): 472-483.
64. Goldstein NS. Immunophenotypic characterization of 225 prostate adenocarcinomas with intermediate or high Gleason scores. Am J Clin Pathol 2002; 117(3): 471-477.
65. Shah RB, Mehra R, Chinnaiyan AM, et al. Androgen-independent prostate cancer is a heterogeneous group of diseases: lessons from a rapid autopsy program. Cancer Res 2004; 64(24): 9209-9216.
66. Rogers CG, Palapattu GS, Shariat SF, et al. Clinical outcomes following radical cystectomy for primary nontransitional cell carcinoma of the bladder compared to transitional cell carcinoma of the bladder. J Urol 2006; 175(6): 2048-2053.
67. Zhang Y, Zhu C, Curado MP, Zheng T, Boyle P. Changing patterns of bladder cancer in the USA: evidence of heterogeneous disease. BJU Int 2012; 109(1): 52-56.
68. Schwartz LE, Khani F, Bishop JA, Vang R, Epstein JI. Carcinoma of the Uterine Cervix Involving the Genitourinary Tract: A Potential Diagnostic Dilemma. Am J Surg Pathol 2016; 40(1): 27-35.
69. Chang A, Amin A, Gabrielson E, et al. Utility of GATA3 immunohistochemistry in differentiating urothelial carcinoma from prostate adenocarcinoma and squamous cell carcinomas of the uterine cervix, anus, and lung. Am J Surg Pathol 2012; 36(10): 1472-1476.
70. Alexander RE, Hu Y, Kum JB, et al. p16 expression is not associated with human papillomavirus in urinary bladder squamous cell carcinoma. Mod Pathol 2012; 25(11): 1526-1533.
71. Piaton E, Casalegno JS, Advenier AS, et al. p16(INK4a) overexpression is not linked to oncogenic human papillomaviruses in patients with high-grade urothelial cancer cells. Cancer Cytopathol 2014; 122(10): 760-769.
72. Golovina DA, Ermilova VD, Zavalishina LE, et al. Loss of Cell Differentiation in HPV-Associated Bladder Cancer. Bull Exp Biol Med 2016; 161(1): 96-98.
73. Schmid SC, Thumer L, Schuster T, et al. Human papilloma virus is not detectable in samples of urothelial bladder cancer in a central European population: a prospective translational study. Infect Agent Cancer 2015; 10 : 31.
74. Li N, Yang L, Zhang Y, Zhao P, Zheng T, Dai M. Human papillomavirus infection and bladder cancer risk: a meta-analysis. J Infect Dis 2011; 204(2): 217-223.
75. Advenier AS, Casalegno JS, Mekki Y, et al. Genotyping of high-risk human papillomaviruses in p16/Ki-67-positive urothelial carcinoma cells: even a worm will turn. Cytopathology 2015; 26(2): 106-113.
76. Kim SH, Joung JY, Chung J, Park WS, Lee KH, Seo HK. Detection of human papillomavirus infection and p16 immunohistochemistry expression in bladder cancer with squamous differentiation. PloS one. 2014; 9(3): e93525.
77. Pichler R, Borena W, Schafer G, et al. Low prevalence of HPV detection and genotyping in non-muscle invasive bladder cancer using single-step PCR followed by reverse line blot. World J Urol 2015; 33(12): 2145-2151.
78. Cowan M, Springer S, Nguyen D, et al. High prevalence of TERT promoter mutations in primary squamous cell carcinoma of the urinary bladder. Mod Pathol 2016; 29(5): 511-515.
79. Allory Y, Beukers W, Sagrera A, et al. Telomerase reverse transcriptase promoter mutations in bladder cancer: high frequency across stages, detection in urine, and lack of association with outcome. Eur Urol 2014; 65(2): 360-366.
80. Pivovarcikova K, Pitra T, Vanecek T, et al. Comparative study of TERT gene mutation analysis on voided liquid-based urine cytology and paraffin-embedded tumorous tissue. Ann Diagn Pathol 2016; 24 : 7-10.
81. Vinothkumar V, Arunkumar G, Revathidevi S, et al. TERT promoter hot spot mutations are frequent in Indian cervical and oral squamous cell carcinomas. Tumour Biol 2016; 37(6): 7907-7913.
82. Torenbeek R, Lagendijk JH, Van Diest PJ, Bril H, van de Molengraft FJ, Meijer CJ. Value of a panel of antibodies to identify the primary origin of adenocarcinomas presenting as bladder carcinoma. Histopathology 1998; 32(1): 20-27.
83. Ellis CL, Chang AG, Cimino-Mathews A, et al. GATA-3 immunohistochemistry in the differential diagnosis of adenocarcinoma of the urinary bladder. Am J Surg Pathol 2013; 37(11): 1756-1760.
84. Paner GP, McKenney JK, Barkan GA, et al. Immunohistochemical analysis in a morphologic spectrum of urachal epithelial neoplasms: diagnostic implications and pitfalls. Am J Surg Pathol 2011; 35(6): 787-798.
85. Wang G, Xiao L, Zhang M, et al. Small cell carcinoma of the urinary bladder: a clinicopathological and immunohistochemical analysis of 81 cases. Hum Pathol 2018; 79 : 57-65.
86. Rosenbaum JN, Guo Z, Baus RM, Werner H, Rehrauer WM, Lloyd RV. INSM1: A Novel Immunohistochemical and Molecular Marker for Neuroendocrine and Neuroepithelial Neoplasms. Am J Clin Pathol 2015; 144(4): 579-591.
87. Bezerra SM, Lotan TL, Faraj SF, et al. GATA3 expression in small cell carcinoma of bladder and prostate and its potential role in determining primary tumor origin. Hum Pathol 2014; 45(8): 1682-1687.
88. Jones TD, Kernek KM, Yang XJ, et al. Thyroid transcription factor 1 expression in small cell carcinoma of the urinary bladder: an immunohistochemical profile of 44 cases. Hum Pathol 2005; 36(7): 718-723.
89. Agoff SN, Lamps LW, Philip AT, et al. Thyroid transcription factor-1 is expressed in extrapulmonary small cell carcinomas but not in other extrapulmonary neuroendocrine tumors. Mod Pathol 2000; 13(3): 238-242.
90. Erdem GU, Ozdemir NY, Demirci NS, Sahin S, Bozkaya Y, Zengin N. Small cell carcinoma of the urinary bladder: changing trends in the current literature. Curr Med Res Opin 2016; 32(6): 1013-1021.
91. Kouba E, Cheng L. Neuroendocrine Tumors of the Urinary Bladder According to the 2016 World Health Organization Classification: Molecular and Clinical Characteristics. Endocr Pathol 2016; 27(3): 188-199.
92. Zheng X, Zhuge J, Bezerra SM, et al. High frequency of TERT promoter mutation in small cell carcinoma of bladder, but not in small cell carcinoma of other origins. J Hematol Oncol 2014; 7 : 47.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2020 Issue 3-
All articles in this issue
- Immunohistochemistry and renal neoplasias
- Immunohistochemistry in hollow urinary tract
- Practices recommendations in the applications of immunohistochemistry and molecular genetics in testicular tumors. Review article.
- Immunohistochemistry in prostate pathology
- Gossypiboma mimicking recurrent mandibular tumor: case report
- Lymph node metastasis of parotid gland high-grade adenoid-cystic carcinoma
- Merkel cell carcinoma with squamous differentiation – case report
- Praktická imunohistochémia v genitourinárnej patológii
- Profesor Ivo Šteiner osmdesátiletý
- Monitor aneb nemělo by vám uniknout, že...
- Monitor aneb nemělo by vám uniknout, že...
- Diagnostic Histopathology of Tumors
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymph node metastasis of parotid gland high-grade adenoid-cystic carcinoma
- Immunohistochemistry in hollow urinary tract
- Immunohistochemistry and renal neoplasias
- Immunohistochemistry in prostate pathology
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

