-
Medical journals
- Career
Lymfom z plášťové zóny diagnostikovaný z materiálu z radikální prostatektomie provedené pro adenokarcinom - kazuistika
Authors: Eliška Tvrdíková 1; Leoš Křen 1; Alena Sorokač Kubolková 2; Dalibor Pacík 2
Authors‘ workplace: Ústav patologie, FN Brno, Lékařská fakulta, Masarykova univerzita, Brno 1; Urologická klinika, FN Brno, Lékařská fakulta, Masarykova univerzita, Brno 2
Published in: Čes.-slov. Patol., 55, 2019, No. 4, p. 231-234
Category: Original Articles
Overview
V kazuistice prezentujeme případ 64 letého pacienta, u nějž byla stanovena diagnóza lymfomu z buněk plášťové zóny (MCL) z materiálu po radikální prostatektomii, jež byla provedena pro adenokarcinom. Lymfomy infiltrující prostatu, ať už primární či sekundární, nejsou příliš časté. Obecně platí, že mají špatnou prognózu. Nejčastějším lymfomem v prostatě je chronická lymfocytární leukemie / malobuněčný lymfocytární lymfom (CLL/SLL). Výskyt lymfomu z buněk plášťové zóny je v této lokalitě extrémně vzácný. Někdy bývá zastižen MCL současně s urologickou malignitou, nicméně význam této duplicity zůstává doposud nejasný. Při hodnocení bioptických vzorků prostaty je třeba na možnost lymfomu myslet a dbát zvýšené obezřetnosti zejména v případech, kdy je přítomen denzní lymfocytární infiltrát.
Klíčová slova:
Adenokarcinom – duplicita – lymfom z buněk plášťové zóny – prostata
Hematologické malignity v prostatě jsou raritní, ať už se jedná o primární malignitu či sekundární postižení (1). Pacienti s lymfomem postihujícím prostatu bývají starší muži, u nichž se tato malignita může projevit obstrukčními symptomy, infekcí močových cest či hematurií (1,2). Lymfom z buněk plášťové zóny (MCL) představuje 2-10 % všech non Hodgkinských lymfomů. Predominantně se vyskytuje u mužů a to zhruba 2,3-2,5 krát častěji než u žen (3). V následujícím textu bude prezentován překvapivý nález MCL v prostatě u 64 letého pacienta bez lymfoproliferativního onemocní v anamnéze, u něhož byla provedena radikální retropubická prostatektomie pro předem histologicky verifikovaný adenokarcinom. Cílem této kazuistiky je především poukázat na to, že nález lymfocytárního infiltrátu v prostatě neznamená vždy jen chronickou prostatitidu, ale že se může jednat i o lymfoproliferativní onemocnění. Dále se pokusíme shrnout mikroskopické znaky, které by měly patologa navést k úvaze o lymfoproliferaci.
KLINICKÝ NÁLEZ
64 letý pacient byl odeslán na urologickou kliniku FN Brno k provedení punkční biopsie prostaty pro elevaci PSA 5,9 ug/l (procento volného PSA bylo 12 %, digitální rektální vyšetření bylo nesuspektní). Subjektivně pacient udával zcela minimální dysurii, jinak byl bez obtíží. Při histologickém vyšetření punkční biopsie byl diagnostikován acinární adenokarcinom prostaty, Gleason score 3+4, prognostic grade group 2. Vyšetřeno bylo celkem šestnáct punkčních bioptických válečků, přičemž karcinom byl přítomen v pěti punkčních válečcích. Perineurální invaze nebyla zastižena. Dále byla ve vzorcích patrná lymfocytární celulizace, jež byla převážně mírná, ojediněle však lehce hojnější. Tento nález nicméně nevzbuzoval podezření na přítomnost lymfoproliferativního onemocnění a byl hodnocen jako chronická prostatitida. Následně byly provedeny zobrazovací metody k vyloučení diseminace nádorového procesu. Rentgenový snímek plic neprokázal ložiskové změny a ultrasonografické vyšetření jater bylo bez pozoruhodností. Při scintigrafii skeletu byla zjištěna ložisková léze v průběhu 7. žebra levostranně, přičemž tímto vyšetřením nebylo možné vyloučit ani potvrdit přítomnost metastázy. Byla indikována radikální retropubická prostatektomie, po jejímž provedení byl materiál odeslán na Ústav patologie FN Brno k histologickému vyšetření. Pacient před tímto histologickým vyšetřením neměl v anamnéze diagnostikováno žádné lymfoproliferativní onemocnění, krevní obraz byl v normě, lymfadenopatie nebyla přítomna a subjektivně pacient nepociťoval obtíže, jež by přítomnosti lymfoproliferativního onemocnění nasvědčovaly.
MATERIÁL A METODIKA
Materiál byl fixován v 10% roztoku formaldehydu neutralizovaného uhličitanem vápenatým. Histologické řezy byly obarveny hematoxylinem a eosinem (H&E). Na imunohistochemická vyšetření byly použity následující protilátky:
CD3 (SP7, 1 : 80, Zytomed), CD20 (L26, 1 : 250, Dako), cyclinD1 (EP12, 1 : 50, Dako), Ki-67 (SP6, 1 : 75, ZetaCorp), TdT (339, 1 : 25, Novocastra), CD10 (56C6, 1 : 30, Novocastra), CD5 (4C7, 1 : 75, Novocastra), CD23 (SP23, 1 : 30, ZetaCorp), SOX11 (CL0142, RTU, BioSB).
Na řezu z formol parafinového bloku byla provedena fluorescenční in situ hybridizace (FISH) s použitím sondy ZytoLight CCND1/IGH Dual Color Fusion Probe; lot P182 – NI1. Použitý kit: ZYtoLight FISH-Tissue Implementation; Lot N17 – 92210127 2. Při interpretaci FISH nálezu jsme se řídili doporučeným hodnocením pro fúzní sondy, kdy hodnota cutoff je 15 %. V každé hodnocené buňce musí být stanoven počet izolovaných a fúzních signálů, přičemž v normální buňce jsou nalezeny samostatně dva zelené a dva červené signály. Abnormálním nálezem je přítomnost jednoho červeného a jednoho zeleného signálu a dále dvou žlutých signálů v jedné buňce (4).
VÝSLEDKY
K histopatologickému vyšetření byla dodána prostata včetně semenných váčků. Prostata měla rozměry 45 x 44 x 43 mm, pravostranný semenný váček měřil 22 mm a levostranný semenný váček byl délky 24 mm. Na řezu byla patrná tkáň prostaty lobulárního vzhledu.
Mikroskopicky byl v obou lalocích prostaty zastižen acinární adenokarcinom, jenž byl lokalizován dominantně subkapsulárně a infiltroval cca 20 % celkového objemu prostaty. Morfologicky karcinom odpovídal Gleasonovu score 3+4, přičemž Gleason pattern 4 byl zastoupen cca v 25 % adenokarcinomu, prognostic grade group 2. Extrakapsulární propagace nebyla přítomna. Místy bylo patrné perineurální šíření tumoru. V okolí adenokarcinomu byly zastiženy okrsky high-grade prostatické intraepiteliální neoplázie (PIN). Struktury adenokarcinomu neinfiltrovaly resekční linie ani nebylo přítomno prorůstání karcinomu do semenných váčků. Staging adenokarcinomu prostaty byl pT2c NX (hodnoceno dle 8. edice TNM klasifikace). Dále byla úsekově patrná denzní lymfocytární celulizace (bez zřejmých plazmatických buněk), tvořená převážně malými, až středně velkými, relativně uniformními lymfocyty, jejichž jádra měla lehce nepravidelné kontury a chromatin byl jemně granulární, bez nálezu nápadnějších jadérek. Lymfocytární infiltrát byl lokalizován zejména ve fibromuskulárním stromatu a perivaskulárně, převážně v oblastech mimo adenokarcinom, zcela ojediněle byl zastižen v podobě drobných skupinek i v oblastech karcinomu (obr. 1-2). Lymfoproliferace postihovala celou prostatu a to včetně oblastí resekčních linií. Imunohistochemicky byla prokázána silná difúzní CD20 pozitivita v nádorových lymfocytech, dále pak byla patrná pozitivita CD5 (obr. 3). Cyclin D1 byl slabě nehomogenně pozitivní (obr. 4), SOX11 negativní a proliferační aktivita dle Ki-67 byla překvapivě nízká (1-2 %). Nádorové buňky byly negativní v průkazu exprese CD23, CD10 a TdT. Na pozadí byly patrné nečetné CD3 pozitivní T-lymfocyty. I přes sporný výsledek imunohistochemického vyšetření cyklinuD1 a negativitu SOX11, byla nadále zvažována diagnóza MCL, neboť ani negativita těchto dvou markerů diagnózu MCL nevylučuje. Slabá nehomogenní pozitivita cyclinu D1 v kombinaci s výsledky ostatních imunohistochemických vyšetření vedla k indikaci vyšetření pomocí fluorescenční in situ hybridizace (FISH) k průkazu translokace t(11;14). Bylo zhodnoceno 100 jader, přičemž v 86 % byl přítomen fúzní signál a vyšetření bylo zhodnoceno jako jednoznačně pozitivní.
Image 1. Stroma prostaty infiltrováno MCL. H&E (zvětšeno 40x). 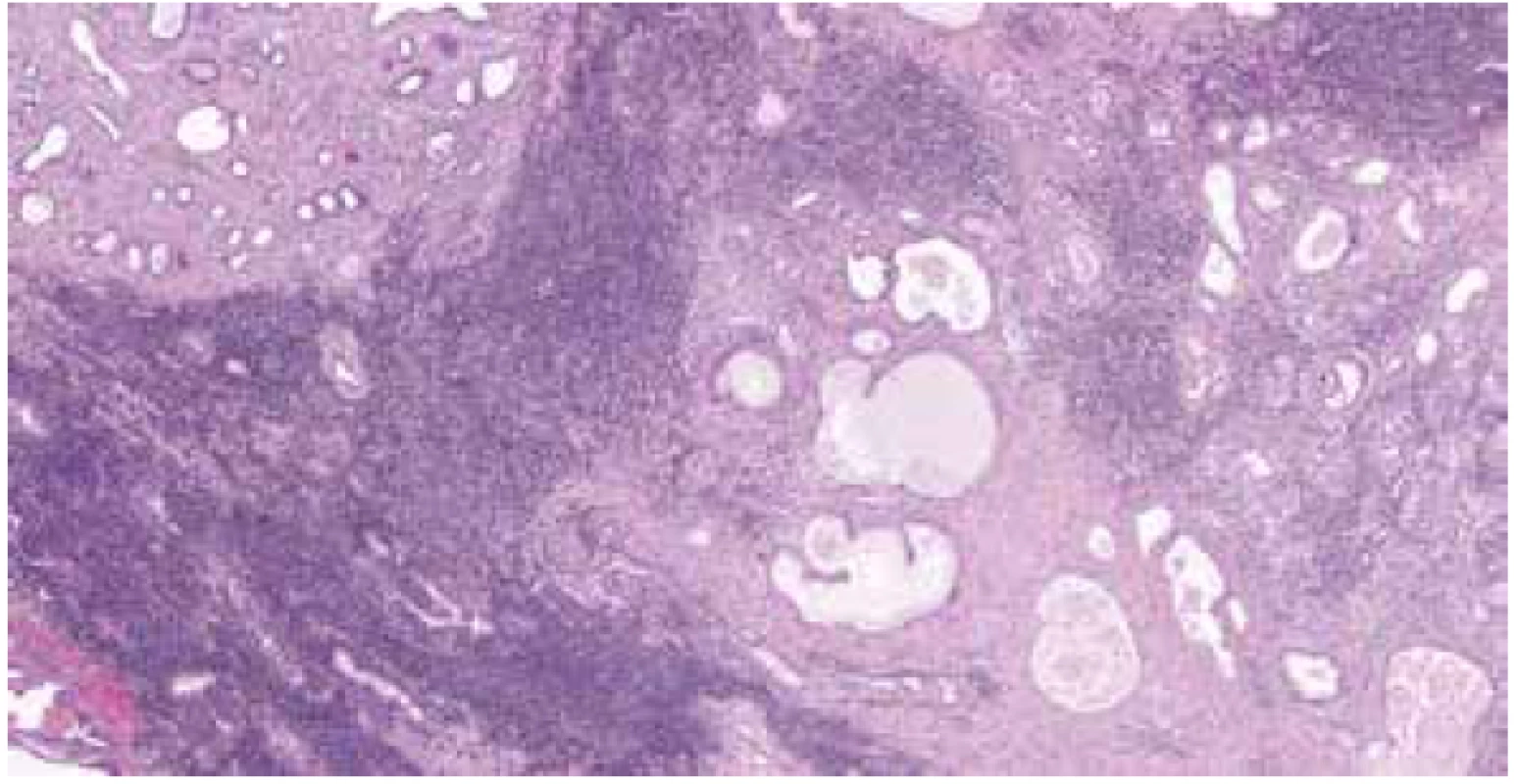
Image 2. Denzní infiltrát uniformních malých buněk MCL. H&E (zvětšeno 400x). 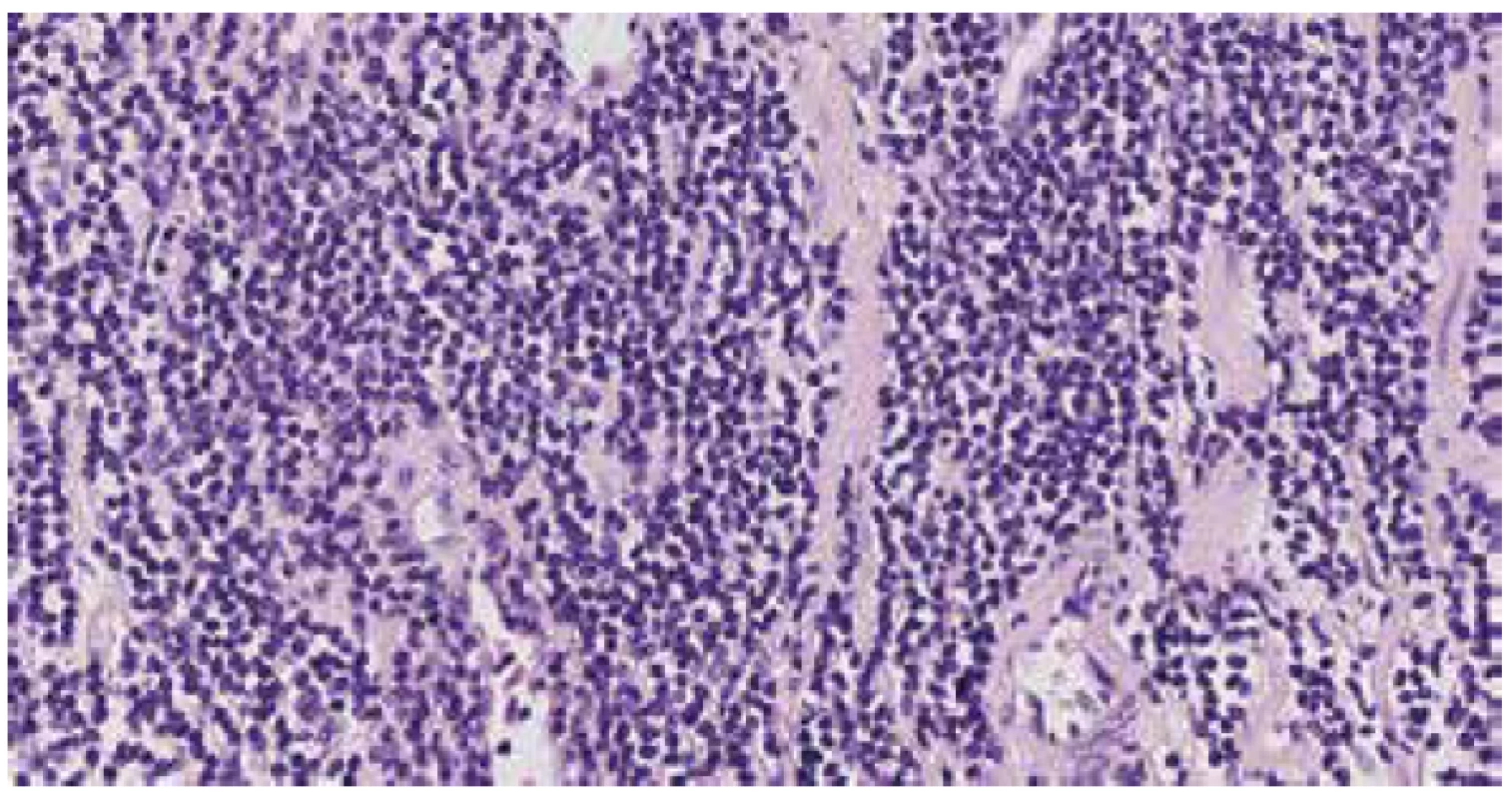
Image 3. Imunohistochemický průkaz CD20 pozitivních buněk MCL, v pravém dolním rohu vložen obrázek imunohistochemického průkazu CD3 – reaktivní T-lymfocyty (zvětšeno 200x). 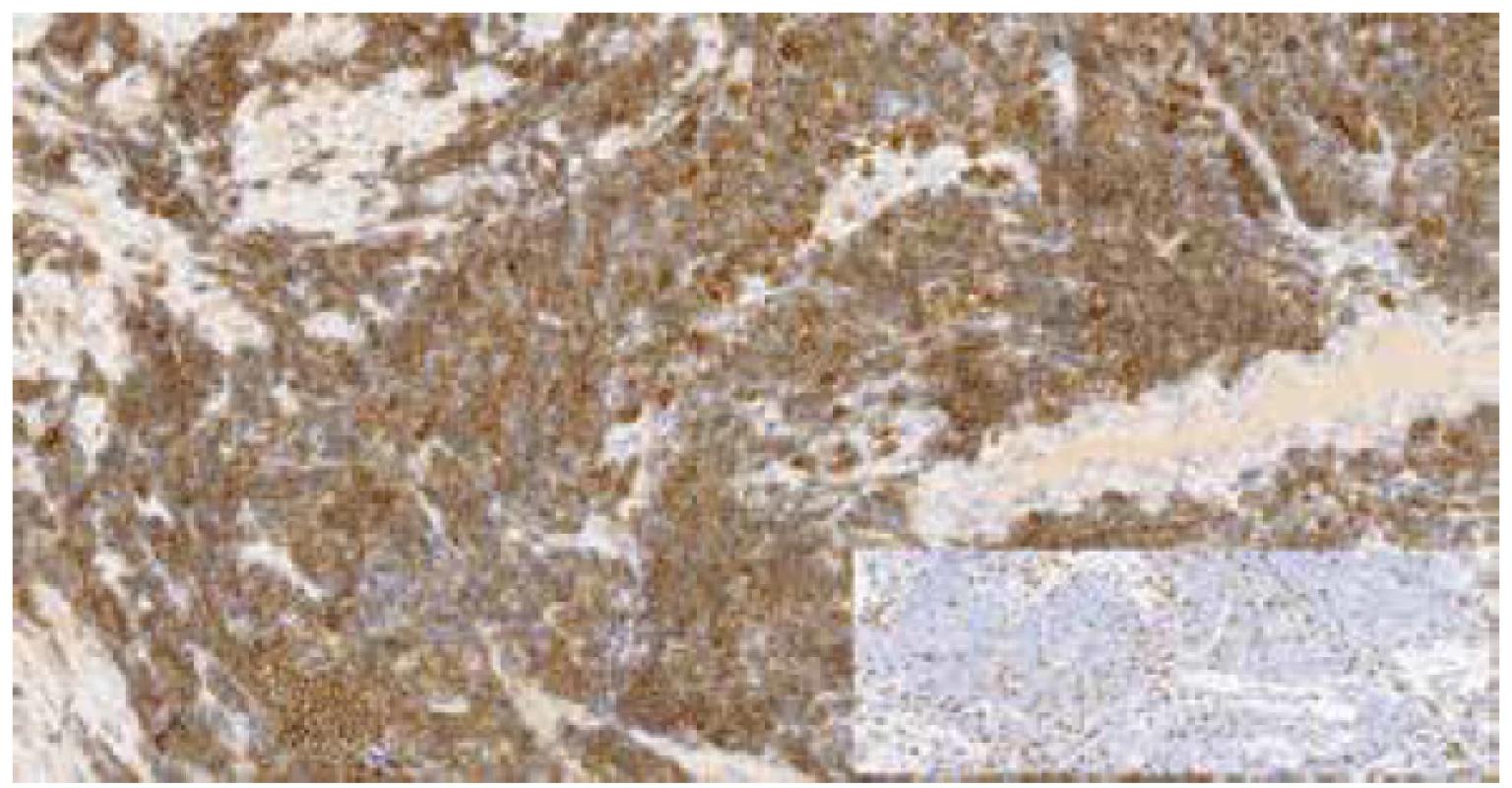
Image 4. Imunohistochemický průkaz cyclin D1 – slabá nehomogenní pozitivita (zvětšeno 40x), v pravém dolním rohu vložen obrázek z FISH vyšetření, pozitivní t(11;14) – abnormální přítomnost jednoho červeného a jednoho zeleného signálu a dále dvou žlutých signálů v jedné buňce (zvětšeno 1000x). 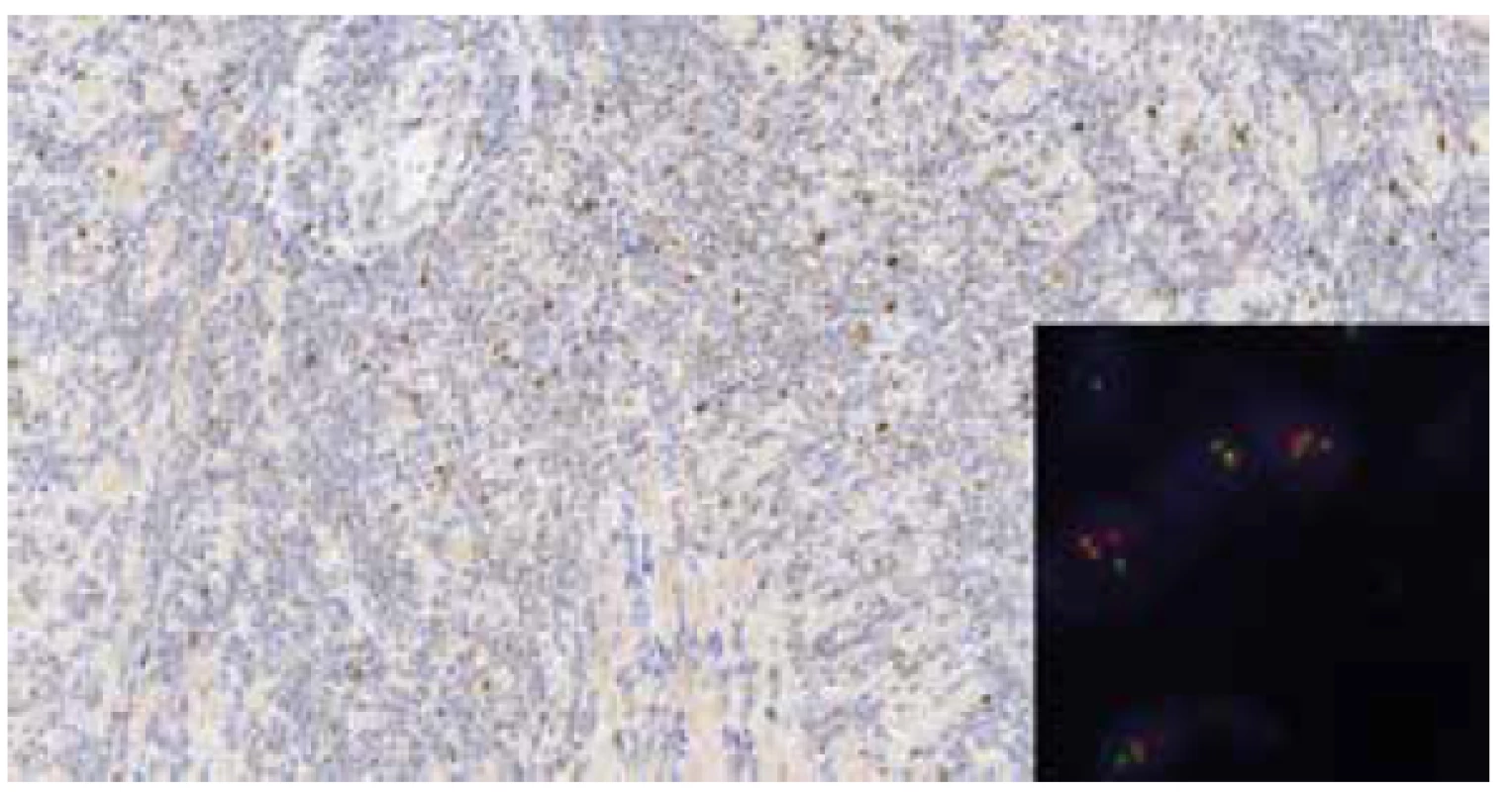
Závěrem histopatologického vyšetření prostaty byl nález acinárního adenokarcinomu prostaty a lymfomu z plášťové zóny, klasické morfologie, v extranodální lokalizaci.
Z urologického pohledu budou dále plánovány pravidelné kontroly PSA, jehož hodnoty jsou v době, kdy píšeme tuto publikaci, po podstoupené prostatektomii stále nedetekovatelné. Vzhledem k diagnóze lymfomu byl pacient předán do péče interní hematoonkologické kliniky, kde byla provedena sternální punkce s následným histologickým potvrzením diagnózy MCL. Pacient byl zařazen do klinického stadia IVA. Potvrzeno bylo postižení prostaty a kostní dřeně, bez nálezu lymfadenopatie, bez přítomnosti lymfoproliferativního onemocnění detekovatelného v periferní krvi (vyšetřeno pomocí průtokové cytometrie) a dále bez nálezu postižení sleziny či jater. Po následné chemoterapii, jež představovala šest cyklů, bylo začátkem roku 2018 u pacienta dosaženo kompletní remise, dle PET/CT i histologického vyšetření krevního koagula ze sternální punkce.
DISKUZE
Hematologické malignity v prostatě jsou raritní. Pokud se vyskytnou, bývá nejčastěji diagnostikována chronická lymfocytární leukemie / malobuněčný lymfocytární lymfom (CLL/SLL) (1). Mezi další jednotky, se kterými se můžeme setkat, patří velkobuněčné lymfomy a dále i jiné malobuněčné lymfomy s difúzním charakterem růstu, kam je možno zařadit i MCL (5). Systémové symptomy jako jsou horečky, noční poty a ztráta váhy nejsou při postižení prostaty příliš běžné (1).
Nejčastěji (zhruba v 65 % případů) jde o sekundární postižení prostaty lymfoproliferativním onemocněním (6). Primární prostatické lymfomy jsou extrémně raritní (2). Odlišení primárního lymfomu od sekundárního postižení prostaty je obtížné a to i přes to, že Bostwick se svými kolegy stanovili diagnostická kritéria, která by měla být použita při hodnocení primárního lymfomu prostaty (tab. 1). V zásadě musí být splněna tři kritéria. Zaprvé musí být lymfoproliferace omezena na prostatu, případně může být zastižena i v blízkých okolních měkkých tkáních. Zadruhé u pacienta nesmí být postiženy lymfatické uzliny a zatřetí musí být prokázán interval v trvání alespoň jeden měsíc od stanovení diagnózy, kdy není přítomno postižení periferní krve, sleziny ani jater (1,6,7).
Table 1. Diagnostická kritéria primárního lymfomu prostaty dle Bostwicka (1,6,7). 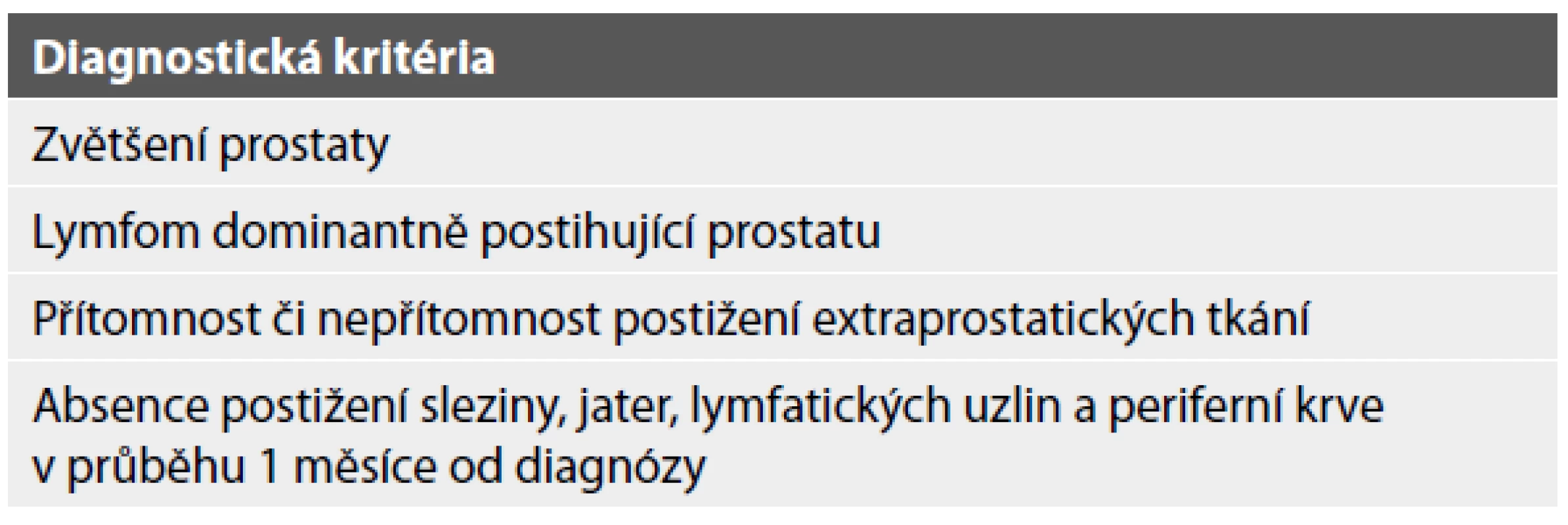
Table 2. Diferenciální diagnostika lymfomu a chronického zánětu (2). 
Table 3. Základní imunohistochemické rozlišení některých zralých B-lymfomů s malobuněčnou morfologií (11). 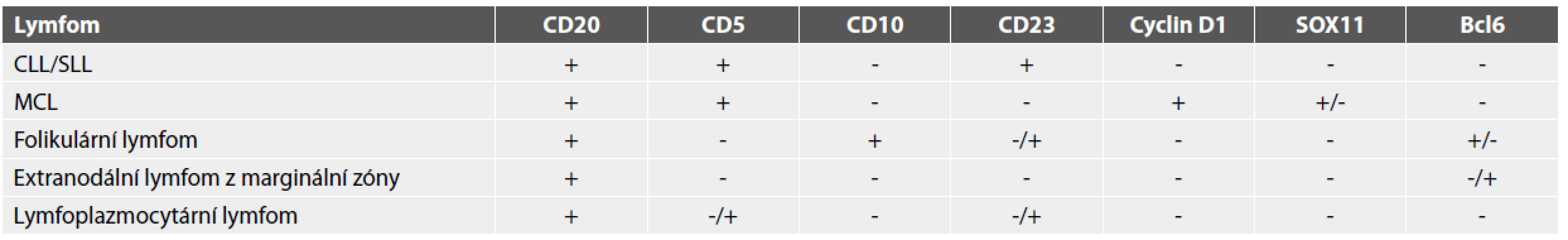
CLL/SLL, chronická lymfocytární leukemie / malobuněčný lymfocytární lymfom; MCL, lymfom z buněk plášťové zóny MCL diagnostikovaný v prostatě ať už primárně či sekundárně je vzácný (7,8). MCL je charakterizován chromozomální translokací t (11;14) mezi těžkým řetězcem imunoglobulinu na chromozomu 14 a CCND1 lokusem na chromozomu 11. Následkem translokace je deregulovaná nadexprese CCND1 (9). Za markery MCL je považována exprese CD5 a cyclinu D1, nicméně dle některých autorů je ne méně než 15 % MCL cyclin D1 negativních. Byl tedy zaveden diagnostický marker SOX11, který bývá pozitivní ve více než 90 % MCL (8). Pozitivita SOX11 bývá přítomna i u MCL, jež jsou cyclin D1 negativní (10).
Diferenciální diagnostika z pohledu patologa v případě nálezu infiltrátu tvořeného malými buňkami lymfoidního vzhledu zahrnuje chronickou prostatitidu, ganulomatózní prostatitidu, leukemie, neuroendokrinní karcinom, nízce diferencovaný uroteliální karcinom, malobuněčný karcinom a v neposlední řadě nízce diferencovaný karcinom prostaty. Největší problémy pravděpodobně činí odlišení chronického zánětu od lymfoproliferativního onemocnění, jež bývá v základním barvení H&E velmi obtížné či nemožné, neboť u chronického zánětu je přítomna výrazná variabilita jeho denzity a rozložení (1). Byly popsány znaky (tab. 2), které by měly patologa vést k zvažování diagnózy lymfoproliferativního onemocnění a současně i k indikaci příslušných imunohistochemických vyšetření. Mezi tyto znaky řadíme například hustotu lymfocytární infiltrátu. V případě lymfoproliferativního onemocnění se setkáváme spíše s infiltráty výrazně denzními. Dále může být pomocným znakem lokalizace infiltrátu. Extenzivní infiltrace fibromuskulárního stromatu prostaty bývá přítomna v případě lymfomu, zatímco u chronických zánětů bývá lymfocytární infiltrát patrný spíše periglandulárně. Dalším vodítkem může být i přítomnost plazmatických buněk v oblastech infiltrátu, neboť plazmatické buňky se jako příměs vyskytují spíše u chronických zánětů (2). V tabulce č. 3 shrnujeme základní imunohistochemická vyšetření u některých zralých B lymfomů s malobuněčnou morfologií (11).
Prognóza lymfomu postihujícího prostatu závisí na typu a stadiu onemocnění (12). Nebyla nalezena rozdílnost přežití u primárních či sekundárních lymfomů. Je udáváno jednoleté přežití u 64 % pacientů a dále pětileté přežití u 33 % pacientů (1). V případě MCL je prognóza ovlivněna také proliferační aktivitou a výsledkem exprese SOX11. MCL, jež ztratily expresi SOX11, bývají asociovány spíše s indolentním chováním a proliferační aktivita, která je pod 10 % při použití markeru Ki-67, bývá také spojována spíše s indolentním průběhem (13).
Některými autory je dokumentována asociace MCL s urologickými karcinomy. Prozatím však jedinou spojitostí obou malignit zůstává pouze mužské pohlaví a vyšší věk pacienta. Jakákoli další spojitost zůstává prozatím neznámá a neprozkoumaná (3).
ZÁVĚR
Nález lymfomu v prostatě není příliš častý a jeho diagnóza při histologickém vyšetření prostatické tkáně u pacienta bez dosud diagnostikovaného lymfoproliferativního onemocnění je ještě vzácnější. Nicméně i tyto případy se vyskytují a je tudíž nezbytné možnost lymfomu zahrnout do diferenciální diagnostiky, zvláště v případě nálezu denzního lymfocytárního infiltrátu.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
MUDr. Eliška Tvrdíková
Ústav patologie, FN Brno
Jihlavská 20, 62500 Brno
tel.: 532 232 819
e-mail: eliska.tvrdikova@gmail.com
Sources
1. Bostwick DG, Cheng L. Urologic surgical pathology (3rd ed). Elsevier Saunders; 2014 : 528-530.
2. Epstein JI, Netto GJ. Biopsy interpretation of the prostate (5th ed). Wolters Kluwer; 2015 : 368-370.
3. Smedby KE, Hjalgrim H. Epidemiology and etiology of mantle cell lymphoma and other non-Hodgkin lymphoma subtypes. Semin Cancer Biol 2011; 21(5): 293-298.
4. Ventura RA, Martin-Subero JI, Jones M, et al. FISH analysis for the detection of lymphoma-associated chromosomal abnormalities in routine paraffin-embedded eissue. J Mol Diagn 2006; 8(2): 141-151.
5. Mills SE, Greenson JK, Hornick JL, Longacre TA, Reuter VE. Sternberg´s Diagnostic Surgical Pathology, Volume II (6th ed.). Wolters Kluwer; 2015 : 2133.
6. Bostwick DG, Iczkowski KA, Amin MB, Discigil G, Osborne B. Malignant lymphoma involving the prostate: report of 62 cases. Cancer 1999; 83(4): 732-738.
7. Abdussalam A, Gerridzen RG. Mantle cell lymphoma of the prostate. Can Urol Assoc J 2009; 3(6): E94-E95.
8. Chen B, Yin G, Duan L, Li W, Jiang X. A new marker, SOX11, aids the diagnosis of mantle cell lymphoma in the prostate: A case report. Oncol Lett 2012; 4(2): 265-267.
9. Rajput AB, Burns B, Gerridzen R, van der Jagt R. Coexisting mantle cell lymphoma and prostate adenocarcinoma. Case Rep Med 2014 : 247286.
10. Petković I, Stojnev S, Krstić M, Pejčić I, Vrbić S. Synchronous mantle cell lymphoma and prostate adenocarcinoma – is it just a coincidence?. Vojnosanit Pregl. 2016; 73(11): 1072-1075.
11. Mills SE, Greenson JK, Hornick JL, Longacre TA, Reuter VE, eds. Sternberg´s Diagnostic Surgical Pathology, Volume I (6th ed.). Wolters Kluwer; 2015 : 707.
12. Taleb A, Ismaili N, Belbaraka R, et al. Primary lymphoma of the prostate treated with rituximab – based chemotherapy: a case report and review of the literature. Cases J 2009; 2 : 8875.
13. Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC; 2017 : 289.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2019 Issue 4-
All articles in this issue
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
- Myokarditida a kardiomyopatie z pohledu kardiologa
- Histopatologická diagnostika myokarditid
- Nejnovější poznatky v mikroskopické diagnostice kardiomyopatií
- Lymfom z plášťové zóny diagnostikovaný z materiálu z radikální prostatektomie provedené pro adenokarcinom - kazuistika
- Incidentálna fokálna idiopatická sklerozujúca mezenteritída u 4-mesačného dieťaťa
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Chondroidní melanom: kazuistika
- Novinky v kardiovaskulární patologii
- Nová učebnice PATOLOGIE je tady
- MONITOR, aneb nemělo by vám uniknout, že...
- MONITOR, aneb nemělo by vám uniknout, že...
- Spomienka na emeritného primára MUDr. Petra Kosseya, CSc.
- Dopis redakci
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myokarditida a kardiomyopatie z pohledu kardiologa
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

