-
Medical journals
- Career
Histiocytární nekrotizující lymfadenitida /Kikuchiho-Fujimotova choroba (HNL/K-F) a její diferenciální diagnostika: analýza 19 případů
: R. Kodet; V. Campr; M. Kalinová; K. Kamarádová; M. Mrhalová; J. Soukup
: Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha
: Čes.-slov. Patol., 48, 2012, No. 4, p. 198-206
: Original Articles
Histiocytární nekrotizující lymfadenitida / Kikuchiho-Fujimotova choroba (HNL/K-F) je rozpoznávána se zvyšující se frekvencí nejen ve východní Asii, ale i v zemích amerických kontinentů a v Evropě. Přesto je její diagnostika nesnadná a se zařazením této jednotky přetrvávají obtíže. V sestavě 19 nemocných diagnostikovaných primárně nebo konzultačně na našem pracovišti bylo 12 žen a 7 mužů. Průměrný věk při diagnóze byl 28 let, medián 25 let. U 18 nemocných byla přítomna krční lymfadenopatie, z toho jednou oboustranná, u ostatních jednostranná. U jednoho nemocného šlo o postižení tříselné lymfatické uzliny a u jednoho nemocného s krční lymfadenopatií bylo zároveň zjištěno postižení uzlin v retroperitoneu. Velikost vyšetřených lymfatických uzlin kolísala od 5 mm do 32 mm. V mikroskopickém obrazu jsme nejčastěji pozorovali tzv. nekrotizující typ (14x), u jednoho případu byla převaha xantomatózní tkáňové reakce v okolí nekróz (xantomatózní typ) a u čtyř nemocných bylo onemocnění bez nekrotizace (u dvou z nich s různě intenzivní apoptózou proliferujících lymfocytů) – proliferativní typ. Z 10 případů druhého čtení byl nález primárně hodnocen jako B lymfom blíže nezařazený (1x), periferní T lymfom (1x), klasický Hodgkinův lymfom smíšené buněčnosti (1x); diferenciálně diagnostická rozvaha mezi periferním T lymfomem a HNL/K-F byla u 2 nemocných; u jednoho případu byla stanovena diagnóza pravděpodobné EBV lymfadenitidy a u jednoho diagnóza HNL/K-F. U zbylých 3 nemocných nebyly dostupné žádné specifické údaje. Autoři zdůrazňují základní morfologické rysy, které by měly vést k diagnóze choroby a měly by zabránit dalším vyšetřením v rámci onkologického stagingu, případně i nasazení chemoterapie. Mezi diagnostické znaky HNL/K-F patří převaha proliferujících CD8 pozitivních blastů s apoptotickým rozpadem, často jsou přítomny tzv. plazmacytoidní monocyty a výrazná bývá reakce makrofágů pozitivních CD68/myeloperoxidáza. Morfologicky ani imunofenotypicky neprokazujeme neutrofilní leukocyty a minimální je přítomnost plazmatických buněk. V případě nekrotizujícího a xantomatózního typu je z diferenciální diagnózy třeba vyloučit také infekční příčiny lymfadenopatií. V případě nutnosti odlišit HNL/K-F od lymfomu je možné výsledek opřít o vyšetření přestavby imunoreceptorového genu T buněčné populace pomocí PCR.
Klíčová slova:
Kikuchiho-Fujimotova choroba – histiocytární nekrotizující lymfadenopatie – imunohistochemické vyšetření – PCRNenádorové lymfadenopatie stály a dosud stojí ve světle klasifikace lymfomů a její složitosti poněkud v pozadí. Přitom jde o relativně častá onemocnění, se kterými přichází do styku každé pracoviště zabývající se bioptickou diagnostikou. Většinou jde o jednoduchou diagnózu hyperplázie lymfatických uzlin, případně specifického zánětu. Nicméně řada nenádorových procesů patologie lymfatických uzlin je méně častá a má komplikovanější diferenciální diagnostiku. Na pracovišti jsme popsali např. nekrotizující lymfadenitidu způsobenou virem spalniček (1) a sinusovou histiocytózu s masivní lymfadenopatií (2). Tato onemocnění často vzbuzují obavy, abychom nepřehlédli lymfom, přičemž rozlišení nenádorových lymfadenopatií a lymfomů nemusí být v konkrétních případech snadné. Přitom správná diagnóza má zásadní dopad na další osud nemocného. Klinická stránka onemocnění není pro diagnostiku mnohdy významná, protože jak nádorové lymfadenopatie, tak nenádorové stavy nemusí mít kromě zvětšení lymfatické uzliny žádné další projevy a anamnéza nemocného je často nevýznamná.
Jednou z diagnosticky náročnějších lézí je histiocytární nekrotizující lymfadenitida Kikuchi-Fujimoto (HNL/K-F). Simultánně ji v roce 1972 popsali v japonském písemnictví Masahiro Kikuchi a autoři Fujimoto Y. et al. Z dostupnějších prací je dobře známá publikace Kikuchi et al. z roku 1977, která poukazovala na souvislost dvou případů s infekcí toxoplazmózou (3). V sedmdesátých letech se HNL/K-F považovala za chorobu východního světa, ale později se ukázalo, že se onemocnění vyskytuje v Evropě a v Americe, i když častěji u asiatů. Prvně na nemocné analyzované z biopsií ze starého kontinentu upozornili v roce 1982 Pileri et al. (4) a krátce na to byli popsáni první pacienti ve Velké Británii (5) a na americkém kontinentu (6). Dorfman a Berry navrhli označovat onemocnění jako Kikuchiho-Fujimotovu chorobu (7).
Základním znakem choroby je akutně či subakutně vzniklá krční lymfadenopatie častěji se vyskytující u mladých žen (obvykle ve třetím decéniu, ale s rozptylem od batolecího věku (8) až do osmého decénia (7)). Může být mírně bolestivá, a může být provázena nebo předcházena příznaky onemocnění dýchacích cest, zvýšenou teplotou nebo horečkou, nočními poty, zvýšenou sedimentací a v krevním obraze neutropenií, někdy s lymfocytózou s atypickými lymfocyty v periferní krvi a vzácněji s dalšími poruchami.
Etiologie onemocnění není do současné doby jasná. Lymfadenopatie nereaguje na běžnou antibiotickou léčbu či kombinovanou anti-tuberkulózní terapii a lymfatická uzlina je proto často exstirpována a histopatologicky vyšetřena. U případů se spontánním průběhem dochází k ústupu příznaků, nejčastěji v rozmezí od jednoho do pěti měsíců od počátku symptomů. Histopatologické vyšetření prokáže v rozvinutých případech nekrotizující lézi v parakortexu, případně vystupňovanou nekrotizaci s postižením až většiny tkáně uzliny. Nápadným znakem je absence neutrofilních leukocytů a minimální je také zastoupení plazmatických buněk. Jsou však přítomny aktivované T lymfocyty, četné makrofágy a někdy jsou hojně zastoupeny zvláštní dendritické buňky připomínající plazmatické buňky, tzv. plazmacytoidní monocyty. Aktivované T lymfocyty mohou převládat a procesu propůjčovat alespoň fokálně uniformní – blastický vzhled. Jsou mitoticky aktivní a tím léze na první pohled připomíná lymfom, zároveň se však ve většině případů objevuje jejich apoptotický rozpad. Uvedený vzhled připomínající lymfom bývá umocněn v případech, kdy lymfadenopatie nevykazuje nekrózu a celý proces má převážně T lymfocytární složení. Kuo et al. postřehli variabilitu cytologického složení patologických infiltrátů a roztřídili morfologické nálezy do tří základních skupin, které by mohly odpovídat časovému vývoji choroby, případně individuálním rozdílům v reaktivitě imunitního systému nemocných (9). Nejčastěji je zaznamenáván obraz s vyvinutou nekrotizací, tzv. nekrotizující typ. Jemu pravděpodobně může předcházet tzv. proliferativní typ, kdy je zastižen blastický infiltrát s apoptotickým rozpadem, ale bez nekrózy. Třetí formou je xantomatózní typ, u kterého v mikroskopickém obrazu převládají makrofágy.
HNL/K-F často vyvolává diferenciálně diagnostické rozpaky v odlišení od lymfomů (7,10,11) a v některých případech i od infekčních lymfadenitid a lymfadenopatií v rámci systémových autoimunitních chorob.
Protože onemocnění není časté, je vhodné si jej připomenout na vlastním souboru nemocných.
Materiál a metody
Soubor nemocných
V letech 2001 až 2012 jsme vyšetřili 24 nemocných s uzlinovým syndromem, ve kterém jsme prokázali nekrotizaci nebo blastický splývající infiltrát z T lymfocytů a vlastní patologický proces neměl nádorovou povahu. Z tohoto souboru jsme vyloučili 5 nemocných, jejichž nález nesplňoval diagnostické znaky nekrotizující lymfadenitidy typu Kikuchi-Fujimoto. U nemocných vyřazených ze sestavy byla zaznamenána nekróza s přítomností hojných granulocytů (2x), epiteloidních buněk v okolí nekróz (2x), expanze parakortexu s hojnými imunoblasty jak B tak T řady naznačující možnost virové lymfadenopatie (1x).
Kromě nenádorových procesů jsme navíc u jedné nemocné na HNL/K-F pomýšleli, ale v průběhu stanovení diagnózy jsme proces zařadili jako tzv. malobuněčnou formu velkobuněčného anaplastického lymfomu, ALK pozitivního.
Vlastní soubor tvořilo 19 nemocných. Z toho 10 bylo zasláno ke druhému čtení z různých pracovišť v ČR (viz poděkování v závěru) a 9 pocházelo z biopsií provedených ve Fakultní nemocnici v Motole.
Imunohistochemické vyšetření
V základním panelu jsme použili protilátky proti molekulám: CD20, CD23, CD3, CD4, CD8, granzyme B, perforin, CD30, CD15, CD56, CD57, CD68, CD138, myeloperoxidázu (MPX), LMP-1 EBV, Ki-67. Kromě této sady byly v průběhu let vyšetřování používány další protilátky (CD2, CD5, CD10, CD31, CD43, CD45 RO, anti-elastáza) a průkaz naphthol-AS-D-chloroacetát esterázy, jejichž opakování jsme pro současnou revizi případů nepovažovali za přínosné.
Imunohistochemické vyšetření exprese jednotlivých molekul jsme prováděli na tkáních fixovaných ve formolu a zalitých do parafinu. Primární protilátky byly použity od následujících výrobců: Dako (CD20, CD8, granzyme B, CD30, CD68, CD138, MPX, LMP-1 EBV, Ki-67), Thermo Scientific – Lab Vision (CD23), BioGenex (CD3, CD4, CD15, CD57), Leica – Novocastra (perforin, CD56). Ředění primárních protilátek a předpříprava tkání pro demaskování antigenních epitopů bylo provedeno podle obvyklých standardizovaných postupů. Pro detekci jsme používali dva typy chromogenních systémů – sekundární protilátky značené biotinem a následně křenová peroxidáza značená streptavidinem nebo systém polymerní bez přítomnosti můstku streptavidin-biotin (polymer s navázanými sekundárními protilátkami a peroxidázou). Jako substrát jsme použili peroxid vodíku a jako ko-substrát 3,3’-diaminobenzidin tetrahydrochlorid hydrát.
Molekulární vyšetření
Ze souboru 19 pacientů jsme sedm nemocných podrobili molekulární analýze využívající detekci klonálních přestaveb imunoreceptorových genů (TCRgamma, TCRdelta, případně TCRbeta, IgH, IgK, IgL) za využití zavedeného standardizovaného mezinárodního protokolu BIOMED-2 (12).
Nukleové kyseliny jsme izolovali u 4 pacientů z parafínových řezů z formolem fixovaných tkání (5-10 řezů, 5μm) pomocí komerčně dostupného kitu (QIAampDNA FFPE tissue kit, QIAGEN), u 3 pacientů byla DNA extrahována z kryostatových řezů (5–10 řezů, 5μm) pomocí TRIZOLU (Invitrogen).
VÝSLEDKY
Sestavu 19 nemocných s diagnostickými znaky odpovídajícími HNL/K-F tvořilo 12 žen a 7 mužů. Věkový průměr v době diagnózy byl 28 let, medián 25 let, nejmladšímu nemocnému bylo 15 let, nejstaršímu 60 let. Jeho kasuistika je popsána samostatně se spoluúčastí jednoho z autorů tohoto článku (13). Z ostatních nemocných nebyl nikdo starší než 43 roky. U 18 nemocných byla přítomna cervikální lymfadenopatie a vyšetření bylo provedeno z exstirpované krční lymfatické uzliny, u jedné nemocné jsme vyšetřovali tříselnou lymfatickou uzlinu. Podle omezených klinických údajů šlo o jednostrannou lymfadenopatii, u jedné ženy bylo zvětšení mízních uzlin oboustranné. U jednoho nemocného bylo zjištěno kromě zvětšené krční uzliny i zvětšení lymfatických uzlin retroperitoneálních, bioptována byla uzlina krční. Jednou jsme zaznamenali předchozí terapii antibiotiky pro zvýšené teploty a krční lymfadenopatii, avšak příznaky neustupovaly a bylo přistoupeno k exstirpaci uzliny. U jednoho nemocného ve věku 15 let byl prokázán systémový lupus erytematodes, u jednoho 24-letého muže bylo podezření na juvenilní revmatoidní artritidu. U šesti pacientů byla lymfatická uzlina exstirpována s klinickým podezřením na lymfom, u ostatních bylo v klinické diagnóze konstatováno zvětšení lymfatické uzliny bez bližší specifikace. Z 10 druhých čtení jsme u jednoho nemocného obdrželi lézi k revizi s původní diagnózou B lymfomu bez bližší specifikace, u jednoho byla stanovena diagnóza periferního T lymfomu blíže neurčeného (PTCL NOS) a u jednoho diagnóza klasického Hodgkinova lymfomu smíšené buněčnosti; u dvou případů jsme nález obdrželi s diferenciální diagnózou mezi PTCL NOS a HNL/K-F. U jednoho muže byla stanovena diagnóza reaktivní lymfadenitidy s podezřením na etiologii EBV. Pouze u jediné nemocné byla stanovena diagnóza HNL/K-F již v prvním čtení. U tří nemocných jsme v korespondenci neměli údaje o diagnóze.
Makroskopicky byly excidovány jednotlivé lymfatické uzliny (popis velikosti byl dostupný u 13 nemocných). Uzliny měřily od 5 mm do 32 mm, v průměru 17 mm. V jednom případě byla exstirpována skupina lymfatických uzlin 30x15x12mm. Na řezu bylo v případě přítomnosti nekrotizace patrné jedno ložisko nebo více mapovitých ložisek světle nažloutlé barvy. U dvou případů byla nekróza modifikována krvácením, ale protože šlo o čerstvé krvácení je pravděpodobné, že krvácení vzniklo jako peroperační artefakt.
Při mikroskopickém vyšetření měly všechny vyšetřené lymfatické uzliny alespoň zčásti zachovanou strukturu – lymfatické folikuly, parakortex a splavy. Typickým znakem byla ložisková, ale nestrukturalizovaná – difúzní expanze parakortexu, kterou tvořila směs buněk s převahou velkých buněk charakteru imunoblastů, s příměsí malých lymfocytů a v šesti případech s nápadnějším zastoupením plazmacytoidních monocytů (obr. 1). Plazmacytoidní buňky byly většinou menší než aktivované imunoblasty, měly excentricky uložené jádro s hrudkami heterochromatinu bez zřetelného jadérka (na rozdíl od imunoblastů) a amfofilní cytoplazmu (obr. 2). Při nižším zastoupení těchto buněk byla jejich identifikace obtížná. Imunoblasty vykazovaly výraznou mitotickou aktivitu a takový infiltrát na první pohled vzbuzoval dojem z maligní povahy. Měly většinou okrouhlá jádra se zřetelným jedním centrálním nukleolem, případně se dvěma menšími nukleoly. Cytoplazma byla rozložena symetricky kolem jádra nebo byla lehce asymetrická. Blasticky aktivované buňky vykazovaly i atypie ve smyslu rozkolísané velikosti, ale zejména jaderné a tvarové nepravidelnosti (obr. 3). V 17 případech byly přítomny znaky rozpadu těchto buněk ve formě četných reziduálních tělísek. Často se přitom vyskytovaly přimísené makrofágy s fagocytózou rozpadlých buněk.
1. Blasticky aktivované lymfocyty s minimálním apoptotickým rozpadem. Nápadná je rozkolísanost velikosti těchto buněk, zřetelná jadérka a bazofilní cytoplazma. Přítomny jsou roztroušené makrofágy s fagocytovanými zbytky rozpadlých buněk. Barveno hematoxylinem a eozinem (zvětšení 200x). 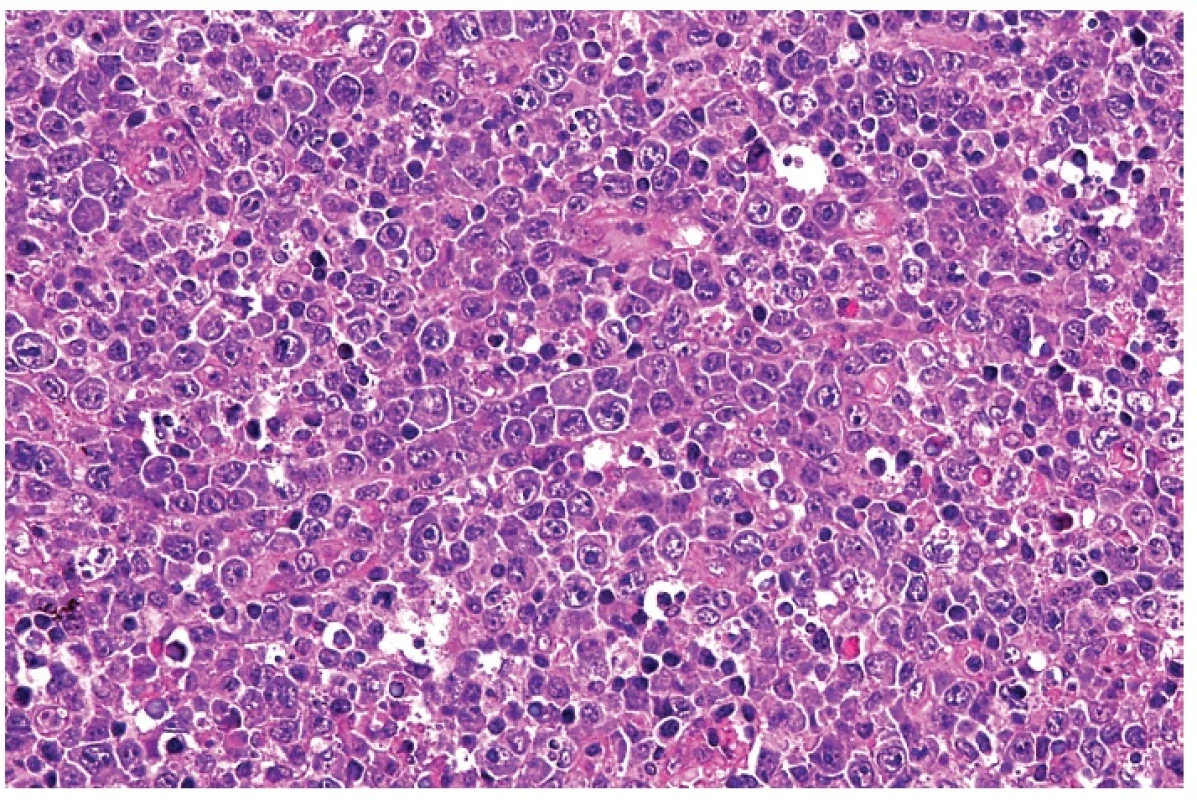
2. Hranice nekrózy s rozpadlou eosinofilní drtí, četnými residuálními tělísky po apoptotickém rozpadu buněk a s příměsí aktivovaných lymfocytů a plazmacytoidních buněk s excentricky uloženými jádry. Barveno hematoxylinem a eozinem (zvětšení 200x). 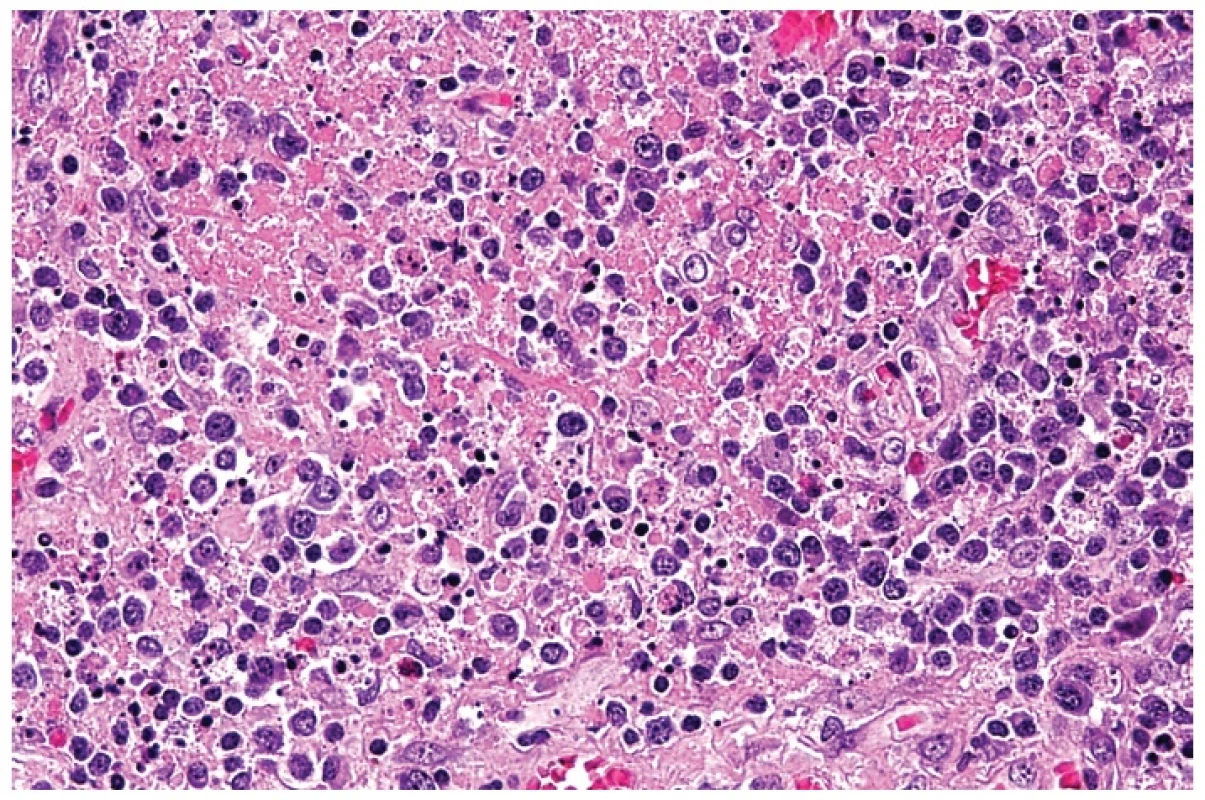
3. Smíšený infiltrát s převažujícím podílem středně velkých a velkých atypických blasticky aktivovaných lymfocytů vzbuzující dojem maligního nádoru. Apoptoticky se rozpadající buňky jsou ojedinělé. Příměsí jsou nesnadno identifikovatelné plazmacytoidní monocyty. Barveno hematoxylinem a eozinem (zvětšení 200x). 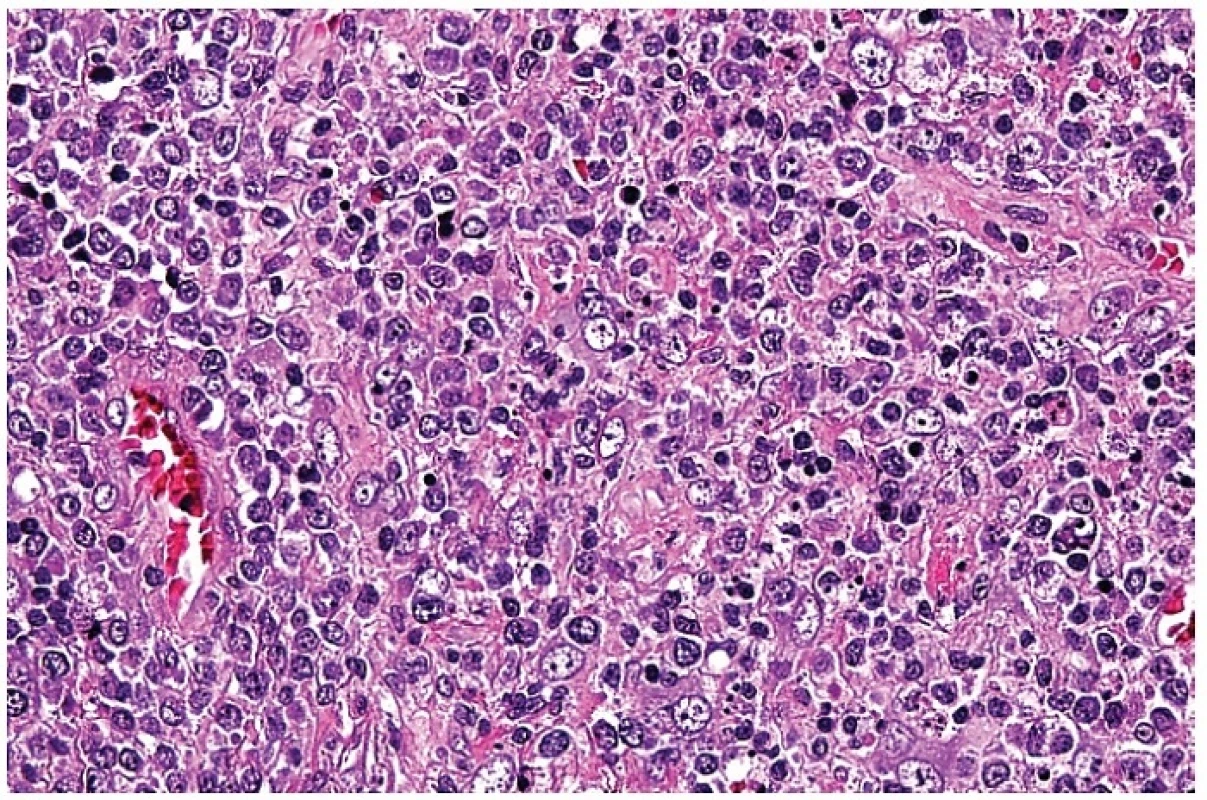
Tento infiltrát propadal ložiskově, často jen v jednom ložisku, nekrotizujícímu rozpadu (obr. 4). Případů s různě rozvinutou nekrózou bylo čtrnáct. Nekrózy měly nepravidelně okrouhlý až mapovitý tvar. V tomto prostředí byly přítomny různě hojné buňky s fragmentací jader do apoptotických tělísek, které se vyskytovaly v houfcích buněk až do ložisek masivního rozpadu. Úseky s intenzivní apoptózou bylo obtížné odlišit od příměsi neutrofilních leukocytů. Nekrotizace byla často inkompletní s rozpoznatelnými jednotlivými buňkami, zejména makrofágy a s karyorhektickými rozpadlými jádry. V ložiscích, kde rozpad buněk nebyl kompletní, měly makrofágy často lateralizované jádro prohnuté do srpku – tzv. srpkovité makrofágy (obr. 5). Jejich cytoplazma byla eozinofilní a hrubě zrnitá. V nekrózách byly patrné stínovitě zachované trombotizované drobné cévy a v nekrotickém detritu jsme pozorovali exsudaci fibrinu. V okolí nekróz byla buď blastická populace s příměsí makrofágů nebo četné světlé pěnité makrofágy a plazmacytoidní monocyty. Chyběly neutrofilní leukocyty (pokud se vyskytovaly, tak v cévách) a plazmatické buňky byly ojedinělé. U čtyř nemocných nebyla nekrotizace vyvinuta a nález jsme hodnotili jako tzv. proliferativní typ HNL/K-F (obr. 6). Makrofagická reakce se světlými pěnitými makrofágy převažovala pouze u jedné nemocné – xantomatózní typ HNL/K-F (obr. 7).
4. Přehledné zvětšení nekrotického úseku v lymfatické uzlině zasahující od pouzdra hluboko do parakortexu. Nápadným rysem je skvrnitost infiltrátě v okolí nekrotického ložiska. Barveno hematoxylinem a eozinem (zvětšení 20x). 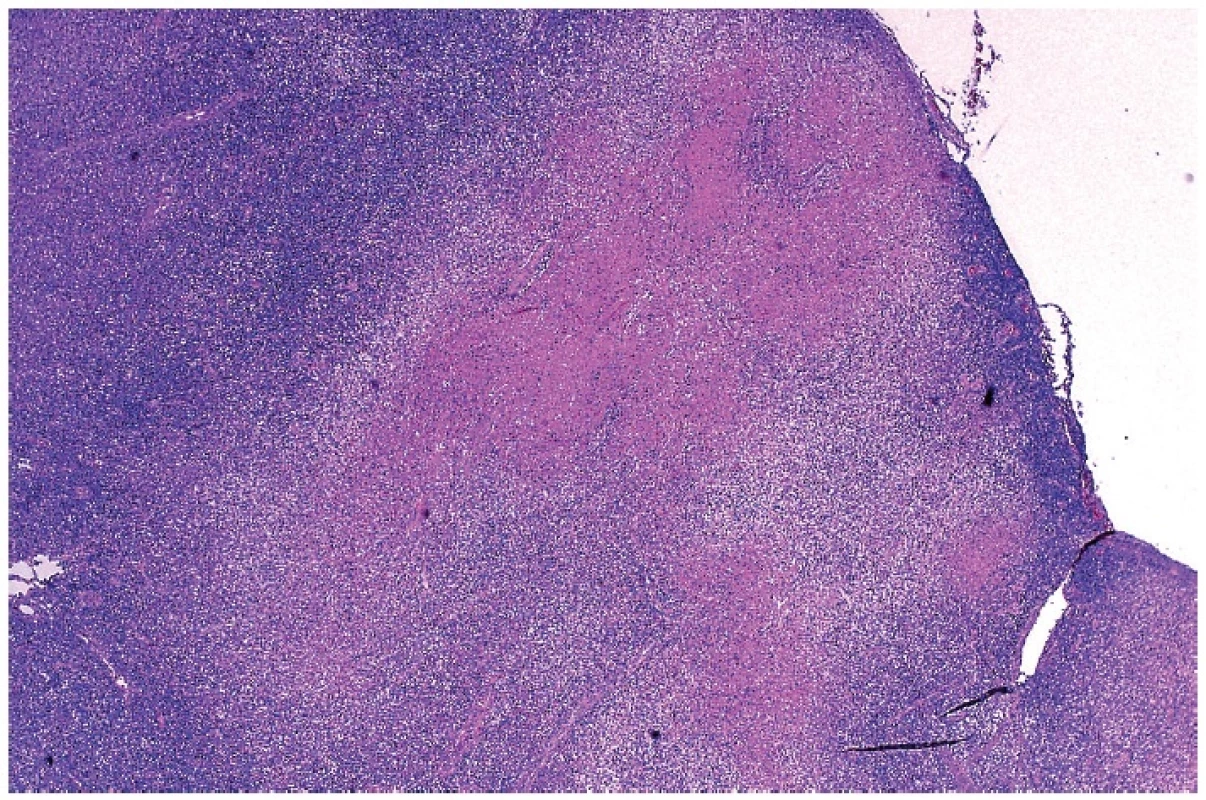
5. Detail hranice nekrotického úseku s akumulací makrofágů, často s lateralizovanými prohnutými jádry – tzv. srpkovité makrofágy. Barveno hematoxylinem a eozinem (zvetšení 200x). 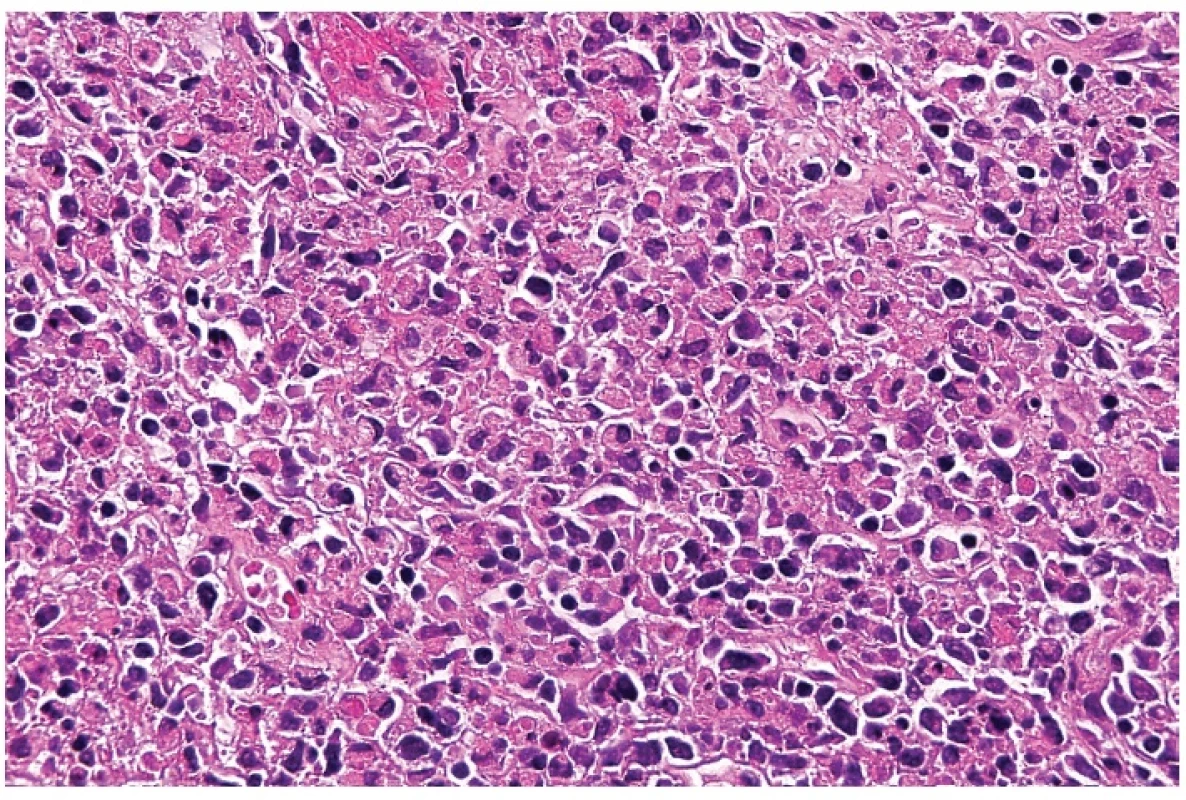
6. Přehledné zvětšení nepravidelně mapovitého infiltrátu lymfatické uzliny bez vyvinuté nekrotizace, tzv. proliferativní typ HNL/K-F. Barveno hematoxylinem a eozinem (zvětšení 20x). 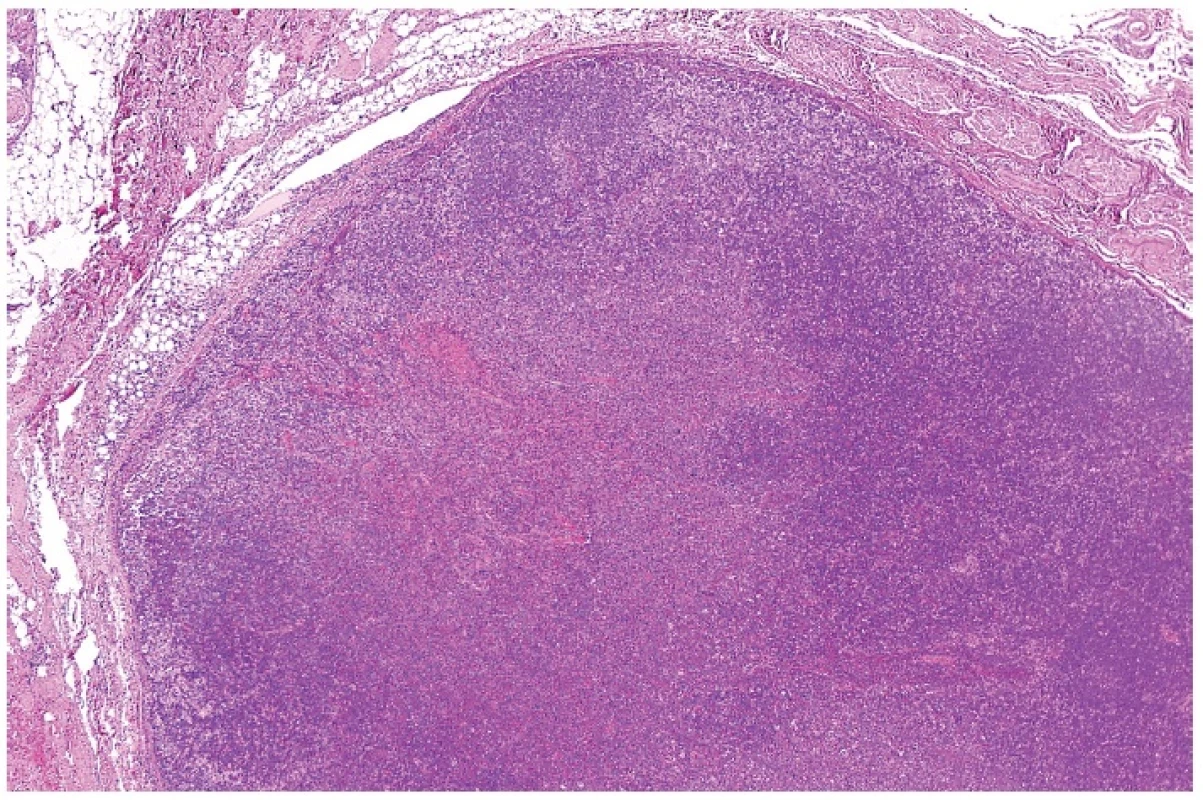
7. Přehled nekrotického úseku v parakortexu lymfatické uzliny s převahou pěnitých makrofágů v okolí nekrózy, tzv. Xantomatózní typ. Barveno podle Giemsy (zvětšení 20x). 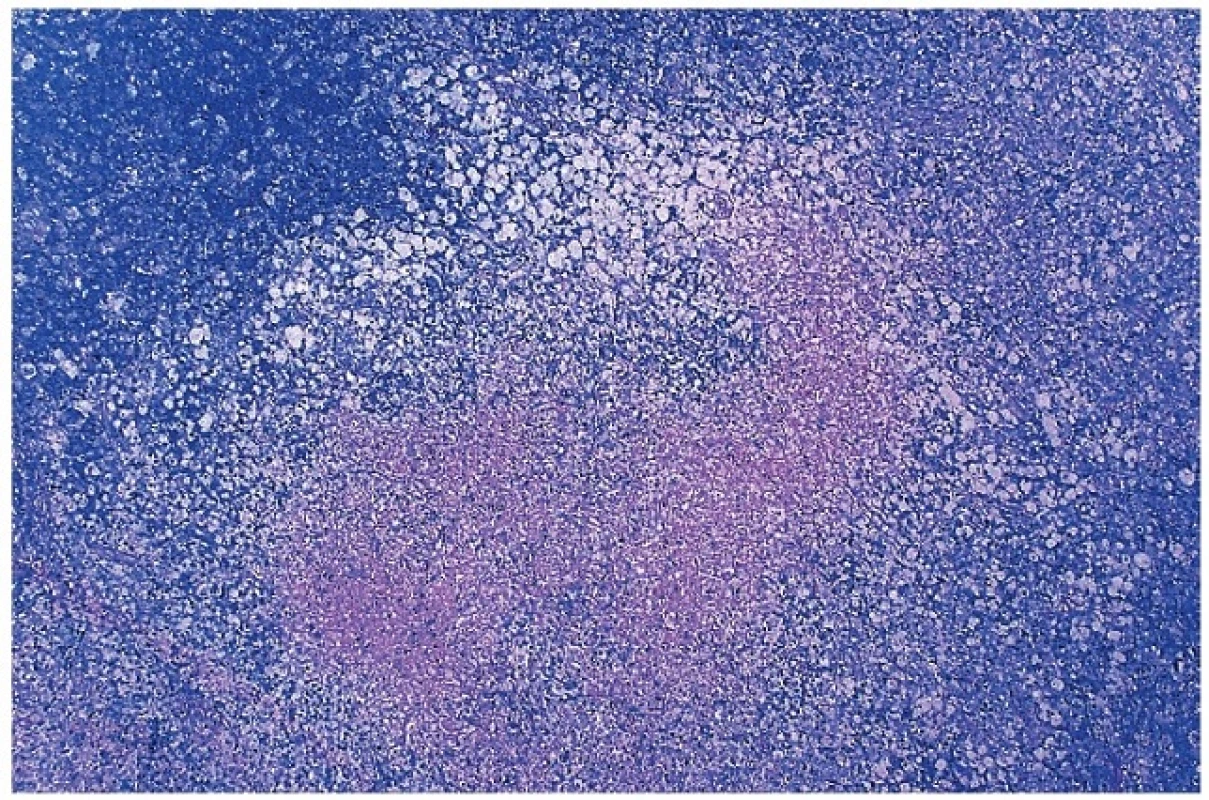
Kromě patologických úseků měly lymfatické uzliny částečně zachovanou folikulární strukturu, u osmi nemocných s aktivací zárodečných center lymfatických folikulů, u ostatních byly folikuly spíše atrofické. Byl zachován marginální splav a intranodální sinusy, většinou bez nápadnější histiocytózy splavů. Pouzdro lymfatických uzlin bylo u tří případů výrazně vazivově ztluštělé, v okolí uzliny byl edém a paprsčitá fibroproduktivní reakce zasahující do okolní tukové tkáně. V jednom případu se patologický infiltrát s přítomností blastů šířil přes pouzdro do okolní tukové tkáně a ve dvou případech jsme zaznamenali malobuněčnou lymfocytární infiltraci zasahující rovněž za pouzdro lymfatické uzliny (obr. 8).
8. Zánětlivá fibroproduktivní reakce paprsčitě vyzařující za hranici původního pouzdra lymfatické uzliny s bohatou lymfocytární příměsí. Oblasti souvisejí s nekrotickým úsekem v uzlině (částečně zachycen v horní části obrázku). Barveno hematoxylinem a eozinem (zvětšení 50x). 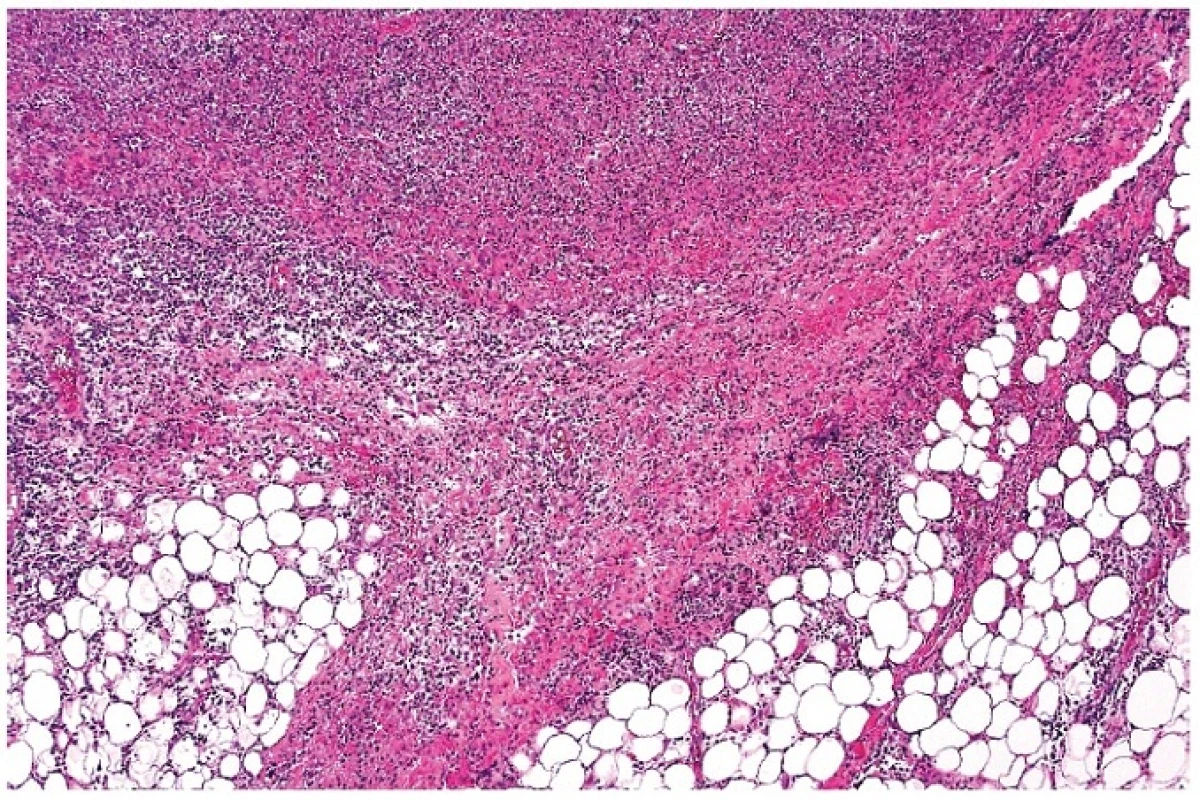
U jedné nemocné, ženy ve věku 22 let, jsme měli k dispozici dvě po sobě následující biopsie s intervalem exstirpace uzlin dva měsíce. V první vyšetřené lymfatické uzlině velikosti v největším rozměru 12 mm byl obraz nenápadný – v rozšířeném parakortexu byly disperzní apoptoticky se rozpadající aktivované lymfocyty, bez příměsi makrofágů. Makrofágy byly přítomné jen v sinusech. Diagnosticky jsme nález uzavírali jako chronickou reaktivní lymfadenopatii s diferenciálně diagnostickým odkazem na možnou HNL/K-F v proliferativní fázi. Ve druhé biopsii provedené s odstupem dvou měsíců pro přetrvávající lymfadenopatii byla ze stejné strany krku odstraněna lymfatická uzlina o velikosti 15 mm s již rozvinutou nekrotizací, makrofagickou reakcí a s vystupňovaným apoptotickým rozpadem lymfocytů v rozšířeném parakortexu.
Imunohistochemické vyšetření
Imunohistochemické vyšetření pomohlo identifikovat různé typy zastoupených buněk. V zachovaných oblastech původní lymfatické uzliny (často jen na periferii uzliny) byla kora s reziduálními lymfatickými folikuly CD20 a PAX5 pozitivní a byly zde také ojedinělé CD138 pozitivní plazmatické buňky (obr. 9). V patologických infiltrátech prakticky chyběly CD20 pozitivní B lymfocyty a plazmatické buňky. CD23 pozitivní síť dendritických buněk byla zachovaná a to i v atrofických folikulech. CD3 a další T buněčné markery ukázaly na masivní pole pozitivit v rozšířeném parakortexu a v patologickém infiltrátu. Důležitou informaci přinášelo posouzení poměru CD4 a CD8 pozitivních lymfocytů, který byl u všech vyšetřených posunut ve prospěch pozitivity CD8 (obr. 10). Je však nutné zdůraznit, že protilátka anti CD4 značila i makrofágy a plazmacytoidní monocyty (obr. 11), takže se místy zdálo, že CD4 pozitivity byly rovněž hojné. Reaktivita CD4 byla v těchto buňkách obecně slabší než kontrola v lymfocytech nepostižené části uzliny a slabší než průkaz CD8. Blastické buňky byly pozitivní rovněž při detekci perforinu a granzymu B (obr. 12). Makrofágy byly CD68 pozitivní (obr. 13). Jejich distribuce byla variabilní, ale byly vždy hojně zastoupeny. Pozitivita byla granulární s různě hrubou zrnitostí. Kromě pozitivity v jasných makrofázích značila protilátka anti CD68 také plazmacytoidní monocyty (obr. 13). Pozitivita těchto buněk se odlišovala od pozitivity makrofágů denzní homogenností reaktivity cytoplazmy a také se zvýraznilo excentrické uložení jádra. Simultánně s pozitivitou CD68 vykazovaly makrofágy také pozitivitu při průkazu MPX (obr. 14). Při absenci nekrotizace byly makrofágy a plazmacytoidní buňky různě hojně roztroušené v populaci atypických CD8 pozitivních buněk. Exprese molekuly CD30 byla pozitivní v aktivovaném parakortexu v imunoblastech, v oblastech infiltrovaných uniformní až blasticky vyhlížející populací byly přítomny jen nečetné velké CD30 pozitivní buňky. U jedné nemocné byly CD30 pozitivní aktivované buňky v parakortexu natolik hojné, že obraz budil podezření na klasický Hodgkinův lymfom. Molekula CD15 byla negativní a také morfologický obraz těchto buněk neodpovídal Hodgkinovým buňkám. Spolu s ostatním nálezem v lymfatické uzlině jsme patologický proces mohli zařadit jako HNL/K-F. Vyšetření molekuly CD57 nebylo přínosné, obvykle jsme prokázali jen nečetné disperzní pozitivní lymfoidní buňky. Molekula CD56 byla exprimována na části plazmacytoidních monocytů.
9. Imunohistochemický průkaz exprese molekuly PAX5 ukazující na zbytkové populace B lymfocytární zóny v uzlině infiltrované aktivovanými buňkami při HNL/K-F. Dobarveno hematoxylinem (zvetšení 20x). 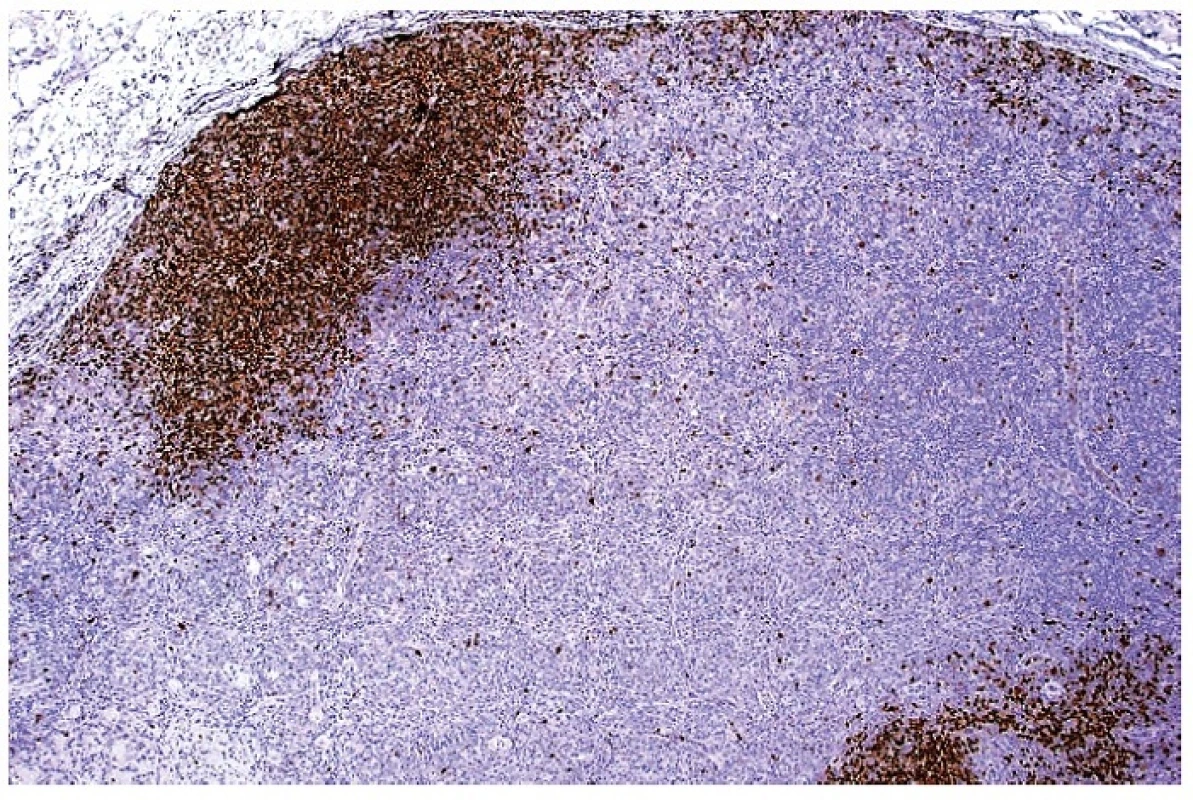
10. Molekula CD8 na buněčných membránách a s bodovou pozitivitou cytoplazmy blasticky aktivovaných T lymfocytů. Imunohistochemická reakce, dobarveno hematoxylinem (zvetšení 200x). 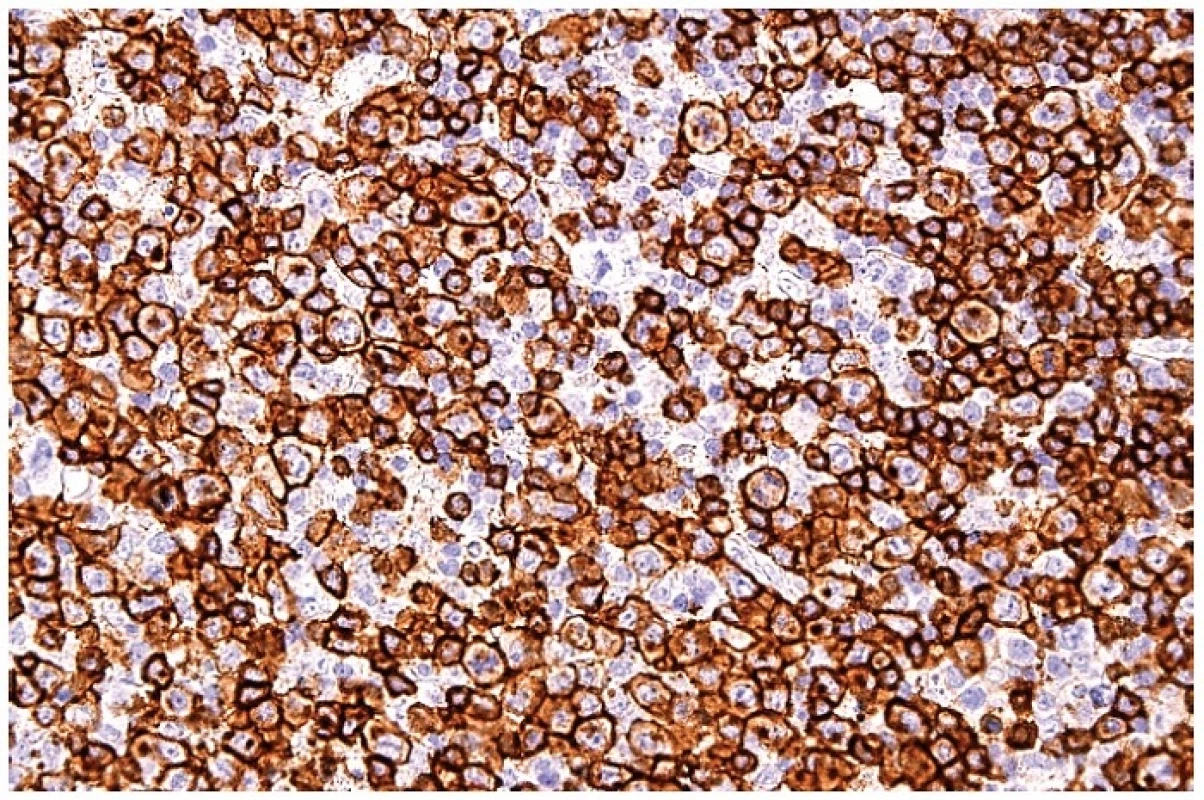
11. Molekula CD4 na buněčných membránách malých lymfocytů a roztroušených středně velkých plazmacytoidních monocytů. Imunohistochemická reakce, dobarveno hematoxylinem (zvetšení 200x). 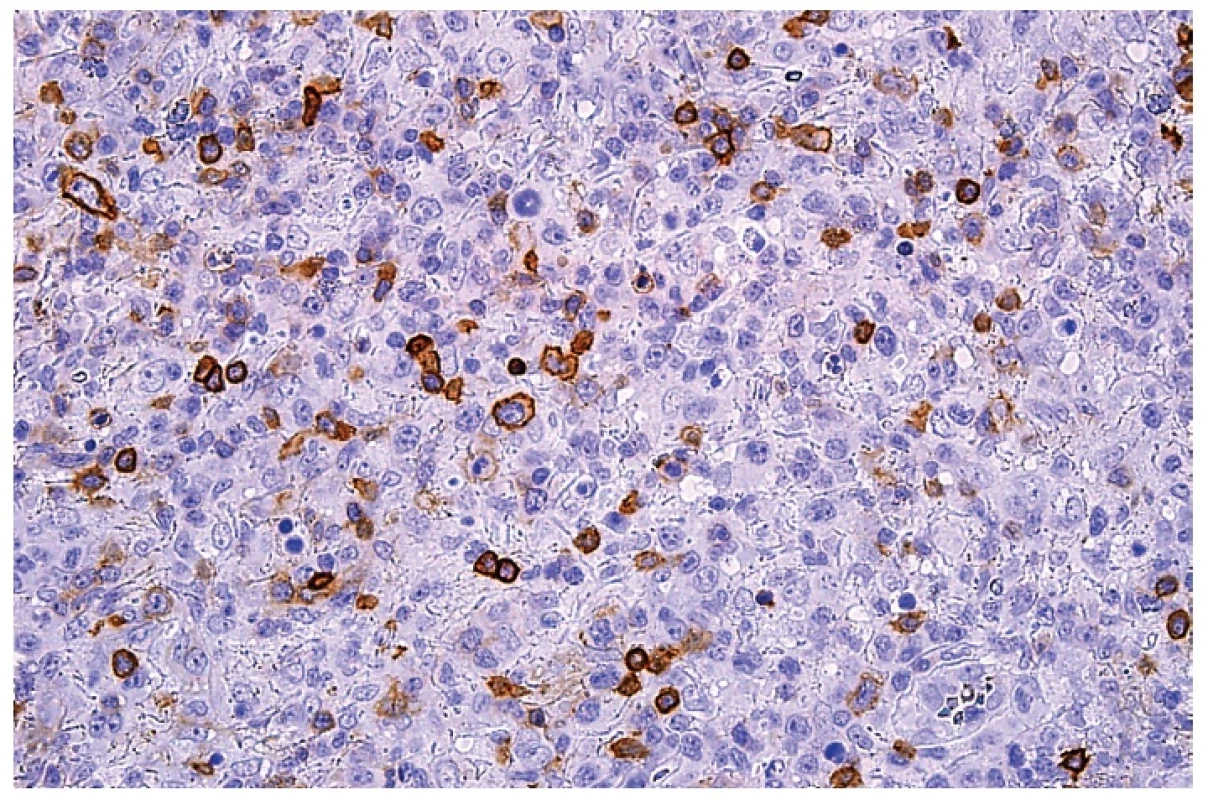
12. Průkaz perforinu v cytoplazmě blasticky aktivovaných T lymfocytů. Zbytkové populace B lymfocytární zóny jsou negativní. Imunohistochemická reakce, dobarveno hematoxylinem (zvetšení 200x). 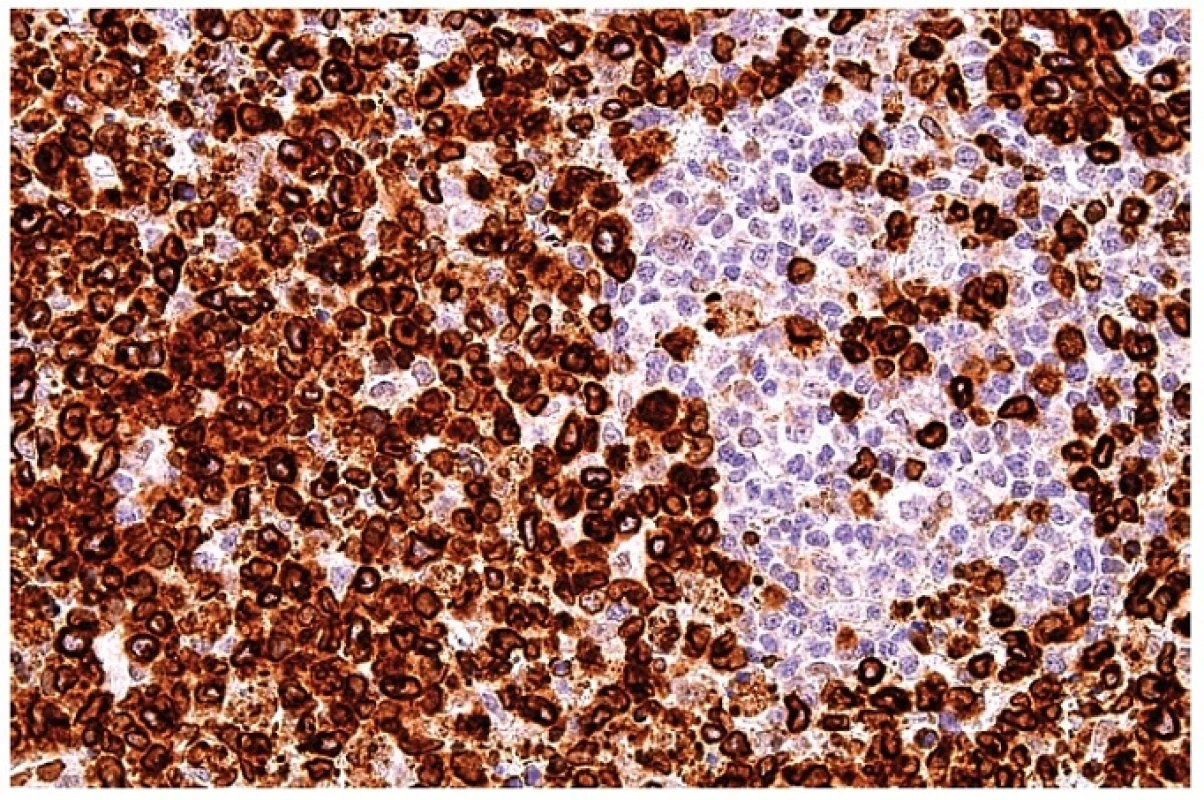
13. Průkaz molekuly CD68 v makrofázích ukazuje zrnitou reaktivitu velkých nepravidelně okrouhlých buněk soustředěných převážně v okolí nekrózy (částečně zastižena v pravé části obrázku). Středně velké buňky s homogenní pozitivitou zejména v centrální části obrázku jsou plazmacytoidní monocyty. Imunohistochemická reakce, dobarveno hematoxylinem (zvětšení 200x). 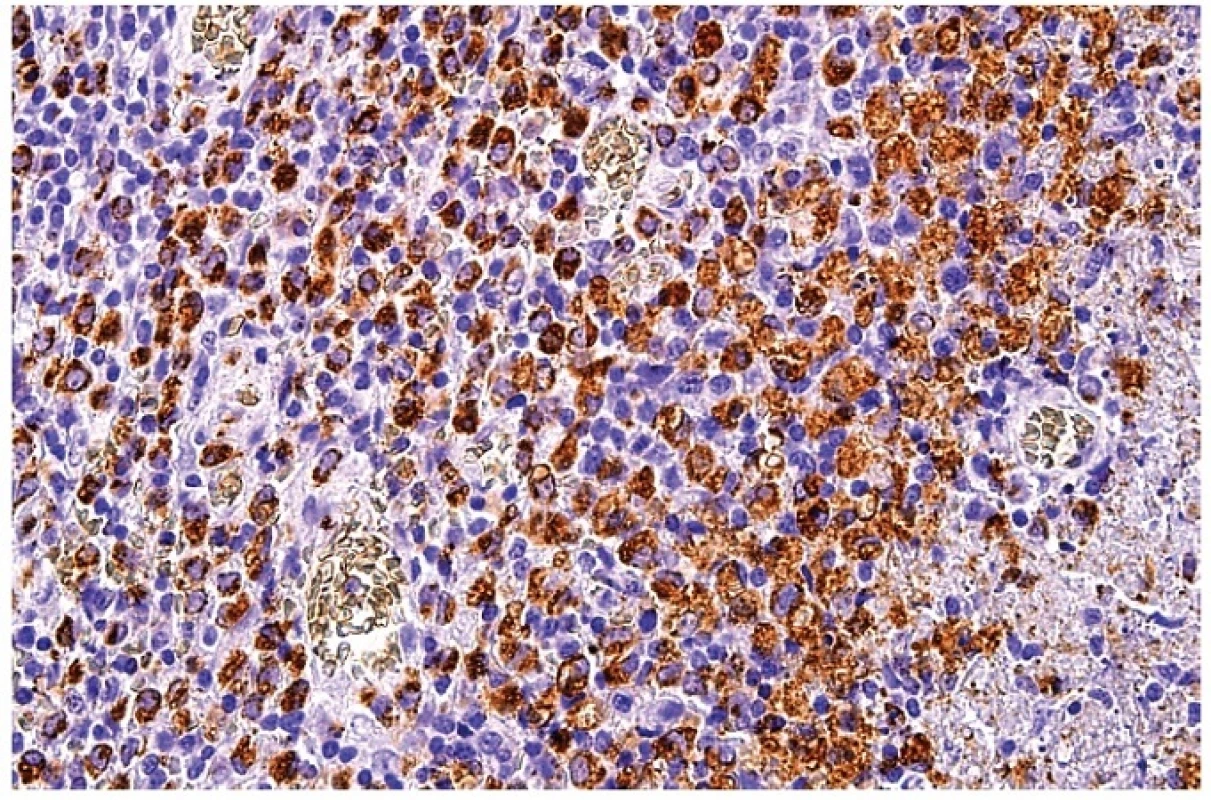
14. Průkaz MPX v makrofázích ukazuje silnou cytoplazmatickou reaktivitu. Blasticky aktivované atypické lymfoidní buňky jsou negativní. Imunohistochemická reakce, dobarveno hematoxylinem (zvětšení 200x). 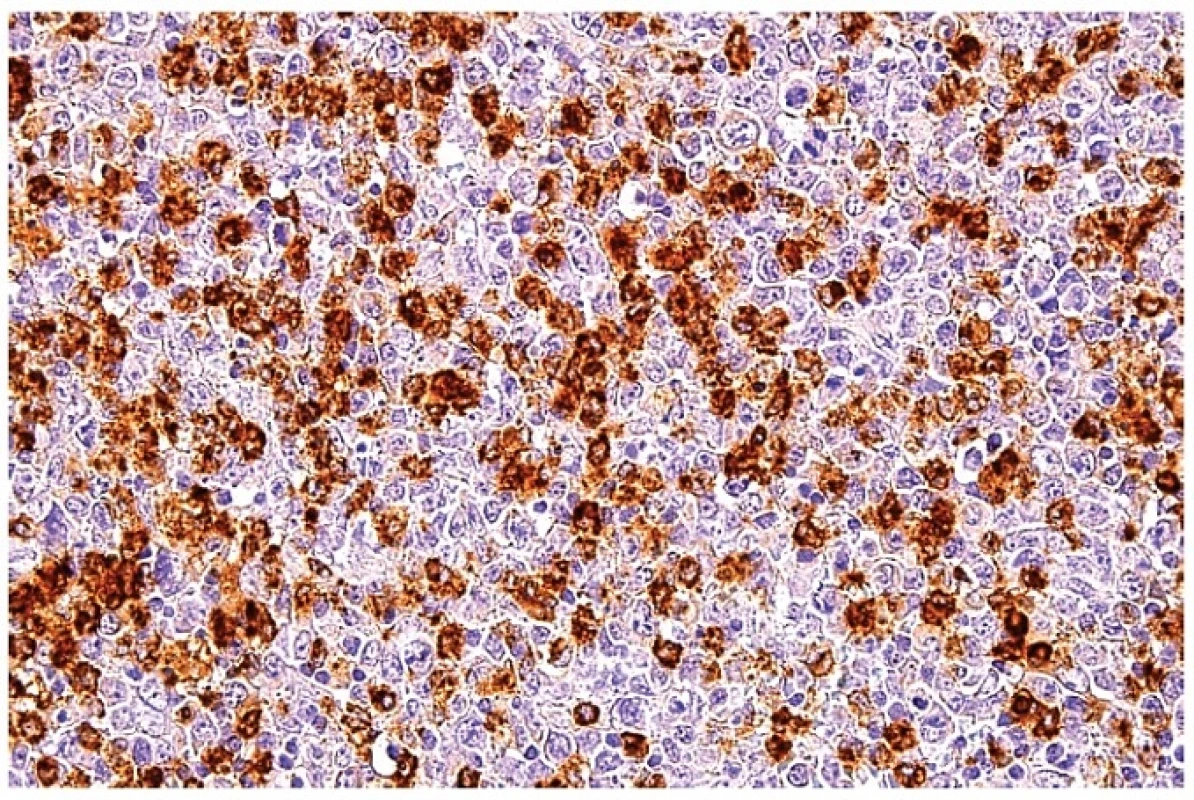
Vyšetření LMP-1 EBV bylo u všech lymfatických uzlin negativní. (U jedné nemocné s podezřením na EBV lymfadenitidu v prvním čtení jsme vyšetřili EBER, rovněž s negativním výsledkem.)
Proliferační aktivita hodnocená podle pozitivity Ki-67 antigenu v patologických oblastech bez nekrotizace, tedy v místech infiltrace lymfatické uzliny aktivovanými T lymfocyty, kolísala od případů s malým počtem blastů s proliferační aktivitou do 10 % až k případům s převahou aktivovaných T lymfocytů se 60 %, výjimečně s 80 % proliferační aktivity.
Při molekulární analýze klonality imunoreceptorových genů byla pouze v jednom případě izolace DNA nevýtěžná (parafínové řezy), kdy došlo k degradaci nukleových kyselin formolovou fixací, a proto jsme v dalších PCR vyšetřeních nepokračovali. U 6 úspěšně vyšetřených pacientů nebyla detekována klonální přestavba genů TCR. Z toho u dvou pacientů jsme navíc provedli také detekci klonality imunoglobulínových genů – klonální B lymfocytární komponentu jsme rovněž neidentifikovali.
DISKUSE
Histiocytární nekrotizující lymfadenitida Kikuchi-Fujimoto je rozpoznána již čtyři desetiletí, přesto stále láká k zamyšlení nad genezí, stejně jako nad diferenciálně diagnostickými obtížemi tohoto patologického procesu. Z námi provedeného vyšetření jsme u žádného nemocného neprokázali LMP-1 EBV (v jednom případě s negativním výsledkem testování in situ hybridizací molekuly EBER) a rovněž klinické údaje nesvědčily u žádného nemocného pro běžnou virovou nebo jinou infekci, byť data nejsou dostupná v celém rozsahu. Ani údaje z publikovaných prací nepřinášejí doklady o jednotné virové etiologii choroby. Jsou sice zaznamenány infekce viry EBV, herpesvirus 6 a 8, herpes simplex, ale žádný důkaz o příčinné souvislosti mezi HNL/K-F a těmito viry podán není. Uvažuje se o možném podílu infekce parvovirem B19 (14). V ojedinělých případech se onemocnění objevuje u nemocných infikovaných retroviry (HIV, HTLV-1), případně s bakteriálními onemocněními. O toxoplazmóze jsme se zmínili v úvodu, ale tato choroba jako příčina HNL/K-F také není potvrzena. Za rámec přesahující koincidenci chorob se považuje vztah HNL/K-F k autoimunitním chorobám, zejména k systémovému lupus erytematodes (SLE). SLE může HNL/K-F předcházet nebo se vyvinout až po proběhlém zánětu lymfatických uzlin (15,16). Kromě SLE je nekrotizující lymfadenitida popsána ve spojení se systémovou juvenilní artritidou, polymyozitidou, uveitidou, autoimunitní hepatitidou a dalšími autoimunitními onemocněními, a v některých případech také ve spojení s nádory (17–19). V naší sestavě byl u jednoho nemocného diagnostikován v předchorobí SLE a u jiného pravděpodobná juvenilní revmatoidní artritida, což by mohlo svědčit pro patologickou imunitní reakci lymfatických uzlin v rámci těchto onemocnění. U ostatních nemocných nebyl autoimunitní proces uveden a o sukcesivním vývoji nemáme zprávy, i když jsme na tuto možnost upozorňovali v bioptických výstupech. Definitivní průkaz, že HNL/K-F vzniká v rámci autoimunitních chorob, však podán není. V současné době se soudí, že lymfadenopatie se rozvíjí jako hyperimunitní stav v odpovědi na různorodé noxy, případně jako součást autoimunitního procesu. S ohledem na častější výskyt onemocnění u asiatů se uvažuje také o genetické predispozici. Tomu by mohla nasvědčovat vyšší incidence genů II. třídy HLA, DPA1*01 a DPB1*0202 u osob s HNL/K-F. Uvedený genotyp je relativně častý u asiatů a vzácný u bělochů (20).
Na problémy diferenciálně diagnostické, zejména s odlišením od lymfomů, poukazují nejen naše zkušenosti, ale jde o problém sdílený od doby identifikace choroby až do současnosti. Hlavním stimulem pro publikaci vyšetřeného souboru nemocných byla naše nedávná zkušenost s případem nemocné s krční lymfadenopatií a s masivní přítomností blastů v postižené uzlině, prakticky bez apoptotického rozpadu. U této nemocné jsme váhali mezi diagnózou lymfomu a HNL/K-F pod obrazem proliferativního typu. Nakonec jsme se pro dramatický morfologický obraz rozhodli pro diagnózu T lymfomu. Tato nemocná byla následně konzultována na jiném pracovišti, kde byl nález posouzen spíše jako nekrotizující lymfadenitida. Po negativním stagingu pro lymfom nebyla nemocná jako lymfom léčena a při jejím sledování u ní dosud nevznikla progrese onemocnění. Tuto nemocnou jsme do analyzovaného souboru nezařadili vzhledem k tomu, že jde o poměrně čerstvý případ a sledování trvá jen několik měsíců. Jsme si však vědomi, že naše diagnóza T lymfomu nebyla s vysokou pravděpodobností správná a že mohlo skutečně jít o vystupňované proliferativní stadium HNL/K-F bez dalších znaků typických pro HNL/K-F. Případ této nemocné podtrhuje stále přetrvávající diagnostické obtíže s tímto onemocněním, a to i v případech, kdy na HNL/K-F myslíme.
Iniciální názor, že onemocnění postihuje téměř výhradně ženy je nutné korigovat. Někteří autoři uvádějí poměry u dospělých nemocných žen a mužů od 1 : 1 až 1,1 : 1 (9) k 1,26 : 1 (21). Ženy tedy převažují méně, než se iniciálně soudilo. V analýze dat u čínských dětí byl dokonce zjištěn častější výskyt u chlapců v poměru k dívkám 1,65 : 1 (8). V naší sestavě byl poměr pohlaví 1,71 : 1 ve prospěch pohlaví ženského. Věkové zasazení nemocných našeho souboru je typické s průměrným věkem 28 let při diagnóze. K mladému věku je vhodné v rámci diagnostické úvahy přihlížet. Periferní T lymfomy se kromě velkobuněčného anaplastického lymfomu vyskytují ve vyšším věkovém zasazení (22).
Lymfadenopatie je v naprosté většině případů krční, obvykle v laterálním krčním trojúhelníku. V našem souboru měla jedna žena lymfadenopatii nadklíčkovou. Zvětšení uzlin nedosahuje velkých rozměrů. Bývá postižena jedna uzlina, méně často dvě nebo tři uzliny na stejné straně těla. Oboustranný proces je neobvyklý, ale u jedné nemocné jsme oboustranné postižení krčních uzlin vyšetřovali. V naší sestavě měřila největší lymfatická uzlina 32 mm, v průměru byla velikost uzlin 17 mm. To koreluje s údaji jiných prací (6, 23). U jedné nemocné jsme zaznamenali postižení tříselné uzliny jako podstatně méně obvyklého primárního místa a také u jednoho nemocného simultánní postižení krčních a retroperitoneálních uzlin. V literatuře jsou dostatečně dobře zmapovány případy s postižením axilárních lymfatických uzlin, uzlin mediastina, retroperitonea, uzlin kolem ilických cév a v tříslech, i když jde spíše o výjimky (6, 11).
Extranodální morfologické projevy jsou neobvyklé, ale nejčastěji jsou zaznamenány makroskopicky nespecifické a značně proměnlivé postižení kůže, kostní dřeně a poruchy jater s hepatosplenomegalií. Postižení kůže jsme zaznamenali u našeho pacienta mužského pohlaví ve věku 60 let (13).
Strukturálně jsou lymfatické uzliny postiženy prakticky vždy jen částečně, a to nepravidelně nodulárním – mapovitým infiltrátem s nekrotizací nebo bez ní. Cytologické složení patologických infiltrátů v lymfatických uzlinách je kolísavé a podle toho je i morfologický obraz poměrně rozmanitý a od pacienta k pacientovi vždy trochu odlišný. Přesto je možné nálezy zařadit do tří typů – proliferativní, nekrotizující a xantomatózní (9). V naší sestavě, podobně jako v jiných studiích, byla nejčastější nekrotizující forma. Xantomatózní typ s převahou makrofagické resorpční reakce jsme identifikovali pouze u jedné pacientky. Diagnosticky je nejproblematičtější proliferativní typ, jak jsme již naznačili. V naší sestavě jsme vyšetřovali čtyři případy proliferativního typu z celkového počtu devatenácti nemocných, tedy přibližně v jedné pětině. Tsang et al. uvádějí, že konečným stavem po reparaci nekrotických ložisek je fibroprodukce, kterou pozorovali u osmi případů, což je zcela v souladu s obecnými pravidly hojení nekróz (23). Hojení nekróz jsme zaznamenali pouze v podobě fibroproduktivního zánětu v oblasti pouzdra uzliny. Je však pravděpodobné, že by pozdější biopsie nekrotického procesu odhalila jizvení.
Blasticky aktivované T lymfocyty tvoří někdy majoritní populaci buněk HNL/K-F a odpovídají velikostně imunoblastům. Jde CD8 pozitivní T lymfocyty. Jádra jsou okrouhlá s centrálním jadérkem a lemem bazofilní cytoplazmy bez výraznějšího excentrického uložení. Prokáží se i buněčné atypie.
Histiocyty u HNL/K-F se ve většině případů neliší od tkáňových histiocytů u jiných onemocnění. Mají okrouhlá jádra a v cytoplazmě mohou obsahovat zbytková tělíska apoptoticky rozpadlých buněk. U části těchto buněk na pomezí nekrotických ložisek nebo přímo v nekrózách je jádro zatlačováno na periferii cytoplazmy a nabývá dosti charakteristický srpkovitý tvar. Tyto buňky se označují jako srpkovité makrofágy (23), nicméně nejsou příznačné pro HNL/K-F. Tyto buňky mohou mít pěnitou cytoplazmu a při lateralizaci srpkovitého jádra se někdy mohou jevit jako prsténčité buňky u metastatického adenokarcinomu (barvení k průkazu mukosubstancí, případně keratinů je negativní). Makrofágy v rámci HNL/K-F choroby vykazují alespoň v části populace koexpresi molekuly CD68 a myeloperoxidázy, CD68+/MPX+ (24), což jsme pozorovali i u našich nemocných. Rozpoznání MPX+ makrofágů od granulocytů nečiní pro jejich velikost a cytologické vlastnosti problémy. Z hlediska typizace makrofagické populace na typ M1 a M2 se ukazuje, že u HNL/K-F se vyskytuje v naprosté převaze typ M2 s expresí CD163, IL 10 a ligandu chemokinu 22 / CCL22, a s koexpresí MPX a CD123 (25). Tyto makrofágy se zřejmě podílejí na úklidové a reparativní aktivitě cytotoxického působení aktivovaných buněk imunitního systému.
Třetí buněčnou složkou vyskytující se charakteristicky u HNL/K-F jsou tzv. plazmacytoidní monocyty (26). Název není přesný, protože jde o jednu z forem dendritických buněk. Chamulak et al. si uvědomili problematické zařazení těchto buněk a navrhovali pro ně eponym – buňky Lennertovy a Remmeleovy (10), avšak termín se neujal a navíc v době před imunohistochemickou charakterizací jednotlivých buněčných typů byly tyto buňky špatně rozpoznatelné a byly nepochybně směšované s blasticky aktivovanými T lymfocyty. Vyskytují v lymfoidních orgánech, ale jejich procentuální zastoupení je za normálních stavů nízké. Proliferují do zvýšeného zastoupení zejména u HNL/K-F a u autoimunitních chorob, u hyalinně-vaskulárního typu Castlemanovy choroby, u Hodgkinova lymfomu a některých dalších nádorových onemocnění (27). Morfologický obraz plazmacytoidních monocytů je sice charakteristický, ale pokud nejsou přítomny v hojném zastoupení, nedají se v běžném vyšetření snadno identifikovat, poněkud lépe imunofenotypizací. Jsou pozitivní CD68 (ale ne MPX), exprimují kromě jiných antigenů CD4, CD56, HLA-DR a molekulu CD123 (28).
V lymfatických uzlinách jsou dále oblasti aktivovaného parakortexu s hojnými blasticky aktivovanými lymfocyty a interdigitujícími dendritickými buňkami. V některých případech je také zřetelná aktivace B zóny s vytvořenými zárodečnými centry v lymfatických folikulech. Často je však B zóna fragmentovaná a lateralizovaná na okraji uzliny a aktivaci nevykazuje. Je tedy sporné, zda je hyperplázie folikulů součástí HNL/K-F nebo je pouze koincidentálním nálezem.
Diferenciálně diagnostická úvaha při posuzování nálezu v lymfatické uzlině zahrnuje především vyloučení maligního onemocnění, které ušetří nemocného kromě stresu z diagnózy také stagingu s biopsií kostní dřeně a dalších vyšetření, případně také nasazení chemoterapie. Diagnostika je však v některých případech obtížná. U vyvinuté ložiskové až mapovité nekrotizace s apoptotickým rozpadem ložisek blasticky aktivovaných buněk bychom měli vždy na prvním místě myslet na HNL/K-F. Ve svízelnější situaci jsme při obrazu blastické infiltrace lymfatické uzliny s minimálním nebo nenápadným apoptotickým rozpadem. Jde o již zmíněný proliferativní typ (fázi) onemocnění (9). Zde je nanejvýš nutné imunohistochemické vyšetření zahrnující především stanovení proporcí B a T infiltrujících lymfocytárních buněk a následné vymezení převahy CD8, případně i granzym B a perforin pozitivních blastů nad buňkami odpovídajícími populaci CD4 lymfocytů. Toto vyšetření a posouzení není bezproblémové, protože makrofágy a plazmacytoidní monocyty reagují s protilátkou anti-CD4 a tím často vzbuzují dojem intenzivnější infiltrace T pomocnými lymfocyty než tomu ve skutečnosti je. Reaktivita CD4 u buněk jiného než T původu je však slabší intenzity. Také je vhodné spolu s reaktivitou posoudit cytologickou charakteristiku CD4 pozitivních buněk.
Z dalších možných záměn je z nádorových procesů třeba vyloučit tzv. blastický nádor z plazmacytoidních dendritických buněk, který se vyskytuje u starších nemocných (častěji mužů) a bývá rozpoznán iniciálně v kůži, ale častá je také lymfadenopatie, případně leukemizace a další systémové projevy (29). Pokud se bioptují lymfatické uzliny prokáže se parakortikální infiltrace plazmacytoidními buňkami, které jsou CD4 a CD56 pozitivní, často také CD68 a TdT pozitivní (30). MPX je negativní. Jde o agresivní onemocnění. O diferenciální diagnóze karcinomu z prsténčitých buněk již byla zmínka (23).
Problémy s diagnózou HNL/K-F zdůraznilo více autorů. Turner et al. uvádějí na sestavě 30 nemocných záměnu s lymfomem u 10 pacientů (6), Menasce et al. u 17 z 25 nemocných (11). Nejčastěji šlo o záměnu s velkobuněčným lymfomem, méně často s Hodgkinovým lymfomem. Záměna může být i s nenádorovými procesy typu sinusové histiocytózy s masivní lymfadenopatií a s virově indukovaným hemofagocytujícím syndromem (11).
Z dalších nenádorových procesů je třeba vyloučit zejména virové lymfadenitidy a lymfadenopatie při systémovém lupus erytematodes. EBV indukovaná lymfadenitida může nekrotizovat, ale liší se od HNL/K-F smíšeným složením aktivovaných buněk B a T řady. Nálezům u HNL/K-F se může podobat také herpetická lymfadenitida, způsobená virem herpes simplex. Někdy se však prokáží virové inkluze a často bývají přítomny neutrofilní leukocyty chybějící u HNL/K-F. Histiocytární infiltrace je také méně nápadná a v imunohistochemickém vyšetření makrofágy nevykazují pozitivní reakci s myeloperoxidázou. Lymfadenopatie při systémovém lupusu mohou být od HNL/K-F neodlišitelné, případně se zde nálezy prolínají a jsou pravděpodobně vyvolané stejným nebo podobným mechanizmem. U typické SLE lymfadenopatie jsou však obvykle cytotoxické T lymfocyty zastoupeny mnohem méně než u HNL/K-F. Bývají zde hojně zastoupeny plazmatické buňky, což rovněž není znakem HNL/K-F. Navíc se u SLE vyskytují hematoxylinová tělíska a tzv. Azzopardiho fenomen, inkrustace cévních stěn zbytky rozpadlých jader buněk. Je nutné připustit, že rozlišení obou typů lymfadenitid není snadné a nálezy mohou splývat.
Je vhodné zdůraznit, že nekrotizace tkáně uzliny nevylučuje nádorovou povahu léze a může se vyskytovat jak u B tak u T lymfomů. Její přítomnost sama o sobě v žádném případě nesměřuje k diagnóze nekrotizující lymfadenitidy. Posouzení musí být komplexní s analýzou cytologického složení patologického infiltrátu doplněné o imunofenotypizaci. Snadno lze vyloučit nekrotizující lymfadenitidy s exsudací neutrofilních leukocytů typu nemoci z kočičího škrábnutí a příbuzná onemocnění (granulomatózně hnisavé lymfadenitidy), v případě nutnosti lze využít histochemické stanovení naphthol-AS-D-chloroacetát esterázy nebo imunohistochemický průkaz exprese molekul MPX a CD15. Na druhé straně šíření patologické infiltrace včetně blastické komponenty za hranici pouzdra postižené lymfatické uzliny nelze považovat za důkaz nádorové povahy posuzované léze. Je často u HNL/K-F prokazováno (10,23). S infiltrací mimo rámec lymfatické uzliny jsme se setkali u tří nemocných, z toho u dvou byla malobuněčná a měla reaktivní charakter spolu s fibroproduktivním zánětem v oblasti pouzdra uzliny, ale u jednoho případu přesahoval blastický infiltrát do tukové tkáně.
V případě rozpaků je vhodné pro vyloučení lymfomu využít stanovení klonální povahy patologického procesu pomocí PCR. V naší sestavě jsme tak učinili u 6 nemocných, klonální expanzi jsme neprokázali. PCR přispěje k rozptýlení obav z možné diagnostické chyby. Ne vždy je však z parafinových bloků extrakce nukleových kyselin dostatečně výtěžná a výsledek PCR není v takových případech interpretovatelný.
Dlouhodobé sledování ukazuje na příznivý průběh onemocnění, většinou bez recidiv. Recidivy se však mohou objevit i po mnoha letech. U jednoho nemocného byla například recidivující nekrotizující lymfadenopatie zaznamenána po 12 letech (11). U dětí se zdá, že vývoj onemocnění je bouřlivější s častějšími systémovými příznaky. Je známo i několik případů s úmrtím (8,31).
ZÁVĚR
Kikuchiho-Fujimotova choroba se vyskytuje i u nemocných diagnostikovaných v Evropě a tedy také u nás. Postihuje spíše mladé osoby do 30 let věku, převaha žen není tak významná, jak se dříve soudilo. Onemocnění je možné zaměnit s nádorovými procesy, zejména s non-Hodgkinovým lymfomem, s klasickým Hodgkinovým lymfomem a s nenádorovými zánětlivými procesy v lymfatických uzlinách. Sami jsme HNL/K-F vylučovali u jednoho nemocného s diagnózou anaplastického velkobuněčného lymfomu ALK pozitivního. Za rozhodující znaky, kdy by mělo vzniknout podezření na HNL/K-F, považujeme zachování struktury alespoň části lymfatické uzliny, patologický mapovitý až splývající infiltrát z mírně až středně polymorfních blastů v převaze CD8 pozitivních, variabilní příměs histiocytů pozitivních CD68+/MPX+ propůjčujících lézi při malém zvětšení skvrnitý vzhled, a nekonstantní příměs tzv. plazmacytoidních monocytů. Neprokážeme neutrofilní leukocyty a chudě jsou zastoupené nebo chybí plazmatické buňky. Nekrotizace s karyorhektickým rozpadem buněk, někdy s příměsí fibrinu, případně nástup xantogranulomatózní složky by pak měly při současně vyjádřeném výše popsaném obrazu vést již přímo k diagnóze. V případě rozpaků s diagnózou je vhodné morfologická a imunofenotypická vyšetření doplnit o průkaz klonální expanze pomocí přestavby imunoreceptorového genu TCR, který prokáže polyklonální T lymfocytární populace.
Poděkování
Práce byla podporována Projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Autoři děkují za poslání biopsií ke druhému čtení: prof. MUDr. K. Dvořákovi, Dr.Sc. in memoriam, MUDr. L. Křenovi a MUDr. M. Moulisovi, (FN Brno Bohunice), MUDr. M. Nové (FN Hradec Králové), prim. MUDr. P. Hrabalovi (ÚVN Praha), prim. MUDr. M. Syrůčkovi (Nemocnice Na Homolce Praha) a MUDr. M. Trnkové (Biolab Praha, s.r.o.).
Adresa pro korespondenci:
Prof. MUDr. Roman Kodet, CSc.
Ústav patologie a molekulární medicíny
2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
tel.: +420 224 435 600, fax: +420 224 435 620
e-mail: roman.kodet@lfmotol.cuni.cz
Sources
1. Stejskal J. Measles lymphadenopathy. Ultrastruct Pathol 1980; 1(2): 243–247.
2. Kodetová D, Kodet R, Syrůček M, Trněný M. Sinusová histiocytóza s masivní lymfadenopatií – diseminovaná forma syndromu Rosai-Dorfman. Cesk Patol 1996; 32(2): 53–59.
3. Kikuchi M, Yoshizumi T, Nakamura H. Necrotizing lymphadenitis: possible acute toxoplasmic infection. Virchows Arch A Pathol Anat Histol 1977; 376(3): 247–253.
4. Pileri S, Kikuchi M, Helbron D, Lennert K. Histiocytic necrotizing lymphadenitis without granulocytic infiltration. Virchows Arch A Pathol Anat Histol 1982; 395(3): 257–271.
5. Ali MH, Horton LW. Necrotising lymphadenitis without granulocytic infiltration (Kikuchi’s disease). J Clin Pathol 1985; 38(11): 1252–1257.
6. Turner RR, Martin J, Dorfman RF. Necrotizing lymphadenitis. A study of 30 cases. Am J Surg Pathol 1983; 7(2): 115–123.
7. Dorfman RF, Berry GJ. Kikuchi’s histiocytic necrotizing lymphadenitis: an analysis of 108 cases with emphasis on differential diagnosis. Sem Diagn Pathol 1988; 5(4): 329–345.
8. Jun-Fen F, Chun-Lin W, Li L, et al. Kikuchi-Fujimoto disease manifesting as recurrent thrombocytopenia and Mobitz type II atrioventricular block in a 7-year-old girl: a case report and analysis of 138 Chinese childhood Kikuchi-Fujimoto cases with 10 years of follow-up in 97 patients. Acta Paediatr 2007; 96(12): 1844–1847.
9. Kuo T-T. Kikuchi’s disease (histiocytic necrotizing lymphadenitis): A clinicopathologic study of 79 cases with an anlysis of histologic subtypes, immunohistology, and DNA ploidy. Am J Surg Pathol 1995; 19 : 798–809.
10. Chamulak GA, Brynes RK, Nathwani BN. Kikuchi-Fujimoto disease mimicking lymphoma. Am J Surg Pathol 1990; 14 : 514–523.
11. Menasce LP, Banerjee SS, Edmondson D, Harris M. Histiocytic necrotizing lymphadenitis (Kikuchi-Fujimoto disease): Continuing diagnostic difficulties. Histopathol 1998; 33 : 248–254.
12. van Dongen JJ, Langerak AW, Bruggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17(12): 2257–2317.
13. Olejárová M, Campr V, Pavelka K. Kikuchiho-Fujimotova nemoc (histiocytární nekrotizující lymfadenitida). Kazuistika a literární review. Vnitr Lek 2004; 50(10): 786–792.
14. Zhang WP, Wang JH, Wang WQ, et al. An association between parvovirus B19 and Kikuchi-Fujimoto disease. Viral Immunol 2007; 20(3): 421–428.
15. Hu S, Kuo TT, Hong HS. Lupus lymphadenitis simulating Kikuchi’s lymphadenitis in patients with systemic lupus erythematosus: a clinicopathological analysis of six cases and review of the literature. Pathol Int 2003; 53(4): 221–226.
16. Kim SK, Kang MS, Yoon BY, et al. Histiocytic necrotizing lymphadenitis in the context of systemic lupus erythematosus (SLE): Is histiocytic necrotizing lymphadenitis in SLE associated with skin lesions? Lupus 2011; 20(8): 809–819.
17. Wilkinson CE, Nichol F. Kikuchi-Fujimoto disease associated with polymyositis. Rheumatology (Oxford) 2000; 39(11): 1302–1304.
18. Ramanan AV, Wynn RF, Kelsey A, Baildam EM. Systemic juvenile idiopathic arthritis, Kikuchi’s disease and haemophagocytic lymphohistiocytosis—is there a link? Case report and literature review. Rheumatology (Oxford) 2003; 42(4): 596–598.
19. Shusang V, Marelli L, Beynon H, et al. Autoimmune hepatitis associated with Kikuchi-Fujimoto’s disease. Eur J Gastroenterol Hepatol 2008; 20(1): 79–82.
20. Tanaka T, Ohmori M, Yasunaga S, et al. DNA typing of HLA class II genes (HLA-DR, -DQ and -DP) in Japanese patients with histiocytic necrotizing lymphadenitis (Kikuchi’s disease). Tissue Antigens 1999; 54(3): 246–253.
21. Lin HC, Su CY, Huang CC, Hwang CF, Chien CY. Kikuchi’s disease: a review and analysis of 61 cases. Otolaryngol Head Neck Surg 2003; 128(5): 650–653.
22. Weisenburger DD, Savage KJ, Harris NL, et al. Peripheral T-cell lymphoma, not otherwise specified: a report of 340 cases from the International Peripheral T-cell Lymphoma Project. Blood 2011; 117(12): 3402–3408.
23. Tsang WYW, Chan JKC, Ng CS. Kikuchi’s lymphadenitis: A morphologic analysis of 75 cases with special reference to unusual features. Am J Surg Pathol 1994; 18 : 219–231.
24. Pileri SA, Facchetti F, Ascani S, et al. Myeloperoxidase expression by histiocytes in Kikuchi’s and Kikuchi-like lymphadenopathy. Am J Pathol 2001; 159(3): 915–924.
25. Nomura Y, Takeuchi M, Yoshida S, et al. Phenotype for activated tissue macrophages in histiocytic necrotizing lymphadenitis. Pathol Int 2009; 59(9): 631–635.
26. Facchetti F, de Wolf-Peeters C, Mason DY, et al. Plasmacytoid T cells. Immunohistochemical evidence for their monocyte/macrophage origin. Am J Pathol 1988; 133(1): 15–21.
27. Jegalian AG, Facchetti F, Jaffe ES. Plasmacytoid dendritic cells: physiologic roles and pathologic states. Adv Anat Pathol 2009; 16(6): 392–404.
28. Kishimoto K, Tate G, Kitamura T, Kojima M, Mitsuya T. Cytologic features and frequency of plasmacytoid dendritic cells in the lymph nodes of patients with histiocytic necrotizing lymphadenitis (Kikuchi-Fujimoto disease). Diagn Cytopathol 2010; 38(7): 521–526.
29. Herling M, Jones D. CD4+/CD56+ hematodermic tumor: the features of an evolving entity and its relationship to dendritic cells. Am J Clin Pathol 2007; 127(5): 687–700.
30. Cota C, Vale E, Viana I, et al. Cutaneous manifestations of blastic plasmacytoid dendritic cell neoplasm-morphologic and phenotypic variability in a series of 33 patients. Am J Surg Pathol 2010; 34(1): 75–87.
31. Quintas-Cardama A, Fraga M, Cozzi SN, et al. Fatal Kikuchi-Fujimoto disease: the lupus connection. Ann Hematol 2003; 82(3): 186–188.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2012 Issue 4-
All articles in this issue
- Pleomorphic adenoma of salivary glands: diagnostic pitfalls and mimickers of malignancy
- Pseudotumors of the central nervous system
- Histiocytic necrotizing lymphadenitis / Kikuchi-Fujimoto disease (HNL/K-F) and its differential diagnosis: analysis of 19 patients
- Expression of p57 marker in differential diagnosis of complete and partial mole – correlation with DNA analysis
- Pseudotumors and mimickers of malignancy of the head and neck pathology
- Gliosarcoma with alveolar rhabdomyosarcoma-like component: Report of a case with a hitherto undescribed sarcomatous component
- Perineural cell differentiation in ganglioneuromas. Report of 8 cases with immunohistochemical expression of perineural cell markers
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pleomorphic adenoma of salivary glands: diagnostic pitfalls and mimickers of malignancy
- Histiocytic necrotizing lymphadenitis / Kikuchi-Fujimoto disease (HNL/K-F) and its differential diagnosis: analysis of 19 patients
- Pseudotumors of the central nervous system
- Expression of p57 marker in differential diagnosis of complete and partial mole – correlation with DNA analysis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

