-
Medical journals
- Career
PROGNÓZA PACIENTŮ SE STŘEDNĚ A VYSOCE RIZIKOVÝM SVALOVINU DETROZORU NEINFILTRUJÍCÍM KARCINOMEM MOČOVÉHO MĚCHÝŘE LÉČENÝCH INTRAVEZIKÁLNÍMI INSTILACEMI MITOMYCINU C V OBDOBÍ NEDOSTUPNOSTI BCG VAKCÍNY
Authors: Michael Pešl 1; Otakar Čapoun 1; Zuzana Vaľová 1; Roman Sobotka 1; Pavel Dundr 2; Tomáš Hanuš 1; Viktor Soukup 1
Authors‘ workplace: Urologická klinika VFN a 1. LF UK, Univerzita Karlova, Praha 1; Ústav patologie VFN a 1. LF UK, Univerzita Karlova, Praha 2
Published in: Ces Urol 2016; 20(4): 302-308
Category: Original Articles
Overview
Cíl:
Cílem této práce je zhodnotit prognózu pacientů se středně a vysoce rizikovým svalovinu detruzoru neinfiltrujícím karcinomem močového měchýře léčených intravezikálními instilacemi Mitomycinu C (MMC) v období nedostupnosti BCG vakcíny.Metoda:
Celkem bylo retrospektivně hodnoceno 66 pacientů s primozáchytem nebo recidivou uroteliálního karcinomu močového měchýře, u kterých byl diagnostikovaný v době od ledna 2012 do září 2014 uroteliální karcinom Ta, T1 a kterým byla následně podána intravezikální léčba Mitomycinem C. Medián sledování byl 25,5 měsíce.Výsledky:
Ve 30 případech (45 %) se jednalo o středně rizikový, v 36 případech (55 %) o vysoce rizikový tumor. U tří pacientů byla léčba předčasně ukončena pro výskyt nežádoucích účinků. V pěti případech byla díky obnovení dodávek BCG léčba MMC změněna na intravezikální imunoterapii. Provedli jsme srovnání průběhu onemocnění u podskupiny pacientů s pT1 G3 nádory léčených MMC (10 pac.) s kontrolní skupinou (20 pacientů s obdobným histologickým nálezem, kteří však v minulosti byli léčeni standardně BCG vakcínou, tzv. „historické kontroly“).
V průběhu sledování recidivovalo osm (27 %) pacientů se středně rizikovým a třináct (36 %) s vysoce rizikovým nádorem, u dvou (5,6 %) pacientů s vysoce rizikovým nádorem byla zjištěna progrese do svalovinu infiltrující formy karcinomu. Ze srovnání s historickými kontrolami bylo zřejmé, že pacienti s pT1 G3 nádorem měli významně vyšší četnost recidiv, v případě, že byli léčeni adjuvantní intravezikální chemoterapií Mitomycinem C (p= 0,0394).Závěr:
Při léčbě pacientů s vysoce rizikovým karcinomem močového měchýře pomocí intravezikální chemoterapie je nutno počítat s vyšším rizikem recidivy než u pacientů se středně rizikovými nádory. Riziko progrese nebylo hodnoceno.
V případě T1 G3 karcinomů je při léčbě MMC riziko recidivy signifikantně vyšší než u pacientů podstupujících standardní léčbu BCG vakcínou.Klíčová slova:
BCG vakcína, instilační terapie, intravezikální chemoterapie, Mitomycin C, nádory močového měchýře.ÚVOD
Karcinom močového měchýře (KMM) je nejčastější malignitou močového traktu, u mužů patří mezi sedmý nejčastější, u žen mezi 17. nejčastější karcinom s incidencí 19 na 100 000 u mužů a 6 na 100 000 u žen (1).
Přibližně 75 % pacientů má v době diagnózy nádor ohraničený na sliznici či submukózní pojivo (CIS, Ta, T1). Tato skupina nádorů je označována jako svalovinu detruzoru neinfiltrující karcinomy močového měchýře (non-muscle invasive bladder cancer, NMIBC). Lze je kompletně odstranit transuretrální resekcí (TUR) a je pro ně charakteristická vysoká četnost recidiv, která v nejrizikovější skupině KMM v rámci dlouhodobého sledování dosahuje 70 až 80 % (2). Po transuretrální resekci následuje intravezikální terapie cytostatiky (Mitomycin C, epirubicin a další), event. intravezikální imunoterapie (především BCG) (3). Pro volbu vhodné adjuvantní intravezikální léčby je zásadní zařazení pacienta do příslušné skupiny podle rizika recidivy, resp. progrese tumoru (2). Několik meta-analýz prokázalo významně vyšší účinnost BCG na snížení rizika recidiv než TUR bez adjuvantní terapie nebo TUR následovaný intravezikální chemoterapií (4, 5). Tento rozdíl je signifikantní u středně (intermediate risk, IR) i vysoce (high-risk, HR) rizikových nádorů (6, 7).
Cílem této práce je zhodnotit prognózu pacientů s IR a HR NMIBC léčených intravezikálními instilacemi Mitomycinu C (MMC) v době, kdy v České republice nebyla k dispozici BCG vakcína.
METODA
Do retrospektivní studie jsme zařadili 66 pacientů (50 mužů, 16 žen) s primozáchytem nebo recidivou uroteliálního karcinomu močového měchýře, kteří měli histologicky verifikovaný intermediate-risk nebo high-risk nádor. Průměrný věk pacientů ve studii byl 67 let. Medián sledování byl 25,5 měsíce (interval sledování zahrnuje období mezi lednem 2012 a zářím 2014). Vzhledem k nedostupnosti BCG vakcíny byli všichni tito pacienti léčeni intravezikálními instilacemi Mitomycinu C. Využili jsme vzniklé situace ke zhodnocení efektu léčby, která v současnosti není považována u této skupiny pacientů za standardní. Ve skupině HR nádorů je dle EAU Guidelines za standardní terapii považována léčba BCG vakcínou, u IR nádorů lze jako alternativu zvolit intravezikální instilace cytostatik. Jednotlivá dávka obsahovala 30 mg MMC, celková doba léčby u jednoho pacienta zahrnovala 15 instilací (první čtyři instilace v týdenních intervalech, dále v měsíčních intervalech do celkové doby jeden rok). Dávku 30 mg MMC na našem pracovišti dlouhodobě používáme. Mnoho autorů používá dávku 40 mg a vyšší, avšak superiorita vyšší dávky než 30 mg nebyla prokázána.
V pěti případech byla díky obnovení dodávek BCG na český trh léčba MMC změněna na intravezikální imunoterapii BCG vakcínou (použitý kmen RIVM). Tito pacienti byli následně z analýzy vyřazeni.
V souhlase s oficiálním doporučením odborné urologické společnosti (viz Dohoda VZP ČR a ČUS ČLS JEP) byla všem pacientů s high-risk nádory navržena radikální cystektomie. Žádný z pacientů v našem souboru však s tímto způsobem léčby nesouhlasil.
Pacienti byli rozděleni do jednotlivých skupin v závislosti na rozdílném stupni buněčné diferenciace (G1 – 12 pacientů, G2 – 31 pacientů, G3 – 16, nestanoveno – 7, resp. PUNLMP – 2 pacienti, LG karcinom – 27 pacientů a HG karcinom – 35 pacientů), stupni nádorové invaze (pTa – 36 pacientů, pT1 – 24 pacientů, pTIS – 5 pacientů, v jednom případě nebyl při histologickém vyšetření pT stanoven, jednalo se však o tumor s makroskopickou charakteristikou neinfiltrujícího tumoru, a proto byl v souboru ponechán), multiplicitě (solitární tumory – 12 pacientů, mnohočetné tumory – 54 pacientů). Po zhodnocení jednotlivých rizikových faktorů podle EORTC tabulek rizika byli pacienti zařazeni do rizikových skupin (intermediate-risk – 30 pacientů, high-risk – 36 pacientů). Výsledky byly analyzovány v jednotlivých rizikových skupinách samostatně.
Dále jsme provedli srovnání průběhu onemocnění u podskupiny pacientů s pT1 G3 nádory léčených MMC (10 pac.) se skupinou historických kontrol s obdobným histologickým nálezem, kteří však v minulosti byli léčeni standardně BCG vakcínou po dobu jednoho roku (15 instilací, 20 následných pac.).
Všichni pacienti s nádory měchýře podstoupili transuretrální resekci (TUR), nádory byly histologicky verifikovány. Druhá doba TUR (re-TUR) byla provedena dle aktuálních EAU Guidelines. Charakteristiku skupiny pacientů s tumory měchýře shrnuje tabulka č. 1.
Table 1. Charakteristika tumorů Tab. 1. Characterization of tumors 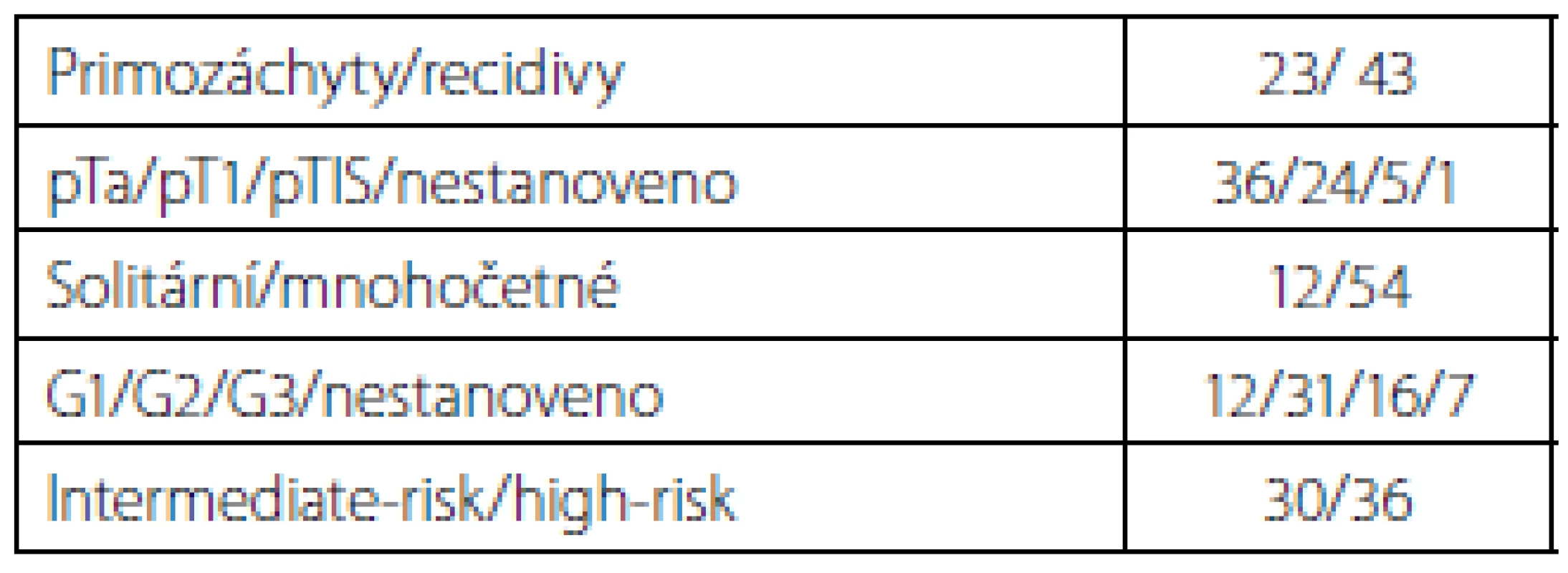
Při statistickém hodnocení byl použit program S.A.S. software release 8.2 (SAS Inc., Cary, USA). Analýza přežití byla provedena pomocí Kaplan ‑ -Meier křivek přežití a Coxova regresního modelu, rozdíl mezi zkoumanými skupinami byl testován pomocí tzv. Log-Rank testu a Wilcoxon testu. Hladina statistické významnosti byla stanovena p=0,05.
VÝSLEDKY
V průběhu sledování jsme zachytili recidivu onemocnění u 21 (32 %) pacientů. Délka přežití do recidivy je patrná z grafu č. 1.
Graph 1. Kaplan-Meierova křivka přežívání bez recidivy (Recurrence free survival) Graph 1. Kaplan-Meier curve of survival without relapse (Recurrence-free survival) 
V průběhu sledování recidivovalo 8 (27 %) pacientů s IR a 13 (36 %) s HR nádorem, rozdíl nebyl signifikantní (graf 2).
Graph 2. Kaplan-Meierovy křivky přežívání do recidivy, modře IR, červeně HR nádory; log-rank p= 0,8349 Graph 2. Kaplan-Meier survival curve recurrence, IR blue, red HR tumors; log-rank p = 0.8349 
U dvou pacientů v souboru byla zjištěna progrese do svalovinu infiltrující formy karcinomu. Oba tito pacienti měli původně HR neinfiltrující nádor, po histologické verifikaci progrese onemocnění podstoupili radikální cystektomii.
V podskupině pacientů s pT1G3 nádory recidivovali dva (20 %) pacienti léčení MMC, oproti třem (15 %) léčeným BCG. Také přežití bez recidivy (RFS) bylo kratší u pacientů léčených MMC. Tento rozdíl byl signifikantní (p=0,0394), jak je patrné na grafu 3.
Graph 3. Kaplan-Meierovy křivky přežití bez recidivy, podskupina pacientů s pT1 G3 nádory; modrá křivka – BCG, červená křivka – MMC; log-rank p= 0,0394 Graph 3. Kaplan-Meier survival curves without recurrence, a subgroup of patients with pT1 G3 tumors; the blue curve - BCGred curve – MMC; log-rank p = 0.0394 
DISKUZE
Standardní léčbou HR tumorů močového měchýře po provedení TUR je intravezikální terapie BCG vakcínou v délce trvání minimálně jeden rok. Práce Sylvestera z roku 2002 (9), ale i další studie (4), jasně dokládají, že přežití bez recidivy je signifikantně delší ve skupině podstupující po TUR adjuvantní terapii s BCG oproti skupině léčené pouze TUR. Tyto práce však také dokládají lepší léčebné výsledky BCG oproti použití MMC. Tyto dva způsoby léčby jsme v naší práci porovnávali na podskupině pacientů s T1G3 nádory. V naší studii jsme prokázali signifikantní rozdíl v přežití bez recidivy ve prospěch instilací BCG. Jistou nevýhodou našich výsledků je to, že jsme k porovnání použili „historický“ soubor z dřívějšího období a že obě skupiny se lišily počtem zařazených pacientů. Je také třeba zohlednit malý počet pacientů s recidivou v obou skupinách, proto rozdílné výsledky považujeme za hraniční. Nedostupnost vakcíny BCG nám umožnila zjistit, jaká je četnost recidiv u HR pacientů, pokud jsou léčeni intravezikální chemoterapií, tedy jinak než je současně doporučovaný standard.
Bohle (4) ve své meta-analýze s 1 328 pacienty s IR a HR nádory pozoroval při průměrné době sledování 26 m. recidivu onemocnění ve více než 46 % případů. V našem souboru recidivovalo 32 % pacientů (27 % s IR a 36 % s HR nádorem).
Pawinski analyzoval šest kvalitních studií (1 629 pacientů s IR tumory, sledování 4,6 roku) a zjistil 6% rozdíl v přežití do recidivy ve prospěch skupiny léčené intravezikální chemoterapií oproti samotné TUR (47 % vs. 52,6 %) (8).
Zatímco některé dřívější studie prokázali při léčbě IR a HR nádorů signifikantní rozdíl v přežití do progrese v závislosti na použité adjuvantní terapii (MMC vs BCG) (9, 10), novější rozsáhlá meta-analýza tento poznatek nepotvrdila (5). Vzhledem k tomu, že v našem souboru progredovali do infiltrující formy karcinomu pouze dva pacienti, jsme tento faktor statisticky nehodnotili.
Mezi jednotlivými prognostickými skupinami dle EORTC se významně liší přežití do recidivy i progrese (2). Toto můžeme potvrdit i na základě našich výsledků, avšak rozdíl v přežití do recidivy mezi IR a HR nádory nebyl signifikantní. Důvodem může být menší soubor pacientů a kratší sledování než u ostatních autorů.
ZÁVĚR
Při léčbě pacientů s high-risk karcinomem měchýře pomocí intravezikální chemoterapie je nutno počítat s vysokým rizikem recidivy i progrese základního onemocnění. Z výsledků naší studie vyplývá, že při použití intravezikální chemoterapie bylo riziko recidivy karcinomu měchýře u pacientů s high-risk karcinomem nesignifikantně vyšší, než u pacientů s intermediate-risk nádory. U pacientů s pT1G3 nádory při použití intravezikální chemoterapie bylo riziko recidivy karcinomu měchýře signifikantně vyšší, než u pacientů léčených BCG vakcínou.
Práce byla podpořena grantem PRVOUK P27/LF1/1
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno žádnou farmaceutickou firmou.
Došlo: 22. 8. 2016
Přijato: 1. 12. 2016
Kontaktní adresa:
MUDr. Michael Pešl, FEBU
Urologická klinika VFN a 1. LF UK
Ke Karlovu 6, 128 08 Praha 2
e-mail: pesl_m@hotmail.com
Sources
1. Ferlay JSH, Bray F, Forman D, et al. GLOBOCAN 2012, Cancer Incidence and Mortality Worldwide: IARC CancerBase 2012, International Agency for Research on Cancer: Lyon, France.
2. Sylvester RJ, van der Meijden APM, Oosterlinck W, et al. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49 : 466–477.
3. Babjuk M, Böhle A, Burger M, et al. EAU Guidelines, 2016.
4. Böhle A, Jochman D, Bock PR, et al. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer: a formal meta-analysis of comparative studies on recurrence and toxicity. J Urol, 2003; 169 : 90.
5. Malmström PU, Sylvester RJ, Crawford RJ, et al. An individual patient data meta-analysis of the long‑term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Guerin for non-muscle-invasive bladder cancer. Eur Urol, 2009; 56 : 247.
6. Sylvester RJ, Brausi MA, Kirkels WJ, et al. Long-term efficacy results of EORTC genito-urinary group randomized phase 3 study 30911 comparing intravesical instillations of epirubicin, bacillus Calmette-Guerin, and bacillus Calmette-Guerin plus isoniazid in patients with intermediate - and high-risk stage Ta T1 urothelial carcinoma of the bladder. Eur Urol, 2010; 57 : 766.
7. Järvinen R, Kaasinen E, Sankilo A, Rintala E, Finn Blader Group. Long-term efficacy of maintenance
bacillus Calmette-Guerin versus maintenance mitomycin C instillation therapy in frequently recurrent
TaT1 tumours without carcinoma in situ: a subgroup analysis of the prospective, randomised FinnBladder
I study with a 20-year follow-up. Eur Urol, 2009; 56 : 260.
8. Pawinski A, Sylvester R, Kurth KH, et al. A combined analysis of EORTC and Medical Research Council
randomised clinical trials for the prophylactic treatment of stage TaT1 bladder cancer. J Urol 1996; 156:
1934–1940.
9. Sylvester RJ, van der Meijden AP, Lamm DL, et al. Intravesical bacillus Calmette-Guerin reduces the
risk of progression in patients with superficial bladder cancer: a meta-analysis of the published results of
randomised clinical trials. J Urol 2002; 168 : 1964–1970.
10. Böhle A, Bock PR. Intravesical bacille Calmette-Guerin versus mitomycin C in superficial bladder cancer:
formal meta-analysis of comparative studies on tumor progression. Urology, 2004; 63 : 682.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2016 Issue 4-
All articles in this issue
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DYSFUNKCE DOLNÍCH MOČOVÝCH CEST U DIABETICKÝCH PACIENTŮ
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- PROGNÓZA PACIENTŮ SE STŘEDNĚ A VYSOCE RIZIKOVÝM SVALOVINU DETROZORU NEINFILTRUJÍCÍM KARCINOMEM MOČOVÉHO MĚCHÝŘE LÉČENÝCH INTRAVEZIKÁLNÍMI INSTILACEMI MITOMYCINU C V OBDOBÍ NEDOSTUPNOSTI BCG VAKCÍNY
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- NAŠE PRVNÍ ZKUŠENOSTI S VYUŽITÍM KOMETOVÉHO TESTU PŘI HODNOCENÍ INTEGRITY DNA VE SPERMIÍCH
- RARITNÍ HISTOLOGICKÝ NÁLEZ MALIGNÍHO TUMORU VYCHÁZEJÍCÍHO Z LOŽISKA ENDOMETRIÓZY LEDVINY
- HIBERNOM JAKO PŘEKVAPIVÝ NÁLEZ PŘI EXSTIRPACI PERIRENÁLNÍHO TUMORU
- 62ND CZECH UROLOGICAL SOCIETY ANNUAL CONFERENCE IN ČESKÉ BUDĚJOVICE 2016
- SELEKTIVNÍ KLAMPING PŘI ROBOTICKY ASISTOVANÉ RESEKCI LEDVINY
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

