-
Medical journals
- Career
NOVÉ TRENDY V LÉČBĚ RENÁLNÍHO ANGIOMYOLIPOMU
Authors: Tomáš Ürge 1; Tomáš Pitra 1; Zdeněk Chudáček 2; Jiří Baxa 3; Petr Stránský 1; Viktor Eret 1; Ondřej Hes 4; Milan Hora 1
Authors‘ workplace: Urologická klinika, Fakultní nemocnice Plzeň a LF UK v Plzni 1; Radiodiagnostické oddělení, Fakultní nemocnice Plzeň a LF UK v Plzni 2; Klinika zobrazovacích metod, Fakultní nemocnice Plzeň a LF UK v Plzni 3; Šiklův ústav patologie, Fakultní nemocnice Plzeň a LF UK v Plzni 4
Published in: Ces Urol 2015; 19(2): 106-117
Category: Review article
Overview
Angiomyolipom ledviny (AML) je benigní mezenchymový nádor, který se vyskytuje sporadicky nebo v rámci komplexu tuberózní sklerózy (TSC). Celková prevalence AML je 0,44 % a vyskytuje se čtyřikrát častěji u žen. Prevalence v ženské populaci je tedy 0,6 %, zatímco u mužů 0,28 %. Jeho diagnostika je založena na přítomnosti tukové složky v nádoru a lze tedy identifikovat předoperačně pomocí zobrazovacích metod. Morfologie AML je velmi variabilní a někdy tedy tuková složka chybí, což může způsobit diagnostické rozpaky. Zcela zásadní roli má aktivní sledování pacientů s jasnou diagnózou AML, jehož růst je pomalý s minimální morbiditu. Pacient však může přijít ve stadiu komplikací, které zahrnují hematurii, bolest či krvácení do retroperitonea způsobené rupturou nádoru. Mezi hlavní rizikové faktory krvácení jsou velikost nádoru, procento zastoupení cévní složky, kterou tvoří aneuryzmatické cévy a přítomnost TSC. Selektivní arteriální embolizace úspěšně řeší hemoragické komplikace a redukuje objem AML. V rámci dlouhodobých výsledků však selhává díky revaskularizaci a dalšímu růstu AML. Zde pak mají lepší výsledky chirurgické operace, kde se snažíme v maximální míře šetřit funkci ledviny. Slibné dlouhodobé výsledky má též radiofrekvenční ablace, která je ale silně limitována velikostí AML. U objemnějších AML se zdá být dobrou alternativou resekčního výkonu kryoablace, která však vyžaduje hůře dostupné speciální přístrojové vybavení. Novinkou je pak systémová léčba mTOR inhibitory (everolimus, sirolimus), které mají nezastupitelné místo u nemocných s TSC, kde jsou AML mnohočetné a recidivující. Tato terapie může pomoci redukovat celkový objem AML a umožnit případný resekční výkon.
Klíčová slova:
Angiomyolipom, arteriální embolizace, radiofrekvenční ablace, kryoablace, resekce, mTOR inhibitory.ÚVOD
Renální angiomyolipom (AML) je mezenchymový nádor ledvin. Celková prevalence AML je 0,44 % a vyskytuje se čtyřikrát častěji u žen. Prevalence v ženské populaci je tedy 0,6 %, zatímco u mužů 0,28 %. AML představuje přibližně 1 % chirurgicky odstraněných nádorů (1). Z hlediska etiologie rozlišujeme dvě varianty, a to AML, který se vyskytuje sporadicky, a AML asociovaný s tuberózní sklerózou (TSC). TSC je dědičné neurokutánní multisystémové onemocnění charakteristické tvorbou benigních tumorů v řadě orgánů a tkání. Incidence je odhadována na 1 : 5 800 živě narozených. TSC je nemocí s autosomálně dominantním typem dědičnosti ale až 2/3 nemocných získávají mutaci de-novo. Riziko pro dítě nemocných rodičů je 50 %. Nemoc vzniká na podkladě mutace v jednom ze dvou tumor-supresorových genů: TSC1 − mutace genu je příčinou onemocnění ve 27 % případů. Gen je uložen na dlouhém raménku 9. chromozomu (9q34). Transkripcí 23 exonů tohoto genu vzniká bílkovina hamartin. Mutace genu TSC2 je nacházena u 73 % nemocných. Gen je lokalizován na krátkém raménku 16. chromozomu (16p13), obsahuje 41 exonů a kóduje informaci pro bílkovinu tuberin. Výsledkem mutace v těchto genech je růst mnohočetných benigních nádorů. Léze se vyskytují v mozku (velkobuněčný subependymální astrocytom – SEGA), ledvinách (AML), srdci (rhabdomyom), játrech (hemangiom), plicích (lymfangioleimyomatóza) a kůži (angiofibrom). Zvláště postižení kůže je typicky na obličeji a je všeobecně známé jako adenoma sebaceum. U nemocných se projevuje epilepsie, mentální retardace, autizmus a rozvíjí se dysfunkce ledvin a plic (2).
Histologická varianta AML, která se skládá z velkých epiteloidních buněk podobných hladké svalovině, v několika případech prokazovala agresivní lokální růst, tvorbu nádorového trombu zasahujícího do dolní duté žíly či metastázy do lymfatických uzlin či do dalších orgánů jako jater, plic a mezenteria. Tato velmi vzácná varianta je pojmenována epiteloidní AML (2). Do současnosti bylo popsáno ve světové literatuře přibližně 200 případů. Epiteloidní AML se vyskytuje sporadicky i ve spojení TSC (3, 4).
Ve vancouverské klasifikaci jsou doplněny znalosti o další stratifikaci AML včetně snahy o lepší predikci biologického chování a zařazení dalších podvariant – onkocytický AML, AML s epiteloidními cystami (5).
DIAGNOSTIKA
Diagnostika AML je většinou jasná podle charakteristického sonografického vzhledu a typické CT a MRI morfologie. Na USG je většina AML patrna jako hyperechogenní léze, která připomíná echogenicitou tuk renálního sinu (6) (obr. 1a). Tuková složka přispívá k negativním denzním hodnotám na CT (obr. 2) a hyperintenzitě na T1 vážené sekvence MRI (6, 7) (obr. 3). CT je obvykle pro diagnostiku angiomyolipomu dostačující. Nicméně radiografický vzhled AML bývá extrémně heterogenní, protože AML se skládá nejenom z tuku ale také z různého množství hladkých svalů a cév a ložisek krvácení. V nedávné studii zahrnující 42 AML (8) se ukázalo, že podíl tukové složky je méně než 25 % u přibližně 50 % ze všech hodnocených případů. Sonograficky se většina AML s minimem tuku jeví homogenně izoechogenně a je obtížné je odlišit od renálního karcinomu. Obdobně na CT snímcích bez podání kontrastní látky jsou hodnoty denzity AML s minimem tuku vyšší než hodnoty okolního parenchymu, zatímco na CT s kontrastní látkou jsou hodnoty denzity AML nižší než hodnoty okolního normálního parenchymu. MRI využívá sekvence s potlačením intenzity tuku a v případně jeho malého obsahu lze využít difuzně vážené sekvence se stanovením aparentního difuzního koeficientu. Jeho standartní odchylky jsou u AML výrazně menší než u RK. Naštěstí jsou AML zcela bez tukové složky velmi vzácné. AML může tvořit multifokální léze, mohou být na CT popsány zvětšené lymfatické uzliny. Nicméně tyto znaky nepředstavují maligní růst. Tato teorie je podpořena četným výskytem AML v mnoha orgánech a benigním klinickým průběhem u pacientů s AML při tuberózní skleróze. Proto by měly solidní léze obsahující zralou tukovou tkáň být vždy považovány za AML bez ohledu na přítomnost zvětšených lymfatických uzlin (2, 3, 9, 10).
Image 1. Žena ve věku 47 let, sledována pro trombocytopenickou purpuru s náhodným nálezem exofyticky rostoucího tumoru levé ledviny cT1aN0MX, RENAL skóre 5a, který byl na CT popsán jako hypodenzní nehomogenní, ale ostře ohraničený suspektní renální karcinom o rozměrech na příčném řezu 36 x 22 mm Fig. 1. A 47-year-old female followed for thrombocytopenic purpura with an incidental finding of an exophytic growing tumour of the left kidney cT1a-N0MX, RENAL score 5a, that was described on CT as hypodense, non-homogeneous, but sharply demarcated suspected renal carcinoma with cross-sectional dimensions of 36 x 22 mm Obr. 1a. Peroperačně bylo provedeno USG pomocí laparoskopické sondy. Tumor je solidní s ložisky hyperechogenní tkáně svědčící pro tuk Fig. 1a. A USG using a laparoscopic probe was performed intraoperatively. The tumour is solid with foci of hyperechogenic tissue suggestive of fat 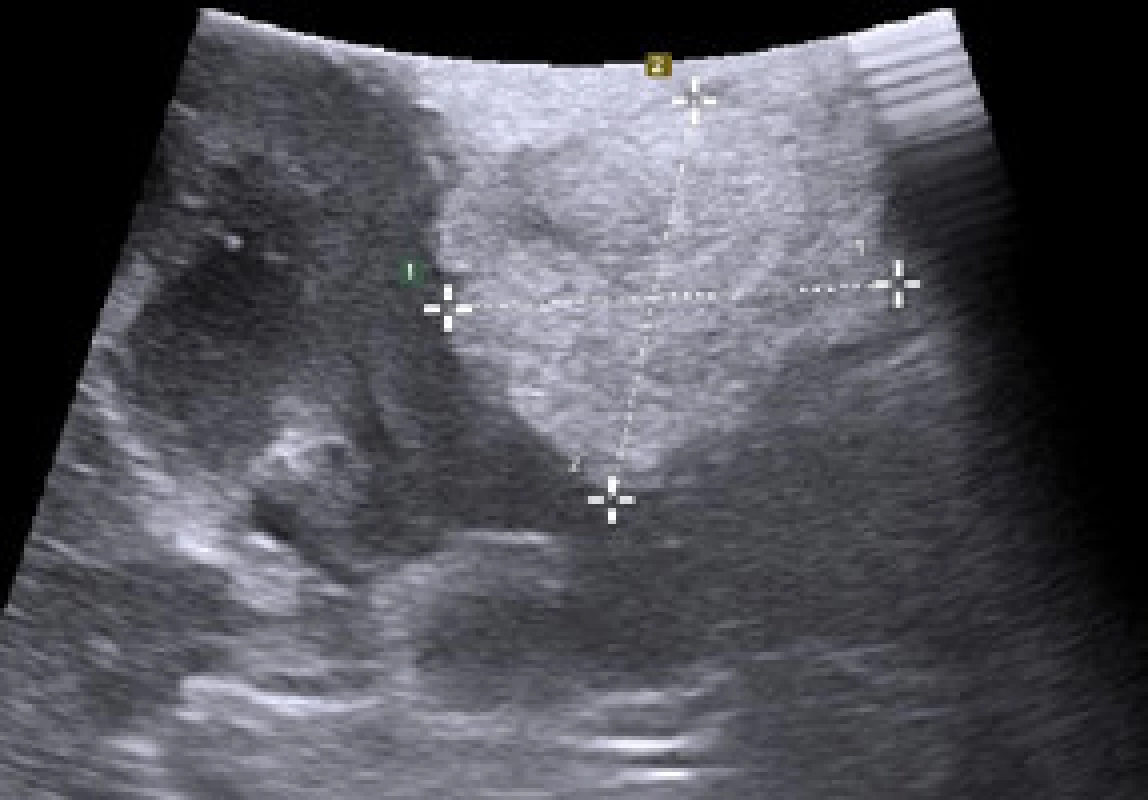
Obr. 1b. Provedli jsme laparoskopickou resekci tumoru, jednalo se o AML Fig. 1b. We performed a laparoscopic tumour resection; AML was found 
Obr. 2a. Žena ve věku 52 let, s náhodným nálezem, 7,5 cm AML horního pólu pravé ledviny; na CT jsou dobře patrné negativní hodnoty denzity -65HU, které odpovídají tukové tkáni Fig. 2a. A 52-year-old female patient with an incidental finding of 7.5 cm AML in the upper pole of the right kidney. Negative density values of -65HU corresponding to adipose tissue are seen on CT 
Obr. 2b. U nemocné byla zvažována selektivní embolizace AML. Byla provedena renovasografie s nálezem středně vaskularizovaného tumoru na horním polu ledviny vpravo, který byl zásobený jak z tepny renální, tak suprarenální. Embolizace suprarenální tepny by byla obtížná, navíc s rizikem destrukce pravé nadledviny. U nemocné jsme proto provedli translumbální resekci tumoru Fig. 2b. Selective embolization for AML was considered. Renovasography was performed and found a moderately vascularized tumour in the upper pole of the right kidney that was supplied by both the renal and suprarenal arteries. Embolization of the suprarenal artery would have been difficult, with an added risk of destroying the right adrenal gland. Therefore, translumbar resection of the tumour was performed 
Obr. 2c. Resekát zahrnující AML, s výrazně zastoupenou tukovou složkou Fig. 2c. Resected part involving AML with a prominent adipose component 
Image 2. Žena ve věku 18 let, s geneticky prokázanou TS (mutace genu TSC1) vyšetřována pro hematurii. Doplněno CT a následně MRI s nálezem objemného 8 cm velkého AML v dolní třetině pravé ledviny Fig. 3. An 18-year-old female with a genetically confirmed TS (TSC1 gene mutation) investigated for haematuria. CT was performed and complemented by MRI with a finding of an 8-cm large AML in the lower third of the right kidney 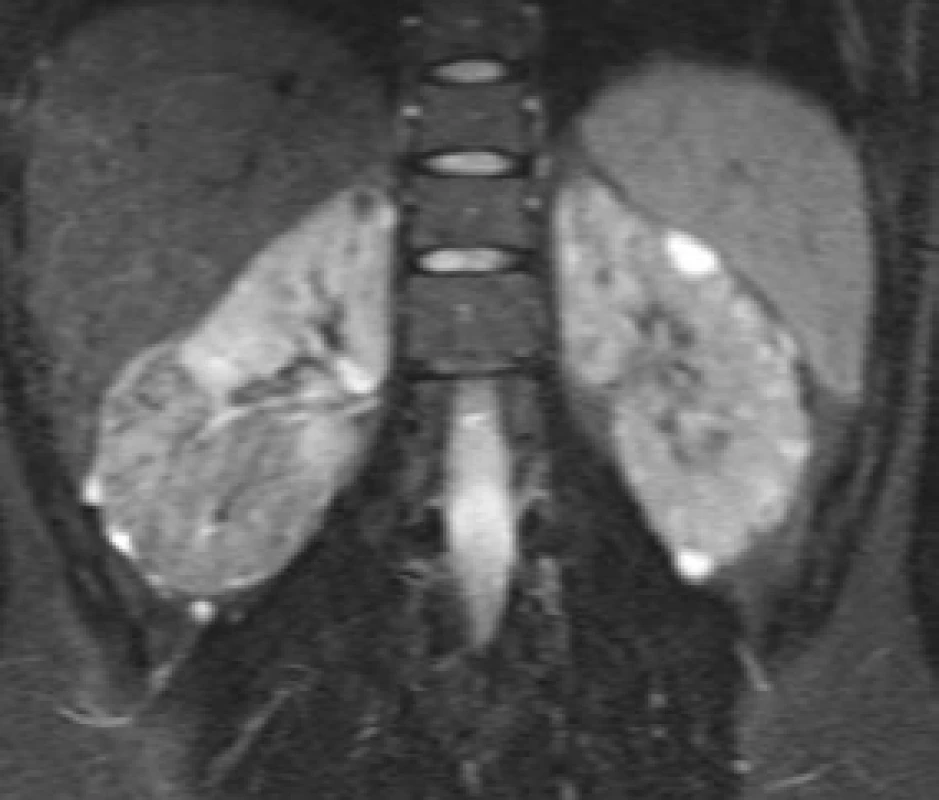
Obr. 3a. Byla provedena renovasografie s patologickou vaskularizací dolního pólu pravé ledviny a četnými aneuryzmaty velikosti do 5 mm Fig. 3a. Renovasography was performed, showing a pathological vascularization of the lower pole of the right kidney and numerous aneurysms with sizes of up to 5 mm 
Obr. 3b. Vzhledem k tomu, že resekční výkon by byl obtížně technicky proveditelný, byla provedena arteriální embolizace PVA částicemi 200 μ, absolutním alkoholem a spirálami Fig. 3b. Given the fact that a resection procedure would be technically challenging, arterial embolization with 200μm PVA particles, absolute alcohol, and coils was performed 
DISPENZARIZACE
Sledování je základním přístupem urologa k těmto nemocným. Za nejvýznamnější prediktor ruptury je v současné době považována velikost nádoru. V současné době je do jisté míry uplatňován algoritmus, který navrhl Oesterling a spol. v roce 1986 (11). Symptomatické AML se prezentují krvácením do retroperitonea při ruptuře nádoru, bolestí či hematurií. Ruptura nádoru je vždy indikována k intervenci. Riziko ruptury AML menšího než 4 cm je asi 13 %, nicméně u AML větších než 4 cm se zvyšuje na 51 % (12).
Asymptomatické AML menší než 4 cm by měly být kontrolovány každých 12 měsíců ultrazvukem. AML prezentující se bolestí či hematurií a menší než 4 cm by měly být sledovány, je možné, že symptomy samy odezní. Frekvence těchto kontrol není dána. Pokud symptomy přetrvávají, měla by být zvážena selektivní embolizace nebo chirurgický výkon. Také asymptomatické AML větší než 4 cm mohou být sledovány pomocí USG každých šest měsíců. Je třeba mít na paměti, že růst AML je pomalý a je zatížen minimální morbiditu (13, 14). Je však nutné počítat s rizikem ruptury AML a k těmto nemocným přistupovat individuálně. Symptomatické AML větší než 4 cm jsou indikovány k intervenci.
INDIKACE LÉČBY
Hlavní indikace léčby AML je krvácení do retroperitonea, trvající bolest či hematurie nebo objemné AML, u kterých předpokládáme vysoké riziko spontánní ruptury. Vzhledem k tomu, že jde o benigní nádor, bylo vynaloženo velké úsilí k nalezení možnosti predikce vzniku krvácivých komplikací. Pokud uvažujeme o velikosti nádoru jako prediktivní hodnotě, několik center navrhlo 4 cm jako limit, nad který by měl být zvažován elektivní výkon. AML větší než 4 cm jsou v 82–94 % symptomatické a v 50–60 % v určité fázi spontánně krvácejí. Je významné, že když AML této velikosti krvácejí, celá třetina pacientů vykazuje známky hemoragického šoku (15). Odhaduje se, že u nádorů větších než 4 cm dochází každých 3,4 let k jedné epizodě krvácení (16). Jiné prediktory budoucího krvácení zahrnují multifokální nádory a významné vaskulární abnormality v rámci AML. Nádorové cévy neobsahují elastickou tkáň a mají charakteristické tortuózní uspořádání. Rovněž šíře stěny cévy se opakovaně mění, na silnostěnné oddíly navazují cévy s tenkou stěnou a tvoří výdutě (aneuryzmata). Yamakado a spol. (17) studovali vztah mezi velikostí nádoru, velikostí aneuryzmat a rupturou. Podle nich všechna prasklá aneuryzmata měla více než 5 mm a 88 % měla více než 9 mm. Použití velikosti aneuryzmatu 5 mm jako prediktoru ruptury přineslo 100 % senzitivitu a 86 % specificitu. Zjistili, že použití velikostí nádoru 4 a 6 cm jako prediktorů ruptury mělo za následek senzitivitu a specificitu 100 a 38 % a 100 a 67 %. Takže použití velikosti nádoru 4 cm má významně horší specificitu než velikost aneuryzmatu 5 mm. Jiné skupiny použily angiografické zobrazení AML větších než 4 cm pro klasifikaci minimální, střední nebo velké vaskularity. Minimální vaskularita AML je definována jako pár malých dilatovaných patologických cév. Střední vaskularita AML má středně velké tortuózní cévy s malými aneuryzmaty nebo bez nich ( < 5 mm) a AML s velkou vaskularitou mají vícenásobné, velké tortuózní cévy s/bez velkých aneuryzmat ( > 5 mm). AML s minimální vaskularitou měly významně menší pravděpodobnost ruptury, než AML s velkou vaskularitou, kde krvácení vykazovalo 14,3 % případů ze skupiny s minimální vaskularitou a 50 % případů s velkou vaskularitou (16, 17). Z výše uvedeného vyplývá, že známky krvácení do nádoru zjištěné na CT bychom vedle velikosti nádoru měli využít jako prediktivní hodnotu možných komplikací a nemocné indikovat k intervenci.
ARTERIÁLNÍ EMBOLIZACE RENÁLNÍCH AML
Poprvé byla arteriální embolizace renálních AML (RAE z angl. Renal Artery Embolism) provedena v roce 1997, kdy ji Han a kol. použili u 14 nemocných se symptomatickým AML, které byly menší než 4 cm (18). Efekt léčby byl sledován angiograficky a novotvořené cévy nebyly prokázány ani po 33 měsících. Pozdější studie ukázala 32% recidivu za průměrnou dobu sledování pacientů 51 měsíců (19). Recidiva byla definována jako zvětšení nádoru o 2 cm během sledování. V rámci dlouhodobých výsledků tedy RAE selhává díky revaskularizaci a dalšímu růstu AML (20). Jako embolizační agens jsou používány různé látky, například čistý alkohol, speciální kovové spirály a polyvinylová alkoholová pěna. Jasný konsenzus pro výběr embolizační látky neexistuje. Někteří autoři doporučují okluzi průtoku spirálou v proximální části tepny následně po okluzi distálního cévního řečiště pomocí polyvinylové alkoholové pěny, aby se zabránilo krvácení způsobenému rupturou při vysokém tlaku v místě distální okluze (21). Použití spirál je však stále předmětem diskuze, protože někteří autoři tvrdí, že způsobuje formování kolaterál a znesnadňuje sekundární embolizaci (22). Dále je dobře znám post-embolizační syndrom, ke kterému dochází až u 85 % pacientů a jeho příčinou je zřejmě uvolnění zánětlivých mediátorů. Syndrom je definován bolestí v boku, horečkou a leukocytózou a často je doprovázen nevolností. S podpůrnou léčbou odeznívá po 2–5 dnech. Závažnější komplikací je tvorba abscesů (kolem 5 %, obr. 4) způsobená uvolněním malého množství embolizační látky (23). Je důležité si povšimnout, že RAE je (kromě resekce či nefrektomie) zřejmě nejužitečnější a nejefektivnější technika při krvácení AML nebo v léčbě velmi objemných AML. Například Bishay a spol., kteří provedli RAE u AML větších než 10 cm, a zjistili, že 62 % pacientů bylo vyléčeno za jedno sezení; 38 % vyžadovalo reembolizaci (24). Po 29 měsících sledování byla u všech pacientů zachována renální funkce. Je jasné, že RAE je atraktivní možnost pro akutní stabilní pacienty s krvácením a dokonce i při selhání léčby stále zůstává možnost opakovat embolizaci. RAE nevylučuje možnost následné parciální nefrektomie. RAE lze aplikovat na léze téměř jakékoliv velikosti a je metodou volby při léčení větších nebo krvácejících lézí, kde jedinou alternativou je nefrektomie.
Image 3. Obr. 4. Nyní 29letá pacientka; v roce 2000 (v 15 letech pacientky) zachycen malý angiomyolipom pravé ledviny 9 mm; nyní intrasinusálně rostoucí angiomyolipom vel 63 mm, který deformuje dutý systém ledviny; AML je nevhodný k resekčnímu výkonu Fig. 4. The patient is now 29 years old. In 2000 (when she was 15 years old), a small 9-mm angiomyolipoma of the right kidney was detected. At present, the angiomyolipoma sized 63 mm is growing intrasinusoidally, deviating the kidney‘s collecting system. The AML is considered infeasible for a resection procedure 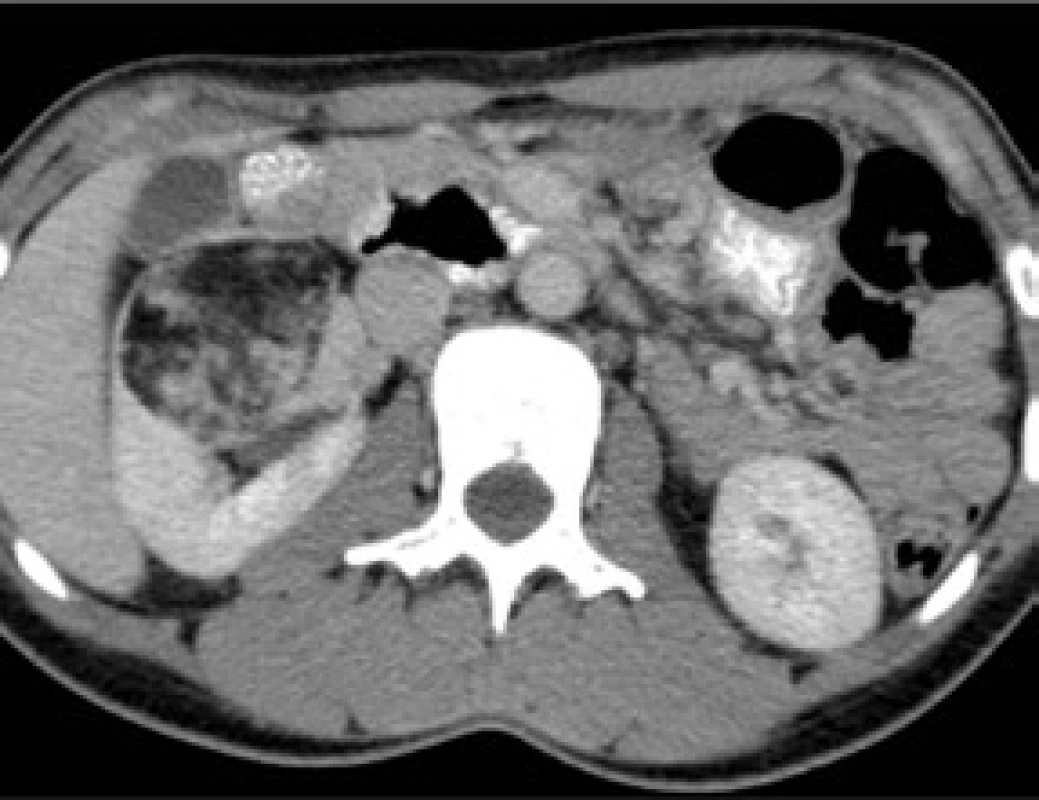
Obr. 4a. Vzhledem k progresi AML nemocná přijata k superselektivní embolizaci tumoru; dle angiografie tepny zásobící AML mnohočetně odstupují ze segmentární větve pro ventrální segmenty ledviny, a to i velmi centrálně těsně za větvením kmene; provedena kompletní embolizace této segmentární větve pomocí PVA a alkoholu v množství 2 ml a dále s pomocí okluze kmene segmentární větve dvěma spirálami tornádo 3/2 mm<sup>®</sup> Fig. 4a. Given the progression of AML, the patient was admitted for superselective embolization of the tumour. Angiography showed that arteries supplying the AML arise multiply from the segmental branch for the kidney‘s ventral segments, even very centrally just beyond the branching of the trunk. Complete embolization of this segmental branch was performed using PVA and 2 ml of alcohol as well as occlusion of the trunk of the segmental branch with two 3/2 Tornado coils 
Obr. 4b. U nemocné bylo 6 týdnů po výkonu provedeno kontrolní CT; tumor nápadně zregredoval svojí velikostí, z původních rozměrů 63 x 55 mm, nyní dosahuje rozměrů 54 x 45 mm v nejširším místě; změnila se také výrazně jeho struktura, kdy centrálně obsahuje zkolikvovaný tuk ve své ventrální části a ve své dorzální části tekutinu, vytvořilo se silnější nebarvící se pouzdro; tato tekutina byl příčinou nefralgií nemocné; kolekce se bez dalších komplikací vstřebávala dalších 10 měsíců Fig. 4b. A follow-up CT scan was performed in the patient six weeks after the procedure. The tumour has apparently regressed in size, from the original dimension of 63 x 55 mm to the present 54 x 45 mm in the widest part. Also, its structure has markedly changed, centrally containing liquefied fat in its ventral portion and fluid in its dorsal portion, with a stronger non-enhancing capsule having been formed. The fluid was the cause of nephralgias in the patient. The collection was absorbed uneventfully within the next ten months 
Image 4. Žena ve věku 40 let, sledována pro shluk 2 AML 4 roky pro shluk dvou AML o celkové velikosti 35 mm; pro opakované ataky makroskopické hematurie provedeno RFA angiomyolipomu na přechodu pars intermedia a kaudální třetiny ledviny vlevo; pacientka je 26 měsíců od výkonu bez známek recidivy Fig. 5. A 40-year-old woman had been followed for a cluster of two AMLs of a total size of 35 mm for four years. Due to repeated attacks of macroscopic haematuria, RFA for angiomyolipoma was performed at the transition between pars intermedia and the caudal third of the left kidney. The patient shows no signs of recurrence 26 months following the procedure 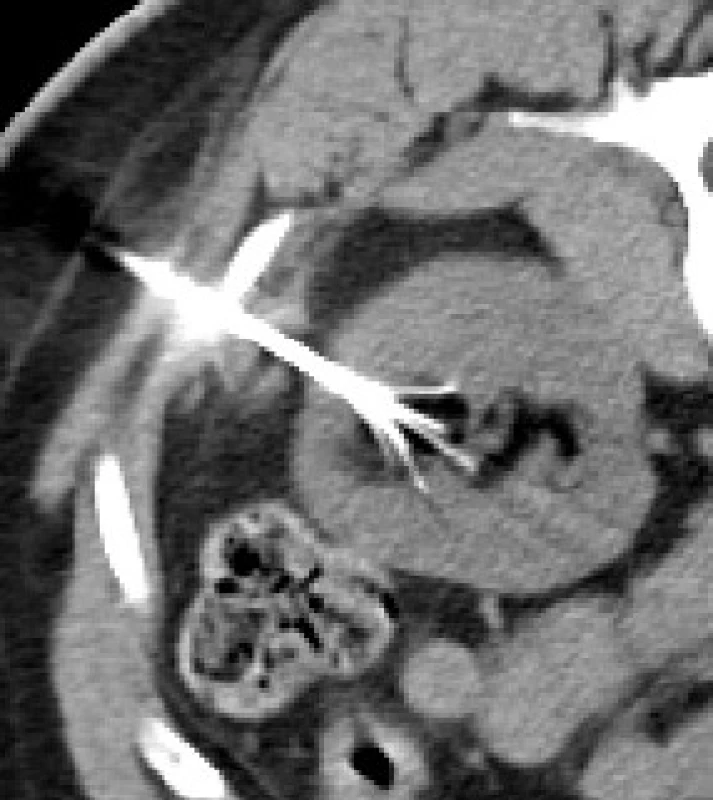
RADIOFREKVENČNÍ ABLACE
Radiofrekvenční ablace (RFA) byla prvně použita v roce 2008 k léčbě 4,5cm AML (25). Zatím největší soubor prezentovali Castle a kol. V této studii bylo léčeno 15 pacientů průměrnou velikostí AML 2,6 cm (1,0–3,7 cm), z nichž pět podstoupilo laparoskopickou RFA a deset perkutánní CT řízenou RFA. Pro laparoskopickou RFA byl použit transperitoneální přístup. Žádný z těchto pacientů neměl TSC a všechny léze byly léčeny bez intraoperačních komplikací. Nebyla zjištěna recidiva AML během střednědobého sledování 21,5 měsíců (25).
K RFA jsou vhodné AML, které rostou extrarenálně i intrarenálně. Nejméně přístupné jsou nádory centrální, představují negativní prognostický faktor a nejsou většinou pro RFA indikované (27). Velikost nádorů, u kterých byla provedena RFA, se v literatuře pohybuje od 30 mm do 223 mm (27, 28, 29). Nejlepší výsledky (úspěch ablace ve 100 % bez recidivy) byly u nádorů menších než 40 mm. K destrukci nádorů menších než 30–35 mm v největším rozměru postačí v naprosté většině jeden výkon, při větší velikosti se signifikantně častěji přistupuje k dalšímu výkonu (reRFA) s cílem destrukce reziduální nádorové tkáně. Úspěšnost RFA a reRFA u všech nádorů do velikosti 40 mm byla v 93 %. U nádorů větších než 40 mm byla RFA, reRFA a rereRFA úspěšná jen v 57 %. Klingler et al. (30) prezentovali experimentálně klinickou práci, která by mohla vysvětlovat vyšší výskyt recidiv a tudíž horší výsledky u RFA. Rozsah koagulační nekrózy je závislý na aplikované energii, geometrii radiofrekvenční sondy, trvání expozice vysokých teplot, perfuzi krve orgánem a především impedanci (odporu) okolní tkáně. Tok proměnlivého vysokofrekvenčího proudu (375–500 kHz) může přeskočit do oblasti s menší impedancí, čímž ponechá některé oblasti tkáně bez ablačního účinku. Tento jev se nazývá „skipping“ fenomén.
Přestože se zdá, že RFA je bezpečná v případě malých a středních renálních AML, nicméně chybí údaje o dlouhodobém efektu RFA. Většina dostupných studií zabývajících se léčbou AML pomocí RFA se týkaly lézí < 4 cm, z nichž většina možná mohla být jen sledována. Je proto nutné provést větší studie s dlouhodobějšími údaji, aby bylo možné zjistit, zda je RFA skutečně efektivnější než RAE.
KRYOABLACE
Kryoablace (CA) AML byla popsána v roce 1996 Delworthem a kol. (31), kteří použili ještě otevřený přístup pro nasazení sondy. Jednalo se o objemný AML (10 x 8 cm) u nemocné s tuberózní sklerózou. Bohužel po třech měsících došlo k opětovnému růstu nádoru. S rozvojem laparoskopie byly publikovány další práce s využitím laparoskopické kontroly umístěním kryosondy, které zahrnovaly 50 pacientů. Ošetřené AML však byly menší (medián 4 cm) a kryoablace byla provedena s dobrým efektem, pacienti nevykazovali recidivu po dobu sledování 21 měsíců (32, 33). Retrospektivní nekontrolované studie předpokládají, že v provnání s RFA může kryoablace nabídnout menší potřebu doplňujících výkonů (reablací) a vykazuje nižší četnost lokálních recidiv. Nicméně proměnné, jako jsou chirurgický přístup (laparoskopický vs perkutánní), funkční zdatnost/nedostatečnost parenchymu, anestezie (celková vs. Analgosedace) a odbornost lékaře (intervenční radiolog vs. urolog), mohou významně ovlivnit výsledky každé metody. Úspěšnost ablačních metod prokázaná histologicky byla podle studie Weighta a kol. 93,8 % (CA) a 64,8 % (RFA) (34). Metaanalýza 99 pacientů prokázala lokální recidivu u 4,6 % (CA) a u RFA dosáhla 11,7 %. Obě metody vykazovaly signifikantně vyšší četnost lokálních recidiv ve srovnání s NSS (35).
RESEKČNÍ VÝKONY NA LEDVINĚ (NSS)
Zlepšení diagnostických technik spolu s prokázanou efektivitou NSS pro RCC má za následek snahu aplikovat NSS i na AML. Práce, které se touto problematikou zabývaly, prezentovaly 80 nemocných (36–39) s AML průměrné velikosti 2,5–12,5 cm (medián 4,5 cm), které byly resekovány bez komplikací (Clavien/Dindo I-II), a to včetně resekčního výkonu na solitární ledvině. Délka sledování byla 26–58 měsíců bez recidivy onemocnění či vzniku renální insuficience. Msezane a spol. srovnávají výsledky laparoskopické parciální nefrektomie (LPN) u pacientů s AML s pacienty s jinými renálními nádory (40). I když AML lézí se týkala analýza podskupiny o 14 pacientech, kteří byli identifikováni až retrospektivně, autoři nezjistili žádný rozdíl v intraoperačních a pooperačních komplikacích nebo konverzi ve srovnání s LPN pro jiné malé renální léze. Jiné podobné studie srovnávající výsledky LPN s otevřenou parciální nefrektomií AML versus jiné malé renální nádory ukazují podobná zjištění, stejně jako srovnatelné přežití bez recidivy (41, 42). NSS pro sporadické renální AML tedy nabízí dlouhodobé zachování renální funkce a jsou asociovány s menším počtem komplikací a menším výskytem recidivy. Údaje z těchto velkých studií podporují, že NSS lze indikovat jako primární léčbu AML, pokud není doporučena dispenzarizace. Pro úplnost je třeba ještě zmínit techniku laparoskopické resekce jedním portem (43), avšak je nutné si uvědomit, že je to velmi raná studie a vyžaduje značnou erudici v oblasti technik LESS. Stejně si stojí i roboticky asistovaná parciální nefrektomie (44).
SYSTÉMOVÁ TERAPIE MNOHOČETNÉHO AML
TSC je způsobená inaktivační mutací genu TSC1 nebo TSC2. Inaktivace genu pak vede ke zvýšení exprese savčího receptoru rapamycinové dráhy, která ovlivňuje mnohé buněčné procesy, jako je zvýšená produkce vaskulárního endoteliálního růstového faktoru (VEGF) a další. Bylo zjištěno, že deriváty rapamycinu, takzvané mTOR inhibitory (everolimus, sirolimus), mají inhibiční účinek na produkci VEGF, růst nádoru a angiogenezi, a to jak in vitro, tak in vivo (41, 42). Byla provedena mezinárodní dvojitě zaslepená studie (EXIST 2), která prokázala významné snížení objemu nádoru (43). Everolimus a následně sirolimus je schválen k léčbě dospělých pacientů s TSC s renálním AML, kteří nevyžadují okamžitý chirurgický zákrok a dospělých a dětí s TSC od tří let věku se SEGA, kteří vyžadují terapeutický zásah, ale nejsou kandidáty kurativní chirurgické resekce. Cílená systémové terapie poskytuje alternativu chirurgické léčby či umožňuje kurativní chirurgický výkon po redukci objemu AML (44). V České republice je schválena k léčbě SEGA a mnohočetného AML u TSC Votubia ® (Novartis Europharm Ltd), 2,5 mg tbl, jako alternativa léčby tohoto vzácného onemocnění. Nicméně jsou potřeba další studie, které by řešily otázky recidivy či reziduálního AML po úvodní léčbě everolimem.
ZÁVĚR
Zcela zásadní roli má aktivní sledování pacientů s pomalu rostoucím AML. V současné době jsou k intervenci indikovány symptomatické AML nebo objemné AML, u kterých předpokládáme vysoké riziko spontánní ruptury. Selektivní arteriální embolizace je metoda první volby, která úspěšně řeší hemoragické komplikace a redukuje objem AML. V rámci dlouhodobých výsledků však selhává díky revaskularizaci a dalšímu růstu AML. Zde pak mají lepší výsledky chirurgické operace, kde se snažíme v maximální míře šetřit funkci ledviny. Slibné dlouhodobé výsledky má též radiofrekvenční ablace (RFA), která je ale silně limitována velikostí AML. U objemnějších AML se zdá být dobrou alternativou resekčního výkonu kryoablace, která však vyžaduje hůře dostupné speciální přístrojové vybavení. Novinkou je pak systémová léčba mTOR inhibitory (everolimus, sirolimus), které mají nezastupitelné místo u nemocných s TSC, kde jsou AML mnohočetné a recidivující. Tato terapie může pomoci redukovat celkový objem AML a umožnit případný resekční výkon.
Došlo: 8. 2. 2015
Přijato: 31. 3. 2015
Střet zájmů: žádný.
Prohlášení o podpoře: Zpracovnání tohoto sdělení bylo podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806)
Kontaktní adresa:
MUDr. Tomáš Ürge, Ph.D.
Urologická klinika LF UK a FN
E. Beneše 13, 305 99 Plzeň
e-mail: urget@fnplzen.cz
Sources
1. Fittschen A, Wendlik I, Oeztuerk S, et al. Prevalence of sporadic renal angiomyolipoma: a retrospective analysis of 61,389 in - and out-patients. 1. Abdom Imaging. 2014 Oct; 39 (5): 1009–1013.
2. Ürge T, Hora M, Hes O, Chudáček Z. Renální angiomyolipom, histologie, diagnostika a terapie. Čas. Lék. čes 2005; 144 (12): 821–823.
3. Nese N, Martignoni G, Fletcher CD, et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney: a clinicopathologic study of 41 cases: detailed assessment of morphology and risk stratification. Am J Surg Pathol 2011, 35 : 161–176
4. He W, Cheville JC, Sadow PM, et al. Epithelioid angiomyolipoma of the kidney: pathological features and clinical outcome in a series of consecutively resected tumors.Mod Pathol. 2013 Oct; 26(10): 1355–1364.
5. Hora M, Ürge T, Kalusová K, Michal M, et al. Novelizovaná klasifikace nádorů ledvin 2013 (International society of urological pathology Vancouver classification of renal neoplasia). Ces Urol 2014; 18(1): 9–20.
6. Zedebin D, Kammerhober F, Uggowitzer MM, Szolar DH. Criteria for ultrasound differentiation of small angiomyolipomas ( < 3cm) and renal cell carcinomas. RoFo Forschr Geb Rontgenster Neuen Bilgeb Verfahr 1998; 169 : 627–632.
7. Tanaka H, Yoshida S, Fujii Y, et al. Diffusion-weighted magnetic resonance imaging in the differentiation of angiomyolipoma with minimal fat from clear cell renal cell carcinoma. Int J Urol. 2011 Oct; 18 (10): 727–308.
8. Halpenny D, Snow A, McNeill G, Torreggiani WC. The radiological diagnosis and treatment of renal angiomyolipoma – current status. Clinical Radiology 2010; 65 : 99–108.
9. Mues AC, Palacios JM, Haramis G, et al. Contemporary experience in the management of angiomyolipoma. J Endourol 2010 Nov; 24(11): 1883–1886.
10. Eble JN, Sauter G, Epstein JI, et al. (eds). Pathology and genetics of tumours of the urinary system and male genital organs. World Health Organization Classification of Tumours. Lyon: IARC Press, 2004 : 9–87.
11. Oesterling JE, Fishman EK, Goldman SM, Marshall FF. The management of renal angiomyolipoma. J Urol 1986; 135 : 1121–1124.
12. Nelson CP, Sanda MG. Contemporary diagnosis and management of renal angiomyolipoma. J Urol 2002. Oct; 168 (4 Pt 1): 1315–1325.
13. Sooriakumaran P, Gibbs P, Coughlin G, et al. Angiomyolipomata: challenges, solutions, and future prospects based on over 100 cases treated. BJU Int. 2010; 105(1): 101–106.
14. Ouzaid I, Autorino R, Fatica R, et al. Active surveillance for renal angiomyolipoma: outcomes and factors predictive of delayed intervention. BJU Int. 2014 Sep; 114 (3): 412–417.
15. Sýkora R, Fabišovský M, Němec D, Vašík J, Krhut J. Život ohrožující krvácení do dutiny břišní na podkladě spontánní ruptury angiomyolipomu. Ces Urol 2013; 17(1): 51–54.
16. Dickinson M, Ruckle H, Beaghler M, Hadley HR. Renal angiomyolipoma: optimal treatment based on size and symptoms. Clin Nephrol. 1998; 49(5): 281–286.
17. Yamakado K, Tanaka N, Nakawaga T, et al. Renal angiomyolipoma: relationships between tumour size, aneurysm formation and ruptute. Radiology 2002; 225 : 78–82.
18. Han YM, Kim JK, Roh BS, et al. Renal angiomyolipoma: selective arterial embolization-effectiveness and changes in angiomyogenic components in long-term follow-up. Radiology. 1997; 204(1): 65–70.
19. Ramon J, Rimon U, Garniek A, et al. Renal angiomyolipoma: long-term results following selective arterial embolization. Eur Urol 2009 May; 55(5): 1155–1161.
19. Kothary N, McClarc S, Clark TW, et al. Ranal angiomyolipoma: long term results after arterial embolization. J Vasc Interv Radiol 2005; 16(1): 45–50.
20. Ewalt DH, Diamond N, Rees C, et al. Long-term outcome of transcatheter embolization of renal angiomyolipomas due to tuberous sclerosis complex. J Urol. 2005; 174(5): 1764–1766.
21. Chi Kwok Chan, Simon Yu, Sidney Yip, and Paul Lee. The efficacy, safety and durability of selective renal arterial embolization in treating symptomatic and asymptomatic renal angiomyolipoma. UROLOGY 2011; 77(3): 641–648.
22. Stránský P, Chudáček Z, Havel V, et al. Možnosti intervenční radiologie při léčbě nádorů ledvin. Ces Urol 2012; 16(1): 50–57.
23. Bishay VL, Crino PB, Wein AJ, et al. Embolization of giant renal angiomyolipomas: technique and results. J Vasc Interv Radiol. 2010; 21(1): 67–72.
24. Hocquelet A, Cornelis F, Le Bras Y, et al. Long-term results of preventive embolization of renal angiomyolipomas: evaluation of predictive factors of volume decrease. Eur Radiol. 2014 Aug; 24(8): 1785–1793.
25. Prevoo W, van den Bosch MA, Horenblas S. Radiofrequency ablation for treatment of sporadic angiomyolipoma. Urology. 2008; 72(1): 188–191.
26. Castle SM, Gorbatiy V, Ekwenna O, Young E, Leveillee RJ. Radiofrequency ablation (RFA) therapy for renal angiomyolipoma (AML): an alternative to angio-embolization and nephron-sparing surgery. BJU Int. 2012; 109(3): 384–387.
27. Morávek P jr, Morávek P, Dvořák P. Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti. Ces Urol 2010; 14(2): 104–109.
28. Jacomides L, Ogan K, Watumull L, Cadeddu JA. Laparoscopic application of radio frequency energy enables in situ renal tumor ablation and partial nephrectomy. J Urol. 2003; 169(1): 49–53.
29. Davenport MS, Cavili EM, Cohan RH, et al. MRI and CT characteristics of success fully ablated renal masses: Imaging surveillance after radiofrequency ablation. ARJ AM J Roentgenol 2009; 192(6): 1571–1578.
30. Klingler HC, Marberger M, Mauermann J, et al. ‘Skipping’ is still a problem with radiofrequency ablation of small renal tumours. BJU Int 2007; 99 : 998–1001.
31. Delworth MG, Pisters LL, Fornage BD, von Eschenbach AC. Cryotherapy for renal cell carcinoma and angiomyolipoma. J Urol. 1996; 155(1): 252–254.
32. Johnson SC, Graham S, D’Agostino H, Elmajian DA, Shingleton WB. Percutaneous renal cryoablation of angiomyolipomas in patients with solitary kidneys. Urology. 2009; 74(6): 1246–1249.
33. Byrd GF, Lawatsch EJ, Mesrobian HG, Begun F, Langenstroer P. Laparoscopic cryoablation of renal angiomyolipoma. J Urol. 2006; 176 (4 Pt 1): 1512–1516.
34. Weight CJ, Kaouk JH, Hegarty NJ, et al. Correlation of radiographic imaging and histopathology following cryoablation and radio frequency ablation for renal tumors. J Urol 2008; 179(4): 1277–1281.
35. Kunkle DA, Egleston BL, Uzzo RG. Excise, ablate or observe: the small renal mass dilemma – a meta-analysis and review. J Urol 2008; 179 (4): 1227–1233.
36. Boorjian SA, Frank I, Inman B, Lohse Ch M, Cheville JC, et al. The Role of Partial Nephrectomy for the Management of Sporadic Renal Angiomyolipoma. UROLOGY 2007; 70 : 1064–1068.
37. Heidenreich A, Hegele A, Varga Z, vonKnobloch R, Hofmann R. Nephron sparing surgery for renal angiomyolipoma. Eur Urol 2002; 41 : 267–273.
38. Čermák A, Pacík D, Vít V. Současný pohled na léčbu malých nádorů ledvin. Urol List 2012; 10(3): 6–15.
39. Hora M, Eret V, Ürge T, et al. Results of laparoscopic resection of kidney tumour in everyday clinical practice, CEJU (Central European Journal of Urology), 2009, 62(3): 160–166.
40. Msezane L, Chang A, Shikanov S, et al. Laparoscopic nephronsparing surgery in the management of angiomyolipoma: a single center experience. J Endourol. 2010; 24(4): 583–587.
41. Simmons MN, Chung BI, Gill IS. Perioperative efficacy of laparoscopic partial nephrectomy for tumors larger than 4 cm. Eur Urol. 2009; 55(1): 199–207.
42. Lane BR, Aydin H, Danforth TL, et al. Clinical correlates of renal angiomyolipoma subtypes in 209 patients: classic, fat poor, tuberous sclerosis associated and epithelioid. J Urol. 2008; 180(3): 836–843.
43. Schips L, Berardinelli F, Neri F, Tamburro FR, Cindolo L. Laparoendoscopic single-site partial nephrectomy without ischemia for very small, exophytic renal masses: surgical details and functional outcomes. Eur Urol. 2012.
44. Bolufer E, López-Fontana G, Castillo OA. Robot assisted partial nephrectomy (Da Vinci) in an angiomyolipoma associated to Wünderlich Syndrome. Arch Esp Urol. 2012; 65(9): 831–834.
45. El-Hashemite N, Walker V, Zhang H, Kwiatkowski DJ. Loss of Tsc1 or Tsc2 induces vascular endothelial growth factor production through mammalian target of rapamycin. Cancer Res. 2003; 63(17): 5173–5177.
46. Dabora SL, Franz DN, Ashwal S, et al. Multicenter phase 2 trial of sirolimus for tuberous sclerosis: kidney angiomyolipomas and other tumors regress and. PLoS One. 2011; 6(9): e23379.
47. Bissler JJ, Kingswood JC, Radzikowska E, et al. Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST-2): a multicentre, randomised, double-blind, placebo-controlled trial. 1. Lancet. 2013 Mar 9; 381(9869): 817.
48. Staehler M, Sauter M, Helck A, et al. Nephron-sparing resection of angiomyolipoma after sirolimus pretreatment in patients with tuberous sclerosis. Int Urol Nephrol 2012 Dec; 44 (6): 1657–1661.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2015 Issue 2-
All articles in this issue
- LAPAROSKOPICKÁ RESEKCE TUMORŮ LEDVINY
- NOVÉ TRENDY V LÉČBĚ RENÁLNÍHO ANGIOMYOLIPOMU
- ISCHEMIE LEDVINY PŘI RESEKCÍCH LEDVIN A MOŽNOSTI JEJÍHO OVLIVNĚNÍ
- FYZIOTERAPIE V LÉČBĚ INKONTINENCE MOČI U ŽEN
- ASYNCHRONNÍ BILATERÁLNÍ SEMINOM NA PODKLADĚ INTRATUBULÁRNÍ GERMINÁLNÍ NEOPLAZIE – NEKLASIFIKOVATELNÝ TYP
- TUMOR GLANS PENIS JAKO KLINICKÁ MANIFESTACE PLAZMABLASTICKÉHO LYMFOMU
- KRÁTKODOBÉ ONKOLOGICKÉ VÝSLEDKY PO RADIKÁLNÍ PROSTATEKTOMII S ROZŠÍŘENOU PÁNEVNÍ LYMFADENEKTOMIÍ A S NÁLEZEM UZLINOVÝCH METASTÁZ. LZE POMÝŠLET NA ÚSPĚCH BEZ SYSTÉMOVÉ LÉČBY?
- LÉČBA DE NOVO URGENTNÍHO SYNDROMU PO TOT IMPLANTACI
- LIPOSARKOM A GANGLIONEUROM JAKO PRIMÁRNÍ NÁDORY RETROPERITONEA
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- NOVÉ TRENDY V LÉČBĚ RENÁLNÍHO ANGIOMYOLIPOMU
- LIPOSARKOM A GANGLIONEUROM JAKO PRIMÁRNÍ NÁDORY RETROPERITONEA
- TUMOR GLANS PENIS JAKO KLINICKÁ MANIFESTACE PLAZMABLASTICKÉHO LYMFOMU
- FYZIOTERAPIE V LÉČBĚ INKONTINENCE MOČI U ŽEN
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




