-
Medical journals
- Career
Nádor varlete z Leydigových buněk
: Jakub Szewczyk 1; Radoslava Tomanová 2; Radek Sýkora 1; Kateřina Kouřilová 1; Jan Krhut 1
: Urologické oddělení, Fakultní nemocnice Ostrava 1; Ústav patologie, Fakultní nemocnice Ostrava 2
: Ces Urol 2014; 18(1): 65-68
: Case report
Prezentujeme dvě kazuistiky pacientů s nádorem z Leydigových buněk varlete. Od roku 1989 byly na našem pracovišti zaznamenány pouze tyto dva případy. U jednoho pacienta se jednalo o benigní formu, u staršího pacienta o nádor nejisté biologické povahy. V článku popisujeme diagnostiku, léčbu a dispenzarizaci. Dále rozebíráme možnosti záchovného výkonu. Upozorňujeme na nutnost sledování všech pacientů pro možnou malignizaci původně benigních forem.
Klíčová slova:
nádor z Leydigových buněk, stromální nádor, orchiektomie, záchovný výkon, nejistá biologická povaha.ÚVOD
Nádor z Leydigových buněk představuje 1–3 % všech nádorů varlat, z toho kolem 10 % má maligní povahu. Nejčastější výskyt nádoru je ve 3.–6. dekádě. U starších pacientů je častější výskyt maligních forem (1). U dětí se vyskytuje vždy jen benigní forma. V 3 % se jedná o bilaterální nádor. V případě zhoubného nádoru metastázy nejčastěji nalezneme v retroperitoneálních lymfatických uzlinách, játrech, plicích a kostech (2).
KAZUISTIKA 1
V dubnu 2012 přichází 27letý pacient na urologickou ambulanci. Při samovyšetření si nahmatal drobnou nebolestivou rezistenci na pravém varleti. Palpačním vyšetřením zjištěno velice diskrétní ložisko, následné ultrazvukové vyšetření skrota prokazuje hypoechogenní ložisko na horním pólu varlete velikosti 15 × 13 mm, levé varle homogenní struktury, bez nálezu patologie. S pacientem byly probrány možnosti léčby, preferuje radikální orchiektomii. Odebrány základní onkomarkery laktátdehydrogenáza, alfa-fetoprotein, beta - -humánní choriový gonadotropin (LDH, AFP, bHCG), které byly negativní.
Provedena radikální orchiektomie vpravo, preparát odeslán na akutní histologické vyšetření. Makroskopicky na řezu varlete patrné tumorózní ložisko bělavého charakteru, tužší konzistence. Mikroskopicky zjištěn neopouzdřený tumor z Leydigových buněk (TLB). Buňky s výraznou fibrózou stromatu. Nádor nepřesahuje tunicu albugineu a angioinvaze nebyla nalezena, biologická povaha nádoru hodnocena jako benigní. Jako vedlejší nález zjištěn Pickův adenom bez souvislosti s TLB. Preparát odeslán na jiné pracoviště ke 2. čtení s identickým výsledkem.
U pacienta provedeno CT vyšetření plic, s nálezem drobných mikronodulů velikosti do 4 mm, dále CT vyšetření břicha s nálezem drobných nespecifických hypodenzit v játrech charakteru cyst či kavernomu. Vzhledem k histologicky benigní povaze nádoru, hodnotíme nálezy na CT jako irelevantní, benigní. Za 6 měsíců po orchiektomii provedeno kontrolní CT vyšetření plic a břicha se stejným nálezem. Při kontrolním ultrazvukovém vyšetření solitárního varlete prokazujeme zcela homogenní strukturu. Odběry gonadotropinů, estradiolu a testosteronu v normě. Pacient je bez gynekomastie. Nyní čeká narození potomka, oplodnění proběhlo přirozenou cestou ještě před stanovením diagnózy. Pacient bude i nadále sledován v pravidelných intervalech.
KAZUISTIKA 2
V lednu 2012 přichází 62letý pacient do urologické ambulance s asi dvoutýdenní anamnézou bolestivosti pravého varlete s propagací do třísla a hmatnou rezistencí na varleti. Provedena ultrazvuková diagnostika s nálezem hypoechogenního ložiska velikosti 10 × 8 mm na pravém varleti. Jako vedlejší nález spermatokéla. Proveden odběr onkomarkerů – LDH, b-HCG, AFP - negativní. Pacient indikován k revizi varlete.
Peroperačně zjištěno ložisko žlutobělavé barvy, které je dobře ohraničené, tuhé konzistence, homogenní struktury. Provedena radikální orchiektomie vpravo.
Histologicky zjištěn nádor z Leydigových buněk bez nekróz, pleomorfie, bez známek invaze do cév. Nádor prostupuje do vnitřní vrstvy tunica albuginea, skrze tunicu však neprorůstá. Hraniční počet mitóz: dvě mitózy na 10 zorných polí při velkém zvětšení (HPF, high power field). Histologický preparát odeslán na jiné pracoviště ke 2. čtení s výsledkem: Diagnoza shodná, biologická povaha tumoru nejistá, avšak jednoznačné morfologické známky malignity nejsou přítomny.
Po orchiektomii provedeno CT vyšetření břicha a plic. Bez známek generalizace. Na CT plic zjištěn ojedinělý mikronodulus vlevo subpleurálně velikosti 3 × 3 × 2 mm. Vzhledem k velikosti nemá jednoznačný charakter meta změn.
Další sledování v pravidelných šestiměsíčních intervalech. Půl roku po orchiektomii proveden kontrolní PS plic – bez patrné patologie, ultrazvuk břicha – bez zvětšení uzlin retroperitonea, bez patrných metastáz parenchymových orgánů. Odběr gonadotropinů, estriadolu a testosteronu v normě. Při další kontrole provedeno CT břicha a plic – bez patrné generalizace. Pacient je bez urologických obtíží.
1. Vpravo patrný nádor z Leydigových buněk, vlevo normální parenchym varlete Fig. 1. Right side, Leydig cell tumor; left side, normal parenchyma of the testis 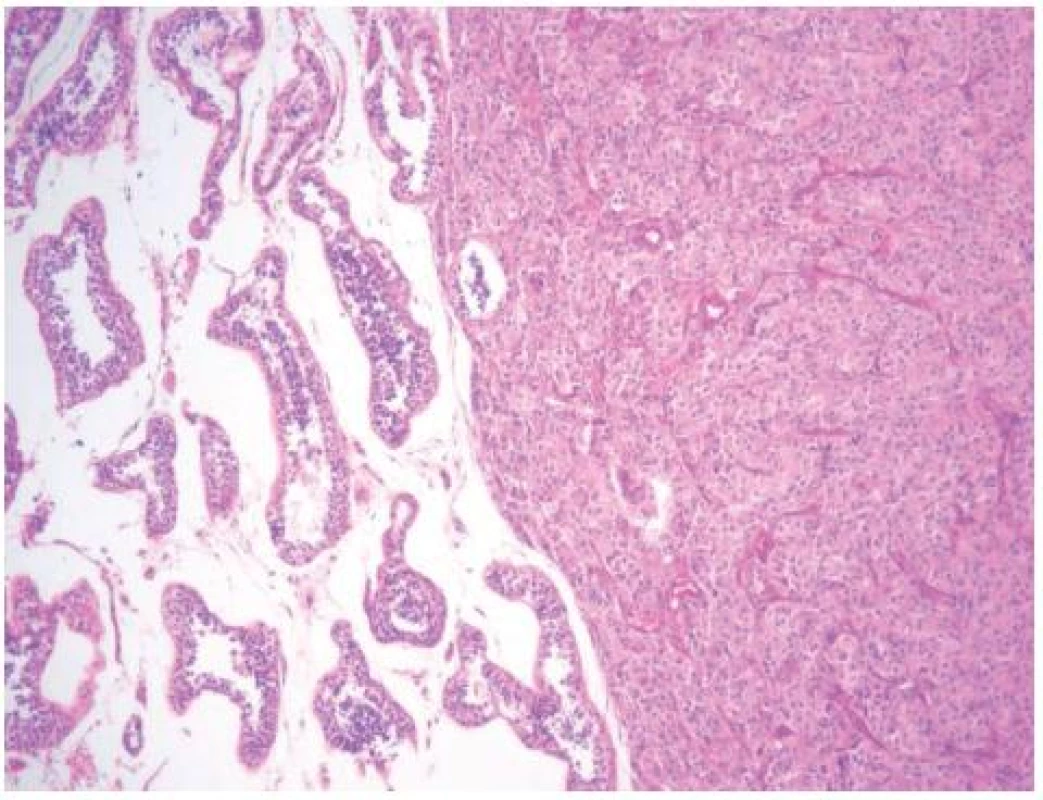
2. varletem s patrným intraparenchymovým nádorem Fig. 2. Crossection of the testis with intraparenchymal tumor 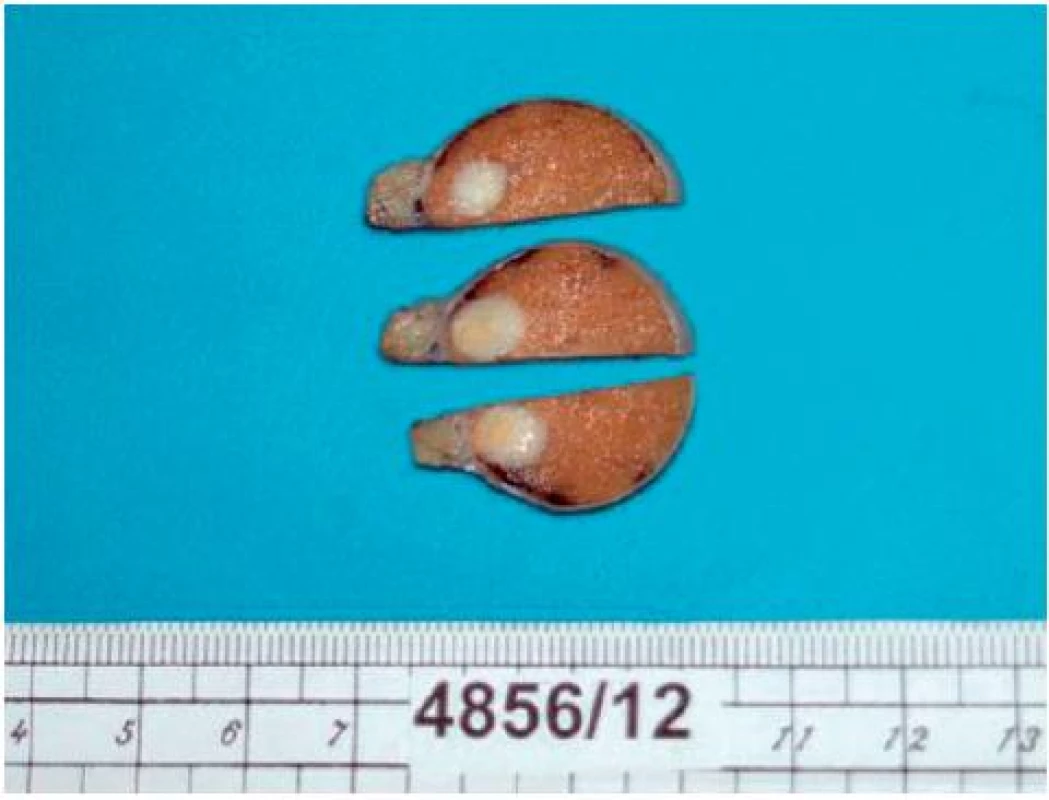
3. Náhodný nález Pickova adenomu v parenchymu varlete Fig. 3. Incidental Pick’s adenoma in parenchyma of the testis 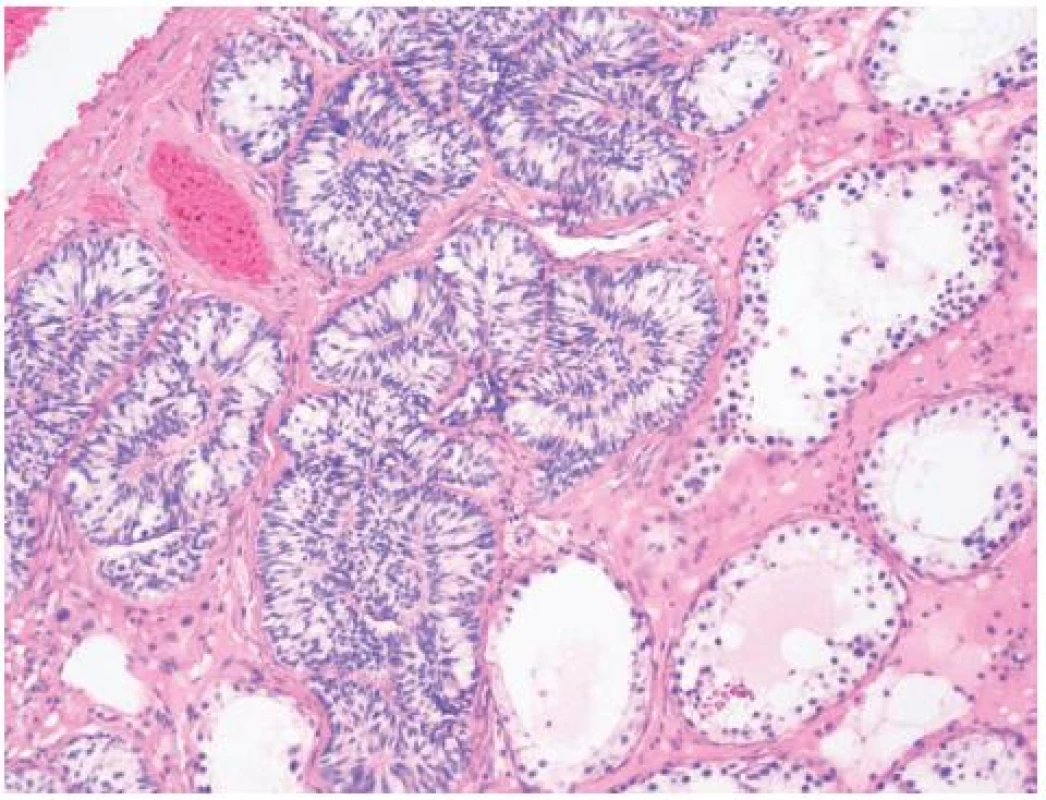
DISKUSE
Tumor z Leydigových buněk zařazujeme mezi stromální nádory varlete (3). Tvoří 1–3 % všech nádorů varlat, z toho 10 % má maligní povahu. Nejčastější výskyt nádoru je mezi 3.–10. rokem života a 30.–60. rokem věku (1, 4). U dětských pacientů se jedná vždy o benigní formu spojenou často s předčasnou pubertou, gynekomastií a hormonální dysbalancí (5). Rizikovým faktorem vzniku nádoru je kryptorchismus (4). U starších pacientů je častější výskyt maligních forem (1). Přibližně u 3% se jedná o bilaterální formu (4, 6). Maligní forma nádoru má následující znaky: velikost > 5 cm, jaderná atypie, zvýšená mitotická aktivita (> 3 mitózy na 10 HPF), zvýšená exprese MIB-1, nekrózy, vaskulární invaze, infiltrace okrajů, šíření do testikulárního parenchymu, DNA aneuploidie (1, 7–9). DNA aneuploidie je přítomna u všech metastazujících nádorů, avšak pouze u cca 39 % nemetatastazujících forem. Z této skupiny se později může vyvinout maligní varianta nádoru navzdory původním benigním rysům (2, 7).
U zhoubné formy nádoru se metastázy nejčastěji vyskytují v retroperitoneálních lymfatických uzlinách, játrech, plících a kostech (2). Popsány byly i jiné lokalizace metastáz jako prsní žláza, ledvina, nadledvina, mezenterium, kůže, omentum, peritoneum, jejunum, ureter, srdce, pleura a mícha. Padesát procent nádorů je hormonálně aktivních (9). Nejčastěji produkují estrogeny, progesteron, testosteron, zpětnovazebně jsou vyšší hodnoty FSH a LH. U zhruba 15–30 % pacientů se objevuje gynekomastie (1, 4). Gynekomastie často předchází zvětšení šourku. Přibližně 10 % pacientů nemá vyjádřené žádné symptomy, nádory jsou nalezeny náhodně při fyzikálním vyšetření (4). V literatuře TLB je makroskopicky nejčastěji popisován jako nádor žluté barvy a v ojedinělých případech může mít bělavé zabarvení. Shodou náhod naše preparáty měly bělavý charakter zbarvení.
Při sonografickém vyšetření se většinou jeví jako hypoechogenní homogenní ložisko hladké kontury (10).
Při nálezu ložiska ve varleti je nejčastější metodou volby radikální orchiektomie. Orgán šetřící výkon je doporučen u bilaterálního nádoru a nádoru solitárního varlete, pokud masa nádoru nepřesahuje 30 % objemu varlete. U pacientů s gynekomastii nebo hormonální dysbalancí by se mělo pomýšlet na možný stromální nádor, je proto vhodné provést nejdříve biopsii z nádoru a dále postupovat dle výsledku histologie. V případě zjištění benigní varianty nádoru je metodou volby enukleace nádoru se zachováním chirurgické radikality (1, 10). V našem případě u mladšího pacienta byla navržena peroperační biopsie s histologií na zmrzlo, tento postup však pacient neakceptoval. Při zjištění maligního nádoru z Leydigových buněk je doporučována radikální orchiektomie a následně retroperitoneální lymfadenektomie ve snaze oddálení diseminace onemocnění. U pacientů s metastázami je špatná chemo - a radiosenzitivita, doba přežití je krátká (1, 9). Průměrná doba přežití u pacientů s maligní formou TLB je 3 roky po operaci (6, 11). U nádoru bez histologických známek malignity je doporučeno sledování pomocí CT vyšetření břicha, plic, dále měření hladiny testosteronu a estriadolu, nicméně ke každému pacientovi je potřeba přistupovat individuálně (1, 2, 9). Byl publikován případ, kdy elevace estriadolu upozornila na rekurenci nádoru (12). Z literatury jsou známy případy, kdy původně patologem hodnocený nádor jako benigní metastazoval (9). Jasné doporučení frekvence vyšetření chybí. My jsme zvolili půlroční sledovací interval u obou pacientů. Při kontrole provádíme vždy ultrazvukové vyšetření solitárního varlete.
ZÁVĚR
Nádory z Leydigových buněk varlat jsou vcelku raritní diagnózou. U menších nádorů a při podezření na stromální etiologii je možné provést záchovný výkon jen v případě peroperačního nálezu benigní léze, je nutné však pacienta informovat o všech možných rizicích. Pro nevyzpytatelnou biologickou povahu nádoru je potřeba pravidelná a pečlivá dispenzarizace všech pacientů i po radikální orchiektomii a histologicky benigní variantě. Maligní varianta je slabě chemo - i radiosenzitivní, doba přežití je krátká.
Došlo: 26. 9. 2013.
Přijato: 29. 11. 2013.
Střet zájmů: nezávislý článek.
Kontaktní adresa
MUDr. Jakub Szewczyk
Urologické oddělení FN
17. listopadu 1790, 708 52 Ostrava-Poruba
e-mail: kubion@volny.cz
Sources
1. Albers P, Albrecht W, Algaba F, et al. EAU Guidelines on Testicular Cancer, the 2011 update. Eur Urol 2011; 60(2): 304–319.
2. Mati W, Lam G, Dahl C, Thorup Andersen J, Balslev E. Leydig cell tumour – a rare testicular tumour, Int Urol Nephrol 2002; 33 : 103–105.
3. Kawaciuk I. Nádory z Leydigových buněk. Urologie 2009; 147 : 418.
4. Kim I, Young R, Scully R. Leydig cell tumor of the testis, Am J Surg Pathol 1985; 9(3): 177–192.
5. Dvořáček J, Babjuk M. Nádory ze specifického gonadálního mezodermu, Onkourologie. Praha: Galén, Karolinum 2005; 481–482,506–507.
6. Satish R, Rajesh C, Deepak M. Leydig cell tumor: A case report and review of the literature. Tumori 2002; 88 : 75–76.
7. Cheville JC, Sebo TJ, Lager DJ, Bostwick DG, Farrow GM. Leydig Cell Tumor of the Testis, Am J Surg Pathol 1998; 22(11): 1361–1367.
8. Powari M, Kakkar N, Singh SK, Rai RS Jogai S. Malignant Leydig Cell tumour of the Testis. Urol Int 2002; 68 : 63–65.
9. Hyršl I, Abrahámová J, Zuntová A, Kawaciuk I, Dušek P. Nádory varlete z Leydigových a Sertoliho buněk. Ces Urol 2005; 9(3): 16–18.
10. Wegner HEH, Dieckmann KP, Herbst H, Andresen R, Miller K. Leydig cell tumor – comparison of results of radical and testis–sparing surgery in a single center., Urol Int 1997; 59 : 170–173.
11. Papatsoris AG, Triantafyllidis A, Gekas A, Karamouzis MV, Rosenbaum T. Leydig cell tumor of the testis. new cases and review of the current literature. Tumori 2004; 90 : 422–423.
12. Maeda T, Itoh N, Ashi KK, Takahashi A, et al. Elevated serum estradiol suggesting recurrence of Leydig cell tumor nine years after radiál orchiectomy, Int J Urol 2002; 9 : 659–661.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2014 Issue 1-
All articles in this issue
- Amended classification of renal tumours 2013 (International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)
- Benefit of determining [-2]proPSA levels in the differential diagnosis of prostate cancer
- Radical prostatectomy – analysis of 191 cases examined using whole-mount section method
- Monitoring the loss of botulinum toxin during intradetrusor administration – pilot study results
- Benign retroperitoneal schwannoma
- Synchronic triplicity of urological malignancies
- Solitary metastasis of a urothelial carcinoma in the renal parenchyma imitating a primary tumour of the kidney
- Squamous cell carcinoma of the renal pelvis
- Thromboembolism of the renal artery causing renal parenchymal infarction
- Leydig cell tumor
- Leydig cell tumor of the testis
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Leydig cell tumor
- Benign retroperitoneal schwannoma
- Leydig cell tumor of the testis
- Thromboembolism of the renal artery causing renal parenchymal infarction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

