-
Medical journals
- Career
Glukokinázový diabetes u dětí
Authors: Woznicová Kateřina 1; Strnadel Jiří 1; Průhová Štěpánka 2; Pavlíček Jan 1,3; Hladík Michal 1,3
Authors‘ workplace: Klinika dětského lékařství, FN Ostrava 1; Pediatrická klinika 2. LF UK, a FN Motol, Praha 2; Lékařská fakulta, Ostravská univerzita, Ostrava 3
Published in: Čes-slov Pediat 2022; 77 (2): 86-90.
Category: Case Report
Overview
Glukokinázový diabetes je monogenně podmíněná forma diabetu vznikající na podkladě nosičství patogenní varianty v genu GCK, kódujícím enzym glukokinázu. Je to jeden z typů MODY diabetu (maturity onset diabetes of the young), který představuje heterogenní skupinu onemocnění, jehož prevalence činí zhruba 2–3 % ze všech pacientů s diabetem manifestovaným do 30 let věku v evropských zemích. Charakteristický je autosomálně dominantní typ dědičnosti a časný začátek (první záchyt hyperglykemie nejčastěji v období puberty či časné dospělosti). Glukokinázový diabetes představuje 65 % všech pacientů s MODY diabetem v České republice a je nejčastěji diagnostikován u dětí a dospívajících, díky nimž se následně prokáže tato forma diabetu u dalších členů rodiny. Charakteristická je mírná chronická hyperglykemie u jinak asymptomatických jedinců, kterou ve většině případů není potřeba léčit. Kazuistika popisuje náhodné zachycení hyperglykemie u osmileté dívky s malým vzrůstem, kde po sérii vyšetření byla prokázána patogenní varianta v genu pro glukokinázu.
Klíčová slova:
GCK – hyperglykemie – maturity onset diabetes of the young
Úvod
Diabetes MODY (maturity onset diabetes of the young) byl poprvé popsán v roce 1974. V rámci klasifikace diabetu jej řadíme mezi ostatní formy diabetes mellitus (DM) způsobené genetickou změnou, tj. monogenní diabetes.(1) Tvoří zhruba 2–3 % z celkového počtu pacientů s diabetem diagnostikovaným do 30 let věku, často ale bývá nesprávně zařazen jako diabetes 1. nebo 2. typu.(2,3) Podstata onemocnění spočívá v nosičství heterozygotní patogenní varianty v jednom z genů zapojených do vývoje nebo metabolismu β-buněk pankreatu, což má vliv na sekreci inzulinu.(4) Typický je nález diabetu nebo hyperglykemie v časném věku u probanda a současně alespoň u jednoho člena rodiny před 40. rokem života, což odpovídá autosomálně dominantnímu typu dědičnosti.(5) Vzácně se můžeme setkat i s případy bez rodinné anamnézy, kde je patogenní varianta v některém z MODY genů prokázána de novo.(6) Základní rozdíl oproti diabetu 1. typu spočívá v nepřítomnosti autoprotilátek proti ostrůvkovým buňkám pankreatu (např. antiGAD, IAA, ICA, ZnT8). U MODY diabetu nebývá acanthosis nigricans, obezita ani inzulinová rezistence, které se obvykle vyskytují u pacientů s diabetem 2. typu.(7) Stanovení správné diagnózy pomocí molekulárně genetického vyšetření je naprosto zásadní pro výběr vhodné terapie a další prognózu pacienta.(4,8)
Kdy zvažovat u pacienta MODY diabetes:(1)
1. Pozitivní rodinná anamnéza DM (porucha glukózové tolerance, gestační diabetes, mírná hyperglykemie nalačno) a manifestace onemocnění do 40. roku života.
2. Manifestace diabetu (hyperglykemie) bez známek diabetické ketoacidózy.
3. Trvalá stacionární mírná hyperglykemie.
4. Nepřítomnost autoprotilátek proti ostrůvkovým buňkám pankreatu – anti-GAD, IA2, IAA, ICA, ZnT8.
Patofyziologie vzniku MODY diabetu
MODYdiabetes vzniká mutací genů kódujících proteiny, které jsou nezbytné pro správnou funkci β-buněk. Dochází tedy buď k porušení produkce, anebo sekrece inzulinu.(1) Ta je ovlivněna metabolismem a aktuální koncentrací glukózy v krvi. Glukóza vstupuje do β-buněk pankreatu pomocí nízkoafinitního transportéru GLUT2. Pomocí enzymu glukokinázy dochází k fosforylaci glukózy na glukóza-6-fosfát (G6P). Oxidace G6P při glykolýze a následné zpracování v Krebsově cyklu vede k produkci ATP . Zvýšením poměru ATP /ADP se uzavírá ATP -senzitivní draslíkový kanál. Uzavřením draslíkového kanálu dochází ke změně membránového potenciálu a otevření kalciového kanálu a toku vápenatých iontů do nitra β-buňky, čímž je spuštěna exocytóza inzulinu ze sekrečních granul (obr. 1).(9)
Image 1. Základní funkce ?-buňky. Glukóza vstupuje do ?-buňky glukózovým transportérem GLUT2 podle koncentračního gradientu. Metabolismus glukózy v ?-buňce zahajuje enzym glukokináza (GCK), který bývá s mírnou nadsázkou označován jako „senzor“ ?-buňky pro glukózu. Metabolizace glukózy následně probíhá v dalších krocích v mitochondriích a vyústí ve zvýšení poměru ATP : ADP. Tento poměr je klíčovým podnětem pro změnu konformace napěťově řízeného draslíkového kanálu ?-buňky. Ten má dvě složky – vnitřní, zvanou Kir6.2, a regulační, označenou jako SUR1 (sulfonylureový receptor). Snížení prostupnosti draslíkového kanálu depolarizuje buněčnou membránu, což otevře vápníkový kanál a zvýší intracelulární koncentraci kalcia. To je poslední podnět pro exocytózu inzulinu z intracelulárních granul. Volně upraveno dle(10). 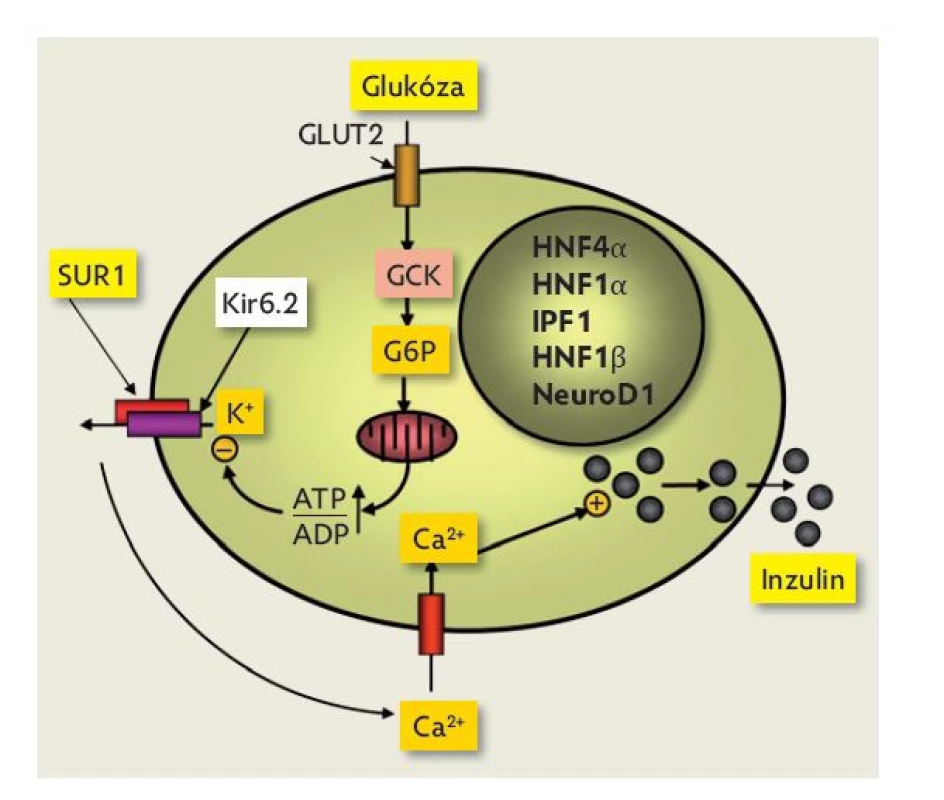
Důležitou úlohu hrají v β-buňce transkripční faktory (hepatocytární nukleární faktor HNF1A, HNF1B, HNF4A a další), které jsou součástí transkripční regulační sítě. Úlohou transkripčních faktorů je kontrola správné funkce β-buněk a také exprese řady genů kódujících proteiny, zapojených do transportu a metabolismu glukózy.(11)
Klinické typy MODY diabetu
Ačkoli bylo doposud identifikováno nejméně 14 genů spojených se vznikem MODY diabetu, pro klinickou praxi má význam jen 4–5 genů. Jednotlivé typy se liší v klinických projevech, patofyziologii vzniku, extrapankreatické manifestaci, riziku komplikací, prognóze a způsobu léčby. I přes zmíněné odlišnosti mají podtypy MODY mnoho společného, proto je můžeme rozdělit na základní 2 skupiny dle genu, který je mutován (tab. 1):(5,12)
Table 1. Přehled častých typů MODY diabetu 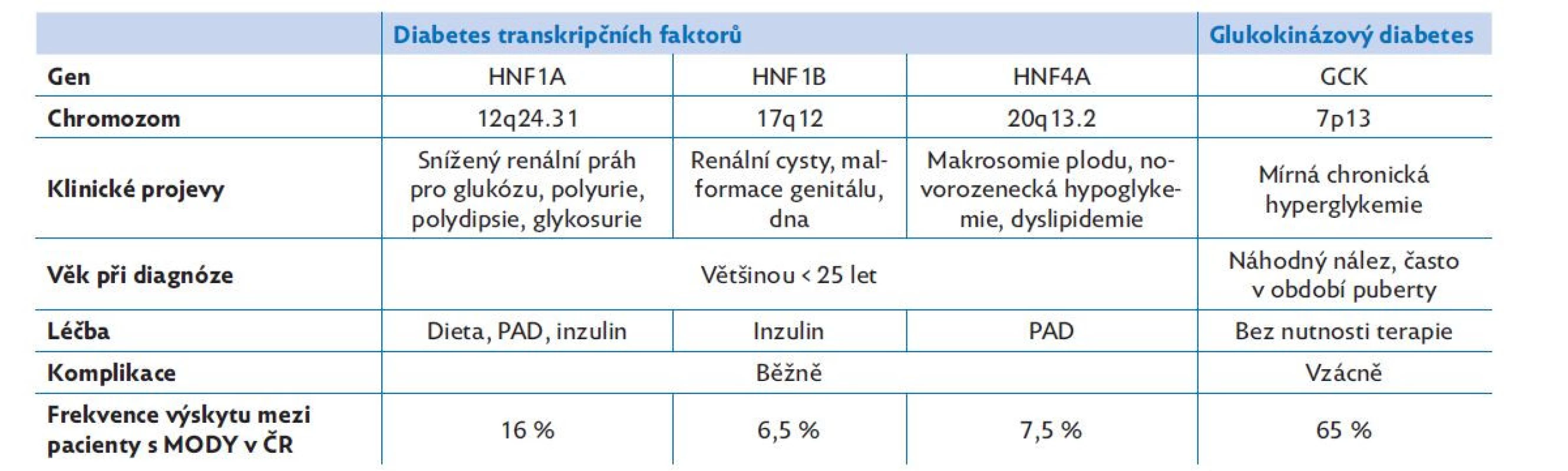
MODY – maturity onset diabetes of the young; PAD – perorální antidiabetika Glukokinázový diabetes (GCK diabetes či MODY 2) představuje nejčastější formu MODY, je způsoben patogenní variantou v genu pro glukokinázu, což vede k mírné chronické hyperglykemii s minimální progresí v průběhu života.(13)
Diabetes transkripčních faktorů je zastoupen zejména HNF1A-MODY a HNF4A-MODY. Transkripční faktory regulují expresi mnoha genů, kromě β-buněk jsou zodpovědné za normální funkci jater, ledvin a exokrinní části pankreatu. V β-buňkách pankreatu pak zejména regulují produkci a sekreci inzulinu a transport a metabolismus glukózy.(11,13)
Glukokinázový diabetes (GCK-MODY neboli MODY 2)
Glukokinázový diabetes je nejčastější formou MODY diabetu u dětí.(14,15) V České republice tvoří 65 % z celkového počtu pacientů s MODY diabetem. U dětí a adolescentů představuje přes 50 % případů náhodně zachycené hyperglykemie.(16) Příčinou vzniku je heterozygotní nosičství patogenní varianty v genu pro glukokinázu, kódujícím enzym, který katalyzuje fosforylaci glukózy na glukóza-6-fosfát a bývá označován jako „glukózový senzor“ β-buňky pankreatu.( 17,18) Důsledkem mutace je snížená citlivost β-buněk na hyperglykemii a sekrece inzulinu je zahájena až při vyšší hladině glykemie než obvykle.(19,20) Dědičnost tohoto diabetu je autosomálně dominantní. Závažnější formou je homozygotní nosičství patogenní varianty, která způsobí vznik novorozeneckého diabetu s celoživotní nutností terapie inzulinem.( 21)
Klinický obraz
Pacienti s výše popsaným genetickým defektem mají trvale zvýšenou glykemii od narození s minimální progresí v průběhu života. Hodnota glykemie nalačno bývá v rozmezí 5,5–9 mmol/l. Většina pacientů je zcela asymptomatická a hyperglykemie je zjištěna náhodně při rutinním vyšetření z jiné indikace.(5) Komplikace ve smyslu mikrovaskulárních a makrovaskulárních změn jsou vzácné.(22,23)
Kdy zvažovat glukokinázový diabetes:(1)
1. Glykemie nalačno v rozmezí 5,5–8 mmol/l.
2. Mírný vzestup glykemie při oGTT (orální glukózový toleranční test) mezi 0. a 120. minutou (většinou o méně než 3 mmol/l).
3. Glykovaný hemoglobin HbA1c nad horní hranicí normy (až do 56 mmol/mol).
4. Pozitivní rodinná anamnéza hyperglykemie.
5. Absence autoprotilátek anti-GAD, IAA, IA2, případně ZnT8.
Diagnostika a léčba
V případě, že pacient splňuje výše uvedená kritéria, je doporučeno molekulárně genetické vyšetření vzorku DNA k průkazu monogenního diabetu. U dětí s geneticky potvrzenou diagnózou je vhodná dispenzarizace diabetologem s pravidelnými kontrolami 1x ročně. Farmakoterapie není při nekomplikovaném průběhu GCK-MODY indikována. Dieta nemá zásadní vliv na ovlivnění glykemie.(24) Doporučuje se zdravý životní styl, zejména prevence obezity.(25) Jiná je situace v těhotenství, kdy terapie inzulinem může být potřebná k ochraně plodu, který MODY nezdědil. V případě, že matka má GCK-MODY, ale plod variantu v genu pro glukokinázu nenese, bude plod reagovat na dlouhodobé vystavení hyperglykemii zvýšenou sekrecí inzulinu, což povede k nadměrnému růstu a následné makrosomii. Naopak, pokud plod nese stejnou variantu, je před vznikem makrosomie ochráněn.(26) Zda bude matka s GCK-MODY léčena inzulinem, rozhoduje zejména velikost plodu při pravidelných ultrazvukových kontrolách.(1)
Genetika
Molekulárně genetické vyšetření potvrzující klinické podezření na MODY diabetes se v České republice provádí např. v Laboratoři molekulární genetiky Pediatrické kliniky 2. lékařské fakulty Univerzity Karlovy (www.Lmg.cz). Vyšetření se provádí buď cíleně pomocí PCR a Sangerova sekvenování konkrétní varianty vyskytující se například v rodině, nebo pomocí sekvenování nové generace pomocí panelu genů pro monogenní diabetes. Potenciálně patogenní varianty se vždy potvrzují Sangerovým sekvenováním a klasifikují podle aktuálně platné klasifikace nalezených variant (ACMG – American College of Medical Genetics and Genomics z roku 2015).(27) V českém národním registru osob s monogenním diabetem je k 31. 8. 2020 vedeno 1501 rodin s klinickým podezřením nebo již prokázaným monogenním diabetem. Dosud bylo geneticky diagnostikováno v České republice 638 rodin s MODY diabetem. GCK-MODY představuje 65 %, HNF1A-MODY 16 %, HNF4A-MODY 7,5 % a HNF1B-MODY 6,5 % potvrzených případů. Velmi vzácně se vyskytují i patogenní varianty v jiných genech pro monogenní diabetes. V rámci srovnání s ostatními typy diabetu představuje monogenní diabetes 2–3 % dětí s diabetem (např. v registru ČENDA – Českém národním registru dětí s diabetem je to přesně 2,9 %)(28) a kolem 2 % dospělých osob s diabetem do 30 let věku. Glukokinázový diabetes patří jednoznačně mezi nejčastěji zachycené typy MODY. V některých oblastech České republiky je záchyt MODY diabetu poměrně vysoký a některé varianty se vyskytují endemicky a jejich původ byl prokázán mnoho set generací zpět.(29,30)
Kazuistika
V ordinaci dětského endokrinologa byla vyšetřena osmiletá dívka, která byla odeslaná praktickou lékařkou pro malý vzrůst. V osmi letech měřila 113 cm (-3,2 SDS). V rodině se vyskytuje menší vzrůst u rodičů i prarodičů. Matka je sledována pro diabetes 2. typu na dietě, v posledních 6 letech byla léčena metforminem. Na základě provedených vyšetření dívky (hormonální profil, stanovení kostního věku, karyotypu, vyšetření SHOX genu) a vzhledem k výšce rodičů byl stav zhodnocen jako familiární malý vzrůst. Náhodným nálezem byla hodnota glykemie nalačno 6,7 mmol/l. Opakovaný odběr potvrdil zvýšenou glykemii nalačno i zvýšenou hladinu glykovaného hemoglobinu HbA1c 47 mmol/mol. Při oGTT došlo pouze k mírnému vzestupu glykemie mezi 0. a 120. minutou (o 2,5 mmol/l). Negativní byly specifické autoprotilátky proti ostrůvkovým buňkám pankreatu (anti-GAD, IAA, ICA, IA2). Pro přetrvávající zvýšené hodnoty glykemie nalačno, kolísající hodnoty glykovaného hemoglobinu a pozitivní rodinnou anamnézu diabetu byl v diferenciální diagnostice zvažován glukokinázový diabetes. Pomocí molekulárně genetického vyšetření byla prokázaná heterozygotní patogenní varianta p.Gly318Arg v genu pro glukokinázu. Tato varianta (dříve označována jako mutace) je kauzální pro glukokinázový diabetes. V dalším průběhu bylo doplněno genetické vyšetření u matky, které prokázalo stejný typ patogenní varianty. Matka byla do stanovení diagnózy léčena perorálními antidiabetiky, která byla následně vysazena beze změny laboratorních hodnot kompenzace diabetu. Dívka je trvale sledována, kontroly jsou indikovány 1x ročně. Při kontrolách hodnoty glykemie nepřevyšují 8 mmol/l, hodnoty glykovaného hemoglobinu kolísají v rozmezí 42–47 mmol/mol. U dívky nebyla zahájena medikamentózní terapie, doporučena byla pouze režimová opatření, zejména prevence obezity.
Závěr
Glukokinázový diabetes je nejčastější formou MODY diabetu u dětí. Onemocnění je charakteristické mírnou hyperglykemií. Při došetření hraje důležitou roli hladina glykovaného hemoglobinu, orálně glukózový toleranční test a nepřítomnost autoprotilátek proti ostrůvkovým buňkám pankreatu. Diferenciálně diagnosticky je vždy nutno vyloučit diabetes 1. typu. Konečnou diagnózu glukokinázového diabetu potvrdí až molekulárně genetické vyšetření. Prognóza je dobrá, pacienti jsou dlouhodobě bez komplikací a většinou postačuje konzervativní sledování bez terapie. Genetické vyšetření je v České republice podpořeno grantem Ministerstva zdravotnictví ČR AZV NV18-01-00078.
Korespondenční adresa:
MUDr. Kateřina Woznicová
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
Sources
1. Lebl J, Al Taji E, Koloušková S, et al. Dětská endokrinologie a diabetologie. Praha: Galén 2016 : 372–382.
2. Cammidge PJ. Diabetes Mellitus and Heredity. BMJ 1928; 2 : 738-41.
3. Tattersall RB. Mild familial diabetes of the young: a clinical history. Diabet Med 1998; 15 : 1–4.
4. Fajans SS, Bell GI. MODY : history, genetics, pathophysiology, and clinical decision making. Diabetes Care 2011; 34(8): 1878–84.
5. Hattersley, AT . Maturity-onset diabetes of the young: clinical heterogenity explained by genetic heterogenity. Diabet Med 1998; 15 : 15–24.
6. Stanik J, Dusatkova P, Cinek O, et al. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia 2014; 57(3): 480–4.
7. Ellard S, Bellanné-Chantelot C, Hattersley AT . Best practice guidelines fot the molecular genetic diagnosis of maturity-onset diabetes of the young, Diabetologia 2008; 51 : 546–553.
8. Shepherd M. Our evolving understanding of monogenetic diabetes: possibilities of improving glycaemic control following transfer from insulin to sulphonylureas. Prim Care Diabetes 2008; 2(2): 87–90.
9. Heuvel-Borsboom H, de Valk HW, Losekoot M, et al. Maturity onset diabetes of the young: Seek and you will find. Neth J Med 2016; 70(5): 193–200.
10. Fajans SS, Bell Gl, Polonsky KS. Molecular mechanisms and clinical pathophysiology of maturity-onset diabetes of the young. N Engl J Med 2001; 345(13): 971–980.
11. Sanyoura M, Phillipson LH, Naylor R. Monogenetic diabetes in children and adolescents: Recognition and treatment options. Current Diabetes Rep 2018; 18(8): 1–13.
12. Urakami T. Maturity-onset diabetes of the young (MODY ): current perspectives on diagnosis and treatment. Diabetes, metabolic syndrome and obesity: targets and therapy 2019; 12 : 1047–1056.
13. Průhová Š, Lebl J. Kapitola z knihy: Trendy soudobé diabetologie. Svazek 11. Praha: Galén 2007.
14. Průhová Š, Dušatková P, Šumník Z, et al. Glucokinase diabetes in 103 families from a country-based study in the Czech Republic: geographically restricted distribution of two prevalent GCK mutations. Pediatr Diabetes 2010; 11 : 529–35.
15. Průhová Š, Ek J, Lebl J, et al. Genetic epidemiology of MODY in the Czech republic: new mutations in the MODY genes HNF-4A, GCK and HNF-1A. Diabetologia 2003; 46 : 291–295.
16. Feigerlová E, Průhová Š, Dittertová L, et al. Aetiological heterogeneity of asymptomatic hyperglycaemia in children and adolescents. Eur J Pediatr 2006; 165 : 446–452.
17. Matschinski FM, Glaser B, Magnuson MA. Pancreatic β-cellglcokinase: closingthe gap between theoretical concepts and experimental realities. Diabetes 1998; 47 : 307–315.
18. Nolan CJ, Prentki M. The islet β-cell: fuel responsive and vulnerable. Trends Endocrinol Metab 2008; 19 : 285–291.
19. Velho G, Froguel P, Clement K, et al. Primary pancreatic β-cell secretory defect caused by mutation in glucokinase gene in kindreds of maturity onset diabetes of the young. Lancet 1992; 340 : 444–448.
20. Byrne MM, Sturis J, Fajans SS, et al. Altered insulin secretory responses to glucose in subjects with a mutation in the MODY 1 geneon chromosome 20. Diabetes 1995; 44 : 699 – 704.
21. Gloyn AL. Glucokinase (GCK)mutation in hyper - and hypoglycaemia: maturity-onset diabetes og the young, permanent neonatal diabetes, and hyperinsulinemia in infancy. Human Mutat 2003; 22 : 353–362.
22. Steele AM, Shields BM, Wensley KJ, et al. Prevalence of vascular complications among patients with glucokinase mutations and prolonged, mild hyperglycaemia. JAMA 2014; 311(3): 279–86.
23. Velho G, Blanché H, Vaxillaire M, et al. Identification od 14 new glucokinase mutations and description og the clinical profile of 42 MODY -2 families, Diabetologia 1997; 40(2): 217–24.
24. Hattersley AT . Molecular genetics goes to the diabetes clinic. Clin Med 2005; 5(5): 476–81.
25. Hattersley AT , Bruining J, Shield J, at al. ISPAD Clinical Practice Consensus Guidelines 2006-2007. The diagnosis and management of monogenetic diabetes in children. Pediat Diab 2006; 7 : 352–360.
26. Velho G, Hattersley AT , Froguel P. Maternal diabetes alters birth weight in glucokinase-deficient (MODY 2) kindreds but has no influence on adult weight, height, insulin secretion or insulin sensitivity. Diabetologia 2000; 43 : 1060–1063.
27. Richards S, Aziz N, Bale S, et al. Committee ALQA. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015; 17(5): 405–424.
28. Šumník Z, Venháčová J, Škvor J, et al.; ČENDA Project Group. Five years of improving diabetes control in Czech children after the establishment of the population-based childhood diabetes register ČENDA. Pediatr Diabetes 2020; 21(1): 77–87.
29. Dusatkova P, Pruhova S, Borowiec M, et al. Ancestral mutations may cause a significant proportion of GCK-MODY . Pediatr Diabetes 2012; 13(6): 489–98.
30. Pruhova S, Dusatkova P, Sumnik Z, et al. Glucokinase diabetes in 103 families from a country-based study in the Czech Republic: geographically restricted distribution of two prevalent GCK mutations. Pediatr Diabetes 2010; 11(8): 529–35.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 2-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Válka na Ukrajině očima kyjevské lékařky
- Editorial
- 100 let inzulinu: Příběh Elisabeth Hughesové a jednoho zázraku v medicíně
- Kompenzace diabetu 1. typu u českých dětí se dlouhodobě zlepšuje: data z národního registru ČENDA (2013–2020)
- Postiniciálna remisia u detí s diabetes mellitus 1. typu
- Technologická revoluce v léčbě diabetu 1. typu
- Glukokinázový diabetes u dětí
- Oxygenoterapie u akutních stavů v praxi
- Resuscitace novorozence, kardiopulmonální resuscitace dětí
- Pandemie covidu-19 v pediatrické populaci Ústeckého kraje
- Osobní zprávy
- Historický rozhovor s legendou: doc. MUDr. Alois Kopecký, CSc. (1920–2013)
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Resuscitace novorozence, kardiopulmonální resuscitace dětí
- Oxygenoterapie u akutních stavů v praxi
- Technologická revoluce v léčbě diabetu 1. typu
- Kompenzace diabetu 1. typu u českých dětí se dlouhodobě zlepšuje: data z národního registru ČENDA (2013–2020)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

