-
Medical journals
- Career
Hereditárny angioedém u detí: čo potrebuje vedieť pediater
Authors: Hulínková Ivana; Čižnár Peter
Authors‘ workplace: Detská klinika Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb v Bratislave
Published in: Čes-slov Pediat 2022; 77 (1): 19-26.
Category: Original Papers
Overview
Hereditárny angioedém (HAE) je zriedkavé geneticky podmienené ochorenie charakterizované rekurentnými epizódami lokalizovaného, bradykinínom sprostredkovaného opuchu hlbokých tkanív kože, dýchacieho a gastrointestinálneho traktu, ktorý môže ohroziť pacientov život. Vo väčšine prípadov je HAE spôsobený nedostatkom inhibítora C1-esterázy (C1-inhibítora), najčastejšie vplyvom mutácie v géne SERPING1. Symptómy sa obvykle začínajú v detstve alebo adolescencii a smerom k dospelosti sa zhoršujú. Diagnostiku komplikuje značná variabilita klinických príznakov a/alebo prítomnosť sprievodných najmä alergických ochorení. V článku uvádzame súbor 6 pacientov z 3 rodín s geneticky potvrdeným HAE a ich klinický fenotyp.
Klíčová slova:
diagnostika – bradykinin – hereditárny angioedém – C1- inhibítor – Kazuistiky
ÚVOD
Opakujúce sa opuchy kože a slizníc, viditeľné na tvári a končatinách alebo skryté v intestinálnom trakte, prejavujúce sa brušnými kolikami, prípadne spojené s obštrukciou horných dýchacích ciest sa obvykle pripisujú alergii. Zriedkavé hereditárne príčiny zvyknú dlho unikať pozornosti napriek tomu, že významne znižujú kvalitu života pacienta a sú príčinou opakovaných návštev lekára. Hereditárny angioedém (HAE) je zriedkavou príčinou angioedémov (obr. 1). Prevalencia HAE sa odhaduje 1 prípad na 50000 ľudí.(1) Výskyt prvých symptómov je veľmi individuálny. U troch štvrtín pacientov sa prejaví do nástupu puberty.(2) Rodinný výskyt s autozómovo dominantným typom dedičnosti má 80 % pacientov, v ostatných prípadoch ide o de novo mutáciu. Príčinou HAE sú mutácie v géne pre proteín inhibujúci serínové proteázy SERPING1, tiež označovaný ako C1-inhibítor, zriedkavo ide o mutácie v iných génoch.(3,4) Defekt v tvorbe enzýmu (HAE-1), resp. defekt jeho funkcie (HAE-2) vedie k dysregulácii kinín-kallikreínového systému. Konečným dôsledkom je zvýšené uvoľňovanie bradykinínu, ktorý má prozápalový a silný vazodilatačný účinok (obr. 2). V súčasnosti sú dostupné viaceré efektívne lieky, ktoré dokážu účinne tlmiť tento patologický proces.
Image 1. Rozdelenie angioedémov podľa etiológie 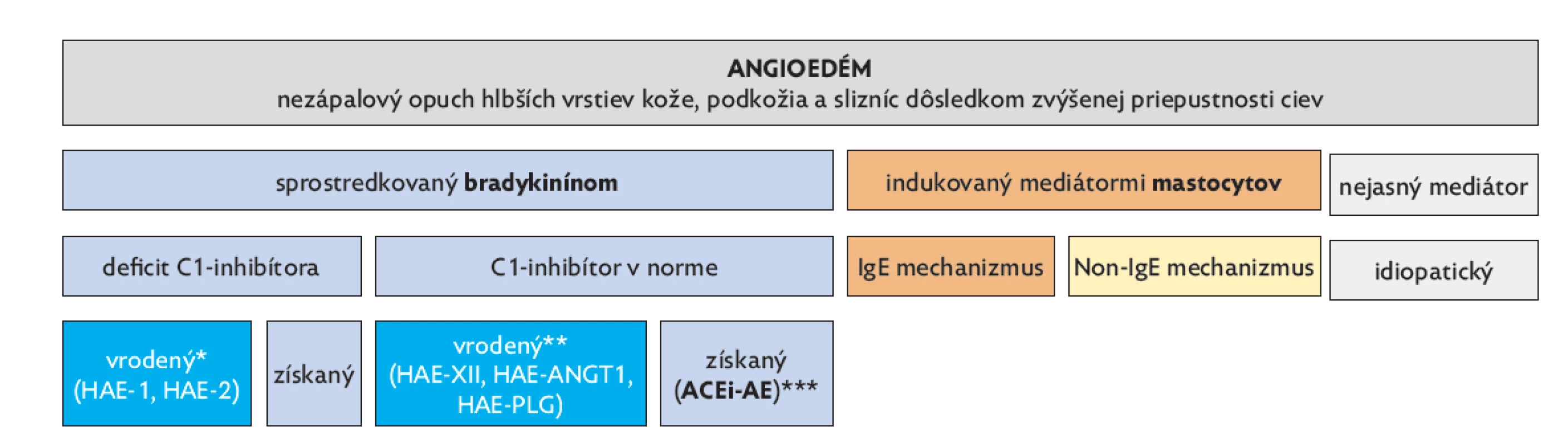
*HAE-1 – deficit C1-inhibítora HAE-2 – porucha funkcie C1-inhibítora.
**HAE s normálnym C1-inhibítorom, spôsobený mutáciami génu pre faktor XII (HAE-XII), génu pre angiopoetin-1 (HAE-ANGT1), génu pre plazminogén (HAE-PLG), génu pre kininogén a ďalších génov.
***ACEi-AE – angioedém indukovaný inhibítormi angiotenzín konvertujúceho enzýmu.Image 2. Kinín-kallikreínový systém a jeho inhibícia 
Vysvetlivky:
Liečba u detí: A. C1-INH (získaný z plazmy alebo rekombinantný), B. selektívny antagonista bradykinínového receptora (ikatibant), C. inhibítor kallikreínu (lanadelumab)
C1-INH – C1-inhibítor, FXII – zrážací faktor XII, HMW-kininogén – kininogén s vysokou molekulovou hmotnosťou.Na Detskej klinike LFUK a NÚDCH sme v ostatných 5 rokoch diagnostikovali 6 pacientov z 3 rodín, ktorí názorne charakterizujú úskalia diagnostického procesu.
RODINA 1
Probandkou (P1) bolo 16-ročné dievča, ktoré odoslal lekár oddelenia urgentného príjmu pre opuch tváre a sťažené prehĺtanie. V čase prijatia užila 6. dávku penicilínu, ktorú ordinoval pediater pre akútnu tonzilitídu. Podľa osobnej anamnézy bola už hospitalizovaná pre alergickú reakciu po ibuprofene, ktorú sprevádzal opuch tváre. Pre symptómy astmy a polinózy bola v sledovaní alergológa. Užívala inhalačné bronchodilatanciá a antihistaminiká podľa potreby, resp. pravidelne sezónne. V čase prijatia na Detskú kliniku LFUK a NÚDCH mala opuchnuté viečka a hornú peru (obr. 3). Iniciálne podané kortikoidy a antihistaminiká pre predpokladanú alergickú reakciu viedli len k čiastočnej regresii opuchu. Následná cielená anamnéza ukázala, že pacientka máva opakované, nesvrbivé opuchy s krátkym trvaním každý mesiac, počas celého posledného roku. Matka pacientky exitovala vo veku 42 rokov na opuchovú reakciu s edémom pľúc. Na podobné stavy trpel aj už nežijúci starý otec z matkinej strany.
Image 3. Pacientka 1, edém hornej pery a periorbitálne 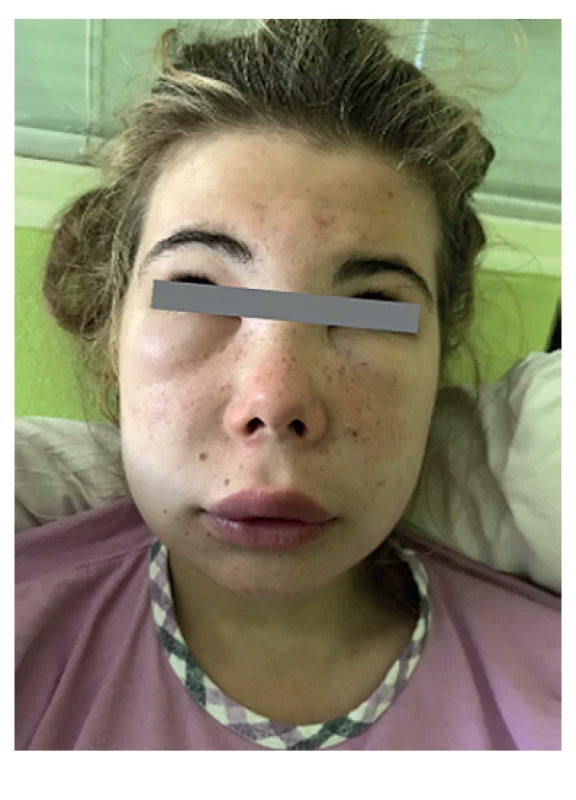
Výsledky laboratórneho vyšetrenia u pacientky potvrdili prítomnosť atopickej multisenzibilizácie s vysokou koncentráciou IgE protilátok proti peľovým alergénom tráv, brezovitých stromov a burín (> 100 kU/ml). Stredne vysoké boli koncentrácie IgE protilátok proti alergénom zvierat a vzdušných plesní. Identifikovala sa významná senzibilizácia na primárne a skrížene reagujúce alergény potravín zo skupiny PR-10 (jablko, broskyňa, sója) a zásobných proteínov orechov (Jug r2). Tento typ alergie s istotou vyvolával respiračné príznaky, ale len s veľmi malou pravdepodobnosťou spôsoboval opakované systémové reakcie. Analýza komplementu opakovane potvrdila nízke koncentrácie zložky C4 a C1-inhibítora, čo je kľúčové diagnostické kritérium HAE 1. typu (tab. 1 a 2). Molekulárno-genetické vyšetrenie identifikovalo patogénnu mutáciu v géne SERPING1. U pacientky sa tak potvrdili dve nezávislé klinické jednotky, z ktorých HAE bol z hľadiska prognózy významne rizikovejší. Atopickú formu alergie môžeme v tomto prípade považovať za rizikový faktor, ktorý pôsobí ako jeden z mnohých spúšťačov a faktorov zosilňujúcich potenciálne riziko fatálnej komplikácie, tak ako sa to s vysokou pravdepodobnosťou stalo u pacientkinej matky.
Table 1. Diagnostické kritériá pre hereditárny angioedém 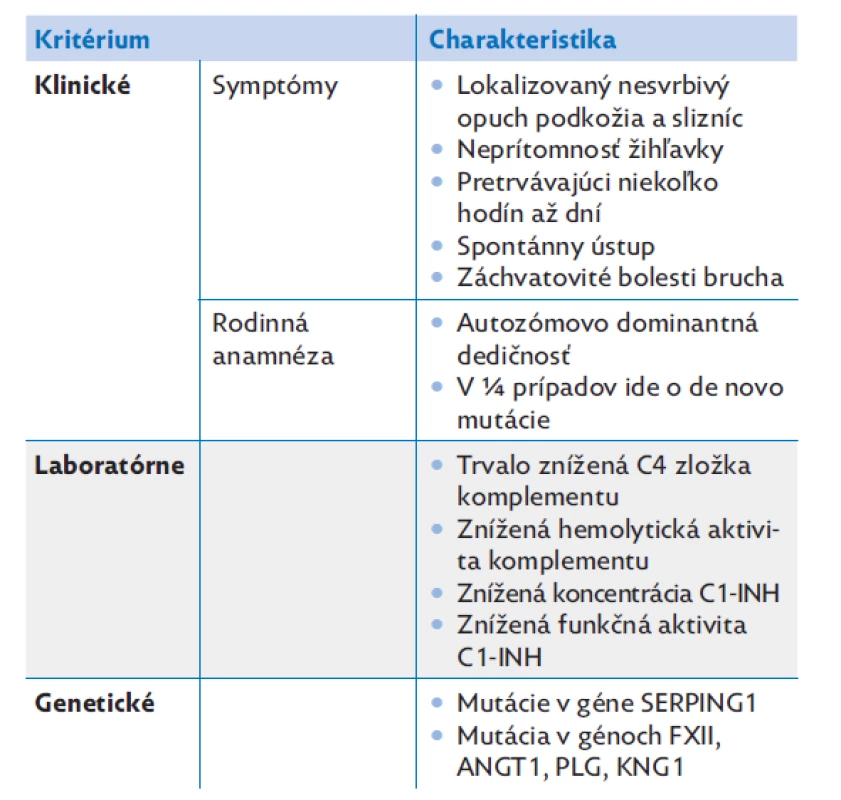
C1-INH – C1-inhibítor, FXII – zrážací faktor XII, ANGT1 – angiopoetin-1, PLG – plazminogén, KNG – kininogén 1. Table 2. Klinické a laboratórne parametre u pacientov P1–P6 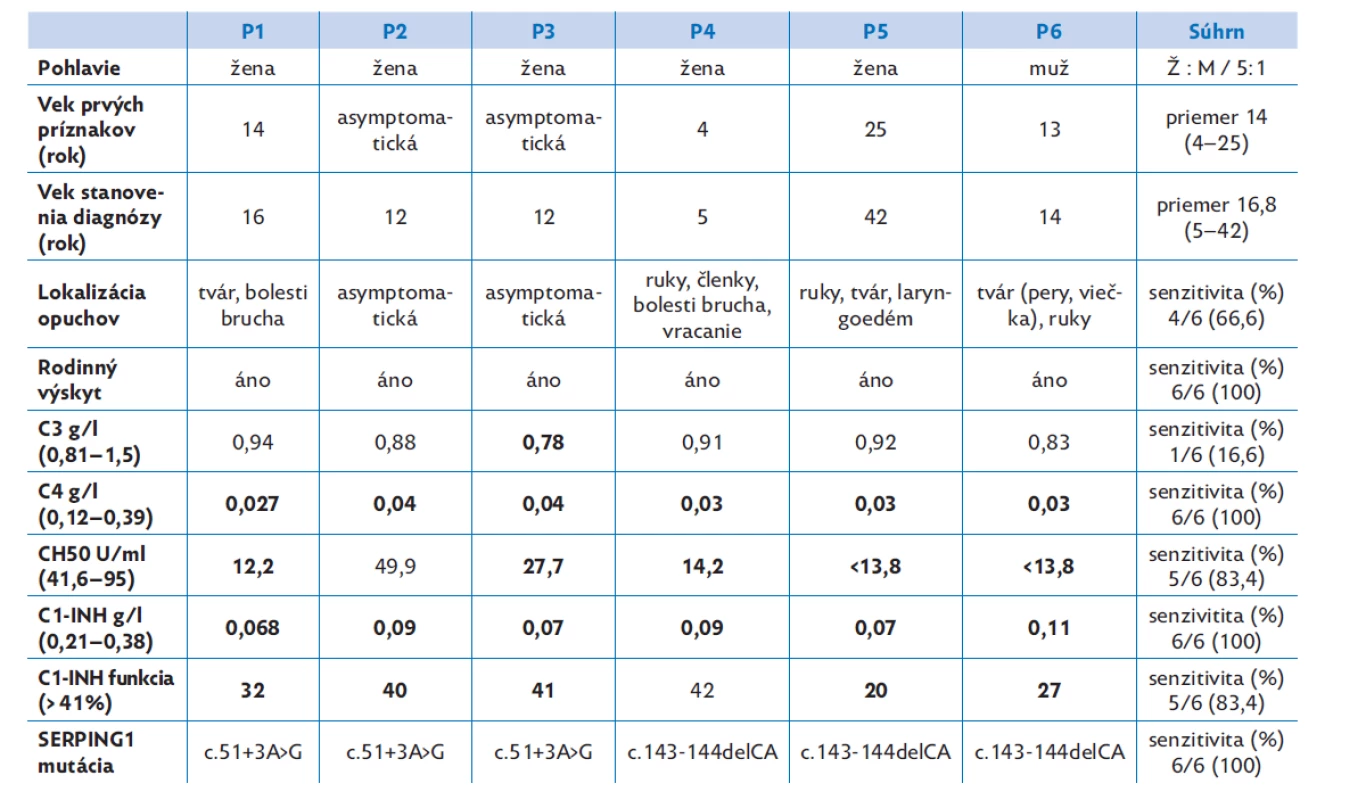
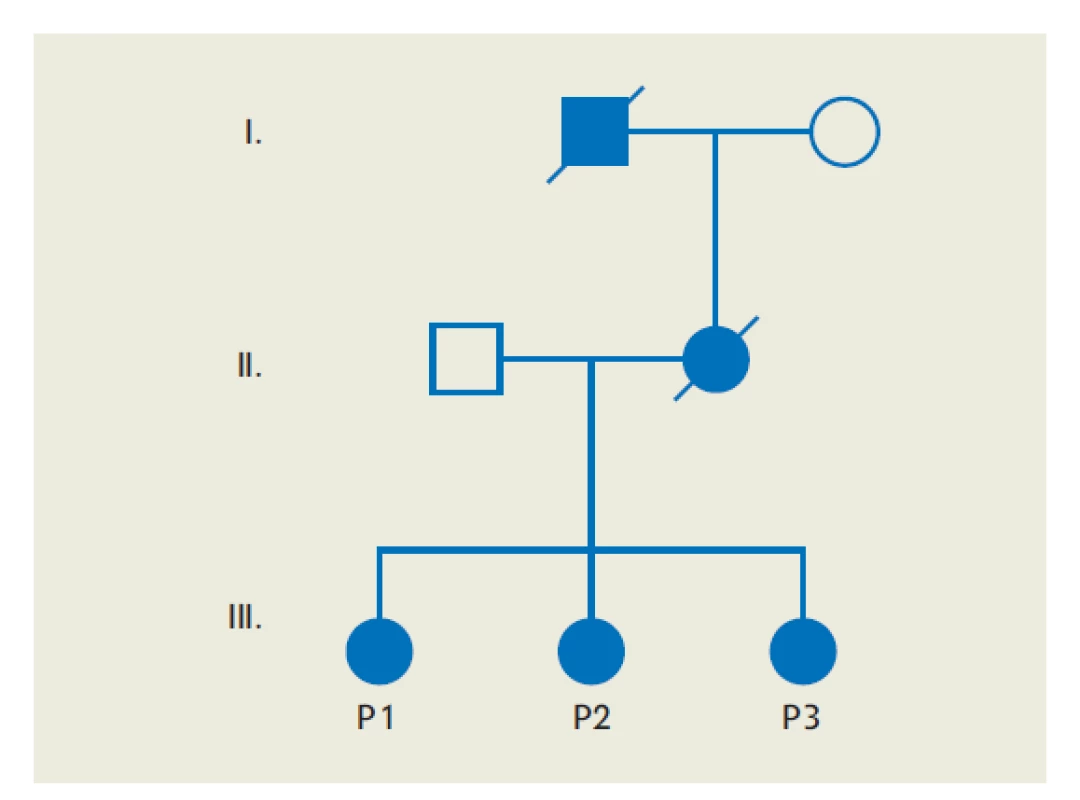
Za klinicky významný výsledok považujeme znížené koncentrácie C1-inhibítora a identickú mutáciu v géne SERPING1 u obidvoch mladších sestier probandky (P2, P3). Ich aktuálny asymptomatický priebeh podmieňuje nižší vek a čiastočne zachovaná funkcia C1-inhibítora (obr. 4).
RODINA 2
5,5-ročné dosiaľ zdravé dievča (P4) bolo odoslané na vyšetrenie pediatrom pre pretrvávajúci opuch pravého chodidla nejasnej príčiny. Podľa osobnej anamnézy bola sledovaná alergológom pre selektívny deficit IgA a zvýšené plazmatické koncentrácie celkového IgE (2100 IU/ml), bez dôkazu špecifickej alergickej senzibilizácie. Bolestivé opuchy rúk (lakťových kĺbov, dlaní a zápästia) (obr. 5) a nôh (členkov) v trvaní 1-2 dni sa objavovali v nepravidelných intervaloch od 4. roku života. V ostatnom roku mávala bolesti brucha spojené s vracaním, takmer v mesačných intervaloch. Bolesť ustupovala spontánne, obvykle do nasledujúceho dňa. Nemala ordinovanú žiadnu pravidelnú farmakoterapiu. Príležitostne užívala ibuprofen v sirupe. Dodržiavala diétu s vylúčením „dráždivých“ jedál. Matka (P5) bola sledovaná pre polyvalentnú liekovú a potravinovú alergiu. Niekoľkokrát mesačne udávala opuchy pravého predlaktia, ktoré sa pripisovali neurologickým ťažkostiam bez ďalšieho vyšetrovania. Podobné ťažkosti mával matkin otec. Bratranec z matkinej strany exitoval vo veku 40 rokov z neznámych príčin.
Image 5. Pacientka 4, edém dlane a dorzálnej časti pravej ruky 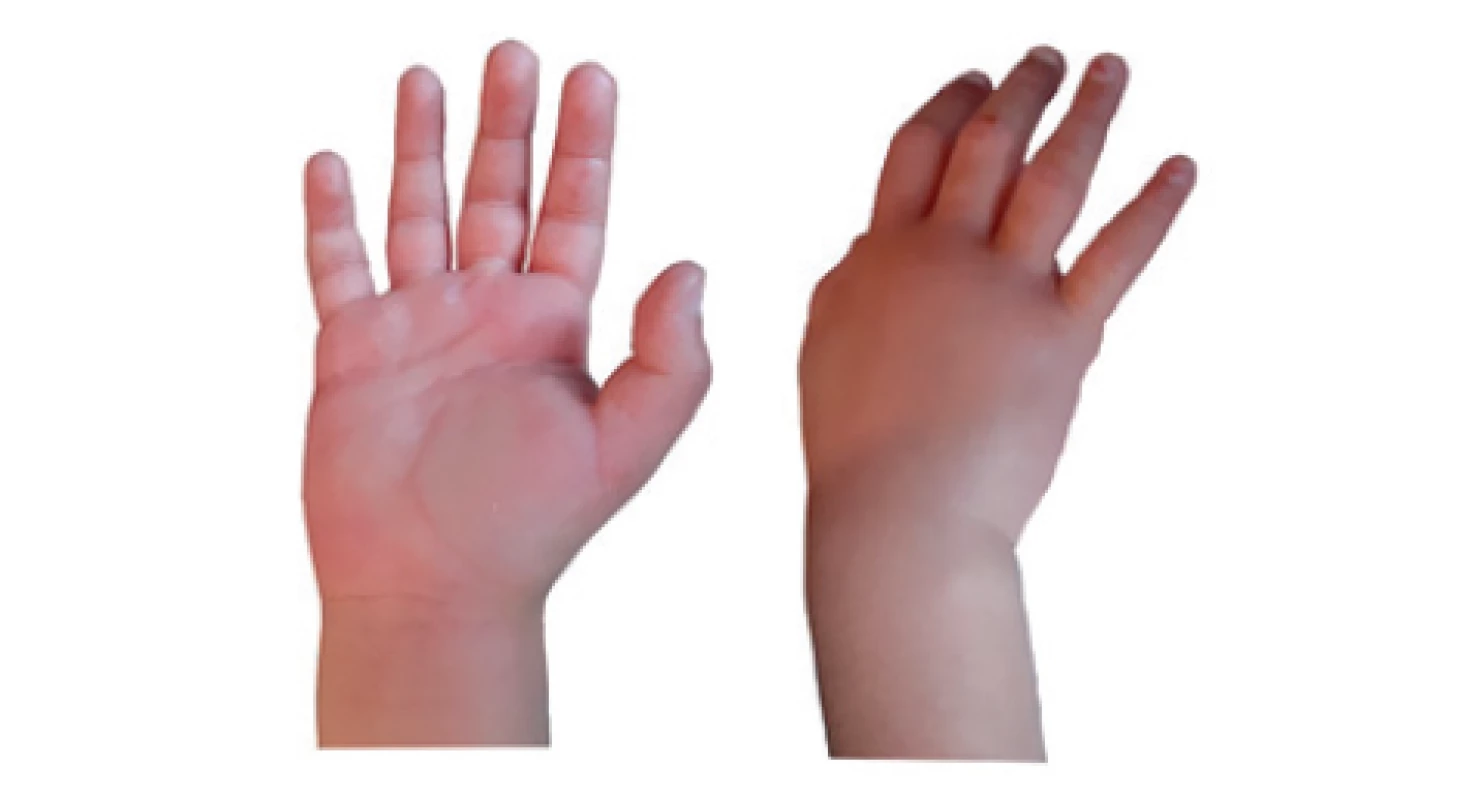
Vyšetrenie komplementu potvrdilo nízke koncentrácie C4 zložky a C1-inhibítora u dieťaťa aj jeho matky (tab. 2). Funkčná aktivita u dieťaťa sa pri iniciálnom vyšetrení pohybovala na dolnej hranici pásma pre možnú poruchu. U matky bola v pásme závažnej poruchy. U obidvoch pacientiek sme potvrdili patogénnu mutáciu v géne SERPING1. Vyšetrenie matkinho otca potvrdilo HAE-1.
RODINA 3
14-ročný chlapec (P6) s geneticky potvrdeným Di - George syndrómom (del22q11.2) bol odporučený na vyšetrenie pre nesvrbivý opuch tváre, očí, pier a rúk po nezávažnom úraze – páde z kolobežky. V priebehu 2 dní opuchy spontánne ustúpili. Pacientov otec exitoval na anafylaxiu po úraze tváre. Mával opakované opuchy, pre ktoré však nebol nikdy vyšetrovaný. Laboratórne vyšetrenia komplementu u dieťaťa potvrdili nízku koncentráciu C4 zložky a nízku celkovú hemolytickú aktivitu komplementu (tab. 2). Koncentrácia aj funkčná aktivita C1-inhibítora boli patologicky znížené.
Molekulárno-genetická analýza identifikovala patologickú mutáciu v géne SERPING1. Vyšetrenie u staršej sestry HAE nepotvrdilo. Typ mutácie a lokalita bydliska však naznačili možný príbuzenský vzťah s rodinou 2, ktorý nebol dovtedy známy. Familiárny vzťah potvrdilo genealogické vyšetrenie (obr. 6).
Image 6. Rodokmeň rodiny 2 a 3 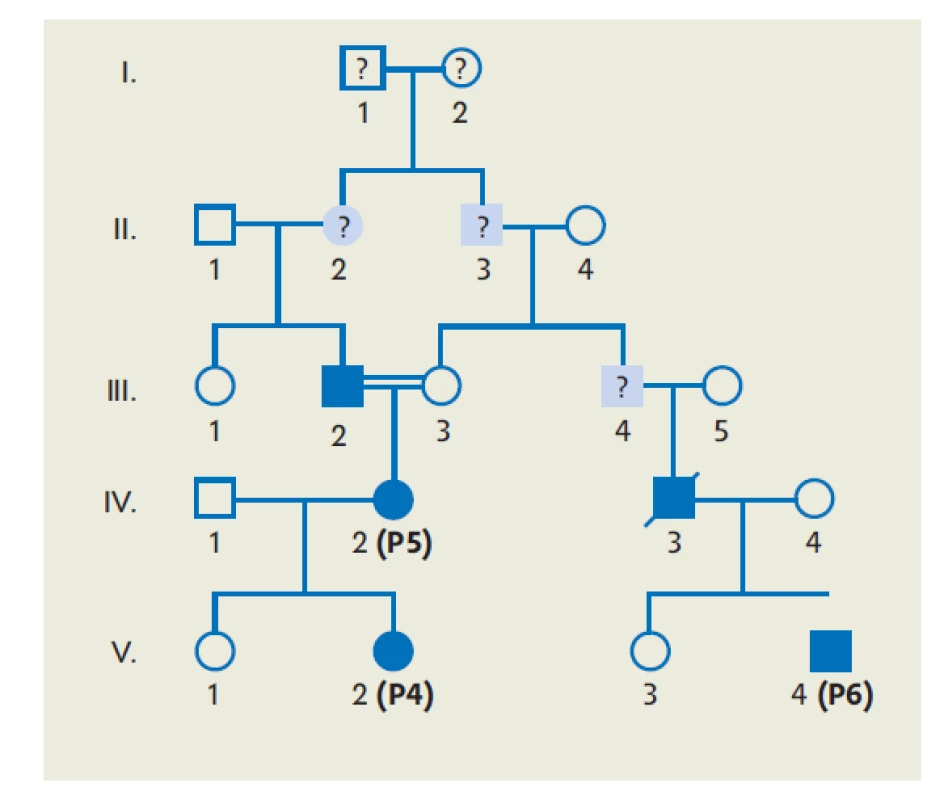
(P4–P6 – pacient 4 až pacient 6; I/1, I/2, II/2, II/3, III/4 – pacienti s nejasnou anamnézou postihnutia) DISKUSIA
Nástup symptómov HAE býva veľmi variabilný. Ochorenie sa u väčšiny pacientov manifestuje v priebehu puberty alebo krátko po nej. U našich chorých sa prvé klinické symptómy HAE prejavili v časovom období medzi 4. rokom života a dospelosťou. Je zaujímavé, že dvaja 12 - roční súrodenci nemali žiadne príznaky v čase vyšetrenia napriek patologickým laboratórnym nálezom. V štúdii Donaldsona a spol. mala takmer polovica pacientov prvé symptómy priemerne vo veku 6 rokov, hoci boli menej závažné.( 5) Farkas a spol. zaznamenali prvé ataky edémov v mediáne 6,6 roka s rozsahom od 4 do 11 rokov.(6) Nemecký súbor mal medián prvého záchvatu vo veku 11 rokov. U takmer 90 % pacientov sa symptómy prejavili pred 20. rokom života.(7) Rozdielne mediány prvých symptómov uvádzajú aj práce z Dánska – 9,5 roka(8) a zo Španielska – 12,5 roka.(9) V našom súbore bol medián výskytu prvého záchvatu 13,5 roka. Tieto údaje potvrdzujú skutočnosť, že hoci väčšina pacientov máva prvé symptómy v detstve a puberte, časť pacientov ostáva asymptomatická resp. nediagnostikovaná až do dospelého veku, ako v prípade náhleho úmrtia rodičov detí v rodine 1 a 3 na „anafylaktickú reakciu“. Identifikovanie nositeľov patologickej mutácie v rodinách spolu s genetickou konzultáciou je významným nástrojom v prevencii akútnych fatálnych komplikácií.(7,10)
Včasnejší nástup symptómov a časté ataky v detskom veku predpovedajú vážny priebeh ochorenia v dospelosti.(7,11) Zvyšujúca sa početnosť a závažnosť atakov v období puberty naznačuje úlohu endogénneho estrogénu u dievčat. Pre zhoršený priebeh u chlapcov uspokojivé patogenetické vysvetlenie zatiaľ nemáme. U našich pacientov sa symptómy líšili od veľmi miernych až po závažné. Vo všeobecnosti sa HAE prejavuje najmä opuchmi končatín, tváre, črevnej sliznice a sliznice žalúdka, zriedkavejšie edémom laryngu. Bolesti brucha sa môžu zamieňať za náhle príhody brušné a viesť k zbytočným a rizikovým chirurgickým intervenciám. Vyšetrenie komplementu má byť preto súčasťou diferenciálnej diagnostiky opakujúcich sa nejasných bolestí brucha. USG vyšetrenie črevnej sliznice počas akútnej fázy môže identifikovať typický obraz zhrubnutej črevnej steny.(12) Smrteľné ataky sú v detstve zriedkavé. Dokumentuje to veková analýza 70 fatálnych prípadov v kohorte 728 pacientov s HAE, z ktorých traja zomrelí boli mladší ako 21 rokov.(13) Aj u matky pacientky P4 sa manifestoval život ohrozujúci edém laryngu až v dospelosti. Treba však zdôrazniť, že v každej z našich rodín sa v anamnéze vyskytlo úmrtie na retrospektívne stanovenú diagnózu HAE.
Sprievodné ochorenia vo všeobecnosti často modifikujú symptómy a odďaľujú určenie primárnej diagnózy. Výskyt alergie je z epidemiologického hľadiska veľmi častý. Tretina populácie má niektoré z alergických ochorení,(14) a preto sa príznaky angioedému pripisujú prevažne mediátorom mastocytov. Kombináciu 2 klinických jednotiek sme identifikovali v rodine č. 1 a vysoké koncentrácie IgE mala aj pacientka P4. Anamnéza alergie sa uvádzala v dokumentácii vo všetkých troch rodinách. Významný rozdiel, ktorý môže upozorniť na bradykinínom podmienený edém je absencia urtiky a pruritu. Pri koexistencii obidvoch mechanizmov vyžaduje hodnotenie stavu klinické skúsenosti. K odlíšeniu môže pomôcť údaj o slabom a/alebo žiadnom účinku protialergickej liečby, ako sú antihistaminiká, glukokortikoidy či adrenalín.
Na rozdiel od dospelých, záchvaty HAE u detí bývajú menej nápadné, kolíšu v svojej intenzite a môžu sa podobať iným ochoreniam. Podľa viacerých aj novších štúdií sa udáva diagnostické oneskorenie dlhšie ako 10 rokov.(8,9,15) Odďaľovanie efektívnej liečby (obr. 2) veľmi negatívne ovplyvňuje život pacientov a vedie k mnohým neopodstatneným vyšetreniam. Súčasné liečebné postupy pritom umožňujú dobrú kontrolu akútnych symptómov a prevenciu exacerbácií, ktoré môžu vyprovokovať plánované výkony (extrakcia zubov, chirurgické výkony). Nie všetky farmaká sú vhodné pre deti (napr. androgény). Navyše sú pediatrickí pacienti znevýhodnení pre nedostatočné a limitované dáta z klinických skúšaní nových typov liekov.
AKTUÁLNE DOSTUPNÁ TERAPIA PRE DETI A ADOLESCENTOV
V zásade existujú tri liečebné stratégie. Prvou je liečba náhodných akútnych exacerbácií. Druhou krátkodobá profylaxia pred plánovanými diagnostickými a terapeutickými výkonmi spojenými s poškodením tkanív a nakoniec dlhodobá profylaxia u pacientov s častými exacerbáciami (> 2x mesačne). Pre detských pacientov sú k dispozícii humánny C1-inhibítor z ľudskej plazmy (Berinert®) alebo rekombinantná forma ľudského C1-inhibítora (Ruconest®), ktorá je vhodná od 2 rokov veku. Na domácu aplikáciu je určený kompetitívny antagonista B2 bradykinínového receptora, ikatibant (Firazyr®), taktiež od 2 rokov. Na dlhodobú profylaxiu u deti nad 12 rokov je registrovaná monoklonálna protilátka proti kallikreínu, lanadelumab (Takhzyro®). Každý z pacientov vyžaduje individuálny terapeutický plán a dostupný účinný liek pre prípad akútnej exacerbácie.
Naši pacienti vyžadovali profylaktické podanie C1-inhibítora v priemere 1 ročne (0–3) a z dôvodu exacerbácie príznakov 1,8x ročne (0–6). Pacientke P5 sa pre časté exacerbácie indikovala liečba monoklonálnou protilátkou lanadelumab.
ZÁVER
Napriek tomu, že hereditárny angioedém I. a II. typu je vzácne ochorenie, treba ho diferenciálne-diagnosticky zvažovať pri opakujúcich sa opuchových stavoch. Detskí pacienti vyvíjajú symptómy menej zreteľne a diagnostické oneskorenie je časté. Opisované prípady našich rodín názorne ilustrujú význam cielenej osobnej a rodinnej anamnézy. Vyšetrenie C4 zložky komplementu je bežne dostupné v laboratóriách a pomáha identifikovať väčšinu prípadov. Na určenie optimálnej liečebnej stratégie u detí s HAE sú potrebné ďalšie prospektívne pediatrické štúdie.
V najbližších rokoch sa očakávajú výsledky klinických skúšaní s orálnymi prípravkami na liečbu a prevenciu, ktoré majú veľký potenciál významne zlepšiť kvalitu života pacientov.
Korespondenční adresa:
MUDr. Ivana Hulínková
Detská klinika Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb v Bratislave
Limbová 1
831 01 Bratislava
Sources
1. Aygören-Pürsün E, Magerl M, Maetzel A, Maurer M. Epidemiology of Bradykinin mediated angioedema: a systematic investigation of epidemiological studies. Orphanet J Rare - Dis 2018; 13 : 73.
2. Bennett G, Craig T. Hereditary angioedema with a focus on the child. Allergy Asthma Proc 2015; 36 : 70–73.
3. Davis AE 3rd. The pathophysiology of hereditary angioedema. Clin Immunol 2005; 114 : 3–9.
4. Hakl R, Kuklínek P, Chovancová P, Litzman J. Vrozené poruchy komplementu II. – hereditární angioedém. Čes Slov Pediat 2021; 76 (4): 218–221.
5. Donaldson VH, Rosen FS. Hereditary angioneurotic edema: a clinical survey. Pediatrics 1966; 37 : 1017–27.
6. Farkas H. Pediatric hereditary angioedema due to C1-inhibitor deficiency. Allergy Asthma Clin Immunol 2010; 6 : 18–27.
7. Bork K, Meng G, Staubach P, Jardt J. Hereditary angioedema: new findings concerning symptoms, affected organs, and course. Am J Med 2006; 119 : 267–74.
8. Maurer M, Magerl M, Ansotegui I, et al. The international WAO/ EAACI guideline for the management of hereditary angioedema - the 2017 revision and update. World Allerg Org J 2018; 11 : 5.
9. Farkas H, Martinez-Saguer I, Bork K, et al. International consensus on the diagnosis and management of pediatric patients with hereditary angioedema with C1 inhibitor deficiency. Allergy 2017; 72 : 300–313.
10. Roche O, Blanch A, Caballero T, et al. Hereditary angioedema due to C1 inhibitor deficiency: patient registry and approach to the prevalence in Spain. Ann Allergy Asthma Immunol 2005; 94 : 498–503.
11. Bygum A, Fagerberg CR, Ponard D, et al. Mutational spectrum and phenotypes in Danish families with hereditary angioedema because of C1 inhibitor deficiency. Allergy 2011; 66 : 76–84.
12. Gakhal MS, Marcotte GV. Hereditary angioedema: imaging manifestations and clinical management. Emerg Radiol 2015;22(1): 83–90.
13. Bork K, Hardt J, Witzke G. Fatal laryngeal attacks and mortality in hereditary angioedema due to C1-INH deficiency. J Allergy Clin Immunol 2012; 130 : 692–7.
14. Skoczylas D, Gujski M, Bojar I, Raciborski F. Importance of food allergy and food intolerance in allergic multimorbidity. Ann Agric Environ Med 2020; 27(3): 413–417.
15. Cancian M, The Italian Network for C1-INH-HAE (ITACA ). Diagnostic and therapeutic management of hereditary angioedema due to C1-inhibitor deficiency: the Italian experience. Curr Opin Allergy Clin Immunol 2015; 15 : 383 – 391.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 1-
All articles in this issue
- Vybrané poznámky k psychofarmakoterapii dětského a dorostového věku
- Laboratorní novorozenecký screening
- Hereditárny angioedém u detí: čo potrebuje vedieť pediater
- Perinatální mortalita a morbidita u infekce SARS-CoV-2 v průběhu těhotenství
- Diferenciální diagnostika syndromu multisystémové zánětlivé odpovědi asociované s nákazou SARS-CoV-2 u dětí a mladistvých
- Kardiovaskulární projevy u syndromu multisystémové zánětlivé odpovědi asociované s covidem-19 u dětí (PIMS-TS)
- Sekundární hemofagocytující lymfohistiocytóza při infekci virem SARS-CoV-2
- Z historie pediatrie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní novorozenecký screening
- Diferenciální diagnostika syndromu multisystémové zánětlivé odpovědi asociované s nákazou SARS-CoV-2 u dětí a mladistvých
- Vybrané poznámky k psychofarmakoterapii dětského a dorostového věku
- Z historie pediatrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career