-
Medical journals
- Career
Edwardsův syndrom – fenotyp, prognóza, etické postoje, odborná a paliativní péče
Authors: E. Pavlíčková 1; J. Pavlíček 2,3
Authors‘ workplace: Mobilní hospic Ondrášek, Ostrava 1; Klinika dětského lékařství FN a LF OU Ostrava, Oddělení dětské a prenatální kardiologie 2; Centrum biomedicínského výzkumu FN Hradec Králové 3
Published in: Čes-slov Pediat 2021; 76 (6): 335-343.
Category: Review
Overview
Edwardsův syndrom je syndrom trizomie 18. chromozomu. Charakterizován je primordiálně nízkým vzrůstem, typickou dysmorfií tváře, těžkou psychomotorickou retardací a mnohočetnými anomáliemi. Tento syndrom se vyznačuje vysokou prenatální i postnatální mortalitou. Přes nepříznivou prognózu část pacientů přežívá jeden rok života a ojedinělé případy překlenou i dětský věk. Současná úroveň lékařské vědy je schopna nabídnout intervenční zákroky a řešení morfologických patologií. Péče o děti s tímto typem genetického postižení má stále mnoho zdravotnických a etických otázek. Pro tyto pacienty je výhodný koncept paliativní péče. Největší důraz je kladen na kvalitu života dítěte a rodiny.
Klíčová slova:
Edwardsův syndrom – faciální dysmorfismus – mnohočené anomálie – trizomie
ÚVOD A DEFINICE
Edwardsův syndrom (ES) je syndrom trizomie 18. chromozomu (T18). ES byl poprvé popsaný Edwardsem a Smithem v roce 1960 [1, 2]. Po trizomii chromozomu 21 (Downův syndrom) je ES druhou nejčastější lidskou autozomální trizomií. Tento syndrom je charakterizován primordiálně nízkým vzrůstem, typickou dysmorfií tváře, těžkou psychomotorickou retardací a mnohočetnými anomáliemi. ES se vyznačuje vysokou prenatální i postnatální mortalitou. Nejčastější defekty jsou srdeční (75–90 %), časté jsou urogenitální vady (25–75 %), méně časté pak vady gastrointestinální, vady centrálního nervového systému, rozštěpy obličeje, vady očí a defekty končetin (5–25 %) [3].
ETIOLOGIE A EPIDEMIOLOGIE
ES patří mezi numerické chromozomální aberace, u těchto aneuploidií přebývá jeden chromozom. Tyto chyby vznikají většinou nesprávným rozdělením chromozomů při meiotickém dělení buněk již u rodičů nebo poruchami mitózy v časné fázi embryonálního vývoje. U ES je nejčastější příčinou nadpočetného chromozomu nondisjunkce mateřského původu a extra chromozom 18 je od matky. U menší části případů má nadpočetný chromozom otcovský původ a chyba je v postzygotické fázi dělení. Celkově v 94 % případů jde u ES o plnou trizomii, nadpočetný je celý chromozom 18, ve zbývajících procentech se vyskytují mozaikové formy nebo parciální trizomie dlouhého raménka chromozomu 18 (18q) [4]. U parciální trizomie 18 jde o triplikaci dlouhého raménka 18. chromozomu, nejčastěji v důsledku balancované translokace nebo inverze u jednoho z rodičů. U plné trizomie příčina nondisjunkce není známa, jako rizikový faktor je uváděn věk matky, po 30. roce se riziko vzniku T18 zvyšuje a pak pravděpodobně zůstává konstantní po 45. roce věku [5].
Incidence narozených dětí s ES je závislá na prenatálním screeningu. ES má vysokou prenatální morbiditu a před možností jeho prenatální detekce byla incidence 2–3 případy na 10 000 živě narozených dětí [5, 6]. Při přirozeném průběhu gravidity se narodí pouze 1/3 plodů, nejvyšší fetální ztráty jsou v I. a III. trimestru. V současnosti je většina případů ES diagnostikována před narozením. Incidenci v populaci významně ovlivňuje přístup rodičů, většina těhotných žen se rozhodne pro umělé ukončení gravidity. U prenatálně diagnostikovaných ES se po započtení ukončených gravidit a nitroděložních úmrtí narodí pouze 3 % plodů s T18 [7]. Prenatální diagnostikou se údaj o celkovém výskytu ES zpřesnil, dle různých studií je největší rozptyl 1 : 2500 až 1 : 10 000, jako nejpřesnější odhad se jeví 1 : 6000 [8, 9]. Postnatálně u ES převažuje ženské pohlaví. Původně udávané vysoké fetální ztráty mužského pohlaví se u jiných autorů nepotvrzují [7, 10]. Důvodem by ale mohl být větší výskyt končetinových defektů, rozštěpových vad obličeje a břicha u chlapců, kteří jsou pak častěji prenatálně diagnostikováni a tyto gravidity jsou ukončeny [11].
Stejná data platí pro sledování ES v České republice, zvyšuje se prevalence diagnostikovaných případů, až nad 90 % v posledních letech. Celkový výskyt je v naší zemi okolo 4 případů na 10 000 živě narozených, průměrný výskyt u narozených je 0,7 dětí na 10 000 živě narozených [12, 13].
PRENATÁLNÍ DIAGNOSTIKA A PRENATÁLNÍ FENOTYP
Prenatální diagnostika nejčastějších trizomií je nyní na vysoké úrovni a většina těchto aberací je detekována během prvního a druhého trimestru těhotenství. Různé typy screeningů (kombinovaný, kontingenční, integrovaný) berou v úvahu věk matky, hodnoty biochemických markrů a sonografických nálezů [14]. Tyto známky mají pro prenatální detekci T18 vysokou senzitivitu [15].
Ze sononografických známek mají nejčastěji plody s ES v prvním trimestru patologickou hodnotu šíjového projasnění a chybění nosní kůstky. V případě hodnocení patologických toků v ductus venosus a trikuspidální regurgitace stoupá možnost detekce až na 80 % [16]. S vývojem ultrazvukových technologií existuje řada dalších více či méně specifických sonografických známek pro ES jako je polyhydramnion, fetální růstová restrikce, hydrops plodu, abnomální tvar hlavy a obličejová dysmorfie, rozštěp rtu a patra, hypertelorismus, mikroftalmie, meningomyelokéla, ventrikulomegalie, agenese corpus callosum, překrývající se prsty na rukou, anomální tvar nohou, srdeční defekty, omfalokéla, diafragmatická hernie, abnormity ledvin, kryptorchismus, dvoucévný pupečník, sporným markerem jsou cysty chorioidálních plexů (obr. 1a, b, c) [17].
Image 1. Edwardsův syndrom, prenatální fenotypové projevy:
a) hydrops plodu,
b) plochý obličej,
c) omfalokéla.
Fig. 1. Edwards syndrome, prenatal phenotypic manifestations:
a) fetal hydrops,
b) flat face,
c) omphalocele.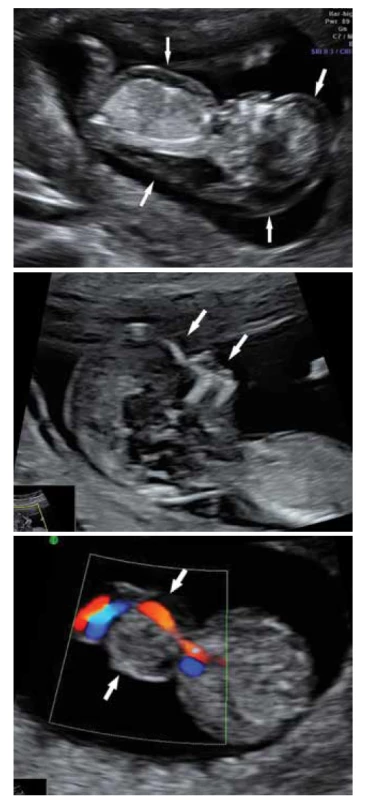
Pro zisk materiálu na genetické vyšetření se provádí biopsie choriových klků nebo amniocentéza, zcela výjimečně kordocentéza. Z neinvazivních vyšetření je možno nabídnout testování volné fetální DNA v mateřské krvi. Toto vyšetření má v současnosti pro ES až 98% specificitu a nízkou hodnotu falešné pozitivity [18]. Pozitivní výsledek je nutno potvrdit klasickou metodou (vyšetřením choriových klků nebo amniocentézou), až poté je diagnóza ES stanovena definitivně.
POSTNATÁLNÍ FENOTYP
Pro ES typická kraniofaciální dysmorfie zahrnuje mikrocefalii, dolichocefalii, hlava je úzká s prominujícím záhlavím a vysokým, vyklenutým a širokým čelem. Uši jsou nízko posazené, malé, atypického tvaru. Oční štěrbiny jsou krátké a úzké, mohou být v šikmém postavení, možný je hypertelorismus, epikantus, ptóza víčka. Nos je malý, možná je atrézie choan, filtrum je úzké, děti mají mikrognacii, mikrostomii, rozštěpové vady. Krk a hrudník jsou krátké, prsní bradavky jsou relativně vzdálené. Charakteristické jsou flekční kontraktury kloubů prstů s překřížením 2. a 5. prstu přes 3. a 4. prst. Flekční deformity nacházíme i na dolních končetinách, postižena je abdukce v kyčlích. K dalším známkám na končetinách patří: parciální syndaktylie, krátké a dorzálně flektované palce u nohou, prominence patní kosti, „rocker bottom feet – kolébkové nohy“, pes equinovarus, hypoplazie nehtů.
Srdeční defekty jsou nejfrekventnější morfologické postižení u ES. Dominuje defekt komorového septa, defekt síňového septa a otevřená tepenná dučej, možné je valvární postižení u více chlopní. U menší části případů (10 %) byla diagnostikována významnější komplexní srdeční vada typu dvojvýtokové pravé komory, Fallotovy tetralogie, atrioventrikulárního defektu nebo levostranných obstrukčních vad, koarktace aorty [4].
V oblasti respirace jsou časté dýchací potíže, které jsou nejčastější příčinou smrti u této trizomie. Částá je laryngomalacie nebo tracheobronchomalacie. Možné jsou centrální nebo spánkové apnoe. Děti trpí častými pneumoniemi. Podle významnosti srdeční vady dochází k vývoji plicní hypertenze [10, 19].
Četné vady jsou popsány v oblasti urogenitálního a gastrointestinálního traktu. Dvě třetiny pacientů mají podkovovitou ledvinu, možná je aplazie nebo hypoplazie ledvin, vývoj hydronefrózy. Dalším postižením je hypospadie, kryptorchismus, vývojové vady uteru, hypoplazie ovarií, hypertrofický klitoris. Z významných gastrointestinálních patologií se vyskytuje diafragmatická hernie, omfalokéla, atrézie jícnu, tracheoezofageální píštěl, stenóza pyloru, atrézie anu, přítomnost Meckelova divertiklu, tříselné nebo pupeční hernie. V oblasti obličeje jsou typické rozštěpové vady. Děti s ES mají vždy výživové problémy. U těchto pacientů je horší sání a polykání, potíže zhoršuje časný gastroezofageální reflux a hrozí aspirace. Pacienti často trpí obstipací.
Existuje mnoho očních a ušních příznaků: mikroftalmie, anomálie duhovky, katarakta, pigmentové změny sítnice, strabismus, poruchy zrakové ostrosti, slepota, epikantus, ptóza víčka, fotofobie. Z postižení sluchového aparátu jde o atrézii zvukovodů, vady středního a vnitřního ucha, různý stupeň hluchoty. Pacienti mají časté sinusitidy a záněty středouší.
V oblasti muskuloskeletálního a neurologického postižení byl u 5–10 % případů zjištěn defekt končetin (aplazie radia nebo další dysmelie). Vzácnější jsou anomálie žeber, obratlů, skolióza. Časté jsou flekční kontraktury. V oblasti centrální nervové soustavy je častá hypoplazie mozečku, ageneze corpus callosum, mikrogyrie, hydrocefalus, meningomyelokéla, encefalokéla, dilatace cisterna magna. V časném dětství jsou děti hypotonické, v pozdějším věku se vyvíjí hypertonus. Až u 50 % dětí se vyvíji záchvatové a křečové stavy.
Růstová retardace začíná již prenatálně a pokračuje v postnatálním období. V průměru se děti rodí lehce nezralé a většinou s hmotností pod 2000 g. V dalším období se pak obvod hlavy, váha a míra pohybuje pod 3. percentilem.
Pacienti s ES jsou vždy významně psychomotoricky postiženi. Snížená je kognitivní a intelektová složka. Nevyvíjí se regrese, postižení zůstává stejného stupně, dítě může získat některé dovednosti. Ve většině případů nedojde k vývoji jazykových schopností ani samostatné chůze. Postižení je různé, jsou děti, které jsou schopny napodobování, pochopení jednoduchých příkazů, komunikace a dokonce samostatného hraní. U jiných pacientů je postižení výrazně těžší. V prvním roce života jsou děti schopny se přetočit, natahovat po předmětu, usmívat se a rozpoznávat blízké dospělé. Ve 2–3 letech mohou sedět s oporou, imitovat výrazy, rozpoznají slova. V předškolním věku jsou některé děti schopny samostatného hraní a vykonání jednoduchých příkazů, porozumět pojmům, příčinám a následkům, použít znaky. Za pokračujícího a příznivého vývoje starší děti identifikují běžné objekty, mohou chodit s chodítkem, rozumí slovům a frázím. Výjimečně byla popsána samostatná chůze a hygiena.
ES přináší vyšší riziko výskytu některých tumorů, nejčastěji Wilmsova tumoru ledvin a hepatoblastomu. Tyto tumory se objevují až ve vyšším věku, u Wilmsova tumoru v rozmezí 1–13 let, u hepatoblastomu v rozmezí 4 měsíce – 3 roky [20]. Prognóza je variabilní, pacienti zemřeli buď pro progresi nádoru, nebo na srdeční selhání při celkových komplikacích. Mozaiková forma u T18 má velkou fenotypovou variabilitu, od téměř normálního fenotypu a vývoje, až po těžce vyjádřený ES s časným úmrtím. U mozaiky T18 množství patologických linií koreluje pravděpodobně se zhoršením inteligence, u fenotypových příznaků již jasná korelace nebyla nalezena. U mozaikových forem je riziko, že rutinní karyotyp z kultury lymfocytů nestačí k diagnostice mozaiky. Při podezření na ES je vhodné doplnit vyšetření karyotypu z kožních fibroblastů. Mozaikovou formu je možno zjistit i z bukálního stěru a biopsie kůže nemusí být provedena.
PŘIROZENÝ PRŮBĚH
V přirozeném průběhu se ES chová nepříznivě. Syndrom má vysoké fetální ztráty, perinatálně se vyskytují četné komplikace. Přibližně 1/3 dětí umírá při porodu, 1/3 se rodí nezralá, u ES je zaznamenán i vyšší počet císařských řezů. Očekávaná je výrazně zkrácená délka života [1]. Medián přežití je 3–14 dní, 24 hodin přežije 60–75 %, 1 týden 40–60 %, 1 měsíc 22–44 %, 6 měsíců 9–18 %, 1 rok 5–10 % dětí [4, 8, 10, 19].
Limitní pro život se nejvíce jeví dýchací a výživové potíže [21, 22]. Děti s ES mají v prvním roce života až 100krát větší riziko úmrtí než běžná populace [22]. Většina úmrtí proběhne jako náhlá smrt pro centrální nebo obstrukční apnoi, kardiální selhání s plicní hypertenzí, aspirační příhodu nebo kombinaci těchto faktorů. Srdeční vada není jasný faktor pro úmrtí [23]. Celkově se péče i o geneticky postižené děti zlepšuje a nabídnutí intenzivnější péče a eventuální řešení srdeční vady a přidružených patologií délku života s T18 může prodloužit v prvním roce, v déletrvajícím časovém horizontu se ale délku života ovlivnit nedaří. U mozaikových forem je jednoroční přežití až 70 % [24].
PÉČE O DÍTĚ S EDWARDSOVÝM SYNDROMEM
Pacient může být propuštěn z porodnice. Dětem s ES by měla být nabídnuta stejná péče jako normální populaci. Možná je imunizace, v úvahu je nutno vzít hmotnost, celkový stav a přítomnost záchvatových poruch. Největší problémy očekáváme v oblasti krmení a výživy. Kojení je výhodnější, ale obtížnější než krmení z lahve. Děti s rozštěpovou vadou obličeje můžeme krmit speciálními savičkami nebo umělými bradavkami. Měření váhy, míry, obvodu hlavy se provádí standardně, u pacienta vedeme růstové křivky. Nutností může být došetření jícnu, lze provést polykací akt vodnou kontrastní látkou, ultrazvukové vyšetření. Při přítomnosti gastroezofageálního refluxu zahajujeme léčbu. V případech nemožnosti normálního krmení je nutno zvážit zavedení nazogastrické sondy nebo provedení gastrostomie. Gastrostomie je pak nejčastější chirurgický výkon u dětí s ES. Další nejčastější invazivní výkony jsou: operace srdečních vad, ortopedické a ORL výkony [25]. U dětí s ES je doporučena péče zubního lékaře, nejpozději ve věku 1 roku nebo do 6 měsíců po prvním prořezání dentice. Sanace chrupu je důležitá i z pohledu častých srdečních vad.
Nejčastější srdeční vadou je defekt komorového septa, defekt síňového septa a otevřená tepenná dučej, část dětí má kombinaci těchto defektů [26]. Většina z nich je operovatelná, a tato problematika je u dětí s ES nejvíce diskutována. Každé dítě s ES by mělo mít kompletní vyšetření dětským kardiologem a měla by být přesně stanovena povaha vady a eventuální možnost řešení. Rizikem je vývoj plicní hypertenze po 2–3 měsících věku. Původně byl preferován konzervativní přístup a dítěti s ES nebyla operativa nabízena. Operaci srdce je ale možné indikovat s dobrými výsledky [27]. Komplikací pro výkon je nízká porodní hmotnost nebo neonatologické komplikace, nutností je také posuzovat celkový stav a stabilitu dítěte než pouze povahu srdeční vady. Nejčastější je u T18 operace komorového defektu [28]. V registrech jsou zaznamenány ale i další typy operací, diagnostických katetrizací, ligací dučeje nebo i aplikace pacemakeru. Přes genetické postižení je operace srdečních vad u ES možná a prodlužuje život pacientům, studie dokazují, že přežívání je jednoznačně delší u operovaných dětí oproti dětem bez provedení kardiochirurgického výkonu [9, 29]. Pacienti mohou profitovat nejen z radikální operace, ale i z paliativního zákroku, kterým je většinou u těchto typů vad bandáž plicnice. Operace srdeční vady může zároveň zlepšit problémy s krmením. Přestože riziko komplikací je vyšší než u normální populace nebo například u trizomie 21, je operativa eticky přijatelná. Zda zlepšuje dlouhodobou prognózu, stále není známo. Respirační potíže lze konzultovat s pneumologem a ORL, řešení obstrukčních problémů se neliší od zdravých dětí. I u dětí s ES lze provést spánkovou studii a hodnocení spánkové apnoe. Ve stejných principech jako u jiných komplikací je nutno probrat s rodinou možnost domácí kyslíkové terapie nebo provedení tracheostomie [25]. Otázkou je pasivní imunizace proti RS viru Synagisem u kojenců s T18 před zimní sezónou.
V oblasti očního lékařství a ORL se doporučuje běžné řešení strukturálních abnormalit, u starších dětí vyšetření a korekce vizu. I mladší děti mohou trpět výraznou fotofobií a doporučujeme nošení slunečních brýlí. Rutinní oční vyšetření se doporučuje po jednom roce věku. Nutná je verifikace event. atrézie zvukovodů, vhodné je CT vyšetření k popisu všech částí ucha. Novorozenec by měl mít proveden audiologický screening, dále by sluchové vyšetření mělo být provedeno po 6 měsících a po jednom roku věku. Dle audiologického vyšetření lze nabídnout sluchové pomůcky. U svalového a kosterního systému je nutná detekce skoliózy, možno je doplnit RTG vyšetření a zhodnocení ortopedem, nošení ortéz, u starších dětí je možná i operační korekce. Ortopedické vyšetření poprvé navrhujeme po 2 letech věku. Anomálie nohou (club foot) se řeší výjimečně vzhledem k tomu, že děti s ES jsou málokdy schopné zcela samostatné chůze.
U všech dětí doporučujeme ultrazvuk břicha a ledvin, hlídáme vznik močové infekce, jejichž léčba se neliší od zdravých dětí. Ultrazvuk břicha je vhodný i pro detekci nitrobřišních tumorů, doporučuje se začít po 6. měsíci života a kontrolovat dítě po půl roce. Neurologické sledování je indikováno při diagnostice a léčbě epilepsie, většinou postačuje standardní farmakototerapie. Neurologické vyšetření se u přežívajících dětí ale doporučuje vždy. Rehabilitace, fyzikální terapie a bazální stimulace je u těchto dětí na zvážení, je vhodná především při vývoji hypertonu. U přežívajících starších dětí by rehabilitace měla být zavedena vždy. Umožňuje zlepšení svalové síly, motorické koordinace, event. lokomoce, je prevencí malformací kloubů, udržování jejich rozsahu celkového a držení těla, zlepšuje i respiraci [30]. Vedoucím lékařem je dětský obvodní lékař, postupně je možno zapojit i paliativní týmy. U školních dětí je dle nálezů a stavu otázka specializačního vzdělávání a poskytnutí ergoterapie, logopedie, zrakových cvičení. Souhrn doporučené péče o dítě s ES uvádí tabulka 1.
Table 1. Postnatální péče o dítě s Edwardsovým syndromem. 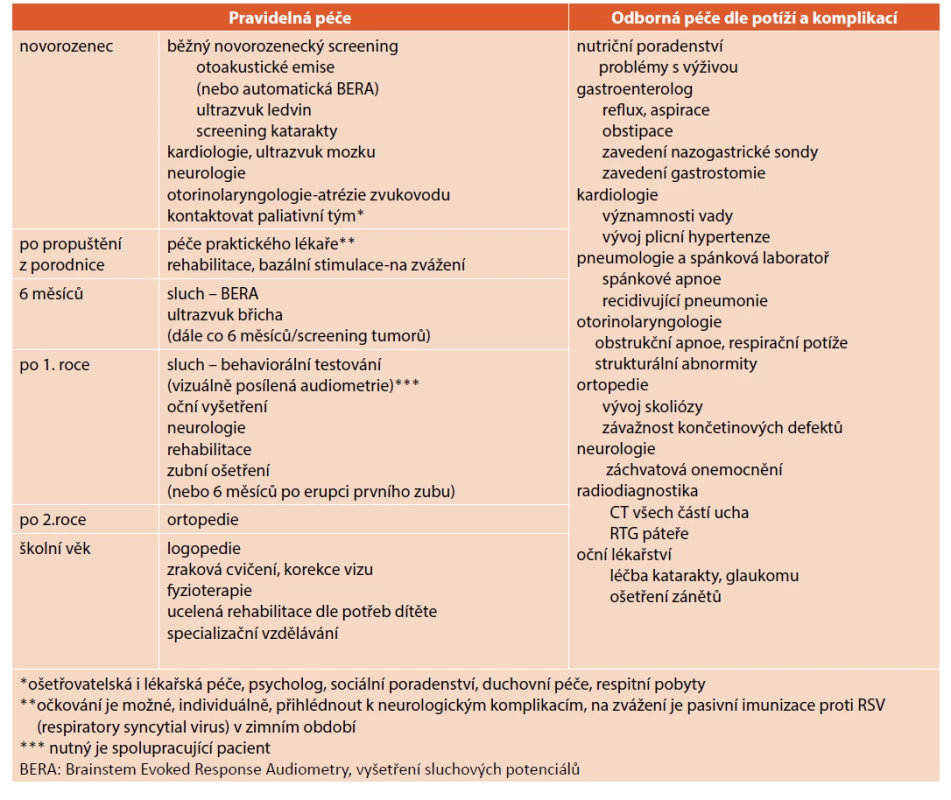
ETICKÁ PROBLEMATIKA
Původně byl ES považován za stav, při kterém není indikována intervence u novorozence. Diskutovaná témata se nejčastěji dělí do okruhů: nejlepší zájem dítěte a kvalita jeho života, poskytování standardní péče, autonomie rodičů a zároveň i alokace ekonomických zdrojů pro péči o tyto děti. U tohoto syndromu bychom se měli vyhnout termínu „letální“ vzhledem k tomu, že 5–10 % dětí přežije bez ohledu na intervence první narozeniny. Nejstarší pacienti s plnou trizomií 18 přesáhli 30 let života [31].
Názory lékařských týmů na péči o novorozence se liší. Převládá spíše zdrženlivost, podpora neposkytnutí péče, která nemění základní prognózu, podpora neposkytnutí neoprávněné intenzivní péče, nezahájení resuscitace u novorozence, neprovádění operačních výkonů [32]. Největší spory se vedou o agresivitu zákroku v případě respiračních komplikací a možnosti chirurgických řešení. Lékařský tým musí před každým zákrokem zvážit, zda léčit novorozence se vzácnou nemocí, zda je předpoklad, že zásah bude úspěšný, jaká jsou rizika spojená s výkonem, jaká jsou rizika spojená s neléčením, zda prodlužujeme život dítěte nebo mu měníme kvalitu života, zda mu přineseme bolest a nepohodlí. Zároveň bychom měli respektovat přání rodičů podporovat dítě [32]. Po porodu je možno poskytnout bazální a paliativní péči anebo pacienta agresivněji resuscitovat a poskytnout mu invazivní a operační výkony. ES může být vyňat z DNR (do not resuscitated) již na novorozeneckém oddělení.
V poslední době se mění postoj neonatologů k „neresuscitaci“ a týmy jsou ochotny dítě resuscitovat a agresivněji léčit, pokud je toto mateřské přání a zlepší to stav dítěte po porodu. Obecně nejpřijatelnější se jeví „úcta k přání rodičů“, zároveň je ale nutno respektovat potenciální kvalitu života dítěte a celé rodiny [33]. Většinou trváme na plné informovanosti rodičů o zdravotním stavu a cílech péče. Rodina pak volí další postup, bez ohledu na jejich volbu bychom měli jejich rozhodnutí ctít a podporovat, rodiny zaslouží náš plný respekt. Zdravotnické týmy by se měly podílet na tom, aby život postiženého dítěte a jeho rodiny byl tak nejlepší, jak je to jen možné. Rodiče postižených dětí chtějí být součástí rozhodnutí týkajících se péče. Většinou rodiče tuto péči velmi dobře zvládnou. Mezi hlavní rodičovská přání patří touha pečovat o postižené dítě, přivést dítě domů a strávit další čas jako rodina a dát dítěti co nejlepší kvalitu života. Zároveň rodiče často vyjadřují obavy z lékařské složitosti této problematiky, bolesti dítěte a dlouhodobých pobytů v nemocnici [34].
Pokud zvažujeme intervence, tak kvalita života dítěte by měla stát nad kvantitou operačních a invazivních řešení. Měli bychom posoudit potenciální zlepšení, množství operací a délku hospitalizací, délku závislosti na umělé plicní ventilaci a pravděpodobnost odpojení. Zvažujeme možné utrpení dítěte, změnu dosavadní péče, kterou nový zákrok způsobí, eskalaci péče při komplikacích, schopnost rodičů porozumět a interpretovat medicínské informace, schopnost rodičů pečovat o postižené dítě a jeho komplikace, přání rodičů, zda chtějí prodloužit život dítěte za každou cenu. Důležitá je účast sourozenců a dalších rodinných příslušníků, finanční možnosti rodiny, emoční vnímání, náboženské a kulturní přesvědčení. Dilemata nejlépe shrnuje otázka: „Protože můžeme nabídnout intervenci, měli bychom?“ [35]. Konverzace s rodiči je zaměřena na to, zda intervence dosáhne požadovaných cílů, nebo je zlepšení nepravděpodobné. Nepříjemnou bolest a utrpení bez jakéhokoli prospěchu pro pacienta nelze ospravedlnit. Rodiče a poskytovatelé péče potřebují společně diskutovat o potenciálních přínosech a zátěži jakéhokoli zásahu.
U těchto syndromů je nejčastěji řešen konflikt mezi medicínskou vědou a autonomií rodičů. Stále bude existovat skupina rodičů, kteří budou žádat o co největší technickou podporu a řešení všech komplikací. Pouze menší část lékařů by provedla invazivní výkon na přání rodičů, z mateřských obav zhoršení stavu nebo pro svou právní ochranu. Většina týmů se ale shoduje na upřednostnění správnosti hydratace, zvládání bolesti, použití antibiotika a neinvazivní podpory dýchání. Část lékařů podporuje větší agresivitu léčby a řešení komplikací s možnosti posunu přežití a částečného vývoje [36]. Léčba může mít negativní stránku v bolesti a prodloužení utrpení a umírání [37]. Část autorů ale doporučuje paliativní péči, která zabezpečí „komfort, teplo a náruč, a ne resuscitaci“ [38]. Rozvinuté státy se liší v přístupu k péči, zejména v novorozeneckém a časném věku. Jsou země, kde lékaři v zásadě nežádají rodiče o svolení k redukci péče (Francie), v jiných zemích (USA) naopak, v obavě z právních komplikací je tendence udělat vše, aby se vyhnuli konfliktu s rodiči a případné žalobě [39].
Autonomii rodičů a jejich prosby se většinou snažíme podporovat, řadu výsledků ale můžeme považovat za nejednoznačné a měli bychom být schopni předložit, že žádání o výkon je chybné rozhodnutí. Na druhou stranu budou existovat rodiče, kteří budou trvat na invazivitě a budou schopni si sehnat lékaře, který výkon bude indikovat [40]. Rodičovskou volbu bychom mohli považovat za mylnou, pokud terapie způsobí bolest a utrpení bez naděje na zlepšení. Výsledný stav nebo délka života se po invazivních procedurách nemusí změnit. Přestože se v nemocniční i ambulantní péči o těžce postiženého pacienta obtížně hovoří o ekonomických aspektech, je potřeba i toto vzít v úvahu. Je otázkou, zda a jak velké mají být vynaložené zdroje na léčbu nevyléčitelně nemocného. Ekonomické zdroje je lépe zaměřit na alternativní a podpůrné programy pro tyto děti než prodlužovat utrpení a přežití za každou cenu.
Do konfliktu se může dostat ošetřující personál v nemocnici nebo v ambulantní péči, který nesouhlasí s procedurami prosazovanými rodinou a vidí dítě jako příliš trpící. Žádný názor nemusí být správný, o postupech je třeba mezi rodinou a ošetřujícím personálem opakovaně diskutovat, pomoci může i etická komise. Je důležité, aby ošetřující zdravotníci identifikovali etická dilemata, pojmenovali je a s pomocí všech znalostí a zdrojů je pomohli řešit k nejlepšímu prospěchu postiženého dítěte. Poskytovatelé zdravotní péče musí někdy vyvažovat příliš negativní obraz špatné a letální prognózy s přílišným optimismem některých webových stránek [41]. Samostatnou kapitolou je vyrovnávání rodičů s nepříznivou diagnózou. Prenatálně i postnatálně rodiče nemusí reagovat racionálně. Rodiče jsou pod vlivem šoku, projdou fázemi viny, popírání diagnózy, nadějí a „růžových brýlí“. Postižení ovlivňuje rodiče i širší rodinu. Navázání důvěry mezi rodiči a členy rodiny a zdravotníky se jeví být klíčové pro další péči o dítě.
PALIATIVNÍ PÉČE
I u genetických syndromů, které mají nepříznivou prognózu, můžeme nabídnout paliativní a hospicovou péči [23]. Dětská paliativní péče je doporučována pro novorozence s trizomií 18, kteří jsou propuštěni do domácí péče. Paliativní tým může vnést do problematiky své zkušenosti a rozšířit tradičně zúžený pohled na kvalitu života těchto pacientů [46]. Při paliativní péči o dítě s ES se snažíme většinou odpovědět na zásadní témata: kdy je etické omezit možné intervence?; kdo finálně rozhoduje, zda se lékařské intervence považují již za marné?; jaké máme návody a doporučení pro řízení péče?; můžeme používat termíny, jako je marná péče a smrtelná diagnóza? [42].
Komplex paliativní péče se zaměřuje na komfort pacienta a umožňuje koordinovat zásahy, jako je terapie, ošetření a dokonce i chirurgické zákroky. Paliativní péče pomáhá rodičům při rozhodování o péči o jejich dítě s diagnózou omezující život. S rozvojem prenatální diagnostiky je možno pro rodiče, kteří se rozhodnou pokračovat v graviditě, nabídnout koncept perinatální paliativní péče. Tato péče je záhájena již v době fetální diagnózy a pokračuje perinatálně a postnatálně [43]. Paliativní tým pomáhá vytvořit plán péče od narození až do konce života, od stanovení diagnózy posuzuje rodinné potřeby, pomáhá poskytovat a zpracovávat informace, sleduje kontinuitu péče a návaznost jednotlivých odborností. Již prenatálně existuje řada otázek, na které by měl odpovědět specialista na fetální medicínu, porodník, neonatolog, pediatr a další odborníci.
Rodiče by měli být informováni, že je možno povolit propuštění těžce nemocného dítěte domů, kde dítě zemře přirozenou smrtí. Péče o dítě je pak podporována multidisciplinárním týmem v modelu paliativní hospicové péče. Rodiče je možno seznamovat se statistikou a předvídáním doby ztráty dítěte, zároveň je ale zásadní, aby tým dal rodině naději na další přežití postiženého pacienta. Lékařská věda vyvíjí úspěšné intervence, které mohou prodloužit přežití novorozenců i u trizomie 18. Etické konflikty pak vyvstávají jak pro zdravotnické týmy, tak pro rodiče, kteří se podílí na rozhodování a stupni péče. Cílem by měla být shoda mezi lékaři a rodiči tak, aby byla podporována kvalita života a umírání, které by mělo být důstojné v co největší laskavosti a lidskosti. Pokud tato shoda chybí, může dojít k vývoji morální úzkosti, bolesti a zklamání.
U těžce nemocných a postižených dětí je patrný posun jak v péči, tak ve stupni rozhodování. Je patrný posun k rodičovské autonomii, rodiče chtějí být aktivními účastníky rozhodování o invazivitě a celkové péči. V současnosti rodiče chtějí být „dobrými rodiči“ a kvalita života a komfort dítěte jsou většinou těmi klíčovými faktory, které zvažují. Zároveň jsou schopni zvažovat a přijmout umírání dítěte nebo odnětí podpory základních životních funkcí. Rodiče často zpětně litují, že nebyli schopni odmítnout péči, nebo že jejich přání byla ignorována. Často doma rodiče říkají jiné názory než v nemocnici, doma mají pocit, že situaci dobře zvládnou, v nemocnici mají ale pak pod tlakem zdravotníků pocit selhání. Naopak se může také stát, že nemocničním personálem je vytvářen příliš velký důraz na to, aby rodiče rozhodli, a příliš mnoho autonomie pak selhává. Paliativní tým může rodičům poskytnout podporu, přestože vyžadují agresivnější přístup a invazivní výkony. Důležitá je podpora emoční a udržování dobrého vztahu s rodinami, přes náš nesouhlas s poskytováním dalších procedur. Hlavním cílem by mělo být vytvoření naděje na úlevu a snížení utrpení pro dítě a rodinu a možnosti prožití lásky v péči o život dítěte.
Paliativní tým může nabídnout informativní, podpůrnou a uklidňující možnost pro rodiče, kteří hledají co nejlepší alternativu pro dítě, zároveň pomůže dosáhnout určité rodičovské autonomie, selektivního využití lékařské péče a intervencí a může být určitým pojítkem mezi nemocniční péči a rodinou [26].
VLASTNÍ ZKUŠENOSTI PRENATÁLNÍHO CENTRA A HOSPICOVÉHO ZAŘÍZENÍ
Autoři dlouhodobě sledují výskyt významných genetických a kardiálních patologií v regionu Moravskoslezského kraje. V posledních deseti letech (2011–2020) se zde vyskytlo 80 případů plodů a dětí s ES. Tento výskyt, 6 : 10 000, je ve sledovaném regionu mírně vyšší než uváděné incidence v předchozích částech textu. Prenatálně bylo diagnostikováno 93 % (74/80) případů. Z této skupiny se 95 % (70/74) těhotných žen rozhodlo pro ukončení gravidity, jeden plod nitroděložně zemřel, tři rodiny pokračovaly v graviditě a narodily se tři děti s touto trizomií. Společně s šesti prenatálně neidentifikovanými dětmi tvořila postnatální skupina 9 pacientů. Celkově 7 dětí zemřelo v kojeneckém věku, dva pacienti žijí a mají v této době 4 a 18 měsíců (obr. 2a, b).
Image 2. Edwardsův syndrom, postnatální fenotyp:
a) po porodu,
b) věk 18 měsíců.
Fig. 2. Edwards syndrome, postnatal phenotype:
a) after delivery,
b) age 18 months.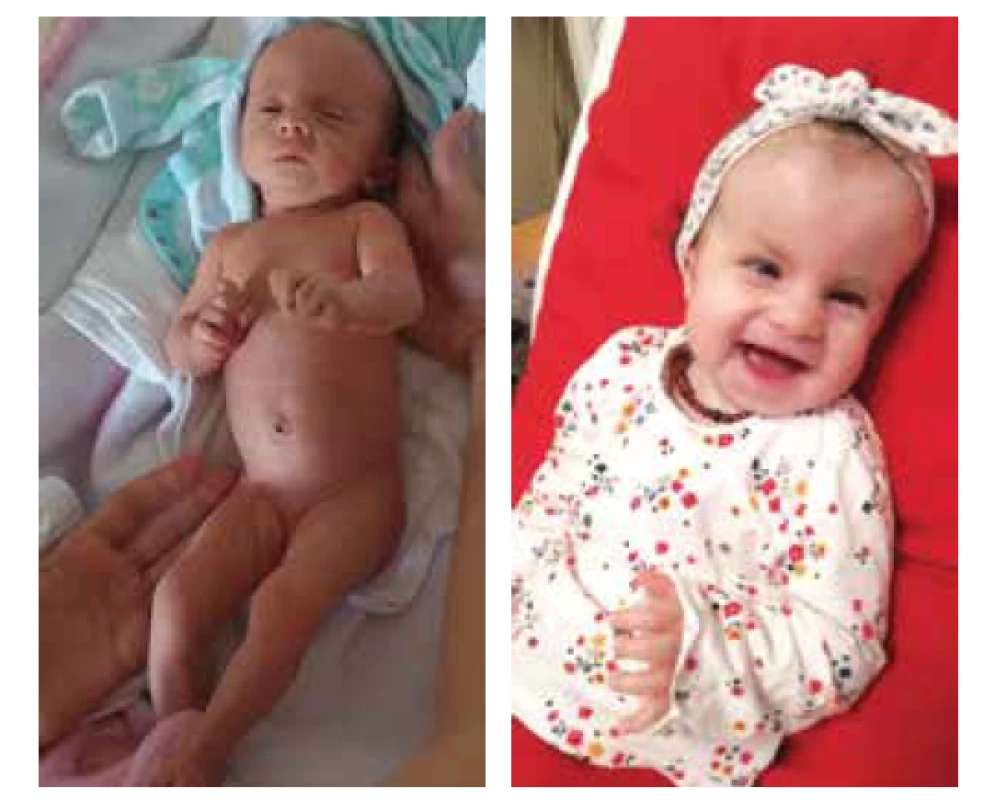
Obě děti jsou sledovány dětským kardiologem, gastroenterologem, neurologem, v současné době rehabilitují (Bobath koncept). U obou je přítomen významný defekt komorového septa, po dohodě s rodiči intervenci neplánujeme. Starší dítě je živeno kompletně per os, mladší nazogastrickou sondou. Rodičům je postupně nabízeno spektrum možné péče, o vyšetřeních a nabízených procedurách se sami rozhodují.
Oběma rodinám byla nabídnuta paliativní podpůrná péče mobilního hospice, kterou využívají. Rodinám je k dispozici lékař, zdravotní sestra, psycholog a sociální pracovnice. Medikaci, včetně analgetické, v současnosti děti nevyžadují. Paliativní tým hraje významnou roli jak v péči o postižené dítě, tak v podpoře pečujících rodin.
ZÁVĚR
Edwardsův syndrom je druhou nejčastější lidskou autozomální trizomií. Nejčastějším morfologickým defektem jsou srdeční vady, vždy je přítomná psychomotorická retardace a výživové problémy. Přes nepříznivou prognózu část pacientů přežívá jeden rok života a ojedinělé případy překlenou i dětský věk. Současná úroveň lékařské vědy je schopna nabídnout intervenční zákroky a řešení morfologických patologií. Péče o děti s tímto typem genetického postižení má stále mnoho zdravotnických a etických otázek. Pro tyto pacienty je výhodný koncept paliativní péče. Největší důraz klademe na kvalitu života dítěte a rodiny.
Došlo: 11. 11. 2020
Přijato: 12. 4. 2021
Korespondující autor:
Doc. MUDr. Jan Pavlíček, Ph.D.
Oddělení dětské a prenatální kardiologie
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava Poruba
e-mail: jan.pavlicek@fno.cz
Sources
1. Edwards JH, Harnden DG, Cameron AH, et al. A new trisomic syndrome. Lancet 1960; 275 (7128): 787–790.
2. Smith DW, Patau K, Therman E, Inhorn SL. A new autosomal trisomy syndrome: multiple congenital anomalies caused by an extra chromosome. J Pediatr 1960; 57 (3): 338–345.
3. Cereda A, Carey JC. The trisomy 18 syndrome. Orphanet J Rare Dis 2012; 7 (1): 81.
4. Carey JC. Trisomy 18 and trisomy 13 syndromes. Cassidy and Allanson‘s Management of Genetic Syndromes. Wiley Online Library, 2021 : 937–956.
5. Savva GM, Walker K, Morris JK. The maternal age‐specific live birth prevalence of trisomies 13 and 18 compared to trisomy 21 (Down syndrome). Prenat Diagn 2010; 30 (1): 57–64.
6. Tennant PW, Pearce MS, Bythel M, Rankin J. 20-year survival of children born with congenital anomalies: a population-based study. Lancet 2010; 375 (9715): 649–656.
7. Morris JK, Savva GM. The risk of fetal loss following a prenatal diagnosis of trisomy 13 or trisomy 18. Am J Med Genet A 2008; 146 (7): 827–832.
8. Rasmussen SA, Wong LYC, Yang Q, et al. Population-based analyses of mortality in trisomy 13 and trisomy 18. Pediatrics 2003; 111 (4): 777–784.
9. Irving C, Richmond S, Wren C, et al. Changes in fetal prevalence and outcome for trisomies 13 and 18: a population-based study over 23 years. J Matern-Fetal Neo M 2011; 24 (1): 137–141.
10. Niedrist D, Riegel M, Achermann J, et al. Trisomy 18: changes in sex ratio during intrauterine life. Am J Med Genet A 2006; 140 (21): 2365–2367.
11. Springett A, Wellesley D, Greenlees R, et al. Congenital anomalies associated with trisomy 18 or trisomy 13: A registry‐based study in 16 european countries, 2000–2011. Am J Med Genet A 2015; 167 (12): 3062–3069.
12. Gregor V, Šípek A, Šípek Jr A, et al. Prenatální diagnostika chromozomálních aberací Česká republika: 1994–2007. Čes Gynek 2009; 74 (1): 44–54.
13. Šípek A, Gregor V, Horáček J, et al. Prevalence vybraných vrozených vad v České republice: vývojové vady ledvin, srdce a vrozené chromozomové aberace. Epidemiol Mikrobiol Imunol 2013; 62 (3): 112–128.
14. Belošovičová H, Calda P. Screening Downova syndromu v prvním, druhém nebo obou trimestrech? Actual Gyn 2012; 4 : 14–21.
15. Yamanaka M, Setoyama T, Igarash Y, et al. Pregnancy outcome of fetuses with trisomy 18 identified by prenatal sonography and chromosomal analysis in a perinatal center. Am J Med Genet A 2006; 140 (11): 1177–1182.
16. Geipel A, Willruth A, Vieten J, et al. Nuchal fold thickness, nasal bone absence or hypoplasia, ductus venosus reversed flow and tricuspid valve regurgitation in screening for trisomies 21, 18 and 13 in the early second trimester. Ultrasound Obstet Gynecol 2010; 35 : 535–539.
17. Kroes I, Janssens S, Defoort P. Ultrasound features in trisomy 13 (Patau syndrome) and trisomy 18 (Edwards syndrome) in a consecutive series of 47 cases. Facts Views Vis Obgyn 2014; 6 (4): 245–249.
18. Palomaki G, Dec C, Kloz EM, et al. DNA sequencing of maternal plasma reliably identifies trisomy 18 and trisomy 13 as well as Down syndrome: an international collaborative study. Genet Med 2012; 14 (3): 296–305.
19. Vendola C, Canfield M, Daiger SP, et al. Survival of Texas infants born with trisomies 21, 18, and 13. Am J Med Genet A 2010; 152 : 360–366.
20. Kitanovski L, Ovcak Z, Jazbec J. Multifocal hepatoblastoma in a 6-month-old girl with trisomy 18: a case report. J Med Case Rep 2009; 3 (1): 8319.24. Banka S, Metcalfe K, Clayton-Smith J. Trisomy 18 mosaicism: report of two cases. World J Pediatr 2013; 9 (2): 179–181.
21. Boss RD, Holmes KW, Althaus J, et al. Trisomy 18 and complex congenital heart disease: seeking the threshold benefit. Pediatrics 2013; 132 (1): 161–165.
22. Merritt TA, Catlin A, Wool C, et al. Trisomy 18 and trisomy 13: Treatment and management decisions. NeoReviews 2012; 13: e40–e48.
23. Catlin A. Transition from curative efforts to purely palliative care for neonates: does physiology matter? Adv Neonatal Care 2011; 11 (3): 216–222.
24. Wu J, Springett A, Morris JK. Survival of trisomy 18 (Edwards syndrome) and trisomy 13 (Patau syndrome) in England and Wales: 2004–2011. Am J Med Genet A 2013; 161(10): 2512–2518.
25. Nelson KE, Hexem KR, Feudtner C. Inpatient hospital care of children with trisomy 3 and trisomy 18 in the United States. Pediatrics 2012; 129 : 869–876.
26. Bruns DA, Martinez A. An analysis of cardiac defects and surgical interventions in 84 cases with full trisomy 18. Am J Med Genet A 2016; 170 (2): 337–343.
27. Maeda J, Yamagishi H, Furutani Y, et al. The impact of cardiac surgery in patients with trisomy 18 and trisomy 13 in Japan. Am J Med Genet A 2011; 155 : 2641–2646.
28. Bruns DA, Campbell E. Twenty-two long-term survivors with full trisomy 18: Presenting and current medical conditions. Am J Med Genet Part A 2014; 164 : 610–619.
29. Courtwright AM, Laughon MM, Doron MW. Length of life and treatment intensity in infants diagnosed prenatally or postnatally with congenital anomalies considered to be lethal. J Perinatol 2011; 31 : 387–391.
30. Raczkowski JW, Daniszewska B, Paradecka A. Edwards syndrome in a 6-year old girl. Neuro Endocrinol Lett 2010; 31 (1): 43–46.
31. Fenton LJ. Trisomy 18 and 13: quality of life: treading “softly”. Am J Med Genet A 2011; 155 : 1527–1528.
32. McGraw MP, Perlman JM. Attitudes of neonatologists toward delivery room management of confirmed trisomy 18: potential factors influencing a changing dynamic. Pediatrics 2008; 121 (6): 1106–1110.
33. Wilfond BS, Carey JC. Parental requests for interventions in children with lethal conditions. In: Clinical Ethics in Pediatrics: A Case-Based Textbook. Cambridge: University Press Cambridge, 2011 : 174–180.
34. Janvier A, Farlow B, Barrington KJ. Parental hopes, interventions, and survival of neonates with trisomy 13 and trisomy 18. Am J Med Genet Part 2016: Semina Med Genet 2016 Sept; 172 (3): 279–287.
35. Prager K, Hardart G. Ethical challenges posed by trisomy 18 infants. Isr Med Assoc J 2012; 14 (8): 498–500.
36. Bruns DA. Neonatal experiences of newborns with full trisomy 18. Adv Neonatal Care 2010; 10 (1): 25–31.
37. Barnum B. Benevolent injustice: a neonatal dilemma. Adv Neonatal Care 2009; 9 (3): 132–136.
38. Catlin A. Trisomy 18 and choices. Adv Neonatal Care 2010; 10 (1): 32–33.
39. Harrison H. The offer they can’t refuse: parents and perinatal treatment decisions. Semin Fetal Neonatal Med 2008; 13 (5): 329–334.
40. Yates AR, Hoffman TM, Shepherd E, et al. Pediatric sub-specialist controversies in the treatment of congenital heart disease in trisomy 13 or 18. J Genet Couns 2011; 20 (5): 495.
41. Janvier A, Farlow B, Wilfond BS. The experience of families with children with trisomy 13 and 18 in social networks. Pediatrics 2012; 130 (2): 293–298.
42. Santucci G, Battista V, Kang TI. Caring for the infant with trisomy 18: The bioethical implications of treatment decisions on nurses. J Hosp Palliat Nurs 2014; 16 (7): 388–393.
43. American Academy of Pediatrics. Committee on Bioethics and Committee on Hospital Care. Palliative care for children. Pediatrics 2000; 106 : 351–371.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics
2021 Issue 6-
All articles in this issue
- Effect of gastroesophageal reflux on cilia in upper respiratory tract in children
- Systemic lupus erythematosus with hematological symptoms – a multifaceted disease: case reports and summary for clinical practice
- BRDLÍKOVA CENA
- Narcolepsy in childhood – our experiences
- Not every hemangioma is a hemangioma...
- Iron deficiency in pediatric patients with congenital heart defects
- Edwards syndrome – phenotype, prognosis, ethical attitudes, professional and palliative care
- Jak komunikovat s pacienty a jejich rodiči na dálku a mít vše efektivně hrazeno?
- Specifics of care for tracheostomized pediatric patients – relevant topic
- List redakcii
- Mavena B12 přináší nové možnosti v léčbě chronických zánětů kůže
- Německá pediatrie v Praze – profesor Dr. med. Berthold EPSTEIN (1890–1962) (přednosta německé univerzitní kliniky v Praze na Karlově v letech 1932–1939 a po válce primář Dětského oddělení Nemocnice Bulovka v Praze)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Edwards syndrome – phenotype, prognosis, ethical attitudes, professional and palliative care
- Not every hemangioma is a hemangioma...
- Systemic lupus erythematosus with hematological symptoms – a multifaceted disease: case reports and summary for clinical practice
- Specifics of care for tracheostomized pediatric patients – relevant topic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

