-
Medical journals
- Career
Fokální nodulární hyperplazie u dětí – diagnostika a léčba
: S. Jaroščiaková 1; B. Frýbová 2; M. Kynčl 3; M. Grega 4; J. Šnajdauf 2; M. Rygl 2
: III. chirurgická klinika 1. LF Univerzity Karlovy a FN Motol, Praha 1; Klinika dětské chirurgie 2. LF Univerzity Karlovy a FN Motol, Praha 2; Klinika zobrazovacích metod 2. LF Univerzity Karlovy a FN Motol, Praha 3; Ústav patologie a molekulární medicíny 2. LF Univerzity Karlovy a FN Motol, Praha 4
: Čes-slov Pediat 2018; 73 (8): 469-474.
:
Fokální nodulární hyperplazie (FNH) je druhý nejčastější benigní nádor jater u dětí. Je tvořena hyperplastickými uzly hepatocytů, které jsou oddělené fibrózními pruhy. Nemá maligní potenciál a komplikace jsou vzácné. Až polovina pacientů má asymptomatický průběh a FNH je náhodně zjištěna při vyšetření z jiného důvodu. Patogeneze FNH není zcela jasná, pravděpodobně vzniká jako hyperplastická odpověď hepatocytů na vrozenou nebo získanou cévní anomálii. O získaném původu svědčí i rostoucí incidence FNH u dětí, které v minulosti podstoupily onkologickou léčbu pro malignitu.
Vzhledem k vysokému výskytu malignit u primárních nádorů jater má přesná diagnóza FNH zásadní význam. Definitivní diagnózu lze stanovit pomoci zobrazovacích metod. Metodou volby je magnetická rezonance s použitím hepatobiliární kontrastní látky. Histologická verifikace pomocí perkutánní nebo otevřené biopsie je nutná u atypického nálezu. Konzervativní postup je možno uplatnit u asymptomatických pacientů s jednoznačnou diagnózou FNH. Naopak chirurgická terapie je indikována při diagnostických rozpacích a u dětí se symptomatickou a progredující lézí.
KLÍČOVÁ SLOVA:
fokální nodulární hyperplazie, děti, magnetická rezonance, hepatobiliární kontrastní látka
ÚVOD
Fokální nodulární hyperplazie (FNH) je po hemangiomu druhý nejčastější benigní tumor jater. Nemá maligní potenciál a komplikace jako krvácení a ruptura jsou extrémně vzácné [1, 2]. Onemocnění poprvé popsal americký patolog profesor Edmondson v roce 1956. V literatuře se můžeme setkat s různou terminologií – solitární hyperplastický uzel, fokální cirhóza, cholangiohepatom, hepatický hamartom, smíšený adenom, benigní hepatom. FNH je nejčastěji užívaným pojmem, který je od roku 1975 uznáván Světovou zdravotnickou organizací [3–5].
Výskyt
V dětském věku se FNH vyskytuje vzácně. Tvoří 2 % všech primárních jaterních tumorů. Postihuje 0,02 % dětské populace a stejně jako u dospělých se vyznačuje ženskou predominancí [6, 7]. Vyskytuje se v kterémkoliv věku, včetně prenatálních a neonatálních forem [8, 9]. Raritně se vyskytuje konkomitantně s jinými tumory jater, jako je hemangiom, adenom, hepatoblastom, hepatocelulární karcinom nebo metastázy [10–14].
Etiopatogeneze
Přesná příčina není jasná. FNH nejspíše vzniká jako hyperplastická odpověď hepatocytů na vrozenou nebo získanou cévní anomálii – neřadí se mezi léze neoplastické [15]. Podle některých hypotéz vznik FNH je indukován cirkulační poruchou na podkladě trombózy, hyperplazie intimy, zvýšeného tlaku v sinusoidech, zvýšeného krevního průtoku atd. Tyto teorie podporuje i možná asociace s některými stavy jako např. ageneze portální žíly, vrozený nebo chirurgický portosystémový shunt, transplantace jater, hereditární teleangiektázie [2, 16–18].
Recentní zahraniční studie dokumentují rostoucí incidenci FNH u dětí, které v minulosti podstoupily onkologickou léčbu pro maligní onemocnění radioterapií, chemoterapií, transplantací kostní dřeně nebo kmenových buněk. U těchto dětí je incidence FNH ještě vyšší než v obecné dětské populaci (0,045 %). Podle Icher-De Bouyn a kol. je FNH nejvíce patrná u neuroblastomu. Její vznik je daný typem léčby, ale ne typem malignity. V této souvislosti jsou za nejvíce hepatotoxické cytoredukční látky považovány melphalan a busulphan [7, 19]. Studie také ukazují, že FNH se objevuje v pozdějším období od stanovení primární diagnózy malignity než metastázy (medián u FNH 92,9 měsíců vs. medián 18,5 mě-síců u metastáz, p <0,0001) [20]. Na druhé straně se neprokázalo, že vznik FNH ovlivňuje užívaní perorálních kontraceptiv [21].
Histopatologie
FNH je dobře ohraničená neopouzdřená léze. Může být solitární nebo vícečetná a dosahovat velikosti několika mm až desítek centimetrů. Je tvořená hyperplastickými uzly jaterní tkáně (obr. 1). Na řezu je patrná centrální jizva hvězdicovitého tvaru, ze které radiálně vycházejí fibrózní septa oddělující jednotlivé uzly hepatocytů (obr. 2a). U menších lézí jizva může chybět. Histologicky jsou uzly tvořené normálně funkčními hepatocyty, které jsou mírně větší a s lehce světlejší cytoplazmou oproti normálnímu jaternímu parenchymu v okolí. Jizva a fibrózní septa jsou tvořené kolagenním vazivem, obsahují velké silnostěnné arterie, proliferace žlučových kanálků a drobných žlučovodů a často lymfocytární infiltrát (obr. 2b). Normální interlobulární žlučovody a portální pole chybí [1].
1. Peroperační nález fokální nodulární hyperplazie (FNH) levého jaterního laloku u 10letého chlapce.
Fig. 1. Peroperative image of focal nodular hyperplasia (FNH) in 10-year-old boy.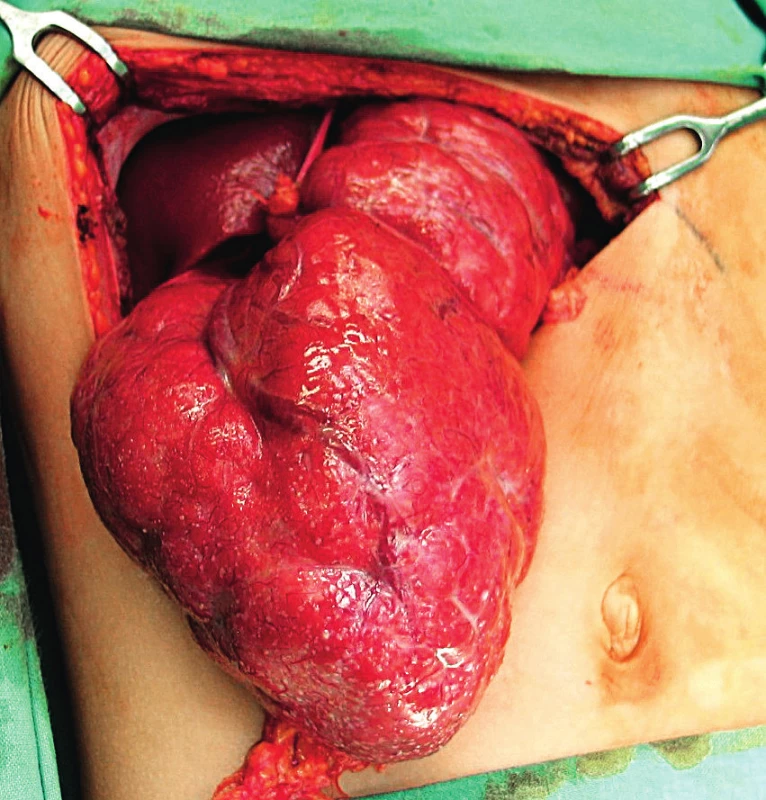
Obr. 2a. Řez FNH s centrální jizvou.
Fig. 2a. Macroscopic view of FNH with central scar.
Obr. 2b. Barvení hematoxylin-eozinem. V mikroskopickém obrazu je patrná centrální jizva (➡) s cévami většího kalibru (★), nodulární uspořádání léze s vazivovými septy (►), ve kterých proliferují drobné žlučovody a mírný chronický zánět, portální pole chybí.
Fig. 2b. Hematoxylin and eosin staining. Microscopically, FNH is characterized by central scar (➡) with large arteries (★), hyperplastic liver nodules that are separated by fibrous bands (►). The bands conntain ductular proliferation, chronic inflamation without portal fields.
Obr. 2c. Imunohistochemické vyšetření GS s mapovitou pozitivitou hepatocytů FNH.
Fig. 2c. Glutamine synthetase imunostaning of FNH with map-like pattern.
Klinické projevy
Až polovina pacientů je asymptomatická a léze je náhodně zjištěna při vyšetření z jiného důvodu. Větší léze se projevují nespecifickými bolestmi břicha z útlaku okolních struktur či hmatnou rezistencí.
DIAGNOSTIKA
Základem diagnostiky je anamnéza (onkologická léčba, sdružené onemocnění), objektivní a biochemické vyšetření, zobrazovací metody a histologie. Jaterní testy jsou obvykle v mezích normy, i když sérová hladina aminotransferáz a gamma-glutamyltransferázy může být lehce zvýšená [1, 22, 23]. Onkomarkery včetně alfa-fetoproteinu jsou negativní. FNH má charakteristický obraz při zobrazovacích vyšetřeních a diagnóza může být stanovena definitivně i bez histologické verifikace.
Ultrazvuk
Ultrazvuk je považován za standardní iniciální zobrazovací metodu, která poskytuje nespecifické informace o počtu, velikosti, charakteru léze a zbylého jaterního parenchymu. FNH je dobře ohraničená homogenní léze s variabilní echogenitou, která může být izoechogenní, hypoechogenní nebo hyperechogenní k jaternímu parenchymu [24]. Během duplexní a barevné dopplerovské sonografie se nekonstantně zobrazuje tzv. spoke-wheel sign (obr. 3), který odpovídá centrifugálnímu uspořádaní arterií vycházejících z centra léze do periferie [25]. Další možnosti je kontrastní ultrazvuk (CEUS – Contrast-Enhanced Ultrasound), který je rozšířeným a často definitivním diagnostickým vyšetřením FNH v dospělé populaci. Principem je intravenózní aplikace suspenze mikrobublin plynu, které zvyšují echogenitu tkáně, ve které jsou přítomné. Po aplikaci kontrastní látky (KL) se rychle objevuje výše zmíněný tzv. spoke-wheel sign.
Obr. 3. Spoke-wheel obraz.
Fig. 3. Spoke-wheel sign.
Během posledních desetiletí je CEUS využíván v některých evropských a světových dětských centrech [26–29]. V České republice a v Evropě je registrována KL druhé generace SonoVue® (Bracco, Milano, Itálie), která není schválena pro nitrožilní použití v dětské populaci [30]. Do roku 2017 bylo v zahraniční literatuře publikovaných několik prací s 1048 dětí, u kterých byl proveden CEUS s nitrožilně podanou KL celkem 1320krát. Ve dvou případech se objevily závažné nežádoucí účinky (anafylaktický šok a arteriální hypotonie, zvracení, flushing ve druhém případě) a mírné přechodné nežádoucí příznaky u 11 dětí. Podle studií je CEUS pro dětí bezpečné a diagnosticky výtěžné vyšetření [31]. Hlavní výhodou je absence radiační zátěže, možnost vyhnout se celkové anestezii a nežádoucím účinkům nefrotoxických KL. Navzdory různé legislativě v jednotlivých státech off-label preskripce léků u dětí je relativně běžný fenomén (Evropa 39 %, celosvětově 49 % léků) [32, 33]. Vítaným prvním krokem k možnému akceptování této techniky v evropských zemích by mohla být recentní autorizace nitrožilní KL Lumason® (výrobní název SonoVue® v USA) u CEUS jater u dětí Americkou společností pro kontrolu léčiv (FDA – Food and Drug Administration) [34].
Výpočetní tomografie (CT)
Použití CT v diagnostice FNH má klesající tendenci. Při nativním zobrazení je léze dobře ohraničená izo - až lehce hypodenzní oproti jaternímu parenchymu. Po podání KL se v arteriální fázi prudce zvyšuje denzita léze, v portální a pozdní fázi se stává izodenzní k jaternímu parenchymu. Centrální jizva je před podáním kontrastní látky hypodenzní, postkontrastně je izo - nebo hyperdenzní a vyskytuje se asi u poloviny lézí [35–36].
Magnetická rezonance (MR)
Ve srovnání s UZ a CT má MR nejvyšší senzitivitu (70–82,6 %) a specificitu (98 %) v detekci FNH [36, 37]. Léze je typicky homogenní izo - či hypointenzní v T1 vážených obrazech (T1) a lehce hyper - či izointenzní v T2 vážených obrazech (T2) (obr. 4). Jedním z nejvíce charakteristických znaků je centrální jizva, která je přítomna u 80 % lézí (vs. u 50–70 % lézí na CT). V T1 je hypointenzní, hyperintenzní v T2 a postkontrastně se sytí v pozdní fázi (38–41).
Obr. 4. MR jater u 10leté pacientky s FNH pravého laloku jater. Před podáním KL je FNH izointenzní v T2 (A) a hypointenzní v T1 vážených obrazech (B). Postkontrastně se homogenně syti (C) a v pozdní fázi zůstava izointenzní k jaternímu parenchymu (D). Centrální jizva je hyperintenzní v T2, hypointenzní v T1 obrazech a sytí se v pozdní fázi.
Fig. 4. Magnetic resonance imaging of liver in 10-year-old girl with FNH of right liver lobe. The lesion is isointense on precontrast T2-weighted images (A) and hypointense on T1-weighted images (B). On contrast- enhanced MRI the mass shows homogeous enhancement (C) and is isointense to liver parenchyma on delay sequences (D). The central scar is hyperintense on T2-weighted image, hypointense on T1-weighted images with enhancement on delayed phase images.
V současnosti metodou volby v diagnostice FNH je MR s použitím hepatobiliární kontrastní látky. Jedná se o smíšenou extracelulární KL, která je vychytávána funkčními hepatocyty FNH v arteriální fázi, kdy se léze nápadně homogenně sytí (v závislosti na přítomnosti OATP – transportérů organických aniontů) [42]. Během pozdní hepatobiliární fáze (20–40 minut od aplikace KL) dochází ke zpomalené exkreci KL abnormálními žlučovými kanálky a FNH se protrahovaně sytí [43]. K dispozici jsou dvě KL, kyselina gadobenová (Multihance®, Berlín, Německo) a kyselina gadoxetová (Primovist®, Miláno, Itálie) [30]. V zahraničí se běžně obě KL u dětí používají, ale stejně jako CEUS je jejich použití off-label. Studie Schneidera a Gellera ukazují, že vyšetření je bezpečné a efektivní v diagnostice FNH u dětí [44, 45]. Využití narůstá nejen pro chybějící radiační zátěž, ale také pro lepší diferenciaci od maligních tumorů a metastáz. Nevýhodou je prodloužený zobrazovací čas a tím i potřeba sedace či anestezie u menších dětí.
Diferenciální diagnostika magnetickou rezonancí
Adenomy a hepatocelulární karcinom (HCC) se v arteriální fázi rychle sytí, ale na rozdíl od FNH v hepatobiliární fázi nastává tzv. rychlý washout a obě léze jsou hypointenzní vůči zbylému parenchymu. Centrální jizva může být přítomná také u fibrolamelárního HCC, ale je hypointenzní na T1 i T2 obrazech [46]. U metastáz a adenomů centrální jizva chybí. Krvácení a maligní transformace jsou typické pro adenomy.
Biopsie a histologické vyšetření
Perkutánní biopsie je miniinvazivní technika ke stanovení definitivní diagnózy u dětí s atypickým nálezem na MR. Její diagnostická přesnost je limitována. V případě nejasného nálezu nebo nereprezentativního vzorku by měla být doplněna otevřená biopsie. Diagnostika FNH může být složitá i v resekovaném vzorku, pokud jeden z hlavních znaků chybí, nebo je nenápadný (centrální jizva, proliferace žlučovodů), FNH je steatotická a noduly jsou malé.
Bylo prokázáno, že imunohistochemický průkaz glutamin syntetázy (GS) je užitečným markerem pro upřesnění diagnózy FNH a odlišení od HCA a uzlů cirhotické jaterní tkáně. GS je klíčovým enzymem metabolismu dusíku, který katalyzuje syntézu glutaminu z glutamátu. Imunohistochemický průkaz GS u FNH je mapovitý (tzv. map-like vzor) a chybí u hepatocytů v blízkosti fibrózních pruhů, které obsahují abnormální cévy a žlučovody (obr. 2c). Exprese beta-kateninu je membránová jako u normálních hepatocytů, naproti tomu u HCC je přesun exprese do jádra [1, 47, 48].
TERAPIE
V současnosti neexistují doporučené postupy pro léčbu FNH u dětí. Konzervativní management je zažitou strategií v dospělé populaci, u dětí je vhodný jen u asymptomatických pacientů s jasně stanovenou diagnózou pomocí zobrazovacích metod nebo na základě histologického vyšetření. Na druhé straně aktivní přístup v podobě radikální resekce je žádoucí u symptomatické FNH, při progresi velikosti nebo v případě, kdy nelze vyloučit maligní původ onemocnění.
Embolizace a vaskulární okluze jsou další možností v léčbě objemných symptomatických a neresekabilních lézí [49]. Zmenšením velikosti je možno provést resekci ve druhé době nebo při vymizení obtíží pokračovat ve sledování. U malých centrálně uložených FNH je alternativou radiofrekvenční ablace. O výsledcích a efektu posledně zmíněných terapeutických modalit v literatuře není dostatek informací a tento přístup u dětí je nutno ověřit pomocí dalších studií.
Vlastní zkušenosti
Za období 25 let (1992–2016) bylo na Klinice dětské chirurgie ve Fakultní nemocnici Motol léčených celkem 15 dětí s diagnózou FNH. Děvčat bylo 9, chlapců 6, s průměrným věkem 7,7 let a rozměrem léze 7,2 cm. Léze byla náhodně zjištěna u 7 dětí (47 %) a nejčastějším klinickým příznakem byla bolest břicha a hmatná rezistence. Jaterní testy byly lehce zvýšené ve 2 případech a u dalších 2 pacientů do věku šest měsíců byl zvýšený AFP. Iniciálně všichni pacienti podstoupili UZ břicha a následně CT a/nebo MRI.
Osm z 15 dětí (z toho 75 % chlapců) vyžadovalo primární operaci. Indikací k operaci bylo podezření na malignitu (6/8) a objemná symptomatická léze (2/8). Sedm dětí podstoupilo resekci jater a v jednom případě 13letý chlapec s vícečetným ložiskovým procesem otevřenou biopsii. Výkon a hospitalizace proběhly bez komplikací, pacienti byli propuštěni v průměru 11. den po operaci. Žádný pacient nevyžadoval reoperaci. Medián doby sledování byl 7 let. U zbylých 7 dětí (4 děvčata, 3 chlapci) jsme diagnózu stanovili pomocí zobrazovacích metod. Pacienty jsme pravidelně sledovali (průměrná doba 6,4 let) pomocí ultrazvuku. Velikost léze zregredovala u 2/7 pacientů a stabilní byla u jednoho pacienta. Léze se zvětšovala u 4 dětí, z nich 2 vyžadovaly resekci jater pro rozvoj bolesti břicha po 5 a 4 letech od stanovení diagnózy. Všichni pacienti jsou zdraví a bez obtíží. V našem souboru ani jeden pacient v minulosti neabsolvoval onkologickou terapii.
ZÁVĚR
Fokální nodulární hyperplazie u dětí je vzácný benigní tumor jater, který je často náhodně zjištěn při vyšetření. Nemá maligní potenciál a komplikace jsou vzácné. Za metodu volby v diagnostice je považována MR s použitím hepatobiliární KL. Biopsie by měla být provedena při atypickém nálezu FNH na MR.
Děti s jasnou diagnózou FNH lze léčit konzervativně. Chirurgická terapie je indikována u pacientů se symp-tomatickou a progredující FNH či při diagnostických rozpacích. U centrálně uložených symptomatických a neresekabilních lézí je možné zvážit embolizaci.
MUDr. Silvia Jaroščiaková
III. chirurgická klinika 1. LF Univerzity Karlovy
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: silvia.jarosciakova@fnmotol.cz
Sources
1. Nguyen B, Flejou J-F, Terris B, et al. Focal nodular hyperplasia of the liver: a comprehensive pathologic study of 305 lesions and recognition of new histological forms. Am J Surg Pathol 1999; 23 : 1441–1458.
2. Wanless IR, Mawdsley C, Adams R. On the pathogenesis of focal nodular hyperplasia of the liver. Hepatology 1985; 5 : 1194–1200.
3. Patton RJ. Hamartoma of the liver. Ann Surg 1948; 127 : 180–186.
4. Ziegler MM, Azzizkhan RG, Allmen DV, Weber TR. Operative Pediatric Surgery. New York: McDraw-Hill, 2003 : 1233–1234.
5. Gibson JB, Sobin LH. Histological Typing of Tumours of the Liver, Biliary Tract, and Pancreas. Geneva: World Health Organization, 1978.
6. Greenberg M, Filler RM. Hepatic tumors. In: Pizzo PA, Poplack DG (eds). Principles and Practice of Pediatric Oncology. Philadelphia: Lippincott Williams & Wilkins, 1989, 569–582.
7. Bouyn CI, Leclere J, Raimondo G, et al. Hepatic focal nodular hyperplasia in children previously treated for a solid tumor. Incidence, risk factors, and outcome. Cancer 2003; 97 : 3107–3113.
8. Okamura N, Nakadate H, Ishida K, et al. Telangiectatic focal nodular hyperplasia of the liver in the perinatal period: case report. Pediatric and Developmental Pathology 2005; 8 (5): 581–586.
9. Petrikovsky BM, Cohen HL, Scimeca P, Bellucci E. Prenatal diagnosis of focal nodular hyperplasia of the liver. Prenat Diagn 1994; 14 (5): 406–409.
10. Dimitroulis D, Lainas P, Charalampoudis P, et al. Co-existence of hepatocellular adenoma and focal nodular hyperplasia in a young female. World J Hepatol 2012; 4 (11): 314–318.
11. Gong Y, Chen L, Qiao ZW, Ma YY. Focal nodular hyperplasia coexistent with hepatoblastoma in a 36-d-old infant. World J Gastroenterol 2015; 21 (3): 1028–1031.
12. Lautz T, Tantemsapya N, Dzakovic A, Superina R. Focal nodular hyperplasia in children: clinical features and current management practice. J Pediatr Surg 2010; 45 : 1797–1803.
13. Toshikuni N, Kawaguchi K, Miki H, et al. Focal nodular hyperplasia coexistent with hemangioma and multiple cysts of the liver. J Gastroenterol 2001; 36 : 206–211.
14. Nisar PJ, Zaitoun AM, Damera A, et al. Metastatic rectal adenocarcinoma to the liver associated with focal nodular hyperplasia. J Clin Pathol 2002; 55 : 967–969.
15. Kumagai H, Masuda T, Oikawa H, et al. Focal nodular hyperplasia of the liver: direct evidence of circulatory disturbances. J Gastroenterol Hepatol 2000; 15 (11): 1344–1347.
16. Ra HS, Kaplan JB, Lassman RC. Focal nodular hyperplasia after orthotopic liver transplantation. Liver Transpl 2010; 16 : 98–103.
17. Abella SF, Branchereau S, Lambert V, et al. Complications of congenital portosystemic shunts in children: therapeutic options and outcomes. J Pediatr Gastroenterol Nutr 2010; 51 (3): 322–330.
18. Guérin F, Blanc T, Gauthier F, et al. Congenital portosystemic vascular malformations. Semin Pediatr Surg 2012; 21 (3): 233–244.
19. Méresse V, Hartmann O, Vassal G, et al. Risk factors for hepatic veno-occlusive disease after high-dose busulfan - containing regimens followed by autologous bone marrow transplantation: a study in 136 children. Bone Marrow Transplant 1992; 10 : 135–141.
20. Smith EA, Salisbury S, Martin R, Towbin AJ. Incidence and etiology of new liver lesions in pediatric patients previously treated for malignancy. AJR 2012; 199 : 186–191.
21. Mathieu D, Kobeiter H, Maison P, et al. Oral contraceptive use and focal nodular hyperplasia of the liver. Gastroenterology 2001; 118 : 560–564.
22. Stocker JT, Ishak KG. Focal nodular hyperplasia of the liver: a study of 21 pediatric cases. Cancer 1981; 48 : 336–345.
23. Cheon JE, Kim WS, Kim IO, et al. Radiological features of focal nodular hyperplasia of the liver in children. Pediatr Radiol 1998; 28 : 878–883.
24. Chung EM, et al. From the archives of the AFIP: pediatric liver masses: radiologic-pathologic correlation part 1. Benign tumors. Radiographics 2010; 30 (3): 801–826.
25. Shamsi K, et al. Focal nodular hyperplasia of the liver: radiologic findings, Abdom Imaging 1992; 18 (1): 32–38.
26. Rosado E, Riccabona M. Off-label use of ultrasound contrast agents for intravenous applications in children: analysis of the existing literature. J Ultrasound Med 2016; 35 (3): 487–496.
27. Torres A, Koskinen SK, Gjertsen H, et al. Contrast-enhanced ultrasound using sulfur hexafluoride is safe in the pediatric setting. Acta Radiol 2017; 58 (11): 1395–1399.
28. Yusuf GT, Sellars ME, Deganello A, et al. Retrospective analysis of the safety and cost implications of pediatric contrast - enhanced ultrasound at a single center. AJR Am J Roentgenol 2017; 208 (2): 446–452.
29. Knieling F, Strobel D, Rompel O, et al. Spectrum, applicability and diagnostic capacity of contrast-enhanced ultrasound in pediatric patients and young adults after intravenous application – retrospective trial. Ultraschall Med 2016; 37 : 619–626.
30. Souhrn údajů o přípravku. www.sukl.cz.
31. Ntoulia A, Anupindi SA, Darge K, Back SJ. Applications of contrast-enhanced ultrasound in the pediatric abdomen. Abdom Radiol 2018; 43 (4): 948–959.
32. Conroy S, Choonara I, Impicciatore P, et al. Survey of unlicensed and off label drug use in paediatric wards in european countries. European network for drug investigation in children. BMJ 2000; 320 : 79–82.
33. Lindell-Osuagwu L, Korhonen MJ, Saano S, et al. Off-label and unlicensed drug prescribing in three paediatric wards in Finland and review of the international literature. J Clin Pharm Ther 2000; 34 : 277–287.
34. Sidhu PS, Cantisani V, Deganello A, et al. Roleof contrast-enhanced ultrasound (CEUS) inpaediatric practise: An EFSUMB position statement. Ultraschall Med 2017; 38 (4): 446.
35. Carlson SK, Johnson CD, Bender CE, Welch TJ. CT of focal nodular hyperplasia of the liver. AJR Am J Roentgenol 2000; 174 (3): 705–712.
36. Mortele KJ, Praet M, Van Vlierberghe H, et al. CT and MR imaging findings in focal nodular hyperplasia of the liver: Radiologic-pathologic correlation. AJR Am J Roentgenol 2000; 175 : 687–692.
37. Valentino PL, Ling SC, Ng VL, et al. The role of diagnostic imaging and liver biopsy in the diagnosis of focal nodular hyperplasia in children. Liver Int 2014; 34 (2): 227–234.
38. Vilgrain V, Flejou JF, Arrive L, et al. Focal nodular hyperplasia of the liver: MR imaging and pathologic correlation in 37 patients. Radiology 1992; 184 : 699–703.
39. Yang Y, Fu S, Li A, et al. Management and surgical treatment for focal nodular hyperplasia in children. Pediatr Surg Int 2008; 24 : 699–703.
40. Jha P, Chawla SC, Tavri S, et al. Pediatric liver tumors –a pictorial review. Eur Radiol 2009; 19 : 209–219.
41. Hussain SM, Terkivatan T, Zondervan PE, et al. Focal nodular hyperplasia: findings at state-of-the-art MR imaging, US, CT, and pathologic analysis. Radiographics 2004; 24 : 3–17.
42. Yoneda N, Matsui O, Kitao A, et al. Hepatocyte transporter expression in FNH and FNH-like nodule: correlation with signal intensity on gadoxetic acid enhancedmagnetic resonance images. Jpn J Radiol 2012; 30 : 499–508.
43. Boulahdour H, Cherqui D, Charlotte F, et al. The hot spot hepatobiliary scan in focal nodular hyperplasia. J Nucl Med 1993; 34 : 2105–2110.
44. Schneider G, Schürholz H, Kirchin MA, et al. Safety and adverse effects during 24 hours after contrast-enhanced MRI with gadobenate dimeglumine (MultiHance) in children. Pediatr Radiol 2013; 43 : 202–211.
45. Geller J, Kasahara M, Martinez M, et al. Safety and efficacy of gadoxetate disodium–enhanced liver MRI in pediatric patients aged >2 months to <18 years – results of a retrospective, multicenter study. Magn Reson Insights 2016; 9 : 21–28.
46. Corrigan K, Semelka RC. Dynamic contrast-enhanced MR imaging of fibrolamellar hepatocellular carcinoma. Abdom Imaging 1995; 20 : 122–125.
47. Bioulac-Sage P, Laumonier H, Rullier A, et al. Over-expression of glutamine synthetase in focal nodular hyperplasia: a novel easy diagnostic tool in surgical pathology. Liver Int 2009; 29 : 459–465.
48. Bioulac-Sage P, Cubel G, Taouji S, et al. Immunohistochemical markers on needle biopsies are helpful for the diagnosis of focal nodular hyperplasia and hepatocellular adenoma Subtypes. Am J Surg Pathol 2012; 36 (11): 1691–1699.
49. Oliveira C, Gil-Agostinho A, Gonçalves I, Noruegas MJ. Transarterial embolisation of a large focal nodular hyperplasia, using microspheres, in a paediatric patient. BMJ Case Rep 2015; Jul 10.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2018 Issue 8-
All articles in this issue
- Focal nodular hyperplasia in children – diagnostics and treatment
- Bone remodeling – the basic condition for treatment of forearm fractures in the growing skeleton
- Laparoscopy in childhood – appendectomy, spleen preserving surgery, hepatobiliary surgery
- Necrotizing enterocolitis in the Perinatological Centre of the University Hospital Hradec Králové in 2010–2017
- The Family Eating and Activity Habits Questionnaire – Czech translation and verification questionnaire clarity
- The current incidence of coronary heart disease risk factors in children in the Czech Republic in 2016
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Focal nodular hyperplasia in children – diagnostics and treatment
- Necrotizing enterocolitis in the Perinatological Centre of the University Hospital Hradec Králové in 2010–2017
- Bone remodeling – the basic condition for treatment of forearm fractures in the growing skeleton
- The current incidence of coronary heart disease risk factors in children in the Czech Republic in 2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

