-
Medical journals
- Career
Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I)
Authors: P. Pokorná 1; J. Záhora 3; J. Chládek 2; V. Vobruba 1; I. Selke-Krulichová 3; Š. Studená 2; J. Chládková 4; J. Martinková 2
Authors‘ workplace: Jednotka intenzivní a resuscitační péče, Klinika dětského a dorostového lékařství UK 1. LF a VFN, Praha přednosta prof. MUDr. J. Zeman, DrSc. 1; Ústav farmakologie, Lékařská fakulta Univerzity Karlovy, Hradec Králové přednosta doc. MUDr. S. Mičuda, Ph. D. 2; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Karlovy, Hradec Králové přednosta doc. Ing. J. Hanuš, Ph. D. 3; Dětská klinika Fakultní nemocnice, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 4
Published in: Čes-slov Pediat 2013; 68 (4): 219-233.
Category: Original Papers
Overview
Účel studie:
Cílem je predikce dávkování gentamicinu (Ge) s účinkem závislým na plazmatické koncentraci (Cpl), k navození cílového rozsahu ustálené údolní Cpl Ctrough,3 (0,5–2,0 mg/l) a vrcholové Cpeak4 (5,0–10,0 mg/l), tj. 0,5 hod před čtvrtou a 1 hodinu po startu čtvrté 30minutové i.v. infuze. Cpeak určuje baktericidii, Ctrough snižuje neurotoxicitu a nefrotoxicitu.Metody:
Analýza Ge fluorescenční polarizační imunoesejí (TDx Analyzer; Abbott Laboratories, Abbott Park Illinois). Fitováním parametrů 2kompartm. modelu se čtyřmi Cpl Ge byly odhadnuty: distribuční objem (Vd1) a systémová clearance (Cl1) pomocí MW-Pharm 3.15 (Mediware, Groningen, NL). Pokud simulace Cpl při standardním dávkování (4 mg/kg/24–48 hod podle GV a porodní hmotnosti) neprokázala cílové Cpl, dávkování počínaje intervalem po 2. infuzi bylo změněno podle kinetických parametrů. Ctrough,3 a Cpeak4 byly ověřeny analýzou.Výsledky:
U 54 novorozenců (32 velmi nedonošených, GV <34. týden a 22 mírně nedonošených, GV <38. týden) Cpeak,1 (po první infuzi) dosáhla cílového rozmezí v 80 %, Ctrough,1 <2 mg/l u všech. Standardní dávkování bylo upraveno v 85 %, zejména snížením rychlosti (65 %). Cílová Cpeak,4 byla dosažena u 69 % velmi nedonošených a 68 % mírně nedonošených, Cpeak,4 <5 mg/l u 31 % velmi nedonošených a 32 % mírně nedonošených, cílová Ctrough,3 byla dosažena u všech s 1 výjimkou. Za příčinu rozdílu Cpeak,4 predikované a ověřené byla označena retence tekutin v čase od první do čtvrté infuze Ge. Při perzistujícím ductus arteriosus nabyla až +374,0 (45,1) ml/kg.Závěr:
Kineticky řízená léčba Ge u septických novorozenců v prvním týdnu života na základě Cpl po první infuzi je žádoucí zejména u velmi nedonošených novorozenců. K dosažení baktericidní Cpeak,4 je třeba vycházet z retence tekutin, doprovázející kritický stav.Klíčová slova:
novorozenec, sepse, gentamicin, kineticky řízené dávkování, perzistující ductus arteriosusÚvod
Gentamicin (Ge) je aminoglykosidové baktericidní antibiotikum používané u novorozenců v léčbě sepse v kombinaci s betalaktámovými antibiotiky [1, 2, 3]. Výhodou je rychlá baktericidie, zejména proti gramnegativním bakteriím, a nízké pořizovací náklady na antibiotickou léčbu [4]. Účinnost a toxicita léčby závisejí více na plazmatické koncentraci (Cpl) nežli na dávce [5]. Baktericidie je určena vrcholovou Cpl ( Cpeak) [6] a MIC (minimální inhibiční koncentrace, pro daný mikroorganismus stanovená in vitro). Baktericidní Cpeak gentamicinu se pohybuje v rozmezí 5–10 mg/l a poměr Cpeak/MIC mezi hodnotami 8–12 [6]. Pro aminoglykosidy je typický úzký rozsah terapeutické Cpl, tj. rozdíl mezi koncentrací, která determinuje minimální účinek a toxicitu (zejména neurotoxicitu a nefrotoxicitu). Toxicita gentamicinu je spojována s opakovanou expozicí a prodloužením doby terapie a redukována, jestliže Cpl stanovována 30 minut před následující infuzí (Ctrough) je <2 mg/l, zatímco přechodně zvýšená hodnota Cpeak>12 mg/l riziko toxicity pravděpodobně nezvyšuje [1]. Nevýhodou aminoglykosidů je značná interindividuální a intraindividuální variabilita v kinetice i antibakteriální účinnosti hlavně u kriticky nemocných pacientů [7]. Variabilita je připisována faktorům (kovariátám), které významně ovlivňují kinetiku aminoglykosidů. Široký distribuční objem (Vd) a nízká clearance byly opakovaně popisovány u dospělých pacientů po chirurgickém zákroku i u septických nemocných včetně novorozenců [8, 9]. Rychle se měnící Vd aminoglykosidů je připisován velkému objemu tekutin, který je součástí protokolu léčby sepse [10] nebo retenci tekutin – homeostatické odpovědi na multiorgánové selhání. Naopak snížení Vd aminoglykosidů a zrychlení clearance jsou spojovány s úspěšnou léčbou [11]. U novorozence je také nutné zohlednit vliv maturačních kovariát (viz dále).
Výše zmíněné komplikace léčby jsou indikací pro terapeutické monitorování (TDM), tj. pro postup, který k individuální predikci dávkování využívá znalosti individuálních Cpl léčiv [12]. Protože dosud chybějí spolehlivé znalosti o maturačních a obtížně identifikovatelných patologických kovariátách, které by u TDM zvýšily žádoucí přesnost odhadu dávkování, objevily se názory zpochybňující terapeutický benefit aminoglykosidů jako nejistý až nepředvídatelný [13].
Zmíněnou problematikou u donošených a nedonošených septických novorozenců, léčených gentamicinem v prvním týdnu života jsme se začali zabývat před několika lety a pokračovali v této klinicko-farmakologické analýze [14]. Současná prospektivní otevřená studie rozšiřuje studii předchozí. Věnuje se nedonošeným septickým novorozencům v prvním týdnu věku. Hlavním cílem je ověření spolehlivosti individuální predikce dávkování gentamicinu na základě TDM, vycházejícího z Cpl po první dávce antibiotika, tj. koncentrací zároveň ovlivněných kovariátami – faktory generovanými gestačním věkem (maturační kovariáty), sepsí, perzistujícím ductus arteriosus (PDA) a jinými komorbiditami (patologické kovariáty). Sekundárním cílem je hodnocení tolerability léčby (toxikodynamiky – tj. akutní a pozdní reakce na toxicitu), viz část II.
Metody
Demografická a klinická charakteristika souboru (tab. 1)
Do prospektivní studie (leden 2006 – prosinec 2009) byli zařazeni nedonošení novorozenci, hospitalizovaní na Jednotce intenzivní a resuscitační péče (JIRP) ve Všeobecné fakultní nemocnici, léčení gentamicinem v prvním týdnu života pro suspektní nebo prokázanou sepsi nebo bakteriální pneumonii. Protokol studie byl schválen Etickou komisí Fakultní nemocnice v Hradci Králové a Etickou komisí Všeobecné fakultní nemocnice a UK 1. LF v Praze. Novorozenci byli zařazeni do studie vždy po získání písemného informovaného souhlasu od jednoho rodiče a svědka (zdravotní sestra). Vstupní kritéria pro přijetí do studie byla: prokázaná sepse, suspektní sepse a bakteriální pneumonie. Vylučující kritéria: enterokoková endokarditida, vrozená vada neslučitelná se životem a akutní renální selhání definované jako vstupní hodnota sérové kreatininemie ≥133 μmol/l (≥1,5 mg/dl) s oligurií (výdej moči <1 ml/kg/hod) [15, 16]. Prokázaná sepse byla definována jako soubor klinických příznaků systémové odpovědi na infekci a přítomnost bakteriemie, potvrzené MIC, před začátkem antibiotické terapie nebo později, jestliže nebylo dosaženo očekávaného účinku terapie. Suspektní sepse byla definována jako soubor klinických příznaků, charakteristických pro systémovou odpověď na infekci a neprokázané bakteriemie nebo prokázané ≥5 dnů antibiotické terapie [2]. Klinické příznaky sepse: závažná apnoe, vyžadující nazální kontinuální distenční terapii (NCPAP), umělou plicní bifázickou ventilaci pozitivním přetlakem (BIPAP), vysokofrekvenční oscilační ventilaci (HFOV) nebo inhalaci NO; kapilární návrat ≥4–5 s; změny teploty (>38 °C nebo <36,2 °C); letargie, hypotonie; intolerance potravy; žloutenka. Laboratorní parametry sepse: poměr I/T >0,2, vyhodnocený s přihlédnutím ke GV, absolutní počet leukocytů >25 000 nebo <5000/mm3 a C-reaktivní protein (CRP) >10 mg/l. Pneumonie jako forma zánětlivé systémové odpovědi [17, 18]. Časná sepse se manifestovala během 5–7 dnů po porodu, nejčastěji během prvních 72 hodin, pozdní sepse obvykle po 7 dnech po porodu. Doba antibiotické léčby se řídila klinickými projevy, laboratorními parametry infekce a vymizením bakteriemie. Obvykle trvala 6–10 dnů.
Terapeutický antibiotický režim: gentamicin s ampicilinem 50 mg/kg i.v. nebo kombinace ampicilin/sulbactam 75 mg/kg/den i.v. každých 12 hodin. Dvě iniciální standardní dávky gentamicinu a první dávkovací interval byly odvozeny z porodní tělesné hmotnosti a GV [19], dávkování pokračovalo podle kinetického principu. Cesta podávání: 30minutovou infuzí periferní žílou (Alaris GS/GH/CC programovatelnou pumpou; Cardinal Health, Rolle, Švýcarsko). Vankomycin byl iniciálně kombinován s gentamicinem 10 mg/kg každých 12 hodin i.v. 60minutovou infuzí, pro pozdní sepsi 10 mg/kg každých 8 hod i.v.
Kineticky řízená terapie (obr. 2)
Stanovení gentamicinu. K detekci Cpl gentamicinu po první dávce byly odebrány 4 vzorky krve z centrálního venózního katétru nebo periferního arteriálního katétru (nesloužily k podávání antibiotik). První vzorek pro stanovení vrcholové Cpeak,1 byl odebrán 1 hodinu po startu první infuze, další vzorky byly získány v 6. a 12. hodině (mírně nedonošení) a ve 12. a 24. hodině (velmi nedonošení), čtvrtý vzorek ke stanovení údolní koncentrace 30 min před druhou dávkou (Ctrough,1). Vzorky byly odebírány do standardních EDTA zkumavek, centrifugovány (10 min při 4 °C) během první hodiny po odběru a uchovávány maximálně 2 dny při -20 °C. Gentamicin byl stanovován fluorescenční polarizační imunoesejí (TDx Analyzer; Abbott Laboratories, Abbott Park Illinois). Kvantifikační limit byl 0,3 mg/l, variační koeficient mezi dny dosahoval 4,5 % při 1 mg/l, 2,7 % při 4 mg/l a 2,4 % při 8 mg/l. Kontrola kvality analytické metody byla zajištěna Referenzinstitut fűr Bioanalytik, Bonn, Německo.
Terapeutické monitorování léčby gentamicinu (TDM) bylo prováděno v Ústavu farmakologie Univerzity Karlovy v Praze, Lékařské fakulty v Hradci Králové. Fitováním parametrů 2kompartmentového modelu [5] se čtyřmi Cpl gentamicinu po první dávce byly odhadnuty individuální farmakokinetické parametry gentamicinu: distribuční objem (Vd1) a clearance (Cl1), a to k simulaci fluktuace Cpl odpovídajících konstantnímu standardnímu dávkování po dobu léčby pomocí počítačového programu MW-Pharm 3.15 (Mediware, Groningen, Holandsko). Cílovými Cpl byla Ctrough,3 (30 min před čtvrtou dávkou, v rozsahu 0,5–2,0 mg/l) a Cpeak,4 (1 hodinu po startu čtvrté infuze, 5–10 mg/l). Čtvrtá dávka byla zvolena proto, že ve většině případů byla dávkou poslední a nastavila 90–95 % rovnovážného stavu (Css). Pokud konstantní standardní dávkování nevedlo k cílovému rozsahu Ctrough,3 a Cpeak,4 (jak ukázala simulace), pak byla predikována individuální změna rychlosti dávkování (úprava dávky, nebo/i dávkovacího intervalu). Cílové Ctrough,3 a Cpeak,4 byly jak predikovány, tak pro kontrolu kvality predikce následně stanoveny (obr. 2).
Laboratorní metody. Cpl gentamicinu, základní laboratorní biochemické, hematologické a mikrobiologické parametry byly stanovovány v laboratoři Ústavu klinické biochemie, laboratorní diagnostiky a mikrobiologie a Ústavu hematologie VFN a UK 1. LF Praha. Hemokultury byly zajištěny a MIC analyzovány pomocí systému Bactec 9240, Becton, Dickinson, Cockeysville, Maryland.
Komorbidity, jejich hodnocení pomocí biomarkerů a klinických projevů
Perzistující ductus arteriosus (PDA): Diagnóza klinicky a echokardiograficky podle doporučených kritérií, farmakologický uzávěr ibuprofen lysinem v 15minutové i.v. infuzi ve třech dávkách každých 24 hodin následovně: první dávka 10 mg/kg, druhá a třetí dávka 5 mg/kg podle p. hm. a GV. Oběhové selhání: hodnoceno podle klinického stavu (tachykardie, systémová arteriální hypotenze); koncentrace laktátu v krvi (≥2,5 mmol/l); dávky léčiv pozitivně ovlivňujících kardiovaskulární systém po předchozí neúspěšné volumexpanzi (≥10 ml/kg); oligurie (výdej moči <1 ml/kg/hod) [20].
Renální dysfunkce: oligurie (výdej moči <1 ml/kg/hod) během 6 hodin; sérová kreatininemie ≥88 μmol/l (0,99 mg/dl) nebo dvojnásobného vzestupu nad iniciální hodnotu [20]. Uremie ≥7,14 mmol/l (20 mg/dl) podle kritérií RIFLE [21, 22].
Pro klinické hodnocení orgánových dysfunkcí byly použity monitorované klinické parametry: arteriální krevní tlak (systolický, diastolický a střední v mmHg) cestou periferní nebo umbilikální arterie nebo oscilometricky a srdeční frekvence pomocí EKG. Příjem tekutin (parenterálně + perorálně) v ml/kg: podle standardních doporučení pro parenterální výživu. Volumexpanze – podání ≥10 ml/kg parenterálních tekutin (krystaloidy, koloidy a krevní deriváty) [20]. Sběr moči každou hodinu pomocí permanentně zavedeného močového katétru. Retence tekutin (ml/kg): vypočtena jako rozdíl mezi příjmem tekutin a výdejem moči v intervalu od startu první infuze gentamicinu do startu čtvrté infuze [14] a vztažena k tělesné aktuální hmotnosti (a. hm.) denně hodnocené ve speciálně vybavených inkubátorech, pokud to klinický stav novorozence dovolil.
Velmi nedonošení (GV <34 týdnů) byli ošetřováni v termoneutrálním prostředí inkubátorů (Draeger Medical GmbH, Luebeck, Německo), mírně nedonošení (GV 34–38 týdnů) na výhřevném lůžku (Alfamedic, Lišov, ČR). Tělesná teplota kontinuálně měřena rektálně.
Statistická analýza standardními statistickými metodami: aritmetický průměr, výběrová směrodatná odchylka, nejmenší a největší hodnota a medián. Normalita dat byla testována pomocí D’Agostinova testu normality. Pro data splňující podmínku normality byly použity t-testy a korelační koeficient, v opačném případě byl použit Mannův-Whitneyův test a Pearsonův korelační koeficient. Pro testování byla zvolena hladina významnosti 5 %. Výpočty byly prováděny pomocí programů Kinetica 4.0 package (Inna Phase, Thermo Fisher Scientific Inc., Waltham, MA), MS Excel 2007 (Microsoft Corporation, 1985–2003), a Statistica 9.0 (StatSoft, Inc., 1984–2010).
Výsledky
V souboru novorozenců původně přijatých do studie (n = 67) chyběly požadované odběry krve ke stanovení Cpl gentamicinu u 12/67 (18 %) probandů, u jednoho byla antibiotická léčba ukončena během 48 hodin od zahájení. Finálně bylo do studie zařazeno 54 nedonošených, a to velmi nedonošených 32/54 (59 %) a mírně nedonošených 22/54 (41 %) (tab. 1). Významně častější výskyt komorbidit byl zjištěn ve skupině velmi nedonošených novorozenců, a to respirační selhání léčené HFOV, oběhové selhání a perzistující ductus arteriosus (PDA) léčený ibuprofenem. Prevalence respiračního selhání podpořeného plicní ventilací BIPAP byla v obou skupinách vysoká. Prevalence vstupní renální dysfunkce, časné asfyxie, perinatální asfyxie a IUGR byla relativně nízká.
Table 1. Demografická charakteristika a komorbidita v souboru nedonošených novorozenců (n = 54) rozdělených do dvou skupin podle gestačního věku (S1 a S2). V tabulce jsou uvedeny četnosti komorbidit ve skupině velmi nedonošených a mírně nedonošených novorozenců (tj. demografická charakteristika a komorbidity). 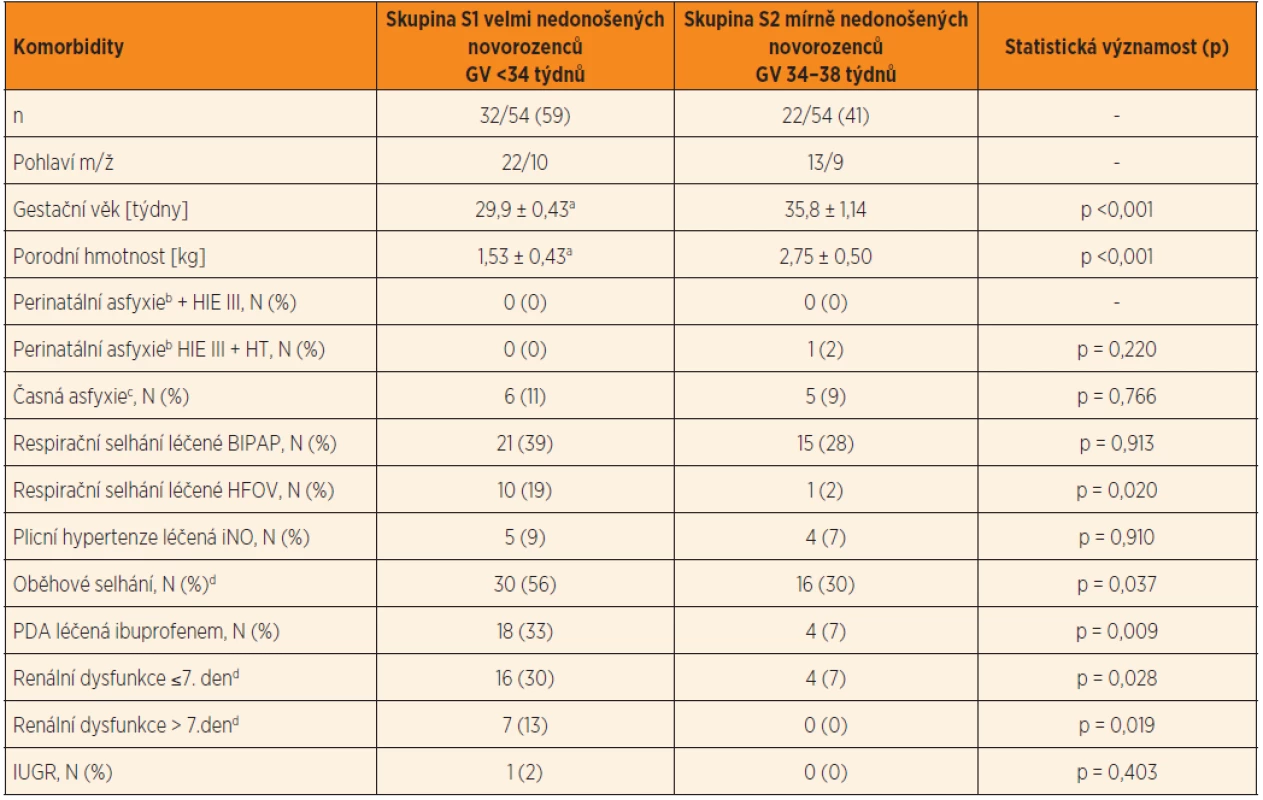
Vysvětlivky: ap <0,001, skupina 1 vs. skupina 2 bApgar skóre 0–3 body v ≥5. min, parametr byl použit k hodnocení časné asfyxie cApgar skóre 0–3 body v ≥5. min, parametr byl použit k hodnocení perinatální asfyxie dkritérium pro oběhové selhání a renální dysfunkci (podle Goldsteina 2005) Průměr (SD); N – incidence/skupina (%) HIE III (Hypoxic-Ischemic Encephalopathy) – hypoxicko-ischemická encefalopatie stupeň III; HT (Therapeutic Hypothermia) – terapeutická celotělová hypotermie; PH (Pulmonary Hypertension) – plicní hypertenze; iNO – inhalační oxid dusnatý; BIPAP (Biphasic Positive Airway Pressure) – bifázická ventilace pozitivním přetlakem; HFOV (High-Frequency Oscillation Ventilation) – vysokofrekvenční oscilační ventilace; IUGR (Intrauterine Growth Restriction) – intrauterinní růstová restrikce; PDA (persistent ductus arteriosus) – perzistující ductus arteriosus Empirická a cílená antibiotická léčba
Iniciálně bylo léčeno empiricky 51/54 novorozenců (95 %), a to kombinací ampicilin + gentamicin ve 43/54 (80 %) případech a ampicilin/sulbaktam + gentamicin v 8/54 (15 %) případech. Iniciální cílená terapie ve třech případech (6 %) znamenala kombinaci ampicilin + gentamicin u 2/54 případů a vankomycin + gentamicin podanou jednomu novorozenci. Změna antibiotické léčby pro pozdní sepsi kombinací vankomycin + gentamicin byla indikována u 5/54 (9 %), včetně léčby cílené u 2/54 novorozenců.
Plazmatické koncentrace gentamicinu a kinetické parametry po první standardní dávce
Individuální časové profily Cpl gentamicinu po první standardní dávce 4 mg/kg i.v. svědčí pro značné rozdíly mezi nedonošenými (obr. 1).
Image 1. Profily plazmatických koncentrací gentamicinu u velmi nedonošených novorozenců (skupina 1 – S1 GV <34 týdnů), mírně nedonošených novorozenců (skupina 2 – S2, GV 34–38 týdnů) a donošených novorozenců (skupina 3 – S3, GV >38 týdnů) po první standardní dávce 4 mg/kg i.v. 30minutovou infuzí.
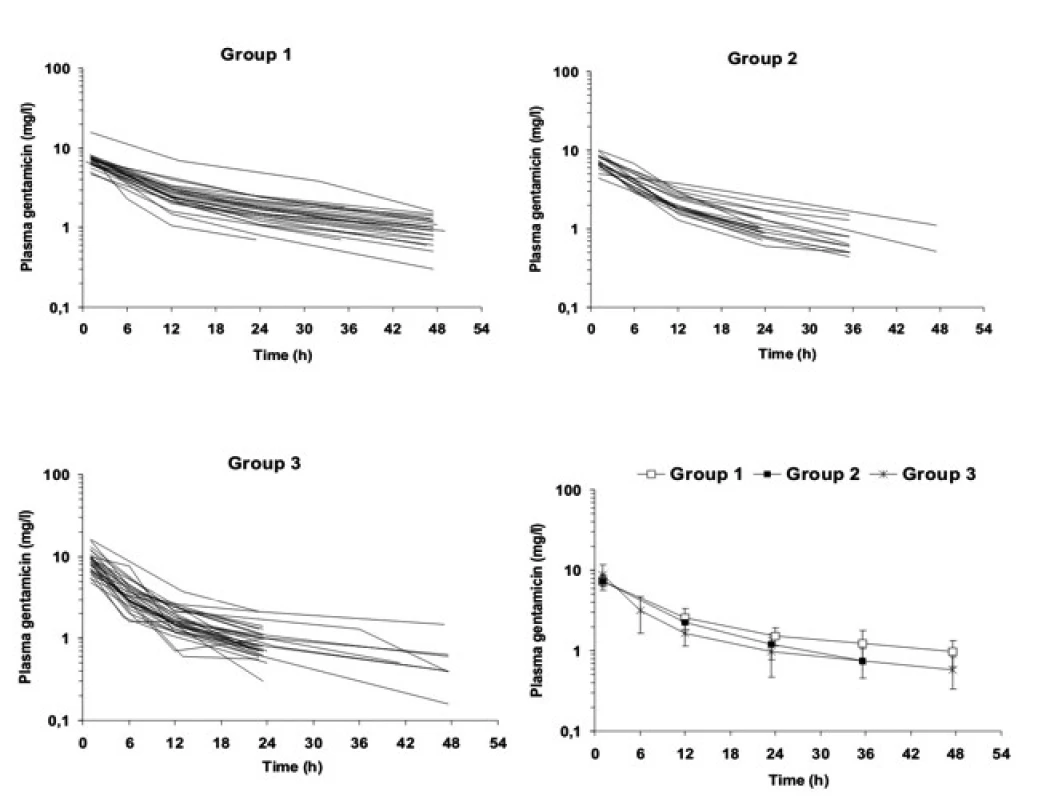
Legenda: Obrázek ukazuje významnou interindividuální variabilitu Cpeak,1 (vrcholová plazmatická koncentrace gentamicinu) a take význam trvání dávkovacího intervalu pro dosažení Ctrough, 1 (údolní koncentrace gentamicinu), nejdelší dávkovací interval 48 hodin náleží velmi nedonošeným s perzistujícím ductus arteriosus (skupina 1) Vysvětlivky: GV – gestační věk, Cpeak,1 – vrcholová koncentrace stanovená 1 hodinu po startu první 30minutové i. v. infuze, Ctrough, 1 – údolní koncentrace 30 minut před druhou infuzí, osa y (plasma gentamicin) – plazmatické koncentrace gentamicinu První standardní dávka navozuje Cpeak,1 v cílovém rozmezí 5–10 mg/l u 43/54 (80 %), Cpeak,1 <5 mg/l u 10/54 (19 %) a Cpeak,1 >10 mg/l pouze u jednoho novorozence (tab. 2). V porovnání mezi oběma skupinami se Cpeak,1 neliší. Cílové hodnoty Ctrough,1 <2 mg/l je dosaženo ve všech případech, u velmi nedonošených vyžaduje dlouhý interval mezi 1. a 2. dávkou.
Table 2. Dávkování gentamicinu, plazmatické koncentrace a odhad PK parametrů gentamicinu po první standardní dávce 4 mg/kg*, podávané 30minutovou i.v. infuzí nedonošeným novorozencům se sepsí v prvním týdnu života. V tabulce jsou uvedeny PK parametry: distribuční objem a clearance gentamicinu po první dávce gentamicinu ve skupině velmi nedonošených a mírně nedonošených novorozenců, rozdělených do skupin podle perzistujícího ductus arteriosus (PDA) a bez perzistujícího ductus arteriosus (bez PDA). 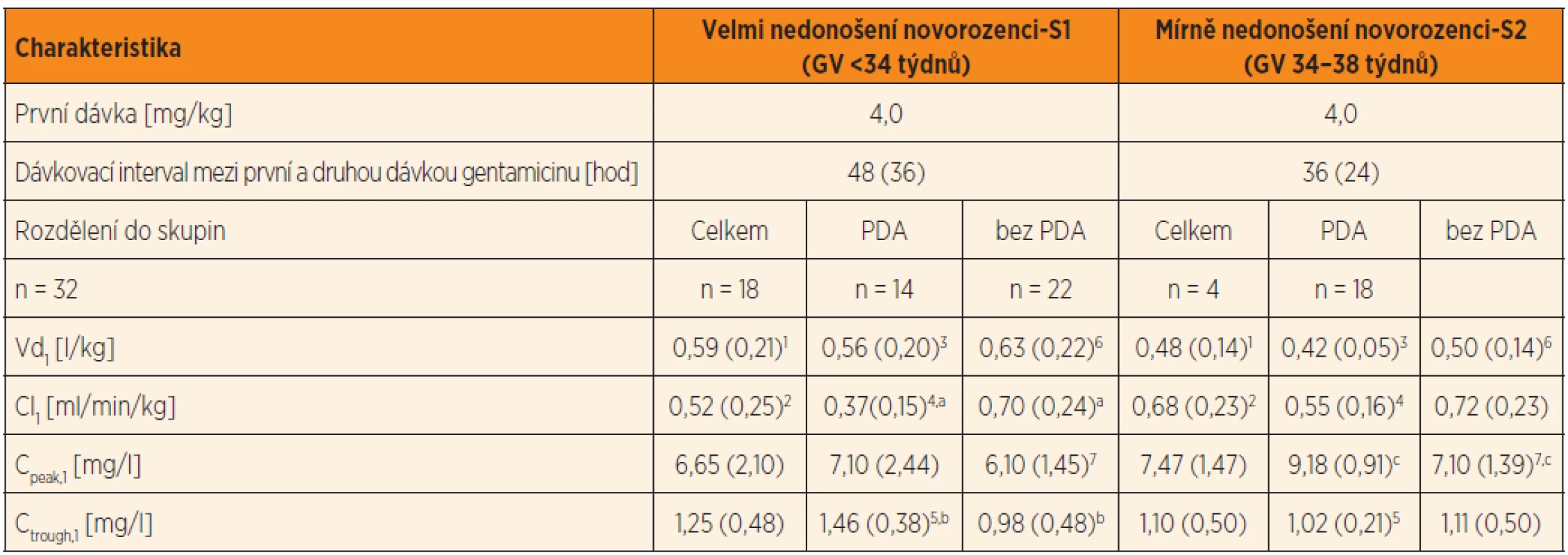
Vysvětlivky: Vd1 a Cl1 = distribuční objem a clearance po první dávce; Cpeak,1 = vrcholová koncentrace stanovená 1 hodinu po startu první 30minutové i.v. infuze, Ctrough,1 = údolní koncentrace 30 minut před druhou infuzí; GV = gestační věk. Průměry (SD). PDA (persistent ductus arteriosus) – perzistující ductus arteriosus. PK – farmakokinetika S1 vs. S2: Vd1 (p = 0,032)1; Cl1 (p = 0,016)2 S1 PDA vs. S2 PDA: Vd1 (p = 0,021)3; Cl1 (p = 0,050)4; Ctrough,1 (p = 0,037)5 S1 bez PDA vs. S2 bez PDA: Vd1 (p = 0,052); Cpeak,1 (p = 0,050)7 S1 PDA vs. S1 bez PDA:Cl1 (p <0,0001)a; Ctrough,1 (p = 0,003)b S2 PDA vs. S2 bez PDA: Cpeak,1 (p = 0,01)c *První a druhá dávka a dávkovací interval mezi první a druhou dávkou jsou empiricky predikovány podle gestačního věku a porodní hmotnosti (skupina S1 a S2) U velmi nedonošených je širší distribuční objem (Vd1) (p = 0,032), který odpovídá nižší hodnotě Cpeak,1. Clearance gentamicinu je u velmi nedonošených významně pomalejší – Cl1 = 0,52 (0,25) ml/min/kg ve srovnání s mírně nedonošenými Cl1 = 0,68 (0,23) ml/min/kg (p = 0,016) (tab. 2) a koreluje s GV velmi nedonošených (r = 0,45; p = 0,07) i mírně nedonošených (r = 0,41; p = 0,04). Zároveň byla prokázána korelace mezi Cl1 a porodní hmotností u velmi nedonošených (r = 0,53; p = 0,001) i u mírně nedonošených (r = 0,37; p = 0,065).
Vliv perzistujícího ductus arteriosus na plazmatické koncentrace gentamicinu a jeho farmakokinetiku po první standardní dávce
Vliv perzistujícího ductus arteriosus byl analyzován u obou skupin novorozenců (původně koncipovaných podle GV) další stratifikací na podskupiny s perzistujícím ductus arteriosus (PDA) a bez perzistujícího ductus arteriosus (bez PDA). Cpeak,1 jeví značnou interindividuální variabilitu jak u velmi nedonošených s PDA (CV % = 31 %), tak u mírně nedonošených bez PDA (CV % = 29 %). Ctrough,1 je u velmi nedonošených s PDA významně vyšší ve srovnání s novorozenci bez PDA (p = 0,003) (tab. 2). Distribuční objem gentamicinu (Vd1 ) u novorozenců s PDA je závislý na GV, vlastní přítomnost PDA vs. bez PDA není pro Vd1 rozhodující. Clearance gentamicinu (Cl1) je u jedinců s PDA významně nižší nežli clearance gentamicinu u novorozenců bez PDA (p <0,0001) (tab. 2).
Kineticky řízené dávkování pro udržovací dávky gentamicinu a dávkovací intervaly
Úprava iniciálního standardního dávkování byla navržena u 46/54 (85 %) nedonošených (tab. 3). Snížení rychlosti dávkování bylo provedeno u 35/54 (65 %) jedinců; prodloužením dávkovacího intervalu po druhé a následujících dávkách gentamicinu u 3/54 (6 %) nedonošených, nebo snížením třetí a následujících dávek u 32/54 (59 %). Ke snížení rychlosti dávkování kombinací obou bylo přistoupeno u jednoho novorozence a je demonstrováno na obrázku 2. Zvýšení rychlosti dávkování bylo zvoleno u 11/54 (20 %) nedonošených, a to zkrácením dávkovacího intervalu po druhé a následujících dávkách u 5/54 (9) nebo zvýšením třetí a dalších dávek u 6/54 (11 %) (tab. 3).
Image 2. Fluktuace plazmatických koncentrací (Cpl) gentamicinu po první standardní dávce gentamicinu 30minutovou infuzí intravenózně.
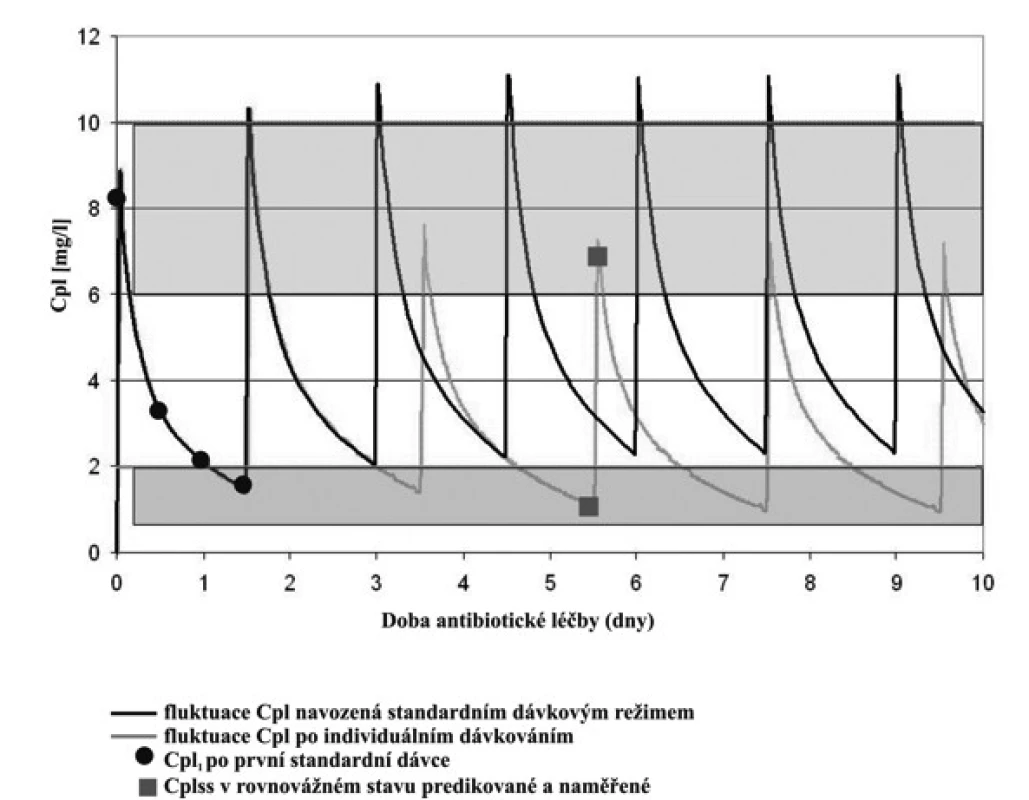
Legenda: Rozsah cílových koncentrací Cpeak je 5–10 mg/l a Ctrough <2 mg/l. Čtyři plazmatické koncentrace gentamicinu po první standardní dávce 4 mg/kg byly využity k odhadu individuálních kinetických parametrů gentamicinu a k simulaci fluktuace plazmatických koncentrací za předpokladu konstantního dávkování standardní dávky po dobu léčby. Simulace ukázala, že obě cílové koncentrace Ctrough,3 a Cpeak,4 přesahují terapeutický rozsah, proto bylo navrženo snížení dávky a prodloužení dávkovacího intervalu tak, aby cílové koncentrace vyhovovaly požadavkům pro účinnost a bezpečnost léčby. Ctrough,3 a Cpeak,4 byly predikovány i následně stanoveny pro kontrolu správnosti predikce.Table 3. Kineticky řízená úprava dávkování gentamicinu na základě odhadu individuálních kinetických parametrů po první dávce a simulace plazmatických koncentrací stanovených 30 min před 4. infuzí (Ctrough,3) a plazmatických koncentrací 1 hodinu po startu čtvrté dávky (Cpeak,4). Nedonošení novorozenci a perzistující ductus arteriosus (PDA) a bez perzistujícího ductus arteriosus (bez PDA). 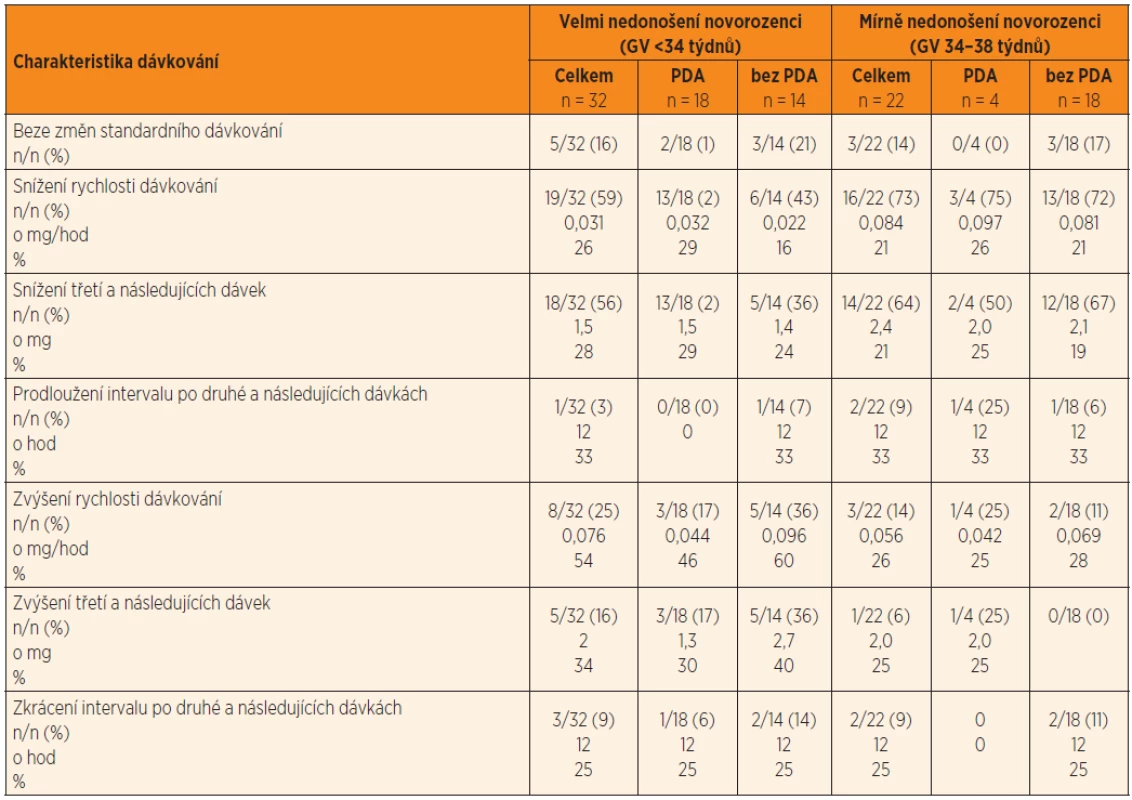
Vysvětlivky: Průměry (SD); GV – gestační věk Změny iniciálního (standardního) dávkování na režim udržovací predikovaný na základě individuální kinetiky gentamicinu. Změny jsou vyhodnoceny jako rychlost dávkování (mg/hod), jako dávky (mg) a dávkovací interval mezi dávkami (hod). Změny jsou také vyjádřeny v % původní hodnoty Cílové koncentrace Ctrough,3 a Cpeak,4 kineticky řízenou léčbou predikované a skutečně naměřené
Předpověď Cpeak,4 s cílem dosáhnout baktericidní koncentrace v rozsahu 5–10 mg/l je u velmi nedonošených bez PDA úspěšnější. U velmi nedonošených s PDA je Cpeak,4 <5 mg/l častější. Cpeak,4 >10 mg/l nebyl zjištěn. Ctrough,3 <2 mg/l byl dosažen u všech nedonošených s výjimkou jednoho novorozence. Ctrough,3 <0,5 mg/l se vykytuje spíše u mírně nedonošených bez PDA (tab. 4).
Table 4. Cpeak,4 a Ctrough,3 dosažené kineticky řízenou úpravou dávkování gentamicinu na základě odhadu individuálních kinetických parametrů po první dávce gentamicinu a simulace plazmatických koncentrací stanovených 30 minut před 4. infuzí (Ctrough,3) a plazmatických koncentrací 1 hodinu po startu čtvrté dávky (Cpeak,4) ve skupině nedonošených novorozenců s perzistujícím ductus arteriosus (PDA) a bez perzistujícícho ductus arteriosus (bez PDA). 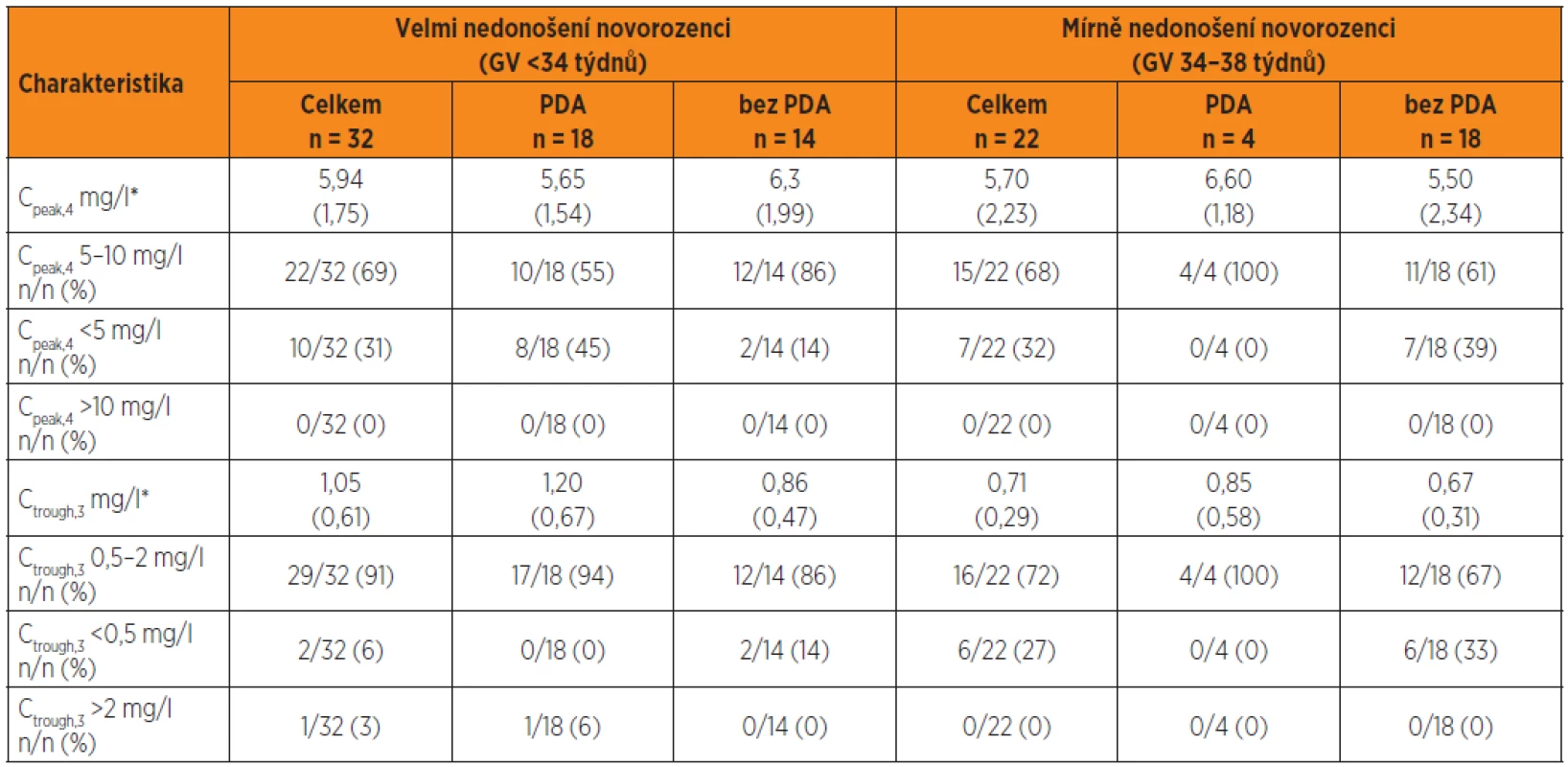
Vysvětlivky: *Průměry (SD). Cpeak,4 = vrcholová koncentrace stanovená 1 hodinu po startu čtvrté 30minutové i.v. infuze, Ctrough,3 = údolní koncentrace 30 min před čtvrtou infuzí Klinický výstup léčby a význam komorbidit
Sepse. Infekční mikroorganismy byly identifikovány u 8/54 (15 %) nedonošených. U 3/54 (6 %) případů byla prokázána časná sepse, u 5/54 (9 %) pozdní sepse. U 46/54 (85 %) nedonošených nebyl patogen prokázán. U novorozenců s PDA byla bakteriemie prokázána ve 3/54 (6 %) případech, z toho u 1/54 (2 %) se jednalo o časnou formu sepse, ve 2/54 (4 %) o pozdní formu. U novorozenců bez PDA byla bakteriemie prokázána u 5/54 (9 %), z toho u 2/54 (4 %) během časné sepse, u 3/54 (6 %) během pozdní sepse. V případech časné sepse byl ve výše popsaném pořadí identifikován kmen Escherichia coli (MIC = 0,25 mg/l), v druhém případě kmen Listeria monocytogenes (MIC <0,5 mg/l). Hodnoty MIC svědčily pro velmi dobrou citlivost obou kmenů na gentamicin a Cpeak,1 ležela v cílovém rozmezí (5–10 mg/l). Ve třetím případě se jednalo o kmen Staphylococcus saprophyticus (MIC >16 mg/l). Kmen byl primárně rezistentní na gentamicin, proto byl gentamicin v původní empirické léčbě cíleně nahrazen vankomycinem. U pozdní sepse byly prokázány následující patogeny: Staphylococcus epidermidis (MIC <0,125 mg/l), Pseudomonas aeruginosa (MIC <0,125 mg/l), Candida albicans (MIC se netestuje), Acinetobacter ursingii (MIC <0,1 mg/l) a Staphylococcus epidermidis (MIC >16 mg/l). Cpeak,4 dosahovaly hodnot: 4,2 mg/l; 4,3 mg/l; 5,6 mg/l; 5,1 mg/l a 5,4 mg/l. Ačkoliv hodnoty Cpeak,4 byly v prvních dvou případech <5 mg/l, index Cpeak/MIC u těchto dvou citlivých kmenů (MIC <0,125 mg/l) mnohonásobně přesahoval doporučený rozsah 8–12 [7]. Proto i tehdy byly splněny požadavky pro rychlou baktericidii. U jedinců s primárně rezistentním kmenem na gentamicin (MIC >16 mg/l) byla léčba gentamicinem ukončena a nahrazena vankomycinem (viz výše). Časná a pozdní sepse byla vyléčena ve všech případech. Antibiotika byla podávána 6–10 dnů, s výjimkou jediného novorozence, který byl pro pozdní sepsi léčen 14 dnů. Jeden extrémně nezralý novorozenec zemřel pro závažné nitrolební krvácení 5. den po ukončení léčby gentamicinem ve stáří 13 dnů. Cpl gentamicinu v tomto případě byly v terapeutickém rozmezí ( Cpeak,1 = 7,0 mg/l, Ctrough,1 = 1,2 mg/l, Ctroug,3 = 0,7 mg/l a Cpeak,4 = 4,5 mg/l).
Perzistující ductus arteriosus (tab. 1) byl farmakologicky uzavřen třemi dávkami ibuprofenu s výjimkou jediného velmi nezralého novorozence, u něhož bylo nutno podávání ibuprofenu opakovat. U jednoho mírně nedonošeného novorozence stačily k uzavření duktu dvě dávky ibuprofenu.
Oběhové selhání (tab. 1) bylo prokázáno u všech nedonošených s PDA. U nedonošených bez PDA byla incidence oběhového selhání v obou skupinách nižší a srovnatelná: u 12/54 (22 %) velmi nedonošených a u 12/54 (22 %) mírně nedonošených.
Retence tekutin a změny aktuální hmotnosti při multiorgánovém selhávání. Objem tekutin retinovaný od dne, kdy byla zahájena antibiotická léčba do dne podání čtvrté dávky gentamicinu, je významně vyšší u velmi nedonošených jedinců s PDA: +374,0 (45,10) ml/kg proti velmi nedonošeným bez PDA: +175,2 (22,14) ml/kg (p >0,001). Změna aktuální hmotnosti (a. hm.) vyjádřená v % porodní hmotnosti u velmi nedonošených se lišila u jedinců s PDA: a. hm. = 121,0 (4,4) % ve srovnání s jedinci bez PDA: a. hm. = 97,9 (1,9) % (p = 0,0003) a korelovala s retencí tekutin (ml/kg) shromažďované od první do čtvrté dávky gentamicinu (r = -0,25), (p = 0,02). Objem parenterální výživy od první do čtvrté dávky gentamicinu (tj. 1.–8. den léčby) představoval u velmi nedonošených s PDA = +1256,7 (69,8) ml/kg proti jedincům bez PDA = +1188,5 (84,9) ml/kg a byl srovnatelný u obou skupin, při standardně doporučeném příjmu tekutin pro velmi nedonošené s porodní hmotností <1,0 kg = +1120 ml/kg, s porodní hmotností 1,0–1,5 kg = +1080 ml/kg a s porodní hmotností >1,5 kg = +980 ml/kg (p = 0,005), což zároveň svědčí proti restrikci tekutin jako možné příčině vyšší dokumentované uremie (viz dále).
Koncentrace sérového albuminu. Průměrná vstupní koncentrace sérového albuminu u velmi nedonošených s PDA byla nižší, tj. = 22,34 (3,2) g/l ve srovnání s albuminemií velmi nedonošených bez PDA = 26,90 (3,38) g/l (p = 0,001). U mírně nedonošených nebyly významné rozdíly potvrzeny: u PDA dosahovala koncentrace sérového albuminu 25,9 (3,12) g/l a bez PDA 26,7 (3,3) g/l (p = 0,603). Hypoalbuminemie byla korigována.
Diskuse
Tato otevřená prospektivní studie se zabývá kriticky nemocnými novorozenci v prvním týdnu života, léčenými pro sepsi kineticky řízenou terapií gentamicinem. Kineticky řízená terapie (TDM) predikuje individuální dávkování léčiva na základě Cpl léčiva získaných od daného jedince. Cílem této studie bylo prověřit účinnost TDM založené na Cpl dosažených po první doporučované standardní dávce [23] ve srovnání se standardním dávkováním vycházejícím z gestačního věku a porodní tělesné hmotnosti. Metodickým požadavkem bylo zjistit, zda vrcholové a údolní koncentrace odpovídají požadavkům účinné a bezpečné antibiotické léčby, a to jak po první dávce (dávka nárazová), tak po opakované dávce navozující ustálený stav (tj. po čtvrté dávce – udržovací). O účinné léčbě (baktericidii) vypovídají koncentrace vrcholové (tj. s cílem navodit Cpeak v rozsahu 5–10 mg/l), o riziku toxicity koncentrace údolní (tj. s cílem dosáhnout Ctrough <2 mg/l). Originálním přístupem bylo monitorování potenciálního vlivu kovariát, které význam TDM negují tím, že významně a dosud nedostatečně popsaným mechanismem ovlivňují kinetiku a následně účinek gentamicinu činí nejistým, až nepředvídatelným.
K TDM sloužil program MWPHARM, který umožnil následující postup:
- Čtyři Cpl po první dávce byly využity k predikci individuálních kinetických parametrů nezbytných pro simulaci Cpl Ge po dávkách následujících (profil).
- Simulace individuálního profilu Cpl odhalila novorozence, kterému nebude vyhovovat standardní postup, tj. využití gestačního věku + porodní hmotnosti jako jediných prediktorů dávkování Ge, protože simulované Cpl neodpovídaly požadavkům na účinnost a bezpečnost léčby.
- Ošetřujícímu lékaři bylo doporučeno, jak individuálně upravit standardní dávkování po druhé dávce tak, aby byly dosaženy cílové Ctrough,3 a Cpeak,4 vztahující se ke čtvrté dávce.
- Cílové koncentrace byly nejen predikovány, ale i skutečně ověřeny.
Úprava dávkování ve většině případů vyžadovala snížení dávkování, a to především redukci třetí a dalších dávek. Ověřením cílových koncentrací se ukázalo, že prakticky úspěšná byla ve všech případech predikce údolních koncentrací spojovaných s toxicitou. O praktickém významu stanovení čtyř CPl po první dávce gentamicinu svědčí obrázek 1.
Naopak, cílové vrcholové koncentrace dosažené po 4. dávce ( Cpeak,4) byly u nezanedbatelného počtu nedonošených (17/54 jedinců – 32 %) nižší než predikovaná cílová dolní baktericidní koncentrace ( Cpeak,4 <5 mg/l). Podobný neúspěch byl popsán v literatuře [23]. Snažili jsme se najít možné příčiny. Při posuzování profilů Cpl Ge po první dávce byla zjevná interindividuální variabilita Cpl a kinetických parametrů gentamicinu, která je u novorozenců v prvním týdnu života známa [14, 24, 25]. Na variabilitě se podílí širší distribuční objem a nízká clearance Ge u nedonošených novorozenců. Nejnižší úspěšnost v dosažení Cpeak se projevila u velmi nedonošených s perzistujícím ductus arteriosus a mírně nedonošených s oběhovým selháním. To znamená, že u kriticky nemocných kromě maturačních kovariát mohou k variabilitě přispět patologické kovariáty – protože se jedná o nemocné s multiorgánovým selháním a interkurentní léčbou – potenciálním zdrojem lékových interakcí. Sepse, perzistující ductus arteriosus, oběhové selhání a další patofyziologické faktory mohou mít aditivní vliv. Skutečně nejvýznamnější změny v kinetických parametrech jsme našli u velmi nedonošených se sepsí a s perzistujícím ductus arteriosus – u těchto nemocných byla clearance gentamicinu nejnižší.
Jako možný mechanismus nás zajímal leak syndrom – charakteristický zvýšenou propustností mikrocirkulace pro krevní plazmu. Kromě vstupní hypoalbuminemie u velmi nedonošených s perzistujícím ductus arteriosus jsme nenalezli žádný důkaz pro mikrocirkulační leakage, pravděpodobně pro rychlou a účinnou kompenzaci hypoalbuminemie a náležitou prevenci hypotenze a hypovolemie.
Další zdroj patologických kovariát – perzistující ductus arteriosus – představuje patofyziologický stav, při kterém dochází pro zkratování krve mezi arteriálním a venózním řečištěm k významnému negativnímu účinku na prerenální cirkulaci [26] s následným zpomalením clearance gentamicinu a prodloužením jeho biologického poločasu eliminace [26, 27, 28]. I tato studie potvrdila závěry z literatury. Aditivní vliv může mít léková interakce při současném podávání ibuprofenu, indikovaného k farmakologickému uzávěru perzistujícího ductus [26, 27, 28]. V této studii první ze tří dávek ibuprofenu většinou předcházela o 1–2 dny začátku terapie gentamicinu a nelze vyloučit její podíl na nízké clearance Ge po první dávce.
Sepse a septický šok u kriticky nemocných nedonošených novorozenců mohou zvyšovat distribuční objem léčiv distribuujících se do extracelulární tekutiny (aminoglykosidy) a snižovat clearance, a to pro převod velkého objemu tekutin během léčby systémové hypotenze v akutní fázi onemocnění, pro potenciální zmiňovanou mikrocirkulační leakage nebo multiorgánové selhání při sepsi [29, 30]. V naší předchozí práci se ukázalo, že ani vrcholová koncentrace po první dávce, ani distribuční objem nejsou ovlivněny objemem tekutin podaným v souvislosti s první dávkou gentamicinu. Je to rozvoj retence tekutin, zejména u nedonošených, který se projevuje významnými hmotnostními přírůstky za období mezi první a čtvrtou dávkou a také nižšími koncentracemi Cpeak,4 po podání čtvrté dávky gentamicinu [14], zatímco u fyziologických novorozenců se v daném postnatálním období projeví fyziologický hmotnostní úbytek. Největší objem tělesných tekutin retinovali velmi nedonošení s perzistujícím ductus arteriosus, u kterých bylo současně diagnostikováno oběhové selhání na rozdíl od velmi nedonošených bez perzistujícího ductus arteriosus, kde se oběhové selhání vyskytovalo u 22 % jedinců. Retenci tekutin je možno monitorovat pomocí změn aktuální tělesné hmotnosti [14], a je proto třeba ji brát v úvahu při dávkování aminoglykosidů (mg/kg), neboť aminoglykosidy se do extracelulární tekutiny distribuují.
Je možno shrnout, že výsledky této studie ukázaly, že se na nepřesnosti predikce dávkování gentamicinu k dosažení cílové hodnoty Cpeak podílejí kovariáty spojené s velmi nízkou maturací, perzistujícím ductus arteriosus a jeho farmakologickým uzávěrem podáváním ibuprofenem a s oběhovým selháním. Společným jmenovatelem bývá retence tekutin hodnotitelná pomocí aktuální tělesné hmotnosti. Pravděpodobně se uplatní i příznivé změny clearance gentamicinu (původně nízké) v průběhu úspěšné léčby.
Zároveň se ukázalo, že pro posouzení baktericidie je třeba zajistit nejen cílovou plazmatickou koncentraci, ale je třeba znát i mikrobiologické vyšetření MIC in vitro, které hodnotí citlivost infekčního agens na antibiotikum. Baktericidní účinnost gentamicinu je determinována vztahem Cpeak/MIC, která má vyhovovat rozsahu 8–12 [7]. I když četnost vyšetření MIC v této studii byla nízká, ve většině případů prokázala vysokou citlivost patogenních kmenů (index Cpeak/MIC podstatně převyšoval doporučené rozmezí). V takových případech baktericidní účinnosti vyhovovala i nižší vrcholová koncentrace Cpeak, než byla původní cílová koncentrace ( Cpeak ≥5 mg/l) [6].
Za předpokladu, že známe MIC a lze průběžně monitorovat změny aktuální tělesné hmotnosti, pak je možno považovat kineticky řízenou léčbu gentamicinem na základě plazmatických koncentrací po první dávce získaných od nemocných novorozenců za daných maturačních i patologických stavů za zajišťující účinnost za přijatelné tolerability (bezpečnosti) léčby (viz část 2).
Závěr
Kineticky řízená léčba gentamicinem u septických nedonošených novorozenců v kritickém stavu, která je založena na plazmatických koncentracích po první dávce, zajistila dosažení bezpečné údolní koncentrace Ctrough (<2 mg/l) u všech nedonošených. Pro dosažení cílové baktericidní vrcholové plazmatické koncentrace ( Cpeak 5–10 mg/l) je třeba respektovat další prediktory: aktuální hmotnost – biomarker retence tělesných tekutin a MIC – biomarker citlivosti infekčního agens na dané antibiotikum. Tento požadavek platí zejména pro velmi nedonošené novorozence s perzistujícím ductus arteriosus (GV <34 týdny) a pro mírně nedonošené (GV 34–38 týdnů) s oběhovým selháním.
Poděkování:
První autorka děkuje profesorce MUDr. Jiřině Martínkové, Ph.D., doc. Ing. Jaroslavu Chládkovi, Ph.D., za odborné vedení postgraduální práce a všem spolupracovníkům, bez kterých by tato práce nebyla uskutečnitelná.
Práce vznikla za podpory Grantu Ministerstva zdravotnictví (IGA 1A 6771-5/05) a RVO VFN 64165/2012.
Došlo: 27. 6. 2012
Přijato: 1. 4. 2013
MUDr. Pavla Pokorná
Jednotka intenzivní a resuscitační péče
Klinika dětského a dorostového lékařství
UK 1. LF a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: pokornakarlov@seznam.cz
Sources
1. Avent ML, Kinney JS, Istre GR, Whitfield JM. Gentamicin and tobramycin in neonates: comparison of a new extended dosing interval regimen with a traditional multiple daily dosing regimen. Am J Perinatol 2002; 19 (8): 413–420.
2. Stolk LM, Degraeuwe PL, Norman FH, de Wolf MC, de Boer A. Population pharmacokinetics and relationship between demographic and clinical variables and pharmacokinetics of gentamicin in neonates. Ther Drug Monit 2002; 24 (4): 527–531.
3. Měchurová A, Vlk R, Unzeitig V, Macko J, Zach J. Doporučené postupy v perinatologii a neonatologii. Čes Gynek 2010; 75 (Suppl 1).
4. Contopoulos-Ioannidis DG, Giotis ND, Baliatsa DV, Ioannidis JP. Extended-interval aminoglycoside administration for children: a meta-analysis. Pediatrics 2004; 114 (1): e111–e118.
5. García B, Barcia E, Pérez F, Molina IT. Population pharmacokinetics of gentamicin in premature newborns. J Antimicrob Chemother 2006; 58 (2): 372–379.
6. de Hoog M, Mouton JW, Schoemaker RC, Verduin CM, van den Anker JN. Extended-interval dosing of tobramycin in neonates: implications for therapeutic drug monitoring. Clin Pharmacol Ther 2002; 71 (5): 349–358.
7. Moore RD, Smith CR, Lietman PS. The association of aminoglycoside plasma levels with mortality in patients with gram-negative bacteremia. J Infect Dis 1984; 149 (3): 443–448.
8. Pons G, d‘Athis P, Rey E, de Lauture D, Richard MO, et al. Gentamicin monitoring in neonates. Ther Drug Monit 1988; 10 (4): 421–427.
9. Schentag JJ, Jusko WJ. Renal clearance and tissue accumulation of gentamicin. Clin Pharmacol Ther 1977; 22 (3): 364–370.
10. Rocha MJ, Almeina AM, Alfonso E, Martins V, Santos J, et al. The kinetic profile of gentamicin in premature neonates. J Pharm Pharmacol 2000; 52 (9): 1091–1097.
11. Triginer C, Izquierdo I, Fernández R, Rello J, Torrent J, et al. Gentamicin volume of distribution in critically ill septic patients. Intensive Care Med 1990; 16 (5): 303–306.
12. Glover ML, Shaffer CL, Rubino CM, Cuthrell C, Schoening S, et al. A multicenter evaluation of gentamicin therapy in the neonatal intensive care unit. Pharmacotherapy 2001; 21 (1): 7–10.
13. De Paepe P, Belpaire FM, Buylaert WA. Pharmacokinetic and pharmacodynamic considerations when treating patients with sepsis and septic shock. Clin Pharmacokinet 2002; 41 (14): 1135–1151.
14. Martínková J, Pokorná P, Záhora J, Chládek J, Vobruba V, et al. Tolerability and outcomes of kinetically guided therapy with gentamicin in critically ill neonates during the first week of life: An open-label, prospective study. Clin Ther 2010; 32 (14): 2400–2414.
15. Mehta RL, Kellum JA, Shah SV, Molitoris BA, Ronco C, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11 (2): R31.
16. Mathur VS, Swan SK, Lambrecht LJ, Anjum S, Fellmann J, et al. The effects of fenoldopam, a selective dopamine receptor agonist, on systemic and renal hemodynamics in normotensive subjects. Crit Care Med 1999; 27 (9): 1832–1837.
17. Gerberdig JL, Fleming DW. Centres for Diseases Control and Prevention Guidelines for the prevention of intravascular catheter – related infections, 2002.MMWR August 9, 2002; 51 (RR-10): 1–29.
18. de Brito CS, de Brito DV, Abdallah VO, Gontijo Filho PP. Occurrence of bloodstream infection with different types of central vascular catheter in critically neonates. J Infect 2010; 60 (2): 128–132.
19. Young TE. A Manual of Drugs Used in Neonatal Care. 19th ed. Raleigh, North Carolina: Acorn Publishing USA, NeoFax, 2006.
20. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005; 6 (1): 2–8.
21. Askenazi DJ, Feig DI, Graham NM, Hui-Stickle S, Goldstein SL. 3–5 year longitudinal follow-up of pediatric patients after acute renal failure. Kidney Int 2006; 69 (1): 184–189.
22. Askenazi DJ, Ambalavanan N, Goldstein SL. Acute kidney injury in critically ill newborns: what do we know? What do we need to learn? Pediatr Nephrol 2009; 24 (2): 265–274.
23. Isemann BT,Kotagal UR, Mashni SM. Optimal gentamicin therapy in preterm neonates includes loading doses and early monitoring. Ther Drug Monit 1996; 18 : 549–555.
24. Lingvall M, Reith D, Broadbent R. The effect of sepsis upon gentamicin pharmacokinetics in neonates. Br J Clin Pharmacol 2005; 59 (1): 54–61.
25. Yaffe SJ, Aranda JV. Pediatric pharmacology. In: Assael B, Rusconi F (eds). Aminoglycoside Antibiotics. 2nd ed. Philadelphia: Philadelphia Saunders, 1992 : 244–251.
26. van den Anker JN. Pharmacokinetics and renal function in preterm infants. Acta Paediatr 1996; 85 (12): 1393–1399.
27. Touw DJ, Westerman EM, Sprij AJ. Therapeutic drug monitoring of aminoglycosides in neonates. Clin Pharmacokinet 2009; 48 (2): 71–88.
28. Allegaert K, Anderson BJ, van den Anker JN. Renal drug clearance in preterm neonates: Relation to prenatal growth. Ther Drug Monit 2007; 29 : 284–291.
29. Buijk SE, Mouton JW, Gyssens IC. Experience with a once-daily dosing program of a aminoglykosides in critically ill patiens. Intensive Care Med 2002; 28 : 936–942.
30. van Dalen R, Vree TB. Pharmacokinetics of antibiotics in critically ill patients. Intensive Care Med 1990; 16 (3): S235–S238.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2013 Issue 4-
All articles in this issue
- Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I)
- Prevalencia nadhmotnosti a obezity u študentov bratislavských stredných škôl – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Hazard a obec
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

