-
Medical journals
- Career
Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
Authors: F. Fencl 1; V. Stará 1; K. Bláhová 1; J. Zieg 1; M. Horáčková 2; M. Pecková 2; J. Charvát 2
Authors‘ workplace: Pediatrická klinika UK 2. LF a FN Motol, Prahapřednosta prof. MUDr. J. Lebl, CSc. 1; Interní klinika UK 2. LF a FN Motol, Prahapřednosta prof. MUDr. M. Kvapil, CSc., MBA 2
Published in: Čes-slov Pediat 2013; 68 (1): 43-48.
Category: Case Report
Overview
Incidence tromboembolických komplikací u pacientů s nefrotickým syndromem (NS) je udávána kolem 1,8–5 %, může však být podhodnocena. Většina pacientů s tromboembolickou nemocí (TEN) je asymptomatická.
Osmnáctiletá pacientka užívající hormonální antikoncepci s nevýznamnou rodinnou a osobní anamnézou byla přijata pro dušnost, bolest na hrudi, kolapsový stav a diskrétní otoky víček, rukou a nohou. Echokardiografické vyšetření prokázalo nepřímé známky plicní hypertenze, dilataci a dysfunkci pravé komory, na EKG byl blok pravého Tawarova raménka. CT vyšetření potvrdilo oboustrannou masivní plicní embolii (PE). Byla zahájena antikoagulační terapie heparinem, která byla následně převedena na nízkomolekulární heparin. Ultrazvukové vyšetření neprokázalo zdroj embolizace, stejně tak nebyly přítomny ani symptomy hluboké žilní trombózy. Další podrobnější vyšetření odhalila výraznou nefrotickou proteinurii (6 g/m2/den), biochemické parametry odpovídaly NS.
Provedená renální biopsie prokázala diagnózu nefrotického syndromu s minimálními změnami glomerulů. Terapie prednisonem podle standardního protokolu měla pouze přechodný efekt, při vysazování došlo k opětovnému vzestupu proteinurie. Následně byla zahájena terapie cyklosporinem A.
Nefrotický syndrom by měl být diferenciálně diagnosticky zvažován u všech pacientů s PE, všichni tito pacienti by měli podstoupit vyšetření moči na proteinurii. Jak jsme demonstrovali, masivní plicní embolie může být vzácně prvním symptomem NS.Klíčová slova:
proteinurie, plicní embolie, nefrotický syndrom, nefrotický syndrom s minimálními změnami glomerulůÚVOD
Pacienti s nefrotickým syndromem (NS) mají zvýšené riziko tromboembolických příhod [1–4]. Etiologie je multifaktoriální, zahrnuje poškození endoteliálních buněk, hyperagregabilitu destiček a hyperkoagulační stav. U pacientů s NS dochází ke zvýšenému uvolňování arachidonové kyseliny, zvýšené produkci metabolitů kyseliny arachidonové včetně tromboxanu A2 (TXA2) a je zkrácené přežívání destiček. Byla také prokázána zvýšená agregabilita destiček na různé podněty – zejména ADP, kolagen a kyselinu arachidonovou. Tato hyperagregabilita je připisována hypoalbuminemii, protože albumin inhibuje agregaci destiček indukovanou kyselinou arachidonovou a konverzi kyseliny arachidonové uvolněné z destičkových fosfolipidů na endoperoxidové metabolity a TXA2. Další mechanismy zahrnují hypokalcemii a hypercholesterolemii. Byly rovněž zaznamenány abnormality v koagulační kaskádě, zejména zvýšené hladiny koagulačních faktorů V, VII, VIII, vWF a fibrinogenu. Ty jsou zdůvodňovány zvýšenou syntézou v hepatocytech a sníženým intravaskulárním objemem při normální rychlosti odbourávání. Snížené hladiny antitrombinu III (AT III) jsou dány ztrátami do moči a zvýšenou konzumpcí v průběhu intravaskulární koagulace. Změny hladin proteinů C a S jsou nekonstantní a mohou nastat oběma směry [5, 6]. Mezi další faktory ovlivňující koagulaci patří hemokoncentrace daná vysokou diurézou u NS a farmaka po-užívaná v léčbě. Za nejrizikovější jsou z tohoto pohledu považována diuretika a kortikosteroidy [7]. Užívání diuretik vede k hemo-koncentraci a zvýšené viskozitě krve, steroidy zvyšují koncentraci řady koagulačních faktorů, zejména faktoru VIII.
Incidence tromboembolických komplikací u pacientů s nefrotickým syndromem je udávána kolem 1,8–5 %, ale může být podhodnocena. Některé studie uvádí kumulativní incidenci tromboembolických komplikací u pacientů s NS téměř 50 % [8–10]. Většina pacientů s TEN je asymptomatická.
KAZUISTIKA
Osmnáctiletá pacientka užívající hormonální antikoncepci s nevýznamnou osobní a rodinnou anamnézou byla přijata do spádové nemocnice pro synkopu, slabost, dušnost, bolest na hrudi a bolest hlavy. Klinicky byly přítomny dyspnoe, tachykardie, hypotenze, dehydratace, otoky víček a diskrétní otoky horních a dolních končetin, prodloužený kapilární návrat, oligurie (0,6 ml/kg/hod).
Bezprostředně po překladu na naše pracoviště byly na echokardiografickém vyšetření prokázány nepřímé známky plicní hypertenze, dilatace a těžká dysfunkce pravé komory, na EKG sinusová tachykardie a blok pravého Tawarova raménka. Bylo indikováno CT-angiografické vyšetření, které potvrdilo oboustrannou masivní plicní embolii (obr. 1–4). V rozšířených vstupních laboratorních vyšetřeních byla v krevním obraze leukocytóza 26,8 x 109/l, hemoglobin 172 g/l, trombocytopenie 56 x 109/l, v koagulacích fibrinogen 2,79 g/l, AT III 43 %, D-dimer 11 462 ng/ml, v biochemii elevace CRP 95,2 mg/l, elevace renálních parametrů (urea 14,8 mmol/l a kreatinin 231 µmol/l) a nálezy odpovídající nefrotickému syndromu – hypoproteinemie (celková bílkovina 20,6 g/l, albumin 13,0 g/l), hyperlipidemie (triacylglyceroly 2,35 mmol/l, cholesterol 5,1 mmol/l), biochemické vyšetření moči prokázalo vysokou proteinurii 6 g/m2/den (následný odběr až 10 g/m2/den).
Obr. 1–4. CT-angiografické vyšetření – oboustranná masivní plicní embolie. Fig. 1–4. CT-angiography – bilateral massive pulmonary embolism. 
Pro nejasný zdroj embolizace bylo doplněno ultrazvukové vyšetření zaměřené na detekci trombů, ale žádné známky trombotizace žilního systému nebyly nalezeny. Rovněž klinické známky žilní trombózy nebyly přítomny. Ultrazvuk ledvin prokázal akutní parenchymovou lézi s normální perfuzí.
Ihned po CT průkazu embolie byla zahájena antikoagulační terapie úvodní dávkou heparinu s následným přechodem na nízkomolekulární heparin (Clexane inj. 2x 0,2 ml) s anti-Xa udržovaném v terapeutickém rozmezí. AT III nebyl hrazen. Trombolýza nebyla indikována. Pro anurické akutní renální selhání dané akutní tubulární nekrózou byla pacientka dvakrát hemodialyzována.
Po stabilizaci stavu pacientka podstoupila renální biopsii. Ve světelné mikroskopii byla patrná akutní tubulární nekróza, imuno-fluorescenční vyšetření bylo negativní, v elektronmikroskopickém vyšetření bio-ptického vzorku bylo zjištěno splynutí pedicel podocytů, které potvrdilo diagnózu nefrotic-kého syndromu na podkladě minimálních změn glomerulů (obr. 5).
Image 1. Elektronová mikroskopie: nefrotický syndrom s minimálními změnami glomerulů – kapilární klička glomerulu s fúzí pedicel podocytů, mikrovilózní přeměna podocytů. Fig. 5. Electron microscopy: nephrotic syndrome with minimal change glomerulopathy – the capillary loop of glomerulus with the effacement of visceral epithelial foot processes and epithelial microvillous transformation. 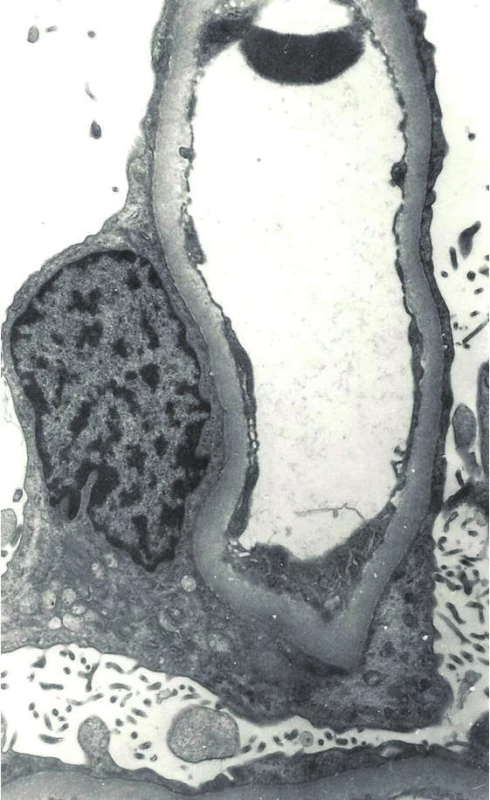
Byla zahájena terapie kortikosteroidy podle standardního protokolu. Po 6 týdnech léčby byla proteinurie redukována na 890 mg/m2/den. Během vysazování léčby však došlo k novému vzestupu proteinurie na hodnotu 3420 mg/m2/den, proto byla nasazena imunosupresivní léčba cyklosporinem A. Hodnoty proteinurie jsou znázorněny v grafu 1. Vývoj renálních parametrů po hemodialýze byl příznivý, měsíc po ukončení hemodialýzy byl kreatinin 205 µmol/l, urea 29,6 mmol/l, glomerulární filtrace (eGFR MDRD) 0,45 ml/s/1,73 m2, po dalším měsíci (při dimisi) byl kreatinin 71 µmol/l, urea 8,2 mmol/l, eGFR MDRD >1,5 ml/s/1,73 m2.
Graph 1. Proteinurie [mg/m<sup>2</sup>/den]. ![Proteinurie [mg/m<sup>2</sup>/den].](https://pl-master.mdcdn.cz/media/image/e8c074c0842930f5daea1a22c5d1c2ff.jpg?version=1537797435)
Ostatní vyšetření zaměřená na vyloučení hereditárních hyperkoagulačních stavů (Leidenská mutace, mutace MTHFR, AT III deficience a protein C/S deficience, vyšetření kardiolipinu IgG) byla negativní.
Další průběh onemocnění byl bez komplikací, hodnoty proteinurie byly nízké, v současnosti jsou 130 mg/m2/den. Antikoagulační léčba byla ukončena po 6 měsících. Terapie cyklosporinem A byla postupně zcela vysazena v průběhu 18.–23. měsíce od manifestace onemocnění. Současné renální parametry s odstupem dalších 23 měsíců od začátku onemocnění jsou v normě, kreatinin 64 µmol/l, urea 3,7 mmol/l, eGFR MDRD >1,2 ml/s/1,73 m2.
DISKUSE
Zvýšené riziko TEN u pacientů s NS je všeobecně známé, etiologie trombofilního stavu u NS byla popsána v úvodu textu. Tyto obecně platné faktory se týkají všech pacientů s NS bez ohledu na jeho etiologii. Pro posouzení míry rizika vzniku TEN u daného konkrétního pacienta s NS bývají některými autory definovány tzv. rizikové faktory zahrnující laboratorní parametry, dědičné dispozice k TEN a zejména užívání léků majících vztah ke vzniku TEN [10, 11, 12]. Tyto rizikové faktory jsou shrnuty v tabulce 1. Řada rizikových faktorů byla přítomna i u naší pacientky, tyto jsou vyznačeny v tabulce tučně. Jedním z nejvýznamnějších je bezpochyby vliv hormonální antikoncepce.
Table 1. Rizikové faktory tromboembolických komplikací u pacientů s nefrotickým syndromem (rizikové faktory přítomné u naší pacientky jsou zvýrazněny tučně). 
Pacientka z této kazuistiky má ve vztahu k tromboembolické nemoci negativní rodinnou anamnézu. Hlavním rizikovým faktorem TEN byl nefrotický syndrom a jeho důsledek, hyperkoagulační stav. Za prediktory individuálního rizika TEN mohou být považovány nízký sérový albumin (<25 g/l), vysoká proteinurie (>10 g/den), vysoká hladina fibrinogenu, nízká hladina AT III (<75 %) a hypovolemie, které jsou spojeny s vysokým rizikem TEN [10]. Naše pacientka splňuje 4 z 5 těchto kritérií.
Druhým významným protrombotickým faktorem byla hormonální antikoncepce. Ostatní hereditární hyperkoagulační stavy byly vyloučeny.
Lokalizace primární trombózy nebyla nalezena, ultrazvukové vyšetření zaměřené na nalezení primárního zdroje embolizace bylo negativní, stejně jako klinické symptomy předchozí hluboké žilní trombózy. Elevace CRP byla důsledkem plicní embolie, pacientka v době přijetí neměla známky bakteriální infekce. Některé práce zmiňují CRP spolu s validnějším NT-proBNP u diagnózy PE jako prognostický marker asociovaný se stupněm dysfunkce pravé komory [13].
Samotná manifestace NS s minimálními změnami glomerulů je rovněž neobvyklá ve věku 18 let. NS na podkladě minimálních změn glomerulů je nejčastější příčinou NS u dětí, ve věkové kategorii pod 10 let tvoří 70–90 % případů, u starších pak 50 %. U dospělých je příčinou NS pouze u 10–15 % pacientů. Ve srovnání s dětmi je u dospělých vyšší četnost komplikací NS zahrnujících hypertenzi, hematurii, akutní renální selhání. Waldman et al. [14] publikovali retrospektivní studii zahrnující 95 dospělých pacientů (z nich 61 % žen) s NS na podkladě minimálních změn glomerulů. Z této skupiny došlo u 24 pacientů k akutnímu renálnímu selhání (u 17 při manifestaci NS, u 7 při relapsu). Čtyři pacienti měli trombotickou komplikaci, hypertenze byla přítomna u 43 % a hematurie u 29 % pacientů.
Z našeho pracoviště byla publikována kazuistika rozsáhlé trombózy vena cava inferior s plicní embolizací u 15letého pacienta s nefrotickým syndromem [15].
ZÁVĚR
Uvedená kazuistika dokumentuje raritní manifestaci NS s minimálními změnami glomerulů u 18leté pacientky prostřednictvím jeho velmi závažné komplikace, masivní PE. Přestože PE je u dětských pacientů neobvyklou diagnózou, NS by měl být vždy diferenciálně diagnosticky zvažován jako příčina PE a všichni tito pacienti by měli podstoupit vyšetření moči na proteinurii.
Došlo: 14. 5. 2012
Přijato: 20. 9. 2012
MUDr. Filip Fencl, Ph.D.
Pediatrická klinika UK 2. LF
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: filip.fencl@gmail.com
Sources
1. Singhal R, Brimble KS. Thromboembolic complications in the nephrotic syndrome: pathophysiology and clinical management. Thromb Res 2006; 118 (3): 397–407.
2. Llach F. Hypercoagulability, renal vein thrombosis, and other thrombotic complications of nephrotic syndrome. Kidney Int 1985; 28 (3): 429–439.
3. Rabelink TJ, Zwaginga JJ, Koomans HA, Sixma JJ. Thrombosis and hemostasis in renal disease. Kidney Int 1994; 46 (2): 287–296.
4. Crew RJ, Radhakrishnan J, Appel G. Complications of the nephrotic syndrome and their treatment. Clin Nephrol 2004; 62 (4): 245–259.
5. Retzinger GS. Hypercoagulability in the nephrotic syndrome. Lab Lines 2001; 7 (3): 1–2.
6. McPheeters RA, Purcell TB, Snyder DL, Peterson RT. Fatal pulmonary embolism in a 10-year old with nephrotic syndrome. Cal J Emerg Med 2003; 4 (2): 36–38.
7. Jones CL, Hebert D. Pulmonary thrombo-embolism in the nephrotic syndrome. Pediatr Nephrol 1991; 5 (1): 56–58.
8. Bellomo R, Atkins RC. Membranous nephropathy and thromboembolism: is prophylactic anticoagulation warranted? Nephron 1993; 63 (3): 249–254.
9. Kayali F, Najjar R, Aswad F, Matta F, Stein PD. Venous thromboembolism in patients hospitalized with nephrotic syndrome. Am J Med 2008; 121 (3): 226–230.
10. Robert A, Olmer M, Sampol J, Gugliotta JE, Casanova P. Clinical correlation between hypercoagulability and thrombo-embolic phenomena. Kidney Int 1987; 31 (3): 830–835.
11. Mahmoodi BK, ten Kate MK, Waanders F, Veeger NJ, Brouwer JL, Vogt L, et al. High absolute risks and predictors of venous and arterial thromboembolic events in patients with nephrotic syndrome: results from a large retrospective cohort study. Circulation 2008; 117 (2): 224–230.
12. Kerlin BA, Blatt NB, Fuh B, Zhao S, Lehman A, Blanchong C, et al. Epidemiology and risk factors for thromboembolic complications of childhood nephrotic syndrome: a Midwest Pediatric Nephrology Consortium (MWPNC) study. J Pediatr 2009; 155 (1): 105–110.
13. Abul Y, Karakurt S, Ozben B, Toprak A, Celikel T. C-reactive protein in acute pulmonary embolism. J Investig Med 2011; 59 (1): 8–14.
14. Waldman M, Crew RJ, Valeri A, Busch J, Stokes B, Markowitz G, et al. Adult minimal-change disease: clinical characteristics, treatment, and outcomes. Clin J Am Soc Nephrol 2007; 2 (3): 445–453.
15. Janda J, Zabrodsky V, Spatenka J, Tuma S. Thrombosis of the inferior vena cava with successive lung embolization in a 15-year-old boy with the nephrotic syndrome. Padiatr Padol 1986; 21 (2): 177–182.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2013 Issue 1-
All articles in this issue
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
- Tělesná aktivita a návykové nemoci: překvapivá zjištění
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




