-
Medical journals
- Career
Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
Authors: Šenolt Ladislav; Kolektiv Výboru České Revmatologické Společnosti: Karel Pavelka; Mann Heřman; Horák Pavel; Tegzová Dana; Olejárová Marta; Bradna Petr; Bortlík Ladislav; Šmucrová Hana; Fojtík Zdeněk; Doležalová Pavla; Forejtová Šárka; Macháček Stanislav; Dvořák Zdeněk; Sedláčková Marie; Tomčík Michal; Hrnčíř Zbyněk; Vencovský Jiří
Published in: Čes. Revmatol., 28, 2020, No. 4, p. 197-205.
Category: Recomendation
Overview
Pandemie akutním respiračním onemocněním COVID-19 způsobena novým typem koronaviru SARS-CoV-2 významně ovlivnila lékařskou praxi. Pacienti s autoimunitním zánětlivým revmatickým onemocněním mají zvýšené riziko infekcí, a to nejen na podkladě vysoké aktivity revmatického onemocnění, ale zejména pod vlivem dlouhodobé kortikoterapie, chorobu modifikující antirevmatické a imunosupresivní léčby. V kontextu infekce SARS-CoV-2 a revmatických onemocnění přibývá množství často i protichůdných sdělení. Česká revmatologická společnost (ČRS) se rozhodla diskutovat obecná preventivní opatření infekce SARS-CoV-2, riziko nákazy a závažného průběhu onemocnění COVID-19 a vliv chorobu modifikující léčby na průběh COVID-19 u revmatických pacientů. Důležitým krokem bylo také poskytnout revmatologům praktický návod jak postupovat v léčbě pacientů s autoimunitním zánětlivým revmatickým onemocněním během pandemie COVID-19, včetně předběžného stanoviska k očkování proti SARS-CoV-2. Stanovisko ČRS se opírá o provizorní návod Evropské ligy proti revmatismu (EULAR) revidovanou verzi Americké asociace revmatologů (ACR) a nejnovější poznatky o nemoci COVID-19 u pacientů s autoimunitním zánětlivým revmatickým onemocněním.
Klíčová slova:
COVID-19 – infekce – autoimunitní zánětlivá revmatická onemocnění – chorobu modifikující léčba – glukokortikoidy
ÚVOD
V roce 2020 zasáhla celý svět pandemie akutním respiračním onemocněním COVID-19, která je způsobena novým koronavirem s označením SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2) a byla poprvé popsána koncem roku 2019 v čínském městě Wu-chan (1). Celosvětově bylo ke konci roku 2020 hlášeno více než 82 milionů lidí s COVID-19, přičemž více než 1,8 milionů z důvodu nákazy zemřelo (2). V době jarní (první) vlny byla vypracována provizorní doporučení Evropské ligy proti revmatismu (EULAR jak postupovat v léčbě pacientů se zánětlivým revmatickým onemocněním během pandemie COVID-19 (3). Restriktivní opatření přijatá na jaře 2020 v České republice přispěla k úspěšnému zvládnutí šíření nemoci COVID-19. S léčbou revmatických pacientů nakažených SARS-CoV-2 tak nebylo v té době dostatek zkušeností, nicméně během podzimní (druhé) vlny pandemie se Česká republika stala jednou z nejpostiženějších zemí počtem nakažených i zemřelých z důvodu COVID-19 na počet obyvatel (2). Česká revmatologická společnost (ČRS) se tak rozhodla vydat praktický návod jak postupovat v léčbě pacientů se zánětlivým revmatickým onemocněním během pandemie COVID-19 a stanovisko k očkování proti SARS-CoV-2. Návod vychází primárně z provizorních doporučení EULAR, revidované verze Americké asociace revmatologů (ACR) a z nových poznatků o nemoci COVID-19 u pacientů s autoimunitním zánětlivým revmatickým onemocněním (3–5).
OBECNÁ OPATŘENÍ A PREVENCE INFEKCE SARS-CoV-2
Pacientům s revmatickým onemocněním by mělo být doporučeno, aby dodržovali všechna preventivní a kontrolní opatření předepsaná směrnicí ministerstva zdravotnictví stejně jako pacienti bez revmatického onemocnění.
Pokud není podezření nebo potvrzení nemoci COVID-19, mělo by být doporučeno pokračovat v zavedené revmatologické léčbě beze změny, což platí pro nesteroidní antirevmatika, analgetika, glukokortikoidy, léčbu osteoporózy, syntetická i biologická chorobu modifikující léčiva. Toto doporučení je důležité s ohledem na ujištění pacientů se zánětlivým revmatickým onemocněním, kteří se obávají bezpečnosti jejich léčby v kontextu nemoci COVID-19.
RIZIKO NÁKAZY ONEMOCNĚNÍM COVID-19 U REVMATICKÝCH PACIENTŮ
Pacienti se zánětlivým revmatickým onemocněním, zejména pokud jsou vystaveni vlivu dlouhodobé kortikoterapie, chorobu modifikujícím antirevmatickým léčivům a imunosupresivní terapii, mají obecně zvýšené riziko infekčních komplikací (6). Není zatím jasné, zda u revmatických onemocnění existuje také vyšší riziko nákazy infekcí SARS-CoV-2. Na podkladě dostupných dat se zdá, že vnímavost pacientů se zánětlivým nebo autoimunitním onemocněním k nákaze SARS-CoV-2 je podobná jako u běžné populace (7–10). Metaanalýza observačních a kontrolovaných studií však prokázala dvojnásobně vyšší riziko nákazy infekcí SARS-CoV-2 u pacientů s autoimunitním revmatickým onemocněním proti kontrolní skupině, a to zejména při terapii glukokortikoidy (11). Lze tedy konstatovat, že pacienti s revmatickým onemocněním mají přibližně stejné riziko nebo mírně zvýšené riziko nákazy SARS-CoV-2, a to zejména v kontextu léčby glukokortikoidy.
RIZIKOVÉ FAKTORY ZÁVAŽNÉHO PRŮBĚHU ONEMOCNĚNÍ COVID-19 U REVMATICKÝCH PACIENTŮ
V běžné populaci patří mezi hlavní rizikové faktory těžkého průběhu COVID-19 vyšší věk (> 65 let), mužské pohlaví, nadváha a některá přidružená onemocnění (diabetes mellitus, kardiovaskulární a další chronická onemocnění) (12). Riziko závažnosti jakékoliv infekce u revmatických pacientů obecně vzrůstá s přítomností vážné infekce v anamnéze, při vysoké aktivitě základního revmatického onemocnění, ale i s věkem a přidruženými komorbiditami (13).
Na podkladě současných poznatků nelze jednoznačně konstatovat, že by samotné zánětlivé revmatické onemocnění nebo chorobu modifikující antirevmatická léčba představovaly zvýšené riziko vážného průběhu COVID-19. Analýza prvních 600 pacientů z mezinárodního registru pacientů s revmatickým onemocněním a COVID-19 (Global Rheumatology Alliance physician-reported registry, https://rheum-covid.org) zatím nenaznačuje negativní vliv zánětlivého revmatického onemocnění ani chorobu modifikující antirevmatické léčby na závažnost COVID-19 s nutností hospitalizace (14). Mezi hlavní rizikové faktory závažného průběhu COVID-19 patří vyšší věk, délka trvání revmatického onemocnění a počet přidružených komorbidit, které jsou u revmatických pacientů častější (15). Na podkladě analýzy prvních 6 měsíců pandemie v USA lze konstatovat, že pacienti s revmatickým onemocněním nemají v porovnání s běžnou populací v důsledku nemoci COVID-19 vyšší riziko hospitalizace, přijetí na jednotku intenzivní péče ani úmrtí (16). Nicméně se jednalo o pouze malý soubor 143 pacientů. Nejrozsáhlejší multicentrická analýza 2379 pacientů z USA však prokázala, že pacienti se systémovým autoimunitním revmatickým onemocněním, z nichž polovina měla revmatoidní artritidu, neměli sice vyšší riziko úmrtí nebo nutnost ventilační podpory, ale měli celkově horší prognózu a častější potřebu hospitalizace, přijetí na jednotku intenzivní péče, rozvoje akutní renální insuficience a tromboembolické nemoci při onemocnění COVID-19, což bylo podmíněno četnějšími komorbiditami (17). Pokud však byly do statistického modelu přiřazeny komorbidity, nebyly již, kromě vyššího rizika tromboembolických příhod, ostatní parametry závažnějšího průběhu COVID-19 u systémových autoimunitních revmatických onemocnění statisticky četnější.
Analýza menší španělské kohorty 123 pacientů ukazuje, že pacienti s COVID-19 a se systémovým onemocněním pojiva mají více než trojnásobné riziko nutnosti hospitalizace než pacienti s chronickou zánětlivou artritidou (18). Výsledky rozsáhlé kohortové studie z Velké Británie poukazují na to, že u pacientů se systémovým onemocněním pojiva je proti běžné populaci vyšší riziko úmrtí z jakékoliv příčiny během onemocnění COVID-19 (19). Není však jasné, zda je tou příčinou vlastní infekce SARS-CoV-2 nebo omezení zdravotní péče během pandemie.
V současné době tak nelze učinit jednoznačný závěr, ale na podkladě stávajících zkušeností se zdá, že na rozdíl od běžných komorbidit, jako je obezita, kardiovaskulární nebo plicní onemocnění, není pravděpodobně riziko vážného průběhu nebo úmrtí spojené s COVID-19 u pacientů se zánětlivým revmatickým onemocněním zvýšené. Pacienti s revmatickým onemocněním by ale měli být při onemocnění COVID-19 intenzivněji sledováni pro zvýšené riziko tromboembolických komplikací.
VLIV LÉČBY NA ZÁVAŽNOST PRŮBĚHU ONEMOCNĚNÍ COVID-19 U REVMATICKÝCH PACIENTŮ
Pokud jsou pacienti s imunitně zprostředkovaným zánětlivým onemocněním léčeni cytokinovými inhibitory (anti-TNF, anti-IL-6R a anti-IL-17), mají nižší výskyt IgG protilátek SARS-CoV-2 ve srovnání se zdravými jedinci nebo s pacienty, kteří tuto biologickou léčbu nedostávají (20). Dalo by se tak spekulovat, že biologická léčba částečně chrání před infekcí SARS-CoV-2, přispívá k asymptomatickému nebo mírnějšímu klinickému průběhu nemoci COVID-19, ale nelze ani vyloučit utlumenou reakci imunitního systému.
Výše uvedené zjištění podporují i výsledky z registrů. Např. na výše zmíněném souboru 600 pacientů s revmatickým onemocněním a COVID-19 z registru 40 zemí bylo prokázáno, že riziko těžkého průběhu a nutnosti hospitalizace bylo u pacientů na léčbě biologickými přípravky nižší v porovnání s pacienty bez této léčby (14). Zdá se, že nesteroidní antirevmatika ani konvenční chorobu modifikující léčiva toto riziko minimálně nezvyšovaly (14). Podobně ve francouzské kohortě 694 pacientů se zánětlivým revmatickým onemocněním, kteří se nakazili infekcí SARS-CoV-2, bylo zjištěno, že léčba TNF inhibitory je provázena mírnější formou COVID-19 s méně častou nutností hospitalizace (15). Rozvoj těžké formy COVID-19 byl spojen kromě vyššího věku, mužského pohlaví, obezity a hypertenze také s léčbou glukokortikoidy, mykofenolátem a rituximabem. Methotrexát ani blokáda IL-6 nepředstavovala riziko závažného průběhu COVID-19 (15).
Na menším souboru 103 pacientů se zánětlivým revmatickým onemocněním z New Yorku byla kromě vyššího věku a známých komorbidit (hypertenze a chronická obstrukční plicní nemoc) popsána zvýšená pravděpodobnost přijetí k hospitalizaci u pacientů užívajících glukokortikoidy, ale ne biologickou léčbu (21). Podobně bylo ve výše zmíněné rozsáhlé multicentrické komparativní kohortové studii z USA prokázáno, že konvenční ani cílená chorobu modifikující léčba nemá vliv na vážnější průběh nemoci COVID-19 u pacientů s autoimunitním revmatickým onemocněním (17). Nepříznivý vliv na průběh nemoci COVID-19 mělo opakovaně potvrzené užívání glukokortikoidů.
Ve španělských a italských kohortových studiích nebyla také prokázána souvislost mezi chorobu modifikující léčbou a těžkým průběhem COVID-19 s nutností hospitalizace (22–24). Německý registr ale upozornil na těžší průběh, častější nutnost hospitalizace a ventilační podpory u nemocných na rituximabu (25).
Závěrem lze konstatovat, že jednoznačné riziko vážnějšího průběhu onemocnění COVID-19 představuje podávání glukokortikoidů, zejména při dávce 10 mg prednisonu a více denně. Zvýšené obezřetnosti je třeba u pacientů na rituximabu, ale zdá se, že ostatní cílená i konvenční chorobu modifikující léčiva nemají na průběh nemoci COVID-19 zásadní vliv. V případě cytokinových inhibitorů je naopak možné uvažovat o určitém protektivním vlivu před infekcí SARS-CoV-2, případně mírnějším klinickém průběhu onemocnění COVID-19. Léčba hydroxychlorochinem či chlorochinem nemá žádný efekt na vnímavost k infekci SARS-CoV-2 ani neovlivňuje průběh onemocnění (26, 27)
LÉČBA REVMATICKÝCH ONEMOCNĚNÍ V PŘÍPADĚ NOUZOVÉHO STAVU
Při léčbě revmatických pacientů v době pandemie COVID-19 existuje několik aspektů, které je třeba zohledňovat:
aktivita revmatického onemocnění
komorbidity
potenciální toxicita léčby
obava (rizikových) pacientů navštívit zdravotnické zařízení
Pokud je revmatické onemocnění stabilizované a nejsou příznaky toxicity imunosupresivní léčby, lze pravidelnou kontrolu krevních testů a ambulantní vyšetření pacienta dočasně odložit. Posunutí návštěvy je možné jednou, případně dvakrát, ale maximálně o 6 měsíců. V ideálním stavu je vhodné doporučit provést laboratorní kontrolu v místě bydliště a v případě potřeby provést konzultaci vzdáleně, nejlépe telefonicky/telekonferenčně nebo e-mailem. Některé pojišťovny umožnily vykazování distančních vyšetření speciálními kódy.
Doporučení EULAR z jara 2020 uvádí, že v případě aktivního revmatického onemocnění, kdy je nutné farmakologickou léčbu upravit nebo pokud byla farmakologická léčba nedávno zahájena, případně pokud je přítomna léková toxicita, tak by pacient a revmatolog měli zvážit riziko návštěvy zdravotnického zařízení s ohledem na místní omezení a rozhodnout se o dalším postupu společně (3). S ohledem na délku pandemie a zkušenosti je nezbytné, aby v těchto případech byli pacienti s revmatickým onemocněním vyšetřeni ambulantně nebo za hospitalizace, přičemž by se lékař a pacient měli řídit místními pokyny pro prevenci a kontrolu infekce, včetně použití ochranných pomůcek a prostředků, např. dezinfekčních gelů, nošení roušek/respirátorů, rukavic, ochranných štítů atp.
LÉČBA REVMATICKÝCH ONEMOCNĚNÍ PŘI NEPŘÍTOMNOSTI SARS-CoV-2 INFEKCE
V nepřítomnosti infekce nebo bez známé expozice SARS-CoV-2 je doporučováno pokračovat v zavedené chorobu modifikující antirevmatické léčbě (tab. 1). Revmatolog by v době pandemie COVID-19 neměl automaticky doporučovat ukončení chorobu modifikující léčby. Glukokortikoidy není vhodné bez důvodu náhle vysadit, ale je třeba je ponechat v co nejnižší možné účinné dávce.
Table 1. Revmatologická léčba v průběhu pandemie COVID-19 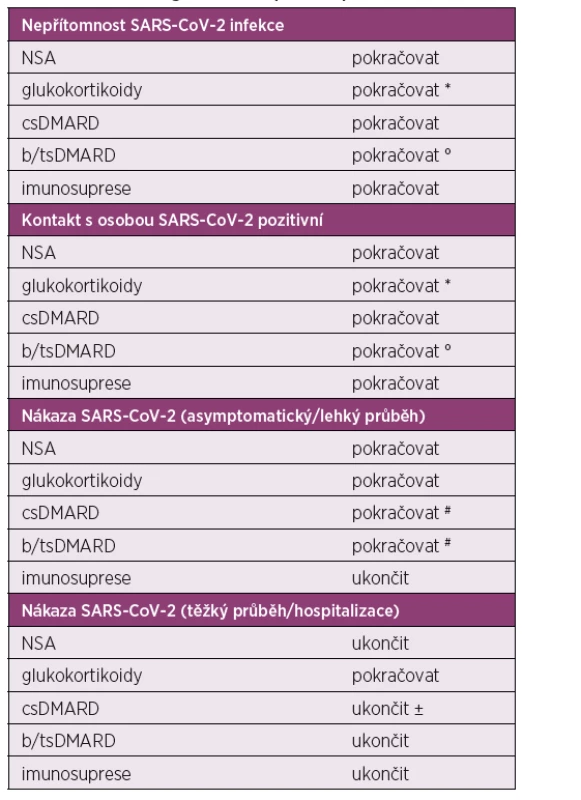
NSA – nesteroidní antirevmatika, csDMARD – konvenční syntetická chorobu modifikující antirevmatická léčba, b/tsDMARD – biologická/cílená syntetická chorobu modifikující antirevmatická léčba
* v co nejnižší možné dávce
° v případě rituximabu zvážit vynechání infuze
# individuální přístup, lze zvážit krátkodobé přerušení léčby, pokud se pacient bude cítit bezpečněji a nehrozí velké riziko exacerbace revmatického onemocnění
± možné pokračovat antimalarikyPři léčbě nově diagnostikovaného zánětlivého revmatického onemocnění nebo při exacerbaci etablovaného onemocnění je možné zahájit nízkou dávku glukokortikoidů (prednison ≤ 10 mg na den nebo jeho ekvivalent) a je také možné nově nasadit nebo změnit konvenční i cílenou chorobu modifikující léčbu.
V současné době není doporučováno provádět screeningové vyšetření na SARS-CoV-2 před zahájením (cílené) antirevmatické léčby (28).
Při souběžné léčbě ovlivňující CD20 lymfocyty byl popsán těžší průběh COVID-19 (15, 25), proto ČRS v současné době nepovažuje za vhodné zahajovat léčbu rituximabem, pokud existuje jiná alternativa nebo pokud to nutně nevyžaduje stav pacienta (např. plicní postižení u systémové sklerodermie). V případě, že pacient je již léčen rituximabem dlouhodobě, je třeba postupovat individuálně. Pokud je onemocnění stabilizované, lze spíše doporučit cyklus rituximabu přerušit, a to zejména s ohledem na možnost brzké vakcinace proti SARS-CoV-2 (29).
V případě systémového onemocnění pojiva nebo při život ohrožujícím orgánovém postižení (např. vaskulitida, SLE, nefritida, těžká zánětlivá myopatie) doporučuje ČRS v souladu s pracovní skupinou EULAR a ACR (3, 4) zahájit vysoké dávky glukokortikoidů, včetně imunosupresivní léčby.
LÉČBA REVMATICKÝCH ONEMOCNĚNÍ PO KONTAKTU S OSOBOU SARS-CoV-2 POZITIVNÍ
Pacienti s revmatickým onemocněním, kteří byli v epidemiologicky významném kontaktu se SARS-CoV-2-pozitivním jedincem, by měli být testováni na SARS-CoV-2. Pracovní skupinou EULAR byla tato situace diskutována asi nejvíce. Přestože bylo původně navrženo některá léčiva na několik dnů do negativního testu vysadit, nakonec bylo rozhodnuto chorobu modifikující léčbu za této situace nevysazovat. Revidovaná doporučení ACR naopak v tomto případě umožňují pokračovat symptomaticky pouze nesteroidní antirevmatika, antimalarika nebo sulfasalazin a jako součást sdíleného rozhodnutí biologickou léčbu proti receptoru IL-6. Přechodně doporučují vysadit všechny ostatní chorobu modifikující léky na dobu 2 týdnů nebo do negativního testu.
Po zvážení všech okolností nedoporučuje ČRS u asymptomatických jedinců zavedenou léčbu ukončovat a přiklání se k návrhu pracovní skupiny EULAR.
LÉČBA REVMATICKÝCH ONEMOCNĚNÍ PŘI INFEKCI SARS-CoV-2
Pokud je pacient s revmatickým onemocněním SARS-CoV-2 pozitivní nebo má příznaky COVID-19 a je chronicky léčen glukokortikoidy, měla by tato léčba dále pokračovat (tab. 1).
Pokud je pacient s revmatickým onemocněním asymptomatický nebo má jen mírné příznaky COVID-19 (tab. 2), měl by být přístup individuální, ale v podstatě je podle doporučení pracovní skupiny EULAR možné v chorobu modifikující léčbě pokračovat (3). Druhá verze pracovní skupiny ACR doporučuje naopak bez ohledu na závažnost onemocnění COVID-19 přerušit podávání sulfasalazinu, methotrexátu, leflunomidu, všech imunosupresivních léčiv, biologických léků a JAK inhibitorů (4). Ponechat je možné pouze antimalarika a za vybraných okolností jako součást sdíleného rozhodnutí i biologickou léčbu proti receptoru IL-6.
Table 2. Příznaky COVID-19 (upraveno podle (3)) 
ČRS se přiklání spíše k návrhu pracovní skupiny EULAR a doporučuje v případě mírného průběhu COVID-19 zachování stávající chorobu modifikující léčby (viz tab. 1). Pokud se ale pacient bude cítit bezpečněji a nehrozí-li velké riziko exacerbace základního revmatického onemocnění, může být rozumnou alternativou krátkodobé přerušení této léčby.
V případě zhoršení iniciálně mírných příznaků COVID-19 infekce (horečka ≥38 °C, dušnost, tachypnoe, hypoxie nebo cyanóza) by měla být vyhledána odborná lékařská pomoc. Praktický lékař, často na podkladě telefonického hovoru, by měl zhodnotit závažnost příznaků; onemocnění může vyžadovat mezioborovou spolupráci, většinou mezi specialisty na infekční choroby, pneumologem, případně internistou nebo lékařem intenzivní péče. Chorobu modifikující léčba by měla být přerušena do vyléčení infekce (viz tab. 1). Pokud pacient dostává dlouhodobě glukokortikoidy, mělo by se pokračovat ve stejné dávce.
Pacient s revmatickým onemocněním, který je přijat do nemocnice pro závažné příznaky COVID-19, by měl podstoupit léčbu infekce podle lokálně platného protokolu léčby COVID-19. Základem je udržení saturace krve kyslíkem nad 90 %, u středně těžších forem se doporučuje kortikoterapie (nejvíce dokladů je pro dexamethason), prevence tromboembolických příhod, remdesivir a časné podání rekonvalescentní plazmy. Podpůrně se podává vitamin C a vitamin D. Péče o nemocné v těžkém stavu zahrnuje multidisciplinární přístup, těžké případy je nutné izolovat na jednotkách intenzivní péče nebo ARO, indikována je invazivní ventilace, případně extrakorporální membránová oxygenace.
Experimentálně se zkouší řada přípravků, včetně inhibitorů receptoru IL-6, inhibitorů Janus kináz (baricitinib), ovlivnění faktoru stimulující kolonie granulocytů a makrofágů (GM-CSF), inhibitory replikace virů atd. (30). Výsledky jsou v některých případech protichůdné. Remdesivir např. vedl k rychlejšímu uzdravení, ale neměl významný účinek na delší přežití, což bylo pozorováno v kombinaci baricitinib a remdesivir (31, 32).
Opětované nasazení antirevmatické léčby by mělo být zváženo po 1–2 týdnech od vymizení symptomů infekce v nekomplikovaných případech COVID-19 infekce, u komplikovaných případů je nutné postupovat individuálně.
PREVENCE INFEKCÍ A PŘEDBĚŽNÉ STANOVISKO K OČKOVÁNÍ PROTI SARS-CoV-2
Pacientům s revmatickým onemocněním bez příznaků COVID-19 by mělo být doporučeno aktualizovat jejich vakcinaci v souladu s doporučeními EULAR pro očkování pacientů s revmatickým onemocněním (3), a to zvláště se zaměřením na pneumokoky a chřipku, přičemž v současné době začíná být aktuální také vakcinace proti samotnému SARS-CoV-2. Na toto téma vyvstává několik otázek.
Je vakcína proti SARS-CoV-2 bezpečná?
Který typ vakcíny je vhodný pro pacienty s imunitně podmíněným onemocněním?
Na jak dlouho bude vytvořena dostatečná imunitní odpověď a bude tomu stejně u imunokompromitovaných pacientů?
Je nutné při vakcinaci upravovat antirevmatickou léčbu?
Mají být očkováni nemocní, kteří prodělali COVID-19?
Na řadu z těchto otázek v současné době není jednoznačná odpověď. Obecně lze ale konstatovat, že vakcíny jsou bezpečné (33). Závažné nežádoucí účinky vakcinace, nejčastěji anafylaktické reakce, jsou velmi vzácné, což platí i pro vakcíny proti SARS--CoV-2 (34), a jejich riziko je významně převáženo nepříznivým vývojem pandemie a vážnými následky infekce SARS-CoV-2. Vakcína proti SARS-CoV-2 představuje velmi pravděpodobně jedinou reálnou šanci jak zvládnout pandemii COVID-19. V současné době není známo, na jak dlouho bude vytvořena dostatečná imunitní odpověď a v jakém časovém horizontu bude třeba vakcinaci opakovat. Spekuluje se o nutnosti očkovat jednou ročně.
Protože v klinických studiích s vakcínami proti SARS-CoV-2 nebyli zařazeni pacienti s autoimunitním onemocněním, neexistuje žádná evidence o účinnosti této vakcíny u pacientů s revmatickým onemocněním. Imunosupresivní léčba může negativně ovlivnit navození dostatečné imunitní odpovědi. Je možné ale očekávat, že tento účinek bude dostačující, tedy podobný jako při očkování proti chřipce (35). V současné době chybí informace, aby se dalo doporučit, která vakcína bude vhodnější pro pacienty s revmatickým onemocněním. Zatím je možné konstatovat, že očkování jakoukoliv vakcínou je lepší než vůbec žádné očkování.
Podávání nízkých dávek glukokortikoidů (≤ 7,5 mg prednisonu denně), pravděpodobně i středních dávek cca do dávky 20 mg prednisonu denně, nejspíše nemá na imunitní odpověď zásadní vliv (36). Při nutnosti podávat vysoké dávky glukokortikoidu je třeba postupovat individuálně a vždy zvažovat riziko aktivity základního revmatického onemocnění, zvažovat riziko expozice infekci a doporučit i nadále dodržovat protiepidemická opatření, případně změřit hladiny protilátek.
Podávání methotrexátu neovlivňuje protektivní účinnost vakcinace proti chřipce a pracovní skupinou EULAR není doporučenou methotrexát z těchto důvodů přerušovat (37), nicméně methotrexát vede k určitému snížení imunitní odpovědi na vakcinaci a vynechání dvou dávek methotrexátu po očkování vede k vylepšení této dopovědi (38). Nicméně pro vytvoření dostatečné imunity se nejdříve dostupné očkování proti SARS-CoV-2 provádí ve dvou dávkách v odstupu 3 (4) týdnů a je možné, že vynechání 4 týdnů methotrexátu by mohlo vést k exacerbaci základního onemocnění. Proto ČRS doporučuje individuální přístup a spíše doporučuje léčbu methotrexátem nepřerušovat, a to zejména v případě rizika exacerbace revmatického onemocnění. Pokud je navozena dlouhodobá remise revmatického onemocnění, je možné zvážit vynechání dvou dávek methotrexátu po každém z očkování, eventuálně alespoň po podání první dávky vakcíny.
Rituximab může významně snížit účinnost očkování, a je proto třeba očkovat v době, kdy jsou přítomné B-lymfocyty a plazmatické buňky schopné vyvinout dostatečnou protilátkovou odpověď (39). Pokud je již pacient léčen rituximabem, měla by být vakcína proti SARS-CoV-2 podána ideálně v odstupu 6 měsíců po posledním cyklu rituximabu, podobně jak je doporučeno při očkování proti chřipce (37). Následnou nebo vůbec první infúzi rituximabu je možné naplánovat minimálně 2, lépe 4 týdny od druhé vakcíny proti SARS-CoV-2 tak, aby byla umožněna dostatečná imunitní odpověď.
Vliv ostatních konvenčních chorobu modifikujících léčiv na účinnost vakcinace není významný, ostatní biologické a cílené syntetické přípravky pravděpodobně minimálně snižují imunitní odpověď na očkování, bez jasného klinického dopadu, proto je není nutné při očkování přerušovat (40).
V současné době nejsou k dispozici informace, a tudíž ani jednoznačná doporučení k očkování pro nemocné, kteří již prodělali COVID-19. Očkování proti SARS-CoV-2 po prodělaném onemocnění COVID-19 lze považovat za bezpečné a potenciálně poskytující další ochranu. Individuálně je možné počkat např. 2–3 měsíce po prodělaném onemocnění COVID-19 nebo podat pouze jednu dávku očkování, případně se řídit podle hladin protilátek IgG SARS-CoV-2.
U pacientů se systémovým revmatickým onemocněním, nejčastěji s těžkým SLE, vaskulitidou, sklerodermií nebo myozitidou, léčených cyklofosfamidem nebo glukokortikoidy, by měla být podávána profylaxe pneumonie způsobené Pneumocystis jiroveci (3).
ZÁVĚR
Pandemie COVID-19 významně změnila lékařskou praxi a do jisté míry ovlivňuje vedení léčby u pacientů s autoimunitním revmatickým onemocněním. Přestože se zdá, že většina chorobu modifikujících léčiv nemá na průběh COVID-19 a očkování proti SARS-CoV-2 zásadní vliv, je třeba považovat toto stanovisko za provizorní, a je možné, že s přibývajícími zkušenostmi a novými doporučeními EULAR může být v dohledné době revidováno.
KLÍČOVÉ BODY DOPORUČENÍ PRO PRAXI
1. Pacienti se zánětlivým revmatickým onemocněním mají pravděpodobně podobné nebo jen mírně zvýšené riziko nákazy SARS-CoV-2 jako jedinci bez revmatického onemocnění. Vyšší riziko pravděpodobně existuje pro pacienty se systémovým onemocnění pojiva, a to převážně v kontextu s kortikoterapií.
2. Pacienti s revmatickým onemocněním nemají v porovnání s běžnou populací vyšší riziko závažného průběhu nemoci COVID-19, které je spíše spojeno s věkem a komorbiditami. Vážnější průběh mohou mít pacienti se systémovým onemocněním pojiva.
3. Většina chorobu modifikujících léčiv není spojena se závažnějším průběhem COVID-19.Glukokortikoidy, zejména ve vyšších dávkách, představují riziko vážnějšího průběhu onemocnění COVID-19 a možné riziko existuje u pacientů na rituximabu.
4. Pokud není podezření na onemocnění COVID-19, mělo by být doporučeno pokračovat v zavedené revmatologické léčbě beze změny. Glukokortikoidy je třeba podávat v co nejnižších dávkách. Individuálně je třeba postupovat u pacientů na rituximabu, ke zvážení je v případě stabilizovaného stavu posunutí infuze.
5. V případě epidemiologicky významného kontaktu revmatického pacienta se SARS-CoV-2-pozitivním jedincem, nebo pokud má revmatický pacient asymptomatický, případně mírný průběh COVID-19, není nutné chorobu modifikující léčbu ukončovat.
6. Při zhoršení příznaků COVID-19 (horečka ≥38 °C, dušnost, tachypnoe, hypoxie nebo cyanóza) nebo při vážném průběhu by měla být chorobu modifikující léčba přerušena. V léčbě dlouhodobě podávanými glukokortikoidy je vhodné pokračovat ve stejné dávce.
7. Pacientům s revmatickým onemocněním by mělo být doporučeno aktualizovat jejich vakcinaci, a to zvláště se zaměřením na pneumokoky a chřipku, a podpořit je v rozhodnutí registrovat se na vakcinaci proti SARS-CoV-2.
8. Při očkování proti SARS-CoV-2 není nutné přerušovat konvenční chorobu modifikující léčbu, která spolu s nízkou až střední dávkou glukokortikoidů nevede k zásadnímu snížení imunitní odpovědi. Vakcína proti SARS-CoV-2 může být podána při cílené léčbě, ale v případě rituximabu ideálně 6 měsíců po posledním cyklu rituximabu, který může být nasazen 4 týdny od druhé aplikace vakcíny proti SARS-CoV-2.
Podpořeno projektem Ministerstva zdravotnictví ČR pro koncepční rozvoj výzkumné organizace 023728.
Konflikt zájmů: žádný.
adresa pro korespondenci:
prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav
Na Slupi 4, 128 00 Praha 2
e-mail: senolt@revma.cz
Sources
1. Cohen J, Normile D. New SARS-like virus in China triggers alarm. Science 2020; 367(6475): 234–235.
2. https://www.worldometers.info/coronavirus/
3. Landewé RB, Machado PM, Kroon F, et al. EULAR provisional recommendations for the management of rheumatic and musculoskeletal diseases in the context of SARS-CoV-2. Ann Rheum Dis 2020; 79(7): 851–858.
4. Mikuls TR, Johnson SR, Fraenkel L, et al. American College of Rheumatology Guidance for the Management of Rheumatic Disease in Adult Patients During the COVID-19 Pandemic: Version 2 [published online ahead of print, 2020 Jul 30]. Arthritis Rheumatol 2020; 10.1002/art.41437. doi:10.1002/art.41437
5. Lauper K, Bijlsma JWJ, Burmester GR. Trajectories of COVID-19 information in the Annals of the Rheumatic Diseases: the first months of the pandemic. Ann Rheum Dis 2021; 80(1): 26–30.
6. Listing J, Gerhold K, Zink A. The risk of infections associated with rheumatoid arthritis, with its comorbidity and treatment. Rheumatology (Oxford) 2013; 52(1): 53–61.
7. Sarzi-Puttini P, Marotto D, Caporali R, et al. Prevalence of COVID infections in a population of rheumatic patients from Lombardy and Marche treated with biological drugs or small molecules: A multicentre retrospective study. J Autoimmun 2020; 102545. doi:10.1016/j.jaut.2020.102545
8. Moradi S, Masoumi M, Mohammadi S, et al. Prevalence of coronavirus disease 2019 in rheumatic patients and evaluation of the effect of disease-modifying anti-rheumatic drugs. Intern Emerg Med 2020; 1–5. doi:10.1007/s11739-020-02535-5
9. Aries P, Iking-Konert C. No increased rate of SARS-CoV-2 infection for patients with inflammatory rheumatic diseases compared with the general population in the city of Hamburg (Germany). Ann Rheum Dis 2020; annrheumdis-2020-218400. doi:10.1136/annrheumdis-2020-218400
10. Zen M, Fuzzi E, Astorri D, Saccon F, et al. SARS-CoV-2 infection in patients with autoimmune rheumatic diseases in northeast Italy: A cross-sectional study on 916 patients. J Autoimmun 2020;112 : 102502. doi: 10.1016/j.jaut.2020.102502 [Epub 2020 Jun 8]. PMID: 32527675.
11. Akiyama S, Hamdeh S, Micic D, Sakuraba A. Prevalence and clinical outcomes of COVID-19 in patients with autoimmune diseases: a systematic review and meta-analysis. Ann Rheum Dis 2020; annrheumdis-2020-218946. doi:10.1136/annrheumdis-2020-218946 [Epub ahead of print]. PMID: 33051220; PMCID: PMC7554412.
12. Figliozzi S, Masci PG, Ahmadi N, et al. Predictors of adverse prognosis in COVID-19: A systematic review and meta-analysis. Eur J Clin Invest 2020; 50(10): e13362. doi:10.1111/eci.13362
13. Baillet A, Gossec L, Carmona L, et al. Points to consider for reporting, screening for and preventing selected comorbidities in chronic inflammatory rheumatic diseases in daily practice: a EULAR initiative. Ann Rheum Dis 2016; 75(6): 965–973.
14. Gianfrancesco M, Hyrich KL, Al-Adely S, et al. Characteristics associated with hospitalisation for COVID-19 in people with rheumatic disease: data from the COVID-19 Global Rheumatology Alliance physician-reported registry. Ann Rheum Dis 2020; 79(7): 859–866.
15. FAI2R/SFR/SNFMI/SOFREMIP/CRI/IMIDIATE consortium and contributors. Severity of COVID-19 and survival in patients with rheumatic and inflammatory diseases: data from the French RMD COVID-19 cohort of 694 patients. Ann Rheum Dis 2020; annrheumdis-2020-218310. doi:10.1136/annrheumdis-2020-218310.
16. Serling-Boyd N, D‘Silva KM, Hsu TY, et al. Coronavirus disease 2019 outcomes among patients with rheumatic diseases 6 months into the pandemic. Ann Rheum Dis 2020; annrheumdis-2020-219279. doi:10.1136/annrheumdis-2020-219279
17. D’Silva KM, Jorge A, Cohen A, McCormick N, Zhang Y, Wallace ZS, Choi HK. COVID-19 Outcomes in Patients with Systemic Autoimmune Rheumatic Diseases (SARDs) Compared to the General Population: A US Multi-Center Comparative Cohort Study. Arthritis Rheumatol 2020 Dec 10. doi:10.1002/art.41619 [Epub ahead of print]. PMID: 33305544.
18. Freites Nuñez DD, Leon L, Mucientes A, et al. Risk factors for hospital admissions related to COVID-19 in patients with autoimmune inflammatory rheumatic diseases [published online ahead of print, 2020 Aug 7]. Ann Rheum Dis 2020; annrheumdis-2020-217984. doi:10.1136/annrheumdis-2020-217984
19. Peach E, Rutter M, Lanyon P, et al. Risk of death among people with rare autoimmune diseases compared to the general popula-tion in England during the 2020 COVID-19 pandemic. Rheumato-logy (Oxford) 2020; keaa855. doi:10.1093/rheumatology/keaa855
20. Simon D, Tascilar K, Krönke G, et al. Patients with immune-mediated inflammatory diseases receiving cytokine inhibitors have low prevalence of SARS-CoV-2 seroconversion. Nat Commun 2020; 11(1): 3774.
21. Haberman RH, Castillo R, Chen A, et al; NYU WARCOV Investigators. COVID-19 in Patients With Inflammatory Arthritis: A Prospective Study on the Effects of Comorbidities and Disease-Modifying Antirheumatic Drugs on Clinical Outcomes. Arthritis Rheumatol 2020; 72(12): 1981–1989.
22. Monti S, Balduzzi S, Delvino P, et al. Clinical course of COVID-19 in a series of patients with chronic arthritis treated with immunosuppressive targeted therapies Annals of the Rheumatic Diseases 2020; 79 : 667–668.
23. Salvarani C, Bajocchi G, Mancuso P, et al. Susceptibility and severity of COVID-19 in patients treated with bDMARDS and tsDMARDs: a population-based study. Ann Rheum Dis 2020; 79(7): 986–988.
24. Jovani V, Calabuig I, Peral-Garrido ML, et al. Incidence of severe COVID-19 in a Spanish cohort of 1037 patients with rheumatic diseases treated with biologics and JAK-inhibitors [published online ahead of print, 2020 Jun 25]. Ann Rheum Dis 2020; annrheumdis-2020-218152. doi:10.1136/annrheumdis-2020-218152
25. Schulze-Koops H, Krueger K, Vallbracht I, Hasseli R, Skapenko A. Increased risk for severe COVID-19 in patients with inflammatory rheumatic diseases treated with rituximab. Ann Rheum Dis 2020; annrheumdis-2020-218075. doi:10.1136/annrheumdis-2020-218075 [Epub ahead of print]. PMID: 32591357; PMCID: PMC7371570.
26. Abella BS, Jolkovsky EL, Biney BT, Uspal JE, Hyman MC, Frank I, Hensley SE, Gill S, Vogl DT, Maillard I, Babushok DV, Huang AC, Nasta SD, Walsh JC, Wiletyo EP, Gimotty PA, Milone MC, Amaravadi RK; and the Prevention and Treatment of COVID-19 With Hydroxychloroquine (PATCH) Investigators. Efficacy and Safety of Hydroxychloroquine vs Placebo for Pre-exposure SARS-CoV-2 Prophylaxis Among Health Care Workers: A Randomized Clinical Trial. JAMA Intern Med 2020; e206319. doi:10.1001/jamainternmed.2020.6319 [Epub ahead of print]. PMID: 33001138; PMCID: PMC7527945.
27. Putman M, Chock YPE, Tam H, Kim AHJ, Sattui SE, Berenbaum F, Danila MI, Korsten P, Sanchez-Alvarez C, Sparks JA, Coates LC, Palmerlee C, Peirce A, Jayatilleke A, Johnson SR, Kilian A, Liew J, Prokop LJ, Murad MH, Grainger R, Wallace ZS, Duarte-García A; COVID-19 Global Rheumatology Alliance. Antirheumatic Disease Therapies for the Treatment of COVID-19: A Systematic Review and Meta-Analysis. Arthritis Rheumatol 2020; 10.1002/art.41469. doi:10.1002/art.41469 [Epub ahead of print]. PMID: 32741139; PMCID: PMC7435536.
28. Landewé RBM, Schulze-Koops H. Response to: Should patients starting biologics be screened for COVID-19? by Cardenas-de la Garza et al. [published online ahead of print, 2020 Jul 22]. Ann Rheum Dis 2020; annrheumdis-2020-218470. doi:10.1136/annrheumdis-2020-218470
29. Baker D, Roberts CAK, Pryce G, Kang AS, Marta M, Reyes S, Schmierer K, Giovannoni G, Amor S. COVID-19 vaccine-readiness for anti-CD20-depleting therapy in autoimmune diseases. Clin Exp Immunol 2020; 202(2): 149–161.
30. Chopra D, Boparai JK, Bhandari B, Srivastava A, Gupta R. Pharmacological strategies for COVID-19 – A review of the most promising repurposed antiviral drugs. Infect Disord Drug Targets 2020 Dec 18. doi:10.2174/1871526520666201218151841 [Epub ahead of print]. PMID: 33342420.
31. Beigel JH, Tomashek KM, Dodd LE, et al; ACTT-1 Study Group Members. Remdesivir for the Treatment of Covid-19 – Final Report. N Engl J Med 2020; 383(19): 1813–1826.
32. Kalil AC, Patterson TF, Mehta AK, et al. Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19. N Engl J Med 2020 Dec 11. doi:10.1056/NEJMoa2031994 [Epub ahead of print]. PMID: 33306283.
33. https://www.cdc.gov/vaccinesafety/index.html
34. Halstead SB, Katzelnick L. COVID-19 Vaccines: Should We Fear ADE? J Infect Dis 2020; 222(12): 1946–1950.
35. Chen C-M, Chen H-J, Chen W-S, et al. Clinical effectiveness of influenza vaccination in patients with rheumatoid arthritis. Int J Rheum Dis 2018; 21 : 1246–1253.
36. Westra J, Rondaan C, van Assen S, Bijl M. Vaccination of patients with autoimmune inflammatory rheumatic diseases. Nat Rev Rheumatol 2015; 11(3): 135–145.
37. Furer V, Rondaan C, Heijstek MW, et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2020; 79(1): 39–52.
38. Park JK, Lee YJ, Shin K, et al. Impact of temporary methotrexate discontinuation for 2 weeks on immunogenicity of seasonal influenza vaccination in patients with rheumatoid arthritis: a randomised clinical trial. Ann Rheum Dis 2018; 77(6): 898–904.
39. Baker D, Roberts CAK, Pryce G, et al. COVID-19 vaccine-readiness for anti-CD20-depleting therapy in autoimmune diseases. Clin Exp Immunol 2020; 202(2): 149–161.
40. Subesinghe S, Bechman K, Rutherford AI, Goldblatt D, Galloway JB. A Systematic Review and Metaanalysis of Antirheumatic Drugs and Vaccine Immunogenicity in Rheumatoid Arthritis. J Rheumatol 2018; 45(6): 733–744.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 4-
All articles in this issue
-
Něco staré končí,
něco nové začíná…. - Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
-
Nízkodávková výpočetní tomografie s cínovou filtrací v diagnostice sakroiliitidy –
naše první zkušenosti - Kardiotoxicita cyklofosfamidu při léčbě mikroskopické polyangiitidy
- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
-
Něco staré končí,
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
- Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

