-
Medical journals
- Career
Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
Authors: M. A. Sokalska-Jurkiewicz 1; M. Kment 2; R. Ryšavá 3; L. Šedová 1
Authors‘ workplace: Revmatologický ústav Praha 1; Institut klinické a experimentální medicíny, Praha 2; Klinika nefrologie 1. LF UK a VFN, Praha 3
Published in: Čes. Revmatol., 28, 2020, No. 4, p. 248-252.
Category: Case Report
Overview
ANCA asociované vaskulitidy (AAV) je skupina vzácných, autoimunitních zánětlivých onemocnění s přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Podstatou nemocí je zánět malých cév (polyangiitida) s tvorbou granulomů a vznikem nekrózy. Postižení ledvin je jednou s nejzávažnějších klinických manifestaci AAV a často má formu rychle progredující glomerulonefritidy. V článku popisujeme případ pacienta s projevy granulomatózy s polyangiitidou s postižením ledvin, u kterého vstupní biopsie ledviny neprokázala přítomnost glomerulonefritidy. Pacient byl přes to intenzivně léčen glukokortikoidy, cyklofosfamidem a azathioprinem. Vzhledem k progresi močového nálezu byla provedena rebiopsie, která tentokrát již prokázala aktivní glomerulonefritidu. Terapeuticky byl podán rituximab s dobrým efektem. V této kazuistice se poukazuje na to, že i přes úvodní negativní výsledek biopsie u pacienta došlo k vývoji závažné, rychle progredující glomerulonefritidy, nereagující na terapii cyklofosfamidem a vyžadující podání rituximabu k dosažení remise.
Klíčová slova:
ANCA – ANCA asociované vaskulitidy – glomerulonefritida – renální biopsie – rituximab
ÚVOD
ANCA asociované vaskulitidy (AAV) je skupina závažných, vzácných, autoimunitních zánětlivých onemocnění s typickou přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Podstatou nemocí je zánět malých cév (polyangiitida) s tvorbou granulomů a vznikem nekróz patrných v histopatologickém nálezu. Roční výskyt AAV se pohybuje mezi 13 a 20 novými případy na milion obyvatel, nemoc postihuje obě pohlaví obdobně s možnou mírnou preferencí mužů a vrchol incidence je mezi pátou a šestou dekádou života (1). Obecný princip etiopatogeneze AAV je obdobný jako u ostatních autoimunitních nemocí a spočívá v kombinaci vlivu zevních faktorů (např. infekční agens, léky, konzervující látky, znečištění ovzduší) a genetické dispozice. Na buněčné úrovni mají významnou patogenetickou úlohu ANCA protilátky, které jsou silným aktivátorem neutrofilů. Po aktivaci uvolňují tyto buňky prozánětlivé cytokiny, lytické enzymy a reaktivní kyslík (2). Navíc dle recentních literárních zdrojů aktivované neutrofily intenzivně tvoří neutrofilní extracelulární pasti (NETs), které vedou k poškození malých cév a zároveň stimulují další tvorbu ANCA protilátek (2).
Do skupiny AAV patří granulomatóza s polyangiitidou (GPA), eozinofilní granulomatóza s polyangiitidou (EGPA), mikroskopická polyangiitida (MPA) a léky indukovaná AAV.
Tyto nemoci mají značný sklon k relapsům a špatnou prognózu. V generalizované systémové formě AAV postihují dýchací cesty a ledviny, ale zánětlivé změny se mohou objevit prakticky v každém orgánu, což vede ke vzniku velmi pestrého klinického obrazu nemoci.
Postižení ledvin je jednou s nejzávažnějších klinických manifestaci AAV. Objevuje se častěji u MPA (90 %), GPA (80 %) a méně často u EGPA (45 %) (3). Často se projevuje jako rychle progredující glomerulonefritida (RPGN) s nálezem hematurie s dysmorfními erytrocyty a erytrocytárními válci, proteinurie a poklesem renálních funkcí. Pro RPGN je příznačná přítomnost srpků (crescents). Synonymem pro RPGN je označení srpkovitá glomerulonefritida s přítomností alespoň 50 % srpků v renální biopsii a poklesem glomerulární filtrace (4). V případě GPA je postižení ledvin přítomné ihned při první manifestaci nemoci u 17 % pacientů a je obvykle asymptomatické (5). Bez terapie může snadno vést k finálnímu selhání ledvin s nutností trvalé dialyzační léčby (6).
POPIS PŘÍPADU
Pacient, 56 let, bez závažné osobní anamnézy, exkuřák (10 balíčko-roků) se dostavil k vyšetření k praktickému lékaři pro dlouhodobé stěhovavé artralgie a 3 měsíce trvající artritidy, postihující hlavně klouby dolních končetin. Na podkladě klinického obrazu byla vyslovená suspekce na lymeskou boreliózu a pacient absolvoval čtyřtýdenní kúru doxycyklinem zcela bez efektu. S odstupem byly vyšetřené protilátky proti Borrelia spp. s negativním výsledkem. Následně došlo ke vzniku ústních ulcerací, drobné purpury na dolních končetinách, rozvoji febrilních špiček, únavy, konjunktivitidy a byla zjištěná významná elevace CRP. Se suspekcí na autoimunitní onemocnění byl pacient odeslán k hospitalizaci do Revmatologického ústavu v Praze. Za hospitalizace se stav pacienta postupně horšil, přetrvávaly febrilie, únava, ústní ulcerace a polyartritida, nově se objevila polakisurie. Laboratorně přetrvávaly vysoké reaktanty akutní fáze (sedimentace erytrocytů 101 mm/ hodinu, sérový C-reaktivní protein 250 mg/l, sérový ferritin 1300 µg/l),dále byla zjištěna pozitivita revmatoidního faktoru, ANCA protilátek – anti-PR3 (c-AN-CA), leuko - a erytrocyturie s proteinurii 3,5 g/den). Na podkladě provedených vyšetření bylo vysloveno podezření na AAV s postižením ledvin. Úvodní renální funkce byly v normě. V rámci diferenciální diagnostiky byl proveden základní onkologický screening a bylo pátráno po infekčních fokusech. Proto byla během hospitalizace provedená extrakce dvou kariézních zubů se známkami infekce u kořene na panoramatickém snímku.
Následně pacient byl indikován k renální biopsii a přeložen na nefrologickou kliniku, kde byla provedená punkce levé ledviny. Biopsie nebyla bohužel dosti reprezentativní (malý vzorek) a zastihla jen několik glomerulů bez srpků, bez nekróz či postižení intersticia (obr. 1, tab. 1). I přes tento negativní nález byl stav po konzultaci s nefrology hodnocen jako AAV charakteru granulomatózy s polyangiitidou (GPA), a to na podkladě přítomnosti ústních ulcerací, konjunktivitidy, polyartritidy, purpury dolních končetin, močového nálezu (erytrocyturie a proteinurie), febrilií a pozitivity ANCA protilátek PR3. Následně byla zahájená terapie glukokortikoidy: byly podány tři pulzy methylprednisolonu po 500 mg 3 dny po sobě a bylo pokračováno v perorálním prednisonu v dávce 70 mg/den. Jíž po podání methylprednisolonu došlo k promptnímu poklesu reaktantů akutní fáze a zlepšení klinického stavu pacienta. Dále se pokračovalo v léčbě šesti pulzy cyklofosfamidu v dávce 15 mg/kg tělesné hmotnosti v intenzifikovaném režimu (první tři pulzy po 2 týdnech, další tři pulzy po 3 týdnech) a bylo započato v redukci dávek prednisonu. Pacient se zároveň současně s pulzy cyklofosfamidu zúčastnil klinického hodnocení s avacopanem (blokátor receptoru pro složku komplementu C5a) (7).
Table 1. Tabelární znázorněni výsledků biopsie ledvin 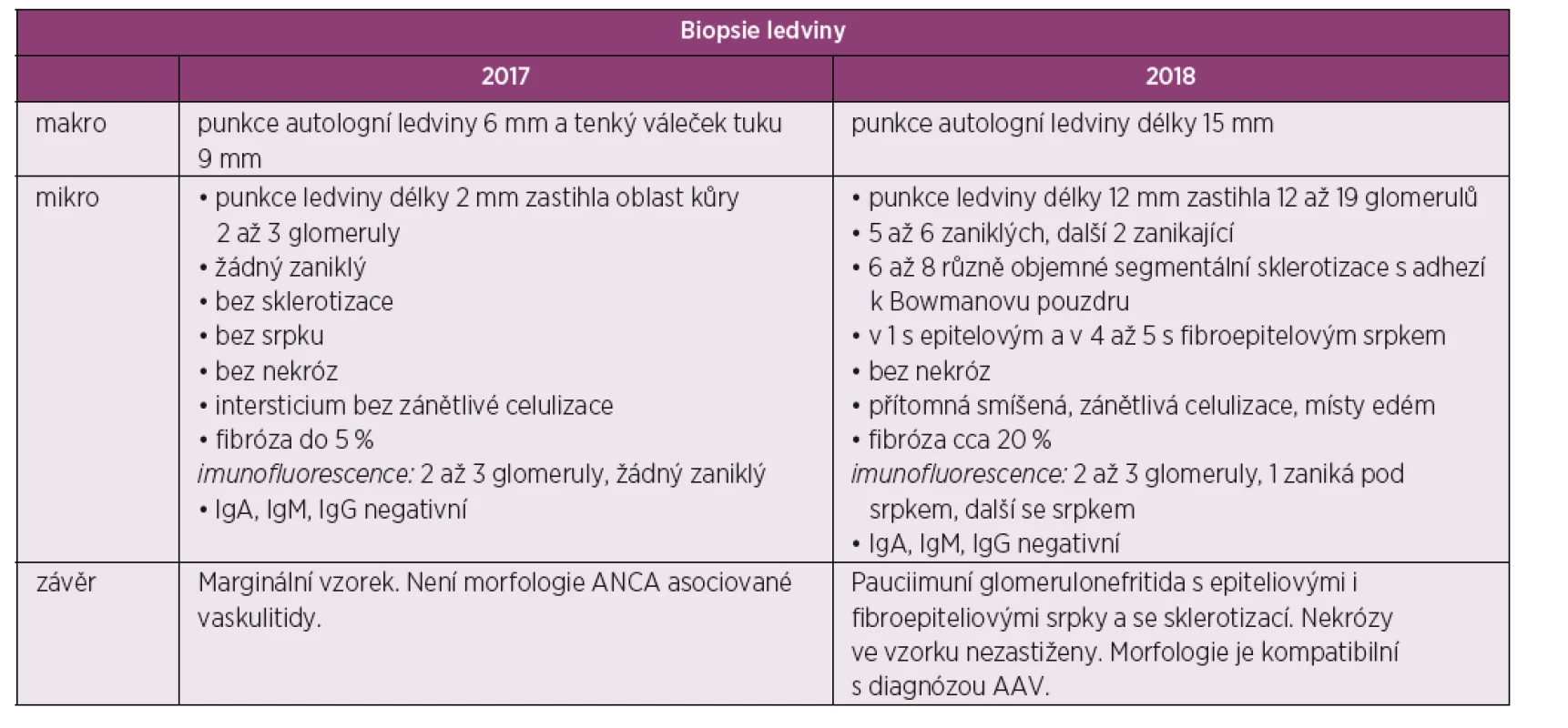
Image 1. Fotodokumentace první renální biopsie provedené v roce 2017 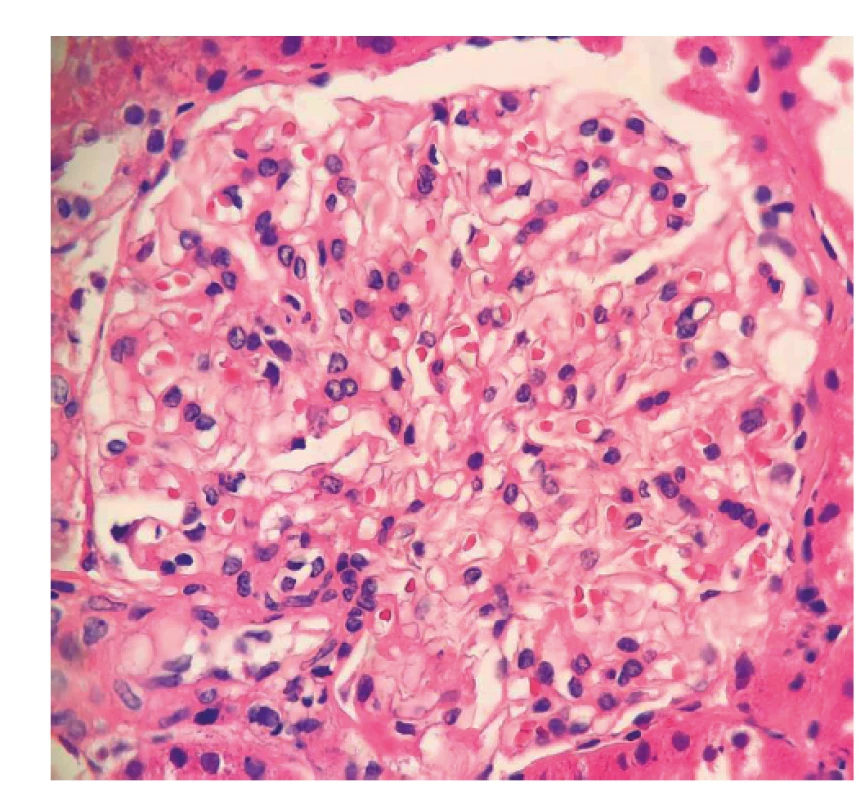
Již před druhým pulzem cyklofosfamidu jsme zaznamenali pokles renálních funkcí. Poškození ledvin progredovalo i přes další pulzy cyklofosfamidu (celkem šest pulzů), proto bylo po konzultaci nefrologa zastaveno snižování dávek glukokortikoidů (pacient ponechán na 20 mg prednisonu denně) a byl nasazen inhibitor angiotenzin konvertujícího enzymu.
Po ukončení pulzní terapie cyklofosfamidem byla zahájena terapie azathioprinem v dávce 112,5 mg/den. I přes tuto intenzivní léčbu došlo k relapsu onemocnění s horečkou a elevací reaktantů akutní fáze. Laboratorně přetrvávala významná proteinurie (8 g/den) a dále se horšily renální funkce (pokles glomerulární filtrace na 0,74 ml/s/1,7). Po dohodě s nefrologem byla zopakována renální biopsie k ujasnění, zda se jedná o aktivní glomerulonefritidu či o trvalé neaktivní poškození po proběhlé vaskulitidě. Ve vzorku ledvinné tkáně, získaném při rebiopsii, byla patrná aktivní glomerulonefritida – pauciimunní glomerulonefritida s epitelovými i fibroepitelovými srpky a se sklerotizací, nekrózy ve vzorku nebyly zastiženy (srpky 6/19 glomerulů, 5–6/19 zaniklých glomerulů, 2/19 zanikající, 6–8 glomerulů se sklerotizací) (obr. 2, tab. 1). Stav byl hodnocen jako selhání terapie cyklofosfamidem a byl podán rituximab – dvě infuze po 1000 mg v odstupu 14 dnů. Podání rituximabu vedlo k pozvolnému poklesu proteinurie, vymizení ANCA protilátek a zlepšení renálních funkci. Terapie byla zopakována v šestiměsíčních intervalech ještě 2krát. Pacient setrvává v trvalé remisi i přes významnou redukci dávek glukokortikoidů (5 mg/den). Reaktanty akutní fáze jsou nízké, renální funkce zlepšené, proteinurie je nízká a ANCA protilátky negativní.
Image 2. Fotodokumentace druhé renální biopsie provedené v roce 2018 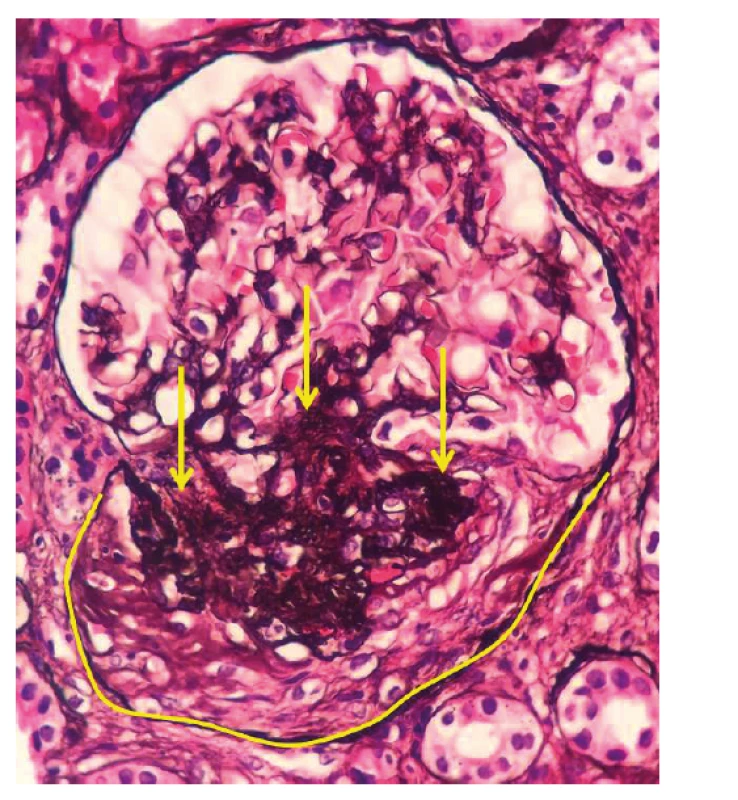
DISKUZE
Plně vyjádřená granulomatóza s polyangiitidou (GPA) postihuje horní dýchací cesty, dolní dýchací cesty a ledviny. V klinické praxi jsou navíc časté limitované formy GPA (8). Diagnostika AAV je velmi obtížná a zároveň je její časné stanovení klíčem k úspěšné terapii. Diagnostická kritéria neexistují. Nemoc lze diagnostikovat na podkladě klasického klinického obrazu a průkazu zánětlivého procesu při histopatologickém vyšetření postižených orgánů (dýchací cesty, ledviny, kůže). V roce 1990 ACR navrhlo klasifikační kritéria GPA, která byla postavena na původním popisu nemoci dle Godmana a Churga z roku 1954 (9). Potvrzení diagnózy si vyžádá splnění dvou z těchto čtyř kritérií:
zánětlivé změny v ústní nebo nosní dutině (ústní ulcerace nebo epistaxe)
přítomnost nodozit, infiltrátů čí kavernózních změn v oblasti plicních polí
mikrohematurie nebo erytrocytární válce v močovém sedimentu
granulomatózní změny v bioptickém vzorku (10)
Nelze ale zapomenout, že se jedná o kritéria klasifikační, nikoliv diagnostická. V roce 2017 bylo vyvinuto další úsilí o tvorbu kritérii, které byly vstupně prezentované v průběhu konference EULAR 2018, ale dosud nebyly ještě plně validované (11). Popsaný nemocný kritéria z roku 1990 úvodně splnil (ulcerace v dutině ústní a mikrohematurie), ale k potvrzení diagnózy bylo nutné získat histopatologický průkaz vaskulitidy. Renální biopsie je zlatým standardem v diagnostice AAV vaskulitid s postižením ledvin (12). Její úloha je obzvlášť důležitá v případech, kde není kompletně vyjádřen charakteristický pulmorenální syndrom, právě jako tomu bylo u popsaného pacienta. Nepřítomnost typických změn v bioptickém vzorku ledviny nesvědčila pro diagnózu GPA či jiné vaskulitidy. Přesto byla zahájena intenzivní imunosupresivní terapie, což se s odstupem času ukázalo být správnou volbou s ohledem na velmi agresivní průběh onemocnění. Přímé informace o úplně negativním výsledku biopsie ledviny při aktivní ANCA asociované glomerulonefritidě nejsou v literatuře dostupné. Po odečtení pozitivních biopsií od celkového počtu provedených získáváme informaci o tom, že negativní nález při biopsii ledvin není častý (cca 1–2 % případů) a týká se hlavně pacientů v počáteční fázi onemocnění nebo případů, kdy byla získána tkáň s malým množstvím glomerulů (13). U popsaného pacienta byla biopsie provedená v krátkém intervalu od vzniku prvních projevů nemoci a byla získána jen periferní část ledviny s malým množstvím glomerulů (marginální vzorek – 2 mm 2 až 3 glomeruly), což bylo nejspíše důvodem nevýtěžnosti vyšetření. Za reprezentativní se v případě renální biopsie považuje vzorek s alespoň 10 glomeruly.
Dle literatury je rebiopsie, vzhledem k její zátěži pro pacienta, nejčastěji prováděna pro známky akutní vaskulitidy (suspektní relaps onemocnění) nebo pro rychlý pokles renálních funkcí (13). V popsaném případu nastaly obě situace a pomocí rebiopsie byla zjištěna aktivní glomerulonefritida, což vedlo k eskalaci terapeutického postupu s dobrým efektem.
ZÁVĚR
ANCA asociované vaskulitidy je skupina potenciálně letálních, multiorgánových, autoimunitních zánětlivých onemocnění s velmi pestrým klinickým obrazem a typickou přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Obtížnost diagnostiky těchto nemocí odpovídá lokalizaci a rozsahu zánětlivých změn. Biopsie ledvin má významnou úlohu v diagnostickém procesu AAV, ale její negativní výsledek při podezření podloženým typickým klinickým obrazem, by neměl být důvodem pro odklad zahájení agresivní imunosupresivní terapie. Tato kazuistika jasně ukazuje, že i přes úvodní negativní výsledek biopsie došlo u pacienta k vývoji závažné glomerulonefritidy nereagující na terapii cyklofosfamidem a vyžadující podání rituximabu k dosažení remise. Trvá-li klinické a laboratorní podezření na aktivní a závažnou formu onemocnění, není vhodné léčbu odkládat ani v případě negativní biopsie dominantně postiženého orgánu; zde je vždy nutné mít na paměti, že biopsie nám dává obraz jen o ložiskových změnách postiženého orgánu v místě biopsie (na jiném místě mohou být změny velmi aktivní) a její výtěžnost vždy závisí na reprezentativnosti odebraného vzorku.
Poděkování patří lékařům z Kliniky nefrologie 1. LF UK a VFN za spolupráci na diagnostice a úspěšné terapii popsaného nemocného.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Magdalena Agnieszka
Sokalska-Jurkiewicz, Ph.D.
Revmatologický ústav a Klinika revmatologie 1. LF UK
Na Slupi 4, 128 50 Praha 2
e-mail: sokalska@revma.cz
Sources
1. Tsalouchos A, Salvadori M. Epidemiology and pathogenesis of ANCA-associated vasculitis. In: Zahoorullah S. Reviews in Imunology. In-Press SM Group Open Access eBooks 2018; 1–24.
2. Nakazawa D, Masuda S, Tomaru U, Ishizu A. Pathogenesis and therapeutic interventions for ANCA-associated vasculitis. Nat Rev Rheumatol 2019; 15 : 91–101.
3. Jennette JC, Falk RJ. Small-vessel vasculitis. N Engl J Med 1977; 337 : 1512–1523.
4. Zakyianov O, Vachek J, Tesař V. Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy). Kardiol Rev Int Med 2014; 16(1): 62–66.
5. Hoffman GS, Kerr GS, Leavitt RY, Hallahan CW, Lebovics RS, Travis WD, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992; 116(6): 488–498.
6. Rowaiye OO, Kusztal M, Klinger M. The kidneys and ANCA-associated vasculitis: from pathogenesis to diagnosis. Clin Kidney J 2015; 8(3): 343–350.
7. Jayne DRW, Bruchfeld AN, Harper L, Schaier M, Venning MC, Hamilton P, et al. Randomized Trial of C5a Receptor Inhibitor Avacopan in ANCA-Associated Vasculitis. JASN 2017; 28 (9): 2756–2767.
8. Kubaisi B, Samra KA, Foster CS. Granulomatosis with polyangiitis (Wegener’s disease): An updated review of ocular disease manifestations. Intractable Rare Dis Res 2016; 5(2): 61–69.
9. Godman CC, Churg J. Wegener’s granulomatosis: Pathology and review of the literature. AMA Arch Pathol 1954; 58 : 533–553.
10. Leavitt RY, Fauci AS, Bloch DA, Michel BA, Hunder GG, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener‘s granulomatosis. Arthritis Rheum 1990; 33 : 1101–1107.
11. Robson J, Grayson P, Ponte C, Suppiah R, Craven A, Khalid S, et al. OP0021 Draft classification criteria for the anca associated vasculitides. Ann Rheum Dis 2018; 77 : 60–61.
12. Berden AE, Ferrario F, Christiaan Hagen E, Jayne DR, Jennette JC, Joh K, et al. Histopathologic Classification of ANCA-Associated Glomerulonephritis. JASN 2010; 21 : 1628–1636.
13. Aasarød K, Bostad L, Hammerstrøm J, Jørstad S, Iversen BM. Renal histopathology and clinical course in 94 patients with Wegener’s granulomatosis. Nephrology Dialysis Transplantation 2001; 16(5): 953–960.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 4-
All articles in this issue
-
Něco staré končí,
něco nové začíná…. - Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
-
Nízkodávková výpočetní tomografie s cínovou filtrací v diagnostice sakroiliitidy –
naše první zkušenosti - Kardiotoxicita cyklofosfamidu při léčbě mikroskopické polyangiitidy
- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
-
Něco staré končí,
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
- Validace české verze dotazníků hodnotících funkční omezení pacientů se systémovou sklerodermií
- Stanovisko České revmatologické společnosti k léčbě revmatických onemocnění a očkování v kontextu infekce SARS-CoV-2
- Klinické zkušenosti z dlouhodobé léčby axiální spondyloartritidy secukinumabem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

