-
Medical journals
- Career
Klinicky suspektní artralgie: současný pohled na preklinickou fázi revmatoidní artritidy
Authors: M. Filková
Authors‘ workplace: Revmatologický ústav, Revmatologická klinika, 1. lékařská fakulta, Univerzita Karlova, Praha
Published in: Čes. Revmatol., 26, 2018, No. 4, p. 162-170.
Category: Review Article
Overview
Na vývoj revmatoidní artritidy (RA) se díváme jako na několikastupňový proces, který podmiňuje přítomnost genetických a environmentálních rizikových faktorů, pokračuje prolomením imunitní tolerance a vznikem autoimunitních procesů spojených s tvorbou autoprotilátek, objevením prvních symptomů bez klinicky detekovatelné artritidy, a posléze manifestací artritidy – nediferencované nebo již splňující klasifikační kritéria pro RA. I přes typické kloubní postižení u pacientů s RA začíná patogeneze onemocnění daleko od kloubních struktur – první imunopatogenetické procesy pravděpodobně začínají v plicích, případně na jiném slizničním rozhraní, např. periodonciu. Tuto teorii podporuje i normální nález v synoviální tkáni u jedinců s pozitivními protilátkami proti citrulinovaným proteinům (ACPA). Přítomnost ACPA je detekovatelná již několik měsíců až let před první manifestací RA. Kombinace ACPA a revmatoidních faktorů až 10x zvyšuje riziko progrese do RA v porovnání s jedinci bez přítomnosti těchto autoprotilátek.
S vývojem poznatků o průběhu RA se posouvají hranice pro její diagnostiku, léčbu a nově i pokusy o preventivní opatření s cílem zabránit manifestaci do stadia, které předchází klinicky detekovatelné artritidě – do tzv. preklinického stadia RA (pre-RA). Vytvoření EULAR definice jedinců suspektních z progrese do RA (clinically suspect arthralgia, CSA) umožňuje sjednocení klinické charakteristiky těchto jedinců (a potenciálně budoucích pacientů), zatím zejména pro účely výzkumu a klinických hodnocení. Tento převrat v pohledu na pre-RA dokazují i probíhající klinická hodnocení, jejichž primárním cílem je oddálení manifestace resp. úplné zabránění vzniku RA pomocí různých léčebných modalit.
Klíčová slova:
revmatoidní artritida, artralgie, ACPA
Úvod
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění, které v případě opožděné nebo nedostatečné léčby vede k ireverzibilním kloubním destrukcím a mimokloubnímu postižení [1]. RA představuje prototyp autoimunitních zánětlivých revmatických onemocnění, pro které máme k dispozici kritéria pro časnou diagnózu, doporučení pro intenzivní léčbu i uplatňování principů léčby k cíli [2, 3]. Cílem léčby je dosažení remise (případně nízké klinické aktivity), což je předpoklad zamezení rozvoje kloubních destrukcí. Lepší pochopení patogeneze RA posouvá zájem vědců i lékařů léčit čím dál časnější stadia: klinicky definovanou artritidu, která ale ještě nesplňuje klasifikační kritéria pro RA [2], nebo stadium předcházející manifestaci artritidy samotné [4]. I přesto, že preventivní programy jsou samozřejmostí v jiných oborech např. u infekčních nebo kardiovaskulárních onemocnění, může se zatím zdát prevence RA jako utopie.
Cílem tohoto přehledného článku je nabídnout pohled na preklinickou fázi RA, možnosti detekce a preventivní (ne)léčebná opatření.
RA jako několikastupňový proces: od genetické predispozice až po kloubní otoky
Na vývoj RA se díváme jako na několikastupňový proces, kterého počátek lze hledat několik let před první manifestací artritidy [1, 5]. Genetická predispozice RA byla popsána u řady genů, nejznámější je vtah polymorfismu v lokusu HLA-DRB1. Alely tohoto lokusu obsahují tzv. sdílený epitop (konzervovaný úsek aminokyselin OKRAA či QRRAA v hypervariabilní oblasti tohoto řetězce v pozicích 70-74), který je schopen prezentovat specifické antigeny T lymfocytům, je asociovaný nejenom se vznikem RA, ale i závažností, mortalitou a odpovědí na léčbu [6, 7]. Genetická predispozice ke vzniku onemocnění je popisovaná u 60 % pacientů s RA, a zejména nositelů protilátek proti citrulinovaným proteinům (anti-citrullinated protein antibodies, ACPA) nebo revmatoidních faktorů (RF). U tzv. séronegativní RA je tato asociace pravděpodobně menší. Prvostupňoví příbuzní pacientů s RA mají vyšší prevalenci ACPA v porovnání se zdravými kontrolami (48 % vs. 10 %), prevalence sdíleného epitopu je rovněž vyšší (62 %) [8]. Další genetický (a tím i neovlivnitelný faktor) predisponující RA je ženské pohlaví. Ženy trpí RA 2–3x častěji než muži, ale role hormonů v patogenezi RA je nadále kontroverzní [1].
Genetická výbava však automaticky negarantuje vznik onemocnění. Predisponovaní jedinci jsou ovlivněni prostředím a faktory životního stylu, např. kouřením, lokální infekcí (např. periodontitida), obezitou a dalšími, které iniciují kaskádu dalších imunopatogenetických procesů. Jako příklad poslouží nejlépe zdokumentována interakce mezi sdíleným epitopem a kouřením. Kouření zvyšuje riziko RA až dvacetkrát v porovnání s nekuřáky, kteří nenesou sdílený epitop. Vlivem kouření (nebo i vlivem jiné noxy, např. inhalaci prachu, uhlí, nebo při infekci) dochází v plicích k apoptóze nebo nekróze buněk, což vede k aktivaci enzymů peptidyl-deimináz (PAD). PAD v prostředí bohatém na vápník uvolňovaným při apoptóze způsobují post-translační modifikaci proteinů (citrulinaci). Tyto modifikované proteiny představují potenciální autoantigen, který po navázání na sdílený epitop antigen-prezentujících buněk (např. dendritické buňky a makrofágy) vede k aktivaci T a B lymfocytů. Důsledkem je tak nastartování autoimunitních dějů a tvorba ACPA u těchto nadále asymptomatických jedinců [9]. Dalším diskutovaným faktorem je i složení mikrobiomu, např. zánětem ovlivněného parodontu. Na periodontitidě se účastní i bakterie Porphyromonas gingivalis (P. gingivalis) produkující vlastní PAD, který citrulinuje nejenom vlastní proteiny, ale i antigeny hostitele. Podobně jako tomu bylo v plicích, i prostředí periodontitidy přestavuje slizniční rozhraní, kde dochází ke vzniku nových antigenů a spuštění autoimunitních procesů. ACPA, RF a další autoprotilátky se tvoří a jsou detekovatelné v krvi již několik let před první manifestací symptomů [10].
U nositelů ACPA protilátek dochází časem ke vzniku prvních symptomů – artralgií, a to dokonce i bez známek lokálního kloubního zánětu [5]. Příčinou bolesti v tomto stadiu je IL-8, který se uvolňuje po navázání ACPA na osteoklasty a který se váže na příslušné receptory umístěné na nociceptorech [11].
ACPA jako takové nejsou schopné indukovat artritidu, ale u jedinců s již probíhajícím zánětem tento preexistující zánět potencují [12]. Z toho vyplývá, že rozvoj chronické artritidy je podmíněný dalším spouštěcím faktorem (tzv. druhý úder nebo „second hit“), o jehož etiologii existují různé teorie [5]. Tento spouštěč každopádně způsobuje v synoviální tkáni zánět, který se v dalším průběhu klinicky manifestuje jako artritida a z jedinců s bolestmi kloubů se stávají pacienti s otokem kloubu – artritidou [2, 13].
Na základě výše zmíněných milníků v patogenezi RA charakterizujeme jedince v preklinickém stadiu RA (pre-RA), tj. ještě před rozvojem artritidy detekovatelné fyzikálním vyšetřením, na stadium A) asymptomatických, geneticky predisponovaných jedinců, B) asymptomatických nositelů ACPA, C) symptomatických nositelů ACPA s artralgiemi a posléze D) se subklinickým zánětem (obr. 1) [4, 5, 14]. Jedince v bezpříznakovém stadiu A a B tak ještě nelze nazvat pacienty. Nicméně jedince ve stadiu C a D, kteří sice ještě nemají definované onemocnění, ale mají již bolesti kloubů, pro které vyhledali lékaře, bychom již pacienty mohli nazývat. Jako klinicky definované onemocnění lze považovat pacienty ve stadiu E) s nediferencovanou artritidou, kteří ještě nesplňují kritéria pro RA, a stadiu F) s artritidou splňující klasifikační kritéria pro RA (obr. 1) [2].
Image 1. Rozvoj revmatoidní artritidy jako několikastupňový proces. Preklinické stadium A) asymptomatických geneticky predisponovaných jedinců, B) asymptomatických nositelů ACPA, C) symptomatických nositelů ACPA s artralgiemi a D) jedinců se subklinickým zánětem. Jako klinicky definované onemocnění lze považovat stadium u pacientů E) s nediferencovanou artritidou, kteří ještě nesplňují kritéria pro RA, a F) s plně vyjádřenou RA splňující klasifikační kritéria. Upraveno podle [4, 5]. ![Rozvoj revmatoidní artritidy jako několikastupňový proces. Preklinické stadium A) asymptomatických geneticky
predisponovaných jedinců, B) asymptomatických nositelů ACPA, C) symptomatických nositelů ACPA s artralgiemi a D) jedinců
se subklinickým zánětem. Jako klinicky definované onemocnění lze považovat stadium u pacientů E) s nediferencovanou
artritidou, kteří ještě nesplňují kritéria pro RA, a F) s plně vyjádřenou RA splňující klasifikační kritéria. Upraveno podle [4, 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/bc065bd7f3fae6ecd33629e2d680c605.png)
Legenda: ACPA – anti-citrullinated protein antibodies, protilátky proti citrulinovaným proteinům; RA – revmatoidní artritida; RF – revmatoidní faktory. Charakteristika preklinického stadia RA a koncept klinicky suspektních artralgií
Jaké jsou stesky jedinců ve stadiu pre-RA v porovnání s pacienty s diagnózou RA? Jedinci v stadiu pre-RA popisují bolest kloubů jako „otravnou“, intermitentní a narušující spánek, a bolestivou ranní ztuhlost, která se zhoršuje s délkou trvání nemoci. Pacienti s časnou RA retrospektivně popisují zhoršující se až nesnesitelnou bolest těsně před diagnózou RA. Pre-RA jedinci často popisují zarudnutí kůže a pocity pálení, které pokládají za předzvěst kloubních otoků. Pacienti s RA retrospektivně pocity pálení potvrdili, navíc otokům předcházela intenzivní bolest, často palindromického a migrujícího charakteru předtím, než se symptomy staly trvalými. Obě skupiny si stěžují na svalové křeče, nepříjemné pocity na kůži, poruchu motoriky, slabost, únavu (i svalovou) spojenou s poruchami spánku a psychickou nepohodu [15]. Obtíže s jemnou motorikou a omezení denních aktivit se již ve stadiu pre-RA přibližují pacientům s časnou RA [16]. Porovnání symptomů jedinců s artralgiemi s a bez pozitivity ACPA (ACPA+ a ACPA-) ukazuje, že ACPA+ jedinci mají vyšší výskyt symptomů na dolních končetinách (50 vs. 22 %), překvapivě menší počet palpačně bolestivých kloubů (5 vs. 9), v době vyšetření delší trvání příznaků (22 vs. 14 týdnů) a mnohem kratší dobu od prvního vyšetření do klinicky detekovatelné artritidy (6 vs. 18 týdnů). Časová prodleva mezi začátkem artralgií a návštěvou lékaře je u ACPA+ jedinců delší, což lze odůvodnit pozvolným nástupem a zpočátku intermitentním charakterem symptomů [17]. Zdá se, že průběh preklinické fáze se u ACPA+ a ACPA - pacientů liší a ACPA+ jedinci přichází k lékaři krátce před manifestací artritidy.
Jak ale nejlépe charakterizovat jedince v pre-RA stadiu z pohledu lékaře? Konsorcium expertů z iniciativy Evropské ligy proti revmatismu (EULAR) ve fázi II vícefázového projektu na základě klinických zkušeností vytvořilo prozatimní charakteristiku pacientů, jejichž symptomy jsou experty pokládány za předzvěst RA [18]. Byla vytvořena definice tzv. klinicky suspektních artralgií (clinically suspect arthralgia, CSA), která je tvořena souborem 5 symptomů a jednoduchého vyšetření (tab. 1). Nejlepší poměr senzitivity a specifity má přítomnost 3–4 znaků. Vytvoření této definice vzniklo z potřeby sjednotit klinickou charakteristiku jedinců v pre-RA stadiu s uplatněním v klinických hodnoceních cílených na tuto populaci. Definice CSA je proto zatím určena pro vědecké použití v klinických hodnoceních. Tato definice nebyla validována pro běžnou klinickou praxi a neslouží ani jako univerzální pomůcka pro lékaře, které pacienty odesílat na specializovaná pracoviště [18].
Table 1. Definice klinicky suspektních artralgií podle EULAR. Nejlepší poměr senzitivity a specifity má přítomnost 3–4 znaků. Upraveno podle [18]. ![Definice klinicky suspektních artralgií podle EULAR.
Nejlepší poměr senzitivity a specifity má přítomnost 3–4 znaků.
Upraveno podle [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3de3e9339a19d22f00b58b560d205073.png)
Legenda: MCP – metakarpofalangeální klouby; RA – revmatoidní artritida. Význam zobrazovacích metod v pre-RA stadiu
U pacientů ve stadiu pre-RA lze pomocí zobrazovacích metod najít známky zánětu v podobě osteitidy, synovitidy nebo tenosynovitidy [19–22]. V kloubech ACPA+ jedinců s artralgiemi byla na magnetické rezonanci (MRI) dominantní ruky pozorována v 65 % synovitida a v 35 % osteitida. Až v 80 % byla přítomna tenosynovitida, která byla spojena s pozdějším vývinem RA. Přítomnost erozí na MRI u 65 % u těchto jedinců odpovídala nálezům na HR-pQCT (high resolution peripheral quantitative computed tomography), korelovala zejména s výskytem osteitidy, což podporuje roli zánětu kostní dřeně v iniciální tvorbě kostních erozí [20]. V celkovém hodnocení dle MRI skóre (tzv. RAMRIS skóre) nebyl rozdíl u jedinců, kteří vyvinuli RA do 2 let, nicméně přítomnost tenosynovitidy ve 2 a více kompartmentech a anatomická lokalizace byla spojena s rozvojem otoku v této lokalizaci [20].
Jiná práce u jedinců s artralgiemi, z nichž 16 % bylo ACPA+, byla synovitida přítomna u 26 %, osteitida u 17 % a tenosynovitida u 29 %. Artritida se do 12 měsíců vyvinula u celkem 31% pacientů se zánětem na MRI (57 % bylo ACPA+), a celkem u 71 % ACPA+ se subklinickým zánětem. Pokud nebyl zánět na MRI detekovatelný na začátku, tak manifestace artritidy do 12 měsíců nebyla častá (celkem v 6 %, u ACPA - jedinců ve 3 %) [22]. Při analýze MRI měli známky subklinického zánětu MRI víc starší a ACPA+ jedinci. Nejvíc byly známky zánětu v lokalizacích typických pro časnou RA, zejména 3. metakarpofalangeální kloub, os capitatum a lunatum, radiokarpální a interkarpální klouby. Symptomy neodlišily pacienty s a bez subklinického zánětu na MRI [21]. Podobný prediktivní význam má i subklinický zánět detekovaný pomocí ultrazvuku, kde přítomnost synovitidy na šedé škále s pozitivním dopplerovským mapováním až 13x zvyšuje pravděpodobnost rozvoje artritidy v tomto kloubu [23].
Synoviální tkáň ve stadiu pre-RA – prvotní místo signalizující počínající RA?
Výše zmíněné práce podporují přítomnost zánětlivých změn v symptomatickém stadiu pre-RA. Synoviální biopsie z kolenního kloubu ACPA+ asymptomatických jedinců nicméně vykazuje histologický obraz téměř neodlišitelný od zdravých kontrol (fenotypové zastoupení buněk, vaskularizace nebo exprese adhezivních molekul). Na základě těchto výsledků se lze domnívat, že synoviální tkáň u pacientů v asymptomatickém stadiu se neliší od kontrol, že asymptomatická autoimunita skutečně předchází subklinickému zánětu a je potřebný další spouštěcí faktor zánětu [24, 25]. Nicméně i tyto výsledky je potřebné interpretovat s opatrností, protože synoviální tkáň z praktických důvodů byla odebrána z kolenního kloubu, který není typickým kloubem pro první manifestaci RA, a navíc MRI z těchto kolenních kloubů nevykazovala známky subklinického zánětu.
Můžeme polemizovat, jestli změny v kloubu jsou skutečným prvním signálem vzniku RA. V souladu s prolomením imunity na úrovni sliznic se nabízí spíš plicní tkáň, kde u ACPA+ jedinců v porovnání se zdravými kontrolami byly nalezeny abnormality a tyto změny byly podobné změnám u pacientů s časnou RA [26]. Existuje i práce poukazující i na změny v lymfatických uzlinách ACPA+ jedinců [27].
Predikce rozvoje RA
Jak již bylo zmíněno výše, ACPA jsou přítomny v krvi potenciálních pacientů několik měsíců až let před první manifestací artritidy [10]. Predikční algoritmy založené na přítomnosti autoprotilátek ukazují, že riziko vzniku RA u jedinců ACPA+ a RF+ je 10,5x vyšší, u ACPA+ a RF - 8x vyšší, u ACPA - a RF+ 2,6x vyšší než u ACPA - a RF - jedinců [28]. Některé práce do těchto algoritmů zahrnují zobrazovací metody – zejména MRI, které ale v běžné praxi nejsou často využívány [22]. Ke genetické predispozici přispívají i další známé (i neznámé) faktory, jak již bylo zmíněno výše. S ohledem na tyto podmiňující faktory je riziko progrese do RA variabilní. U séropozitivních (tj. ACPA+ a/nebo RF+) jedinců existují algoritmy, které stratifikují riziko na vysoké, střední a nízké po dobu 1 až 5 let (tab. 2) [29]. Ukazuje se, že informace o riziku vzniku RA výrazně ovlivňuje i motivaci ke změně návyků spojených se vznikem RA u těchto rizikových jedinců [30].
Table 2. Stratifikace rizika progrese do revmatoidní artritidy u séropozitivních jedinců s artralgiemi. Upraveno podle [29]. ![Stratifikace rizika progrese do revmatoidní artritidy u séropozitivních jedinců s artralgiemi. Upraveno podle [29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/280a9e35b9b06f8144481fdc2c8de647.png)
Legenda: ACPA – anti-citrullinated protein antibodies, protilátky proti citrulinovaným proteinům; RA – revmatoidní artritida; RF – revmatoidní faktory. Lze preventivními opatřeními v preklinickém stadiu RA a předejít jejímu vzniku?
Doporučení a strategie léčby etablované RA jsou dobře specifikované a v běžné klinické praxi se jimi řídíme. Víme, že dostatečně intenzivní léčbou, která je adjustována klinickému stavu pacienta, jsme ve většině případů schopni progresi RA zpomalit ev. zastavit.
Jak ale přistupovat k jedincům v riziku rozvoje RA? Jistě bude náš přístup jiný u asymptomatických nositelů ACPA, symptomatických jedinců s artralgiemi s ranní ztuhlostí s/bez přítomnosti autoprotilátek nebo s již přítomným subklinickým zánětem. Stanovení (léčebného) cíle je u této skupiny jedinců jistě složitější než u pacientů s diagnózou RA. Jakoukoli terapii v tomto stadiu můžeme pokládat za terapii „preventivní“.
Jaké jsou možnosti prevence RA [31]? Cílem primární prevence je podle obecné definice zabránit vzniku onemocnění jako takového v době, když ještě nejsou přítomny žádné známky nemoci. Primární prevence by znamenala intervenci v asymptomatickém stadiu před detekcí autoprotilátek, kdy by se riziko rozvoje RA zakládalo na genetickém pozadí v kombinaci s demografickými faktory, faktory životního stylu a rodinné anamnéze. Primární prevence by spočívala zejména ve změně životního stylu (např. zanechání kouření, dentální hygiena k prevenci periodontitidy atd.), cílená terapeutická intervence by v tomto stadiu nepřipadala v úvahu. Sekundární prevencí rozumíme detekci a monitorování stavu před začátkem symptomů a zabránění plné manifestaci onemocnění. Sekundární prevence u pre-RA by byla směřována na jedince s vyšším rizikem – tj. asymptomatické jedince s přítomností autoprotilátek, ev. již s kloubními symptomy či subklinickým zánětem podle zobrazovacích vyšetření. Tady je samozřejmě otázkou, do jaké míry v této fázi (vzhledem k nastartování autoimunitních procesů nebo již přítomným artralgiím) již samotné onemocnění začalo… Terciární prevence znamená navrátit pacienta s diagnostikovaným onemocněním do plného fyzického, mentálního a sociálního zdraví. Ke zvážení je, jestli terapeutickou intervenci u pacientů s nediferencovanou artritidou s cílem zabránit splnění klasifikačních kritérií pro RA lze ještě považovat v kontextu pre-RA ještě za prevenci, jelikož se jedná již o pacienty s klinicky manifestní artritidou.
Nejadekvátnější je proto u pre-RA sekundární prevence. Jaký by byl vhodný kandidát pro tento typ prevence? Vyšetření pacienta a určení, jestli se jedná o pacienta s manifestní artritidou, resp. v preklinickém stadiu, patří do rukou specialisty. Ten určí míru a charakter symptomů pacienta a doporučí ev. komplementární laboratorní a zobrazovací vyšetření, případně biopsii (např. synoviální tkáně nebo lymfatické uzliny). Rovněž by se mělo jednat o pacienta, u kterého jsme schopni odhadnout riziko manifestace RA. Bylo publikováno několik algoritmů na spočítání a stratifikaci rizika rozvoje RA [22, 29, 32]. Tyto byly spočítány na menších skupinách, resp. kohortách, pro účely experimentální a validace v obecném měřítku s cílem implikace v běžné klinické praxi nebyla zatím provedena. Každopádně tato skóre mohou poskytnout informaci, jestli se jedná pouze o pacienta s autoimunitním fenoménem, nebo ev. pacienta se symptomy a pozitivním nálezem na MRI, kde riziko manifestace RA je do 2–3 let [21, 22], podle některých výsledků u 25 % do 4 měsíců [20].
Jaké terapeutické možnosti přicházejí v úvahu v léčbě pre-RA?
Zatímco doporučení pro léčbu RA jsou dobře definovaná a zavedená v klinické praxi, neexistují žádná doporučení pro léčbu nebo celkově management jedinců v riziku vývoje RA. V současné době jsou k dispozici limitovaná data z klinických hodnocení, kde hlavním cílem bylo zabránit progresi z nediferencované artritidy do plně manifestované RA [33-36] (tab. 3), resp. zabránit manifestaci artritidy jako takové [37, 38] (tab. 4).
Table 3. Přehled ukončených placebem kontrolovaných klinických hodnocení u pacientů s nediferencovanou artritidou. 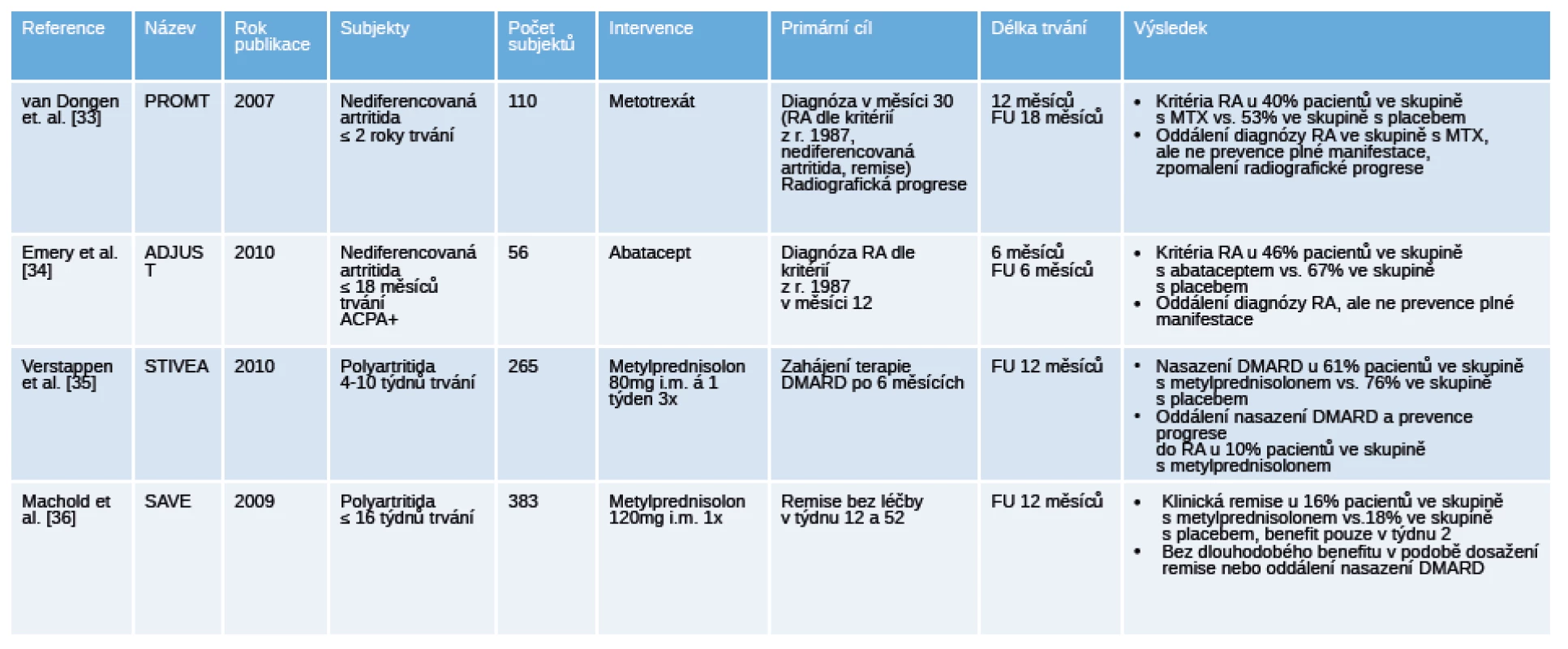
Legenda: DMARD – disease modifying antirheumatic drugs, chorobu modifikující antirevmatické léky; FU – follow up, doba sledování; MTX – methotrexát; RA – revmatoidní artritida. Table 4. Přehled ukončených placebem kontrolovaných „proof of concept“ klinických hodnocení u pacientů s polyartralgiemi a pozitivitou specifických autoprotilátek. 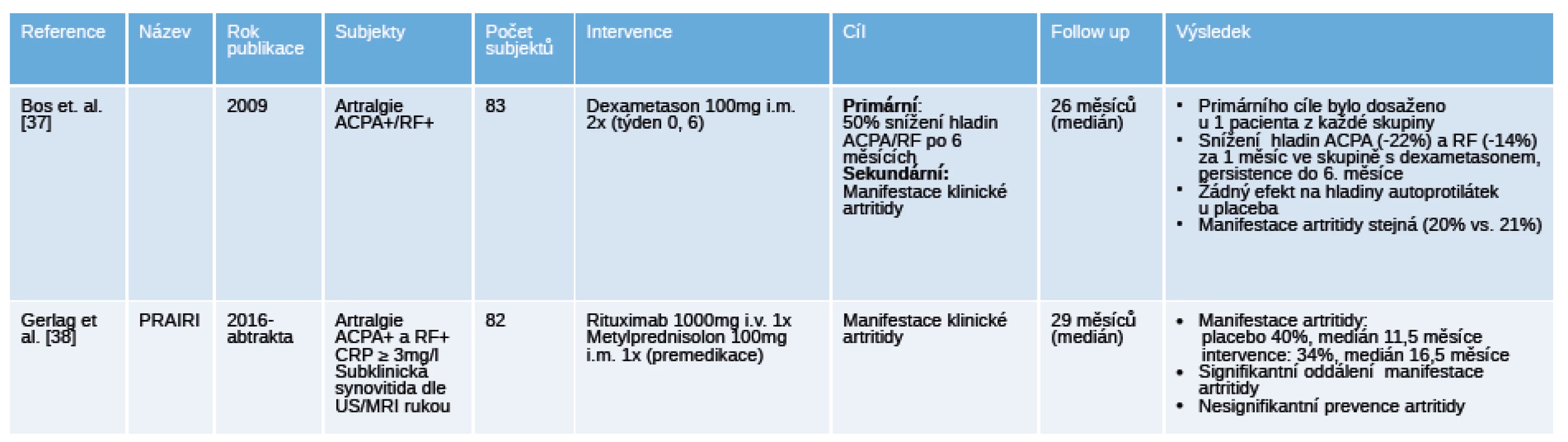
Legenda: ACPA, anti-citrullinated protein antibodies, protilátky proti citrulinovaným proteinům; CRP – C-reaktivní protein; MRI – magnetická rezonance; RF – revmatoidní faktory; US – ultrazvuk. V hodnocení PROMPT (Probable rheumatoid arthritis: Methotrexate versus placebo treatment) u pacientů s nediferencovanou artritidou při terapii methotrexátem (MTX) došlo k oddálení splnění klasifikačních kritérií pro RA z r. 1987 (40 % MTX vs. 53 % placebo), ale ne k zabránění její plné manifestace. Ve skupině s placebem všichni splnili kritéria RA do 12 měsíců, zatím so ve skupině s MTX pouze 50 %, a dalších 50 % při detrakci léčby, MTX navíc zpomalil radiografickou progresi [33]. V této práci došlo ke spontánní remisi ve skupině s placebem ve 24 %, což znamená, že léčba MTX byla ve čtvrtině případů excesivní. Fakt, že významnějšího klinického efektu bylo dosaženo ve skupině ACPA+ pacientů, ale ne v séronegativní větvi, dokazuje, že pro případnou intervenci je nutná stratifikace pacientů a výběr těch s vyšší pravděpodobností progrese do RA. Otázkou klinické hodnocení ADJUST (Abatacept study to determine the efectiveness in preventing the development of rheumatoid arthritis in patients with undifferentiated inflammatory artrhritis and to evaluate safety and tolerability) u pacientů s ACPA+ nediferencovanou artritidou bylo zastoupení pacientů, kteří splnili kritéria pro RA. I přesto, že primárního cíle nebylo dosaženo, tak diagnóza RA byla ve skupině s abataceptem oddálena u 67 % a ve skupině s placebem u 46 % pacientů. Víc pacientů léčených abataceptem v porovnání s placebem dosáhlo remise v měsíci 12 podle skóre DAS28 (71 % vs. 35 %) a zároveň i regresi zánětu dle MRI [34]. V klinickém hodnocení STIVEA podání 3 intramuskulárních injekcí metylprednisolonu pacientům s nediferencovanou artritidou oddálilo u 76 % nasazení chorobu modifikujících léků (DMARD) oproti 61 % ve skupině s placebem, u 10 % pacientů tato intervence zabránila progresi do RA. K remisi ke konci sledování došlo u 20 % pacientů ve větvi s glukokortikoidy a u 10 % ve větvi s placebem [35]. V podobně koncipovaném klinickém hodnocení SAVE (Stop Arthritis Very Early) byla u pacientů s časnou artritidou podána 1 injekce metylprednisolonu. Studie prokázala, že v porovnání s větví s placebem nebyl v týdnu 12 a 52 rozdíl v zastoupení pacientů v remisi (16 % vs. 18 %) a počet pacientů vyžadujících specifickou terapii DMARD. Na konci pozorování byla u 50 % pacientů diagnostikována RA, 30 % zůstalo nadále pod diagnózou nediferencované artritidy [36].
Blíž k prevenci RA mají jistě 2 klinická hodnocení u jedinců s artralgiemi bez ještě manifestované klinické artritidy [37] [38] (tab. 4). Klinické hodnocení u jedinců s ACPA+ a/nebo RF+ artralgiemi mělo za primární cíl pokles nebo normalizaci hladin uvedených autoprotilátek za 6 měsíců po aplikaci dexametazonu, jako sekundární cíl bylo zastoupení pacientů s klinicky manifestní artritidou. Snížení hladin autoprotilátek pod požadovanou hranici bylo dosaženo pouze u 1 pacienta z každé skupiny, ale ve skupině léčené dexametazonem došlo k signifikantnímu snížení hladin ACPA o 22 % a RF o 14 % už po 1 měsíci a toto snížení bylo zachováno až do měsíce 6 [37]. Jedinci byli dlouhodobě sledováni, artritidu manifestovalo 20 % ve skupině s dexametazonem a 21 % ve skupině s placebem, medián sledování byl 26 měsíců. Dalším průkopníkem je randomizované, dvojitě zaslepené hodnocení PRAIRI u jedinců s ACPA+ a/nebo RF+ artralgiemi, kterým byla podána 1 infuze 1000 mg rituximabu nebo placebo [38]. Data ukazují, že v průběhu sledování vyvinulo artritidu 40 % pacientů v mediánu 11,5 měíců ve skupině s placebem 34 % pacientů v mediánu 16,5 měsíců ve skupině s rituximabem. Pozorované riziko vzniku RA bylo ve skupině s placebem 40% a ve skupině s rituximabem bylo o 55% nižší v měsíci 12. I přes nedostatečný efekt ve smyslu prevence vzniku artritidy další analýzy ukazují, že oddálení manifestace RA v intervenční skupině bylo o 12 měsíců.
V současné době probíhají další klinická hodnocení (tab. 5) s použitím různých farmakologických přístupů (abatacept, methotrexát, hydroxychlorochin, atorvastatin), které v budoucnu ukážou jejich efekt na prevenci vzniku RA [39–43].
Table 5. Přehled probíhajících placebem kontrolovaných „proof of concept“ klinických hodnocení u pacientů s polyartralgiemi a pozitivitou specifických autoprotilátek. 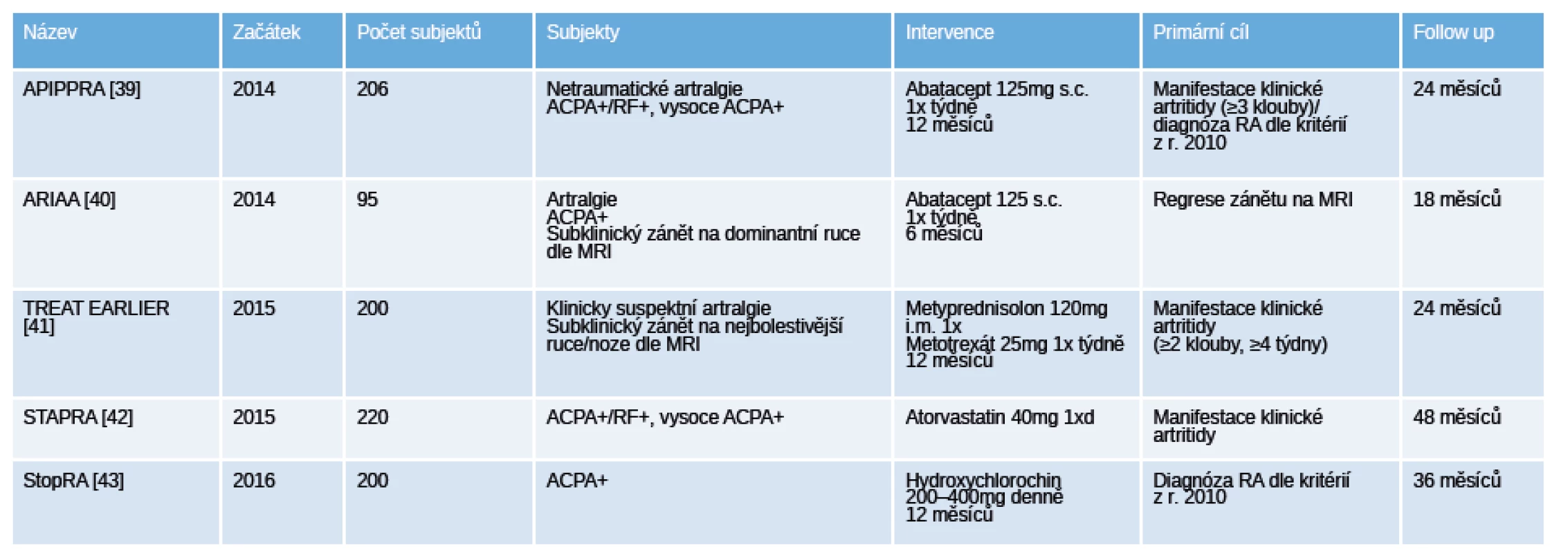
Legenda: ACPA – anti-citrullinated protein antibodies, protilátky proti citrulinovaným proteinům; MRI – magnetická rezonance; RA – revmatoidní artritida; RF – revmatoidní faktory. Závěr
Na RA se v současnosti díváme jako na několikastupňový proces sahající od asymptomatických geneticky predisponovaných jedinců, později nositelů autoprotilátek, přes symptomatické jedince s artralgiemi, až po pacienty s klinicky definovanou artritidou. S vývojem poznatků o průběhu a patogenezi RA se otvírají nové terapeutické možnosti etablované RA, ale nabízí se i otázka preventivních opatření. Zatím co prevence vzniku onemocnění je celkem běžná v jiných oborech, v oblasti RA je zatím tato možnost předmětem výzkumu. Výsledky dosavadních klinických hodnocení by se mohly zdát jako neúspěch, protože terapeutická intervence nepředešla vzniku RA. Na druhé straně ale poskytly prostor pro další optimalizaci: od selekce subjektů, načasování, dávkování a výběru terapie a iniciovaly další klinická hodnocení. Až budoucnost ukáže, jestli bude RA nadále pouze léčitelným onemocněním, nebo se stane vyléčitelnou chorobou, anebo se s ní budoucí generace budou setkávat pouze v učebnicích.
Poděkování: Tato práce vznikla za podpory grantu AZV-17-32612A.
adresa pro korespondenci:
MUDr. Mária Filková, Ph.D.
Revmatologický ústav
Revmatologická klinika, 1. LF UK
Na Slupi 4
128 50 Praha 2
Tel. 234 075 462
Fax. 224 914 451
Email: filkova@revma.cz
Sources
1. Smolen JS, Aletaha D, Barton A, Burmester GR, Emery P, Firestein GS, et al. Rheumatoid arthritis. Nat Rev Dis Primers 2018; 4 : 18001.
2. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, 3rd, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/ European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69(9): 1580–8.
3. Smolen JS, Landewe R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017; 76(6): 960–77.
4. Raza K, Klareskog L, Holers VM. Predicting and preventing the development of rheumatoid arthritis. Rheumatology (Oxford) 2016; 55(1): 1–3.
5. Catrina AI, Svensson CI, Malmstrom V, Schett G, Klareskog L. Mechanisms leading from systemic autoimmunity to joint-specific disease in rheumatoid arthritis. Nat Rev Rheumatol 2017; 13(2): 79–86.
6. Gregersen PK, Silver J, Winchester RJ. The shared epitope hypothesis. An approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthritis Rheum 1987; 30(11): 1205–13.
7. Viatte S, Plant D, Han B, Fu B, Yarwood A, Thomson W, et al. Association of HLA-DRB1 haplotypes with rheumatoid arthritis severity, mortality, and treatment response. JAMA 2015; 313(16): 1645–56.
8. Barra L, Scinocca M, Saunders S, Bhayana R, Rohekar S, Racape M, et al. Anti-citrullinated protein antibodies in unaffected first-degree relatives of rheumatoid arthritis patients. Arthritis Rheum 2013; 65(6): 1439–47.
9. Klareskog L, Malmstrom V, Lundberg K, Padyukov L, Alfredsson L. Smoking, citrullination and genetic variability in the immunopathogenesis of rheumatoid arthritis. Semin Immunol 2011; 23(2): 92–8.
10. Sokolove J, Bromberg R, Deane KD, Lahey LJ, Derber LA, Chandra PE, et al. Autoantibody epitope spreading in the pre-clinical phase predicts progression to rheumatoid arthritis. PLoS One 2012; 7(5): e35296
11. Wigerblad G, Bas DB, Fernades-Cerqueira C, Krishnamurthy A, Nandakumar KS, Rogoz K, et al. Autoantibodies to citrullinated proteins induce joint pain independent of inflammation via a chemokine-dependent mechanism. Ann Rheum Dis 2016; 75(4): 730–8.
12. Kuhn KA, Kulik L, Tomooka B, Braschler KJ, Arend WP, Robinson WH, et al. Antibodies against citrullinated proteins enhance tissue injury in experimental autoimmune arthritis. J Clin Invest 2006; 116(4): 961–73.
13. Firestein GS, McInnes IB. Immunopathogenesis of Rheumatoid Arthritis. Immunity 2017; 46(2): 183–96.
14. Gerlag DM, Norris JM, Tak PP. Towards prevention of autoantibody-positive rheumatoid arthritis: from lifestyle modification to preventive treatment. Rheumatology (Oxford) 2016; 55(4): 607–14.
15. Stack RJ, van Tuyl LH, Sloots M, van de Stadt LA, Hoogland W, Maat B, et al. Symptom complexes in patients with seropositive arthralgia and in patients newly diagnosed with rheumatoid arthritis: a qualitative exploration of symptom development. Rheumatology (Oxford) 2014; 53(9): 1646–53.
16. Ten Brinck RM, van Steenbergen HW, Mangnus L, Burgers LE, Reijnierse M, Huizinga TW, et al. Functional limitations in the phase of clinically suspect arthralgia are as serious as in early clinical arthritis; a longitudinal study. RMD Open 2017; 3(1): e000419.
17. Burgers LE, van Steenbergen HW, Ten Brinck RM, Huizinga TW, van der Helm-van Mil AH. Differences in the symptomatic phase preceding ACPA-positive and ACPA-negative RA: a longitudinal study in arthralgia during progression to clinical arthritis. Ann Rheum Dis 2017; 76(10): 1751–4.
18. van Steenbergen HW, Aletaha D, Beaart-van de Voorde LJ, Brouwer E, Codreanu C, Combe B, et al. EULAR definition of arthralgia suspicious for progression to rheumatoid arthritis. Ann Rheum Dis 2017; 76(3): 491–6.
19. Krabben A, Stomp W, van der Heijde DM, van Nies JA, Bloem JL, Huizinga TW, et al. MRI of hand and foot joints of patients with anticitrullinated peptide antibody positive arthralgia without clinical arthritis. Ann Rheum Dis 2013; 72(9): 1540–4.
20. Kleyer A, Krieter M, Oliveira I, Faustini F, Simon D, Kaemmerer N, et al. High prevalence of tenosynovial inflammation before onset of rheumatoid arthritis and its link to progression to RA-A combined MRI/CT study. Semin Arthritis and Rheum 2016; 46(2): 143–50.
21. van Steenbergen HW, van Nies JA, Huizinga TW, Bloem JL, Reijnierse M, van der Helm-van Mil AH. Characterising arthralgia in the preclinical phase of rheumatoid arthritis using MRI. Ann Rheum Dis 2015; 74(6): 1225–32.
22. van Steenbergen HW, Mangnus L, Reijnierse M, Huizinga TW, van der Helm-van Mil AH. Clinical factors, anticitrullinated peptide antibodies and MRI-detected subclinical inflammation in relation to progression from clinically suspect arthralgia to arthritis. Ann Rheum Dis 2016; 75(10): 1824–30.
23. van de Stadt LA, Bos WH, Meursinge Reynders M, Wieringa H, Turkstra F, van der Laken CJ, et al. The value of ultrasonography in predicting arthritis in auto-antibody positive arthralgia patients: a prospective cohort study. Arthritis Res Ther 2010; 12(3): R98.
24. van de Sande MG, de Hair MJ, van der Leij C, Klarenbeek PL, Bos WH, Smith MD, et al. Different stages of rheumatoid arthritis: features of the synovium in the preclinical phase. Ann Rheum Dis 2011; 70(5): 772–7.
25. de Hair MJ, Lehmann KA, van de Sande MG, Maijer KI, Gerlag DM, Tak PP. The clinical picture of rheumatoid arthritis according to the 2010 American College of Rheumatology/European League Against Rheumatism criteria: is this still the same disease? Arthritis Rheum 2012; 64(2): 389–93.
26. Demoruelle MK, Weisman MH, Simonian PL, Lynch DA, Sachs PB, Pedraza IF, et al. Brief report: airways abnormalities and rheumatoid arthritis-related autoantibodies in subjects without arthritis: early injury or initiating site of autoimmunity? Arthritis Rheum 2012; 64(6): 1756–61.
27. van Baarsen LG, de Hair MJ, Ramwadhdoebe TH, Zijlstra IJ, Maas M, Gerlag DM, et al. The cellular composition of lymph nodes in the earliest phase of inflammatory arthritis. Ann Rheum Dis 2013; 72(8): 1420–24.
28. Ten Brinck RM, van Steenbergen HW, van Delft MAM, Verheul MK, Toes REM, Trouw LA, et al. The risk of individual autoantibodies, autoantibody combinations and levels for arthritis development in clinically suspect arthralgia. Rheumatology (Oxford) 2017; 56(12): 2145–53.
29. van de Stadt LA, Witte BI, Bos WH, van Schaardenburg D. A prediction rule for the development of arthritis in seropositive arthralgia patients. Ann Rheum Dis 2013; 72(12): 1920–6.
30. Sparks JA, Iversen MD, Yu Z, Triedman NA, Prado MG, Miller Kroouze R, et al. Disclosure of Personalized Rheumatoid Arthritis Risk Using Genetics, Biomarkers, and Lifestyle Factors to Motivate Health Behaviour Improvements: A Randomized Controlled Trial. Arthritis Care Res (Hoboken) 2018; 70(6): 823–33.
31. Cope AP. Emerging therapies for pre-RA. Best Pract Res Clin Rheumatol 2017; 31(1): 99–111.
32. Scott IC, Seegobin SD, Steer S, Tan R, Forabosco P, Hinks A, et al. Predicting the risk of rheumatoid arthritis and its age of onset through modelling genetic risk variants with smoking. PLoS Genet 2013; 9(9): e1003808
33. an Dongen H, van Aken J, Lard LR, Visser K, Ronday HK, Hulsmans HM, et al. Efficacy of methotrexate treatment in patients with probable rheumatoid arthritis: a double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2007; 56(5): 1424–32.
34. Emery P, Durez P, Dougados M, Legerton CW, Becker JC, Vratsanos G, et al. Impact of T-cell costimulation modulation in patients with undifferentiated inflammatory arthritis or very early rheumatoid arthritis: a clinical and imaging study of abatacept (the ADJUST trial). Ann Rheum Dis 2010; 69(3): 510–6.
35. Verstappen SM, McCoy MJ, Roberts C, Dale NE, Hassell AB, Symmons DP, et al. Beneficial effects of a 3-week course of intramuscular glucocorticoid injections in patients with very early inflammatory polyarthritis: results of the STIVEA trial. Ann Rheum Dis 2010; 69(3): 503–9.
36. Machold KP, Landewe R, Smolen JS, Stamm TA, van der Heijde DM, Verpoort KN, et al. The Stop Arthritis Very Early (SAVE) trial, an international multicentre, randomised, double-blind, placebo-controlled trial on glucocorticoids in very early arthritis. Ann Rheum Dis 2010; 69(3): 495–502.
37. Bos WH, Dijkmans BA, Boers M, van de Stadt RJ, van Schaardenburg D. Effect of dexamethasone on autoantibody levels and arthritis development in patients with arthralgia: a randomised trial. Ann Rheum Dis 2010; 69(3): 571–4.
38. Gerlag DM, Safy M, Maijer KI, Tang MW, Tas SW, Starmans-Kool MJF, et al. Effects of B-cell directed therapy on the preclinical stage of rheumatoid arthritis: the PRAIRI study. Ann Rheum Dis. 2018 Dec 1. [Epub ahead of print]
39. ISRCTN registry. ISRCTN46017566 Arthritis prevention in the pre-clinical phase of rheumatoid arthritis with abatacept. BioMed Central http://dx.doi.org/10.1186/ISRCTN46017566 (2015)
40. US National Library of Medicine. ClinicalTrials.gov http://clinicaltrials.gov/ct2/show/NCT02778906 (2016)
41. Nederlands Trial Register. Trialregister.nl http://www.trialregister.nl/trialreg/admin/rctview.asp?TC=4853 (2014)
42. Nederlands Trial Register. Trialregister.nl http://www.trialregister.nl/trialreg/admin/rctview.asp?TC=5265 (2015)
43. US National Library of Medicine. ClinicalTrials.gov http://clinicaltrials.gov/ct2/show/NCT02603146 (2017)
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 4-
All articles in this issue
- Stanovisko České revmatologické společnosti k terapii antirevmatiky v graviditě a laktaci
- Dlouhodobé výsledky léčby revmatoidní artritidy adalimumabem v národním registru ATTRA
- Klinicky suspektní artralgie: současný pohled na preklinickou fázi revmatoidní artritidy
- Extracelulární miRNA – biogeneze, funkce a využití jako biomarkerů u revmatických onemocnění
- Nefarmakologická terapie u idiopatických zánětlivých myopatií – cvičení a jeho účinky na pacienty s IZM, od roku 1993 až po dnes
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinicky suspektní artralgie: současný pohled na preklinickou fázi revmatoidní artritidy
- Stanovisko České revmatologické společnosti k terapii antirevmatiky v graviditě a laktaci
- Dlouhodobé výsledky léčby revmatoidní artritidy adalimumabem v národním registru ATTRA
- Extracelulární miRNA – biogeneze, funkce a využití jako biomarkerů u revmatických onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

