-
Medical journals
- Career
Stanovisko České revmatologické společnosti k terapii antirevmatiky v graviditě a laktaci
: D. Tegzová; J. Vencovský
: Revmatologický ústav, Praha
: Čes. Revmatol., 26, 2018, No. 4, p. 143-152.
: Recommendation
Gravidita a laktace jsou období, která u nemocných žen s revmatickým onemocněním mohou být riziková. Toto riziko vyplývá jednak z povahy samotné revmatické choroby, jednak z terapie matky před koncepcí a v průběhu těhotenství a laktace. Zánětlivá aktivita dané revmatické choroby je pro graviditu rovněž nebezpečná, někdy i více než samotná imunosupresivní terapie. Farmakoterapie léky používanými v revmatologii, jež je aplikována ženě v době před početím, v graviditě a v laktaci, může mít značný nežádoucí vliv jak na matku, tak zejména na plod či novorozence. Při léčbě revmatických chorob jsou používána nesteroidní antirevmatika (NSA), glukokortikoidy, antimalarika, sulfasalazin, methotrexát, mykofenolát, azatioprin, cyklosporin A, cyklofosfamid, biologické léky a dále antikoagulační a antiagregační léčba. Naprostá většina těchto léků má určité riziko pro těhotenství. Jednotlivé antirevmatické léky mají z hlediska těhotenství odlišné nežádoucí účinky a možnost jejich použití je formulována na základě analýzy dlouhodobých bezpečnostních dat těchto léků. Ne všechny léky mají k dispozici dostatečné informace o jejich možných nežádoucích účincích v graviditě, takovéto léky by v graviditě neměly být podávány. Údaje o bezpečnosti léčby jsou dlouhodobě evidovány a hodnoceny a jednotlivá doporučení se mohou i měnit. To platí zejména pro nové, hlavně biologické léky, které jsou k dispozici relativně krátkou dobu a dostupné údaje o jejich bezpečnosti v graviditě jsou zatím omezené. Komise Evropské ligy proti revmatismu navrhla nová doporučení pro terapii revmatickými léky pro období před graviditou, v graviditě a v laktaci a na jejich základě i Česká revmatologická společnost zaujímá své stanovisko k této problematice.
Klíčová slova:
revmatické nemoci, gravidita, laktace, farmakoterapie
Úvod
Gravidita a laktace u žen s revmatickým onemocněním mohou být rizikové situace. Toto riziko vyplývá jak z povahy samotné revmatické choroby, tak i z podávané terapie matce. Farmakoterapie léky používanými v revmatologii může mít značný nežádoucí vliv jak na matku, tak zejména na plod či novorozence. Zánětlivá aktivita dané revmatické choroby je pro graviditu rovněž nebezpečná, někdy i více, než samotná imunosupresivní terapie. Volba typu léčby revmatické nemoci v graviditě je dána typem revmatické nemoci a jejím předpokládaným průběhem v graviditě, aktivitou nemoci v době koncepce, eventuálním orgánovým postižením a i interkurentními chorobami ženy. Zásadní podmínkou úspěšné gravidity je její důsledné naplánování, sledování a mezioborová spolupráce (1).
Jednotlivé antirevmatické léky mají z hlediska těhotenství odlišné nežádoucí účinky a možnost jejich použití je formulována na základě analýzy dlouhodobých bezpečnostních dat těchto léků (2, 3).
Zjistit a přesně popsat bezpečnost jakékoli medikamentózní terapie v graviditě je z celé řady důvodů vždy velmi obtížné. Provádět jakékoli kvalitní studie u těhotných žen je totiž problematické z důvodů zdravotních i etických a získané informace jsou vždy velmi omezené jak v jejich počtu, tak i v rozsahu. To platí zejména pro nové, hlavně biologické léky, které jsou užívány v revmatologii až v posledních dvou dekádách, a průběžně jsou neustále vyvíjeny léky nové. Navíc výskyt revmatických nemocí, a tím i četnost gravidit žen s těmito nemocemi, je relativně dosti nízký, a proto jsou využívány i poznatky z jiných medicínských oborů, zejména z gastroenterologie. V té je biologická terapie TNF blokátory často používána v léčbě idiopatického střevního zánětu a vzhledem k jeho nepříznivému a rizikovému průběhu v graviditě je aplikována daleko častěji a i po celou dobu gravidity (4).
Farmakoterapii revmatických nemocí v graviditě se věnuje řada předních pracovišť na celém světě a výsledky provedených analýz a názory tamějších odborníků a jejich zkušenosti jsou důležitým zdrojem informací a doporučení, která do jisté míry i absenci validních dat nahrazují. Jejich váha však nemůže nahradit precizní informace z opravdu dlouhodobého systematického sledování. Proto nemůžeme v této oblasti hovořit o jasných „doporučeních“, ale spíše o „uvažovaných bodech“. A takto je i třeba k této problematice přistupovat (2).
Navrhované a posuzované možnosti terapie v graviditě dle ČRS
Česká revmatologická společnost (ČRS) vypracovala návrh k posouzení okolností, které je potřebné zvažovat při terapii antirevmatickými léky v graviditě a v laktaci.
Při vypracování tohoto návrhu byly jako zdroje informací použity „body k uvážení při léčbě antirevmatiky v graviditě a laktaci“, které vypracovala Evropská liga proti revmatismu (EULAR) na základě analýzy její odborné komise pro tuto oblast (2). Komise provedla systematickou literární analýzu dostupných informací o jednotlivých lécích, užívaných při léčbě revmatických chorob. Byly plně respektovány principy medicíny založené na důkazech a pro hodnocení kvality provedených studií, a tedy získaných informací, byla vytvořena speciální stupnice, která odrážela váhu, tedy význam jednotlivých doporučení. (2, 4). Dále byly pro tvorbu našeho návrhu použity i další zdroje, které respektovaly principy medicíny založené na důkazech (například doporučení britská) (1).
Mezi základní obecné principy pro absolvování gravidity u žen s revmatickou nemocí patří tyto zásady:
- Plánovaní těhotenství by mělo být součástí přístupu ke každé pacientce v reprodukčním věku. Měla by být zvážena i očekávaná léčba v graviditě a celý léčebný postup by tomu měl být přizpůsoben.
- Léčba v graviditě a v laktaci by měla být prováděna s cílem co nejvíce potlačit riziko vzplanutí nemoci a nepoškodit plod nebo kojené dítě.
- Riziko léčby a eventuálního poškození plodu nebo dítěte by mělo být zváženo ve srovnání s výší rizika, které nastává pro matku i plod/dítě v případě neléčené nemoci.
- Rozhodnutí o použité terapii v graviditě a v laktaci by mělo být provedeno na základě konzultace a dohody mezi revmatologem, gynekologem/porodníkem a samotnou ženou (2, 5, 6).
Principy možné terapie v graviditě
K terapii zánětlivých revmatických nemocí jsou užívána
- nesteroidní antirevmatika (NSA),
- glukokortikoidy (GK),
- konvenční syntetické chorobu modifikující léky, (conventional synthetic DMARD = csDMARD)
- cílené syntetické chorobu modifikující léky, (targeted synthetic DMARD = tsDMARD) a
- biologické, chorobu modifikující léky (bDMARD).
- csDMARD použitelné v graviditě jsou hydroxychlorochin, chlorochin, sulfasalazin, azatioprin, takrolimus a kolchicin. Je tedy možno je v graviditě používat k dosažení a udržení remise nemoci a pro léčbu relapsu.
- csDMARD methotrexát, mykofenolát mofetil a cyklofosfamid jsou teratogenní a je nutno je vysadit před koncepcí.
- Neselektivní COX2 inhibitory a prednison mohou být podávány v graviditě, je-li to nutné k potlačení aktivity nemoci. NSA by měla být omezena na 1. a 2. trimestr.
- Glukokortikoidy v pulzní formě a intravenózní imunoglobuliny lze použít v případě těžké refrakterní formy nemoci v graviditě, v tomto výjimečném případě lze připustit dokonce i použití cyklofosfamidu ve 2. a 3. trimestru.
- csDMARD, tsDMARD a protizánětlivé léky s nedostatečnými důkazy o bezpečnosti pro graviditu by neměly být použity do doby, než budou tyto důkazy k dispozici. To se týká leflunomidu, tofacitinibu, baricitinibu, apremilastu a selektivních COX2 inhibitorů.
- Pokračování zavedené léčby TNF inhibitory během prvé části gravidity je možné. Etanercept a certolizumab mohou být použity po celou dobu gravidity vzhledem k nízkému průchodu placentou.
- bDMARD jako rituximab, anakinra, tocilizumab, abatacept, belimumab a ustekinumab mají k dispozici omezené průkazy bezpečnosti pro podávání v době gravidity a měly by být ještě před koncepcí nahrazeny jinou bezpečnou alternativou terapie. V graviditě by měly být použity jen v případě, že není k dispozici jiná bezpečná a efektivní alternativa terapie. Velmi málo je známo o vztahu těhotenství a nejnovějších biologických léků sarilumab, secukinumab a ixekizumab, i když u sarilumabu lze snad předpokládat podobné vlastnosti jako u tocilizumabu.
Posouzení k použití jednotlivých léků v graviditě jsou shrnuta v tabulce číslo 1 a 2 (2).
1. Nejčastěji používaná antirevmatika. 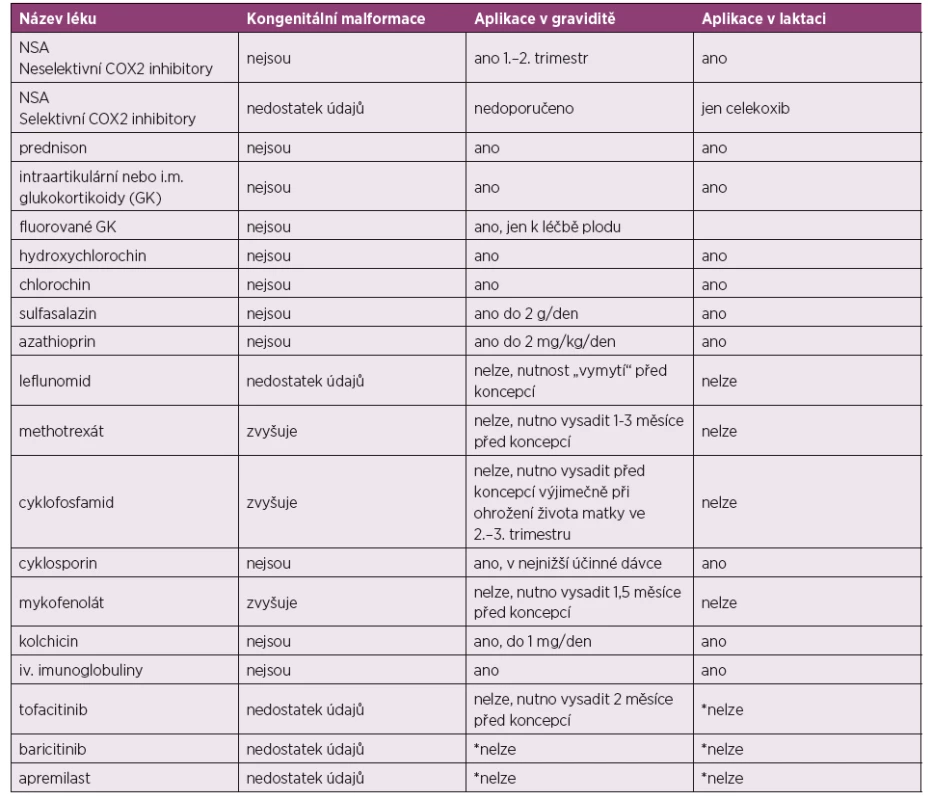
*nelze z důvodu absence potřebných údajů o bezpečnosti
Převzato a upraveno dle: Gotestam Skorpen C, Holetzenbein M, Tincani A et al. The EULAR point to consider for use of antirheumatic drugs before pregnancy and during pregnancy and lactatio. Ann Rheum Dis 2016; 75(5): 795–810.2. Nejčastěji používaná biologická DMARD. 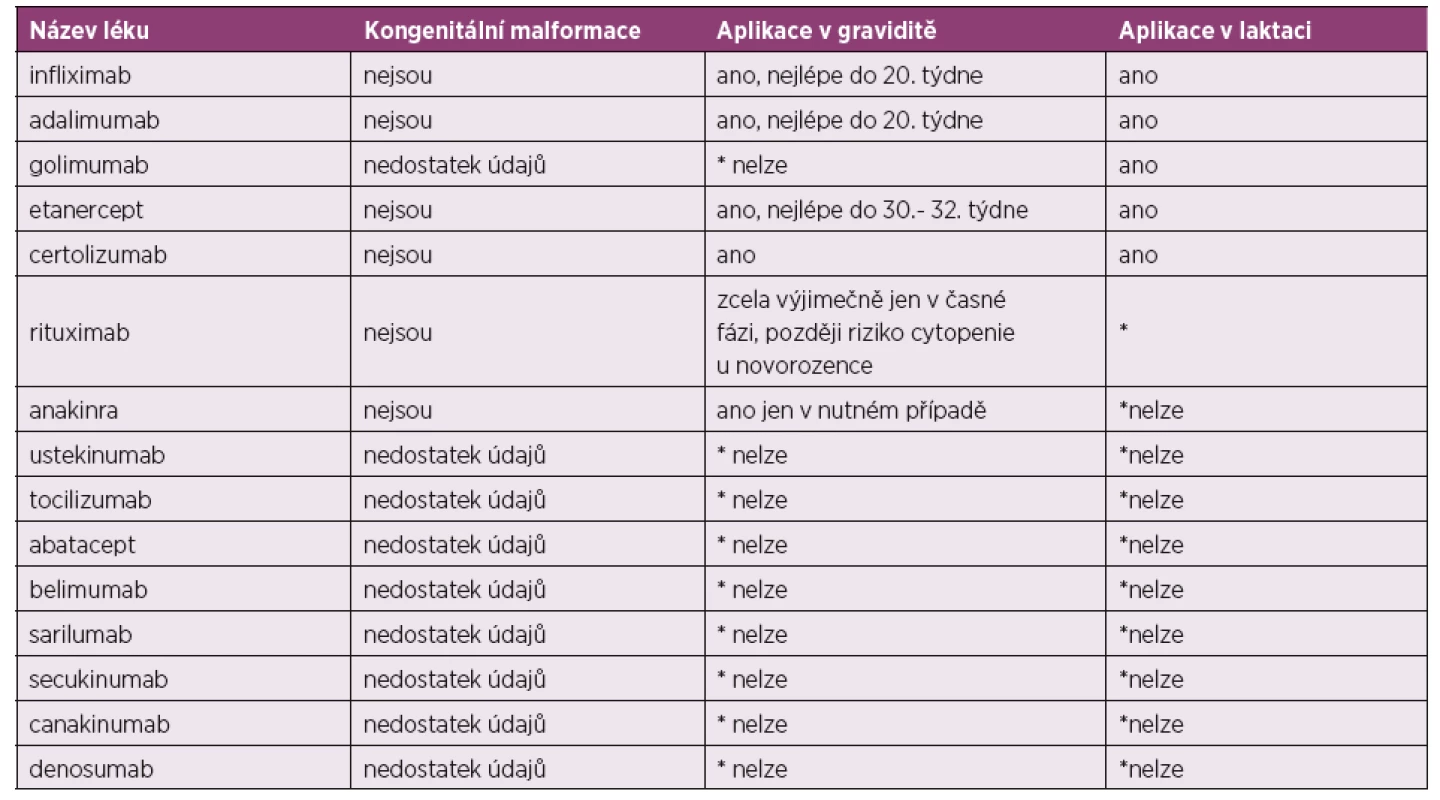
*nelze z důvodu absence potřebných údajů o bezpečnosti
Převzato a upraveno dle: Gotestam Skorpen C, Holetzenbein M, Tincani A et al. The EULAR point to consider for use of antirheumatic drugs before pregnancy and during pregnancy and lactatio. Ann Rheum Dis 2016; 75(5): 795–810.Principy možné terapie v graviditě
- csDMARD a protizánětlivé léky kompatibilní s kojením mohou být použity po dobu laktace v případě, že není jiná kontraindikace ze strany zdravotního stavu kojence. K těmto lékům patří hydroxychlorochin, chlorochin, sulfasalazin, azatioprin, cyklosporin, takrolimus, kolchicin, prednison, imunoglobuliny, neselektivní COX2 inhibitory a celekoxib.
- csDMARD, tsDMARD a protizánětlivé léky bez průkazu bezpečnosti nebo s omezenými údaji o bezpečnosti pro kojení by neměly být v laktaci podávány. To se týká methotrexátu, mykofenolát mofetilu, cyklofosfamidu, leflunomidu, tofacitinibu, baricitinibu, apremilastu a COX2 inhibitorů vyjma celekoxibu.
- Nízký přechod do mateřského mléka byl dokumentován u infliximabu, adalimumabu, etanerceptu a certolizumabu, proto pokračování terapie TNF inhibitory je v laktaci možné.
- bDMARD bez potřebných údajů o bezpečnosti pro laktaci jako rituximab, anakinra, belimumab, ustekinumab, tocilizumab a abatacept by neměly být v laktaci podávány, pakliže je dostupná jiná bezpečná a efektivní terapie. Na základě farmakologických vlastností těchto bDMARD se usuzuje, že v případě terapie těmito léky a absenci jiné vhodné možnosti léčby nemusí být laktace přerušena. Prakticky nic není známo o vztahu kojení a nejnovějších biologických léků sarilumab, secukinumab a ixekizumab.
Jednotlivá doporučení k použití jednotlivých léků v laktaci jsou shrnuta v tabulce číslo 1 a 2 (2).
Terapie muže s ohledem na fertilitu
Vliv farmakoterapie muže z hlediska možného rizika pro fertilitu není tak významný jako u žen, ale určitá rizika postižení spermiogeneze je nutno respektovat. Cyklofosfamid má možný teratogenní vliv na spermie a může vést až k azoospermii, methotrexát způsobuje reverzibilní sterilitu a sulfasalazin vede k oligospermii až k reverzibilní infertilitě. Proto je u mužů léčených těmito léky nutno vždy uvážit, zda a kdy plánují se svými partnerkami graviditu, včas rizikové léky před koncepcí vysadit a tuto terapii vždy uvádět v terapeutické anamnéze (7). V poslední době je stále diskutován vliv MTX na poruchu spermiogeneze a fertility a rovněž možný i teratogenní vliv na spermie. Poslední obsáhlé studie neprokázaly přítomnost těchto toxických vlivů. Nebyl prokázán klinicky významný vliv na spermiogenezi, a tedy i na fertilitu, a nebyl prokázán ani teratogenní vliv na plod partnerky muže léčeného MTX. Dle britských doporučení pro léčbu antirevmatiky je možno nízké dávky MTX aplikovat při léčbě bez významného omezení. Nicméně tyto vědecky podložené údaje a návrhy neodpovídají doporučení v lékovém SPC, kde je uvedeno striktní omezení a je doporučeno vysadit léčbu u muže až 6 měsíců před plánovanou koncepcí. Je však třeba zohlednit pohled medicíny založené na důkazech a dle toho pak po uvážení k léčbě MTX a jejímu ukončení i přistupovat (8).
Ostatní léky užívané v léčbě mužů s revmatickým onemocněním, tedy NSA, glukokortikoidy a ostatní chorobu modifikující léky, jsou z hlediska fertility bezpečné (7).
Jednotlivé nejčastější antirevmatické léky a jejich vztah ke graviditě a laktaci
Nesteroidní antirevmatika
Nesteroidní antirevmatika (NSA) nejsou teratogeny. V období před koncepcí mohou v důsledku inhibice syntézy prostaglandinů blokovat implantaci blastocysty. Nežádoucí účinek na matku spočívá – mimo obecně známé projevy toxicity – v možnosti prodloužení gestace a zvýšeném porodním krvácení, a to zejména tehdy, jsou-li NSA užívána během posledních šesti týdnů před porodem. NSA podávaná v tomto období mohou u plodu způsobit předčasné uzavření ductus arteriosus, mohou se podílet na vyvolání plicní hypertenze, na poruše renálních funkcí, což vede ke snížení objemu plodové vody. Tento stav je ale po vysazení léku plně reverzibilní. V období laktace dosahují velmi nízkých koncentrací v mateřském mléce a mohou zvyšovat riziko jádrového ikteru u novorozence (9, 10). V období gravidity je možno v nutných případech NSA podávat, je ale potřebné užívat jen nižší dávky, preferovat NSA s krátkým poločasem a NSA podávat intermitentně. Recentní studie upozorňuje na riziko častějších potratů v souvislosti s užíváním NSA, zejména na počátku těhotenství (11).
Selektivní inhibitory cyklooxygenázy 2 nejsou vzhledem k nedostatečným informacím o jejich bezpečnosti v graviditě doporučeny, v laktaci je možno podávat jen celekoxib. Od 32. týdne gravidity je nutno všechna NSA vysadit, aby u novorozence nedošlo k uvedeným komplikacím včetně předčasného uzavření ductus arteriosus (12, 13, 14).
Glukokortikoidy
Glukokortikoidy (GK) nemají u lidí teratogenní efekt. Dřívější pozorování uvádějí zvýšené relativní riziko výskytu orálních rozštěpů po terapii GK v prvém trimestru, ale novější údaje již toto riziko nepotvrzují (1). Systematická literární review z let 2008–2015 s analýzou 3500 gravidit neprokázala, že by terapie GK byla asociována se zvýšením rizika kongenitálních malformací (9). Dlouhodobá terapie GK může zpožďovat koncepci, zvyšuje riziko intrauterinních infekcí i předčasných porodů a vysoké dávky mohou vzácně vést i k adrenální supresi. Naopak riziko nízké porodní váhy nebo nízkého gestačního věku novorozenců je častěji spjato spíše s vlivem základní nemoci než s léčbou GK.
Krátce působící nefluorované glukokortikoidy pronikají přes placentu v nízkých koncentracích, a proto jsou dobře tolerovány. Plod je vystaven jen asi 10 % z dávky matky, což je dáno tím, že jsou z výrazné části inaktivovány placentárním enzymem 11-beta hydroxylázou. Do mléka přecházejí málo a v období laktace nejsou u prednisonu a metylprednisolonu udávány závažné nežádoucí účinky. Proto jsou tyto krátce působící GK používány k léčbě revmatického onemocnění matky. U rodiček s dlouhodobou terapií GK je vhodné jejich dávku na období krátce před porodem a i několik dní po porodu navýšit (1, 3)
V případě, že je nutno terapeuticky ovlivnit plod, např. ve snaze urychlit dozrávání fetálních plic, je nutno aplikovat ty GK, které významně pronikají placentární bariérou, tedy fluorované glukokortikoidy (dexametazon, betametazon). Terapii těmito fluorovanými glukokortikoidy je dle současných doporučení možno v graviditě aplikovat v co nejnižší účinné dávce například při terapii kongenitálního AV bloku při projevech lupus neonatorum.
U gravidních a kojících matek léčených GK je doporučována běžná prevence osteoporózy kalciem a vitaminem D, při vyšších dávkách GK v laktaci je pak nutno upravit intervaly mezi kojením a aplikací GK tak, aby koncentrace v mléce v okamžiku kojení byla co nejnižší. Při použití takovéto vyšší dávky (nad 50 mg denně) by mělo kojení následovat nejdříve po 4 hodinách po aplikaci léku. Novorozence těchto matek je pak nutno sledovat s ohledem na možnost adrenální suprese. Lokální, resp. intraartikulární aplikace GK nemá v graviditě specifická omezení (2).
Hydroxychlorochin, chlorochin
Antimalarika hydroxychlorochin a chlorochin nemají žádný vliv na fertilitu mužů či žen a hlavním nežádoucím účinkem na matku je okulotoxicita. Ta se ale netýká plodu nebo novorozence a je stejná, jako u běžné populace nebo v období mimo graviditu. Nejsou to teratogeny a nebyly zjištěny zásadní nežádoucí účinky na plod nebo na kojeného novorozence. V nízkých dávkách jsou v graviditě i v laktaci bezpečné a je preferováno použití zejména hydroxychlorochinu. Jsou vhodné k udržení nízké aktivity před plánovanou koncepcí i v graviditě. U revmatoidní artritidy je možno je jak prekoncepčně, tak i v graviditě kombinovat se sulfasalazinem, což je dle některých prací stejně efektivní, jako monoterapie methotrexátem, která je v graviditě pochopitelně kontraindikovaná (15, 16, 17).
Sulfasalazin
Sulfasalazin nemá žádný vliv na fertilitu u žen, ovšem u mužů snižuje pohyb spermií, způsobuje abnormální vývoj spermií, oligospermii a může vést až k reverzibilní infertilitě. Nežádoucí účinky na matku spočívají v obecných možných projevech toxicity, tedy zejména hepatotoxickém a myelotoxickém vlivu. Sulfasalazin nemá významný nežádoucí vliv na plod a nezvyšuje frekvenci fetálních abnormalit ani abortů. Přechází do mléka, ale nemá žádný významný vliv na kojené dítě. Jen ojediněle byl popsán případ krvavého průjmu u novorozence matky, která byla pomalou acetylátorkou, takže hladina sulfasalazinu byla vysoká. Sulfasalazin není kontraindikován ani v graviditě ani v laktaci a je lékem prvé volby u žen s revmatoidní artritidou, které plánují graviditu. V literatuře je udáváno, že denní dávka v graviditě by neměla přesáhnout 2 gramy (2, 10). Dále je doporučována suplementace folátů prekoncepčně i po dobu gravidity, jelikož sulfasalazin může nepříznivě zasahovat do jejich metabolismu (9). Vzhledem k tomu, že způsobuje reverzibilní infertilitu u mužů, je nutno jej u nich 2–3 měsíce před plánovanou koncepcí vysadit (4, 6).
Kyselina acetylsalicylová
Kyselina acetylsalicylová (ACP) nemá významný vliv na koncepci a fertilitu, ojedinělé anomálie plodu byly popsány jen u zvířat. U matky vede v denních dávkách vyšších než 3 mg/kg ke snížení kontraktility dělohy a k prodloužení gestace, zvyšuje riziko porodního krvácení a jsou udávány i častější porodní komplikace. U plodu může ve vyšších dávkách způsobit předčasné uzavření ductus arteriosus a úmrtí plodu. Proniká do mléka a u novorozence může vyvolat metabolickou acidózu, krvácení, porušení plicní cirkulace a vzácně i Reyův syndrom. Nízké dávky aspirinu je možno podávat po celou dobu gravidity i laktace a jsou vhodnou a bezpečnou možností antiagregační léčby v graviditě u žen s vyšším rizikem tromboembolické příhody. Vyšší dávky aspirinu by neměly být gravidním ženám podávány posledních 4–8 týdnů před porodem a v průběhu laktace (2, 6).
Warfarin
Warfarin může u plodu způsobit fetální warfarinový syndrom, který je charakterizován embryopatií, poškozením CNS, spontánními aborty, porody mrtvého plodu, hemoragiemi a předčasnou zralostí plodu. V graviditě je nutno jej vysadit a změnit léčbu za heparin nebo nízkomolekulární heparin (10).
Nová perorální antikoagulancia (gatrany a xabany) jsou s ohledem na nedostatek informací a i potenciální toxicitu rovněž pro graviditu nevhodná, resp. kontraindikovaná.
Heparin a nízkomolekulární heparin
Antikoagulační léčba heparinem nebo nízkomolekulárním heparinem je bezpečná pro matku i plod a její aplikace v graviditě i v laktaci je možná. Vyšší molekulární váha má pozitivní význam v tom, že lék neproniká ani přes placentu, ani do mléka. Významným nežádoucím projevem terapie heparinem a jeho deriváty je zvýšená ztráta kostní hmoty, a proto je u takto léčených gravidních žen nutná důsledná prevence rozvoje osteoporózy pomocí kalcia a vitaminu D (2, 9).
Azatioprin
Azatioprin nejspíše nemá vliv na fertilitu a není teratogen. Mezi jeho hlavní nežádoucí účinky na matku jsou řazeny zejména projevy myelotoxicity, hepatotoxicity a zvýšení rizika infekce. Proniká přes placentu, ovšem u plodu chybí enzym inosin-fosforyláza, konvertující azatioprin na aktivní metabolit (6-merkaptopurin), což vede k útlumu jeho efektu. U plodu má azatioprin prolongovaný imunosupresivní vliv, může vést k retardaci růstu plodu, tvorbě chromozomálních abnormit, adrenální hypoplazii, útlumu thymu a snížení hladiny imunoglobulinů. Dále může způsobit častější vznik infekce, a to zejména cytomegalovirem a gram-negativními bakteriemi. Proniká do mléka a má tak prolongovaný imunosupresivní vliv na kojeného novorozence. Gravidita a laktace jsou při léčbě azatioprinem možné v případech, kdy je tato terapie nezbytná. V literatuře je udáváno, že maximální denní dávka v graviditě by neměla být vyšší než 2 mg/kg váhy pacientky (2, 10). Někteří autoři doporučují ve 32. týdnu gravidity redukovat jeho dávku, a tím předejít rozvoji leukopenie a trombocytopenie u novorozence (2, 4).
Cyklosporin A
Cyklosporin A (CsA) nemá významný vliv na fertilitu a jeho nežádoucí účinky na matku jsou zejména projevy nefrotoxicity a vyvolání nebo zhoršení hypertenze. CsA není teratogenem. U plodu může způsobit nižší porodní váhu, ale nevede k retardaci růstu. Vzácně byla u plodu popsána cytopenie, diseminovaná intravaskulární koagulace, hypoglykemie, ikterus a mozková hemoragie. Proniká do mléka a u kojeného novorozence může mít prolongovaný imunosupresivní vliv, může vést k neutropenii a ne zcela jasný je jeho kancerogenní vliv. Terapie CsA není obecně u gravidních žen vhodná, ale v nezbytných případech ohrožení života matky, například u relapsu lupusové nefritidy, je možno jej podávat. Kojení při terapii CsA je rovněž v nezbytných případech možné, ale jen v nejnižší nutné denní dávce (1, 6).
Mykofenolát
U mykofenolát mofetilu byl prokázán výskyt kongenitálních malformací plodu, nejtypičtěji v oblasti oka (mikrocie a anocie). Vzácněji se vyskytují kongenitální srdeční vady a anomálie dolních končetin, atrezie jícnu, vertebrální abnormity, brániční hernie a poruchy ledvin a CNS. Proto je v graviditě kontraindikován a je nutno jej vysadit alespoň 6 týdnů před plánovanou koncepcí. Rovněž jej nelze podávat v laktaci (2, 9).
Kolchicin
Kolchicin není teratogen a v graviditě je možno jej aplikovat do dávky 1mg za den a i laktace je možná. Ovšem terapeutické indikace k této terapii v těhotenství jsou velmi řídké (2).
Intravenózní imunoglobuliny
Intravenózní imunoglobuliny je v indikovaných případech možno použít jak v graviditě, tak i v laktaci (1, 2).
Methotrexát
Methotrexát (MTX) nesnižuje fertilitu u žen, ale může způsobit přechodnou sterilitu u mužů v době terapie. Je embryotoxický a je závažným teratogenem. Deficit folátů vyvolaný MTX může vést k neurálnímu tubálnímu poškození, a proto je při terapii MTX nutná důsledná suplementace folátů i v období před plánovanou koncepcí a měla by pokračovat i v těhotenství. Mezi projevy toxicity MTX na matku patří zejména hepatotoxicita, myelosupresivní účinek a vyšší riziko infekčních komplikací. Teratogenní účinek na plod může způsobit poškození zejména v oblasti kraniofaciální a CNS, vzácně může vyvolat deskvamační fibrotizující alveolitidu a má i myelosupresivní účinek. MTX proniká do mléka, může se akumulovat ve tkáních novorozence a může působit imunosupresivně, vyvolat neutropenii, způsobit poruchu růstu. MTX má i účinek karcinogenní. Vzhledem k těmto závažným projevům toxicity je MTX v období gravidity a laktace přísně kontraindikován a je nutno jej u ženy vysadit minimálně 1–3 měsíce před plánovanou koncepcí. Starší doporučení ovšem udávala delší dobu, resp. minimálně 3 měsíce. Kontrolované studie u mužů užívajících methotrexát neukázaly vliv na vyšší procento malformací, a proto se předpokládá, že MTX může být používán v průběhu koncepce. Někteří však soudí, že bezpečnější by bylo vysadit methotrexát 3 měsíce před plánovanou koncepcí vzhledem k možnému vstřebání ejakulátu s obsahem methotrexátu v průběhu gravidity (19).
Leflunomid
Leflunomid byl doposud považován za teratogen a dle dosavadních doporučení je tudíž kontraindikován v graviditě i v laktaci. Nicméně názory na teratogenní efekt leflunomidu jsou v poslední době stále diskutovány. U zvířat byl prokázán teratogenní účinek a zvýšené riziko úmrtí plodu, ale v podmínkách humánní gravidity tento závěr nebyl tak jednoznačně potvrzen. Dle některých studií není považován za významný lidský teratogen a je zvažováno, zda požadavek dvouletého vysazení léku před graviditou (bez vymývací procedury) a dosažení plazmatické hladiny pod 0,02 mg/l není příliš opatrným přístupem.
Každopádně v současné době stále platí nutnost eliminačních opatření před graviditou. Vzhledem k tomu, že leflunomid se akumuluje v organismu, je nutno u ženy plánující graviditu provést eliminační, tzv. „vymývací“ postup. Ten spočívá v aplikaci cholestyraminu v dávce 24 g denně (8 g třikrát denně) po dobu 11 dní. Poté je nutno dvakrát vyšetřit sérovou hladinu leflunomidu a je-li zvýšena nad doporučenou normu, což je 0,02 mg/1, je nutno aplikovat další cholestyramin. Další alternativou vymývacího postupu je pak užití aktivního uhlí v celkové denní dávce 200 mg (tedy čtyřikrát denně 50 mg) po dobu 11 dnů. Bez této vymývací procedury dojde k poklesu hladiny lefunomidu až za řadu měsíců, v některých případech dokonce až během dvou let (2, 6).
Cyklofosfamid
Cyklofosfamid (CF) vyvolává u žen amenoreu, přičemž vyšší riziko je u žen starších 30 let. Udává se, že při perorální terapii CF se do jednoho roku rozvine amenorea u 70 % a při pulzní intravenózní léčbě v intervalu jednoho měsíce u 45 % léčených žen. Poškození ovarií bývá trvalé, a proto je nutná důsledná ochrana vajíčka. Dříve používaná aplikace CF v době menstruace, tedy v časné folikulární fázi, nyní rozhodně není považována za účinnou ochranu vajíčka. K tomu, aby byla ochrana efektivní, je nutno zabránit zrání vajíčka, a to hormonální antikoncepcí nebo užitím terapie agonisty gonadoliberinu. Nejúčinnější ochranou je však odběr a zmrazení vajíčka a u mužů je před terapií CF doporučena kryokonzervace spermatu. U mužů je k prevenci azoospermie možno aplikovat testosteron v dávce 100 mg intramuskulárně 15 dní před podáním pulzu CF.
Cyklofosfamid je teratogen a onkogen a může vést ke zpomalení růstu plodu, k vyvolání dřeňového útlumu a dále zvyšuje riziko infekce a hemoragie. Teratogenní efekt postihuje u plodu zejména skelet, patro, končetiny a oko. CF přechází do mléka, kde dosahuje významných hladin. CF je přísně kontraindikován v graviditě i v laktaci a musí být vysazen minimálně tři měsíce před plánovanou koncepcí. Zcela výjimečně, jen v případě ohrožení života gravidní matky, je možno jej aplikovat ve 2. a 3. trimestru (2, 10).
Tofacitinib
U malé skupiny pacientů s RA či psoriázou léčených tofacitinibem nebyly pozorovány rozdíly v dopadu těhotenství proti běžné populaci (18). To zatím ale není považováno za dostatečné bezpečnostní údaje, takže jej nelze podávat ani v graviditě, ani v laktaci a je nutno lék vysadit alespoň 2 měsíce před plánovanou koncepcí. Biologický poločas tofacitinibu je sice jen 3 hodiny, ale současně negativně ovlivňuje činnost NK buněk a tento vliv může přetrvávat až 6 týdnů. Tofacitinib je malá molekula a přestup do mateřského mléka je pravděpodobný.
Baricitinib
Zatím nejsou známy žádné údaje o vztahu baricitinibu a těhotenství či kojení. Vzhledem k velmi podobné povaze léku se dá očekávat, že doporučení pro terapii před koncepcí, v graviditě i v laktaci budou obdobná, jako u tofacitinibu.
Biologická terapie
V současné době jsou oproti jiným DMARD jen o něco kratší zkušenosti s průběhem gravidity a laktace u žen léčených TNF blokující terapií. Na základě jejich analýzy je terapie TNF inhibitory považována za relativně bezpečnou, a tedy i možnou. Není známo, že by anti-TNF terapie měla teratogenní nebo onkogenní vliv. Gravidita u těch žen, které doposud při TNF blokující léčbě otěhotněly nebo byly v graviditě léčeny, proběhla zatím vesměs vždy bez závažných problémů. Nebyly zjištěny významné změny v porodní váze novorozenců, nebyla prokázána zvýšená četnost porodních komplikací a předčasných porodů. V nedávné době bylo sice zvažováno zvýšení výskytu kongenitálních malformací plodu (tzv. nekompletní syndrom VACTERL), což ale pozdější analýzy nepotvrdily. Hlavní riziko anti-TNF léčby tak dle současného stavu poznatků spočívá v imunosupresivním vlivu na novorozence (1, 2, 20, 21, 22).
Všechny TNF blokátory pronikají placentou; míra jejich průniku je však pro jednotlivé léky odlišná. Nejvíce pronikají placentou monoklonální protilátky obsahující celou molekulu imunoglobulinu. V prvním trimestru k přechodu téměř nedochází, ale ve 2. a 3. trimestru se objeví v placentě neonatální receptory pro Fc část imunoglobulinu, pomocí kterých jsou tyto monoklonální protilátky aktivně transportovány přes stěnu placenty do oběhu dítěte. Stává se, že pokud jsou tyto terapeutické monoklonální protilátky podávány po celé těhotenství, může koncentrace protilátky v oběhu plodu přesáhnout koncentraci v oběhu matky. Méně proniká solubilní receptor a téměř vůbec neproniká pegylovaný Fab fragment monoklonální anti TNF protilátky, tedy certolizumab pegol (23).
Certolizumab
Certolizumab pegol má minimální průnik placentou a do mateřského mléka, což je dokumentováno v nejnovějších studiích (24). Hodnoty léku v séru novorozence i v mateřském mléce dle výsledků uvedených studií dosahují nevýznamných, až neměřitelných hodnot. To je dáno tím, že certolizumab pegol obsahuje pouze Fab část molekuly imunoglobulinu, neobsahuje Fc část, nemůže se tedy vázat na neonatální Fc receptory v placentě a není tedy aktivně přenášen. Nejvýhodnější formou této terapie v graviditě je tudíž právě tento přípravek, který je možno podávat po celou dobu těhotenství a i v laktaci. Fc receptory jsou používány ke vstřebávání také v gastrointestinálním traktu, což může mít význam také při kojení. Použití certolizumabu pegol v graviditě a laktaci je nyní nově uvedeno v SPC tohoto přípravku.
Etanercept
Solubilní receptor pro TNF etanercept proniká díky svému složení přes placentu a do mateřského mléka jen minimálně, a proto je možno jej podávat téměř po celou dobu gravidity, resp. až do jejího 32. týdne (2).
Infliximab, adalimumab
Monoklonální protilátky infliximab a adalimumab je v odůvodněných případech rovněž možno v graviditě podávat, ale je doporučeno ukončit je před 20. týdnem (dle některých, resp. britských doporučení ale již v 16. týdnu). Pakliže jsou podávány ve třetím trimestru, hladiny léku u novorozence jsou významně zvýšeny, což může mít za následek značný imunosupresivní vliv na novorozence (1, 2).
Golimumab
Golimumab není doporučen ani v graviditě ani v laktaci, a to z důvodu nedostatku údajů ověřujících jeho bezpečnost v graviditě. Farmakokinetika golimumabu je však podobná jako u dalších monoklonálních protilátek a lze z ní usuzovat o jeho chování minimálně v prvním trimestru, kdy není nijak aktivně přenášen přes stěnu placenty (2,22).
Tocilizumab
Tocilizumab nemá zatím dostatek bezpečnostních údajů a ta, která jsou k dispozici, jsou omezena na časnou fázi gravidity. Při analýze dosavadních sledovaných těhotenství nebyl zjištěn zvýšený výskyt kongenitálních malformací nebo jiných vážných komplikací, nejsou ale k dispozici žádné poznatky z období třetího trimestru. Oproti zdravé populaci byla ale zvýšená četnost předčasných porodů (31 %). Dle některých doporučení by měl být vysazen už 3 měsíce před koncepcí, což je více než pětinásobek jeho biologického poločasu (25). Vzhledem k farmakokinetickým vlastnostem a faktu, že molekula imunoglobulinu neproniká v prvém trimestru placentou, je nejspíše bezpečné ukončit terapii tocilizumabem až po zjištění gravidity.
Další biologické léky
Z důvodů nedostatečných údajů není v těhotenství doporučována terapie anakinrou, abataceptem, ustekinumabem, sarilumabem, canakinumabem, ixekizumabem a denosumabem (2,21). U secukinumabu jsou nyní k dispozici nová data z počtu téměř 300 gravidit při léčbě tímto lékem u psoriázy, psoriatické artritidy a ankylózující spondylitidy, přičemž nebyly prokázány jeho závažné nežádoucí účinky na plod (26). Nicméně i tato data jsou omezená a nelze aplikaci secucinumabu v graviditě doporučit.
Rituximab
Rituximab byl dle dřívějších doporučení v graviditě kontraindikován a měl být vysazen 12 měsíců před koncepcí, ale v současné době, kdy nebyl prokázán zvýšený výskyt kongenitálních malformací plodu v důsledku této terapie, je ve zcela výjimečných, indikovaných případech možno jej aplikovat, ale jen v časné fázi gravidity, přičemž poté musí být včas ukončen, později je riziko závažné cytopenie u novorozence. Nicméně dle jiných doporučení, například britských, je doporučeno jej preventivně vysadit 6 měsíců před těhotenstvím. Pro použití při laktaci není dostatek důkazů o bezpečnosti. V případě nutnosti použití rituximabu se soudí, že ve výjimečném případě je možné s kojením pokračovat (2, 10).
Belimumab
O belimumabu, což je jediný biologický lék schválený pro terapii SLE, nejsou vzhledem k omezenému počtu léčených pacientů k dispozici potřebné informace o bezpečnosti jeho užití v graviditě. Proto jej tedy právě z důvodu absence těchto dat nelze v době gravidity a laktace doporučit, i když dosavadní zkušenosti s omezeným počtem gravidních pacientek s touto léčbou neprokázaly jeho významné nežádoucí účinky (22).
Závěr
Dle všech vlastností a charakteristik příslušné jednotlivé revmatické nemoci, tedy dle jejího stavu, aktivity, celkového stavu pacientky, a dále dle charakteristiky uvažovaného biologického léku je zvolen konkrétní typ této léčby. Pakliže k ní v graviditě přistoupíme, je samozřejmě nutno uvážit všechna rizika a její možný očekávaný přínos pro nemocnou gravidní ženu. Rovněž je nutno zohlednit i možný vliv léčby na fertilitu mužů. Informace uvedené v tomto článku jsou na současné úrovni poznání, nicméně tyto poznatky jsou průběžně stále analyzovány a aktualizovány, což se děje nepřetržitě a s poměrně častými doplňky, zejména u nověji používaných léků.
Bezpečná gravidita i laktace u žen léčených pro revmatickou chorobu je možná, ovšem za předpokladu splnění některých důležitých podmínek. Gravidita by měla být vždy plánovaná. Nemocná žena by měla absolvovat genetické vyšetření, v době aplikace rizikových léků je nutno dodržovat důslednou antikoncepci a rizikové léky musí být před koncepcí včas vysazeny. Je nutno preventivně sledovat eventuální nežádoucí účinky léků na gravidní ženu i na plod a pacientku je nutno systematicky sledovat za spolupráce příslušných specialistů, tedy revmatologa a gynekologa, resp. porodníka. Porod by měl probíhat v řádném termínu a měl by být zvýšeně sledován. Dále by měla být zajištěna specializovaná péče neonatologa pro případ poporodních komplikací. Vzhledem k neustálému přibývání údajů o bezpečnosti léčby v graviditě a laktaci je také nutné pravidelně sledovat nejnovější informace a podle nich řídit terapii.
Práce vznikla za podpory Výzkumných záměrů ministerstva zdravotnictví ČR číslo: 000 000 23728.
adresa pro korespondenci:
MUDr. Dana Tegzová
Revmatologický ústav
Na Slupi 4
128 50 Praha
E-mail: tegzova@revma.cz
Sources
1. Flint J, Panchal S, Hurrell A et al: BSR and BHPR guideline on prescribing drugs in pregnancy and breastfeeding – part I: standard and biologic disease modifying anti-rheumatic drugs and corticosteroids. Rheumatology 2016; 55 : 1693–97.
2. Gotestam Skorpen C, Holetzenbein M, Tincani A et al. The EULAR point to consider for use of antirheumatic drugs before pregnancy and during pregnancy and lactation. Ann Rheum Dis 2016; 75(5): 795–810.
3. Ostensen M, Khamasta M, Lockshin MD et al. Anti-inflammatory and immunosuppressive drugs and reproduction. Arthritis Res Ther 2006; 8 : 209.
4. Ostensen M, Andreoli L, Brucato A et al. State of the art: reproduction and pregnancy in rheumatic diseases. Autoimmun Rev 2015; 14 (5): 376–86.
5. Ostensen M, Forger F. How safe are anti-rheumatic drugs during pregnancy? Curr Opin Pharmacol 2013; 13(3): 470–5.
6. Murray KE, Moore L, OBrien C et al Updated pharmacological management of rheumatoid arthritis for women before, during and after pregnancy, reflecting recent guidelines. Irish Journal of Medical Science 2018-europepmc.org https://dopi.org/10.1007/s11845-018-1829-7.
7. Micu MC, Ostensen M, Villiger PM et al. Paternal exposure to antirheumatic drugs-What physican should know: Review of the literature. Semin Arthritis Rheum 2018; pii: S0049-0172(17)30747-3.
8. Mouyis M, Flint JD, Giles IP. Safety of anti-rheumatic drugs in men trying to conceive: A systematic review and analysis of published evidence. Semin Arthritis Rheum 2018; pii: S0049-0172(18)30194-X.
9. Forger F, Villiger M. Treatment of rheumatoid arthritis during pregnancy: present and future. Expert Review of Clin Immunology 2016; 12 (9): 937–944.
10. Levy AR, De Jesús GR, De Jesús NR et al. Critical review of current recommendations for the treatment of systemic inflammatory rheumatic diseases during pregnancy and lactation. Autoimmun Rev 15 (2016); 955–963.
11. Li DK, Ferber JR, Odouli R, Quesenberry C. Use of nonsteroidal anti-inflammatory drugs during pregnancy and the risk of miscarriage. Am J Obstet Gynecol 2018 Jun 8. pii: S0002-9378(18)30489-7.
12. Ostensen M, Andreoli L, Brucato A et al. State of the art: reproduction and pregnancy in rheumatic diseases. Autoimmun Rev 2015; 14(5): 376–86.
13. Van Gelder MM, Roeleveld N, Nordeng H. Exposure to non-steroidal anti-inflammatory drugs during pregnancy and the risk of selected birth defects: a prospective cohort study. Plos ONE 2011; 6: e22174.
14. Daniel S, Matok I, Gorodischer R et al. Major malformations following exposure to nonsteroidal anti-inflammatory drugs during the first trimester of pregnancy. J Rheumatol 2012; 39 : 2163–9.
15. Koh JH, Ko HS, Kwok SK Net al. Hydroxychloroquine and pregnancy on lupus flares in Korean patients with SLE. Lupus 2015; 24 : 210–7.
16. Clowse ME, Magder L, Witter F et al. Hydroxychloroquine in lupus pregnancy. Arhritis Rheum 2006; 54 : 3640–7.
17. Ismirly PM, Costedoat-Chalumeau N, Pisconi CN et al. Maternal use of hydroxychloroquine is associated with reduced risk of recurrent anti SSA/Ro - antibody-associated cardiac manifestation on neonatal lupus. Circulation 2012; 126 : 76–82.
18. Clowse MEB, Feldman SR, Isac JD et al. Pregnancy outcomes in the tofacitinib safety databases for rheumatoid arthritis and psoriasis. Drug Saf 2016; 39 : 755–62.
19. Weber-Schoendorfer C, Chambers C, Wacker E et al. Pregnancy outcome after methotrexate treatment for rheumatic disease prior to or during early pregnancy: a prospective multicenter cohort study. Reprod Toxicol 2014; 66 : 1101–10.
20. Norgard B, Pedersen L, Christensen LA et al. Therapeutic drug use in women with Cohn’s disease and birth outcomes: a Danish nationwide cohort study. Am J Gastroenterol 2007; 102 : 1406–13.
21. Ghogomu EA, Maxwell LJ, Buchbinder R et al. Updated method guidelines for Cochrane musculoskeletal group systematic reviews and metaanalyses. J Rheumatol 2014; 41 : 194–205.
22. Ostensen M. The use of biologics in pregnant patients with rheumatic disease, Expert Review of Clinical Pharmacology, 2017; vol 10, 6 : 661-669.
23. Clowse MEB, Wilf DC, Forger F et al. Pregnancy outcomes in subjects exposed to certolizumab pegol J Rheumatol. 2015 Dec; 42(12): 2270–8
24. Firger F, Zbinden A, Villiger P. Certolizumab treatment during late pregnancy in patients with rheumatic diseases: Low drug levels in cord blood but possible risk for maternal infections. A case series of 13 patients. Joint Bone Spine. 2016 May; 83(3): 341–3
25. Hoeltzenbein M, Beck E, Rajwanshi R et al. Tocilizumab use in pregnancy: Analysis of global safety database including data from clinical trials and postmarketing data, Semin Arthritis Rheum 2016; 46(2): 238–45.
26. Warren RB, Reich K, Langley RG et al. Secukinumab in pregnancy: outcomes in psoriasis, psoriatic arthritis and ankylosing spondylitis from the global safety database. Br J Dermatol. 2018 Jun 21. doi: 10.1111/bjd.16901.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 4-
All articles in this issue
- The Czech Society for Rheumatology standpoint for the treatment with antirheumatic drugs in pregnancy and lactation
- Long-term results of treatment of rheumatoid arthritis with adalimumab in the national ATTRA registry
- Clinically suspect arthralgia: a current view of the preclinical phase of rheumatoid arthritis
- Extracellular miRNA – biogenesis, function and their use as biomarkers in rheumatic diseases.
- Non-pharmacological therapy of idiopathic inflammatory myopathies – exercise and its effect on patients with IIM, from 1993 to 2018
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Clinically suspect arthralgia: a current view of the preclinical phase of rheumatoid arthritis
- The Czech Society for Rheumatology standpoint for the treatment with antirheumatic drugs in pregnancy and lactation
- Long-term results of treatment of rheumatoid arthritis with adalimumab in the national ATTRA registry
- Extracellular miRNA – biogenesis, function and their use as biomarkers in rheumatic diseases.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

