-
Medical journals
- Career
Dlouhodobé výsledky léčby revmatoidní artritidy adalimumabem v národním registru ATTRA
: K. Pavelka 1; L. Nekvindová 2; Z. Křístková 2
: Revmatologický ústav, Praha 1; Institut biostatistiky a analýz, Brno 2
: Čes. Revmatol., 26, 2018, No. 4, p. 153-161.
: Original article
Revmatoidní artritida (RA) je chronické onemocnění, a proto je velmi důležité, aby bylo možné podávat biologický lék dlouhodobě. Proto se sleduje tzv. přežívání na léčbě biologickým lékem, a to především v registrech biologické léčby.
Cíl práce:
Analyzovat 10leté přežívání léčby adalimumabem a hodnotit důvody jejího ukončení. Dalším cílem bylo vyhodnocení prediktivních faktorů na začátku léčby pro možné ukončení léčby.
Metodologie:
Pacienti zařazeni do národního registru ATTRA, kteří splňovali kritéria České revmatologické společnosti pro biologickou léčbu. Sledovány demografické charakteristiky, jako hlavní ukazatel aktivity DAS 28, HAQ a EuroQuol. Důvody přerušení léčby hodnoceny jako primární selhání léčby, sekundární selhání léčby a přerušení pro nežádoucí účinky. Analyzováni vždy pacienti, u nichž byl adalimumab podáván jako první biologický lék, a do analýzy byli zařazeni pacienti léčeni v letech 2003–2017.
Výsledky:
Zařazeno 1598 pacientů s průměrným trváním choroby 10 let a průměrným DAS 28 na začátku léčby 5,7 ± 0,9. Po 10 letech léčby bylo stále na léčbě adalimumabem odhadem 27,7 % pacientů, medián přežívání byl 43,9 měsíce. Důvodem přerušení léčby byla nejčastěji ztráta účinku v 30,5 %, primární selhání ve 24,9 % a nežádoucí účinky v 19,8 %. Prediktivními faktory delšího přežívání na léčbě byl věk < 50 let oproti > 50 let (p = 0,027), maximální selhání 1 csDMARD oproti 2 a více v minulosti (p < 0,001) a kombinace adalimumabu s DMARD oproti monoterapii (p < 0,001). Medián přežívání na léku byl nejdelší u ankylozující spondylitidy, následně u psoriatické artritidy a nejkratší u revmatoidní artritidy.
Závěr:
Adherence k léčbě adalimumabem je velmi dobrá a činí 27,7 % po 10 letech léčby. Z pacientů, kteří jsou stále na léčbě, má 78 % stav nízké aktivity či remise. Léčba byla dobře tolerována a nevyskytly se žádné nové signály toxicity.
Klíčová slova:
adalimumab, revmatoidní artritida, registry
Úvod
Biologické léky přinesly do léčby revmatoidní artritidy (RA) doslova revoluční změnu. Jsou schopné rychle a účinně potlačit zánětlivou aktivitu, zmenšit intenzitu pacientem hodnocených symptomů (bolest, únavnost), udržet funkci a v neposlední řadě zpomalit až zastavit rentgenovou progresi RA. Dnes již existují téměř dvacetileté zkušenosti s aplikací biologické léčby u RA, které prokázaly výbornou účinnost biologické léčby nejen v rámci randomizovaných klinických studií, ale i v rámci neselektované populace v běžné klinické praxi. Zdrojem těchto informací jsou především tzv. registry biologické léčby. Primární význam registrů ale je především ve sledování nežádoucích účinků léčby. Významné byly poznatky z registrů především v otázce závažných nežádoucích účinků, jako jsou závažné a oportunní infekce, nádory nebo autoimunitní onemocnění.
Český národní registr ATTRA byl založen v roce 2001 jako první v oblasti střední a východní Evropy. Velkou výhodou registru byl od začátku fakt, že je řízen Českou revmatologickou společností, a protože je v podstatě povinný pro centra biologické léčby, obsahuje data od více než 95 % pacientů léčených biologickými léky v Česku (1). Jde o nezávislý registr, financovaný společně z příspěvků všech farmaceutických firem, řízený tzv. steering committee. V průběhu let byly výsledky publikovány v řadě domácích i zahraničních publikací buď samostatně, nebo v rámci analýzy více evropských registrů v projektech CERRERA, TOCERRA a PANABA (2, 3, 4).
Adalimumab je plně humánní monoklonální protilátka proti TNF alfa. V indikaci revmatoidní artritidy byl rozsáhle testován u celého spektra nemocných s RA, tzn. na biologickou léčbu naivních, MTX selhávajících i TNF selhávajících (5, 6, 7). Adalimumab působí rychle, účinně a kromě symptomů RA, jako je bolest a ztuhlost ovlivňuje i reaktanty akutní fáze a zpomaluje rentgenovou progresi RA.
Cíle práce
Hlavním cílem práce bylo analyzovat dlouhodobé přežívání na léčbě, jinými slovy adherenci pacienta k léčbě adalimumabem. Hlavním hodnoceným ukazatelem byla délka přežívání na léčbě a důvody jejího ukončení. Dále byly vyhodnocovány prediktivní faktory na začátku léčby pro ukončení léčby. Třetím cílem bylo srovnat přežívání na léčbě adalimumabem u revmatoidní artritidy ve srovnání s přežíváním u ankylozující spondylitidy a u psoriatické artritidy.
Metodologie
Pacienti.
Všichni pacienti splňovali na začátku léčby kritéria pro biologickou léčbu schválená Českou revmatologickou společností (8). Ve stručnosti jde o nemocné, kteří selhávali na léčbě methotrexátem nebo jinými DMARDs, a kteří měli aktivitu RA dle DAS 28 skóre vyšší než 5,1. Všichni byli také zařazeni do národního registru ATTRA.
Hodnocené ukazatele.
U všech pacientů jsou na začátku léčby vyhodnocovány základní demografické údaje, RF a anti CCP pozitivita, délka trvání RA, léčba RA v minulosti (glukokortikoidy, počet selhaných csDMARD), dále pak ukazatele aktivity (DAS 28 FW, CRP, počet oteklých kloubů, počet citlivých kloubů, globální aktivita nemoci dle pacienta), pro hodnocení funkce a kvality života pak skóre HAQ a EuroQuol.
Odpověď na léčbu je pak hodnocena v intervalech po třech měsících v průběhu prvního roku a dále v intervalech 6 měsíců. Odpověď je hodnocena jednak z rozdílu DAS 28 oproti bazálním hodnotám, podle odpovědi na léčbu dle EULAR, dále pak dle dosažení stavu nízké aktivity či remise (dle EULAR).
Příčiny ukončení léčby byly vyhodnoceny v kategoriích: primární selhání léčby, sekundární selhání léčby, přerušení pro nežádoucí účinky, dosažení remise, úmrtí pacienta, další důvody.
Byly vyhodnoceny prediktivní faktory ukončení léčby, a to demografické faktory související s léčbou RA (počet selhaných DMARD, komedikace glukokortikoidy) a aktivitou RA.
Analyzováni byli vždy pacienti, u nichž byl adalimumab podáván jako první biologický lék. Do analýzy byli zařazeni pacienti léčení v letech 2003–2017.
Statistické metody. Spojité proměnné jsou popsány pomocí průměru a směrodatné odchylky a pomocí mediánu s 5% a 95% kvantilem. Kategoriální parametry jsou sumarizovány pomocí absolutních a relativních četností. Hodnocení doby setrvání na léčbě adalimumabem bylo provedeno pomocí Kaplan-Meierovy metody. Jako charakteristiky přežití jsou uvedeny medián přežití s 95% intervalem spolehlivosti a dále x-leté přežití (od tříměsíčního po desetileté). Přežívaní na adalimumabu v rámci tří diagnóz bylo po dvojicích porovnáno prostřednictvím Log-rank testu. Statistická významnost byla hodnocená na 5% hladině. Analýza byla provedena v programu IBM SPSS Statistics, verze 24.
Výsledky
Do studie bylo zařazeno celkem 1598 pacientů s diagnózou RA, u nichž byl adalimumab podán jako první biologický lék. Charakteristika pacientů je znázorněna v tab. 1. Šlo o pacienty s dlouhým trváním onemocnění (průměr 10 let), kteří byli léčeni v 60 % glukokortikoidy, v 80 % měli již v minulosti selhání dvěma a více csDMARD, a rovněž aktivita před zahájením biologické léčby byla vysoká, když průměrné DAS 28 na začátku léčby bylo 5,7 + 0,9; počet oteklých kloubů 9,8 + 5,2; počet citlivých kloubů 13,1 + 5,9; CRP 25,2 + 26,9 mg/l a FW 38,3 + 22,6 mm/hod.
1. Základní charakteristika hodnocených pacientů s diagnózou RA. 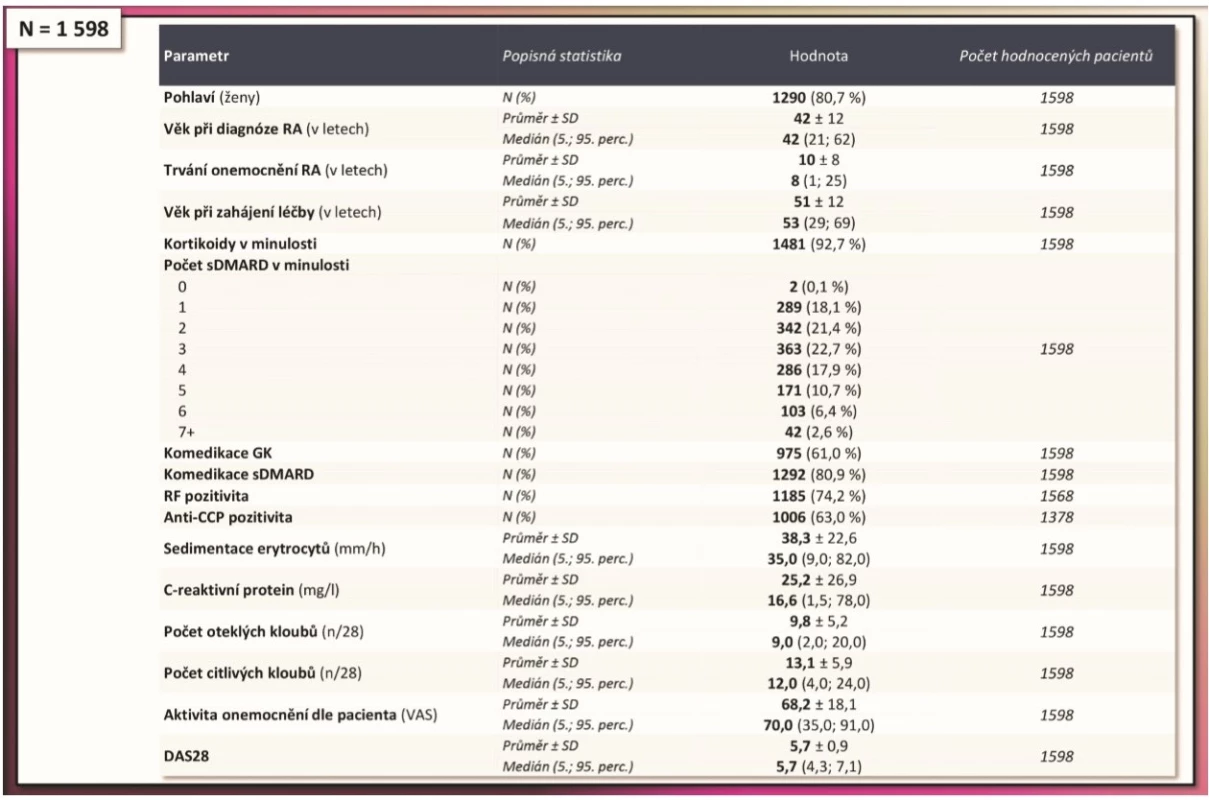
Přežívání na léčbě adalimumabem je na grafu 1. Po roce léčby bylo stále na léčbě adalimumabem odhadem 75,8 % pacientů, po 2 letech 65,2 %, po 5 letech 43,9 % a po 10 letech 27,7 % pacientů. Medián přežívání na léčbě byl 43,9 (38,5, 49,3) měsíce. Důvodem přerušení léčby byla nejčastěji ztráta účinku (sekundární selhání) v 30,5 %, primární selhání v 24,9 %, nežádoucí účinky v 19,8 %, remise v 7,3 % případů, úmrtí pacienta v 1,2 %, farmakoekonomické důvody 0,6 % a jiné důvody v 14,5 %.
1. Dlouhodobá účinnost léčby adalimumabem (Humira®) u diagnózy RA: Setrvání na léčbě. . 
Přežívání na léčbě adalimumabem v národním registru ATTRA bylo srovnatelné s přežíváním na léku v některých registrech ze západní Evropy (graf 2). Je to potvrzení faktu, že rozdílné úhradové systémy v jednotlivých zemích nemusí výsledky léčby příliš ovlivňovat.
2. Přežívání na anti-TNF léčbě u RA v evropských registrech po 3-4 letech. 
Prediktivními faktory delšího přežívání na léčbě byly nižší věk < 50 let oproti > 50 let (p = 0,027), maximálně selhání 1 csDMARD oproti 2 a více v minulosti (p < 0,001), kombinace adalimumabu s csDMARD oproti monoterapii (p < 0,001) (tab. 2). Prediktivními faktory nebyly pohlaví, pozitivita RF, pozitivita anti CCP ani současné podávání glukokortikoidů.
2. ATTRA – faktory asociované s delším přežíváním na léčbě s adalimumabem u revmatoidní artritidy. 
Dále bylo provedeno srovnání přežívání adalimumabu u revmatoidní artritidy, psoriatické artritidy a ankylozující spondylitidy (graf 3). Medián přežívání byl nejdelší u ankylozující spondylitidy 99,6 měsíce, což bylo více než u psoriatické artritidy (62,5 měsíce) (p < 0,001), a delší než u revmatoidní artritidy (43,9 měsíce) (p < 0,001). Přežívání na léčbě u psoriatické artritidy bylo delší než u revmatoidní artritidy (p = 0,020).
3. Přežívání na léčbě adalimumabem u RA, AS a PsA. 
Průměrný DAS 28 na začátku léčby byl 5,7 + 0,9 a poklesl (graf 4) na 2,9 + 1,1 po 12 měsících léčby a po 10 letech byl 2,5 + 0,9 u pacientů, kteří zůstali na léčbě. Dobrá odpověď na léčbu dle EULAR byla dosažena u 62,7 % po roce léčby a po 10 letech byla u 78,3 % pacientů (graf 5). Stavu remise (DAS 28 < 2,6) bylo dosaženo u 41,1 % po roce léčby a 56,5 % po 10 letech léčby u nemocných stále léčených (graf 6). Stavu nízké aktivity (DAS 28 < 3,2) bylo dosaženo u 78,2 % po 10 letech léčby adalimumabem.
4. Dlouhodobá účinnost léčby adalimumabem (Humira®) u diagnózy RA: Snížení DAS28 během léčby. 
5. Dlouhodobá účinnost léčby adalimumabem (Humira®) u diagnózy RA: Odpověď na léčbu dle EULAR kritérií. 
6. Dlouhodobá účinnost léčby adalimumabem (Humira®) u diagnózy RA: Dosažení remise a nízké aktivity onemocnění (LDA). 
Diskuse
Přežívání na léčbě lékem je složený ukazatel, který v sobě obsahuje několik komponent, a to jednak účinnost léčby, dále snášenlivost léčby, určitý komfort při podávání léčby, její dostupnost a někdy i nemedicínské důvody. Nicméně přežívání na léčbě, neboli adherence k léčbě, je důležitým ukazatelem celkové hodnoty léku. Jako příklad lze uvést rozdíl v adherenci k léčbě mezi některými staršími syntetickými csDMARD (zlato, cyklosporin, penicilamin), kde přežívání na léčbě po 2 letech bylo mezi 10–20 %, zatímco po biologických lécích je mezi 65–70 %.
Přežívání na léčbě adalimumabem bylo hodnoceno především v dlouhodobých otevřených extensích původně dvojitě slepých, randomizovaných studií a jednak v registrech. Přežívání na léčbě adalimumabem v registru ATTRA po 10 letech bylo 27,7 % pacientů, zatímco v otevřené extenzi studie DE020 pak 33,8 % (8). V otevřené extenzi studie PREMIER dokončilo 10 let léčby 50,3 % (9). Zde je ale nutné uvést, že populace v registru a v klinické studii se značně liší mnoha charakteristikami, např. kratším trváním onemocnění na začátku léčby ve studii PREMIER. V otevřeném prodloužení studie DE019, do které byli zařazováni pacienti s dlouhým trváním nemoci kolem 11 let, což bylo obdobné jako ve studii ATTRA, bylo desetileté přežívání v 32,6 % (10). Nepřímé srovnání tedy ukazuje, že významným faktorem delšího přežívání na léčbě je kratší délka trvání nemoci na začátku léčby, jinými slovy dřívější nasazení biologické léčby. Dalším sledovaným ukazatelem, který byl pozitivně asociován s délkou přežívání na léčbě, bylo současné podávání csDMARD, které byly podávány asi u 80 % pacientů a silně převažujícím csDMARD byl methotrexát. Kombinace anti TNF plus MTX je RA nejen účinnější než monoterapie anti TNF (11), ale přežívání na léčbě je při kombinaci delší (12). Proto také v Doporučeních EULAR je uvedeno, že pokud je to možné, vždy podávat anti TNF v kombinaci s csDMARD (13).
V klinické praxi byly zkoumány i některé další demografické ukazatele s možným vztahem k přežívání na léčbě či účinnosti jako je pohlaví, věk, pozitivita RF či anti CCP nebo podávání glukokortikoidů s nekonstantními výsledky. Ve studii z registru ATTRA nebyly tyto faktory s přežíváním na léčbě asociovány.
Podle strategie léčba k cíli (T2T) by měli pacienti dosahovat stavu remise či alespoň stavu nízké aktivity, přičemž stále nejčastěji používaným kritériem je DAS 28 (CRP nebo FW). V naší studii dosáhlo DAS 28 nižší než 3,2 po 10 letech léčby 78,2 % pacientů, což je srovnatelné se DE020, kde po deseti letech dosáhlo DAS 28 méně než 3,2 celkem 71,2 % pacientů (8). V této studii byla také vyšší účinnost léčby u pacientů s kratším trváním RA než dva roky, což opět zdůrazňuje nutnost včasného nasazení léčby.
Primárním cílem této studie bylo vyhodnocení přežívání a účinnosti adalimumabu u revmatoidní artritidy. Protože v registru ATTRA sledujeme podobné parametry u ankylozující spondylitidy a psoriatické artritidy, bylo možné provést srovnání u těchto tří diagnóz. Ve shodě s dalšími registry bylo přežívání na léčbě nejdelší u AS, kratší u PsA a nejkratší u RA (14, 15). Jak je toto vysvětlováno? Jednak průměrný věk léčených je v kohortách s AS nižší než u RA, méně časté jsou komorbidity, nesnášenlivost csDMARD, méně často jsou současně podávány glukokortikoidy a funkce hodnocená HAQ bývá nižší.
Kromě účinnosti je samozřejmě dalším faktorem přežívání na léčbě tolerance léčby a přerušení léčby kvůli nežádoucím účinkům. Podrobnější zpracování této problematiky je předmětem právě prováděné analýzy. Lze však konstatovat, že přerušení léčby kvůli nežádoucím účinkům se objevilo pouze asi ve 20 % případů. Nebyly zaznamenány žádné nové signály toxicity adalimumabu, které by se nevyskytovaly v předcházejících studiích (16).
Lze uzavřít, že dlouhodobá účinnost je u adalimumabu v léčbě RA velmi dobrá, a proto je i adalimumab stále nejčastěji používaným anti TNF preparátem v léčbě zánětlivých autoimunitních onemocnění.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 023728 Revmatologický ústav.
adresa pro korespondenci:
Prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: pavelka@revma.cz
Sources
1. Pavelka K, Hejduk K, Mann H. Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA. Čes Revmatol 2013; 3(21): 132–9.
2. Chatzidionysiou K, Lie E, Lukina G, Hetland ML, Hauge E-M, Pavelka K, et al. Rituximab retreatment i rheumatoid arthritis in a real-life cohort: data from the CERERRA collaboration. J Rheumatol 2017; 44(2): 162–9.
3. Gabay C, Riek M, Lund Hetland M, Hauge E-M, Pavelka K, Tomšič M, Canhao H, et al. Effectiveness of tocilizumab with and without synthetic disease-modifying antirheumatic drugs in rheumatoid arthritis: results from a European collaborative study. Ann Rheum Dis 2016; 75 : 1336–42.
4. Iannone F, Courvoisier DS, Gottenberg JE, Hernandez MV, Lie E, Canhao H, Pavelka K, et al. Body mas does not impact the clinical response to intravenous abatacept in patients with rheumatoid arthritis. Analysis from the „pan-European registry collaboration for abatacept (PANABA). Clin Rheumatol 2017; 36 : 733–79.
5. Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum 2003; 48 : 35–45.
6. van der Heijde D, Breedveld FC, Kavanaugh A, et al. Disease activity, physical function, and radiographic progression after longterm therapy with adalimumab plus methotrexate: 5-year results of PREMIER. J Rheumatol 2010; 37 : 2237–46.
7. Smolen JS, Emery P, Fleischmann R, et al. Adjustment of therapy in rheumatoid arthritis on the basis of achievement of stable low disease activity with adalimumab plus methotrexate or methotrexate alone: the randomised controlled OPTIMA trial. Lancet 2014; 383 : 321–32.
8. Furst D, Kavanaugh A, Florentinus S, et al. Final 10-year effectiveness and safety results from FE020 adalimumab treatment in patients with rheumatoid arthritis and an inadequate response to standard therapy. Rheumatology 2015; 54 : 2188–97.
9. Keystone EC, Breedveld F, van der Heijde D, et al.: Long term effect of delaying combination therapy with tumor necrosis factor inhibitor in patients with aggressive early rheumatoid arthritis. 10-year efficacy and safety of adalimumab from the randomized controlled PREMIER trial with open label extension. J Rheumatol 2014; 41 : 5–14.
10. Keystone EC, van der Heijde D, Kavanaugh A, et al. Clinical, functional and radiographic benefits of long-term adalimumab plus MTX: Final 10-year data in longstanding rheumatoid arthritis. J Rheumatol 2013; 40 : 1487–97.
11. Burmester GR, Mariette X, Montecucco C, et al. Adalimumab alone and in combination with disease-modifying drugs for the treatment of rheumatoid arthritis in clinical practice: The Research in Active Rheumatoid Arthritis (ReAct) trial. Ann Rheum Dis 2007; 66 : 732–39.
12. Nam JL, Winthrop KL, van Vollenhoven RF, Pavelka K, et al. Current evidence for the management of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of RA. Ann Rheum Dis 2010; 69 : 976–86.
13. Smolen JS, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017; 76 : 960–77.
14. Glintborg B, Østergaard M, Dreyer L, et al. Treatment response, drug survival, and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: results from the nationwide Danish DANBIO registry. Arthritis Rheum 2011; 63(2): 382–90.
15. Glintborg B, Ostergaard M, Krogh NS, et al. Predictors of treatment response and drug continuation in 842 patients with ankylosing spondylitis treated with anti-tumour necrosis factor: results from 8 years surveillance in the Danish nationwide DANBIO registry. Ann Rheum Dis 2010;69(11): 2002–08.
16. Burmester GR, Panaccione R, Gordon KB, et al. Adalimumab: long-term safety in 23 458 patients from global clinical trials in rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, psoriatic arthritis, psoriasis and Crohn´s disease. Ann Rheum Dis 2013; 72 : 517–24.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 4-
All articles in this issue
- The Czech Society for Rheumatology standpoint for the treatment with antirheumatic drugs in pregnancy and lactation
- Long-term results of treatment of rheumatoid arthritis with adalimumab in the national ATTRA registry
- Clinically suspect arthralgia: a current view of the preclinical phase of rheumatoid arthritis
- Extracellular miRNA – biogenesis, function and their use as biomarkers in rheumatic diseases.
- Non-pharmacological therapy of idiopathic inflammatory myopathies – exercise and its effect on patients with IIM, from 1993 to 2018
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Clinically suspect arthralgia: a current view of the preclinical phase of rheumatoid arthritis
- The Czech Society for Rheumatology standpoint for the treatment with antirheumatic drugs in pregnancy and lactation
- Long-term results of treatment of rheumatoid arthritis with adalimumab in the national ATTRA registry
- Extracellular miRNA – biogenesis, function and their use as biomarkers in rheumatic diseases.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

