-
Medical journals
- Career
Antibiotická terapie v graviditě
: M. Štefan 1; J. Vojtěch 2
: Klinika infekčních nemocí 1. LF UK a ÚVN, Praha, přednosta prof. M. Holub, Ph. D. 1; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 2
: Ceska Gynekol 2018; 83(1): 70-80
Cíl studie:
Přehled aktuálních poznatků o antibiotické léčbě v graviditě.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Klinika infekčních nemocí 1. LF UK a ÚVN, Praha; Ústav po péči o matku a dítě, Praha - Podolí.Materiál a metodika:
Využity byly relevantní literární zdroje, zejména odborné články indexované v Pubmed, dále zahraniční monografie a tuzemské články.Závěr:
Antibiotická léčba v těhotenství musí být racionální. Případný užitek by měl vždy převážit nad rizikem toxicity či teratogenity daného antibiotika. Je třeba se vyhnout zbytečně opatrnému přístupu, zároveň je však nutné vědět o nežádoucích účincích jednotlivých skupin antibiotik. V těhotenství dochází k alteraci farmakokinetických parametrů, proto je nutné u některých antibiotik zvýšit jejich dávku. Předpokládaný vliv antibiotické terapie v perinatálním období na rozvoj atopie a obezity u dětí si jistě zaslouží pozornost.Klíčová slova:
antibiotika, těhotenství, infekce, teratogenita, farmakokinetikaÚVOD
Ke kauzální terapii bakteriálních infekcí se používají různé léky s antibakteriálním účinkem. Podle původu se tyto léky dělí na látky přirozeně se vyskytující v přírodě (antibiotika v původním smyslu slova), synteticky upravené přirozeně se vyskytující látky (semisyntetická antibiotika) a látky plně syntetické (antibakteriální chemoterapeutika). Pro praktické potřeby je vhodné všechny tyto antibakteriální látky zahrnout pod zastřešující pojem antibiotikum. Základní vlastností ideálního antibiotika je tzv. selektivní toxicita, tedy inhibice růstu nebo smrt dané patogenní bakterie a zároveň žádná či minimální toxicita pro organismus pacienta. Takové ideální antibiotikum – Paulem Ehrlichem poeticky pojmenované jako kouzelná střela (Zauberkugel) – však vlastně neexistuje [24]. Při indikaci antibiotické léčby je tedy nutné vždy počítat s větším či menším rizikem nežádoucích účinků. Tato skutečnost platí dvojnásobně při léčbě gravidních žen. V těchto případech totiž podané antibiotikum ovlivňuje také plod, eventuálně novorozence při antibiotické léčbě matky v perinatálním období.
Spolehlivé informace o toxicitě jednotlivých antibiotik většinou nejsou k dispozici. Je tedy nutné spokojit se s údaji ze zvířecích experimentů a v případě lidí s kazuistikami a observačními studiemi (retrospektivními, vzácněji prospektivními). Randomizované kontrolované studie nelze u těhotných žen provádět z etických důvodů [44]. Dostupná literární data jsou navíc značně rozporuplná. Všeobecně lze říci, že mezi nejbezpečnější antibiotika v těhotenství patří beta-laktamová antibiotika, tedy peniciliny, cefalosporiny a karbapenemy [16]. U všech antibiotik však existuje větší či menší riziko pro gravidní ženu, plod či novorozence. Benefit antibiotické léčby musí tedy vždy převážit nad rizikem toxicity daného antibiotika.
Uvádí se, že až 25 % žen je během gravidity léčeno antibiotiky. Antibiotika tvoří až 80 % všech léků předepisovaných gravidním ženám [7]. Důvodů pro antibiotickou léčbu během těhotenství je celá řada, od infekcí postihujících též běžnou populaci po infekce specifické pro těhotenství. Antibiotikum může negativně ovlivnit gravidní ženu jak přímou toxicitou, tak vyvoláním potratu či předčasného porodu. Všechna antibiotika více či méně přestupují přes placentu, plod je tedy vždy do různé míry exponován použitému antibiotiku [7, 16]. Plod může být negativně ovlivněn přímou toxicitou daného antibiotika, případně teratogenním účinkem (tab. 1).
1. Rizika antibiotické terapie v těhotenství 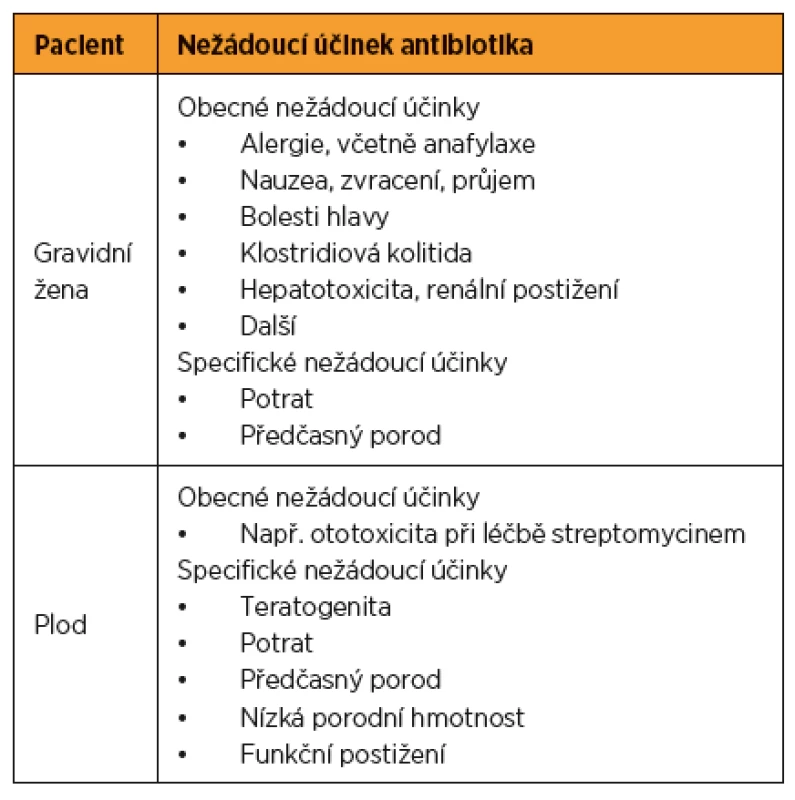
KLASIFIKACE
Nejpoužívanější klasifikací bezpečnosti léků v graviditě je kategorizace podle americké FDA (Food and Drug Administration) [19]. Její výhoda spočívá v přehlednosti, danému léku je přiřazena příslušná kategorie (A-D, X), podle které je možné se relativně lehce orientovat (tab. 2). V roce 2015 však došlo k aktualizaci této klasifikace. Zmíněná kategorizace byla nahrazena narativním popisem rizika daného léku, s výčtem dostupných dat z odborné literatury. „Písmenové“ kategorie tedy byly zrušeny. Smyslem této aktualizace je individualizovat indikaci léků v těhotenství na základě zvážení rizik a benefitu daného přípravku u konkrétní pacientky. Pro nově schválená antibiotika (od roku 2015) je aktualizace závazná. Pro antibiotika schválená po roce 2001 dojde k aktualizaci postupně. Pro léky schválené před rokem 2001 není nové nařízení závazné, ale kategorie podle FDA budou muset být vyňaty z příslušných SPC (Summary of Product Characteristics, souhrn údajů o přípravku) a souvisejících dokumentů [20].
2. Bezpečnost léků v těhotenství podle FDA 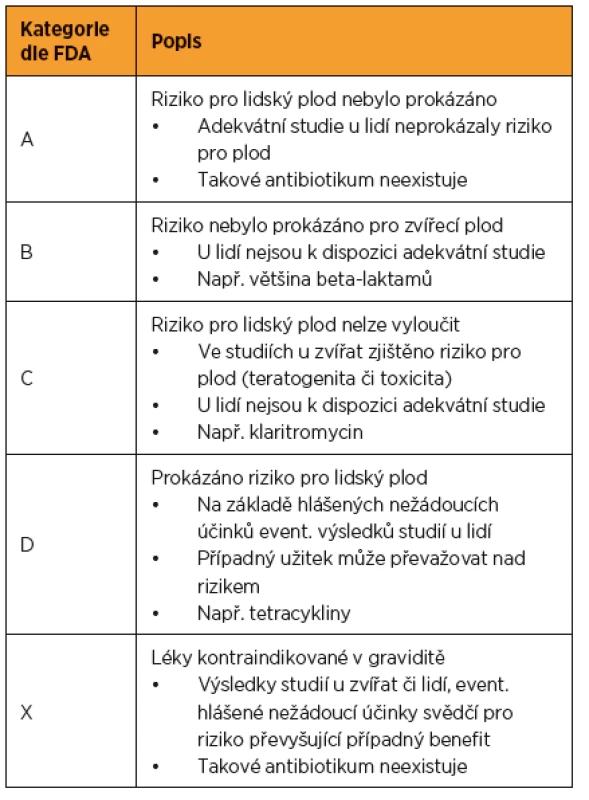
V České republice neexistuje oficiální klasifikace rizika léků v těhotenství, při indikaci příslušného léku se vychází z údajů v SPC a z dostupných literárních údajů [16]. V dalším textu budou kategorie podle FDA u jednotlivých antibiotik uvedeny, a to zejména pro přehlednost a rychlou orientaci.
CHARAKTERISTIKA JEDNOTLIVÝCH ANTIBIOTICKÝCH TŘÍD VE VZTAHU K JEJICH POUŽITÍ V GRAVIDITĚ
Beta-laktamová antibiotika
Beta-laktamová antibiotika (peniciliny, cefalosporiny a karbapenemy) patří mezi nejbezpečnější antibiotika v těhotenství. Svými vlastnostmi se nejvíce přibližují výše zmíněné „kouzelné střele“ [24]. Mechanismus jejich účinku totiž spočívá v inhibici syntézy bakteriální buněčné stěny. Lidské buňky buněčnou stěnu nemají, proto je toxicita beta-laktamových antibiotik minimální. Nejčastějšími nežádoucími účinky jsou různé typy alergických a imunopatologických reakcí. Beta-laktamy představují antibiotika první volby při léčbě mnoha druhů infekcí u gravidních žen, a to vzhledem k jejich baktericidnímu účinku a zmíněné minimální toxicitě.
Peniciliny
Mezi zástupce této skupiny patří přirozené peniciliny (penicilin G a penicilin V), protistafylokokové peniciliny (oxacilin), aminopeniciliny (amoxicilin a ampicilin), protipseudomonádové peniciliny (piperacilin) a kombinované přípravky penicilinového antibiotika s inhibitorem beta-laktamáz (amoxicilin/klavulanát, ampicilin/sulbaktam a piperacilin/tazobaktam). Teratogenita penicilinů nebyla prokázána, jejich použití v graviditě je považováno za bezpečné [7, 16]. Nežádoucí účinky u gravidních žen se neliší od běžné populace, nejčastěji se vyskytují různé typy alergických reakcí. Nejvíce dat o bezpečnosti v graviditě je k dispozici pro přirozené peniciliny a pro aminopeniciliny [30]. Všechny výše uvedené peniciliny jsou však zařazeny do „druhé nejbezpečnější“ kategorie B podle FDA.
Relativně kontroverzní je situace u kombinací penicilinů a inhibitorů beta-laktamáz, někteří autoři jejich použití v graviditě spíše nedoporučují [9]. Žádná přesvědčivá data o případné teratogenitě těchto kombinací však neexistují [6]. Léčba těhotné ženy aminopeniciliny (zejména v kombinaci s inhibitorem beta-laktamáz) v peripartálním období může být asociována s rozvojem nekrotizující enterokolitidy u předčasně narozeného novorozence [26, 47]. Důležité je si však uvědomit, že asociace neprokazuje příčinný vztah. Dostupná data jsou navíc konfliktní, některé práce zmíněnou asociaci nepotvrzují [17].
Cefalosporiny
Cefalosporiny představují rozsáhlou skupinu antibiotik a řadí se do pěti generací. Používají se zejména jako alternativa penicilinových antibiotik, v některých indikacích jsou však antibiotiky první volby (např. empirická léčba komunitní meningitidy cefalosporiny třetí generace). Stejně jako peniciliny patří i cefalosporiny k bezpečným antibiotikům u gravidních pacientek [16]. Všechny cefalosporiny patří do kategorie B podle FDA.
Opatrnosti je třeba u ceftriaxonu. Jde o cefalosporin třetí generace, jehož důležitou farmakokinetickou vlastností je vysoká vazba na sérové bílkoviny. Tato skutečnost stojí za dlouhým poločasem ceftriaxonu, který tak lze dávkovat jen jednou denně. Při použítí u těhotných žen v peripartálním období však může ceftriaxon vytěsnit bilirubin z vazby na albumin, a způsobit tak u novorozence jádrový ikterus [7]. Při nutnosti léčby cefalosporinem třetí generace u těhotných žen (a u novorozenců) je preferován cefotaxim, který se na sérové bílkoviny váže mnohem méně a nepředstavuje tak riziko vzniku jádrového ikteru.
Mírně zvýšené riziko teratogenity je uváděno u cefakloru, cefalexinu a cefradinu [30]. Tyto přípravky však u nás nejsou dostupné. Nové cefalosporiny (ceftarolin, ceftolozan/tazobaktam a ceftazidim/avibaktam) jsou také zařazeny do kategorie B podle FDA. Zkušenosti s jejich použitím u gravidních žen jsou ale zatím malé, je tedy třeba opatrnosti [7].
Karbapenemy
Karbapenemy jsou rezervní antibiotika s velmi širokým spektrem účinku. Používají se hlavně k léčbě infekcí způsobených multirezistentními bakteriemi (např. enterobakterie produkující širokospektrou beta-laktamázu, extended spectrum beta-lactamase, ESBL), případně k empirické léčbě těžkých infekcí u kriticky nemocných pacientů. Další možnou indikací je závažná alergie na peniciliny a cefalosporiny, v tomto případě se považuje riziko zkřížené alergie na karbapenemy za relativně nízké [4, 41]. Meropenem a ertapenem patří do kategorie B podle FDA, zatímco imipenem/cilastatin je řazen do kategorie C. Meropenem je karbapenem první volby. V některých indikacích lze použít ertapenem, který má však oproti meropenemu užší spektrum účinku (nepůsobí na pseudomonády a enterokoky). Výhodou ertapenemu je dlouhý poločas účinku (podání jednou denně), lze jej tedy použít v některých indikacích k ambulantní intravenózní léčbě. Příkladem takového použití ertapenemu je ambulantní intravenózní léčba infekcí močových cest způsobených enterobakteriemi produkujícími ESBL [18]. Je však nutné zmínit, že ambulantní intravenózní léčba antibiotiky není u nás zatím šířeji zavedena [42]. Na rozdíl od ceftriaxonu není v případě ertapenemu popsáno riziko jádrového ikteru u novorozenců.
Glykopeptidy
Vankomycin patří mezi glykopeptidová antibiotika (spolu s mnohem méně používaným teikoplaninem). Vankomycin inhibuje syntézu bakteriální buněčné stěny, ale na jiné úrovni než beta-laktamy. Účinek vankomycinu je baktericidní. Vankomycin je rezervní antibiotikum používané k léčbě infekcí způsobených multirezistentními grampozitivními bakteriemi (např. Staphylococcus aureus rezistentní k methicilinu, MRSA). Mezi nežádoucí účinky vankomycinu patří nefrotoxicita, infuzní reakce (anafylaktoidní reakce projevující se hypotenzí a erytémem kůže, tzv. red man syndrome) a vzácnější ototoxicita [5]. Vankomycin je řazen do skupiny C podle FDA, sporadická data však nesvědčí o teratogenním ani toxickém účinku na zvířata či lidský plod [7, 36]. Vankomycin se používá u těhotných žen, jen pokud není možné zvolit bezpečnější či účinnější alternativu (např. při léčbě sepse způsobené běžně citlivým kmenem S. aureus má podání protistafylokokového penicilinu nebo cefalosporinu vždy přednost před vankomycinem, a to kvůli prokazatelně vyšší účinnosti) [40].
Makrolidy
Makrolidy jsou širokospektrá bakteriostatická antibiotika inhibující bakteriální proteosyntézu. Jejich účinek není tak selektivní jako např. u beta-laktamů. Potenciál pro vyvolání nežádoucích účinků je tedy větší. Makrolidy mohou mít kardiotoxický účinek (např. komorové arytmie vyvolané prodloužením QT intervalu na EKG), závažné gastrointestinální příznaky a řadu lékových interakcí v důsledku inhibice jaterního cytochromu P-450 (inhibicí metabolismu dochází ke zvýšené koncentraci daného léku v organismu, a tím zvýšení jeho účinku). V léčbě běžných bakteriálních infekcí se používají jako alternativa beta-laktamů, těžiště jejich použití spočívá v léčbě infekcí způsobených atypickými bakteriemi (např. chlamydie, mykoplazmata a ureaplazmata) [5].
Bezpečnost jednotlivých makrolidů v těhotenství se liší. Dostupné informace jsou navíc značně konfliktní. Erytromycin patří do kategorie B podle FDA a je považován za nejbezpečnější makrolid [30]. O jeho použití je k dispozici nejvíce informací, jde totiž o historicky první dostupný makrolid [24]. U nás erytromycin však k dispozici není. Klaritromycin je řazen do kategorie C podle FDA, jelikož u zvířat bylo popsáno mírně zvýšené riziko vývojových vad kardiovaskulárního systému [2]. Teratogenita u lidí nebyla popsána, použití klaritromycinu však může zvyšovat riziko spontánního potratu [3]. Azitromycin se řadí do kategorie B podle FDA, teratogenita u zvířat nebyla popsána. V recentní retrospektivní kanadské studie bylo zjištěno zvýšené riziko spontánního potratu při použití azitromycinu a klaritromycinu, ne však erytromycinu. Oproti klaritromycinu bylo v této studii riziko u azitromycinu nižší [34]. Tato zjištění je třeba brát v potaz při indikaci makrolidů v graviditě, konfirmace v dalších studiích je ale jistě žádoucí. Spiramycin sice patří do kategorie C podle FDA, jeho použití v graviditě je však považováno za bezpečné [4, 38]. Spiramycin má kromě antibakteriální aktivity též účinek antiprotozoální. Z toho důvodu se používá k léčbě toxoplazmózy v těhotenství, přesněji k prevenci transplacentárního přenosu infekce při toxoplazmóze matky [5]. Roxitromycin je řazen do kategorie B, animální studie neprokázaly teratogenitu, informace o bezpečnosti u lidí nebyla stanovena [39]. V našich podmínkách je preferovaným makrolidem u gravidních žen azitromycin, který má navíc výhodu minimálních interakcí s ostatními léky (na rozdíl od ostatních makrolidů).
Při použití makrolidových antibiotik v graviditě je na místě opatrnost, a to zejména v prvním trimestru. Léčba by měla být co nejkratší a indikace daného makrolidu nezpochybnitelná.
Linkosamidy
Linkosamidy jsou bakteriostatická antibiotika s účinkem na grampozitivní a anaerobní bakterie. U nás je k dispozici klindamycin, dříve se používal i linkomycin. Klindamycin patří do kategorie B podle FDA a jeho použití v graviditě je považováno za bezpečné. Nejzávažnějším nežádoucím účinkem klindamycinu je kolitida způsobená Clostridium difficile. Ta sice může vzniknout po jakémkoliv antibiotiku, linkosamidy však patří v tomto směru mezi nejrizikovější antibiotika (spolu s fluorochinolony). Klindamycin podaný perorálně lze použít jako alternativu metronidazolu při léčbě bakteriální vaginózy [5]. Intravaginální podání klindamycinu se při léčbě bakteriální vaginózy v těhotenství nedoporučuje, a to z důvodu nízké účinnosti a vyššího výskytu infekcí u novorozence. Intravaginálně podaný klindamycin totiž nepříznivě zasahuje do složení přirozené vaginální flóry, což umožňuje „přerůstání“ patogenních kmenů bakterií. Tímto mechanismem se vysvětluje zmíněné vyšší riziko neonatálních infekcí [29].
Aminoglykosidy
Aminoglykosidy jsou baktericidní antibiotika s účinkem na gramnegativní bakterie a v kombinaci s jinými antibiotiky také na některé grampozitivní bakterie. Mechanismus účinku spočívá primárně v inhibici proteosyntézy, zřejmě se však uplatňují i další mechanismy. Mezi indikace aminoglykosidů patří infekce močových cest, polymikrobiální infekce (včetně nitrobřišních infekcí) a některé zoonózy (např. tularemie a brucelóza). Ve většině indikací se aminoglykosidy používají v kombinaci s jinými antibiotiky (smyslem je synergismus nebo rozšíření spektra), v monoterapii je lze podávat při léčbě lehčích infekcí močových cest. Aminoglykosidy mohou způsobit nefrotoxicitu a ototoxicitu [5]. Streptomycin je řazen do kategorie D podle FDA, byly totiž popsány případy ireverzibilní hluchoty u novorozenců matek léčených streptomycinem [37]. Streptomycin se u nás používá pouze k léčbě tuberkulózy. Ostatní aminoglykosidy patří také do kategorie D, v některých zdrojích je gentamicin zařazen do kategorie C podle FDA [7]. Dostupná data však naznačují, že ostatní aminoglykosidy jsou bezpečnější než streptomycin [30]. U nás jsou k dispozici gentamicin a amikacin. Oba zmíněné aminoglykosidy lze v těhotenství použít, není-li dostupná bezpečnější alternativa, přičemž je preferován gentamicin [7, 30]. Léčba aminoglykosidy by měla být co nejkratší, což ostatně platí i pro běžnou populaci. Samozřejmostí by měla být monitorace krevních koncentrací příslušného aminoglykosidu s případnou úpravou dávkování po konzultaci s klinickým farmaceutem.
Nitrofurantoin a nifuratel
Nitrofurantoin je baktericidní antibiotikum s relativně širokým spektrem účinku. Terapeutických koncentrací dosahuje pouze v moči. Indikován je tedy jen k léčbě infekcí močových cest, vzhledem k nízkým tkáňovým koncentracím není použitelný k léčbě pyelonefritidy. Nelze jej použít ani k léčbě sepse, sérové koncentrace jsou totiž zanedbatelné. Mechanismus účinku není zcela jasný, zřejmě spočívá v poškození bakteriální DNA, RNA a dalších důležitých molekul [5]. Vzhledem k tomuto faktu se objevily obavy o možné teratogenitě nitrofurantoinu [24]. Dostupná data jsou nekonzistentní, teratogenita však nebyla v recentní metaanalýze prokázána [23]. Nitrofurantoin je řazen do kategorie B podle FDA. Někteří autoři přesto doporučují opatrnost v prvním trimestru a uvádějí, že nitrofurantoin je možné v tomto období použít, jen není-li k dispozici jiná alternativa [30]. V recentní kanadské studii nebyla prokázána asociace mezi použitím nitrofurantoinu a spontánním potratem [34]. Nitrofurantoin může vyvolat hemolytickou anémii u novorozenců s deficitem glukóza-6-fosfátdehydrogenázy, z tohoto důvodu se nedoporučuje užívat nitrofurantoin v peripartálním období [45]. Teoretické riziko hemolytické anémie existuje při použití nitrofurantoinu u všech novorozenců, a to z důvodu fyziologicky nízké hladiny antioxidantu glutathionu.
Zajímavou alternativou nitrofurantoinu je nifuratel. Ten se vyznačuje podobným spektrem účinku jako nitrofurantoin, navíc však působí i na Gardenella vaginalis, Trichomonas vaginalis, chlamydie, mykoplazmata, anaerobní bakterie a dokonce i na kandidy. Těžiště jeho použití spočívá v léčbě vaginálních infekcí, lze jej však použít i k léčbě infekcí močových cest. Teratogenita nebyla u nifuratelu na zvířecích modelech prokázána. Použití nifuratelu v graviditě je považováno za bezpečné [28].
Metronidazol
Metronidazol je baktericidní antibiotikum s účinkem na anaerobní bakterie a některé prvoky (např. Trichomonas vaginalis). Mechanismus účinku metronidazolu tkví v poškození bakteriální DNA toxickými radikály. Stejně jako u nitrofurantoinu vyvstává i v případě metronidazolu otázka případné teratogenity. Ačkoli byly publikovány kazuistiky naznačující teratogenitu, mnoho velkých studií tuto asociaci nepotvrdilo [11, 15]. Metronidazol patří do kategorie B podle FDA. V recentní kanadské studii bylo však prokázáno vyšší riziko spontánního abortu [34]. V prvním trimestru by se tedy metronidazol rutinně používat neměl. Na druhou stranu metronidazol patří k lékům první volby symptomatické bakteriální vaginózy a trichomonázy v průběhu celého těhotenství [29]. Ve druhém a třetím trimestru je použití metronidazolu považováno za relativně bezpečné [30].
Kotrimoxazol
Kotrimoxazol je kombinace pyrimidinového antibiotika (trimetoprimu) a sulfonamidového antibiotika (sulfametoxazolu). Kotrimoxazol má široké spektrum účinku, kromě mnoha bakterií působí i např. na mykotický oportunní patogen Pneumocystis jiroveci. Těžiště jeho užití je v léčbě infekcí močových cest. Mechanismus účinku kotrimoxazolu spočívá v sekvenční inhibici enzymů zodpovědných za syntézu, respektive aktivaci kyseliny listové. Výsledný účinek je baktericidní. Kyselina listová je totiž esenciální pro tvorbu nukleových bází a její deplece tak nepřímo vede k inhibici syntézy DNA [5]. Právě vliv na metabolismus kyseliny listové však stojí za zvýšeným rizikem vzniku vývojových vad při použití kotrimoxazolu v těhotenství [14, 25, 32]. Někteří autoři však poukazují na nízkou kvalitu dat [21]. Současné užívání kyseliny listové může mitigovat teratogenní účinek kotrimoxazolu [7]. Tento přístup však může zároveň snížit antibakteriální účinek kotrimoxazolu.
V recentní kanadské studii bylo popsáno zvýšené riziko spontánního potratu při léčbě kotrimoxazolem [34]. Kotrimoxazol je řazen do kategorie C podle FDA. V prvním trimestru by se kotrimoxazol neměl rutinně předepisovat, v jasně indikovaných případech je však jeho podání možné (zejména není-li jiná alternativa). Jako příklad lze uvést léčbu pneumocystové pneumonie u HIV-pozitivní ženy [21]. Při použití kotrimoxazolu v pozdějších fázích těhotenství je na místě opatrnost, ačkoli je riziko nežádoucích účinků na plod zřejmě nižší [7]. Vysoká vazba kotrimoxazolu na sérové bílkoviny stojí za rizikem vzniku jádrového ikteru (podobně jako u ceftriaxonu). Z toho důvodu není použití kotrimoxazolu doporučeno na konci třetího trimestru [30].
Fluorochinolony
Fluorochinolony jsou baktericidní antibiotika se širokým spektrem účinku (grampozitivní, gramnegativní a atypické bakterie). Mechanismus účinku spočívá v zásahu do funkce DNA. Nejčastějším nežádoucím účinkem fluorochinolonů je klostridiová kolitida (podobně jako u linkosamidů) a prodloužení QT intervalu s rizikem komorových arytmií [5]. Fluorochinolony patří do kategorie C podle FDA a v těhotenství jsou všeobecně kontraindikovány. Důvodem je obava z nepříznivého vlivu na vývoj chrupavek a z teratogenity, což bylo prokázáno v animálních studiích [7, 31]. Dostupné humánní studie tyto asociace neprokazují, kvalita dat však není uspokojivá [48]. V recentní kanadské studii byla prokázána asociace mezi použitím fluorochinolonů a spontánním potratem [34].
Fluorochinolony lze použít v těhotenství jen ve výjimečných případech, není-li dostupná jiná alternativa. Příkladem může být postexpoziční profylaxe antraxu v případě bioteroristického útoku.
Tetracykliny
Tetracykliny (tetracyklin, doxycyklin a minocyklin) jsou širokospektrá bakteriostatická antibiotika. Spektrum jejich účinku zahrnuje grampozitivní, gramnegativní a atypické bakterie. Mechanismus účinku tetracyklinů tkví v inhibici bakteriální proteosyntézy [5]. Tetracykliny patří do kategorie D podle FDA a v těhotenství jsou kontraindikovány. V humánních studiích byla prokázána jejich teratogenita [7, 30]. V recentní kanadské studii bylo popsáno riziko spontánního abortu [34]. Při použití tetracyklinů v druhé polovině těhotenství existuje riziko porušeného růstu kostí, zbarvení mléčného chrupu a hypoplazie skloviny [7]. Léčba tetracyklinem v těhotenství může vést k jaterní nekróze u matky [30]. Je však nutné si uvědomit, že většina dostupných dat pochází ze studií s tetracyklinem (starším zástupcem tetracyklinových antibiotik). U nás je z tetracyklinových antibiotik k dispozici pouze doxycyklin, u kterého nebyla výše zmíněná rizika jednoznačně prokázána [13]. Doxycyklin je antibiotikem první volby u ricketsióz a dalších infekcí přenášených klíšťaty či jiným hmyzem (např. horečka tsutsugamushi). Tyto infekce mohou probíhat velmi závažně a léčba těhotných žen doxycyklinem je v této situaci obhajitelná [13]. Doxycyklin je navíc považován za „univerzální“ antibiotikum v případě bioteroristického útoku (účinkuje totiž na Bacillus anthracis, Yersinia pestis, Coxiella burnetii a Francisella tularensis) [10].
Tigecyklin
Tigecyklin je semisyntetický derivát tetracyklinového antibiotika minocyklinu. Jeho spektrum účinku je širší než u tetracyklinů a zahrnuje řadu multirezistentních bakterií (např. MRSA, ESBL a Clostridium difficile) [5]. Jde o relativně recentně registrované antibiotikum a spolehlivá data o jeho bezpečnosti v těhotenství nejsou k dispozici. Tigecyklin je řazen do kategorie C podle FDA, u zvířat byla prokázána toxicita (včetně úmrtí plodu) [7].
Podle výrobce je použití tigecyklinu během těhotenství možné, vyžaduje-li to klinický stav ženy. Ve většině takových případů je však možné zvolit bezpečnější alternativu.
Chloramfenikol
Chloramfenikol je extrémně širokospektré bakteriostatické antibiotikum. Jeho mechanismus účinku spočívá v inhibici bakteriální proteosyntézy. Chloramfenikol působí na širokou škálu grampozitivních, gramnegativních, anaerobních a atypických bakterií. Chloramfenikol patří mezi antibiotika s výrazným průnikem do centrálního nervového systému [5]. Vzhledem sice k malému, ale reálnému riziku aplastické anémie není chloramfenikol běžné používán, a to ani u běžné populace. Chloramfenikol patří do kategorie C podle FDA. Teratogenita chloramfenikolu u lidí nebyla prokázána [36]. Při podání chloramfenikolu krátce před porodem hrozí závažná toxicita u novorozence (tzv. gray baby syndrome), která je dána nedostatečně vyvinutým metabolismem pro eliminaci chloramfenikolu. Mechanismem zmíněného syndromu je toxická myokarditida s následným selháním krevního oběhu.
V případě závažných infekcí je použití chloramfenikolu možné, pouze není-li k dispozici jiná alternativa. Příkladem může být mozkový absces u těhotné ženy, u které je přítomna polyvalentní alergie na bezpečnější antibiotika (např. beta-laktamy, vankomycin a další).
Fosfomycin
Fosfomycin je relativně širokospektré baktericidní antibiotikum. Mechanismus účinku tkví v inhibici syntézy buněčné stěny, a to na jiné úrovni, než je tomu u beta-laktamů a vankomycinu [5]. Fosfomycin je u nás k dispozici pouze pro perorální podání a je indikován k léčbě infekcí močových cest. Jeho výhodou je, že působí i na některé multirezistentní kmeny (např. enterobakterie produkující ESBL). Nežádoucí účinku fosfomycinu jsou minimální. Fosfomycin je řazen do kategorie B podle FDA a jeho použití v graviditě je považováno za bezpečné [7].
Linezolid
Linezolid je bakteriostatické antibiotikum s účinkem na grampozitivní bakterie (včetně řady multirezistetních kmenů, např. MRSA). Mechanismus účinku spočívá v inhibici bakteriální proteosyntézy. Linezolid patří mezi antibiotika s relativně významnou toxicitou, nejčastěji může způsobit reverzibilní útlum kostní dřeně [5]. Linezolid je řazen do kategorie C podle FDA. V animálních studiích byly prokázány jisté toxické účinky na plod (nízká váha a redukce osifikace sterna), ne však teratogenita [22]. Spolehlivá data u lidí dostupná nejsou.
Linezolid lze použít v těhotenství jen v jasně indikovaných případech. Příkladem může být léčba infekce způsobené MRSA u ženy alergické na vankomycin.
Kolistin
Kolistin je baktericidní antibiotikum s účinkem na gramnegativní bakterie (včetně většiny multirezistentních kmenů, např. enterobakterie produkující karbapenemázy). Kolistin účinkuje na úrovni zevní bakteriální membrány, jejíž funkci inhibuje. Toxicita kolistinu je značná, projevuje se zejména nefrotoxicitou a neurotoxicitou [5]. Výsledky animálních experimentů naznačují riziko fetální toxicity. Sporá data u lidí toto riziko nepotvrzují [27]. Kolistin je zařazen do kategorie C podle FDA.
Kolistin lze užít v těhotenství jen v jasně indikovaných případech, není-li k dispozici bezpečnější alternativa. Příkladem může být léčba infekce způsobené gramnegativní bakterií produkující karbapenemázu.
Rifampicin
Rifampicin je baktericidní antibiotikum s relativně širokým spektrem účinku (zejména na grampozitivní bakterie a mykobakteria). Rifampicin inhibuje syntézu bakteriální RNA. Během léčby rifampicinem dochází rychle ke vzniku rezistence, proto se rifampicin musí používat vždy v kombinaci minimálně s ještě jedním účinným antibiotikem. Jako jedno z mála antibiotik proniká rifampicin do biofilmu. Indikací rifampicinu není mnoho, patří mezi ně léčba tuberkulózy a infekcí protetického materiálu (např. totální endoprotéza kloubu). Rifampicin náleží mezi silné induktory cytochromu P-450, je tedy zodpovědný za řadu lékových interakcí [5]. Rifampicin je řazen do kategorie C podle FDA. Toxicita u zvířat byla prokázána (např. poruchy osifikace, spina bifida a embryotoxicita při použití vysokých dávek), zatímco u lidí nikoliv [36]. Rifampicin zvyšuje riziko krvácení u novorozenců, profylaktické podání vitaminu K může však toto riziko snížit [8].
PŘÍKLADY ANTIBIOTICKÝCH REŽIMŮ U NEJČASTĚJŠÍCH INFEKČNÍCH CHOROB V TĚHOTENSTVÍ
V tabulce 3 je uveden praktický přístup k antibiotické léčbě vybraných infekčních chorob v těhotenství [1, 5, 26, 33, 43]. V případě identifikace etiologického agens platí princip úpravy antibiotické terapie dle citlivosti dané bakterie, většinou je možné změnit terapii na antibiotikum s užším spektrem účinku (tzv. deeskalace).
3. Antibiotická terapie vybraných infekcí v těhotenství 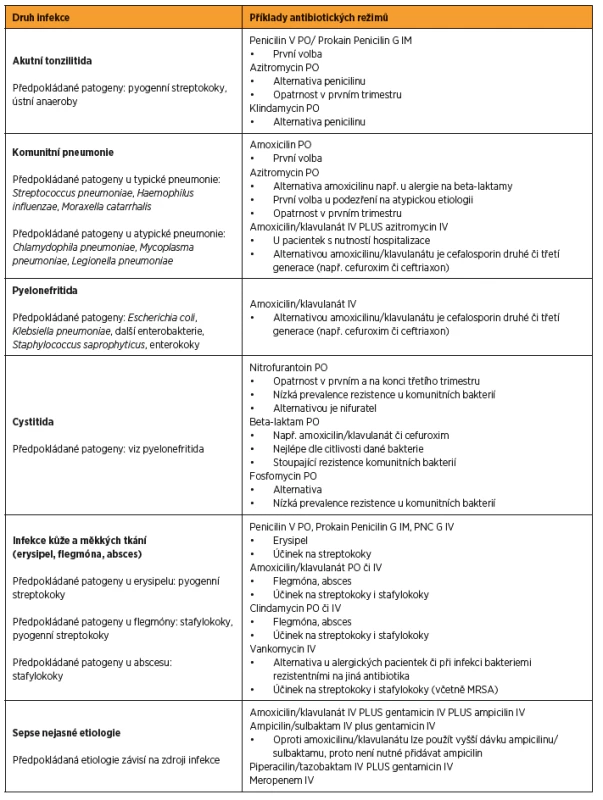

Zkratky: IV – intravenózně, PO – perorálně, IM – intramuskulárně, MRSA – methicilin rezistentní <i>Staphylococcus aureus</i>, GBS – <i>Group B Streptococcus</i> (Streptococcus skupiny B) FARMAKOKINETICKÉ ZMĚNY V TĚHOTENSTVÍ
Během gravidity dochází v organismu ženy k mnoha fyziologickým změnám. Z hlediska antibiotické terapie jde zejména o navýšení objemu celkové tělesné vody a glomerulární filtrace. To se odráží ve změně některých farmakokinetických parametrů, například zvýšení distribučního objemu a urychlení renální eliminace některých antibiotik. V praxi jde zejména o beta-laktamová antibiotika, jejichž sérové koncentrace mohou být z těchto příčin u gravidních žen až o 50 % nižší oproti běžné populaci. Z toho důvodu je doporučeno navýšit dávku beta-laktamového antibiotika, eventuálně zkrátit dávkovací interval [7]. Dále je vzhledem k těžko předvídatelné farmakokinetice doporučeno u těhotných žen monitorovat sérové koncentrace vankomycinu a aminoglykosidů [5]. Výhodné je v těchto případech konzultovat klinického farmaceuta, který dokáže na základě individuálních farmakokinetických parametrů určit správné dávkovací schéma daného antibiotika.
OVLIVNĚNÍ MIKROBIOMU MATKY A NOVOROZENCE ANTIBIOTICKOU TERAPIÍ
Antibiotická terapie ovlivňuje složení střevního mikrobiomu. V dlouhodobém horizontu je vliv antibiotik na střevní mikrobiom malých dětí obviňován ze zvýšeného rizika vzniku ekzému, alergické rinitidy, astmatu a obezity [12, 35, 46]. Zdá se, že tato problematika se týká hlavně antibiotické léčby matky při kojení a antibiotické léčby novorozenců a kojenců. Nelze však vyloučit ani skutečnost, že antibiotická léčba matky těsně před porodem může negativně ovlivnit složení střevního mikrobiomu novorozence, který získává mikrobiom primárně od matky [12].
ZÁVĚR
Antibiotická léčba v těhotenství a při laktaci musí být racionální. Případný užitek by měl vždy převážit nad rizikem toxicity či teratogenity daného antibiotika. Je třeba se vyhnout zbytečně opatrnému přístupu, zároveň je však nutné vědět o nežádoucích účincích jednotlivých skupin antibiotik. Při indikaci antibiotické terapie je vhodné konzultovat klinického mikrobiologa, infektologa a případně klinického farmaceuta. Předpokládaný vliv antibiotické terapie v perinatálním období na rozvoj atopie a obezity u dětí si jistě zaslouží pozornost.
Tato práce byla podpořena projektem MO1012.
MUDr. Marek Štefan
Klinika infekčních nemocí 1. LF UK a ÚVN
U vojenské nemocnice 1200
169 02 Praha 6
e-mail: marek.stefan@uvn.cz
Sources
1. Adámková, V., Balík, M., Bláha, J., et al. Mezioborový doporučený postup – diagnostika a léčba sepse v souvislosti s těhotenstvím. Čes Gynek, 2016, 81, 2, p. 134–139.
2. Amsden, GW. Erythromycin, clarithromycin, and azithromycin: are the differences real? Clin Ther, 1996, 1, p. 56–72.
3. Andersen, JT., Petersen, M., Jimenez-Solem, E., et al. Clarithromycin in early pregnancy and the risk of miscarriage and malformation: a register based nationwide cohort study. PLoS One, 2013, 8, 1, e53327.
4. Bartlett, JG. (ed.) The John Hopkins ABX Guide (online). [cit. 2017-07-03]. Dostupný z www: http:// www.hopkinsguides.com/hopkins/index/Johns_Hopkins_ABX_Guide/All_Topics/A.
5. Bennett, JE. (ed.) Mandell, Douglas and Benett´s principles and practice of infectious diseases. Saunders, 2014, 3904 s.
6. Berkovitch, M., Diav-Citrin, O., Greenberg, R., et al. First-trimestr exposure to amoxycillin/clavulanic acid: a prospective, controlled study. Br J Clin Pharmacol, 2004, 58, 3, p. 298–302.
7. Bookstaver, PB., Bland, CM., Griffin, B., et al. A review of antibiotic use in pregnancy. Pharmacotherapy, 2015, 35, 11, p. 1052–1062.
8. Bothamley, G. Drug treatment for tuberculosis during pregnancy: safety considerations. Drug Saf, 2001, 24, 7, p. 553–565.
9. Brodt, HR. Antibiotika – Therapie. Klinik und Praxis der antiinfektiösen Behandlung. Stuttgart: Schattauer, 2013, 1086 s.
10. Brouillard, JE., Terriff, CM., Tofan, A., et al. Antibiotic selection and resistence issues with fluoroquinolones and doxycykline againts bioterrorism agents. Pharmacotherapy, 2006, 26, 1, p. 3–14.
11. Burtin, P., Taddio, A., Ariburnu, O., et al. Safety of metronidazole in pregnancy: a meta-analysis. Am J Obstet Gynecol, 1995, 172, 2 Pt 1, p. 525–529.
12. Cox, LM., Blaser, MJ. Antibiotics in early life and obesity. Nat Rev Endocrinol, 2015, 11, 3, p. 182–190.
13. Cross, R., Ling, C., Day, NP. Revisiting doxycycline in pregnancy and early childhood-time to rebuild its reputation? Expert Opin Drug Saf, 2016, 15, 3, p. 367–382.
14. Czeizel, AE., Rockenbauer, M., Sørensen, HT., et al. The teratogenic risk of trimethoprim-sulfonamides: a population based case-control study. Reprod Toxicol, 2001, 15, 6, p. 637–646.
15. Diav-Citrin, O., Schechtman, S., Gotteiner, T., et al. Pregnancy outcome after gestational exposure to metronidazole: a prospective controlled cohort study. Teratology, 2001, 63, 5, p. 186–192.
16. Džupová, O. Antibiotická léčba v graviditě. Farmakoterapie, 2005, 1, 5, s. 525–527.
17. Ehsanipoor, RM., Chung, JH., Clock, CA., et al. A retrospective review of ampicillin-sulbactam and amoxicillin + clavulanate vs cefazolin/cephalexin and erythromycin in the setting of preterm premature rupture of membranes: maternal and neonatal outcomes. Am J Obstet Gynecol, 2008, 198, p. e54–e56.
18. Eppes, CS., Clark, SL. ESBL infections during pregnancy: a growing threat. Am J Obstet Gynecol, 2015, 213, 5, p. 650–652.
19. Food and Drug Administration. Labeling and prescription drug advertising: content and format for labeling for human prescription drugs. Fed Reg, 1979, 44, p. 37434–37467.
20. Food and Drug Administration. Content and format of labeling for human prescription drug and biologic products; requirements for pregnancy and lactation labeling. Final rule. Fed Reg, 2014, 79, 233, p. 72063–72103.
21. Ford, N., Shubber, Z., Jao, J., et al. Safety of cotrimoxazole in pregnancy: a systematic review and meta-analysis. J Acquir Immune Defic Syndr, 2014, 66, 5, p. 512–521.
22. French, G. Safety and tolerability of linezolid. J Antimicrob Chemother, 2003, 51, Suppl. 2, ii45–53.
23. Goldberg, O., Moretti, M., Levy, A., et al. Exposure to nitrofurantoin during early pregnancy and congenital malformations: a systematic review and meta-analysis. J Obstet Gynaecol Can, 2015, 2, p. 150–156.
24. Greenwood, D. Antimicrobial drugs. Chronicle of a twentieth century medical triumph. New York: Oxford University Press, 2008, 429 s.
25. Hernandez-Diaz, S., Werler, MM., Walker, AM., et al. Folic acid antagonists during pregnancy and the risk of birth defects. N Engl J Med, 2000, 343, 22, p. 1608–1614.
26. Kacerovský, M., Kokrdová, Z., Koucký, M., et al. Spontánní předčasný porod. Doporučený postup. Čes Gynek, 2017, 82, 2, p. 160–165.
27. Kazy, Z., Puho, E., Czeizel, AE. Parenteral polymyxin B treatment during pregnancy. Reprod Toxicol, 2005, 20, 2, p. 181–182.
28. Kladenský, J., Toršová, V., Chmelařová, E. Přínos nifuratelu pro léčbu akutních nekomplikovaných uroinfekcí. Urolog pro Praxi, 2006, 3, s. 108–110.
29. Koumans, EH., Markowitz, LE., Hogan, V., CDC BV Working Group. Indications for therapy and treatment recommendations for bacterial vaginosis in nonpregnant and pregnant women: a synthesis of data. Clin Infect Dis, 2002, 35, Suppl. 2, s. 152–172.
30. Lamont, HF., Blogg, HJ., Lamont, RF. Safety of antimicrobial treatment during pregnancy: a current review of resistance, immunomodulation and teratogenicity. Expert Opin Drug Saf, 2014, 13, 12, p. 1569–1581.
31. Linseman, DA., Hampton, LA., Branstetter, DG. Quinolone-induced arthropathy in the neonatal mouse. Morphological analysis of articular lesions produced by pipemidic acid and ciprofloxacin. Fundam Appl Toxicol, 1995, 28, 1, p. 59–64.
32. Matok, I., Gorodischer, R., Koren, G., et al. Exposure to folic acid antagonists during the first trimestr of pregnancy and the risk of major malformations. Br J Clin Pharmacol, 2009, 68, 6, p. 956–962.
33. Měchurová, A., Vlk, R., Unzeitig, V. Diagnostika a léčba streptokoků skupiny B v těhotenství a za porodu – doporučený postup. Čes Gynek, 2013, 78, s. 11–S14.
34. Muanda, FT., Sheehy, O., Bérard, A. Use of antibiotics during pregnancy and risk of spontaneous abortion. CMAJ, 2017, 189, 17, E625–633.
35. Mueller, NT., Bakacs, E., Combellick, J., et al. The infant microbiome development: mom matters. Trends Mol Med, 2015, 21, 2, p. 109–117.
36. Nahum, GG., Uhl, K., Kennedy, DL. Antibiotic use in pregnancy and lactation: what is and what is not known about teratogenic and toxic risks. Obstet Gynecol, 2006, 107, 5, p. 1120–1138.
37. Robinson, GC., Cambon, KG. Hearing loss in infants of tuberculous mothers treated with streptomycin during pregnancy. N Engl J Med, 1964, 271, p. 949–951.
38. Rovamycine 1.5 M.I.U. Souhrn údajů o přípravku (online). [cit. 2017-07-03]. Dostupný z www: www.sukl.cz
39. Roxithromycin-ratiopharm 150 mg. Souhrn údajů o přípravku (online). [cit. 2017-07-03]. Dostupný z www: www.sukl.cz
40. Schweizer, ML., Furuno, JP., Harris, AD., et al. Comparative effectiveness of nafcillin or cefazolin versus vancomycin in methicillin-susceptible Staphylococcus aureus bacteremia. BMC Infect Dis, 2011, 11, p. 279.
41. Sodhi, M., Axtell, SS., Callahan, J. Is it safe to use carbapenems in patients with a history of allergy to penicillin? J Antimicrob Chemother, 2004, 54, 6, p. 1155–1157.
42. Štefan, M, Holub, M. Ambulantní parenterální antibiotická terapie. Čas Lék Čes, 2016, 155, s. 21–24.
43. Tita, ATN., Andrews, WW. Diagnosis and management of clinical chorioamnionitis. Clin Perinatol, 2010, 37, 2, p. 339–354.
44. Toršová, V., Chmelařová, E. Antibiotika v těhotenství. Interní Med, 2001, 12, s. 550–552.
45. van de Mheen, L., Smits, SM., Terpstra, WE., et al. Haemolytic anemia after nitrofurantoin treatment in a pregnant woman with G6PD deficiency. BMJ Case Rep, 2014, p. 1–4. Published online.
46. Wegienka, G., Zoratti, E., Johnson, CC. The role of the early-life environment in the development of allergic disease. Immunol Allergy Clin North Am, 2015, 35, 1, p. 1–17.
47. Weintraub, AS., Ferrara, L., Deluca, L., et al. Antenatal antibiotic exposure in preterm infants with necrotizing enterocolitis. J Perinatol, 2012, 32, 9, p. 705–709.
48. Yefet, E., Salim, R., Chazan, B., et al. The safety of quinolones in pregnancy. Obstet Gynecol Surv, 2014, 69, 11, p. 681–694.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2018 Issue 1-
All articles in this issue
- Medroxyprogesteron acetate use to block LH surge in oocyte donor stimulation
- Development of prenatal diagnostics of congenital heart defects, profit of standardized scanning planes
- Intravenous leiomyomatosis as a rare tumor of myometrium
- Various approaches of endometrial preparation for frozen-thawed embryo transfer
- Validation of a new tool for identification of barriers to cervical cancer prevention in Slovakia
- Vein of Galen aneurysmal malformation
- Woman´s subarachnoid hemmorage in pregnancy
- Non-Hodgkin´s B-lymphoma of the ovaries with an unfavourable prognosis – incidental finding during caesarean section
- Hysteroscopically assisted laparoscopic salpingostomy in the treatment of tubal pregnancy
- One-Step Nucleic Acid Amplification method – what is the future of sentinel lymph node management?
- Pregnancy in women with solid-organ transplants
- Antibiotic therapy in pregnancy
- Impact of cesarean section in a private health service in Brazil: indications and neonatal morbidity and mortality rates
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Various approaches of endometrial preparation for frozen-thawed embryo transfer
- Antibiotic therapy in pregnancy
- Vein of Galen aneurysmal malformation
- Medroxyprogesteron acetate use to block LH surge in oocyte donor stimulation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

