-
Medical journals
- Career
Adrenokortikální onkocytom jako raritní příčina Cushingova syndromu v graviditě a následná děložní ruptura po porodu
Authors: M. Kotoulová 1; I. Mikysková 1; J. Dušková 2; J. Vláčil 1; M. Dvořák 1; M. Halaška 1
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc. 1; Ústav patologie 1. LF UK a VFN, Praha, přednosta doc. MUDr. P. Dundr, Ph. D. 2
Published in: Ceska Gynekol 2016; 81(3): 228-232
Overview
Cíl studie:
Popis vzácného případu Cushingova syndromu v těhotenství s následnou rupturou děložní během porodu.Typ studie:
Kazuistika.Název pracoviště:
Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce.Vlastní pozorování:
Prezentujeme výjimečný případ Cushingova syndromu u třiatřicetileté rodičky. Sekundipara byla poprvé hospitalizována na naší klinice ve 30. týdnu těhotenství pro elevaci krevního tlaku a otoky. Během hospitalizace jsme korigovali hypokalémii a arteriální hypertenzi (dvojkombinace Dopegyt, Vasocardin). Posléze přichází ve 36. týdnu s předčasným odtokem plodové vody. Za necelých šestnáct hodin dochází ke spontánnímu porodu zdravé holčičky. Během dne se rozvíjejí u rodičky bolesti břicha. Z provedeného CT vyšetření je patrné hemoperitoneum a je vysloveno podezření na tumorózní expanzi pravé nadledviny. Indikováno je operační řešení. Při revizi nalézáme rupturu v pravé hraně děložní a provádíme abdominální hysterektomii. Na základě endokrinologického vyšetření je postpartálně stanovena diagnóza Cushingova syndromu. Tři měsíce po porodu pacientka podstupuje laparoskopickou adrenalektomii. Histologicky byl prokázán tumor nadledviny – adrenokortikální onkocytom.Závěr:
Cushingův syndrom v graviditě je velmi vzácný. Diagnostika je obtížná, protože symptomy s ním spojené jsou často zaměňovány za symptomy těhotenské. Nejčastěji je stanovena diagnóza Cushingova syndromu až postpartálně. Dominantu ve vyšetřovacích metodách tvoří sonografie a magnetická rezonance. Laboratorní diagnostika je svízelná, neboť v těhotenství dochází k fyziologické elevaci kortizolu. I přes raritní výskyt tohoto onemocnění bychom u gravidní pacientky na něj měli myslet v rámci diferenciální diagnostiky při špatně korigovatelné hypertenzi, diabetu, dysbalanci mineralogramu a při typickém cushingoidním habitu.Klíčová slova:
adrenokortikální onkocytom, Cushingův syndrom v těhotenství, arteriální hypertenze, děložní rupturaÚVOD
Cushingův syndrom v graviditě je velice vzácný. Vysoká hladina kortizolu potlačuje za normálních okolností ovulaci a způsobuje oligomenoreu až amenoreu [1, 2, 7, 9, 10, 12]. Poprvé byla popsána koincidence gravidity a syndromu v roce 1953 Huntem a McConaheyem [6]. Od té doby bylo publikováno přes sto čtyřicet případů. Úskalí v diagnostice spočívá především v záměně symptomů, v limitaci zobrazovacích metod a také ve fyziologických změnách endokrinního systému. V průběhu těhotenství dochází k elevaci kortizolu, avšak se zachovanou diurnální variabilitou [12, 13]. Příznaky, jako jsou hypertenze, diabetes, váhový přírůstek, změny nálad, jsou přičítány těhotenství [10, 12]. Nápomocné jsou nám zobrazovací metody, na prvním místě ultrazvukové vyšetření a vzápětí magnetická rezonance. Nejčastěji je stanovena diagnóza Cushingova syndromu až postpartálně.
VLASTNÍ POZOROVÁNÍ
Při pohotovostní službě přichází třiatřicetiletá druhorodička ve třicátém týdnu těhotenství, protože necítí pohyby plodu. Tři týdny udává pocit oteklého krku a v noci pozoruje mírnou dušnost. Při poslední kontrole u registrujícího gynekologa byl naměřen hraniční krevní tlak 147/72. Při příjmu je zjištěna elevace krevního tlaku (TK 154/78, P 82/ min). Biometrie plodu odpovídá třicátému týdnu a váhový odhad plodu je 1470 g. Ve vstupní laboratoři dominuje hypokalémie (jaterní testy, kyselina močová, TSH, fT4 v normě, hemoglobin 118 g/l, kalium 2,8 mmol/l). Během hospitalizace korigujeme hypokalémii, je provedeno oční a opakovaně interní konzilium. Ke kompenzaci krevního tlaku dochází až po osmi dnech při dvojkombinaci Dopegyt 250 mg 2×2 tbl a Vasocardin 50 mg 2×1. Pacientka po kortikoterapii a s nastavenou perorální medikací je propuštěna desátý den do ambulantní péče. Biometrie plodu odpovídá 32.–33. týdnu a váhový odhad činí 2180 g. Nadále je ambulantně sledována v rizikové poradně, kde je během třetí návštěvy navýšen Vasocardin (50 mg 3×1).
Ve třicátém šestém dokončeném týdnu přichází s předčasným odtokem plodové vody. Rodička je bez kontrakcí, s elevovaným krevním tlakem TK 155/98, P 114/ min, subjektivně se cítí dobře. Při příjmu jsou popsány jizevnaté fialové strie na břiše, které jsou těhotnou připisovány většímu hmotnostnímu přírůstku, kdy od počátku gravidity přibrala 18 kilogramů. Děložní činnost nastupuje spontánně, na závěr první doby porodní je podán Buscopan a infuze s oxytocinem. Šestnáct hodin po odtoku plodové vody pacientka spontánně porodila. Holčička váží 3620 g a měří 49 cm, Apgar skóre 10–10–10, pH 7,23. Porod proběhl bez komplikací, bez dopomoci při tlačení, s přiměřenou krevní ztrátou přibližně 250 ml a s minimálním poraněním – rupturou perinea I. stupně. TK po porodu pokles ze 176/66 na TK 142/85, P 100/min. Během dne si nedělka začíná stěžovat na bolesti břicha, bolesti v pravém podžebří a progredující dušnost. Tachykardie pozorovaná již od příjmu přetrvává nadále, v rozmezích 116–129 pulsů za minutu. Krevní tlak se opět zvyšuje z poporodního TK 110/71 na TK 144/94. Na ultrazvukovém vyšetření je popsána volná tekutina v dutině břišní. Vzhledem k nekomplikovanému průběhu porodu se děložní ruptura jako příčina zdála méně pravděpodobná. Proto je provedeno statim CT břicha, kde je potvrzen nález volné tekutiny s prosáknutím dělohy a jako vedlejší nález je popsána tumorózní expanze pravé nadledviny (obr. 1). Pacientka je indikována k operační revizi.
Image 1. Tumor pravé nadledviny, CT scan 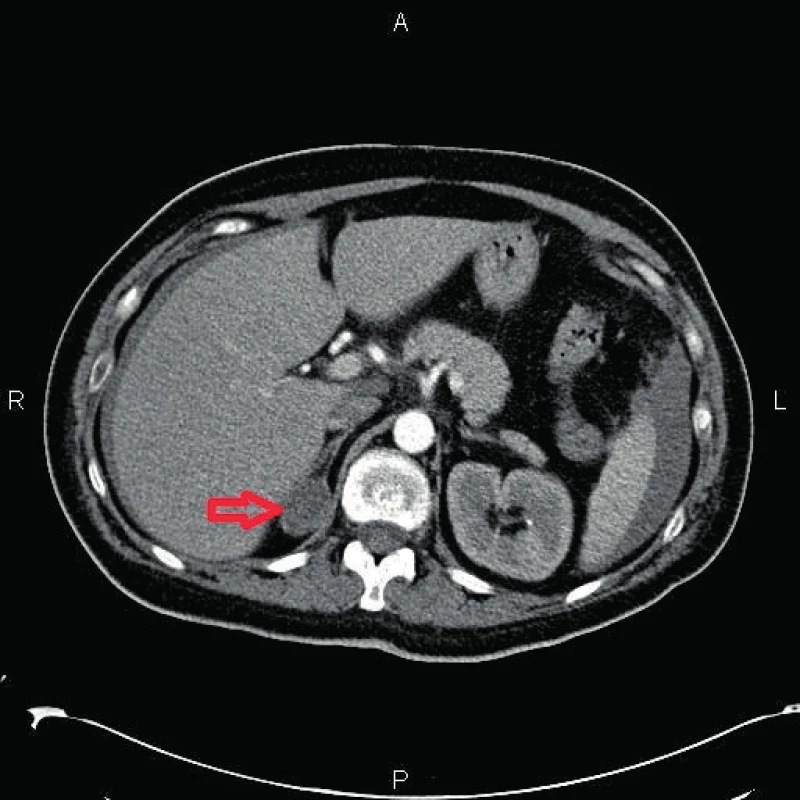
Během operace je vizualizována ruptura pravé hrany děložní s rozsáhlým hematomem devastujícím zadní stěnu děložní, prokrvácení širokého vazu a infundibulopelvického vazu (obr. 2). Je provedena abdominální hysterektomie s celkovou krevní ztrátou dva a půl litru. Pacientka je observována na lůžkové jednotce ARO, posléze na oddělení JIP a šestinedělí. Během následné hospitalizace přetrvává hypertenze (140–155/90–97), kterou korigujeme Vasocardinem. Jsou nabrány katecholaminy k vyloučení feochromocytomu. Šestinedělku propouštíme desátý den po operaci s doporučením do endokrinologické ambulance.
Image 2. Ruptura dělohy, vizualizována během operace 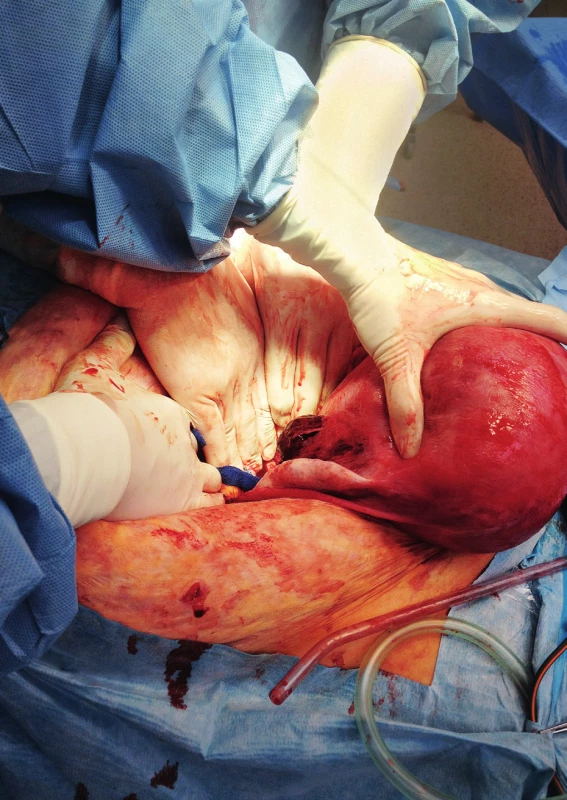
Při pooperační kontrole pacientka zpětně udává výskyt fialových strií na břiše, vnitřní straně paží a dolních končetin proximálně přibližně od pátého měsíce těhotenství. Dále od třicátého týdne pozorovala svalovou slabost. Z postpartálně provedeného sonografického vyšetření je popsán uzel v pravé nadledvině 26×18×25 mm, který přibližně koreluje s CT popsanou tumorózní expanzí 32×29×21 mm. Z endokrinologického vyšetření je stanovena diagnóza periferního Cushingova syndromu při humorálně aktivním tumoru pravé nadledviny. Laboratorní výsledky: ranní kortizol 519 nmol/l (→), krácený dexametazonový test – kortizol 577 nmol/ l (↑),noční kortizol – sliny 26 nmol/l (↑), kortizol volný 257 nmol/l (↑), ACTH 3,1 ng/l (↓), metanefrin0,682 nmol/l (↑) a normetanefrin 0,044 nmol/l (↓).Arteriální hypertenze je s nejvyšší pravděpodobností sekundární, způsobená hyperkortizolismem. Tři měsíce od porodu pacientka podstupuje laparoskopickou pravostranou adrenalektomii. Histologicky je prokázán korový adenom s rozsáhlou onkocytární transformací, až charakteru adrenokortikálního onkocytomu (obr. 3). Nadále zůstává v dispenzární péči endokrinologů.
Image 3. 1. Onkocytom nadledviny s okrajem tlakově atrofické adrenální kůry. Barvení hematoxylin – eozin, obj. 4×. Vložený obrázek – onkocyty – detail, zvětšení 20× 2. Onkocytom nadledviny se silně pozitivním imunohistochemickým průkazem mitochondrií v cytoplazmě nádorových buněk. Slabě pozitivní je i nenádorová kůta nadledviny, obj. 4× 3. Onkocytom nadledviny s negativním imunohistochemickým průkazem chromograninu – neuroendokrinního markeru. Negativní je rovněž kůra nadledviny, obj. 4× 4. Onkocytom nadledviny – imunohistochemický průkaz proliferační aktivity – Ki-67 (MIB1). Jaderná pozitivita nádorových buněk ložiskově variabilní celkově 7% 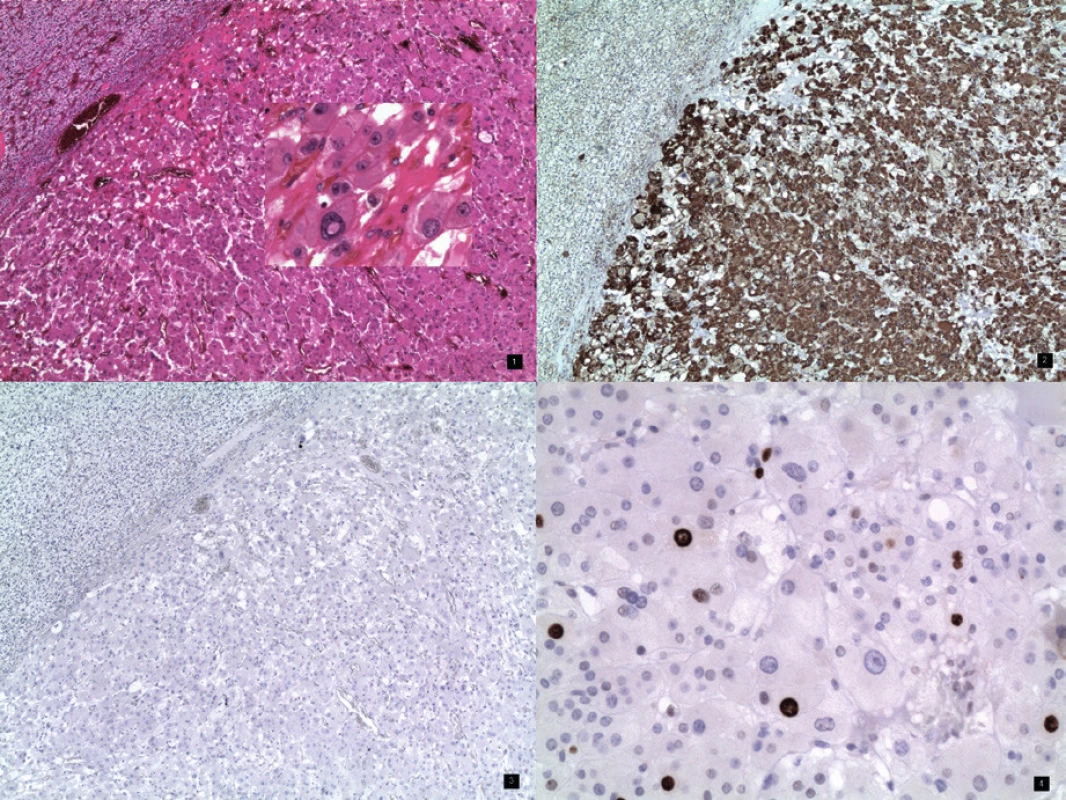
DISKUSE
Onkocytom je převážně benigní a nefunkční tumor vyskytující se nejčastěji v ledvinách, štítné žláze, ve slinných žlázách, příštítných tělíscích a plicích. Termín onkocyt poprvé použil v roce 1950 Hamperl k popisu buněk obsahujících eozinofilní granula u tumoru štítné žlázy [3]. Adrenokortikální onkocytom je velice vzácný, u převážné většiny referovaných případů se jedná o nefunkční a nezhoubné nádory, častěji postihující levostrannou nadledvinu. Tumor postihuje více ženy s věkovým průměrem 46 let. Diagnóza je založena na histopatologickém a imunohistologickém vyšetření. Buňky vykazují velký počet eozinofilních tělísek a mitochondrií, imunohistochemicky prokazujeme v buňkách vimentin, keratin a antimitochondriální protilátky [11]. Charakter tumoru posuzujeme pomocí kritérií podle Bisceglia, kde hodnotíme minor a major markery [11, 15]. Jako maligní se jeví nádor obsahující major markery, a to počet mitóz větších než 5 na 50 polí, dále výskyt atypických mitóz a venózní invazi. Mezi minor markery řadíme velikost tumoru nad 10 cm či 200 gramů, nekrózy a případné subkapsulární či sinusové invaze. Při výskytu jednoho či více minor markerů hodnotíme nádor jako borderline [11]. V našem případě se jednalo o endokrinně aktivní tumor, prezentující se jako Cushingův syndrom. V graviditě se jedná o vůbec první publikovaný případ. Imunohistochemicky byla prokázána proliferační aktivita – Ki-67 (MIB1), která může být použita k predikci malignity. Jaderná pozitivita nádorových buněk byla ložiskově variabilní, celkově 7 %. Funkční adrenokortikální onkocytom bychom měli zahrnout do diferenciální diagnózy Cushingova syndromu.
Incidence Cushingova syndromu (CS) v těhotenství je velice nízká. Významně přispívá ke zvýšení maternální i fetální morbidity a mortality [9, 13]. Gravidita je zde často komplikována vysokou potratovostí, hypertenzí, preeklampsií, gestačním diabetem, dále svalovou slabostí a myopatií. Výjimkou není ani emoční labilita těhotné [2, 7, 8, 10]. Pro zhoršené hojení ran [16] bychom měli preferovat spontánní vedení porodu [9]. Plod je ohrožen intrauterinní růstovou restrikcí, předčasným porodem s následnou prematuritou a mrtvorozeností [2, 7, 8, 13]. Nejčastější příčinou syndromu u těhotných je adenom nadledviny, následovaný adenomem hypofýzy a adenokarcinomem nadledviny [2, 7, 8, 9]. Byly popsány i ojedinělé případy těhotenstvím indukovaného Cushingova syndromu a také kazuistiky s nezjištěnou topikou sekrece adrenokortikotropního hormonu [4, 12].
Diagnostikovat tento syndrom v těhotenství je obtížné. Jeho příznaky jsou často zaměňovány za symptomy těhotenské [7, 8 ]. Nejvíce jsou přínosné zobrazovací metody, na prvním místě sonografie a dále magnetická rezonance [8, 10, 16]. Laboratorní diagnostika je obtížná. Fetoplacentární jednotka totiž ovlivňuje mateřský endokrinní systém [7, 10]. Hladina placentárního i maternálního kortikotropního hormonu vzroste během těhotenství stonásobně. To ovlivňuje fetální i maternální hypofýzoadrenální osu, a tudíž se zvyšuje i hladina kortizolu [2, 12, 13]. Na rozdíl od pacientek s CS u zdravé těhotné dochází k zachování cirkadiánního rytmu sekrece kortizolu [8, 12]. Často dochází ke stanovení přesné diagnózy až postpartálně, jako tomu bylo i v našem případě. Kombinace hypertenze, hypokalémie, cushingoidní habitus se zdá zpětně jako jasné vodítko.V rámci vyšetřovacího protokolu pro obtíže nedělky byla po porodu náhodně na CT diagnostikována tumorózní expanze pravé nadledviny. To vedlo k následnému cílenému vyšetřování a stanovení diagnózy.
Ruptura děložní je vážnou porodnickou komplikací, která významně zvyšuje morbiditu i mortalitu matky a plodu [5, 14]. Ve vyspělých zemích je největším rizikovým faktorem císařský řez v anamnéze. Riziko ruptury u žen majících jizvu na děloze se pohybuje okolo 1 %. Incidence ruptury intaktní dělohy je oproti tomu velice nízká (1 na 15 000) [5, 14].
V průběhu nekomplikovaného porodu bez dopomoci při tlačení se u sekundipary neobjevily žádné známky svědčící pro děložní rupturu. Z histopatologického vyšetření exstirpované dělohy byla popsána ruptura stěny v dolním segmentu vpravo s okolním prokrvácením a zbytnělá svalovina s výrazným prokrvácením. Je otázkou, zda tato komplikace nemohla souviset s případnou hormonálně indukovanou myopatií nebo méněcenností vazivového aparátu. Vezmeme-li v úvahu, že u Cushingova syndromu je prokázáno zhoršené hojení tkání, myopatie, svalová slabost, dále patrné jizevnaté změny na kůži, zdá se tato teorie pravděpodobnou [1, 12]. Bylo by zajímavé posoudit vztah těchto změn navozených hyperkortizolismem na ligamentech a myofibrilách na molekulární úrovni.
Pacientkám s diagnózou Cushingova syndromu můžeme nabídnou medikamentózní a chirurgickou léčbu, která je metodou volby [12, 16]. Doporučuje se provést adrenalektomii ve druhém trimestru [2, 7, 8, 9, 13 ]. Při kontraindikaci výkonu či v pozdější fázi těhotenství se nejvíce uplatňuje podání metyraponu, reverzibilního inhibitoru 11ß - hydroxylázy a dále podání antimykotika ketokonazolu, u kterého je riziko teratogenního vlivu na plod [2, 4, 12, 13, 16]. Jakákoliv terapie zvyšuje šanci porodit zdravého novorozence [10, 16].
ZÁVĚR
Cushingův syndrom v graviditě je velmi vzácný. Diagnostika je obtížná, protože symptomy s ním spojené jsou často zaměňovány za symptomy těhotenské. Nejčastěji je stanovena diagnóza Cushingova syndromu až postpartálně. Dominantu ve vyšetřovacích metodách tvoří sonografie a magnetická rezonance. Oproti tomu laboratorní diagnostika je nelehká. I přes vzácný výskyt tohoto onemocnění bychom u gravidní pacientky na něj měli myslet v rámci diferenciální diagnózy špatně korigovatelné hypertenze, diabetu, minerální dysbalance a při typickém cushingoidním habitu.
MUDr. Marcela Kotoulová
GPK Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: marcela.kotoulova@gmail.com
Sources
1. Češka, R., et al. Interna. První vyd. Praha: Triton, 2010, s. 327–329, 351–352.
2. Garla, V., Kheeten, R., Saleem, T. Cushing´s syndrome in pregnancy: A diagnostic conundrum. [online] West Virginia Med J, 2013, 109, p. 34–36.
3. Hamperl, H. Onkocytes and the so called Hurthle cell tumor. Arch Pathol, 1950, 49, p. 563–570.
4. Hána, V., Dokoupilová, M., Marek, J., et al. Reccurent ACTH-independent Cushing´s syndrome in multiple pregnancies and its treatment with metyrapone. [online] Clinl Endocrinol, 2001, 54, p. 277–281.
5. Hofmeyer, GS., Say, L., Gülmezoglu, AM. WHO systematic review of maternal mortality and morbidity: the prevalence of uterine rupture. [Online] BJOG, 2005, 112, p. 1221–1228.
6. Hunt, AB., McConahay, WM. Pregnancy associated with diseases of the adrenal glands. Am J Obstet Gynecol, 1953, 66(5), p. 970–987.
7. Chang, I., Cha, HH., Kim, JH., et al. Cushing syndrome in pregnancy secondary to adrenal adenoma. [online] Obstet Gynecol Sci, 2013, 56(6), p. 400–403.
8. Jaraith, A., Aulakh, BS. Adrenocortical carcinoma in pregnancy: A diagnostic dilemma. [online] Indian J Urol, 2014, 30(3), p. 342–344.
9. Kim, HG., Lee, HK., Je, GH. et al. A case of Cushing´s syndrome in pregnancy secondary to an adrenal cortical adenoma. [online] J Korean Med Sci, 2003, 18, p. 444–446.
10. Kita, M., Sakalidou, M., Saratzis, A., et al. Cushing´s syndrome in pregnancy: Report of a case and review of the literature. [online] Hormones, 2007, 6(3), p. 242–246.
11. Lee, SS., Baek, KH., Lee, YS., et al. Subclinical Cushing’s syndrome associated with an adrenocortical oncocytoma. [online] J Endocrinol Investigation, 2008, 31(7), p. 675–679.
12. Lekarev, O., New, MI. Adrenal disease in pregnancy. [online] Best Pract Res Clin Endocrinol Metab, 2011, 25, p. 959–973.
13. Lim, WH., et al. The medical mangement of Cushing´s syndrome in pregnancy. [online] Eur J Obstet Gynecol Reprod Biol, 2013, 168, p. 1–6.
14. Mavromatidis, G., Karavas, G., Margioula-Siarkou, C., et al. Spontaneous postpartum rupture of an intact uterus: a case report. [online] J Clin Med Res, 2015, 7(1), p. 56–58.
15. Pereira, BD., Rios, ES., Cabrera, RA., et al. Adrenocortical oncocytoma presenting as Cushing’s syndrome: An additional report of a paediatric case. [online] Endocr Pathol, 2014, 25(4), p. 397–403.
16. Sammour, RN., et al. Adrenalectomy for adrenocortical adenoma causing Cushing´s syndrome in pregnancy: a case report and review of literatue. [online] Eur J Obstet Gynecol Reprod Biol, 2012, 165, p. 1–7.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2016 Issue 3-
All articles in this issue
- Přínos biopsie sentinelových uzlin pro léčbu lokálně pokročilých stadií karcinomu děložního hrdla
-
Dlaždicobuněčné prekancerózy vulvy
Historie a současný stav problematiky - Management péče o HIV pozitivní těhotné v období let 1996–2014
- Operace endometriomů ovaria a ovariální rezerva
- Paraneoplastické neurologické syndromy u gynekologických malignit
- Antepartální možnosti prevence epiziotomie a ruptury hráze při porodu
- Akutní pankreatitida v graviditě komplikovaná rupturou aneuryzmatu arteria lienalis
- Spontánní porod po dvou císařských řezech a jeho možné komplikace – kazuistika
- Rupture of focal nodular hyperplasia in the 37th week of pregnanacy – case report
- Traumatická ruptura spony při vaginálním porodu – kazuistika
- Adrenokortikální onkocytom jako raritní příčina Cushingova syndromu v graviditě a následná děložní ruptura po porodu
- Současná témata reprodukční medicíny v České republice
- Vplyv systémovej enzýmovej terapie na hojenie jazvy po cisárskom reze
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Traumatická ruptura spony při vaginálním porodu – kazuistika
- Antepartální možnosti prevence epiziotomie a ruptury hráze při porodu
- Spontánní porod po dvou císařských řezech a jeho možné komplikace – kazuistika
- Operace endometriomů ovaria a ovariální rezerva
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

