-
Medical journals
- Career
Incidence erytrocytární aloimunizace u těhotných žen v olomouckém regionu
Authors: I. Holusková 1; M. Lubušký 2,3; M. Studničková 2; M. Procházka 2
Authors‘ workplace: Transfuzní oddělení FN a LF UP, Olomouc, primářka MUDr. D. Galuszková, MBA, Ph. D. 1; Porodnicko-gynekologická klinika FN a LF UP. Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2; Ústav lékařské genetiky a fetální medicíny FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, CSc. 3
Published in: Ceska Gynekol 2013; 78(1): 56-61
Overview
Cíl studie:
Určení incidence specifických klinicky významných antierytrocytárních aloprotilátek u těhotných žen v I. trimestru těhotenství v olomouckém regionu.Typ studie:
Retrospektivně-prospektivní klinická studie.Název a sídlo pracoviště:
Fakultní nemocnice Olomouc, Lékařská fakulta Univerzity Palackého Olomouc: Transfuzní oddělení, Porodnicko-gyne-kologická klinika, Ústav lékařské genetiky a fetální medicíny.Předmět a metodika studie:
V letech 2000 až 2011 bylo vyšetřeno celkem 45 435 těhotných žen na Transfuzním oddělení Fakultní nemocnice Olomouc. V prvním trimestru těhotenství byl u všech žen proveden screening nepravidelných tepelných antierytrocytárních protilátek a dále pak i identifikace protilátkových nálezů.Výsledky:
Klinicky významné antierytrocytární aloprotilátky byly detekovány u 1,5 % těhotných žen (683/45 435).Nejčastější příčinou erytrocytární aloimunizace v těhotenství byl antigen E 5,7 ‰ (258/45 435), následován antigeny D 4,0 ‰ (181/45 435), M 1,5 ‰ (70/45435), C 1,2 ‰ (54/45 435), K 1,2 ‰ (55/45435), c 0,6 ‰ (26/45 435), S 0,4 ‰ (20/45435), Jka 0,2 ‰ (9/45 435), PP1pk (Tja) 0,1 ‰ (3/45 435) a Fya 0,0 ‰ (2/45 435).Závěr:
I přes provádění profylaxe anti-D imunoglobulinem u RhD negativních žen představuje RhD antigen druhou nejčastější, avšak klinicky nejvýznamnější příčinu mateřské aloimunizace. Klinický problém rovněž představují non-D antigeny z Rh systému, antigeny z Kell systému, méně často antigeny ze systémů MNS a Kidd.Klíčová slova:
antierytrocytární aloprotilátky – RhD – incidenceÚVOD
Podle doporučeného postupu České gynekologické a porodnické společnosti (ČGPS) České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP) by v České republice (ČR) měl být proveden všem těhotným ženám v prvním trimestru těhotenství screening nepravidelných tepelných antierytrocytárních protilátek [20].
Cílem screeningu nepravidelných tepelných antierytrocytárních protilátek je vyselektovat rizikovou skupinu těhotných žen, u kterých existuje riziko rozvoje hemolytické nemoci plodu a novorozence (HDFN, Haemolytic Disease of the Fetus and Newborn).
V ČR však neexistuje národní registr screeningových programů v těhotenství, a tudíž nejsou k dispozici ani validní informace o incidenci antierytrocytárních protilátek u těhotných žen.
Cílem práce bylo zjistit incidenci specifických klinicky významných antierytrocytárních aloprotilátek u těhotných žen v prvním trimestru těhotenství v olomouckém regionu.
Jako specifické označujeme aloprotilátky, které jsou namířeny proti konkrétnímu antigenu nebo antigenům. Za klinicky významné antierytrocytární aloprotilátky považujeme u těhotných žen takové aloprotilátky, které v případě přítomnosti komplementárního antigenu na povrchu erytrocytů u plodu mohou způsobit rozvoj závažné formy HDFN.
MATERIÁL A METODIKA
Soubor pacientek
V letech 2000 až 2011 bylo na Transfuzním oddělení FN Olomouc vyšetřeno celkem 45 435 žen v prvním trimestru těhotenství. U všech těhotných žen byl v prvním trimestru těhotenství(do konce 14. týdne) proveden screening nepravidelných tepelných antierytrocytárních protilátek metodou sloupcové aglutinace. V případě pozitivního screeningu nepravidelných tepelných antierytocytárních protilátek byla provedena identifikace antierytrocytární aloprotilátky, a pokud šlo o specifickou klinicky významnou aloprotilátku, byla následně provedena i kvantifikace aloprotilátky.
Do roku 2005 byly výsledky hodnoceny retrospektivně a následně již probíhala studie prospektivně. Vyhodnocení bylo prováděno na základě laboratorních výsledků uvedených v laboratorním informačním systému transfuzního oddělení ISTO 2000, od 6. 6. 2010 pak ISTO 3300 a ve formuláři „Záznam o vyšetření gravidní ženy s pozitivními antierytrocytárními protilátkami“.
Odběr vzorku
Vyšetření těhotných pacientek se provádělo ze vzorku žilní krve odebrané venepunkcí do zkumavky s antikoagulační látkou (K3EDTA, tri-draselná sůl kyseliny ethylen-diamin-tetraoctové). Celkem bylo odebráno 6 ml krve, vzorky se následně centrifugovaly 10 minut/4000 otáček, poté byla provedena kontrola množství vzorku a makroskopicky i kontrola hemolýzy. Do provedení vyšetření byly vzorky skladovány v chladnici při teplotě +2 °C až +8 °C. Vyšetření bylo provedeno do 72 hodin od příjmu krevního vzorku na transfuzní oddělení. Nebyly zpracovávány krevní vzorky starší 7 dnů od odběru.
Laboratorní zpracování
Nejdříve byl proveden screening nepravidelných tepelných antierytrocytárních protilátek v séru/plazmě metodou sloupcové aglutinace (DiaMed GmbH, Switzerland). V letech 2000 až 2009 sescreening nepravidelných tepelných antierytrocytárních protilátek prováděl manuálně a od dubna 2009 v souvislosti s automatizací provozu Laboratoře prenatální imunohematologie se prováděl na imunohematologickém analyzátoru TECHNO TwinStation (DiaMed AG, Switzerland). Samotná detekce nepravidelných tepelných antierytrocytárních protilátek se prováděla v nepřímém antiglobulinovém testu a enzymovém (papain) testu za použití diagnostických screeningových erytrocytů ID-DiaCell I-II-III a ID-DiaCell I-II-III-P (DiaMed GmbH, Switzerland) a gelových karet ID-Neutral/Coombs (DiaMed GmbH, Switzerland) s následnou inkubací při 37 °C a centrifugací. V případě pozitivního screeningu nepravidelných tepelných antierytrocytárních protilátek byla vždy následně provedena identifikace protilátkového nálezu na systému sloupcové aglutinace (DiaMed GmbH, Switzerland), s použitím karet ID-Neutral a ID-LISS/Coombs (DiaMed GmbH, Switzerland) a dia-gnostických panelových erytrocytů ID-Dia Panel a ID-Dia Panel P (DiaMed GmbH, Switzerland) s následnou inkubací při 37 °C a centrifugací. Nebylo-li možné uzavřít výsledek na základě vyšetření metodou sloupcové aglutinace (DiaMed GmbH, Switzerland), zejména pokud šlo o směs specifických antierytrocytárních aloprotilátek, byl jako referenční systém použit systém sloupcové aglutinace (Grifols International, S.A., Spain) s použitím karet DG Gel Neutral (Grifols International, S.A., Spain), DG Gel Coombs (Grifols International, S.A., Spain) a diagnostických panelových erytrocytů Identisera Diana/Identisera Diana P (Grifols International, S.A., Spain).
Při identifikaci specifické klinicky významné aloprotilátky v séru těhotné ženy byl následně vyšetřen i komplementární antigenní fenotyp na povrchu erytrocytů.
Ke kvantifikaci aloprotilátek byla použita metoda titrace systémem sloupcové aglutinace (DiaMed GmbH, Switzerland). Ředění plazmy bylo prováděno fyziologickým roztokem.
K titraci aloprotilátek anti-D se použily diagnostické erytrocyty s fenotypem R2R2 (cDE).
Pro titraci aloprotilátek anti-c a anti-E byly použity diagnostické erytrocyty s fenotypem R1R2 (DCcEe) nebo R2R2 (cDE). V případě aloprotilátek anti-C a anti-e se použily diagnostické erytrocyty s fenotypem R1R2 (DCcEe) nebo R1R1 (CDe).
Pro ostatní aloprotilátky se vždy použily erytrocyty, na jejichž povrchu byla přítomna kombinace všech variant pro protilátku komplementárního antigenu.
VÝSLEDKY
Celkem bylo vyšetřeno 45 435 těhotných žen v prvním trimestru těhotenství, u 4,81 % žen bylscreening nepravidelných tepelných antierytrocytárních protilátek pozitivní a bylo následně nutné provést identifikaci protilátky. U 2,25 % žen byla protilátka identifikována a u 1,5 % žen šlo z hlediska možného rozvoje HDFN o specifickou klinicky významnou aloprotilátku, kterou bylo tudíž nutné i kvantifikovat. Uvedený výpočet incidence jednotlivých typů protilátek nezohledňuje možnost současného výskytu více typů specifických aloprotilátek u jedné těhotné ženy.
Incidenci nepravidelných antierytrocytárních protilátek u žen v I. trimestru těhotenství v olomouckém regionu v letech 2000 až 2011 zobrazuje tabulka 1.
Table 1. Incidence nepravidelných antierytrocytárních protilátek u žen v I. trimestru těhotenství v olomouckém regionu v letech 2000 až 2011. Celkem bylo vyšetřeno 45 435 těhotných žen v I. trimestru těhotenství, u 4,81 % žen byl screening nepravidelných tepelných antierytrocytárních protilátek pozitivní a bylo následně nutné provést identifikaci protilátky. U 2,25 % žen byla protilátka identifikována a u 1,5 % žen se jednalo z hlediska možného rozvoje HDFN o klinicky významnou aloprotilátku, kterou bylo tudíž nutné i kvantifikovat. Uvedený výpočet incidence jednotlivých typů protilátek nezohledňuje možnost současného výskytu více typů specifických aloprotilátek u jedné těhotné ženy. 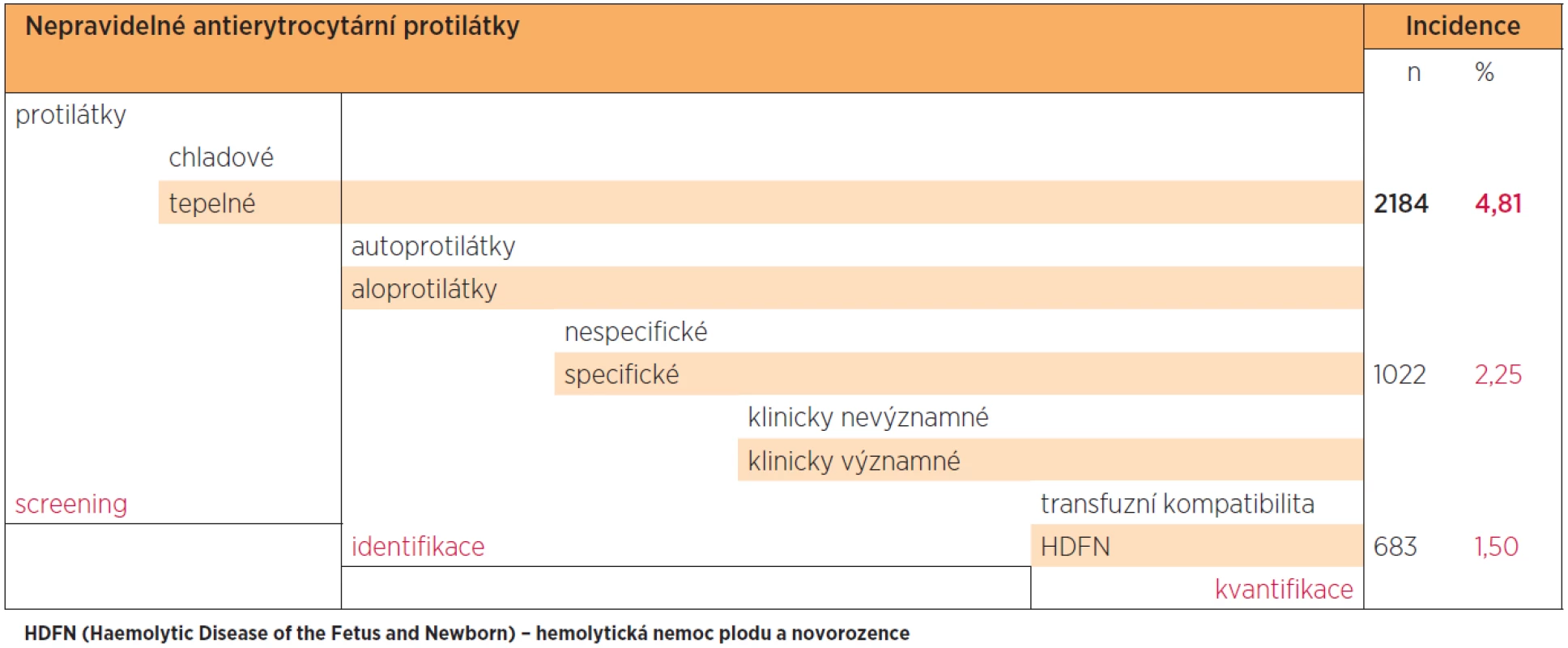
Incidenci specifických klinicky významných anti-erytrocytárních aloprotilátek zachycuje tabulka 2.
Table 2. Incidence specifických klinicky významných antierytrocytárních aloprotilátek u žen v I. trimestru těhotenství v olomouckém regionu v letech 2000 až 2011. Celkem bylo vyšetřeno 45 435 žen. 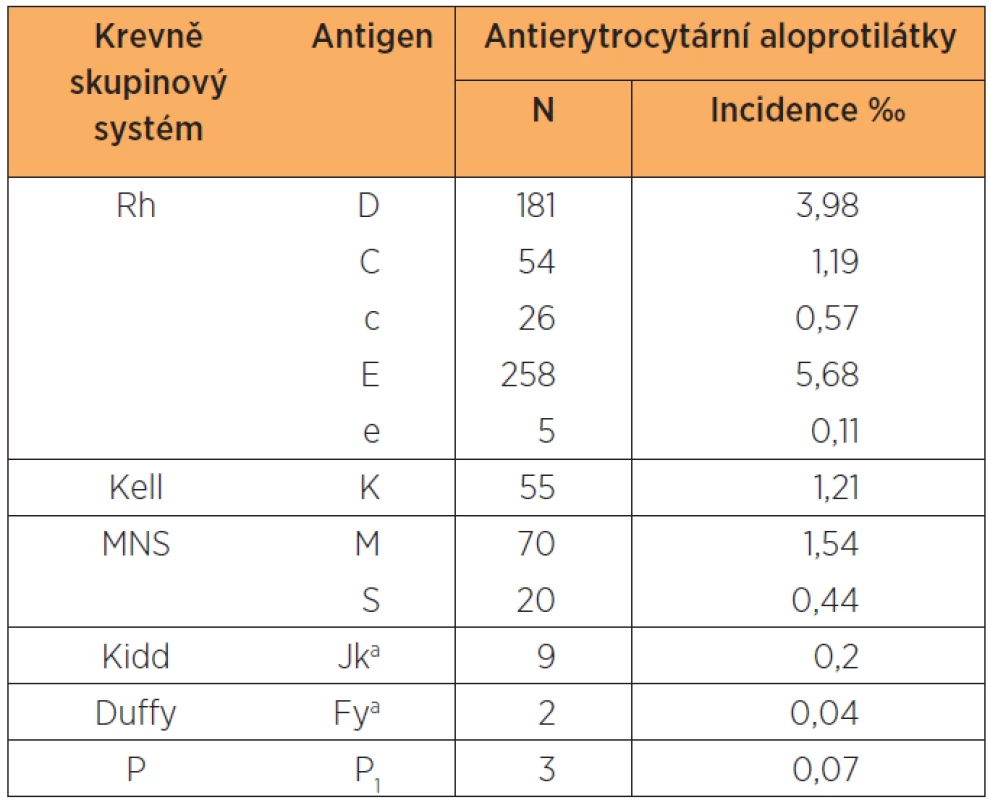
Incidenci RhD aloimunizace v jednotlivých letech znázorňuje graf 1.
Graph 1. Incidence RhD aloimunizace těhotných žen v I. trimestru těhotenství v olomouckém regionu v letech 2000–2011 
Incidenci Kell (K, K1) aloimunizace v jednotlivých letech zobrazuje graf 2.
Graph 2. Incidence Kell aloimunizace těhotných žen v I. trimestru těhotenství v olomouckém regionu v letech 2000–2011 
DISKUSE
V rámci ČR se jedná o ojedinělý soubor pacientek, neboť v současné době neexistuje žádná jiná publikovaná práce, se kterou by bylo možné získaná data o incidenci antierytrocytárních protilátek u těhotných žen porovnat.
Přesná data o incidenci specifických klinicky významných antierytrocytárních aloprotilátek u těhotných žen nejsou v ČR k dispozici. Rovněž výskyt závažných forem hemolytické nemoci plodu a novorozence lze jen odhadovat a případy končící vzhledem k dramatickému průběhu úmrtím plodu již před 24. týdnem těhotenství unikají evidenci zcela.
Závažné formy HDFN způsobují nejčastěji antigeny RhD (85 %), Kell (K1) (10 %) a Rhc (3,5 %) [15, 17].
V našem souboru byly specifické klinicky významné antierytrocytární aloprotilátky diagnostikovány v prvním trimestru těhotenství u 1,5 % žen. Nejčastější příčinou klinicky významné erytrocytární aloimunizace byl antigen E 5,7 ‰ (258/45 435), následován antigeny D 4,0 ‰ (181/45 435),M 1,5 ‰ (70/45 435), C 1,2 ‰ (54/45 435), K 1,2 ‰ (55/45 435), c 0,6 ‰ (26/45 435), S 0,4 ‰ (20/45 435), Jka 0,2 ‰ (9/45435), PP1pk (Tja) 0,1 ‰ (3/45 435) a Fya 0,0 ‰ (2/45 435).
Antigen D je velmi imunogenní antigen. Přibližně 15 % jedinců bílé populace je RhD negativních a asi 2/3 RhD negativních žen budou mít v prvním těhotenství RhD pozitivní plod. Přibližně v 10 % všech těhotenství tudíž nastává situace, že RhD negativní matka bude mít RhD pozitivní plod [1, 6]. Incidence aloprotilátky anti-D byla v našem souboru 4,0 ‰ (181/45 435). Předpokládáme-li v České republice podobné výsledky, pak jde při 100 000 porodech asi o 400 RhD aloimunizovaných těhotných žen ročně. Pokud dvě třetiny z nich budou mít RhD pozitivní plod, můžeme předpokládat asi 267 ohrožených plodů ročně. Všem případům RhD aloimunizace však lze teoreticky zabránit profylaktickým podáním anti-D gamaglobulinu v potřebné dávce při každé potenciálně senzibilizující události [8, 12].
K antigen (K1) patří spolu s antigeny v systémech AB0 a Rh k nejvíce imunogenním antigenům [2]. Incidence aloimunizace antigenem K (K1) byla v našem souboru 1,2 ‰ (55/45 435). Předpokládáme-li v České republice podobné výsledky, tak jde při 100 000 porodech asi o 120 Kell (K, K1) aloimunizovaných těhotných žen ročně. Při 5% pravděpodobnosti, že budou mít K pozitivní plod, můžeme předpokládat asi 6 ohrožených plodů ročně. V České republice není ženám před ukončením reprodukčního období při transfuzi vždy podávána K (K1) kompatibilní nebo K (K1) negativní krev.
V jednom případě (1/45 435) byla u těhotné ženy s K0 fenotypem (null fenotyp) diagnostikována aloprotilátka anti-Ku (incidence 0,02 ‰). K0 fenotyp je vzácný fenotyp, kdy na povrchu erytrocytů chybí antigeny Kell systému. Jedinci s K0 fenotypem produkují anti - Ku protilátku, která reaguje se všemi Kell antigeny, kromě K0 fenotypu. K0 fenotyp se vyskytuje velmi vzácně. Race et al. uvádí nález jednoho K0 fenotypu na 24 953 testovaných bělochů [18]. Aloprotilátka anti-Ku je považována z hlediska HDFN za klinicky významnou aloprotilátku a zajištění hemoterapie pro takovéto pacientky je velmi obtížné. Ve dvou případech byla u těhotných žen detekována aloprotilátka anti-Kpa (incidence 0,04 ‰). Anti-Kpa však způsobuje HDFN pouze vzácně a byl popsán pouze jeden případ hydropsu plodu [19].
RhD aloimunizace je v současnosti jediná erytrocytární aloimunizace, které lze zabránit včasným podáním anti-D imunoprofylaxe. Se zavedením imunoprofylaxe anti-D imunoglobulinem a standardizace postupu při antepartální profylaxi došlo k poklesu výskytu anti-D aloprotilátek u RhD negativních žen [8, 9, 10]. V ostatních antigenních systémech však možnost preventivní imunizace není a aloimunizace těhotných žen těmito klinicky významnými antigeny bude tudíž představovat riziko rozvoje hemolytické nemoci u plodu a novorozence i v budoucnosti.
Geifman-Holtzman a kol. [4] vyšetřil ve svém souboru 37 506 krevních vzorků žen, z nichž 40 % bylo ve fertilním věku a diagnostikoval antierytrocytární aloprotilátky, které mohou být asociovány s HDFN u 1,1 % žen. Nejčastěji šlo o aloprotilátku anti-D 2,7 ‰ (101/37 506), dále pak anti-E 2,0 ‰ (77/37 506), anti-c 0,8 ‰ (32/37 506), anti-C 0,7 ‰ (26/37 506), anti-K 3,0 ‰ (115/37 506), anti-M 0,5 ‰ (19/37 506), anti-S 0,1 ‰ (4/37 506), anti-Fya 0,8 ‰ (31/37 506) a anti-Jka 0,2 ‰ (8/37 506).
Výskyt aloprotilátky anti-D byl ve sledovaném souboru v porovnání s našimi výsledky nižší, což lze vysvětlit kvalitněji prováděnou prevencí RhD aloimunizace, než je tomu v olomouckém regionu a pravděpodobně i v celé ČR. Naopak v našem souboru byl nižší výskyt Kell aloimunizace, což pravděpodobně souvisí se snahou podávat v ČR ženám ve fertilním věku při transfuzi Kell kompatibilní krev.
Více než polovinu tepelných antierytrocytárních protilátek diagnostikovaných u těhotných žen v olomouckém regionu v letech 2000 až 2011 tvořily nespecifické protilátky, které sice nemají klinický význam z hlediska hemolytické nemoci plodu a novorozence, nicméně mohou komplikovat imunohematologické vyšetření těhotné ženy a způsobit komplikace při zajištění eventuální hemoterapie. Vysoká incidence nespecifických protilátek zcela jistě souvisí s prováděním screeningu i enzymovým testem (papain), který má větší senzitivitu při detekci protilátek zejména z Rh systému.
ZÁVĚR
I přes provádění prevence RhD aloimunizace u RhD negativních žen představuje RhD antigen stále druhou nejčastější, avšak klinicky nejvýznamnější příčinu mateřské aloimunizace v ČR. Klinickým problémem rovněž zůstává aloimunizace non D antigeny ze systému Rh, antigeny ze systému Kell, méně často pak antigeny ze systémů MNS a Kidd.
Je-li u těhotné ženy na začátku těhotenství diagnostikována klinicky významná aloprotilátka, je nutné zajistit adekvátní konzultaci pacientky se stanovením dalšího postupu na pracovišti s odborností gynekologie a porodnictví. Pokud nelze vyloučit riziko rozvoje HDFN, měla by být pacientka s ohledem na riziko rozvoje anémie plodu sledována na specializovaném pracovišti, které se zabývá touto problematikou. Nezbytná je mezi-oborová spolupráce gynekologa, imunohematologa a neonatologa. Standardní prenatální péče však může dále probíhat u ošetřujícího gynekologa.
Podpořeno grantem IGA MZ ČRNT-11004-3/2010, NT-12225-4/2011.
MUDr. Iva Holusková
Transfuzní oddělení
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
Sources
1. Berghella, V. Maternal-Fetal Evidence-Based Guidlines (Series in maternal fetal medicine). Informa Healtcare Publishing, 1st ed, 2007.
2. Dean, L. Blood groups and red cell antigens. National Center for Biotechnology Information (US), 2005.
3. Dušková, D., Kubánková, H., Masopust, J., et al. Imunohematologická vyšetření v těhotenství a po porodu. Doporučení společnosti pro transfuzní lékařství ČLS JEP, č. STL2010_06 ze dne 1. 3. 2010 verze 3 (2010_06), Souhrn doporučení.
4. Geifman-Holtzman, O., Wojtowycz, M., Kosmas, E., Artal, R. Female alloimmunization with antibodies known to cause hemolytic disease. Obstet Gynecol, 1997, 89, p. 272–275.
5. Gunduz, E., Meltem-Akay, O., Uskudar-Teke, H., Gulbas, Z. Incidence of red-cell alloimmunization due to non-anti-D antibodies during pregnancy. An experience from Turkey. Transfusion Apheresis Sci, 2012, 43, p. 261–263.
6. Hadley, A., Soothill, P. Aloimune disorders of pregnancy; anemia, thrombocytopenia and neutropenia in the fetus newborn. Cambridge: Cambridge University Press, 2008.
7. Ľubušký, M., Procházka, M., Šantavý, J., et al. Aktuální management těhotenství s rizikem rozvoje anémie plodu. Čes Gynek, 2006, 71, s. 272–280.
8. Ľubušký, M., Procházka, M., Krejčová, L., et al. Prevence RhD aloimunizace u těhotných žen v těhotenství a po porodu RhD pozitivního dítěte. Čes Gynek, 2006, 71, s. 173–179.
9. Ľubušký, M. Prevence Rh(D) aloimunizace u Rh(D) negativních žen. Prakt Gyn, 2008, 12, s. 100–103.
10. Ľubušký, M. Prevence RhD aloimunizace. Evidence Based Medicine a přehled doporučených postupů. Postgrad Med, 2010, 12, s. 194–198.
11. Ľubušký, M., Holusková, I., Procházka, M., et al. The incidence od erythrocyte alloimunization in pregnant women. J Matern Fetal Neonatal Med, 2010, 23 (Suppl 1.), p. 593.
12. Ľubušký, M., Procházka, M., Šimetka, O., Holusková, I. Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen. Čes Gynek, 2010, 75, s. 323–324.
13. Ľubušký, M., Procházka, M. Erytrocytární aloimunizace těhotných žen: Hemolytická nemoc plodu a novorozence. Postgrad Med, 2012, 14, 3, s. 242–246.
14. Ľubušký, M., Procházka, M., Šimetka, O., Holusková, I. Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen. Postgrad Med, 2012, 14, 3, s. 246–247.
15. Moise, JK. Fetal anemia due to non-Rhesus-D red cell alloimunization. Semin Fetal Neonatal Med, 2008, 13, p. 207–214.
16. Natukunda, B., Mugyenyi, G., Brand, A., Schonewille, H. Maternal red blood cell alloimmunization in South Western Uganda. British Blood Transfusion Society. Transfus Med, 2011.
17. Pětroš, M., Ľubušký, M., Šimetka, O., Procházka, M. Alomunizace těhotných žen non-RhD erytrocytárními antigeny; přehledový článek. Čes Gynek, 2010, 75, s. 325–333.
18. Race, RR., Sanger, R. Blood Groups in Man, 6th edn. Oxford: Blackwell Scientific Publications, 1975.
19. Smoleniek, J., Anderson, N., Poole, GD. Hydrops fetalis cuased by anti-Kpa, an antibody not ussually detected in routine screening (Abstract). Tasnfus Med, 1994, (Suppl. 1), p. 48.
20. Unzeitig, V., Měchurová, A., Ľubušký, M. Zásady dispenzární péče ve fyziologickém těhotenství. Čes Gynek, 2012, 77, 3, s. 265–266.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 1-
All articles in this issue
- Historie Porodnicko-gynekologické kliniky v Olomouci
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe
- Porody dětí nízké a velmi nízké porodní hmotnosti ve Fakultní nemocnici v Olomouci (1993–2011)
- Incidence erytrocytární aloimunizace u těhotných žen v olomouckém regionu
- Epidemiologie a management poruch štítné žlázy v těhotenství
- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Výskyt vybraných geneticky podmíněných trombofilních markerů u pacientek podstupujících léčbu neplodnosti
- Možnosti objektivizace tkáňového traumatu u operací pro karcinom endometria
- Problematika krvácivých chorob v porodnictví
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Poruchy funkce štítné žlázy v těhotenství
- Stav kostní minerální denzity po mnohaleté aplikaci antikoncepce Depo-Provery
- Implementace robotické chirurgie v gynekologii a onkogynekologii; analýza prvního tisíce případů
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Problematika krvácivých chorob v porodnictví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

