-
Medical journals
- Career
Stanovení reziduálního cytogenetického rizika v prenatální diagnostice při nahrazení tradičního karyotypování cílenými molekulárními testy určenými k rychlé detekci aneuploidií – retrospektivní studie
Authors: P. Čapková; V. Curtisová; I. Dhaifalah; J. Hyjánek; J. Křepská; R. Streitová; J. Šantavý
Authors‘ workplace: Ústav lékařské genetiky a fetální medicíny FN Olomouc a LF UP Olomouc, přednosta prof. MUDr. J. Šantavý, CSc.
Published in: Ceska Gynekol 2011; 76(1): 51-55
Overview
Cíl studie:
Cílem této studie bylo určení incidence chromozomálních aberací (jiné než trizomie 21, 13, 18, aneuploidie gonozomů a triploidie), které by při použití rychlých a cílených testů (FISH nebo QFPCR) unikly detekci – tzv. reziduální cytogenetické riziko.Typ studie:
Retrospektivní studie.Název a sídlo pracoviště:
Ústav lékařské genetiky a fetální medicíny FN Olomouc.Metodika:
Audit výsledků 5305 prenatálních chromozomálních analýz s ohledem na možnost detekce chromozomálních aberací použitím výlučně testu QFPCR nebo FISH.Výsledky:
Reziduální riziko ve skupině žen podstupujících invazi z důvodu abnormálního výsledku screeningu I. nebo II. trimestru gravidity spolu s rizikem asociovaným s věkem bylo 0,9 %. Toto riziko bylo sedminásobně vyšší (6,9 %) ve skupině žen indikovaných k invazi na základě neobvyklého nálezu na UZ nebo při genetické rodinné zátěži.Závěr:
Rychlé testy mohou nahradit klasické chromozomální vyšetření tam, kde jedinou indikací k invazi je abnormální výsledek screeningu I. nebo II. trimestru gravidity spolu s rizikem asociovaným s věkem ženy za předpokladu, že ultrasonografické vyšetření bude bez abnormalit.Klíčová slova:
chromozomální aberace, kvantitativní fluorescenční PCR (QFPCR), fluorescenční in situ hybridizace (FISH), prenatální cytogenetická analýza.ÚVOD
Prenatální cytogenetická diagnostika je spolehlivou metodou detekce konstitucionálních chromozomálních aberací (CA) plodů po více než 40 let. Nejběžnějším důvodem k provedení prenatálního chromozomálního vyšetření je zvýšené riziko výskytu trizomie 21. chromozomu (Downův syndrom), popř. dalších méně běžných aneuploidií – trizomie 18. chromozomu (Edwardsův syndrom) a trizomie 13. chromozomu (Pataův syndrom), u plodu. Toto riziko je závislé na věku matky [7], výsledcích biochemického screeningu maternálního séra a výsledcích fetálního sonografického vyšetření (screening I. trimestru gravidity, screening II. trimestru gravidity) [6, 14, 15, 16, 17, 18]. Další důvody k provedení chromozomálního vyšetření zahrnují přenašečství balancované chromozomální přestavby u některého z partnerů, přítomnost vrozených vývojových vad (VVV) u plodu detekovaných při ultrazvukovém vyšetření, popř. výskyt CA u plodu v předchozí graviditě.
Chromozomální analýza je v majoritě případů založena na kultivaci amniocytů z plodové vody - amniocentéza (AC) nebo fibroblastů získaných biopsií choriové tkáně – „chorionic villi sampling“ (CVS). Kultivace lymfocytů získaných punkcí pupečníkové krve (kordocentéza) se dnes používá zřídka.
Provedení chromozomální analýzy vyžaduje předchozí tkáňovou kultivaci, která představuje 10–15 dnů, než je dosaženo konečného výsledku, což ve svém důsledku znamená zvýšení anxiozity u některých pacientek. K dalším omezením této metody můžeme také připočítat její pracnost a nákladnost, neboť finální vyhodnocení musí provádět kvalifikovaný cytogenetik s dostatečnou praxí. Vzhledem k tomu, že rezoluce této metody je limitována, mohou některé strukturní chromozomální aberace uniknout detekci.
Rychle se vyvíjející metody molekulární analýzy DNA pomáhají řešit tyto nedostatky a stávají se nedílnou součástí moderní prenatální diagnostiky. Rychlá detekce základních chromozomálních aneuploidií (trizomie 13, 18, 21, triploidie a gonozomální aneuploidie) se opírá zejména o metody fluorescenční in situ hybridizace (FISH) nebo kvantitativní fluorescenční PCR (QFPCR), které nevyžadují předchozí kultivaci [5]. Jejich použitím lze dosáhnout odhalení přibližně 80 % všech prenatálních cytogenetických aberací v rámci 1–2 dnů [1]. Tyto metody jsou tedy rychlé a dostatečně spolehlivé k detekci běžných aneuploidií a triploidií zejména tam, kde důvodem k invazivnímu výkonu bylo výlučně riziko výskytu CA spojené s abnormálním výsledkem těhotenského screeningu Downova syndromu nebo riziko asociované s věkem ženy. Vzhledem k tomu, že tyto indikační skupiny představují majoritu žen podstupujících invazivní výkon, objevuje se stále častěji otázka, zda je možno metody rychlé detekce použít jako jediný test bez vyšetřování celého karyotypu.
Retrospektivní studie výskytu prenatálně detekovaných CA v letech 1998–2009 se zabývá sledováním reziduálního rizika výskytu jiných chromozomálních aberací (strukturní aberace, vzácné aneuploidie), které by při použití pouze „rychlých testů“ (QFPCR nebo FISH) unikly detekci. Vzhledem k tomu, že je toto riziko velmi ovlivněno typem indikace, která vedla k invazivnímu výkonu, je frekvence chromozomálních aberací nezachytitelných cíleným rychlým testem sledována u každé indikační skupiny separátně.
Cílem retrospektivní studie bylo stanovení reziduálního rizika výskytu CA, které by při použití výlučně cíleného rychlého testu unikly detekci, srovnání tohoto rizika mezi jednotlivými indikačními skupinami a srovnání zastoupení rychlými metodami detekovatelných a nedetekovatelných CA v jednotlivých indikačních skupinách.
METODIKA
V letech 1998–2009 bylo na našem pracovišti prováděno vyšetření zaměřené na detekci CA u plodu v souboru 5305 žen. Tyto byly rozděleny do dvou skupin: ve skupině A byla hlavním rizikem pro plod některá z chromozomálních aneuploidií (trizomie 13, 18, 21) v souvislosti s věkem ženy a výsledkem screeningového vyšetření z maternálního séra (screening I. trimestru nebo II. trimestru) bez abnormálních ultrasonografických nálezů. Zvýšené prosáknutí záhlaví plodu (NT) bylo považováno za součást screeningu I. trimestru. V případě „hygroma colli cysticum“ u plodu byla zvažována indikace k výkonu na základě ultrasonografického patologického nálezu.
Ve skupině B byla zahrnuta těhotenství s abnormálními ultrasonografickými nálezy a těhotenství s výskytem rizika přítomnosti CA a priori (přenašečství balancovaných translokací) – tzv. rodinná anamnéza.
U obou těchto skupin bylo vyhodnocováno zastoupení CA detekovatelných použitím cíleného rychlého testu a zastoupení CA, které by při aplikaci pouze této metody detekci unikly. U 155 vzorků CVS nebylo možno provést kultivaci nebo došlo k jejímu selhání. Vzhledem k tomu, že hlavním rizikem pro tato těhotenství byl výskyt trizomií chromozomů 21, 18 a 13, které byly vyloučeny metodou QFPCR, bylo upuštěno od opakování výkonu. Tyto vzorky byly vyloučeny z vyhodnocování zastoupení CA nedetekovatelných rychlými testy, ale byly zahrnuty do sledování frekvence CA zachytitelných rychlými testy.
Za rychlé, cílené testy se považují metody FISH a QFPCR. U každého testu (u obou metod) je zvažována detekce počtu kopií chromozomů 21, 18, 13 a X, Y. To znamená, že tyto testy poslouží k odhalení trizomií 21, 18, 13, triploidií a aneuploidií gonozomů. U metody FISH lze využít dostupných komerčních kitů zahrnujících sondy pro všechny sledované chromozomy. V případě použití QFPCR je nezbytné ověřovat ploidii sledovaných chromozomů ve více lokusech (minimum jsou dva informativní markery). Sledování senzitivity a specifity obou těchto metod není předmětem této studie. Předpokládá se 100% záchyt výše zmíněných CA těmito metodami.
Jako nedetekovatelné těmito testy byly klasifikovány vzácné numerické CA, strukturní přestavby balancované i nebalancované (s výjimkou translokační formy trizomie 13. a 21. chromozomu, které lze zachytit cílenými testy). Pokud byly tyto změny detekovány ve vzorku náhodně, tzn. že chromozomální analýza byla prováděna z jiných důvodů a později se zjistilo, že jde o zděděnou chromozomální aberaci, byly tyto vzorky zařazeny podle své původní indikace. Za strukturální chromozomální aberaci se nepovažovala inv(9)(p12q13), která je považována za chromozomální variantu bez klinického dopadu.
Kultivace buněk odebraných některým z invazivních výkonů (AC, CVS, kordocentéza) se prováděla standardním způsobem v otevřeném kultivačním systému (u kordocentéz podle protokolu určeného ke kultivaci a zpracování periferních lymfocytů). Zpracování kultur bylo také prováděno podle standardního protokolu. Nátěry byly barveny metodou trypsin-Giemsa. Za úspěšně vyhodnocený vzorek se považoval ten, kde bylo vyhodnocováno minimálně 10–15 metafází na asi 400–500 pruhů. Vyhodnocování a popis výsledků respektovalo pravidla ISCN.
VÝSLEDKY
V letech 1998–2009 bylo provedeno 5305 invazivních prenatální vyšetření zaměřených na vyloučení chromozomálních aberací u plodu. Karyotypizace plodu byla úspěšná u 5150 vzorků. Chromozomální aberace byla detekována u 303 (5,8 %) vzorků.
Více než 80 % invazivních výkonů se provádělo na základě výsledku některého ze screeningových těhotenských programů (screening I. nebo II. trimestru, popř. integrovaného výsledku obou) zaměřených na detekci trizomie 21., 18. a 13. chromozomu u plodu a na základě věku těhotné. Metodou QFPCR popř. FISH by se podařilo zachytit celkem 68 % všech CA v testovaném souboru (131 ve skupině A a 75 ve skupině B) (tab. 1). Skupina chromozomálních aberací, které by unikly detekci, představují reziduální riziko při použití cílených rychlých testů. Toto reziduální riziko je pro obě skupiny 1,9 %. Pro skupinu B však bylo toto riziko sedminásobně vyšší (6,9 %) než pro skupinu A (0,9 %) (tab. 1).
Table 1. Frekvence výskytu chromozomálních aberací v jednotlivých indikačních skupinách v letech 1998 - 2009 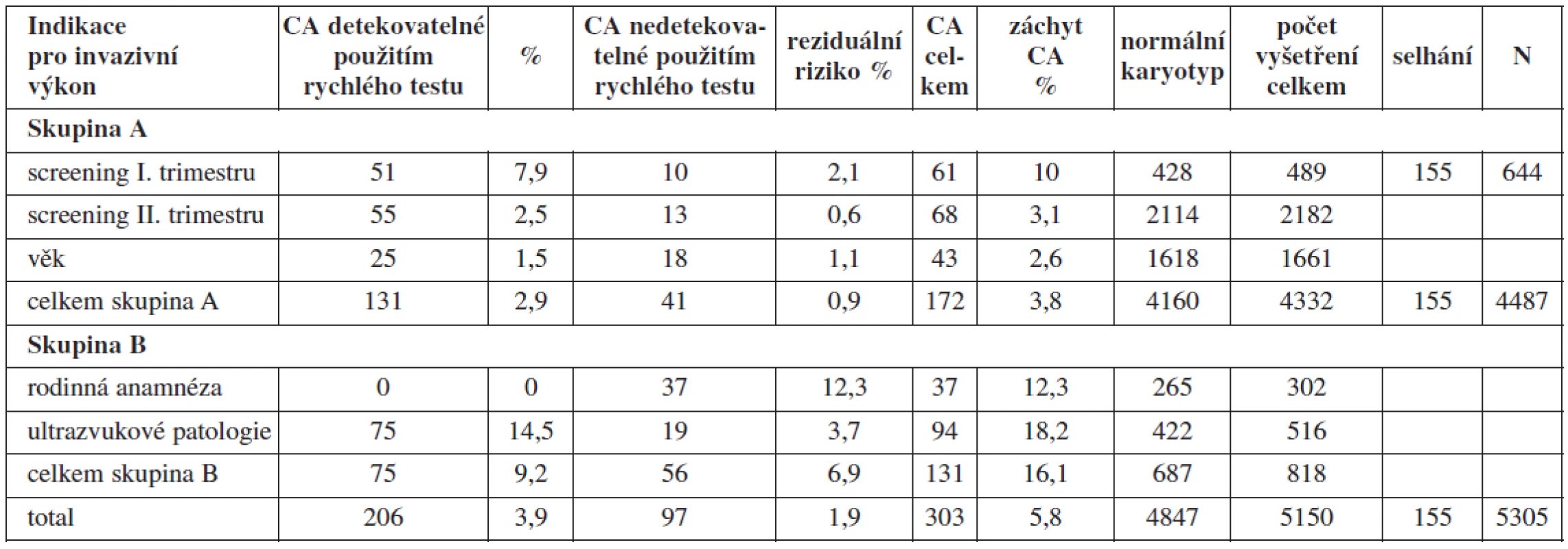
Ve skupině A podstoupilo celkem 3888 žen odběr plodové vody nebo pupečníkové krve a 599 žen odběr choriových klků s úspěšnou karyotypizací u 444 vzorků. Incidence chromozomálních aberací, které by zůstaly neodhaleny byla: 0,8 % u AC a kordocentéz a 2,25 % u CVS (hodnoceno pouze z těch, které byly karyotypovány) v této skupině (tab. 2).
Table 2. Chromozomální aberace detekované jednotlivými metodami ve skupině A a jejich klinický význam 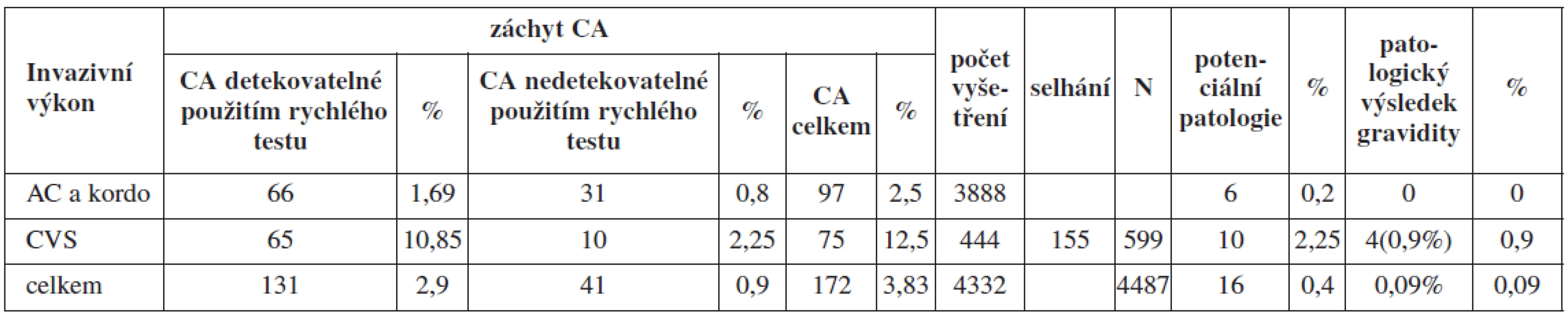
Frekvence chromozomálních aberací s potencionálním klinickým dopadem byla u AC a kordocentéz 0,2 % a 2,25 % u CVS. U CVS s patologickým nálezem byla vždy nabídnuta amniocentéza (tab. 3). V 6 případech z 10 nebyla chromozomální aberace detekovaná ve vzorku biopsie choriových klků v kultivaci z AC vůbec přítomna. Šlo pak tedy pravděpodobně o placentární mozaicismus anebo o kultivační artefakt. Kombinace chromozomální aberace s patologickým průběhem gravidity ve skupině A však byla zaznamenána pouze u žen podstupujících CVS. Ve 4 (0,9 %) případech ze skupiny žen podstupujících CVS došlo ke spontánnímu abortu či umělému přerušení gravidity z důvodu dalších klinických komplikací u těchto gravidit. U žen podstupujících AC ve skupině A nebyl zaznamenán žádný případ patologického průběhu a výsledku gravidity v souvislosti s nálezem chromozomálních aberací nedetekovatelných cíleným testem. Celkově byl současný výskyt CA s patologickým výsledkem gravidity sledován u 0,09 % ve skupině A.
Table 3. Chromozomální aberace odhalené karyotypováním ve skupině A (dn - de novo) 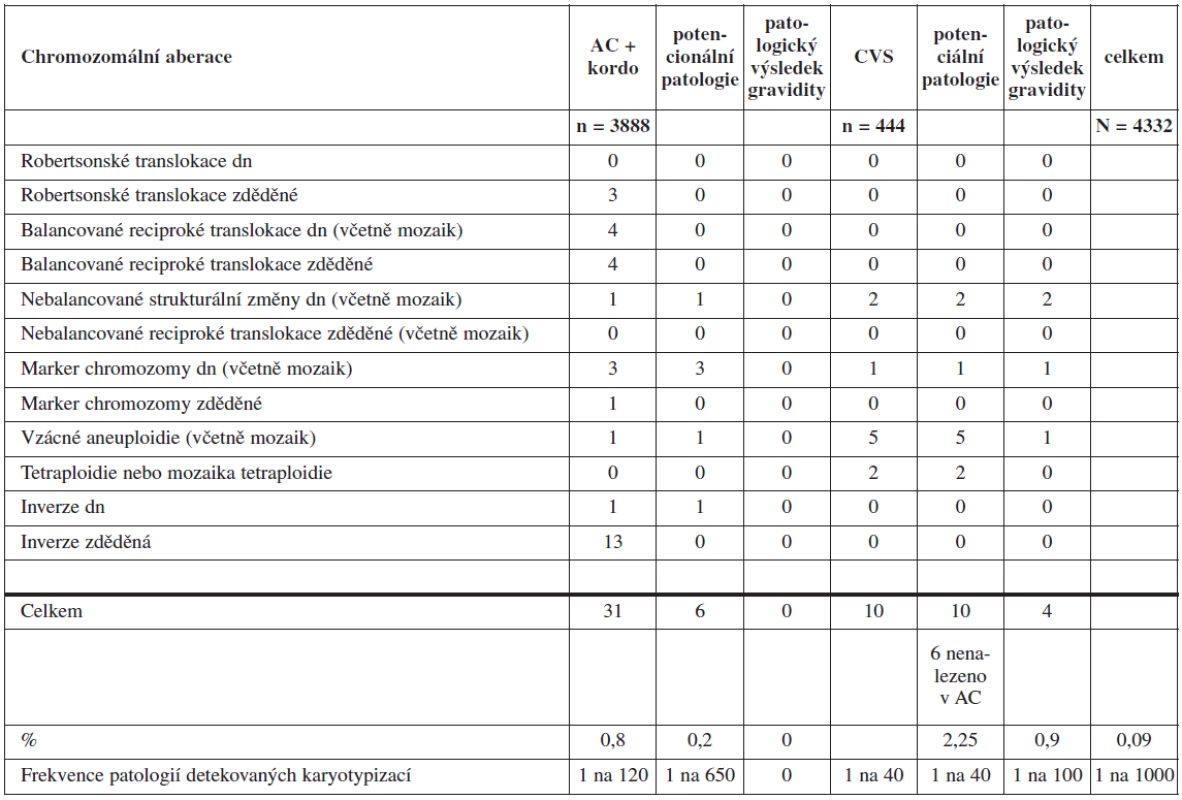
S ohledem na jednotlivé indikace ve skupině A bylo reziduální riziko nejnižší ve skupině žen indikovaných k invazivnímu výkonu na základě suspektní chromozomální aberace u plodu vycházející z výsledků screeningu II. trimestru gravidity – 0,6 % při celkovém záchytu CA v této indikační skupině 3,1 %. Nejvyšší riziko bylo ve skupině screeningu I. trimestru gravidity – 2,1 % při celkovém záchytu CA 10 %. V obou případech však záchyt CA, které by unikly v případě použití pouze cílených testů, představuje vždy přibližně jednu pětinu všech CA zachycených ve jmenovaných indikačních skupinách. V indikační skupině screeningu I. trimestru gravidity je nutno vzít do úvahy relativně častou přítomnost placentárního mozaicismu a kultivačních artefaktů v této studii. Frekvence potvrzeného placentárního mozaicismu se pohybuje v rozpětí 1–2 % všech odběrů choria [11]. V naší studii představovala přítomnost mozaicismu u CVS majoritu CA aberací nezachytitelných rychlými testy.
DISKUSE
Naše výsledky ukazují, že nahrazení kultivace a karyotypování rychlými cílenými testy u všech indikací by znamenalo, že bude zachyceno 68 % všech chromozomálních aberací. Téměř shodná je uváděná frekvence pro výskyt nejčastějších CA (trizomie 21, 13, 18) detekovaných prenatálně v české populaci [4]. Po vyjmutí skupiny žen, kde je riziko rychlými testy nedetekovatelných CA dáno a priori (rodinná anamnéza), by se podařilo zachytit 78 % všech CA – reziduální riziko bez indikační skupiny rodinná anamnéza je tedy 1,2 %. Podobné výsledky přinesly i další studie – záchyt CA nedetekovatelných rychlým testem se pohybuje od 0,1 do 3,1 % [3, 8, 12, 13] v závislosti na zahrnutí jednotlivých indikačních skupin. Ve skupině B (indikace k invazivnímu výkonu na základě rodinné zátěže nebo patologického ultrazvukového nálezu) v naší studii je reziduální riziko téměř sedminásobně vyšší nežli ve skupině A (indikace na základě screeningových vyšetření). Proto je nezbytné provádět kompletní karyotypizaci nejen v případě přítomnosti CA u některého z partnerů, ale i tam, kde se vyskytují neobvyklé ultrasonografické nálezy.
Frekvence strukturálních aberací – nebalancovaných a balancovaných – v neselektované populaci novorozenců je uváděna 0,061 % a 0,522 %. Celková frekvence CA u neselektované populace novorozenců je 0,92 % [10].
Frekvence CA nedetekovatelných cílenými testy v kultivacích z plodové vody byla 1 : 100 a 1 : 40 u kultivací biopsie choria ve studii Caine [1]. Klinický význam měla třetina těchto CA u plodových vod a polovina nálezů z kultivace choria. V naší studii jsme při téměř stejné četnosti těchto CA (AC je 1 : 120; CVS je 1 : 40) zaznamenali potenciální klinický význam u jedné pětiny z nich u AC (1 : 650) a u všech případů CVS (1 : 40). Neúspěšně skončila gravidita ve 4 případech CA nedetekovatelných rychlými testy (ve všech případech šlo o patologické nálezy z CVS). Ve třech případech došlo ke spontánnímu potratu a v jednom případu bylo těhotenství ukončováno z důvodu kostní dysplazie u plodu detekované až po nálezu CA v kultivaci choria. Ani v jednom případě nebylo možno jednoznačně určit, je-li CA příčinou patologického konce gravidity, neboť šlo vždy o mozaicistní nálezy.
Klinický dopad v těchto případech nelze nikdy přesně určit a nelze ani jednoznačně vyloučit zastoupení aberantního klonu ve tkáních plodu, přestože provedený následný odběr plodové vody neprokáže přítomnost patologického klonu. O souvislosti nalezené CA a patologickém konci gravidity lze tedy jen spekulovat. V jednom z těch případů, který skončil spontánním abortem, bylo naměřeno, v rámci screeningového vyšetření prováděného v I. trimestru gravidity, prosáknutí záhlaví 5,6 mm. V některých studiích je doporučováno v případě prosáknutí záhlaví nad 3 mm provést karyotypizaci [2].
ZÁVĚR
Na základě provedeného auditu chromozomálních vyšetření lze vyslovit závěr, že karyotypování by bylo možno nahradit rychlými cílenými testy v případě, že důvodem k provedenému vyšetření bude výlučně věk ženy nebo výsledek screeningu maternálního séra bez přítomnosti neobvyklých ultrasonografických nálezů nebo nepříznivé rodinné anamnézy. Je nutno však vzít v úvahu několik faktů:
- předpokládá se 100% spolehlivost rychlého testu, což může být někdy problematické vzhledem k informativitě markerů u QFPCR nebo vzhledem k možné kontaminaci vzorku maternálními buňkami, která představuje určité omezení zejména u metody FISH [9];
- spolehlivost rychlých testů při detekci mozaik. U testu QFPCR je uváděna detekce mozaik autozomů od 10 % [13]. V případě FISH může být interpretace zejména minoritních mozaik komplikována vědomím možného zkreslení výsledků v důsledku kontaminace maternálními buňkami. Je nutno však vzít v potaz, že i chromozomální vyšetření má své limity např. v počtu hodnocených buněk či rizika falešně negativního výsledku z důvodu kontaminace maternálními buňkami, zejména u CVS;
- náhodná detekce zděděných strukturálních chromozomálních změn v karyotypu plodu může zlepšit prevenci výskytu nebalancovaných CA v populaci.
RNDr. Pavlina Čapkova, Ph.D.
Ústav lékařské genetiky a fetální medicíny
FN Olomouc
I.P.Pavlova 6
775 20 Olomouc
pcapkova@seznam.cz
Sources
1. Caine, A., Maltby, AE., Parkin, CA., et al. Prenatal detection of Down’s syndrome by rapid aneuploidy testing for chromosomes 13, 18, 21 by FISH or PCR without a full karyotype: cytogenetic risk assessment. Lancet, 2005, 366, p. 123-128.
2. Crolla, JA. To quit or not to quit prenatal cytogenetic diagnosis? Chrom Res, 2007, 15, p. 7–8.
3. Evans, MI., Henry, GP., Miller, WA. International, collaborative assessment of 146,000 prenatal karyotypes: expected limitations if only chromosome specific probes and fluorescent in situ hybridization are used. Hum Reprod, 1999, 14(5), p. 1213-1216.
4. Gregor, V., Šípek, A., Šípek, A. jr., Horáček, J., a kol. Prenatální diagnostika chromozomálních aberací Česká republika: 1994 – 2007. Čes Gynek, 2009, 74(1), s. 44-54.
5. Grimshaw, GM., Szczepura, A., Hulten, M., et al. Evaluation of molecular tests for prenatal diagnosis of chromosome abnormalities. Health Technol Assess, 2003, 7, p. 1-146.
6. Haddow, JE., Palomaki, GE., Knight, GJ., et al. Prenatal screening for Down’s syndrome with use of maternal serum markers. N Engl Med, 1992, 327, p. 588-593.
7. Hecht, CA., Hook, EB. The imprecision in rates of Down syndrome by 1 - year maternal age intervals: a critical analysis of rates used in biochemical screening. Prenat Diagn, 1994, 14, p. 729-738.
8. Homer, J., Bhatt, S., Juany, S., Thangavelu, M. Residual risk for cytogenetic abnormalities after prenatal diagnosis by interphase fluorescence in situ hybridization (FISH). Prenat Diagn, 2003, 23, p. 566-571.
9. Hultén, MA., Dhanjal, S., Pert, B. Rapid and simple prenatal diagnosis of common chromosome disorders: advantages and disadvantages of the molecular methods FISH and QF-PCR. Reprod, 2003, 126, p. 279-297.
10. Jacobs, PA., Browne, C., Gregson, N., et al. Estimates of the frequency of chromosome abnormalities detectable in unselected newborns using moderate levels of banding. J Med Genet, 1992, 29(2), p. 103-108.
11. Kalousek, DK., Howard-Peebles, PN., Olson, SB., et al. Confirmation of CVS mosaicism in term placentae mosaicism, Prenat Diagn, 1991, 11, p. 743-750.
12. Leung, WC., Lau, ET., Lao, TT., Tang, MH. Can amnio-polymerase chain reaction alone replace conventional cytogenetic study for women with positive biochemical screening for fetal Down syndrome? Obstet Gynecol, 2003, 101, p. 856-861.
13. Lewin, P., Kleinfinger, P., Bazin, A., et al. Defining the efficiency of fluorescence in situ hybridization on uncultured amniocytes on retrospective cohort of 27 407 prenatal diagnoses. Prenat Diagn, 2000, 20, p. 1-6.
14. Mann, K., Donaghue, C., Fox, SP., et al. Strategies for the rapid prenatal diagnosis of chromosome aneuploidy. Eur J Hum Genet, 2004, 12(11), p. 907-915.
15. Nicolaides, KH., Azar, G., Byrne, D., et al. Fetal nuchal translucency: ultasound screening for chromosomal defects in first trimester of pregnancy. BMJ, 1992, 304, p. 867-869.
16. Nicolaides, KH. Nuchal translucency and other first-trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynaecol, 2004, 191(1), p. 45-67.
17. Spenser, K., Spenser, CE., Power, M., et al. Screening for chromosomal abnormalities in the first trimester using ultrasound and maternal serum biochemistry in a one stop clinic. A review of three years prospective experience. Br J Obstet Gynaecol, 2003, 110, p. 281-286.
18. Wald, NJ, Kennard, A., Hackshaw, A., McGuire, A. Antenatal screening for Down’s syndrome. J Med Screen, 1997, 7, p. 181‑246.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2011 Issue 1-
All articles in this issue
- Fatální průběh neonatální infekce citrobakterem a jeho právní posouzení
- Prognóza úrovně perinatální péče v České republice do nejbližší budoucnosti I. Z pohledu vývoje ukazatelů v ČR
- Prognóza úrovně perinatální péče v České republice do nejbližší budoucnosti II. Z pohledu Světové zdravotnické organizace
- Prognóza vývoje perinatální medícíny v České republice do nejbližší budoucnosti III. Z pohledu současného rozvoje medicíny
- Analýza perinatologických výsledkov Slovenskej republiky v rokoch 2007–2009
- Perinatologické výstupy Žilinského kraja Slovenskej republiky za 10ročné obdobie (2000–2009)
- Proteomika a biomarkery předčasného porodu: systematický přehled literatury
- Vrozená imunita v patogenezi intraamniální infekce u těhotenství komplikovaného předčasným odtokem plodové vody
- Stanovení reziduálního cytogenetického rizika v prenatální diagnostice při nahrazení tradičního karyotypování cílenými molekulárními testy určenými k rychlé detekci aneuploidií – retrospektivní studie
- Vede užívání psychotropních látek k rizikovému sexuálnímu chování?
- Poruchy ženské sexuální touhy – prevalence, klasifikace a možnosti terapie
- Efektivita léčby recidivující stresové inkontinence moči pomocí transobturatorní pásky po selhání kolposuspenze podle Burche
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vede užívání psychotropních látek k rizikovému sexuálnímu chování?
- Fatální průběh neonatální infekce citrobakterem a jeho právní posouzení
- Poruchy ženské sexuální touhy – prevalence, klasifikace a možnosti terapie
- Vrozená imunita v patogenezi intraamniální infekce u těhotenství komplikovaného předčasným odtokem plodové vody
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

