-
Medical journals
- Career
Porovnání produkce reaktivních kyslíkových částic v nativním ejakulátu a v suspenzi spermií
Authors: M. Svobodová 1; I. Oborná 1; H. Fingerová 1; J. Novotný 2; J. Březinová 1; L. Radová 3; J. Vysloužilová 1; J. Horáková 1; J. Grohmannová 1
Authors‘ workplace: Gynekologicko-porodnická klinika FN a LF UP Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 1; Ústav biologie LF UP Olomouc, přednosta doc. RNDr. V. Divoký, Ph. D. 2; Laboratoř experimentální medicíny, LF UP Olomouc, přednosta doc. MUDr. M. Hajdúch, Ph. D. 3
Published in: Ceska Gynekol 2009; 74(6): 399-403
Overview
Cíl práce:
Chemiluminiscenční metodou s luminolem vyhodnotit produkci reaktivních kyslíkových částic (ROS) v nativním ejakulátu a v suspenzi spermií a posoudit korelaci těchto dvou metod.Typ studie:
Prospektivní laboratorní studie.Název a sídlo pracoviště:
Porodnicko-gynekologická klinika LF UP a FN Olomouc.Metodika:
Soubor tvořilo 17 fertilních dobrovolníků, 19 normospermiků z infertilních párů, kde byl prokázán ženský faktor neplodnosti a 15 normospermiků s idiopatickou neplodností páru. Produkce ROS byla vyšetřena stejnou chemiluminiscenční metodou s luminolem současně ve vzorcích nativního ejakulátu i vzorcích suspenze promytých spermií.Výsledky:
Hodnoty ROS v nativním ejakulátu byly řádově nižší než v suspenzi spermií. Nebyly zjištěny statisticky významné rozdíly mezi produkcí ROS u fertilních dobrovolníků a mužů z neplodných párů. Byla potvrzena korelace mezi log ROS v nativním ejakulátu a v suspenzi promytých spermií v PBS u všech tří skupin (FV r=0,85, p=1,5×10-5; NM r=0,76, p<2×10-4; NMI r=0,75, p<1,5×10-3).Závěr:
Měření ROS v nativním ejakulátu je jednodušší, rychlejší a lépe odráží aktuální úroveň oxidačního stresu než měření v suspenzi spermií. Zavedení této metody měření ROS může doplnit algoritmus diagnostiky i léčby mužské neplodnosti a být vodítkem pro antioxidační či antibiotickou léčbu.Klíčová slova:
oxidační stres, reaktivní kyslíkové částice, nativní ejakulát, chemiluminescence.ÚVOD
Mužský faktor je podle Světové zdravotnické organizace [18] příčinou neplodnosti až u 50 % infertilních párů. Dnes používané metody analýzy semene podle doporučení WHO hodnotí koncentraci spermií, jejich pohyblivost, morfologii a kontaminaci leukocyty. Toto rutinní vyšetřování semene však v mnoha případech neumožňuje odhalit funkční poruchy spermií na molekulární úrovni [6]. Jednou z možných příčin těchto poruch může být totiž oxidační stres (OS), nadměrná produkce reaktivních kyslíkových částic, kterou již antioxidanty v seminální plazmě nestačí vychytat. V jeho důsledku pak dochází k peroxidaci lipoproteinů membrán spermií, apoptóze nebo fragmentaci DNA. Proto téměř polovina případů mužské neplodnosti zůstává neobjasněna a označuje se jako nevysvětlitelná, tedy idiopatická neplodnost [14].
Volné, vysoce reaktivní kyslíkové a dusíkové radikály (ROS, RONS), k nimž řadíme i některé oxidační molekuly (např. peroxid vodíku), jsou nezbytné pro správnou funkci spermií během kapacitace, akrozomální reakce a fúze s oocytem. Jakmile jsou však ROS generovány spermiemi nebo aktivovanými leukocyty v nadměrné míře [15], kterou již nestačí kompenzovat antioxidační systém ejakulátu, vzniká OS, který může významně poškodit především motilitu spermií a integritu jejich DNA [4]. Techniky asistované reprodukce při manipulaci se spermiemi zahrnují i kroky, které mohou spermie mechanicky poškodit, a navíc odstraněním seminální plazmy s jejím komplexním antioxidačním systémem, arteficiálně ROS zvýšit. Jde například o vícenásobné centrifugace, resuspendace a kryokonzervace spermií [2, 10].
Manuál WHO z roku 1999 upozorňuje na význam stanovení ROS jako možné příčiny neplodnosti, přesto jeho vyšetřování nebylo doposud zavedeno do rutinní praxe. Na našem pracovišti jsme jako první v ČR [12] zavedli chemiluminiscenční metodu hodnocení produkce ROS v suspenzi promytých spermií ve fosfátovém pufru (PBS), kterou poprvé publikoval Shekarriz [17]. Toto stanovení však postihuje jen jednu složku pro - a antioxidační rovnováhy v mužském semeni. Pokoušeli jsme se proto hodnotit současně celkovou antioxidační kapacitu (TAC, total antioxidant capacity) seminální plazmy pomocí kitu TAS Randox [9]. Podle našich zkušeností však byly rozdíly v hodnotách TAC relativně malé vzhledem k rozmezí naměřených hodnot ROS, protože tento kit spolehlivě detekuje pouze neenzymatické antioxidanty.
Nedávno se v odborné literatuře objevily první práce hodnotící produkci ROS přímo v nativním ejakulátu se stejnou technikou detekce [1, 5, 7]. Na našem pracovišti jsme od roku 2007 začali paralelně vyšetřovat ROS v nativním ejakulátu i suspensi spermií v PBS. Nyní předkládáme první porovnání produkce ROS v obou typech vzorku u mužů z neplodných párů s normospermií podle WHO a fertilních dobrovolníků.
SOUBOR PROBANDŮ A METODIKA
Do studie bylo zařazeno celkem 34 mužů z neplodných párů. U 19 mužů byla klasifikována normospermie (NM) podle WHO a zároveň byl prokázán ženský faktor neplodnosti. U dalších 15 mužů byla také normospermie, ale příčina neplodnosti nebyla diagnostikována, šlo tedy o idiopatickou neplodnost (NMI). Kontrolní skupinu tvořilo 17 mužů s prověřenou plodností (FV). Studie byla schválena etickou komisí Univerzity Palackého v Olomouci a všichni probandi podepsali informovaný souhlas.
Vzorek ejakulátu byl získán po 3-5denní pohlavní abstinenci. Po zkapalnění ejakulátu při 37°C se 0,1 ml vzorku použilo na vyšetření spermiogramu podle WHO, 0,5 ml se odebralo pro měření ROS v nativním ejakulátu a 1 ml pro přípravu suspenze v PBS. Ejakulát byl centrifugován 7 minut při 300 g. Peleta spermií byla promyta v 1 ml PBS a opět centrifugována 7 minut při 300 g. Po odstranění supernatantu byl sediment resuspendován v 1ml PBS a po spočítání spermií v Bürkerově komůrce doředěn na koncentraci 1,25×106 spermií/ml k simultánnímu měření produkce ROS v suspenzi v PBS.
Produkce ROS byla nejprve měřena v nativním ejakulátu bezprostředně po zkapalnění a po asi 30 minutách v suspendovaných spermiích. V obou případech se ke 400 μl vzorku přidalo 10 μl 5mM roztoku luminolu v dimethylsulfoxidu. Emise světla byla měřena na jednodetektorovém luminometru fy Digene DCR1 (Digene Diagnostic, Inc., Gaithersburg, MD, USA) ve 30sekundových intervalech integrálně po dobu 15 minut a vyjádřena v RLU (Relative Light Unit) za minutu a přepočtena v obou měřeních na 20 milionů spermií.
K hodnocení rozdílů mezi hladinami ROS zjištěnými oběma metodami byl použit neparametrický Mannův-Whitneyho test. Statistické hodnocení korelací mezi produkcí ROS v nativu a v suspenzi promytých spermií v PBS u fertilních dobrovolníků, normospermiků z neplodného páru a mužů s idiopatickou neplodností bylo provedeno pomocí Spearmanova testu po logaritmické transformaci.
VÝSLEDKY
Vstupní parametry spermiogramu ani věk se ve vyšetřovaných skupinách významně nelišily, jak je patrné z tabulky 1.
Table 1. Vstupní parametry (průměr ± SD) vyšetřovaných skupin: FV (fertilní dobrovolníci), NM (normospermici s ženským faktorem) a NMI (normospermici z neplodných párů s idiopatickou infertilitou) 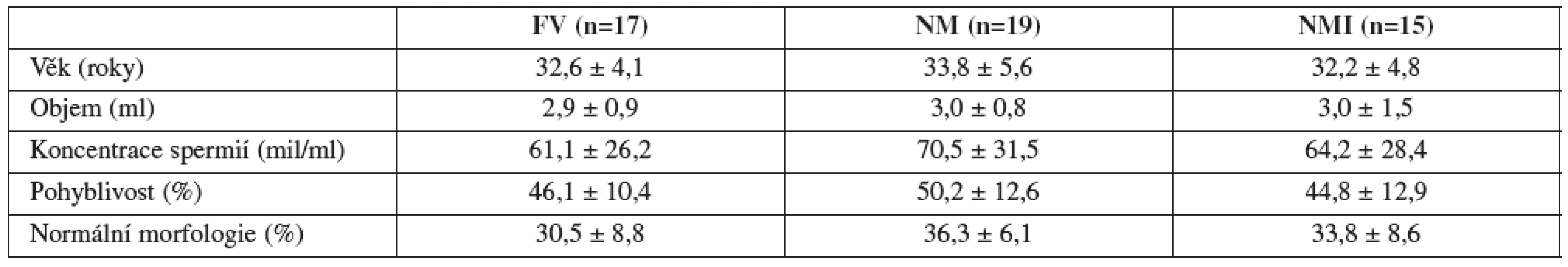
Naměřené hodnoty produkce ROS se v suspenzi spermií v PBS i v nativním ejakulátu pohybovaly v širokém rozmezí. Podle očekávání byly hodnoty ROS v nativním ejakulátu řádově nižší než v suspenzi spermií. Zatímco u dříve zavedené metody stanovení ROS v suspenzi se výsledky pohybovaly od hodnot neměřitelných až do 2,2×107 RLU/min na 20×106 spermií, v paralelních vzorcích nativního ejakulátu byla nalezena produkce ROS jen do 5,5×104 RLU/min.
Vzhledem k těmto extrémním rozdílům v naměřených hodnotách byla pro statistické hodnocení užita logaritmická transformace. Porovnání produkce ROS v suspenzi spermií a nativním ejakulátu u fertilních dobrovolníků (FV), normospermiků z infertilních párů (NM) a mužů s idiopatickou neplodností (NMI) je znázorněno na obrázku 1. Mezi hodnotami naměřené produkce ROS ve sledovaných skupinách vzorků nebyly Mannovým-Whitneyho testem zjištěny statisticky významné rozdíly ani u měření v suspenzi, ani u měření v nativním ejakulátu. Hodnota 75. percentilu produkce ROS v nativním ejakulátu fertilních dobrovolníků odpovídá po delogaritmování 1,2×103 RLU/min/20×106 spermií, zatímco v suspenzi spermií to odpovídá 2,7×105 RLU/min/20×106.
Image 1. Porovnání produkce ROS v logaritmickém vyjádření v suspenzi promytých spermií v PBS a v nativním ejakulátu pro všechny tři skupiny: FV, NM a NMI 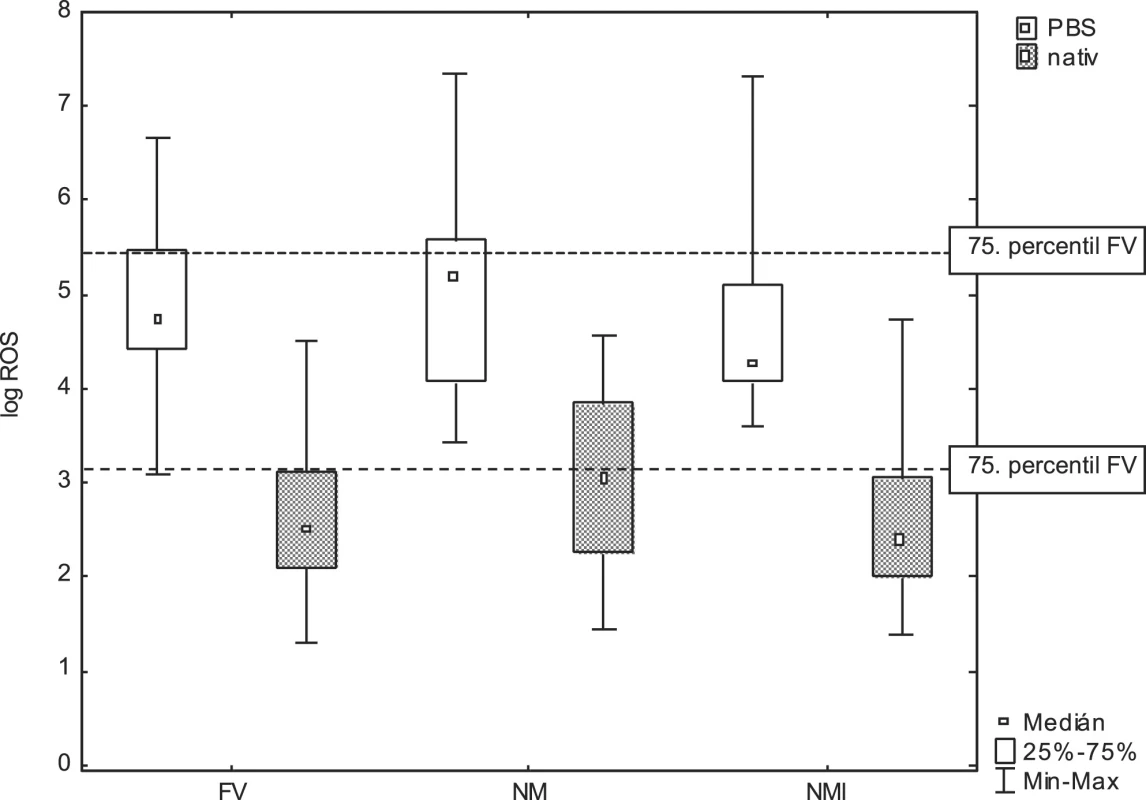
Byla také potvrzena velmi dobrá korelace mezi log ROS v nativním ejakulátu a log ROS v suspenzi promytých spermií v PBS u všech tří skupin. Nejvýznamnější korelace, r = 0,85, p = 1,5×10-5 byla nalezena u fertilních dobrovolníků (obr. 2). Významné korelace byly zjištěny i u normospermiků z neplodných párů (NM; r=0,76, p<2×10-4) stejně jako u mužů s idiopatickým faktorem neplodnosti (NMI; r=0,75, p<1,5×10-3).
Image 2. Korelace mezi log ROS v nativním ejakulátu a log ROS v suspenzi promytých spermií v PBS u skupiny fertilních dobrovolníků 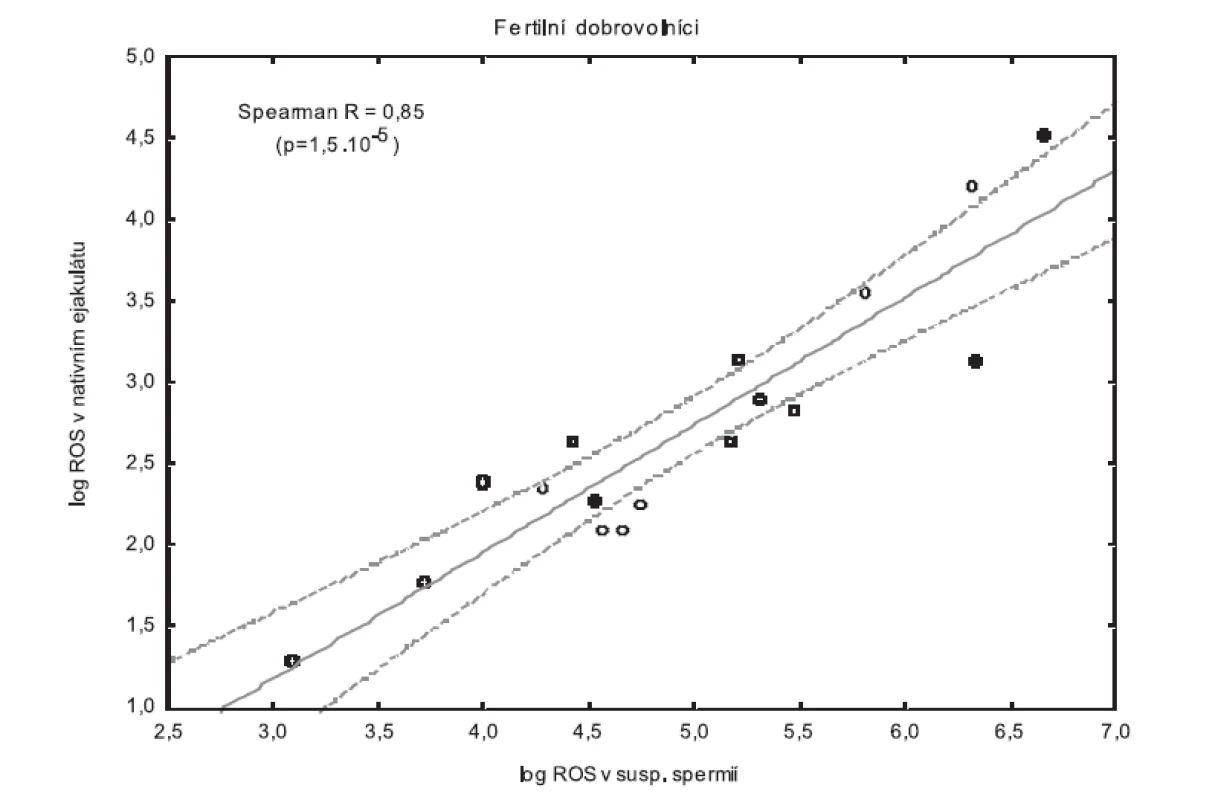
DISKUSE
ROS, označované též nepřesně jako volné radikály, hrají významnou roli v mnoha fyziologických procesech. Na jedné straně je kyslík nezbytnou podmínkou života aerobních buněk, ale na straně druhé některé jeho metabolity (jako např. superoxidový anion, peroxid vodíku, hydroxylový radikál) mohou negativně ovlivňovat buněčné funkce. Hovoří se proto o tzv. „kyslíkovém paradoxu“. Fyziologické hladiny ROS jsou nezbytné pro kapacitaci a hyperaktivaci spermií, i pro splynutí spermie s oocytem [3].
Nadměrná produkce ROS však může narušovat membrány spermií, snižovat jejich progresivní pohyblivost, popřípadě vést až k imobilizaci spermií a poškozovat integritu DNA [4, 11]. Proto mužské spermie a také spermie většiny savců obsahují ochranné mechanismy, které je chrání před reaktivními kyslíkovými radikály. Membrány spermií, které obsahují velké množství nenasycených mastných kyselin, citlivých k lipoperoxidaci, chrání seminální plazma, obsahující velké množství enzymatických (superoxiddismutáza, kataláza, glutathion peroxidáza) a také neenzymatických antioxidantů (vit. E, C, hypotaurin, taurin, kyselina močová a albumin).
Oxidační stres vzniká teprve nerovnováhou mezi nadměrnou produkcí ROS a nedostatečnou kapacitou antioxidačních systémů. Zjistilo se, že používání promytých spermií k hodnocení oxidačního stresu in vivo nedává objektivní výsledky, protože měří produkci ROS po odstranění seminální plazmy, která má antioxidační kapacitu. Během přípravy suspenze se ejakulát centrifuguje, spermie se resuspendují a vortexují a to vše může vést k arteficiálnímu zvýšení hladin ROS. Proto Sharma et al. [16] navrhli ROS-TAC skóre jako nové měření pro hodnocení oxidačního stresu mužské infertility [9]. Jednodušší a spolehlivější metodou je měření ROS stejnou chemiluminiscenční technikou, ale s použitím nativního ejakulátu. Toto měření by mělo teoreticky přímo odrážet aktuální nadprodukci ROS, neboť chemiluminiscenci mohou excitovat pouze ty radikály, které antioxidační kapacita seminální tekutiny nestačí vychytávat. Allamaneni et al. [5] v roce 2005 poprvé porovnával produkci ROS v nativním ejakulátu a v suspenzi promytých spermií u 34 dárců a 44 pacientů s abnormálním spermiogramem. Dárci spermatu měli v nativu 5krát nižší hodnoty ROS než v suspenzi spermií. U pacientů s abnormálním spermiogramem byly hodnoty ROS v nativu signifikantně vyšší než u dárců.
Autoři recentní studie [8] se pokusili o určení mezní hodnoty produkce ROS v nativním ejakulátu stejnou chemiluminiscenční metodou. Vyšetřovali 51 donorů s prokázanou fertilitou a 54 infertilních mužů. Při zvolení mezní hodnoty pro rozlišení ROS pozitivních a ROS negativních vzorků jako 1,85×104 cpm (count per minute) na 20 milionů spermií, mohli identifikovat infertilní pacienty s vysokou specificitou a senzitivitou (82,4 % a 77,8 %).
Jako první pracoviště v ČR jsme již od roku 2003 měřili produkci ROS v suspenzi spermií pomocí chemiluminiscence luminolu [12]. Tuto metodu jsme nyní porovnali se stejnou metodou měření ROS v nativním ejakulátu. Neprokázali jsme statisticky významné rozdíly mezi produkcí ROS u fertilních dobrovolníků a normospermiků z infertilních párů, ať již s přítomností nebo bez přítomnosti diagnostikovaného ženského faktoru. Zvýšené hodnoty ROS nad 75. percentil pro fertilní dobrovolníky se však častěji vyskytovaly u mužů z infertilních párů. Nalezli jsme významnou korelaci mezi naměřenou produkcí ROS v nativním ejakulátu a v suspenzi spermií v PBS pocházející ze stejného vzorku ejakulátu. Naše první zkušenosti s měřením oxidačního stresu v nativním ejakulátu jsou v dobré shodě se zatím ojedinělými, již publikovanými výsledky [1, 5, 8]. Malý počet vyšetření ve skupině fertilních dobrovolníků avšak nedovoluje exaktní stanovení normálního rozmezí produkce ROS v naší populaci.
Pro použití produkce ROS jako diagnostického a prognostického nástroje – u mužského faktoru infertility nebo u metod asistované reprodukce a také pro následnou antioxidační léčbu – bude ovšem potřebné, aby si každé pracoviště stanovilo vlastní referenční meze s ohledem na konkrétní podmínky (přístrojové vybavení, chemikálie, typ populace atd.). Nálezy extrémně vysokých hodnot ROS u mužů z infertilních párů mohou být i bez přesného stanovení limitů fyziologické úrovně OS vodítkem pro nasazení antioxidační léčby, eventuálně při průkazu zvýšeného výskytu leukocytů, primárně antibiotické terapie [13].
ZÁVĚR
Chemiluminiscenční měření reaktivních kyslíkových částic v nativním ejakulátu lépe odráží aktuální úroveň oxidačního stresu bez potřeby dalšího měření antioxidační kapacity seminální plazmy. Ve srovnáním s měřením ROS v suspenzi spermií je to metoda méně pracná a méně časově náročná, tudíž je vhodnější pro klinické použití. Tato výhoda by mohla usnadnit zavedení této metody do klinické praxe a doplnit algoritmus diagnostiky i léčby mužské neplodnosti.
Podpořeno grantem IGA MZd č. A1 8621-5.
Mgr. Magda Svobodová
Centrum asistované reprodukce
Porodnicko-gynekologická klinika LF a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: svobodom@fnol.cz
Sources
1. Athayde, KS., Cocuzza, M., Agarwal, A., et al. Development of normal reference values for seminal reactive oxygen species and their correlation with leukocytes and semen parameters in a fertile population. J Androl, 2007, 28, p. 613-620.
2. Aitken, RJ., Clarkson JS. Significance of reactive oxygen species and antioxidants in defining the efficacy of sperm preparation techniques. J Androl, 1988, 9, p. 367-376.
3. Aitken, RJ., Ryan, AL., Baker, MA., et al. Redox activity associated with the maturation and capacitation of mammalian spermatozoa. Free Radic Biol Med, 2004, 36, p. 994-1010.
4. Aitken, RJ., De Iuliis, GN. Origins and consequences of DNA damage in male germ cells. Reprod Biomed Online, 2007, 14, p. 727-733.
5. Allamaneni, SSR., Agarwal, A., Nallella, KP., et al. Characterization of oxidative stress status by evaluation of reactive oxygen species levels in whole semen and isolated spermatozoa. Fertil Steril, 2005, 83, p. 800-803.
6. Aziz, N., Agarwal, A. Evaluation of sperm damage: beyond the World Health Organization criteria. Fertil Steril, 2008, 90, p. 484–485.
7. Cocuzza, M., Athayde, KS., Agarwal, A., et al. Age-related increase of reactive oxygen species in neat semen in healthy fertile men. Urology, 2008, 71, p. 490-494.
8. Desai, N., Sharma, R., Makker, K., et al. Physiologic and pathologic levels of reactive oxygen species in neat semen of infertile men. Fertil Steril, 2008, doi:10.1016/j.fertnstert. 2008.08.109.
9. Fingerová, H., Novotný, J., Barbořík, J., et al. Antioxidant capacity of seminal plasma measured by TAS Randox Biom Papers, 2007, 151, p. 37-40.
10. Labbe, C., Martoriati, A., Devaux, A., et al. Effects of sperm cryopreservation on sperm DNA stability and progeny development in rainbow trout. Mol Reprod Dev, 2001, 60, p. 397-404.
11. Moustafa, MH., Sharma, RK., Thornton, J., et al. Relationship between ROS production, apoptosis and DNA denaturation in spermatozoa from patients examined for infertility. Hum Reprod, 2004, 19, p. 129-138.
12. Novotný, J., Oborná, I., Březinová, J., et al. The occurrence of reactive oxygen species in semen of males from infertile couples. Biom Papers, 2003, 147, p. 173-176.
13. Oborná, I., Fingerová, H., Hajdúch, M., et al. Lykopen v terapii mužské neplodnosti. Čes Gynek, 2007, 72, s. 326-329.
14. Oborná, I., Fingerová, H., Novotný, J., et al. Oxidační stres v diagnostice a léčbě idiopatické mužské neplodnosti. Čes Gynek, 2008, 73, s. 356-360.
15. Oborná, I., Fingerová, H., Novotný, J., et al. Reactive oxygen species in human semen in relation to leukocyte contamination. Biom Papers, 2009, 153, p. 1-6.
16. Sharma, RK., Pasqualotto, FF., Nelson, DR., et al. The reactive oxygen species – total antioxidant capacity score is a new measure of oxidative stress to predict male infertility. Hum Reprod, 1999, 14, p. 2801-2807.
17. Shekarriz, M., Sharma, RK., Thomas, AJ., et al. Positive myeloperoxidase staining (Endtz test) as an indicator of excessive reactive oxygen species formation in semen. J Assist Reprod Genet, 1995, 12, p.70-74.
18. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Cambridge: Cambridge University Press, UK, 1999.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 6-
All articles in this issue
- Porovnání produkce reaktivních kyslíkových částic v nativním ejakulátu a v suspenzi spermií
- Interleukin 6 v plodové vodě pacientek s předčasným odtokem plodové vody
- Denzitometrické nálezy u žen užívajících gestagenní hormonální antikoncepci
- Kombinovaná léčba symptomů hyperaktivního měchýře anticholinergiky a alfalytiky u žen – pilotní studie
- Fertilitu zachovávající terapie gynekologických malignit
- Molekulární charakteristiky borderline ovariálních tumorů ve vztahu k biologickému chování nádorů
- Reprodukční výsledky po laparoskopické myomektomii – retrospektivní analýza 1994-2007
- Torze ovaria v prvním trimestru gravidity po stimulaci v IVF-ET programu – kazuistika
- Prenatálně vzniklé intrakraniální krvácení – diagnostika a sledování
- Analýza perinatologických ukazatelů Olomouckého kraje v období 1994-2008
- Perioperační podávání kapslí s brusinkovým extraktem v profylaxi uroinfekcí po gynekologických operacích
- Komplikace laparotomické a laparoskopické léčby karcinomu endometria
- Léčba recidivujícího ovariálního karcinomu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Interleukin 6 v plodové vodě pacientek s předčasným odtokem plodové vody
- Prenatálně vzniklé intrakraniální krvácení – diagnostika a sledování
- Torze ovaria v prvním trimestru gravidity po stimulaci v IVF-ET programu – kazuistika
- Fertilitu zachovávající terapie gynekologických malignit
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

