-
Medical journals
- Career
Paraneoplastické syndromy v onkogynekologii
Authors: Luboš Minář; H. Al Awad; J. Kümmel
Authors‘ workplace: Gynekologicko-porodnická klinika LF MU a FN Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
Published in: Ceska Gynekol 2009; 74(3): 171-176
Overview
Cíl studie:
Informace o paraneoplastických syndromech vyskytujících se u gynekologických malignit.Typ studie:
Literární přehled s kazuistikou.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF MU a FN Brno.Metodika:
Literární přehled o paraneoplastických syndromech v onkogynekologii s ilustrativní kazuistikou.Závěr:
Jako paraneoplastické syndromy označujeme příznaky, které doprovázejí nádorové nemocnění, ale nesouvisejí přímo s progresí primárního ložiska nebo s metastazováním nádoru. Tyto příznaky vyžadují pozornost především proto, že mohou v některých případech být primárními projevy nádoru, který ještě nebyl diagnostikován. Mezi paraneoplastické syndromy, jež se vyskytují u malignit, které jsou předmětem zájmu onkogynekologů, patří horečka nádorového původu, anorexie a hubnutí, paraneoplastické syndromy endokrinní, neurologické, muskuloskeletální, hematologické a kožní. V rámci diagnostiky je nezbytná interdisciplinární spolupráce zahrnující účast nejen onkologa, ale i dermatovenerologa, neurologa, revmatologa, hematologa a dalších specialistů podle aktuálního stavu a dominujících potíží pacientky.Klíčová slova:
paraneoplastický syndrom, karcinom prsu a ovaria, dermatomyositis, hyperkalcémie, bisfosfonáty.ÚVOD
Jako paraneoplastické syndromy označujeme příznaky, které doprovázejí nádorové onemocnění, ale nesouvisejí přímo s progresí primárního ložiska nebo s metastazováním nádoru. Tyto příznaky vyžadují pozornost především proto, že mohou v některých případech být primárními projevy nádoru, který ještě nebyl diagnostikován [3]. Patofyziologických mechanismů, které se zde uplatňují, je více, minimálně trojího typu. Nádorové buňky mohou produkovat různé cytokiny, které jsou odpovědné např. za vznik paraneoplastické horečky a anorexii. Druhou variantou je výdej hormonálně aktivních působků nebo hormonálních prekurzorů. Další možností je působení nádorových antigenů, které mohou v důsledku patologické zkřížené reakce poškodit normální buňky, tento mechanismus se uplatňuje u neurologických paraneoplastických syndromů.
TYPY PARANEOPLASTICKÝCH SYNDROMŮ
Horečka nádorového původu
Horečka je u nádorových onemocnění většinou projevem infekčních komplikací. U části nemocných se infekční agens neprokáže a horečka může být paraneoplastickým projevem samotného nádorového onemocnění. Kromě toho se může objevit také jako nežádoucí účinek protinádorové terapie (např. cytostatická léčba). Paraneoplastická horečka vzniká poruchou termoregulačního centra vyvolanou působením cytokinů, které modifikují (resp. zvyšují) hodnotu termoregulačního hypotalamického centra, které je normálně nastaveno na teplotu 36,5–37 st.C. Cytokiny jsou endogenní pyrogeny, nejsilnější pyrogenní účinek mají interleukin 1 (IL-1), tumor nekrosis faktor (TNF) alfa a IL-6. Tyto pyrogeny jsou v případě paraneoplastické horečky uvolňovány z nádorových buněk, prostupují hemoencefalickou bariéru a stimulují biosyntézu a výdej prostaglandinu E2 (PGE2) z endotelií, PGE2 je přímo odpovědný za vyšší nastavení termoregulačního centra. Kromě toho se může spolupodílet i oxid dusnatý vznikající v důsledku zvýšené aktivity NO syntetázy účinkem cytokinů. Samotný nádor působí zvýšený výdej cytokinů buď nepřímo (lokální zánět, nekróza, obstrukce), nebo nádorové buňky samy produkují pyrogenní cytokiny. Z gynekologických malignit se paraneoplastická horečka objevuje zejména u karcinomu ovaria, je spojena s produkcí IL-1.
Terapie spočívá především v úspěšné protinádorové terapii, jinak jsou hlavními léky antipyretika, která zasahují do patogeneze horečky, cílem je omezit syntézu PGE2. Inhibici cyklooxygenázy, která je klíčová pro syntézu prostaglandinů, působí salicyláty nebo nesteroidní antirevmatika. Dále se podávají glukokortikoidy, které působí pravděpodobně dvojím mechanismem. Inhibují fosfolipázu A, a tím nepřímo syntézu PGE2, současně blokují transkripci mRNA pro pyrogenní cytokiny, a tak snižují produkci konkrétních pyrogenů - IL-1 a TNF alfa [14]. Z farmakoterapie lze využít přípravků omezujících vazokonstrikci (např. fenothiaziny) nebo myorelaxancia (snižují svalový tonus, a tím produkci tepla). Kromě farmakoterapie se využívá fyzikální terapie (zábaly), je nutno pečovat o zvýšený příjem tekutin.
Anorexie a hubnutí
Nechutenství je častým (i časným) příznakem maligního onemocnění a je hlavní příčinou úbytku hmostnosti a rozvoje nádorové kachexie. V patogenezi se uplatňují i humorální faktory, které ovlivňují hypotalamická centra regulující chuť k jídlu, ovlivňují žaludeční motilitu a vyprazdňování žaludku. Konkrétně jde o poruchu interakce mezi hypotalamickým centrem hladu a centrem nasycenosti, která je za normálních podmínek zprostředkována humorálně cholecystokininem. U malignit se na vzniku anorexie podílejí substance uvolňované z nádorové tkáně (TNF alfa, kachektin, IL-1 a IL-6). Na prohloubení anorexie se dále podílejí rovněž hyposmie a hypogeuzie připisované snížené koncentraci zinku, která se pravidelně vyskytuje u onkologicky nemocných. Možnosti farkamoterapeutického ovlivnění anorexie spočívají např. v podání gestagenů – megestrol acetát (Megace) [15].
Endokrinní paraneoplastické syndromy
Endokrinní projevy malignit byly dávány do souvislosti s ektopickou sekrecí některých hormonů nádorovou tkání. Tento etiopatogenetický mechanismus se uplatňuje jen v omezené míře, častěji nádorové buňky přeměňují biologicky inaktivní prekurzory proteinových hormonů produkovaných různými (i nenádorovými tkáněmi) v aktivní hormon, který je zodpovědný za klinické projevy paraneoplazie. V oblasti onkogynekologie se setkáváme s hyperkalcemickým syndromem, který je nejčastěji způsoben osteolytickými metastázami, typicky u karcinomu prsu [6].
Hyperkalcémie však nemusí vždy být spojena s destrukcí kosti nádorovým procesem. Vlastní paraneoplastická hyperkalcémie je způsobena zvýšenou resorpcí kosti osteoklasty, které jsou aktivovány PTHrP (parathormone-related peptid) produkovaným nádorovými buňkami. Tento působek je homologní s parathormonem. Jeho nadprodukce je podmíněna zvýšenou expresí genu pro tento protein působením určitých onkogenů (H‑ras, v-src). Spolupodílejí se rovněž některé další humorální faktory uvolňované nádorovými buňkami, např. IL-1, TNF, IL-6 a TGF (transforming growth factor), který má inhibiční účinek na osteoblasty [4]. Klinické příznaky hyperkalcémie jsou zpočátku nenápadné (anorexie, polyurie), později se objevuje obstipace, dehydratace, psychické změny, ev. neurologická symptomatologie. Při sérových hladinách kolem 3,5 mmol/l vzniká tzv. hyperkalcemická krize, spojená s poruchou vědomí a rizikem kardiální zástavy. Hyperkalcemický syndrom jako paraneoplazie se u gynekologických malignit popisuje u karcinomu ovaria. Terapie hyperkalcémie kromě účinné léčby základního onemocnění je založena na dostatečné hydrataci, ve farmakoterapii představují optimální přípravky bisfosfonáty [2]. Mechanismus jejich účinku spočívá v inhibici aktivovaných osteoklastů, omezují účinnost dalších humorálních faktorů, které se podílejí na resorpci kosti (prostaglandiny, TNF beta, IL-1). Jsou k dispozici ve formě perorální – ibandronat (Bondronat) i parenterální – zolendronat (Zometa). V současnosti dělíme bisfosfonáty do tří generací, jak je uvedeno v tabulce (tab. 1). Při hrozící hyperkalcemické krizi je možno použít kalcitonin (Miacalcic), při terapeuticky rezistentních hyperkalcémiích se sérovým kalciem nad 3 mmol/l je indikována dialýza.
Table 1. Přehled jednotlivých generací bisfosfanátů 
Mezi vzácné hormonální paraneoplazie z oblasti onkogynekologie patří např. ektopická sekrece gonadotropinů (LH, FSH) a choriogonadotropinu (hCG) u karcinomu prsu.
Neurologické paraneoplastické syndromy
Neurologické komplikace u malignit jsou relativně časté, ale většinou jsou způsobeny metastatickým postižením, krvácením při trombocytopenii nebo infekční komplikací. Vlastní neurologická paraneoplazie je spojena s produkcí specifických antigenů, vzniklé protilátky pak reagují s intaktními neurony a důsledkem je poškození nervové tkáně, jak centrální, tak i periferní. V terapii je zásadní léčba základního onemocnění, popisuje se i podání glukokortikoidů, imunoglobulinů nebo plazmaferéza. V onkogynekologii se setkáváme s cerebelární degenerací u karcinomu ovaria. Klinicky se objevuje ataxie, dysartrie a mírný stupeň demence [13]. Dále se u karcinomu prsu popisuje Eatonův-Lambertův myastenický syndrom, jehož klinické projevy se podobají myastenii gravis. Podstatou je presynaptická porucha periferní cholinergní neurotransmise.
Muskuloskeletální paraneoplastické syndromy
Popisuje se paraneoplastická polyartritida, která se klinicky podobá revmatoidní artritidě. V etiopatogenezi se uplatňuje alterace buněčné imunity, rovněž tak i podíl cirkulujících imunokomplexů. Klinicky se objevuje náhle vzniklá intenzivní bolest a ranní ztuhlost kloubů. Nejčastěji provází karcinom prsu.
Se syndromem dermatomyozitidy/polymyozitidy se u onkogynekologických pacientek setkáváme u karcinomu ovaria a prsu.
Dermatomyozitida a polymyozitida
Dermatomyozitida (DM) a polymyozitida (PM) jsou získaná chronická zánětlivá onemocnění svalů, u dermatomyozitidy jsou vyvinuty typické kožní projevy. V klasifikaci onemocnění se rozlišuje forma primární idiopatická, paraneoplastická, dětská a forma provázející jiná systémová onemocnění pojiva [14].
Epidemiologie, etiopatogeneze, podstata strukturálních a funkčních změn
Incidence dermatomyozitidy se udává v rozmezí 2–50 na milion obyvatel. Etiologie DM je neznámá. Vznik dermatomyozitidy je popisován při terapii penicilaminem, tamoxifenem. Při virových infektech často dochází k výskytu myozitidy – uvažuje se o možnosti, že viry spouštějí a udržují autoimunitní proces (coxsackie viry, echoviry, herpes viry aj.) [10]. Rovněž se poukazuje na možnou asociaci s infekcí Toxoplasma gondii [5]. Patogeneticky se uplatňuje tvorba a ukládání imunokomplexů v cévních stěnách.
Celkem 26 % dospělých pacientů s DM má malignitu. U DM je zvýšený výskyt neoplazií ve srovnání s normální populací asi o 10 %. Primárním tumorem bývá často kromě karcinomu prsu nebo ovaria rovněž karcinom plic, žaludku, rekta, ledvin a u mužů nádor varlat. Z lymfomů jde o Hodgkinovu chorobu, lymfosarkom, Kaposiho sarkom, thymom, myeloidní leukémii [10].
Dermatomyozizida poškozuje zejména kůži a svaly. Histopatologický nález v kůži záleží na stadiu choroby. U akutní formy bývá rozsáhlý edém kůže a může poškodit všechny vrstvy dermis. Je přítomna vakuolární degenerace bazální vrstvy, lymfocytární infiltrát perivaskulární nebo ve shlucích, infiltrát obsahuje kromě lymfocytů i další typy buněk – histiocyty, plazmatické buňky, eozinofily a depozita mucinu. V pozdějších stadiích choroby kolagen v dermis vykazuje ztluštění, homogenizaci a sklerózu a epidermis se stává atrofickou [11] (obr. 1, 2). Při imunofluorescenčním vyšetření kůže jsou patrny v dermo-epidermální junkci depozita protilátek – IgM, IgG a C3 – v 50 % případů [9]. Při provedení svalové biopsie je zjevná nekróza a regenerace svalových vláken s perifascikulárním či intrafascikulárním mononukleárním zánětlivým infiltrátem, ev. perifascikulární atrofií [11].
Image 1. Histologický obraz dermatomyozitidy 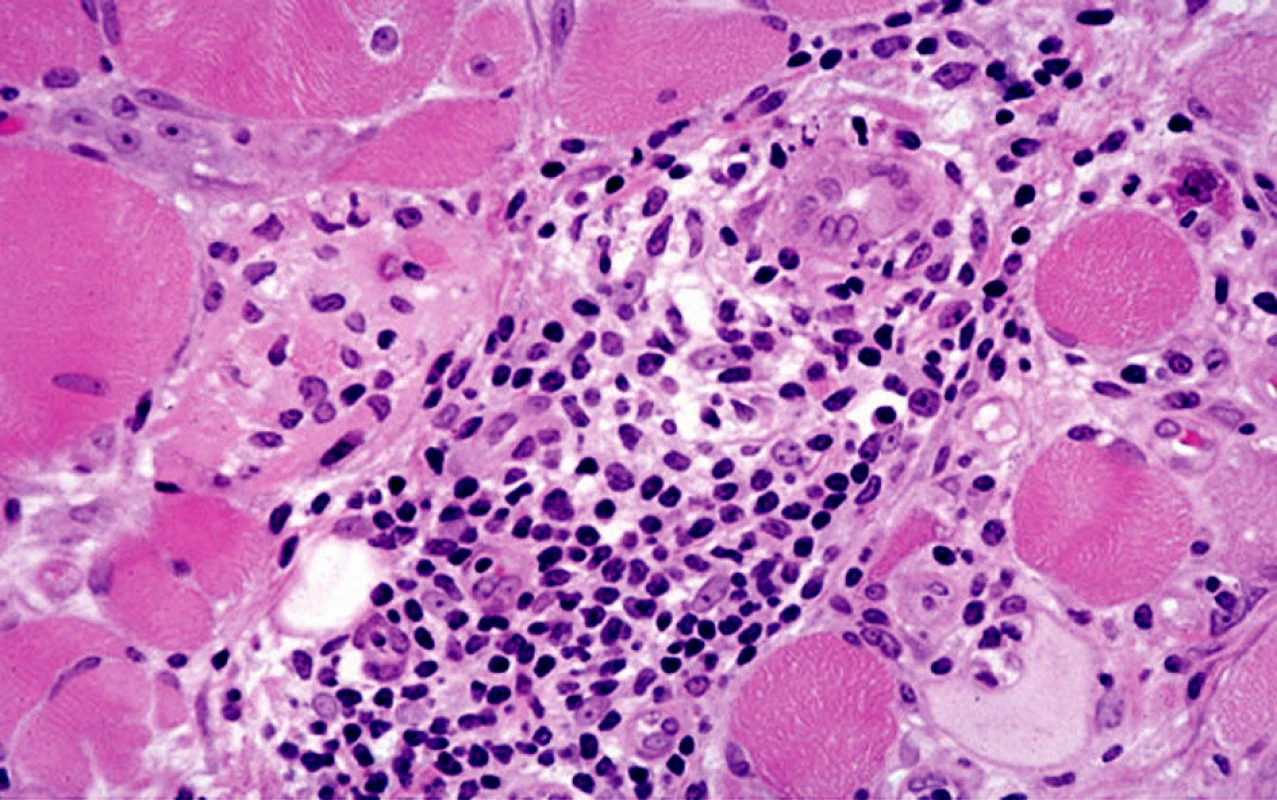
Image 2. Histologický obraz polymyozitidy 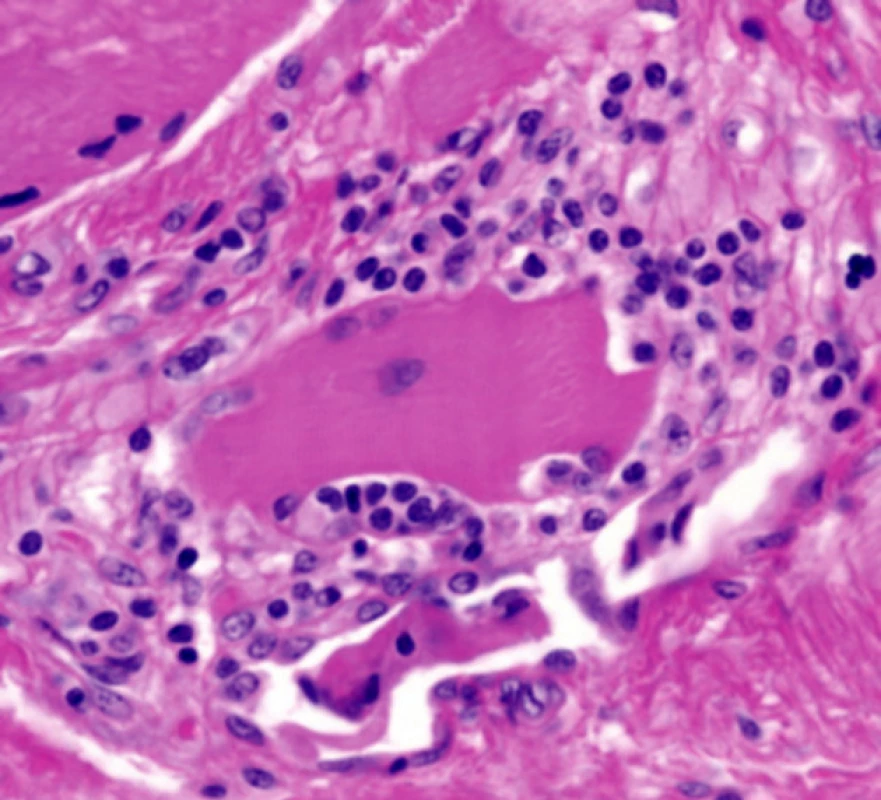
Pro diagnostiku i terapii DM je zásadní interdisciplinární spolupráce s účastí dermatovenerologa, internisty, revmatologa, onkologa a dalších specialistů podle aktuálního stavu pacienta.
Klinický obraz
DM často začíná artralgiemi, únavou, febriliemi, Raynaudovým fenoménem. Nejvýznamnější je postižení svalů horních končetin. Pacient subjektivně udává ochablost a bolestivost svalů. Svalové postižení postupně progreduje – nemocný není schopen elevovat horní končetiny. Postiženy mohou být také svaly dýchací a polykací. Z vnitřních orgánů jsou alterovány ledviny (glomerulonefritida), srdce (myokarditida), vzácně se vyvine plicní fibróza, bývá přítomna artritida a ezofageální dysfunkce. Kožní nález u dermatomyozitidy charakterizuje v akutní fázi heliotropní erytém [7] – červenofialový otok víček. Nad klouby rukou, kolenou a loktů je patrné tzv. Gottronovo znamení – makulopapulózní erytémy nebo polymorfní atrofické plaky, na trupu a proximálních partiích končetin jsou patrné chronické makulární erytémy (obr. 3, 4), na nehtech mohou být přítomny teleangiektazie. U třetiny pacientů je prokazatelná fotosenzitivita [11].
Image 3. Projevy dermatomyozitidy v oblasti krku, hrudníku a ramen u 67leté paceintky s karcinomem ovaria 
Image 4. Projevy dermatomyozitidy v oblasti v oblasti stehen a kolenou u 67leté pacientky s karcinomem ovaria 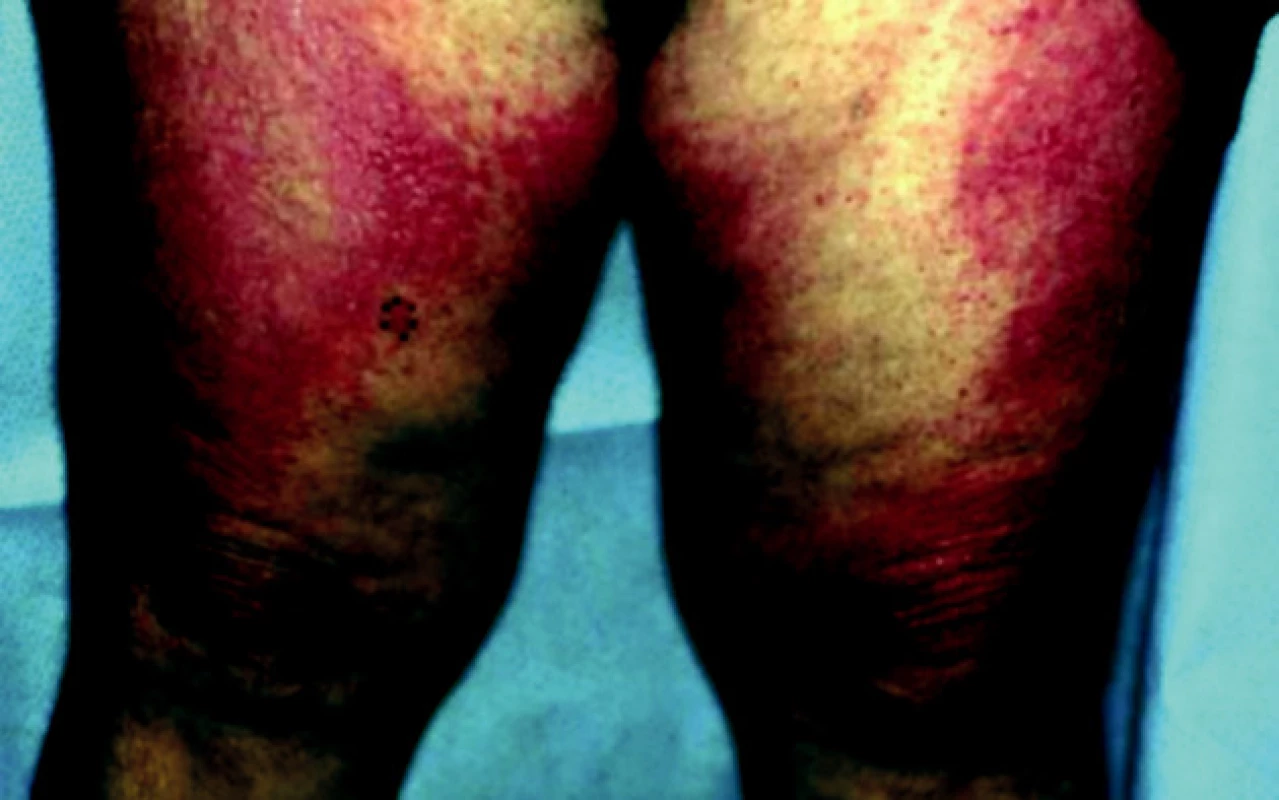
Diagnostika
Ke stanovení diagnózy jsou nutná kromě klinického vyšetření dermatovenerologem rovněž četná doplňková vyšetření, vč. konziliárních interdisciplinárních vyšetření zahrnujících i konzultaci onkogynekologa. V rámci laboratorních vyšetření se provádí kromě základního hematologického a biochemického vyšetření i další laboratorní vyšetření (Hamburgerův sediment, clearance kreatininu, hladina enzymů – aldolázy, kreatinfosfokinázy – v séru, myoglobinu v séru a v moči, protilátky proti Toxoplasma gondii v séru, vyšetření hladin hormonů štítné žlázy, antinukleární protilátky, protilátky proti kardiolipinu aj.), vyšetření histologické a imunohistologické z kůže a svalu (imunohistologické především k odlišení dalších systémových onemocnění pojiva), vyšetření elektromyografické a další specializovaná klinická vyšetření ( k vyloučení orgánových změn – revmatologické, k vyloučení malignity – onkologické, při rozsáhlejším myozitickém postižení – neurologické, k provedení svalové biopsie – chirurgické ap.).
K vyhodnocení diagnostického algoritmu se užívají diagnostická kritéria dermatomyozitidy a polymyozititidy podle Bohana a Petera zahrnující 5 kritérií:
- symetrická proximální svalová slabost,
- zvýšené hodnoty kreatininkinázy, aldolázy nebo myoglobinu,
- elektromyografické známky myopatie,
- svalová biopsie s rysy zánětlivé myopatie,
- typické kožní projevy u dermatomyozitidy.
Diagnóza PM je jistá, platí-li kritéria 1–4, u DM alespoň 3 kritéria + 5. kritérium. Pravděpodobná diagnóza PM je, platí-li 3 kritéria, u DM platí-li 2 kritéria + 5. kritérium.
Diferenciálně diagnosticky je třeba odlišit zejména ostatní choroby pojiva (např. systémový lupus erythematodes, sclerodermatomyositis), toxoplazmózu, jiné myopatie (toxické, endokrinologické, lékově indukované), svalové dystrofie [10].
Terapie
U dospělých nemocných s prokázaným onkologickým onemocněním je nutná léčba této choroby. V některých případech se léčí onkologické onemocnění souběžně s DM. Pacienti s DM jsou ve většině případů léčeni systémově kortikosteroidy – dávka se volí v závislosti na stupni aktivity choroby. Systémovou léčbu kortikosteroidy lze kombinovat s imunosupresivy (methotrexat, azathioprin). Případy rezistentní ke kortikosteroidům a imunosupresivům je nutno nadále léčit ve spolupráci s revmatologem. Kožní projevy mívají příznivou odezvu na terapii antimalariky. U pacientů je třeba sledovat nežádoucí účinky léčby a od počátku aplikovat léky ke zmírnění těchto projevů. Terapie zevní je pouze symptomatická. Jejím účelem je potlačit ev. sekundární infekci, zmírnit zánětlivou reakci v kůži nemocného, snížit infiltraci a erytém u exantému. Využívají se externa s antibiotiky, s epitelizačním účinkem a kortikosteroidní preparáty.
Prognóza
Prognóza onemocnění je závislá na době stanovení diagnózy. Včas objevené onemocnění má prognózu příznivější. Průběh nemoci je však variabilní, lze říci, že lepší prognózu má dermatomyozitida než polymyozitida. Ve fulminantní případech pacienti umírají během prvního roku (asi 20 % nemocných), z nich dvě třetiny umírají na základní onkologická onemocnění.
Kazuistika
V rámci této přehledové práce bychom chtěli prezentovat kazuistiku 67leté pacientky z naší klinické praxe, která k nám byla předána z dermatovenerologické kliniky s diagnostikovanou dermatomyozitidou. Splňovala 2.–4. diagnostické kritérium z diagnostické škály podle Bohana a Petera a současně byly přítomny typické kožní projevy dermatomyozitidy. Měla zavedenou systémovou terapii kortikosteroidy a současně i terapii lokální ke zmírnění přítomného pruritu v místech výsevu kožních morf. Subjektivně udávala kromě zmíněného pruritu intermitentní nespecifické bolesti v podbřišku a meteorismus. Na základě našeho konziliárního vyšetření bylo vysloveno podezření na bilaterální ovariální tumor, pro možnost malignity svědčila jak elevace nádorových markerů (sérová hodnota Ca-125 asi 400 j.), tak i ultrasnografický nález, který prokázal podle UZ kritérií onkologicky suspektní nález – oboustrannou rezistenci v adnexálních krajinách (nehomogenního vzhledu, s převažující solidní složkou, s papilární prominencemi jak do lumina přítomné cystické složky, tak i ne zcela ostré vnější kontury adnexálních tumorů), současně i přítomnost volné tekutiny v cavum Douglasi. CT vyšetření břicha, malé pánve a retroperitonea neprokazovalo adenopatii ve svodné lymfatické oblasti, rovněž tak byl negativní i rtg snímek plic. Pacientka podstoupila probatorní laparotomii, z freeze histologie byl diagnostikován oboustranný ovariální serózní karcinom, prorážející pouzdro tumorů, G3 (obr. 5). Výkon byl proveden v adekvátním rozsahu radikality – tj. abdominální hysterektomie I. stupně radikality s oboustrannou adnexektomií, infrakolickou omentektomií, apendektomií a pánevní a paraaortální lymfadenektomií. Součástí výkonu byl rovněž odběr výpotku z dutiny břišní na cytologické vyšetření a odběr biopsií ze standardních lokalit odpovídajících toku peritoneální tekutiny. Definitivní klasifikace byla pT1c pN0 (celkem 42 negativních lymfatických uzlin, z toho 28 pánevních a 17 paraaortálních) M0, G3. Operační výkon byl zajištěn adjuvantní chemoterapií v režimu Paclitaxel 175 mg/m2 + CBCDA (AUC 6), celkem 6 sérií. V průběhu chemoterapie asi 4 měsíce po provedeném operačním výkonu došlo při současné dermatologické terapii k úplnému vymizení kožních projevů dermatomyozitidy. Nyní je pacientka 3 roky od ukončené onkologické léčby v remisi (týká se jak základního onemocnění, tak i projevů dermatomyozitidy).
Image 5. Histologický preparát s bilaterárním ovariálním karcinomem perforujícím pouzdro 
Hematologické paraneoplastické projevy
Představují změnu v počtu krevních elementů a poruchy koagulace [1]. Nejčastějším paraneoplastickým příznakem je anémie. Mechanismů vzniku je více. Nejčastěji je zprostředkován cytokiny (IL-1, IL‑6, TNF alfa), které účinkem na neutrofilní leukocyty působí uvolnění laktoferinu, který váže železo s větší intenzitou než ferritin, z nedostatku železa vázne vyzrávání erytroblastů a vzniká hypochromní anémie. U mucinózních karcinomů (vč. prsu) se popisuje mikroangiopatická hemolytická anémie s přítomností fragmentovaných erytrocytů. Na jejím vzniku se může podílet turbulence při mikroembolech v plicní cirkulaci. Erytrocyty mohou být fragmentovány fibrinovými vlákny při současně probíhající diseminované intravaskulární koagulaci, která může doprovázet tuto anémii. Trombocytóza se vyskytuje jako paraneoplastický projev karcinomu prsu a ovaria, je způsobena nadprodukcí IL-6 a trombopoetinu. Maligní onemocnění bývají až v 15 % doprovázeny trombotickými komplikacemi. Na jejich vzniku se podílí tkáňový prokoagulační faktor (CP – cancer procoagulans), který se uvolňuje z nádorových buněk a přímo aktivuje koagulační faktor X, dále se může podílet žilní stáza v důsledku mechanického útlaku cév nádorem a snížená tvorba přirozených inhibitorů koagulace (antitrombin, protein C a S) [12].
Závažnou komplikací malignit je syndrom diseminované intravaskulární koagulace (DIC), jehož spouštěcím mechanismem může být přímá aktivace koagulačního faktoru X tkáňovým prokoagulačním faktorem nebo sialovou kyselinou, která je obsažena v mucinu adenokarcinomů.
Kožní paraneoplastické projevy
Acanthosis nigricans se v rámci paraneoplastického syndromu může vyskytnout u karcinomu prsu. Projevuje se jako plochy s tmavou pigmentací, drsným povrchem a verukózními výrůstky, nejčastější lokalizace jsou oblast podpaží, třísel a submammární rýha (obr. 6).
Image 6. Acanthosis nigricans – axillární oblast 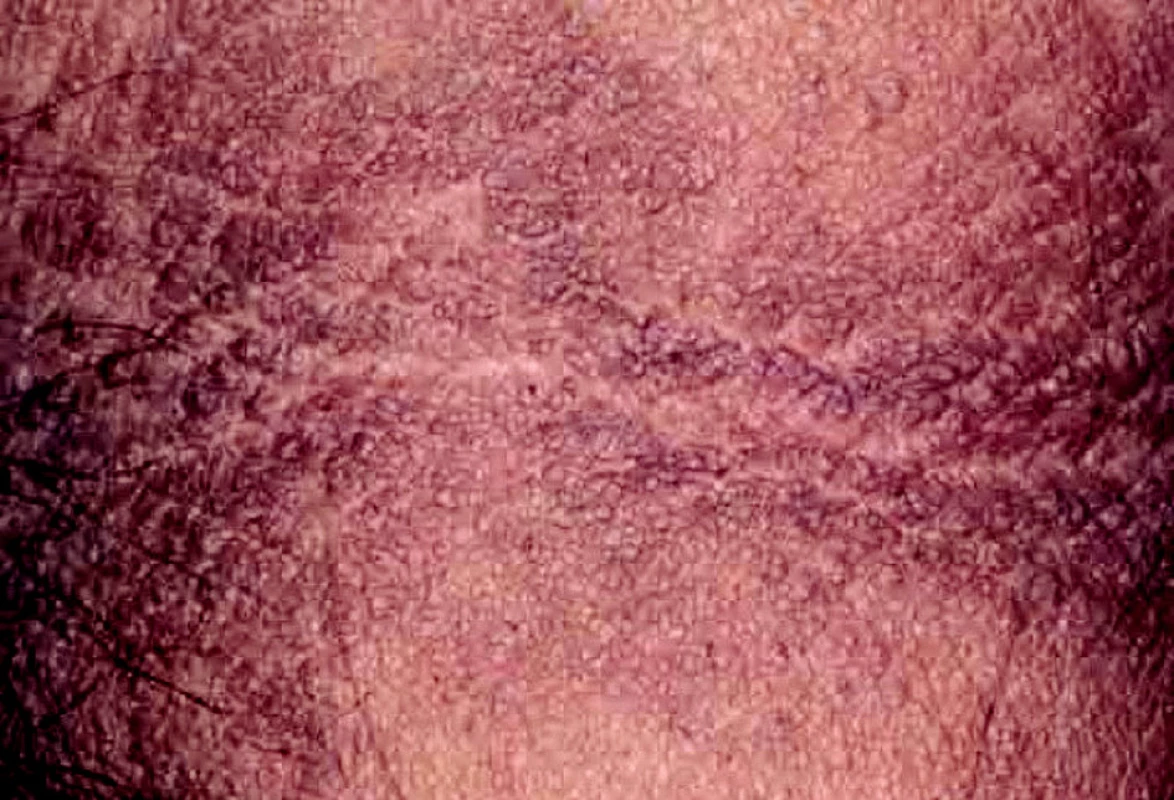
ZÁVĚR
Paraneoplastické syndromy představují symptomy, které doprovázejí nádorové onemocnění, ale nesouvisejí přímo s progresí primárního ložiska nebo s metastazováním nádoru. Těmto symptomům je nutno věnovat zvýšenou pozornost především proto, že mohou v některých případech být primárními projevy nádoru, který ještě nebyl diagnostikován. Mezi paraneoplastické syndromy, jež se vyskytují u malignit, které jsou předmětem zájmu onkogynekologů, patří horečka nádorového původu, anorexie a hubnutí, paraneoplastické syndromy endokrinní, neurologické, muskuloskeletální, hematologické a kožní. V rámci diagnostiky je nezbytná interdisciplinární spolupráce zahrnující účast nejen onkologa (v našem případě onkogynekologa), ale i dermatovenerologa, neurologa, revmatologa, hematologa a dalších specialistů podle aktuálního stavu a dominujících potíží pacientky. V případě diagnostiky malignity je zásadní léčba primárního onkologického onemocnění, projevy paraneoplazie postupně regredují v souvislosti s efektivní protinádorovou terapií.
MUDr. Luboš Minář
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
625 00 Brno
e-mail: lubosminar@seznam.cz
Sources
1. Anděl, M., Gregor, P., Horák, J., et al. Vnitřní lékařství, díl IIIb – Hematologie. Praha: Galén, 2001, s. 123–124.
2. Coleman, RE. Bisphosphonates in Brest cancer. Ann Oncol, 2005, 16, p. 687-695.
3. Dienstbier, Z., Skala, E. Nádorová diagnostika pro lékaře v praxi. Praha: Grada, 1995, s. 112-113.
4. Esbit, P. Hyperkalcemia of malignancy. New insight into an old syndrome. Clin Lab, 2001, 47, s. 67-71.
5. Harland, CC., Marsden, JR., Vernon, SA., et al. Dermatomyositis responding to treatment of associated toxoplasmosis. Br J Dermatol, 1991, 125, p. 76–78.
6. Chovanec, J., Dostálová, Z., Navrátilová, J. Bisfosfonáty v terapii kostních metastáz karcinomu prsu. Prakt Gyn, 2008, 11, 2, s. 79.
7. Jara, M., Ameriko, JA., Duce, L., et al. Dermatomyositis and flagellate erythema. Clin Exp Dermatol, 1996, 21, p. 440–441.
8. Klener, P. Klinická onkologie. Praha: Galén, 2002, s. 79-81.
9. Kratochvil, F. Dermatomyozitis a polymyozitis. In Kratochvil, F. Využití a klinický význam imunofluorescenčních metod v dermatologii. Acta facultatis medicae Brno, 1988, s. 100–103.
10. Mills, JA. Dermatomyositis. In Fitzpatrick, TB. Dermatology in general medicine, McGraw Hill, 1993, p. 2148–2155.
11. Rowell, NR., Goodfield, MJD. Dermatomyositis. In Rook, A., Wilkinson, DS., Ebling, FJG. Textbook of Dermatology, Champion RH 1998, s. 2555–2565.
12. Slováček, L., Jebavý, L., Kačerovský, J. Paraneoplastická leukocytóza. Inter Med pro praxi, 2004, 5, s. 276.
13. Šmardová, L., Král, Z., Štourač, P., et al. Časný relaps Hodgkinova lymfomu manifestující se jako paraneoplastická cerebellární degenerace (kazuistika). Transfúze a hematologie dnes, 2008, s. 91 -92.
14. Štork, J. Dermatomyositis. In Vosmík a kol. Dermatovenerologie. Praha: Karolinum 1999, s. 170–172.
15. Tomíška, M. Současné možnosti farmakologické léčby nádorové anorexie a kachexie. XII. brněnský den paliativní medicíny, 10/2006.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 3-
All articles in this issue
- Proteomika a biomarkery karcinomu ovaria
- Paraneoplastické syndromy v onkogynekologii
- Nové diagnostické přístupy k různým typům hydatidózních mol, hydropickým abortům a příslušné klinické postupy
- Současné možnosti prenatální diagnostiky kongenitální diafragmatické hernie
- IgG protilátky namířené proti lamininu-1 v séru a v peritoneální tekutině u pacientek se sníženou plodností
- Poruchy sexuální diferenciace s chybným vývojem gonád: dosud známé zodpovědné geny a výsledný fenotype
- Běžný variabilní imunodeficit v těhotenství (soubor kazuistik)
- Izolace a imunologická identifikace spermaglutinační protilátky z lidského séra
- Praxe v používání kontracepčních metod u žen v období před porodem a po porodu
- Hyperviskozita ejakulátu v kooperácii (asociácii) s niektorými fyzikálno-morfologickými a mikrobiologickými parametrami
- Komparace prenatálního ultrazvukového vyšetření, post mortem magnetické rezonance a patologicko – anatomické pitvy (kazuistika – schizencefalie)
- Nechtěné děti
- Torze těhotné dělohy – neobvyklá porodnická komplikace
- Cystická duplikatura rekta – kazuistika
- Informovanost českých a rumunských žen o problematice pohlavně přenosných nemocí:Výsledky reprezentativních výzkumů
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nechtěné děti
- Torze těhotné dělohy – neobvyklá porodnická komplikace
- Nové diagnostické přístupy k různým typům hydatidózních mol, hydropickým abortům a příslušné klinické postupy
- Paraneoplastické syndromy v onkogynekologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

